Periyodik Tablonun IVA grubunun genel özellikleri. Grup IVA'nın elemanları IIIA, IVA ve VA gruplarının elemanlarının genel özellikleri
IVA grubu, onsuz ne bizim ne de üzerinde yaşadığımız Dünya'nın olamayacağı en önemli unsurları içerir. Bu karbon, tüm organik yaşamın temelidir ve silikon, mineral krallığının "hükümdarıdır".
Karbon ve silikon tipik metal olmayan maddelerse ve kalay ve kurşun metal ise, o zaman germanyum bir ara pozisyonda bulunur. Bazı ders kitapları onu metal olmayan bir madde olarak sınıflandırırken, diğerleri onu bir metal olarak sınıflandırır. Gümüşi beyaz renktedir ve metalik bir görünüme sahiptir, ancak elmas benzeri bir kristal kafese sahiptir ve silikon benzeri bir yarı iletkendir.
Karbondan kurşuna (metalik olmayan özelliklerin azalmasıyla):
w negatif oksidasyon durumunun stabilitesi azalır (-4)
w en yüksek pozitif oksidasyon durumunun stabilitesi azalır (+4)
w Düşük pozitif oksidasyon durumunun stabilitesi artar (+2)
Karbon tüm organizmaların ana bileşenidir. Doğada hem karbondan oluşan basit maddeler (elmas, grafit) hem de bileşikler (doğal gaz ve petroldeki karbondioksit, çeşitli karbonatlar, metan ve diğer hidrokarbonlar) bulunur. Taş kömürlerindeki karbonun kütle oranı %97'ye ulaşır.
Temel durumdaki bir karbon atomu, bir değişim mekanizması yoluyla iki kovalent bağ oluşturabilir, ancak normal koşullar altında bu tür bileşikler oluşmaz. Bir karbon atomu uyarılmış duruma girdiğinde dört değerlik elektronunun tamamını kullanır.
Karbon oldukça fazla sayıda allotropik modifikasyon oluşturur (bkz. Şekil 16.2). Bunlar elmas, grafit, karabina ve çeşitli fullerenlerdir.
İnorganik maddelerde karbonun oksidasyon durumu +II ve +IV'dür. Karbonun bu oksidasyon durumlarında iki oksit vardır.
Karbon monoksit (II) renksiz, kokusuz, zehirli bir gazdır. Önemsiz isim karbon monoksittir. Karbon içeren yakıtın eksik yanması sırasında oluşur. Molekülünün elektronik yapısı için bkz. sayfa 121. Kimyasal özelliklerine göre CO tuz oluşturmayan bir oksittir, ısıtıldığında indirgeyici özellikler gösterir (çok aktif olmayan metallerin birçok oksidini metale indirger).
Karbon monoksit (IV) renksiz, kokusuz bir gazdır. Önemsiz adı karbondioksittir. Asidik oksit. Suda (fiziksel olarak) az çözünür, kısmen reaksiyona girerek karbonik asit H2CO3 oluşturur (bu maddenin molekülleri yalnızca çok seyreltik sulu çözeltilerde bulunur).
Karbonik asit, iki dizi tuz (karbonatlar ve bikarbonatlar) oluşturan çok zayıf bir dibazik asittir. Çoğu karbonat suda çözünmez. Hidrokarbonatlardan yalnızca alkali metal ve amonyum hidrokarbonatlar ayrı ayrı maddeler olarak mevcuttur. Hem karbonat iyonu hem de bikarbonat iyonu baz parçacıklardır, dolayısıyla sulu çözeltilerdeki hem karbonatlar hem de bikarbonatlar anyonda hidrolize uğrar.
Karbonatlardan en önemlileri sodyum karbonat Na2CO3 (soda, soda külü, çamaşır sodası), sodyum bikarbonat NaHCO3 (kabartma tozu, kabartma tozu), potasyum karbonat K2CO3 (potas) ve kalsiyum karbonat CaCO3'tür (tebeşir, mermer, kireç taşı).
Bir gaz karışımında karbondioksit varlığına kalitatif reaksiyon: test gazını kireç suyundan (doymuş bir kalsiyum hidroksit çözeltisi) geçirirken bir kalsiyum karbonat çökeltisinin oluşması ve ardından gazı daha fazla geçerken çökeltinin çözülmesi. Meydana gelen reaksiyonlar:
Ca2 + 2OH +C02 = CaC03 + H2O;
CaCO3 + CO2 + H2O = Ca2 +2HCO3.
Farmakoloji ve tıpta çeşitli karbon bileşikleri yaygın olarak kullanılmaktadır - karbonik asit ve karboksilik asitlerin türevleri, çeşitli heterosikller, polimerler ve diğer bileşikler. Böylece karbolen (aktif karbon), çeşitli toksinlerin vücuttan emilmesi ve uzaklaştırılması için kullanılır; grafit (merhem şeklinde) - cilt hastalıklarının tedavisi için; radyoaktif karbon izotopları - bilimsel araştırmalar için (radyokarbon tarihleme).
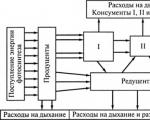
Karbon tüm organik maddelerin temelidir. Herhangi bir canlı organizma büyük ölçüde karbondan oluşur. Karbon yaşamın temelidir. Canlı organizmalar için karbon kaynağı genellikle atmosferden veya sudan gelen CO2'dir. Fotosentez yoluyla canlıların birbirlerini veya birbirlerinin kalıntılarını yediği biyolojik besin zincirlerine girer ve böylece kendi vücutlarını oluşturmak için karbon elde eder. Karbonun biyolojik döngüsü ya oksidasyonla ve atmosfere geri dönüşle ya da kömür ya da yağ şeklinde gömülerek sona erer.
Karbonat iyonu CO 3 2-'nin analitik reaksiyonları
Karbonatlar, sulu çözeltilerde serbest halde kararsız olan ve CO2: H2C03 - CO2 + H2O salınımıyla ayrışan, kararsız, çok zayıf karbonik asit H2C03'ün tuzlarıdır.
Amonyum, sodyum, rubidyum ve sezyum karbonatlar suda çözünür. Lityum karbonat suda az çözünür. Diğer metallerin karbonatları suda az çözünür. Hidrokarbonatlar suda çözünür. Sulu çözeltilerdeki karbonat iyonları renksizdir ve hidrolize uğrar. Alkali metal bikarbonatların sulu çözeltileri, onlara bir damla fenolftalein çözeltisi eklendiğinde renklenmez, bu da karbonat çözeltilerini bikarbonat çözeltilerinden ayırmayı mümkün kılar (farmakope testi).
1. Baryum klorür ile reaksiyon.
Ba 2+ + CO3 2 - -> BaCO 3 (beyaz ince kristalli)
Benzer karbonat çökeltileri kalsiyum (CaCO3) ve stronsiyum (SrCO3) katyonları tarafından üretilir. Çökelti mineral asitlerde ve asetik asitte çözünür. H2S04 çözeltisinde beyaz bir BaS04 çökeltisi oluşur.
Çökelti tamamen eriyene kadar çökeltiye damla damla yavaşça bir HC1 çözeltisi eklenir: BaCO3 + 2 HC1 -> BaCl2 + C02 + H2O
2. Magnezyum sülfatla reaksiyon (farmakope).
Mg 2+ + COZ 2 - ->MgCO 3 (beyaz)
Hidrokarbonat - HCO3 iyonu - yalnızca kaynatıldığında magnezyum sülfat ile MgCO3 çökeltisi oluşturur: Mg2+ + 2 HCO3- -> MgCO3 + CO2 + H2O
MgCO3 çökeltisi asitlerde çözünür.
3. Mineral asitlerle reaksiyon (farmakope).
CO 3 2- + 2 H 3 O = H 2 CO 3 + 2H 2 O
HCO3 - + H3O + = H2C03 + 2H2O
H 2 CO 3 -- CO 2 + H 2 O
Salınan gaz halindeki CO2, gazları, gaz kabarcıklarını (CO2) tespit etmek için bir cihazdaki bariton veya kireçli suyun bulanıklığı ve alıcı test tüpündeki çözeltinin bulanıklığı ile tespit edilir.
4. Uranil hekzasiyanoferrat (II) ile reaksiyon.
2CO 3 2 - + (UO 2) 2 (kahverengi) -> 2 UO 2 CO 3 (renksiz) + 4 -
Kahverengi bir uranil hekzasiyanoferrat (II) çözeltisi, bir uranil asetat (CH3COO)2UO2 çözeltisinin bir potasyum hekzasiyanoferrat (II) çözeltisi ile karıştırılmasıyla hazırlanır:
2(CH 3 SOO) 2 GO 2 + K 4 -> (UO 2) 2 + 4 CH 3 SOOK
Elde edilen çözeltiye, kahverengi renk kaybolana kadar karıştırılarak damla damla bir Na2C03 veya K2C03 çözeltisi eklenir.
5. Kalsiyum katyonları ve amonyak ile reaksiyonlarla karbonat iyonları ve bikarbonat iyonlarının ayrı ayrı keşfi.
Çözeltide karbonat iyonları ve bikarbonat iyonları aynı anda mevcutsa her biri ayrı ayrı açılabilir.
Bunu yapmak için önce analiz edilen çözeltiye fazla miktarda CaCl2 çözeltisi ekleyin. Bu durumda CO3 2, CaCO 3 formunda çökeltilir:
CO3 2 - + Ca 2+ = CaCO 3
Ca(HCO 3) 2 suda çözündüğü için bikarbonat iyonları çözeltide kalır. Çökelti çözeltiden ayrılır ve ikincisine bir amonyak çözeltisi eklenir. HCO 2 - amonyak ve kalsiyum katyonlarına sahip anyonlar yine CaCO 3 çökeltisi verir: HCO 3 - + Ca 2+ + NH 3 -> CaCO3 + NH 4 +
6. Karbonat iyonunun diğer reaksiyonları.
Karbonat iyonları, demir (III) klorür FeCl3 ile reaksiyona girdiğinde, gümüş nitratla kahverengi bir çökelti Fe(OH)C03 oluşturur - beyaz bir gümüş karbonat Ag2C03 çökeltisi, HbTO3'te çözünür ve suda kaynatıldığında ayrışır. koyu çökelti Ag 2 O ISO 2: Ag 2 CO 3 -> Ag 2 O + CO 2
Asetat iyonu CH3COO'nun analitik reaksiyonları"
Asetat - iyon CH3COO- - zayıf monobazik asetik asit CH3COOH anyonu: sulu çözeltilerde renksiz, hidrolize uğrar, redoks özelliklerine sahip değildir; Oldukça etkili bir liganddır ve birçok metalin katyonlarıyla kararlı asetat kompleksleri oluşturur. Asidik ortamda alkollerle reaksiyona girdiğinde esterler üretir.
Amonyum, alkali ve diğer birçok metalin asetatları suda oldukça çözünür. Gümüş CH3COOAg ve cıva (I) asetatları suda diğer metallerin asetatlarına göre daha az çözünür.
1. Demir (III) klorür ile reaksiyon (farmakope).
pH = 5-8'de Fe(III) katyonlu asetat iyonu, çözünür koyu kırmızı (kuvvetli çayın rengi) asetat veya demir (III) oksiasetatı oluşturur.
Sulu çözeltide kısmen hidrolize edilir; Solüsyonun mineral asitlerle asitleştirilmesi hidrolizi baskılar ve solüsyonun kırmızı renginin kaybolmasına yol açar.
3 CH3COOH + Fe --> (CH3COO) 3 Fe + 3 H +
Kaynama sırasında çözeltiden kırmızı-kahverengi bir bazik demir (III) asetat çökeltisi çöker:
(CH3COO) 3 Fe + 2 H2O<- Fe(OH) 2 CH 3 COO + 2 СН 3 СООН
Demir (III) ve asetat iyonlarının konsantrasyonlarının oranına bağlı olarak, tortunun bileşimi değişebilir ve örneğin aşağıdaki formüllere karşılık gelebilir: Fe OH (CH3COO) 2, Fe3 (OH) 2 O3 (CH3COO), Fe30(OH)(CH3COO)6 veya Fe3(OH)2(CH3COO)7.
Reaksiyon, demir (III) ile çökelme oluşturan CO 3 2 -, SO 3 "-, PO 4 3 -, 4 anyonlarının yanı sıra SCN- anyonları (Fe 3+ katyonları ile kırmızı kompleksler veren) tarafından engellenir. , iyodür - iyon G, iyot 1 2'ye oksitlenerek çözeltiye sarı bir renk verir.
2. Sülfürik asitle reaksiyon.
Kuvvetli asidik bir ortamda asetat iyonu, buharları karakteristik bir sirke kokusuna sahip olan zayıf asetik asite dönüşür:
CH3 COO- + H +<- СН 3 СООН
Reaksiyon, aynı zamanda konsantre bir H2SO4 ortamında karakteristik bir kokuya sahip gaz halindeki ürünleri de serbest bırakan NO2 \ S2-, SO32-, S2032- anyonları tarafından engellenir.
3. Asetik etil eter oluşumunun reaksiyonu (farmakope).
Reaksiyon sülfürik asit ortamında gerçekleştirilir. Etanol ile:
CH3COO- + H + -- CH3COOH CH3COOH + C2H5OH = CH3COOC2H4 + H2O
Açığa çıkan etil asetat karakteristik hoş kokusuyla tespit edilir. Gümüş tuzları bu reaksiyonu katalize eder, dolayısıyla bu reaksiyonu gerçekleştirirken az miktarda AgNO 3 ilave edilmesi tavsiye edilir.
Benzer şekilde amil alkol C5HcOH ile reaksiyona girdiğinde hoş bir kokuya sahip amil asetat CH3SOOC5Ni (-armut-) da oluşur.Etil asetatın karakteristik kokusu hissedilir ve karışım hafifçe ısıtıldığında yoğunlaşır. .
Tartrat - POC iyonu - CH(OH) - CH(OH) - CONST'nin analitik reaksiyonları. Tartrat iyonu, zayıf dibazik tartarik asidin bir anyonudur:
HO-CH-COOH
HO -CH-COOH
Tartrat iyonu suda oldukça çözünür. Sulu çözeltilerde tartarat iyonları renksizdir, hidrolize uğrar ve kompleks oluşumuna yatkındır, birçok metalin katyonlarıyla stabil tartarat kompleksleri verir. Tartarik asit iki dizi tuz oluşturur - çift yüklü bir tartarat içeren orta tartratlar - COCH(OH)CH(OH)COO - iyonu ve asit tartaratlar - tek yüklü bir hidrojen tartarat içeren hidrotartratlar - HOOOCH(OH)CH(OH) COO - iyon. Potasyum hidrojen tartarat (-tartar-) KNS 4 H 4 O 6, potasyum katyonlarını açmak için kullanılan suda pratik olarak çözünmez. Ortalama kalsiyum tuzu da suda az çözünür. Ortalama potasyum tuzu K2C4H4O6 suda oldukça çözünür.
I. Potasyum klorür ile reaksiyon (farmakope).
C 4 H 4 O 6 2 - + K + + N + -> KNS 4 H 4 O 6 1 (beyaz)
2. Asidik bir ortamda resorsinol ile reaksiyon (farmakope).
Tartratlar, konsantre sülfürik asit içerisinde resorsinol meta - C6H4 (OH)2 ile ısıtıldığında kiraz kırmızısı reaksiyon ürünleri oluşturur.
14) Gümüşün amonyak kompleksi ile reaksiyonları. Siyah bir metalik gümüş çökeltisi düşüyor.
15) Demir (II) sülfat ve hidrojen peroksit ile reaksiyon.
Tartrat içeren bir çözeltiye seyreltik sulu FeS04 ve H202 çözeltisinin eklenmesi. buruşuk renkte kararsız bir demir kompleksinin oluşumuna yol açar. Daha sonra NaOH alkali çözeltisi ile muamele, kompleksin mavi rengine yol açar.
Oksalat iyonu C 2 O 4 2-'nin analitik reaksiyonları
Oksalat iyonu C2042-, suda nispeten iyi çözünen, orta kuvvette bir dibazik oksalik asit H2C204 anyonudur. Sulu çözeltilerdeki oksalat iyonu renksizdir, kısmen hidrolize edilmiştir, güçlü bir indirgeyici maddedir, etkili bir liganddır - birçok metalin katyonlarıyla stabil oksalat kompleksleri oluşturur. Alkali metallerin, magnezyumun ve amonyumun oksalatları suda çözünürken, diğer metaller suda az çözünür.
1Baryum klorür ile reaksiyon Ba 2+ + C2 O 4 2- = BaC 2 O 4 (beyaz) Çökelti, mineral asitlerde ve asetik asitte (kaynama sırasında) çözünür. 2. Kalsiyum klorür ile reaksiyon (farmakope): Ca 2+ + C 2 O 4 2 - = CaC 2 O 4 (beyaz)
Çökelti mineral asitlerde çözünür, ancak asetik asitte çözünmez.
3. Gümüş nitratla reaksiyon.
2 Ag + + C 2 O 4 2 - -> Ag2C2O 4 .|.(kıvrılmış) Çözünürlük testi. Tortu 3 bölüme ayrılmıştır:
A). Çökelti içeren ilk test tüpüne, çökelti eriyene kadar karıştırarak damla damla HNO3 çözeltisi ekleyin;
B). Çökelti eriyene kadar çökelti ile birlikte ikinci test tüpüne karıştırarak damla damla konsantre amonyak çözeltisi ekleyin; V). Tortu içeren üçüncü test tüpüne 4-5 damla HC1 çözeltisi ekleyin; Test tüpünde beyaz bir gümüş klorür çökeltisi kalır:
Ag 2 C 2 O 4 + 2 HC1 -> 2 AC1 (beyaz) + H 2 C 2 O 4
4. Potasyum permanganat ile reaksiyon. Asidik bir ortamda KMnO4'lü oksalat iyonları, CO2 salınımıyla oksitlenir; manganezin (VII) manganeze (II) indirgenmesi nedeniyle KMPO 4 çözeltisinin rengi bozulur:
5 C 2 O 4 2 - + 2 MnO 4" + 16 H + -> 10 CO 2 + 2 Mn 2+ + 8 H 2 O
KMnO 4'ün seyreltik çözeltisi. İkincisinin rengi bozulur; gaz kabarcıklarının (CO2) salınımı gözlenir.
38 VA Grup Öğeleri
Periyodik Tablonun VA grubunun genel özellikleri. s x p y formunda, VA grubunun elemanlarının harici enerji seviyesinin elektronik konfigürasyonu.
Arsenik ve antimon farklı allotropik modifikasyonlara sahiptir: hem moleküler hem de metal kristal kafes ile. Bununla birlikte, katyonik formların (As 3+, Sb 3+) kararlılığının karşılaştırılması temel alınarak arsenik metal olmayan, antimon ise metal olarak sınıflandırılır.
VA grubu elementleri için oksidasyon durumları stabildir
Azottan bizmut'a (metalik olmayan özelliklerde azalma ile):
w negatif oksidasyon durumunun (-3) stabilitesi azalır (m. hidrojen bileşiklerinin özellikleri)
w en yüksek pozitif oksidasyon durumunun stabilitesi azalır (+5)
w Düşük pozitif oksidasyon durumunun stabilitesi artar (+3)
Bilmek
- karbon ve silisyumun periyodik tablodaki yeri, doğada bulunuşu ve pratik uygulaması;
- karbon ve silisyumun atom yapısı, değerliği, oksidasyon durumları;
- basit maddelerin üretim yöntemleri ve özellikleri - grafit, elmas ve silikon; karbonun yeni allotropik formları;
- ana karbon ve silikon bileşik türleri;
- germanyum alt grubunun elementlerinin özellikleri;
yapabilmek
- basit karbon ve silikon maddelerinin üretimi için reaksiyon denklemlerini ve bu maddelerin kimyasal özelliklerini karakterize eden reaksiyonları hazırlamak;
- karbon grubundaki elementlerin özelliklerini karşılaştırabilir;
- pratik olarak önemli karbon ve silikon bileşiklerini karakterize etmek;
- karbon ve silikonun dahil olduğu reaksiyon denklemlerini kullanarak hesaplamalar yapmak;
sahip olmak
Karbon, silikon ve bunların bileşiklerini içeren reaksiyonların gidişatını tahmin etme becerisi.
Atomların yapısı. Doğada yaygınlık
Periyodik tablonun Grup IVA'sı atom numaraları eşit olan beş elementten oluşur: karbon C, silikon Si, germanyum Ge, kalay Sn ve kurşun Pb (Tablo 21.1). Doğada grubun tüm elementleri kararlı izotopların karışımlarıdır. Karbonun iki izogonu vardır - *|C (%98,9) ve *§C (%1,1). Ayrıca doğada "|С с" radyoaktif izotopunun izleri de vardır. t t= 5730 yıl. Kozmik radyasyondan gelen nötronların dünya atmosferindeki nitrojen çekirdekleriyle çarpışması sırasında sürekli oluşur:
Tablo 21.1
IVA grubu elemanlarının özellikleri
* Biyojenik element.
Karbonun ana izotopu, atomik kütle birimine dayandığından kimya ve fizikte özellikle önemlidir. { /2 bir atomun kütlesinin bir kısmı 'ICO Evet).
Silikonun doğada üç izotopu vardır; Bunlar arasında en yaygın olanı ^)Si'dir (%92,23). Germanyumun beş izotopu vardır (j^Ge - %36,5). Kalay - 10 izotop. Bu, kimyasal elementler arasında bir rekordur. En yaygın olanı 12 5 gSn'dir (%32,59). Kurşunun dört izotopu vardır: 2 §^Pb (%1,4), 2 §|Pb (%24,1), 2 82?b (%22,1) ve 2 82?b (%52,4). Kurşunun son üç izotopu, uranyum ve toryumun doğal radyoaktif izotoplarının bozunmasının son ürünleridir ve bu nedenle yer kabuğundaki içerikleri Dünya'nın varlığı boyunca artmıştır.
Karbon, yer kabuğundaki bolluk açısından ilk on kimyasal elementten biridir. Grafit, birçok kömür çeşidi, petrol, doğal yanıcı gaz, kireçtaşı oluşumları (CaCO e), dolomit (CaC0 3 -MgC0 3) ve diğer karbonatlar şeklinde bulunur. Doğal elmas, mevcut karbonun önemsiz bir kısmını oluştursa da, güzel ve en sert mineral olarak son derece değerlidir. Ancak elbette karbonun en yüksek değeri, tüm canlı organizmaların vücutlarını oluşturan biyoorganik maddelerin yapısal temeli olması gerçeğinde yatmaktadır. Karbon, yaşamın varlığı için gerekli olan birçok kimyasal element arasında haklı olarak ilk sırada yer almaktadır.
Silikon yerkabuğunda en çok bulunan ikinci elementtir. Kum, kil ve gördüğünüz birçok kaya silikon minerallerinden oluşur. Silikon oksitin kristal çeşitleri hariç, tüm doğal bileşikleri silikatlar yani çeşitli silisik asitlerin tuzları. Bu asitlerin kendileri ayrı maddeler olarak elde edilmemiştir. Ortosilikatlar SiOj iyonları içerir, metasilikatlar ise polimer zincirlerinden (Si0 3") oluşur. Silikatların çoğu, aralarında herhangi bir metalin ve bazı metal olmayanların (flor) atomlarının bulunabileceği silikon ve oksijen atomlarından oluşan bir çerçeve üzerine inşa edilir. Bilinen silikon mineralleri arasında kuvars Si0 2, feldspatlar (ortoklaz KAlSi 3 0 8), mikalar (muskovit KAl 3 H 2 Si 3 0 12) yer alır.Toplamda 400'den fazla silikon minerali bilinmektedir.Mücevher ve süs eşyalarının yarısından fazlası Taşlar silikon bileşikleridir.Oksijen-silikon çerçevesi suda düşük çözünürlüklü silikon minerallerine neden olur.Yalnızca binlerce yıl boyunca sıcak yer altı kaynaklarından silikon bileşiklerinin büyümeleri ve kabukları birikebilir.Bu tür kayalar jasper içerir.
Karbon, silisyum, kalay ve kurşun çok eski çağlardan beri basit maddeler veya bileşikler halinde bilindiğinden, keşfedilme zamanlarından bahsetmeye gerek yok. Germanyum, 1886 yılında K. Winkler (Almanya) tarafından nadir mineral argyroditte keşfedildi. Kısa süre sonra, bu tür özelliklere sahip bir elementin varlığının D.I. Mendeleev tarafından tahmin edildiği anlaşıldı. Yeni unsurun adı tartışmalara neden oldu. Mendeleev, Winkler'e yazdığı bir mektupta bu ismi şiddetle destekledi. germanyum.
Grup IVA elemanlarının en dışta dört değerlik elektronu vardır. S- ve p-alt seviyeleri:

Atomların elektronik formülleri:

Temel durumda bu elementler iki değerlidir ve uyarılmış durumda dört değerlikli hale gelirler:

Karbon ve silikon, iki değerlikli durumda çok az sayıda kimyasal bileşik oluşturur; hemen hemen tüm kararlı bileşiklerde dört değerliklidirler. Grubun aşağısında, germanyum, kalay ve kurşun için iki değerlikli durumun kararlılığı artar ve dört değerlikli durumun kararlılığı azalır. Bu nedenle kurşun(1U) bileşikleri güçlü oksitleyici ajanlar gibi davranır. Bu model VA grubunda da belirgindir. Karbon ve grubun diğer elementleri arasındaki önemli bir fark, üç farklı hibridizasyon durumunda kimyasal bağlar oluşturabilme yeteneğidir: sp, sp2 Ve sp3. Silikonun pratikte tek bir hibrit durumu kaldı sp3. Karbon ve silikon bileşiklerinin özellikleri karşılaştırıldığında bu açıkça görülmektedir. Örneğin, karbon monoksit C02 bir gazdır (karbon dioksit) ve silikon oksit Si02 refrakter bir maddedir (kuvars). İlk madde gaz halindedir çünkü ne zaman sp-karbon hibridizasyonu, tüm kovalent bağlar C0 2 molekülünde kapalıdır:
Moleküller arasındaki çekim zayıftır ve bu da maddenin durumunu belirler. Silikon oksitte, dört hibrit 5p3 silikon yörüngesi iki oksijen atomu üzerinde kapatılamaz. Bir silikon atomu dört oksijen atomuyla bağlanır ve bunların her biri başka bir silikon atomuyla bağlanır. Sonuç, tüm atomlar arasındaki bağların aynı kuvvette olduğu bir çerçeve yapısıdır (bkz. diyagram, cilt 1, sayfa 40).
Aynı hibridizasyona sahip karbon ve silikon bileşikleri, örneğin metan CH4 ve silan SiH4, yapı ve fiziksel özellikler bakımından benzerdir. Her iki madde de gazdır.
IVA elemanlarının elektronegatifliği, VA grubunun elemanlarına kıyasla azalır ve bu özellikle 2. ve 3. periyotların elemanlarında belirgindir. IVA grubundaki elementlerin metalikliği VA grubuna göre daha belirgindir. Grafit formundaki karbon bir iletkendir. Silikon ve germanyum yarı iletkenlerdir, kalay ve kurşun ise gerçek metallerdir.
16.1. IIIA, IVA ve VA gruplarının elemanlarının genel özellikleri
B |
C |
N |
Al Alüminyum |
Si |
P |
GA |
Ge germanyum |
Gibi |
İçinde |
sn |
Sb |
TL |
kurşun |
Bi |
Doğal element sisteminin bu üç grubunun bileşimi Şekil 16.1'de gösterilmektedir. Atomların yörünge yarıçaplarının değerleri (angstrom cinsinden) de burada verilmiştir. Metalleri oluşturan elementler (yörünge yarıçapı 1,1 angstromdan büyük) ile ametalleri oluşturan elementler (yörünge yarıçapı 1,1 angstromdan küçük) arasındaki sınır en açık şekilde bu gruplarda görülebilir. Şekilde bu kenarlık çift çizgi ile gösterilmiştir. Bu sınırın hala keyfi olduğunu unutmamalıyız: alüminyum, galyum, kalay, kurşun ve antimon kesinlikle amfoterik metallerdir, ancak bor, germanyum ve arsenik de bazı amfoteriklik belirtileri gösterir.
Bu üç grubun elementlerinin atomlarından aşağıdakiler en sık yer kabuğunda bulunur: Si (w = %25,8), Al (w = %7,57), P (w = %0,090), C (w = %0,087 ve N (w = %0,030). Bunlar bu bölümde karşılaşacağınız kişilerdir.
Grup IIIA elementlerinin atomlarının genel değerlik elektronik formülleri - ns 2 n.p. 1, IVA grubu – ns 2 n.p. 2, VA grupları – ns 2 n.p. 3. En yüksek oksidasyon durumları grup numarasına eşittir. Orta düzey olanlar 2 azdır.
Bu elementlerin atomlarının oluşturduğu tüm basit maddeler (azot hariç) katıdır. Birçok element allotropi ile karakterize edilir (B, C, Sn, P, As). Yalnızca üç kararlı moleküler madde vardır: nitrojen N2, beyaz fosfor P4 ve sarı arsenik As4.
Bu üç grubun metalik olmayan elementleri, kovalent bağlara sahip moleküler hidrojen bileşikleri oluşturma eğilimindedir. Üstelik karbonda o kadar çok şey var ki, hidrokarbonlar ve türevleri ayrı bir bilim olan organik kimya tarafından inceleniyor. Bu elementler arasında ikinci en büyük hidrojen bileşiği sayısı bordur. Borohidritler (boranlar) çok sayıda ve karmaşık yapıda olduğundan borohidritlerin kimyası da kimyanın ayrı bir dalı haline gelmiştir. Silikon yalnızca 8 hidrojen bileşiği (silan), nitrojen ve fosfor - her biri iki, geri kalanı - her biri bir hidrojen bileşiği oluşturur. En basit hidrojen bileşiklerinin moleküler formülleri ve isimleri:
Daha yüksek oksitlerin bileşimi, grup numarasına eşit en yüksek oksidasyon durumuna karşılık gelir. Her gruptaki yüksek oksitlerin türü, atom numarasının artmasıyla birlikte asidikten amfoterik veya bazik yapıya doğru kademeli olarak değişir.
Hidroksitlerin asit-baz karakteri çok çeşitlidir. Yani HNO3 güçlü bir asittir ve TlOH bir alkalidir.
1.IIIA, IVA ve VA grup elementlerinin atomlarının kısaltılmış elektronik formüllerini ve enerji diyagramlarını yapın. Dış ve değerlik elektronlarını belirtin.
Azot atomunun üç eşleşmemiş elektronu vardır, dolayısıyla değişim mekanizmasıyla üç kovalent bağ oluşturabilir. Donör-alıcı mekanizması ile nitrojen atomunun +1 pozitif formal yük kazandığı başka bir kovalent bağ oluşturabilir. e. Bu nedenle, maksimum nitrojen beş değerliklidir, ancak maksimum kovalanlığı dörttür (Bu, nitrojenin beş değerli olamayacağına dair sıklıkla karşılaşılan ifadeyi açıklar).
Dünyadaki nitrojenin neredeyse tamamı gezegenimizin atmosferinde bulunur. Litosferde nitrat formunda çok daha küçük bir nitrojen kısmı bulunur. Azot, tüm organizmalarda ve bunların ayrışma ürünlerinde bulunan organik bileşiklerin bir parçasıdır.
Azot tek oluşturur basit moleküler madde Molekülde diatomik üçlü bağ bulunan N2 (Şekil 16.2). Bu bağın enerjisi 945 kJ/mol olup, diğer bağ enerjilerinin değerlerini aşar (bkz. Tablo 21). Bu, nitrojenin normal sıcaklıklarda eylemsizliğini açıklar. Nitrojen, fiziksel özelliklerine göre doğuştan bildiğimiz renksiz, kokusuz bir gazdır (dünya atmosferinin dörtte üçü nitrojenden oluşur). Azot suda az çözünür.

Azot iki tane oluşturur hidrojen bileşikleri: amonyak NH3 ve hidrazin N2H6:

Amonyak keskin, boğucu bir kokuya sahip renksiz bir gazdır. Konsantre amonyak buharının dikkatsizce solunması spazmlara ve boğulmaya neden olabilir. Amonyak suda çok çözünür, bu da her amonyak molekülünün su molekülleriyle dört hidrojen bağı oluşturmasıyla açıklanır.

Amonyak molekülü bir baz parçacıktır (bkz. Ek 14). Bir protonu kabul ederek amonyum iyonuna dönüşür. Reaksiyon hem sulu çözeltide hem de gaz fazında meydana gelebilir:
NH3 + H20 NH4 + OH (çözelti içinde);
NH3 + H30 B = NH4 + H20 (çözelti içinde);
NH 3g + HCl g = NH4Cl cr (gaz fazında).
Amonyağın sulu çözeltileri, çözünmeyen hidroksitleri çökeltecek kadar alkalindir, ancak amfoterik hidroksitlerin, hidroksi kompleksleri oluşturmak üzere bunların içinde çözünmesine yetecek kadar alkalin değildir. Bu nedenle amfoterik hidroksitlerin hazırlanmasında amonyak çözeltisinin kullanılması uygundur. P-elementler: Al(OH) 3, Be(OH) 2, Pb(OH) 2, vb., örneğin:
Pb2 + 2NH3 + 2H20 = Pb(OH)2 + 2NH4.
Amonyak havada tutuşturulduğunda yanarak nitrojen ve su oluşturur; Bir katalizör (Pt) varlığında oksijen ile etkileşime girdiğinde, nitrojen monoksite geri dönüşümlü olarak oksitlenir:
4NH3 + 3O2 = 2N2 + 6H2O (katalizörsüz),
4NH3 + 5O2 4NO + 6H20 (katalizörlü).
Amonyak ısıtıldığında bakır gibi çok aktif olmayan metallerin oksitlerini azaltabilir:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
Amonyum tuzları özellikleri bakımından (termal stabilite hariç) alkali metal tuzlarına benzer. ikincisi gibi hemen hepsi suda çözünür, ancak amonyum iyonu zayıf bir asit olduğundan katyonda hidrolize edilirler. Isıtıldığında amonyum tuzları ayrışır:
NH4CI = NH3 + HC1;
(NH4)2S04 = NH4HSO4 + NH3;
(NH4)2C03 = 2NH3 + C02 + H20;
NH4HS = NH3 + H2S;
NH4NO3 = N20 + 2H20;
NH4NO2 = N2 + 2H20;
(NH4)2HP04 = NH3 + (NH4)H2P04;
(NH4)H2PO4 = NH4PO3 + H20.
Çeşitli oksidasyon durumlarındaki azot beş tane oluşturur oksitler: N 2 O, NO, N 2 O 3, NO 2 ve N 2 O 5.
Bunlardan en kararlı olanı nitrojen dioksittir. Hoş olmayan bir kokuya sahip kahverengi zehirli bir gazdır. Suyla reaksiyona girer:
2NO2 + H20 = HNO2 + HNO3.
Alkali bir çözelti ile reaksiyon nitrat ve nitrit oluşumuyla meydana gelir.
N2O ve NO tuz oluşturmayan oksitlerdir.
N203 ve N205 asidik oksitlerdir. Su ile reaksiyona girerek sırasıyla nitro ve nitrik asit çözeltileri oluştururlar.
+III oksidasyon durumundaki nitrojen oksoasit nitröz asit HNO2'dir. Molekülleri yalnızca sulu çözeltide bulunan zayıf bir asittir. Tuzları nitrittir. Nitröz asit ve nitritlerdeki nitrojen kolayca +V oksidasyon durumuna oksitlenir.
Nitro asitten farklı olarak nitrik asit HNO 3 güçlü bir asittir. Molekülünün yapısı iki şekilde ifade edilebilir:
Nitrik asit her bakımdan suyla karışır ve seyreltik çözeltilerde onunla tamamen reaksiyona girer:
HNO3 + H2O = H3O + NO3
Nitrik asit ve çözeltileri güçlü oksitleyici maddelerdir. Nitrik asit seyreltildiğinde oksidatif aktivitesi azalır. Herhangi bir konsantrasyondaki nitrik asit çözeltilerinde oksitleyici atomlar öncelikle hidrojen değil nitrojen atomlarıdır. Bu nedenle çeşitli maddelerin nitrik asitle oksidasyonu sırasında yalnızca yan ürün olarak hidrojen açığa çıkar. Asit konsantrasyonuna ve diğer reaktifin indirgeme aktivitesine bağlı olarak reaksiyon ürünleri NO2, NO, N20, N2 ve hatta NH4 olabilir. Çoğu zaman bir gaz karışımı oluşur, ancak konsantre nitrik asit durumunda yalnızca nitrojen dioksit açığa çıkar:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
3FeS + 30HNO3 = Fe2(SO4)3 + Fe(NO3)3 + 27NO2 + 15H2O
Seyreltik nitrik asit durumunda, nitrojen monoksit çoğunlukla açığa çıkar:
Fe + 4HNO 3 = Fe(NO 3) 3 + NO + 2H 2 O
3H 2 S + 2HNO 3 = 2NO + 4H 2 Ö + 3S
Çok seyreltik nitrik asidin güçlü bir indirgeyici maddeyle (Mg, Al, Zn) reaksiyona girmesi durumunda amonyum iyonları oluşur:
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
Konsantre sülfürik asitle pasifleştirilen metaller aynı zamanda konsantre nitrik asitle de pasifleştirilir.
Nitrik asit tuzları - nitratlar - termal olarak kararsız bileşiklerdir. Isıtıldığında ayrışırlar:
2KNO3 = 2KNO2 + O2;
2Zn(N03)2 = 2ZnO + 4N02 + O2;
2AgNO3 = 2Ag + 2NO2 + O2.
1. Paragraf metninde verilen reaksiyonlar için tanımlayıcı denklemler yazın.
2. a) amonyak, b) nitrik asit, c) çinko nitratın kimyasal özelliklerini karakterize eden reaksiyon denklemleri oluşturun.
Amonyak ve nitrik asidin kimyasal özellikleri.
16.3. Fosfor
Azot atomunun aksine, atom fosfor bir değişim mekanizmasıyla beş kovalent bağ oluşturabilir. Bunun geleneksel açıklaması şu üç durumdan birinin uyarılma olasılığına dayanmaktadır: S-elektronlar ve 3'e geçişi D-alt düzey.
Fosfor elementi oldukça fazla miktarda oluşur allotropik modifikasyonlar. Bunlardan üç modifikasyon en kararlı olanıdır: beyaz fosfor, kırmızı fosfor ve siyah fosfor. Beyaz fosfor, P4 moleküllerinden oluşan, havada kendiliğinden yanmaya yatkın, mumsu, toksik bir maddedir. Kırmızı fosfor, oldukça karmaşık bir yapıya sahip, koyu kırmızı renkli, moleküler olmayan, daha az aktif bir maddedir. Tipik olarak, kırmızı fosfor her zaman bir beyaz karışımı içerir, bu nedenle hem beyaz hem de kırmızı fosfor her zaman bir su tabakası altında depolanır. Siyah fosfor aynı zamanda karmaşık bir çerçeve yapısına sahip, moleküler olmayan bir maddedir.
Beyaz fosfor molekülleri tetrahedraldir, içlerindeki fosfor atomu üç değerlidir. Beyaz fosfor molekülünün top ve çubuk modeli ve yapısal formülü:
![]()
Kırmızı fosforun yapısı yapısal formülle ifade edilebilir:

Fosfor, kalsiyum fosfatın kum ve kokla ısıtılmasıyla elde edilir:
Ca3 (PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO.
Fosfor en çok +V oksidasyon durumuna sahip bileşiklerle karakterize edilir. Fosfor aşırı klorla reaksiyona girdiğinde pentaklorür oluşturur. Fosforun herhangi bir allotropik modifikasyonunun yanması sırasında aşırı oksijen oluşur oksit fosfor(V):
4P + 5O2 = 2P2O5.
Fosfor(V) oksidin iki modifikasyonu vardır: moleküler olmayan (en basit formül P2O5 ile) ve moleküler (moleküler formül P4O10 ile). Fosfor oksit genellikle bu maddelerin bir karışımıdır.

Bu oldukça higroskopik asidik oksit, suyla reaksiyona girerek sırasıyla metafosforik, difosforik ve ortofosforik asitler oluşturur:
P 2 Ö 5 + H 2 Ö = 2HPO 3, 2H PO 3 + H 2 Ö = H 4 P 2 Ö 7, H 4 P 2 Ö 7 + H 2 Ö = 2H 3 PO 4.
Ortofosforik asit(genellikle basitçe fosforik olarak adlandırılır) tribazik zayıf bir asittir (bkz. Ek 13). Suda çok çözünür, renksiz kristal bir maddedir. Güçlü bazlarla reaksiyona girdiğinde reaktiflerin oranına bağlı olarak üç sıra oluşturur tuzlar(ortofosfatlar, hidroortofosfatlar ve dihidrojen ortofosfatlar - genellikle "orto" ön eki adlarından çıkarılır):
H3PO4 + OH = H2PO4 + H20,
H3P04 + 2OH = HPO42 + 2H20,
H3P04 + 3OH = P043 + 3H20.
Çoğu orta fosfat (lityum dışındaki alkali elementlerin tuzları hariç) suda çözünmez. Önemli ölçüde daha fazla çözünür asit fosfat vardır.
Fosforik asit, doğal kalsiyum fosfatın fazla sülfürik asitle işlenmesiyle elde edilir. Farklı bir kalsiyum fosfat ve sülfürik asit oranıyla, tarımda “basit süperfosfat” adı verilen mineral gübre olarak kullanılan bir dihidrojen fosfat ve kalsiyum sülfat karışımı oluşur:
Ca3(PO4)2 + 3H2S04 = 2H3P04 + 3CaS04;
Ca3 (PO 4) 2 + 2H2 SO 4 = Ca (H 2 PO 4) 2 + 2CaS04.
Reaksiyonla daha değerli "çift süperfosfat" elde edilir
Ca3 (P04)2 + 4H3PO4 = 3Ca(H2P04)3.
Bu mineral gübrenin ana maddesi kalsiyum dihidrojen fosfattır.
1. Paragraf metninde iyonik denklemlerin verildiği reaksiyonlar için moleküler denklemler oluşturun.
2. Paragraf metninde verilen reaksiyonların denklemlerini açıklayıcı bir şekilde yazın.
3. a) fosfor, b) fosfor oksit (V), c) ortofosforik asit, d) sodyum dihidrojen fosfatın kimyasal özelliklerini karakterize eden reaksiyon denklemleri oluşturun.
Fosforik asidin kimyasal özellikleri.
16.4. Karbon
Karbon tüm organizmaların ana bileşenidir. Doğada hem karbondan oluşan basit maddeler (elmas, grafit) hem de bileşikler (doğal gaz ve petroldeki karbondioksit, çeşitli karbonatlar, metan ve diğer hidrokarbonlar) bulunur. Taş kömürlerindeki karbonun kütle oranı %97'ye ulaşır.
Atom Temel durumdaki karbon, bir değişim mekanizması yoluyla iki kovalent bağ oluşturabilir, ancak normal koşullar altında bu tür bileşikler oluşmaz. Bir karbon atomu uyarılmış duruma girdiğinde dört değerlik elektronunun tamamını kullanır.
Karbon oldukça fazla oluşur allotropik modifikasyonlar(bkz. Şekil 16.2). Bunlar elmas, grafit, karabina ve çeşitli fullerenlerdir.

Elmas çok sert, renksiz, şeffaf kristal bir maddedir. Elmas kristalleri karbon atomlarından oluşur sp 3-melezleştirilmiş durum, mekansal bir çerçeve oluşturuyor.
Grafit, gri-siyah renkte oldukça yumuşak kristal bir maddedir. Grafit kristalleri, karbon atomlarının yer aldığı düz katmanlardan oluşur. sp 2-hibrit durum ve altıgen hücrelerle ağlar oluşturur.
Carbyne, içinde karbon atomlarının bulunduğu doğrusal moleküllerden oluşan, lifli yapıya sahip, renksiz bir maddedir. sp-hibrit durumu (=C=C=C=C= veya –C C–C C–).
Fullerenler, karbonun C 60, C 80 vb. moleküllerle moleküler allotropik modifikasyonlarıdır. Bu maddelerin molekülleri içi boş ağ kürelerdir.
Karbonun tüm modifikasyonları, oksitleyici olanlardan daha büyük ölçüde indirgeyici özellikler sergiler; örneğin, kok (kömür işleme ürünü;% 98'e kadar karbon içerir), demiri oksit cevherlerinden ve bir dizi başka metali oksitlerinden azaltmak için kullanılır. :
Fe203 + 3C = 2Fe + 3CO (yüksek sıcaklıkta).
Çoğu karbon bileşiği, 10. ve 11. sınıflarda öğreneceğiniz organik kimyada incelenir.
İnorganik maddelerde karbonun oksidasyon durumu +II ve +IV'dür. Karbonun bu oksidasyon durumları ile iki tane vardır oksit.
Karbon monoksit (II) renksiz, kokusuz, zehirli bir gazdır. Önemsiz isim karbon monoksittir. Karbon içeren yakıtın eksik yanması sırasında oluşur. Molekülünün elektronik yapısı için bkz. sayfa 121. Kimyasal özelliklerine göre CO tuz oluşturmayan bir oksittir, ısıtıldığında indirgeyici özellikler gösterir (çok aktif olmayan metallerin birçok oksidini metale indirger).
Karbon monoksit (IV) renksiz, kokusuz bir gazdır. Önemsiz adı karbondioksittir. Asidik oksit. Suda (fiziksel olarak) az çözünür, kısmen reaksiyona girerek kömür oluşturur. asit H2C03 (bu maddenin molekülleri yalnızca çok seyreltik sulu çözeltilerde bulunur).
Karbonik asit çok zayıf bir asittir (bkz. Ek 13), dibazik, iki sıra oluşturur tuzlar(karbonatlar ve bikarbonatlar). Çoğu karbonat suda çözünmez. Hidrokarbonatlardan yalnızca alkali metal ve amonyum hidrokarbonatlar ayrı ayrı maddeler olarak mevcuttur. Hem karbonat iyonu hem de bikarbonat iyonu baz parçacıklardır, dolayısıyla sulu çözeltilerdeki hem karbonatlar hem de bikarbonatlar anyonda hidrolize uğrar.
Karbonatlardan en önemlileri sodyum karbonat Na2C03 (soda, soda külü, çamaşır sodası), sodyum bikarbonat NaHC03 (kabartma tozu, kabartma tozu), potasyum karbonat K2C03 (potas) ve kalsiyum karbonat CaC03'tür. (tebeşir, mermer, kireçtaşı).
Kalitatif reaksiyon gaz karışımında karbondioksit varlığı için: test gazı kireç suyundan (doymuş bir kalsiyum hidroksit çözeltisi) geçerken bir kalsiyum karbonat çökeltisinin oluşması ve ardından gazı daha fazla geçerken çökeltinin çözülmesi. Meydana gelen reaksiyonlar: Silikon elementi bir tane oluşturur basit madde aynı isimle. Bu, silikonun sertlik açısından sadece biraz daha düşük olduğu elmas yapısına sahip moleküler olmayan bir maddedir. Geçtiğimiz yarım yüzyılda silikon, tek kristallerinin neredeyse tüm elektronik ekipmanlarda kullanılması nedeniyle uygarlığımız için kesinlikle vazgeçilmez bir malzeme haline geldi.
Silikon oldukça inert bir maddedir. oda sıcaklığında flor ve hidrojen florür dışında hemen hemen hiçbir şeyle reaksiyona girmez:
Si + 2F2 = SiF4;
Si + 4HF = SiF4 + 2H2.
İnce öğütülmüş bir toz halinde ısıtıldığında oksijen içinde yanar ve dioksit (Si02) oluşturur. Alkali ile birleştirildiğinde veya konsantre alkali çözeltileri ile kaynatıldığında silikatlar oluşturur:
Si + 4NaOH = Na4Si04 + 2H2;
Si + 2NaOH + H20 = Na2Si03 + 2H2.
Silikon monoksit SiO – tuz oluşturmayan oksit; kolayca dioksite oksitlenir.
Silikon dioksit Si02, çerçeve yapısına sahip moleküler olmayan bir maddedir. Su ile reaksiyona girmez. asit oksit – alkalilerle kaynaştığında silikatlar oluşturur, örneğin:
Si02 + 2NaOH = Na2Si03 + H20. Alüminyum, Dünya'nın litosferinde silikondan sonra en çok bulunan elementtir. Tek başına ve silikonla birlikte birçok mineral oluşturur: feldispatlar, mikalar, korindon Al2O3 ve değerli çeşitleri (renksiz lökosafir, krom içeren yakut, titanyum içeren safir).
Basit madde alüminyum, gümüşi beyaz parlak hafif bir metaldir. Saf alüminyum çok yumuşaktır, ince folyoya sarılabilir ve içinden tel çekilebilir. Alüminyum iyi bir elektrik iletkenliğine sahiptir. Atmosfer etkilerine karşı dayanıklıdır. Alüminyum alaşımları oldukça serttir ancak iyi işlenebilmektedir. Alüminyum zehirli değildir. Bütün bunlar alüminyumun çok çeşitli endüstrilerde kullanılmasına olanak tanır: havacılık, elektrik, gıda endüstrileri ve inşaat. Alüminyum günlük yaşamda da yaygın olarak kullanılmaktadır. Alüminyum, bileşiklerinin eriyiğinin elektrolizi ile üretilir.
Alüminyumun kimyasal inertliği, yüzeyinde metalin reaktifle temasını önleyen yoğun bir oksit filminin varlığından kaynaklanır. Bu film kimyasal veya mekanik olarak uzaklaştırıldığında alüminyum çok aktif hale gelir. Böylece, oksit filmi olmayan alüminyum, ek ısıtmaya gerek kalmadan havada kendiliğinden tutuşur ve yanar.
Alüminyumun indirgeyici özellikleri özellikle ısıtıldığında belirgindir. Bu koşullar altında birçok metali oksitlerden arındırır: yalnızca demir, titanyum, zirkonyum değil, kalsiyum ve baryum bile.
Alüminyum oksit Al 2 O 3 (önemsiz isimler - alümina, korindon), bağın hem iyonik hem de kovalent olarak zayıf bir şekilde tanımlandığı moleküler olmayan bir maddedir. Bu durumlarda her zaman olduğu gibi amfoterik bir oksittir. Amfoterik özelliklere de sahip olan alüminyum hidroksitin kalsinasyonuyla elde edilir.
Hidratlanmış alüminyum iyonu katyonik bir asittir, bu nedenle çözünür alüminyum tuzları oldukça yüksek oranda hidrolize edilir.
Alüminyum tuzlarından en yaygın olarak kullanılanı potasyum şap KAl(SO4)2 ·12H20 - potasyum alüminyum sülfat dodekahidrattır. Higroskopik olmayan, mükemmel kristalleşen bir maddedir. Çözeltisi, iki farklı sülfatın çözeltilerinin bir karışımı gibi davranır: potasyum sülfat ve alüminyum sülfat. Şapın yapısı şu formülle ifade edilebilir: (SO 4) 2.
1. Paragraf metninde verilen reaksiyonlar için tanımlayıcı denklemler yazın.
2. a) alüminyumun, b) alüminyum hidroksitin, i) potasyum aluminyumun kimyasal özelliklerini karakterize eden reaksiyon denklemleri oluşturun.
Alüminyum tuzlarının kimyasal özellikleri
Özetin anahtar kelimeleri: karbon, silikon, IVA grubunun elementleri, elementlerin özellikleri, elmas, grafit, karabina, fulleren.
Grup IV elemanları karbon, silikon, germanyum, kalay ve kurşun. Karbon ve silikonun özelliklerine daha yakından bakalım. Tablo bu unsurların en önemli özelliklerini göstermektedir.
Bileşiklerinin hemen hemen hepsinde karbon ve silikon bulunur. dört değerlikli , atomları heyecanlı bir durumdadır. Bir karbon atomunun değerlik katmanının konfigürasyonu, atom uyarıldığında değişir:
Silikon atomunun değerlik katmanının konfigürasyonu da benzer şekilde değişir: 
Karbon ve silikon atomlarının dış enerji seviyesi 4 eşleşmemiş elektron içerir. Silikon atomunun yarıçapı daha büyüktür; değerlik katmanında boş noktalar vardır. 3 D-orbitaller, bu, silikon atomlarını oluşturan bağların doğasında farklılıklara neden olur.
Karbonun oksidasyon durumları -4 ila +4 aralığında değişir.
Karbonun karakteristik bir özelliği zincir oluşturma yeteneğidir: karbon atomları birbirine bağlanır ve kararlı bileşikler oluşturur. Benzer silikon bileşikleri kararsızdır. Karbonun zincir oluşturma yeteneği, çok sayıda varlığın varlığını belirler. organik bileşikler .
İLE inorganik bileşikler karbon, oksitlerini, karbonik asidini, karbonatlarını ve bikarbonatlarını, karbürlerini içerir. Geri kalan karbon bileşikleri organiktir.
Karbon elementi şu şekilde karakterize edilir: allotropi allotropik modifikasyonları elmas, grafit, karbin, fulleren. Karbonun diğer allotropik modifikasyonları artık bilinmektedir.
Kömür Ve is olarak görülebilir amorf grafit çeşitleri.
Silikon basit bir madde oluşturur - kristal silikon. Amorf silikon var - beyaz bir toz (kirlilik olmadan).
Elmas, grafit ve kristal silikonun özellikleri tabloda verilmiştir. 
Grafit ve elmasın fiziksel özelliklerindeki bariz farklılıkların nedeni, farklı kristal kafesin yapısı . Bir elmas kristalinde her karbon atomu (kristalin yüzeyindekiler hariç) oluşur. dört komşu karbon atomlarıyla eşit güçlü bağlara sahiptir. Bu bağlar tetrahedronun köşelerine doğru yönlendirilir (CH4 molekülünde olduğu gibi). Böylece, bir elmas kristalinde her karbon atomu, tetrahedronun köşelerinde bulunan aynı atomlardan dördüyle çevrilidir. Bir elmas kristalindeki C-C bağlarının simetrisi ve gücü, onun olağanüstü gücünü ve elektronik iletkenlik eksikliğini belirler.
İÇİNDE grafit kristal Her karbon atomu, aynı düzlemdeki komşu karbon atomlarıyla 120° açıyla üç güçlü, eşdeğer bağ oluşturur. Bu düzlemde altı üyeli yassı halkalardan oluşan bir katman oluşur.
Ayrıca her karbon atomunun eşlenmemiş bir elektron. Bu elektronlar ortak bir elektron sistemi oluşturur. Katmanlar arasındaki bağlantı nispeten zayıf moleküller arası kuvvetlerden kaynaklanmaktadır. Katmanlar, bir katmanın karbon atomu, diğer katmanın altıgeninin merkezinin üzerinde yer alacak şekilde birbirine göre konumlandırılır. Katmanın içindeki C-C bağ uzunluğu 0,142 nm, katmanlar arasındaki mesafe 0,335 nm'dir. Sonuç olarak katmanlar arasındaki bağlar, katman içindeki atomlar arasındaki bağlardan çok daha zayıftır. Bu belirler Grafitin özellikleri: Yumuşaktır, pul pul dökülmesi kolaydır, gri renkli ve metalik parlaklığa sahiptir, elektriksel olarak iletkendir ve kimyasal olarak elmastan daha reaktiftir. Elmas ve grafitin kristal kafeslerinin modelleri şekilde gösterilmektedir.

Grafiti elmasa dönüştürmek mümkün mü? Bu işlem, yaklaşık 5000 MPa'lık bir basınçta ve 1500 °C ila 3000 °C arasındaki sıcaklıklarda, katalizörlerin (Ni) varlığında birkaç saat boyunca zorlu koşullar altında gerçekleştirilebilir. Ürünlerin büyük bir kısmı küçük kristaller (1 ila birkaç mm arası) ve elmas tozudur.
Karabin- karbon atomlarının aşağıdaki tipte doğrusal zincirler oluşturduğu karbonun allotropik modifikasyonu:
–С≡С–С≡С–С≡С–(α-karabina, poliin) veya =C=C=C=C=C=C=(β-karbin, polien)
Bu zincirler arasındaki mesafe, daha güçlü moleküller arası etkileşimler nedeniyle grafit katmanları arasındakinden daha küçüktür.
Carbyne siyah bir tozdur ve yarı iletkendir. Kimyasal olarak grafitten daha aktiftir.
Fulleren– C60, C70 veya C84 molekülleri tarafından oluşturulan karbonun allotropik modifikasyonu. C60 molekülünün küresel yüzeyinde karbon atomları 20 düzgün altıgen ve 12 düzgün beşgenin köşelerinde bulunur. Tüm fullerenler karbon atomlarının kapalı yapılarıdır. Fulleren kristalleri moleküler yapıya sahip maddelerdir.
Silikon. Kristal kafesi elmasınkine benzeyen, silikonun yalnızca bir kararlı allotropik modifikasyonu vardır. Silikon serttir, refrakterdir ( T° pl = 1412 °C), koyu gri renkli, metalik parlaklığa sahip çok kırılgan bir maddedir, standart koşullar altında yarı iletkendir.
| Öğe | C | Si | Ge | sn | kurşun |
|---|---|---|---|---|---|
| Seri numarası | 6 | 14 | 32 | 50 | 82 |
| Atom kütlesi (göreceli) | 12,011 | 28,0855 | 72,59 | 118,69 | 207,2 |
| Yoğunluk (n.s.), g/cm3 | 2,25 | 2,33 | 5,323 | 7,31 | 11,34 |
| t pl, °C | 3550 | 1412 | 273 | 231 | 327,5 |
| t kip, °C | 4827 | 2355 | 2830 | 2600 | 1749 |
| İyonlaşma enerjisi, kJ/mol | 1085,7 | 786,5 | 762,1 | 708,6 | 715,2 |
| Elektronik formül | 2s 2 2p 2 | 3s 2 3p 2 | 3 boyutlu 10 4s 2 4p 2 | 4d 10 5s 2 5p 2 | 4f 14 5d 10 6s 2 6p 2 |
| Elektronegatiflik (Pauling'e göre) | 2,55 | 1,9 | 2,01 | 1,96 | 2,33 |
Soy gazların elektronik formülleri:
- O - 1s 2;
- Ne - 1s 2 2s 2 2p 6;
- Ar - 1s 2 2s 2 2p 6 3s 2 3p 6;
- Kr - 3d 10 4s 2 4p 6;
- Xe - 4d 10 5s 2 5p 6;
Pirinç. Karbon atomunun yapısı.
D.I. Mendeleev'in periyodik kimyasal element tablosunun Grup 14'ü (eski sınıflandırmaya göre grup IVa) 5 element içerir: karbon, silikon, germanyum, kalay, kurşun (yukarıdaki tabloya bakın). Karbon ve silikon metal olmayan maddelerdir, germanyum metalik özellikler sergileyen bir maddedir, kalay ve kurşun tipik metallerdir.
Yerkabuğundaki en yaygın grup 14(IVa) elementi silikondur (Dünyada oksijenden sonra en çok bulunan ikinci elementtir) (%27,6), bunu karbon (%0,1), kurşun (%0,0014) ve kalay (kütle olarak %27,6) takip eder. %0,00022), germanyum (%0,00018).
Silikon, karbondan farklı olarak doğada serbest formda bulunmaz; yalnızca bağlı formda bulunabilir:
- Si02 - kuvars (birçok kayanın, kumun, kilin bir kısmı) ve çeşitleri (akik, ametist, kaya kristali, jasper vb.) formunda bulunan silika;
- silikon açısından zengin silikatlar: talk, asbest;
- alüminosilikatlar: feldispat, mika, kaolin.
Germanyum, kalay ve kurşun da doğada serbest halde bulunmaz, ancak bazı minerallerin bir parçasıdır:
- germanyum: (Cu 3 (Fe, Ge)S 4) - germanit minerali;
- kalay: SnO2 - kasiterit;
- kurşun: PbS - galen; PbS04 - açısit; PbCO3 - serüsit.
Dış enerji seviyesinde uyarılmamış durumdaki 14(IVa) grubunun tüm elemanları iki eşleşmemiş p-elektronuna sahiptir (değerlik 2, örneğin CO). Uyarılmış bir duruma geçiş sırasında (işlem enerji gerektirir), dış seviyedeki bir eşleştirilmiş s-elektronu serbest bir p-orbitaline "sıçrar", böylece 4 "yalnız" elektron (biri s-alt seviyesinde ve üçü s-alt seviyesinde) oluşturur. p-sublevel) , elementlerin değerlik yeteneklerini genişletir (değerlik 4'tür: örneğin, CO 2).

Pirinç. Bir karbon atomunun uyarılmış duruma geçişi.
Yukarıdaki nedenden ötürü, grup 14(IVa)'nın elemanları oksidasyon durumlarını sergileyebilir: +4; +2; 0; -4.
Karbondan kurşuna giden seride bir elektronun s-alt seviyesinden p-alt seviyesine “sıçrayışı” giderek daha fazla enerji gerektirdiğinden (bir karbon atomunu uyarmak için bir kurşun atomunu uyarmaktan çok daha az enerji gerekir), karbon Değerliği dört olan bileşiklere "daha isteyerek" girer; ve kurşun - iki.
Aynı şey oksidasyon durumları için de söylenebilir: karbondan kurşuna olan seride, +4 ve -4 oksidasyon durumlarının tezahürü azalır ve +2 oksidasyon durumu artar.
Karbon ve silikon metal olmadığından, bileşiğe bağlı olarak pozitif veya negatif oksidasyon durumu sergileyebilirler (daha fazla elektronegatif element içeren bileşiklerde, C ve Si elektronlardan vazgeçer ve daha az elektronegatif element içeren bileşiklerde kazanç sağlar):
C +2 O, C +4 O 2, Si +4 Cl 4 C -4 H 4, Mg 2 Si -4
Ge, Sn, Pb, bileşiklerdeki metaller olarak her zaman elektronlarını verirler:
Ge +4 Cl 4, Sn +4 Br 4, Pb +2 Cl 2
Karbon grubunun elemanları aşağıdaki bileşikleri oluşturur:
- dengesiz uçucu hidrojen bileşikleri(genel formül EH4), bunlardan yalnızca metan CH4 stabil bir bileşiktir.
- tuz oluşturmayan oksitler- düşük oksitler CO ve SiO;
- asit oksitler- daha yüksek oksitler C02 ve Si02 - bunlar zayıf asitler olan hidroksitlere karşılık gelir: H2C03 (karbonik asit), H2Si03 (silisik asit);
- amfoterik oksitler- GeO, SnO, PbO ve GeO2, SnO2, PbO2 - ikincisi, germanyum Ge(OH) 4, stronsiyum Sn(OH) 4, kurşun Pb(OH) 4'ün hidroksitlerine (IV) karşılık gelir;