Sifat kimia asas alkana. Alkana: sifat fizikal dan kimia, aplikasi
Sifat kimia hidrokarbon tepu ditentukan oleh kehadiran atom karbon dan hidrogen serta ikatan $C-H$ dan $C-C$ dalam molekulnya.
Dalam molekul alkana termudah, metana, ikatan kimia dibentuk oleh 8 elektron valens (4 elektron daripada atom karbon dan 4 daripada atom hidrogen), yang terletak dalam empat orbital molekul ikatan.
Jadi, dalam molekul metana, empat ikatan kovalen $sp3-s (C-H)$ terbentuk daripada empat $sp3$-orbital hibrid atom karbon dan orbital s bagi empat atom hidrogen (Rajah 1).
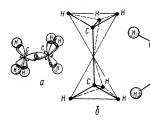
Molekul etana terbentuk daripada dua tetrahedra karbon - satu ikatan kovalen $sp3-sp3 (C-C)$ dan enam ikatan kovalen $sp3-s (C-H)$ (Rajah 2).

Rajah 2. Struktur molekul etana: a - penempatan ikatan $\sigma $ dalam molekul; b - model tetrahedral molekul; c - model bola-dan-kayu molekul; d - model skala molekul mengikut Stewart - Briegleb
Ciri-ciri ikatan kimia dalam alkana
Dalam jenis ikatan kovalen yang dipertimbangkan, kawasan dengan ketumpatan elektron terbesar terletak pada garis yang menghubungkan nukleus atom. Ikatan kovalen ini dibentuk oleh $\sigma $-$(\rm M)$$(\rm O)$ dan dipanggil $\sigma $ bon. Ciri penting ikatan ini ialah ketumpatan elektron di dalamnya diedarkan secara simetri berbanding paksi yang melalui nukleus atom (simetri silinder ketumpatan elektron). Terima kasih kepada ini, atom atau kumpulan atom yang disambungkan oleh ikatan ini boleh berputar dengan bebas tanpa menyebabkan ubah bentuk ikatan. Sudut antara arah valens atom karbon dalam molekul alkana ialah $109^\circ 28"$. Oleh itu, dalam molekul bahan ini, walaupun dengan rantai karbon lurus, atom karbon sebenarnya tidak terletak dalam garis lurus. Rantai ini mempunyai bentuk zigzag, yang dikaitkan dengan pemuliharaan sudut jarak bagi atom karbon (Rajah 3).

Rajah 3. Skema struktur rantai karbon bagi alkana biasa
Dalam molekul alkana dengan rantai karbon yang cukup panjang, sudut ini dinaikkan sebanyak $2^\circ$ disebabkan oleh penolakan atom karbon yang tidak bervalensi terikat antara satu sama lain.
Nota 1
Setiap ikatan kimia dicirikan oleh tenaga tertentu. Telah terbukti secara eksperimen bahawa tenaga ikatan $C-H$ dalam molekul metana ialah 422.9 kJ/mol, etana - 401.9 kJ/mol, dan alkana lain - kira-kira 419 kJ/mol. Tenaga ikatan $C-C$ ialah 350 kJ/mol.
Hubungan antara struktur alkana dan kereaktifannya
Tenaga tinggi ikatan $C-C$ dan $C-H$ menyebabkan kereaktifan hidrokarbon tepu yang rendah pada suhu bilik. Oleh itu, alkana tidak mengubah warna air bromin, larutan kalium permanganat, tidak berinteraksi dengan reagen ionik (asid, alkali), dan tidak bertindak balas dengan agen pengoksidaan atau logam aktif. Oleh itu, sebagai contoh, logam natrium boleh disimpan dalam minyak tanah, iaitu campuran hidrokarbon tepu. Malah asid sulfurik pekat, yang mencemarkan banyak bahan organik, tidak mempunyai kesan ke atas alkana pada suhu bilik. Memandangkan kereaktifan hidrokarbon tepu yang agak rendah, ia pernah dipanggil parafin. Alkana tidak mempunyai keupayaan untuk menambah hidrogen, halogen dan reagen lain. Oleh itu, kelas bahan organik ini dipanggil hidrokarbon tepu.
Tindak balas kimia hidrokarbon tepu boleh berlaku disebabkan oleh pembelahan ikatan $C-C$ atau $C-H$. Pecahnya ikatan $C-H$ disertai dengan penyingkiran atom hidrogen dengan pembentukan sebatian tak tepu atau penggantian seterusnya penyingkiran atom hidrogen oleh atom atau kumpulan atom lain.
Bergantung kepada struktur alkana dan keadaan tindak balas dalam molekul hidrokarbon tepu, ikatan $C-H$ boleh dipecahkan secara homolitik:

Rajah 4. Sifat kimia alkana
Dan heterolitik dengan pembentukan anion dan kation:
Rajah 5. Sifat kimia alkana
Dalam kes ini, radikal bebas boleh terbentuk yang mempunyai elektron tidak berpasangan, tetapi tidak mempunyai cas elektrik, atau karbokation atau karbion, yang mempunyai cas elektrik yang sepadan. Radikal bebas terbentuk sebagai zarah perantaraan dalam tindak balas mekanisme radikal, dan karbokation dan carbanion - dalam tindak balas mekanisme ionik.
Disebabkan oleh fakta bahawa ikatan $C-C$ adalah nonpolar, dan ikatan $C-H$ adalah kutub rendah, dan ikatan $\sigma $-ini mempunyai kebolehpolaran yang rendah, pembelahan heterolitik ikatan $\sigma $-dalam molekul alkana dengan pembentukan ion memerlukan banyak tenaga. Pembelahan hemolitik ikatan ini memerlukan lebih sedikit tenaga. Oleh itu, untuk hidrokarbon tepu, tindak balas yang dijalankan oleh mekanisme radikal adalah lebih tipikal. Pemisahan ikatan $\sigma $-bon $C-C$ memerlukan lebih sedikit tenaga daripada pemisahan ikatan $C-H$, kerana tenaga ikatan $C-C$ adalah kurang daripada tenaga ikatan $C-H$. Walau bagaimanapun, tindak balas kimia lebih kerap melibatkan pembelahan ikatan $C-H$, kerana ia lebih mudah diakses oleh reagen.
Pengaruh percabangan dan saiz alkana terhadap kereaktifannya
Kereaktifan ikatan $C-H$ berubah apabila peralihan daripada alkana dengan struktur linear kepada alkana dengan struktur bercabang. Sebagai contoh, tenaga pemisahan ikatan $C-H$ (kJ/mol) semasa pembentukan radikal bebas berubah seperti berikut:

Rajah 6. Sifat kimia alkana
Di samping itu, nilai tenaga pengionan (IE) untuk alkana menunjukkan bahawa peningkatan dalam jumlah bilangan ikatan $\sigma $-meningkatkan sifat pendermanya dan menjadi lebih mudah untuk mengeluarkan elektron bagi sebatian dengan berat molekul yang lebih tinggi, contohnya. :
Rajah 7. Sifat kimia alkana
Jadi, dalam proses radikal bebas, tindak balas berlaku terutamanya pada atom karbon tertier, kemudian pada atom sekunder, dan terakhir pada yang primer, yang bertepatan dengan siri kestabilan radikal bebas. Walau bagaimanapun, dengan peningkatan suhu, arah aliran yang diperhatikan berkurangan atau diratakan sepenuhnya.
Oleh itu, alkana dicirikan oleh dua jenis tindak balas kimia:
- penggantian hidrogen, terutamanya oleh mekanisme radikal dan
- belahan molekul di belakang ikatan $C-C$ atau $C-H$.
Alkana :
Alkana ialah hidrokarbon tepu, dalam molekulnya semua atom disambungkan oleh ikatan tunggal. Formula -
Ciri-ciri fizikal :
- Takat lebur dan didih meningkat dengan berat molekul dan panjang tulang belakang karbon
- Dalam keadaan biasa, alkana tidak bercabang dari CH 4 hingga C 4 H 10 ialah gas; dari C 5 H 12 hingga C 13 H 28 - cecair; selepas C 14 H 30 - pepejal.
- Takat lebur dan didih berkurangan daripada kurang bercabang kepada lebih bercabang. Jadi, sebagai contoh, pada 20 °C n-pentana ialah cecair, dan neopentana ialah gas.
Sifat kimia:
· Halogenasi
ini adalah salah satu tindak balas penggantian. Atom karbon terhidrogenasi paling sedikit dihalogenkan dahulu (atom tertier, kemudian atom sekunder, atom primer dihalogenkan terakhir). Halogenasi alkana berlaku secara berperingkat - tidak lebih daripada satu atom hidrogen digantikan dalam satu peringkat:
- CH 4 + Cl 2 → CH 3 Cl + HCl (klorometana)
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (diklorometana)
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (triklorometana)
- CHCl 3 + Cl 2 → CCl 4 + HCl (karbon tetraklorida).
Di bawah pengaruh cahaya, molekul klorin terurai menjadi radikal, kemudian mereka menyerang molekul alkana, mengambil atom hidrogen daripadanya, akibatnya radikal metil CH 3 terbentuk, yang bertembung dengan molekul klorin, memusnahkannya dan membentuk. radikal baru.
· Pembakaran
Sifat kimia utama hidrokarbon tepu, yang menentukan penggunaannya sebagai bahan api, ialah tindak balas pembakaran. Contoh:
CH 4 + 2O 2 → CO 2 + 2H 2 O + Q
Sekiranya kekurangan oksigen, karbon monoksida atau arang batu dihasilkan dan bukannya karbon dioksida (bergantung kepada kepekatan oksigen).
Secara umum, tindak balas pembakaran alkana boleh ditulis seperti berikut:
DENGAN n H 2 n +2 +(1,5n+0.5)O2 = n CO 2 + ( n+1)H 2 O
· Penguraian
Tindak balas penguraian berlaku hanya di bawah pengaruh suhu tinggi. Peningkatan suhu membawa kepada pemecahan ikatan karbon dan pembentukan radikal bebas.
Contoh:
CH 4 → C + 2H 2 (t > 1000 °C)
C 2 H 6 → 2C + 3H 2
Alkena :
Alkena ialah hidrokarbon tak tepu yang mengandungi dalam molekul, sebagai tambahan kepada ikatan tunggal, satu ikatan rangkap karbon-karbon - C n H 2n
Kepunyaan hidrokarbon ke dalam kelas alkena dicerminkan oleh akhiran generik –ene dalam namanya.
Ciri-ciri fizikal :
- Takat lebur dan didih alkena (dipermudahkan) meningkat dengan berat molekul dan panjang tulang belakang karbon.
- Dalam keadaan biasa, alkena dari C 2 H 4 hingga C 4 H 8 adalah gas; dari C 5 H 10 hingga C 17 H 34 - cecair, selepas C 18 H 36 - pepejal. Alkena tidak larut dalam air, tetapi sangat larut dalam pelarut organik.
Sifat kimia :
· Dehidrasi ialah proses pemisahan molekul air daripada molekul sebatian organik.
· Pempolimeran ialah proses kimia untuk menggabungkan banyak molekul awal bahan berat molekul rendah ke dalam molekul polimer yang besar.
Polimer ialah sebatian molekul tinggi yang molekulnya terdiri daripada banyak unit struktur yang serupa.
Alcadienes :
Alkadiena ialah hidrokarbon tak tepu yang mengandungi dalam molekul, sebagai tambahan kepada ikatan tunggal, ikatan karbon-karbon berganda -.
. Diena ialah isomer struktur alkuna.Ciri-ciri fizikal :
Butadiena ialah gas (takat didih −4.5 °C), isoprena ialah cecair yang mendidih pada 34 °C, dimetilbutadiena ialah cecair yang mendidih pada 70 °C. Isoprena dan hidrokarbon diena lain mampu mempolimerkan menjadi getah. Getah asli dalam keadaan tulennya ialah polimer dengan formula am (C5H8)n dan diperoleh daripada sap susu beberapa tumbuhan tropika.
Getah sangat larut dalam benzena, petrol, dan karbon disulfida. Pada suhu rendah ia menjadi rapuh dan melekit apabila dipanaskan. Untuk meningkatkan sifat mekanikal dan kimia getah, ia ditukar menjadi getah melalui pemvulkanan. Untuk mendapatkan produk getah, mereka mula-mula dibentuk daripada campuran getah dengan sulfur, serta pengisi: jelaga, kapur, tanah liat dan beberapa sebatian organik yang berfungsi untuk mempercepatkan pemvulkanan. Kemudian produk dipanaskan - pemvulkanan panas. Semasa pemvulkanan, sulfur terikat secara kimia dengan getah. Selain itu, getah tervulkan mengandungi sulfur dalam keadaan bebas dalam bentuk zarah-zarah kecil.
Hidrokarbon diena berpolimer dengan mudah. Tindak balas pempolimeran hidrokarbon diena mendasari sintesis getah. Mereka menjalani tindak balas penambahan (penghidrogenan, halogenasi, hidrohalogenasi):
H 2 C=CH-CH=CH 2 + H 2 -> H 3 C-CH=CH-CH 3
Alkuna :
Alkuna ialah hidrokarbon tak tepu yang molekulnya mengandungi, sebagai tambahan kepada ikatan tunggal, satu ikatan karbon-karbon rangkap tiga Formula-C n H 2n-2
Ciri-ciri fizikal :
Alkuna menyerupai alkena yang sepadan dalam sifat fizikalnya. Lebih rendah (sehingga C 4) ialah gas tidak berwarna dan tidak berbau yang mempunyai takat didih lebih tinggi daripada analognya dalam alkena.
Alkuna tidak larut dalam air, tetapi lebih baik dalam pelarut organik.
Sifat kimia :
Tindak balas halogenasi
Alkuna mampu menambah satu atau dua molekul halogen untuk membentuk derivatif halogen yang sepadan:
Penghidratan
Dengan adanya garam merkuri, alkuna menambah air untuk membentuk asetaldehid (untuk asetilena) atau keton (untuk alkuna lain)

Hidrokarbon tepu ialah sebatian yang merupakan molekul yang terdiri daripada atom karbon dalam keadaan hibridisasi sp 3. Mereka disambungkan antara satu sama lain secara eksklusif oleh ikatan sigma kovalen. Nama hidrokarbon "tepu" atau "tepu" berasal dari fakta bahawa sebatian ini tidak mempunyai keupayaan untuk melekatkan sebarang atom. Mereka melampau, tepu sepenuhnya. Pengecualian ialah sikloalkana.
Apakah alkana?
Alkana ialah hidrokarbon tepu, dan rantai karbonnya terbuka dan terdiri daripada atom karbon yang disambungkan antara satu sama lain menggunakan ikatan tunggal. Ia tidak mengandungi ikatan lain (iaitu, berganda, seperti alkena, atau rangkap tiga, seperti alkil). Alkana juga dipanggil parafin. Mereka menerima nama ini kerana parafin yang terkenal adalah campuran kebanyakannya hidrokarbon tepu C 18 -C 35 ini dengan lengai tertentu.
Maklumat am tentang alkana dan radikalnya
Formula mereka: C n P 2 n +2, di sini n adalah lebih besar daripada atau sama dengan 1. Jisim molar dikira menggunakan formula: M = 14n + 2. Ciri ciri: penghujung dalam nama mereka ialah "-an". Sisa-sisa molekulnya, yang terbentuk sebagai hasil daripada penggantian atom hidrogen dengan atom lain, dipanggil radikal alifatik, atau alkil. Mereka ditetapkan dengan huruf R. Formula umum radikal alifatik monovalen: C n P 2 n +1, di sini n lebih besar daripada atau sama dengan 1. Jisim molar radikal alifatik dikira dengan formula: M = 14n + 1. Ciri ciri radikal alifatik: berakhiran dalam nama "- kelodak." Molekul alkana mempunyai ciri strukturnya sendiri:
- Ikatan C-C dicirikan oleh panjang 0.154 nm;
- Ikatan C-H dicirikan oleh panjang 0.109 nm;
- sudut ikatan (sudut antara ikatan karbon-karbon) ialah 109 darjah dan 28 minit.

Alkana memulakan siri homolog: metana, etana, propana, butana, dan sebagainya.
Sifat fizikal alkana
Alkana adalah bahan yang tidak berwarna dan tidak larut dalam air. Suhu di mana alkana mula mencair dan suhu di mana ia mendidih meningkat mengikut pertambahan berat molekul dan panjang rantai hidrokarbon. Daripada alkana yang kurang bercabang kepada alkana yang lebih bercabang, takat didih dan lebur berkurangan. Alkana gas boleh terbakar dengan nyalaan biru pucat atau tidak berwarna dan menghasilkan haba yang agak banyak. CH 4 -C 4 H 10 ialah gas yang juga tidak mempunyai bau. C 5 H 12 -C 15 H 32 ialah cecair yang mempunyai bau tertentu. C 15 H 32 dan seterusnya ialah pepejal yang juga tidak berbau.
Sifat kimia alkana
Sebatian ini tidak aktif secara kimia, yang boleh dijelaskan oleh kekuatan ikatan sigma yang sukar dipecahkan - C-C dan C-H. Ia juga patut dipertimbangkan bahawa ikatan C-C adalah bukan kutub, dan ikatan C-H adalah kutub rendah. Ini adalah jenis ikatan terpolarisasi rendah yang tergolong dalam jenis sigma dan, oleh itu, ia berkemungkinan besar akan dipecahkan oleh mekanisme homolitik, akibatnya radikal akan terbentuk. Oleh itu, sifat kimia alkana terutamanya terhad kepada tindak balas penggantian radikal.

Tindak balas pembilasan
Alkana bertindak balas hanya dengan asid nitrik dengan kepekatan 10% atau dengan nitrogen oksida tetravalen dalam persekitaran gas pada suhu 140°C. Tindak balas penitratan alkana dipanggil tindak balas Konovalov. Akibatnya, sebatian nitro dan air terbentuk: CH 4 + asid nitrik (dicairkan) = CH 3 - NO 2 (nitrometana) + air.
Tindak balas pembakaran
Hidrokarbon tepu sangat kerap digunakan sebagai bahan api, yang dibenarkan oleh keupayaannya untuk membakar: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
Tindak balas pengoksidaan
Sifat kimia alkana juga termasuk keupayaannya untuk mengoksida. Bergantung pada keadaan yang mengiringi tindak balas dan cara ia diubah, produk akhir yang berbeza boleh diperoleh daripada bahan yang sama. Pengoksidaan ringan metana dengan oksigen dengan kehadiran mangkin yang mempercepatkan tindak balas dan suhu kira-kira 200 ° C boleh mengakibatkan bahan berikut:
1) 2CH 4 (pengoksidaan dengan oksigen) = 2CH 3 OH (alkohol - metanol).
2) CH 4 (pengoksidaan dengan oksigen) = CH 2 O (aldehid - metanal atau formaldehid) + H 2 O.
3) 2CH 4 (pengoksidaan dengan oksigen) = 2HCOOH (asid karboksilik - metana atau formik) + 2H 2 O.

Juga, pengoksidaan alkana boleh dilakukan dalam medium gas atau cecair dengan udara. Tindak balas sedemikian membawa kepada pembentukan alkohol lemak yang lebih tinggi dan asid yang sepadan.
Kaitan dengan haba
Pada suhu tidak melebihi +150-250°C, sentiasa dengan kehadiran pemangkin, penyusunan semula struktur bahan organik berlaku, yang terdiri daripada perubahan dalam susunan sambungan atom. Proses ini dipanggil pengisomeran, dan bahan yang terhasil daripada tindak balas dipanggil isomer. Oleh itu, dari butana biasa, isomernya diperoleh - isobutana. Pada suhu 300-600°C dan kehadiran mangkin, ikatan C-H dipecahkan dengan pembentukan molekul hidrogen (tindak balas penyahhidrogenan), molekul hidrogen dengan penutupan rantai karbon ke dalam kitaran (tindak balas siklik atau aromatisasi alkana) :
1) 2CH 4 = C 2 H 4 (etena) + 2H 2.
2) 2CH 4 = C 2 H 2 (ethyne) + 3H 2.
3) C 7 H 16 (heptana normal) = C 6 H 5 - CH 3 (toluena) + 4 H 2.

Tindak balas halogenasi
Tindak balas sedemikian melibatkan pengenalan halogen (atomnya) ke dalam molekul bahan organik, mengakibatkan pembentukan ikatan C-halogen. Apabila alkana bertindak balas dengan halogen, terbitan halogen terbentuk. Tindak balas ini mempunyai ciri khusus. Ia berjalan mengikut mekanisme radikal, dan untuk memulakannya, adalah perlu untuk mendedahkan campuran halogen dan alkana kepada sinaran ultraungu atau hanya memanaskannya. Sifat-sifat alkana membolehkan tindak balas halogenasi diteruskan sehingga penggantian lengkap dengan atom halogen dicapai. Iaitu, pengklorinan metana tidak akan berakhir dalam satu peringkat dan penghasilan metil klorida. Tindak balas akan pergi lebih jauh, semua produk penggantian yang mungkin akan terbentuk, bermula dengan klorometana dan berakhir dengan karbon tetraklorida. Pendedahan alkana lain kepada klorin di bawah keadaan ini akan mengakibatkan pembentukan pelbagai produk hasil daripada penggantian hidrogen pada atom karbon yang berbeza. Suhu di mana tindak balas berlaku akan menentukan nisbah produk akhir dan kadar pembentukannya. Semakin panjang rantai hidrokarbon alkana, semakin mudah tindak balasnya. Semasa halogenasi, atom karbon terhidrogenasi (tertiary) yang paling sedikit akan diganti dahulu. Yang utama akan bertindak balas selepas semua yang lain. Tindak balas halogenasi akan berlaku secara berperingkat. Pada peringkat pertama, hanya satu atom hidrogen diganti. Alkana tidak berinteraksi dengan larutan halogen (air klorin dan bromin).

Tindak balas sulfoklorinasi
Sifat kimia alkana juga dilengkapi dengan tindak balas sulfoklorinasi (dipanggil tindak balas Reed). Apabila terdedah kepada sinaran ultraungu, alkana dapat bertindak balas dengan campuran klorin dan sulfur dioksida. Akibatnya, hidrogen klorida terbentuk, serta radikal alkil, yang menambah sulfur dioksida. Hasilnya ialah sebatian kompleks yang menjadi stabil akibat penangkapan atom klorin dan pemusnahan molekul seterusnya: R-H + SO 2 + Cl 2 + sinaran ultraungu = R-SO 2 Cl + HCl. Sulfonil klorida yang terbentuk hasil daripada tindak balas digunakan secara meluas dalam penghasilan surfaktan.
Penggunaan alkana agak pelbagai - ia digunakan sebagai bahan api, serta dalam mekanik, perubatan, dll. Peranan sebatian kimia ini dalam kehidupan manusia moden hampir tidak boleh dianggarkan terlalu tinggi.
Alkana: sifat dan penerangan ringkas
Alkana ialah sebatian karbon bukan kitaran di mana atom karbonnya dihubungkan oleh ikatan tepu ringkas. Bahan ini mewakili julat keseluruhan dengan sifat dan ciri tertentu. seperti berikut:
N di sini mewakili bilangan atom karbon. Contohnya, CH3, C2H6.
Empat wakil pertama siri alkana ialah bahan gas: metana, etana, propana dan butana. Sebatian berikut (C5 hingga C17) ialah cecair. Siri ini diteruskan dengan sebatian yang pepejal dalam keadaan normal.
Bagi sifat kimia, alkana adalah rendah aktif - ia boleh dikatakan tidak berinteraksi dengan alkali dan asid. Dengan cara ini, ia adalah sifat kimia yang menentukan penggunaan alkana.
Walau bagaimanapun, sebatian ini dicirikan oleh tindak balas tertentu, termasuk penggantian atom hidrogen, serta proses pemisahan molekul.
- Reaksi yang paling ciri adalah halogenasi, di mana atom hidrogen digantikan oleh halogen. Tindak balas pengklorinan dan brominasi sebatian ini adalah sangat penting.
- Nitrasi ialah penggantian atom hidrogen dengan kumpulan nitro semasa tindak balas dengan cair (kepekatan 10%) Dalam keadaan biasa, alkana tidak bertindak balas dengan asid. Untuk menjalankan tindak balas sedemikian, suhu 140 °C diperlukan.
- Pengoksidaan - dalam keadaan normal, alkana tidak terjejas oleh oksigen. Walau bagaimanapun, selepas pencucuhan di udara, bahan-bahan ini masuk ke dalam produk akhir iaitu air dan
- Keretakan - tindak balas ini berlaku hanya dengan kehadiran pemangkin yang diperlukan. Proses ini melibatkan pembelahan ikatan homolog yang stabil antara atom karbon. Sebagai contoh, apabila butana retak, tindak balas boleh menghasilkan etana dan etilena.
- Pengisomeran - akibat tindakan pemangkin tertentu, beberapa penyusunan semula rangka karbon alkana adalah mungkin.
Aplikasi alkana
Sumber semula jadi utama bahan-bahan ini adalah produk berharga seperti gas asli dan minyak. Bidang penggunaan alkana hari ini sangat luas dan pelbagai.
Sebagai contoh, bahan gas digunakan sebagai sumber bahan api yang berharga. Contohnya ialah metana, yang diperbuat daripada gas asli, serta campuran propana-butana.
Satu lagi sumber alkana ialah minyak , kepentingannya bagi manusia moden sukar untuk dipandang tinggi. Produk petroleum termasuk:
- petrol - digunakan sebagai bahan api;
- minyak tanah;
- bahan api diesel, atau minyak gas ringan;
- minyak gas berat, yang digunakan sebagai minyak pelincir;
- tinggalan digunakan untuk membuat asfalt.
Produk petroleum juga digunakan untuk menghasilkan plastik, gentian sintetik, getah dan beberapa detergen.
Vaseline dan jeli petroleum adalah produk yang terdiri daripada campuran alkana. Mereka digunakan dalam perubatan dan kosmetologi (terutamanya untuk penyediaan salap dan krim), serta dalam minyak wangi.
Parafin adalah satu lagi produk yang terkenal, iaitu campuran alkana pepejal. Ini adalah jisim putih pepejal, suhu pemanasannya ialah 50 - 70 darjah. Dalam pengeluaran moden, parafin digunakan untuk membuat lilin. Mancis diresapi dengan bahan yang sama. Dalam perubatan, pelbagai prosedur terma dilakukan menggunakan parafin.
Adalah berguna untuk memulakan dengan definisi konsep alkana. Ini adalah tepu atau tepu Kita juga boleh mengatakan bahawa ini adalah karbon di mana sambungan atom C dijalankan melalui ikatan ringkas. Formula amnya ialah: CnH₂n+ 2.
Adalah diketahui bahawa nisbah bilangan atom H dan C dalam molekulnya adalah maksimum jika dibandingkan dengan kelas lain. Disebabkan fakta bahawa semua valens diduduki oleh sama ada C atau H, sifat kimia alkana tidak dinyatakan dengan jelas, jadi nama kedua mereka ialah frasa hidrokarbon tepu atau tepu.
Terdapat juga nama lama yang paling mencerminkan sifat lengai kimia relatifnya - parafin, yang bermaksud "tanpa pertalian".
Jadi, topik perbualan kita hari ini ialah: "Alkana: siri homologi, tatanama, struktur, isomerisme." Data mengenai sifat fizikalnya juga akan dibentangkan.
Alkana: struktur, tatanama
Di dalamnya, atom C berada dalam keadaan yang dipanggil hibridisasi sp3. Dalam hal ini, molekul alkana boleh ditunjukkan sebagai satu set struktur C tetrahedral yang bersambung bukan sahaja antara satu sama lain, tetapi juga kepada H.
Di antara atom C dan H terdapat ikatan s-kutub yang kuat dan sangat rendah. Atom sentiasa berputar mengelilingi ikatan ringkas, itulah sebabnya molekul alkana mengambil pelbagai bentuk, dan panjang ikatan serta sudut di antaranya adalah nilai tetap. Bentuk yang bertukar menjadi satu sama lain disebabkan oleh putaran molekul di sekeliling ikatan σ biasanya dipanggil konformasi.

Dalam proses pengabstrakan atom H daripada molekul berkenaan, spesies 1-valent yang dipanggil radikal hidrokarbon terbentuk. Mereka muncul sebagai hasil bukan sahaja tetapi juga sebatian bukan organik. Jika anda menolak 2 atom hidrogen daripada molekul hidrokarbon tepu, anda mendapat radikal 2-valent.
Oleh itu, nomenklatur alkana boleh:
- jejari (versi lama);
- penggantian (antarabangsa, sistematik). Ia dicadangkan oleh IUPAC.
Ciri-ciri tatanama jejari
Dalam kes pertama, nomenklatur alkana dicirikan seperti berikut:
- Pertimbangan hidrokarbon sebagai derivatif metana, di mana 1 atau beberapa atom H digantikan oleh radikal.
- Tahap kemudahan yang tinggi dalam hal sambungan yang tidak terlalu kompleks.
Ciri-ciri tatanama penggantian
Nomenklatur pengganti alkana mempunyai ciri-ciri berikut:
- Asas untuk nama itu ialah 1 rantai karbon, manakala serpihan molekul yang tinggal dianggap sebagai substituen.
- Jika terdapat beberapa radikal yang sama, nombor itu ditunjukkan sebelum namanya (secara ketat dalam perkataan), dan nombor radikal dipisahkan dengan koma.
Kimia: tatanama alkana
Untuk kemudahan, maklumat dibentangkan dalam bentuk jadual.
Nama bahan | Asas nama (root) | Formula molekul | Nama pengganti karbon | Formula Pengganti Karbon |
Nomenklatur alkana di atas termasuk nama-nama yang telah berkembang secara sejarah (4 ahli pertama siri hidrokarbon tepu).
Nama-nama alkana yang tidak berkembang dengan 5 atau lebih atom C berasal daripada angka Yunani yang mencerminkan bilangan atom C yang diberikan Oleh itu, akhiran -an menunjukkan bahawa bahan itu adalah daripada siri sebatian tepu.

Apabila menyusun nama alkana yang tidak dilipat, rantai utama adalah yang mengandungi bilangan maksimum atom C. Ia dinomborkan supaya substituen mempunyai nombor yang paling rendah. Dalam kes dua atau lebih rantai yang sama panjang, yang utama menjadi yang mengandungi bilangan pengganti terbesar.
Isomerisme alkana
Hidrokarbon induk bagi siri mereka ialah metana CH₄. Dengan setiap wakil siri metana yang berikutnya, perbezaan dari yang sebelumnya diperhatikan dalam kumpulan metilena - CH₂. Corak ini boleh dikesan sepanjang keseluruhan siri alkana.
Saintis Jerman Schiel mengemukakan cadangan untuk memanggil siri ini homologi. Diterjemah dari bahasa Yunani ia bermaksud "serupa, serupa."
Oleh itu, siri homolog ialah satu set sebatian organik berkaitan yang mempunyai struktur yang sama dan sifat kimia yang serupa. Homolog ialah ahli siri tertentu. Perbezaan homolog ialah kumpulan metilena di mana 2 homolog jiran berbeza.
Seperti yang dinyatakan sebelum ini, komposisi mana-mana hidrokarbon tepu boleh dinyatakan menggunakan formula am CnH₂n + 2. Oleh itu, ahli seterusnya siri homolog selepas metana ialah etana - C₂H₆. Untuk menukar strukturnya daripada metana, adalah perlu untuk menggantikan 1 atom H dengan CH₃ (rajah di bawah).

Struktur setiap homolog berikutnya boleh disimpulkan daripada yang sebelumnya dengan cara yang sama. Akibatnya, propana terbentuk daripada etana - C₃H₈.
Apakah isomer?
Ini adalah bahan yang mempunyai komposisi molekul kualitatif dan kuantitatif yang sama (rumus molekul yang sama), tetapi struktur kimia yang berbeza, dan juga mempunyai sifat kimia yang berbeza.
Hidrokarbon yang dibincangkan di atas berbeza dalam parameter seperti takat didih: -0.5° - butana, -10° - isobutana. Jenis isomerisme ini dipanggil isomerisme rangka karbon; ia tergolong dalam jenis struktur.
Bilangan isomer struktur meningkat dengan cepat apabila bilangan atom karbon bertambah. Oleh itu, C₁₀H₂₂ akan sepadan dengan 75 isomer (tidak termasuk spatial), dan untuk C₁₅H₃₂ 4347 isomer sudah diketahui, untuk C₂₀H₄₂ - 366,319.
Jadi, ia telah menjadi jelas apa itu alkana, siri homolog, isomerisme, tatanama. Kini ia patut beralih kepada peraturan untuk menyusun nama mengikut IUPAC.

Tatanama IUPAC: peraturan pembentukan nama
Pertama, adalah perlu untuk mencari dalam struktur hidrokarbon rantai karbon yang paling panjang dan mengandungi bilangan substituen maksimum. Kemudian anda perlu menomborkan atom C rantai, bermula dari hujung yang mana substituennya paling hampir.
Kedua, asas ialah nama hidrokarbon tepu yang tidak bercabang, yang, dari segi bilangan atom C, sepadan dengan rantai utama.
Ketiga, sebelum pangkalan adalah perlu untuk menunjukkan bilangan locant berhampiran tempat substituen berada. Nama substituen ditulis selepas mereka dengan tanda sempang.
Keempat, dalam kes kehadiran substituen yang sama pada atom C yang berbeza, lokan digabungkan, dan awalan darab muncul sebelum nama: di - untuk dua substituen yang sama, tiga - untuk tiga, tetra - empat, penta - untuk lima , dsb. Nombor mesti dipisahkan antara satu sama lain dengan koma, dan daripada perkataan dengan tanda sempang.
Jika atom C yang sama mengandungi dua substituen sekaligus, locant juga ditulis dua kali.
Mengikut peraturan ini, tatanama antarabangsa alkana terbentuk.

Unjuran Newman
Saintis Amerika ini mencadangkan formula unjuran khas untuk demonstrasi grafik konformasi - unjuran Newman. Ia sepadan dengan bentuk A dan B dan ditunjukkan dalam rajah di bawah.

Dalam kes pertama, ini ialah konformasi terhalang A, dan dalam kes kedua, ia adalah konformasi terhalang B. Dalam kedudukan A, atom H terletak pada jarak minimum antara satu sama lain. Bentuk ini sepadan dengan nilai tenaga tertinggi, kerana fakta bahawa tolakan di antara mereka adalah yang paling besar. Ini adalah keadaan yang tidak menguntungkan secara bertenaga, akibatnya molekul cenderung meninggalkannya dan bergerak ke kedudukan B yang lebih stabil. Di sini atom H berada sejauh mungkin antara satu sama lain. Oleh itu, perbezaan tenaga antara kedudukan ini ialah 12 kJ/mol, kerana putaran bebas di sekeliling paksi dalam molekul etana, yang menghubungkan kumpulan metil, adalah tidak sekata. Selepas memasuki kedudukan yang menggalakkan secara bertenaga, molekul itu kekal di sana, dengan kata lain, "melambatkan." Itulah sebabnya ia dipanggil terhambat. Hasilnya ialah 10 ribu molekul etana berada dalam bentuk konformasi terhalang pada suhu bilik. Hanya satu yang mempunyai bentuk yang berbeza - dikaburkan.
Mendapatkan hidrokarbon tepu
Daripada artikel itu telah diketahui bahawa ini adalah alkana (struktur dan tatanama mereka telah diterangkan secara terperinci sebelum ini). Adalah berguna untuk mempertimbangkan cara untuk mendapatkannya. Ia dibebaskan daripada sumber semula jadi seperti minyak, semula jadi, dan arang batu. Kaedah sintetik juga digunakan. Contohnya, H₂ 2H₂:
- Proses penghidrogenan CnH₂n (alkena)→ CnH₂n+2 (alkana)← CnH₂n-2 (alkuna).
- Daripada campuran C dan H monoksida - gas sintesis: nCO+(2n+1)H₂→ CnH₂n+2+nH₂O.
- Daripada asid karboksilik (garamnya): elektrolisis di anod, di katod:
- Elektrolisis Kolbe: 2RCOONa+2H₂O→R-R+2CO₂+H₂+2NaOH;
- Tindak balas Dumas (aloi dengan alkali): CH₃COONa+NaOH (t)→CH₄+Na₂CO₃.
- Keretakan minyak: CnH₂n+2 (450-700°)→ CmH₂m+2+ Cn-mH₂(n-m).
- Pengegasan bahan api (pepejal): C+2H₂→CH₄.
- Sintesis alkana kompleks (turunan halogen) yang mempunyai atom C yang lebih sedikit: 2CH₃Cl (klorometana) +2Na →CH₃- CH₃ (etana) +2NaCl.
- Penguraian metanida (karbida logam) oleh air: Al₄C₃+12H₂O→4Al(OH₃)↓+3CH₄.
Sifat fizikal hidrokarbon tepu
Untuk kemudahan, data dikumpulkan ke dalam jadual.
Formula | Alkana | Takat lebur dalam °C | Takat didih dalam °C | Ketumpatan, g/ml |
0.415 pada t = -165°C |
||||
0.561 pada t= -100°C |
||||
0.583 pada t = -45°C |
||||
0.579 pada t =0°C |
||||
2-Metilpropana | 0.557 pada t = -25°C |
|||
2,2-Dimetilpropana | ||||
2-Metilbutana | ||||
2-Metilpentana | ||||
2,2,3,3-Tetra-metilbutana | ||||
2,2,4-Trimetilpentana | ||||
n-C₁₀H₂₂ | ||||
n-C₁₁H₂₄ | n-Undecane | |||
n-C₁₂H₂₆ | n-Dodecane | |||
n-C₁₃H₂₈ | n-Tridecan | |||
n-C₁₄H₃₀ | n-Tetradecane | |||
n-C₁₅H₃₂ | n-Pentadecane | |||
n-C₁₆H₃₄ | n-Heksadekana | |||
n-C₂₀H₄₂ | n-Eicosane | |||
n-C₃₀H₆₂ | n-Triacontan | 1 mmHg st | ||
n-C₄₀H₈₂ | n-Tetracontane | 3 mmHg Seni. | ||
n-C₅₀H₁₀₂ | n-Pentacontan | 15 mmHg Seni. | ||
n-C₆₀H₁₂₂ | n-Hexacontane | |||
n-C₇₀H₁₄₂ | n-Heptacontane | |||
n-C₁₀₀H₂₀₂ |
Kesimpulan
Artikel itu mengkaji konsep seperti alkana (struktur, tatanama, isomerisme, siri homolog, dll.). Sedikit diperkatakan tentang ciri-ciri tatanama radial dan substitutif. Kaedah untuk mendapatkan alkana diterangkan.
Di samping itu, artikel itu menyenaraikan secara terperinci keseluruhan tatanama alkana (ujian boleh membantu anda mengasimilasikan maklumat yang diterima).