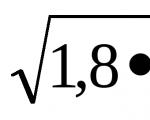Reações de troca iônica chegando ao fim. Equações de reação iônica
Problema 1. Calcule a concentração de íons hidrogênio na solução de HCN (C m = 10 -3 M), se = 4,2∙10 -3 .
Solução: A dissociação do ácido cianídrico ocorre de acordo com a equação HCN ↔ H + + CN - ; as concentrações de íons e na solução são iguais entre si (uma vez que H+: C N - = 1:1, onde
- coeficientes estequiométricos), ou seja, = = Cm, mol/l; Então = = 4,2∙10 -3 ∙ 10 -3 = 4,210 -7 mol/l.
Solução : O hidróxido de amônio dissocia-se da seguinte forma:
NH 4 OH ↔ NH 4 + + OH -, a constante de dissociação tem a forma
K d =;
as concentrações de íons amônio e hidróxido são as mesmas ( (NH4+) : (OH -) = 1:1), nós os denotamos como X:
= =x mol/l , então a expressão para K d assumirá a forma
1,810 -5 = X 2 / 0,01-X. Considerando que X<< С м, решаем уравнение
1,810 -5 =x 2 / 0,01, relativo X:
X=
 =4,2∙10 -4 mol/l; = 4,2∙10 -4 mol/l.
=4,2∙10 -4 mol/l; = 4,2∙10 -4 mol/l.
As concentrações de íons hidrogênio e hidróxido estão relacionadas através do produto iônico da água K c= =10 -14, vamos expressar a concentração de íons hidrogênio = K c/ e calcule seu valor:
110 -14 /4,210 -4 = 2,310 -11 mol/l.
Problema 3. Determine o pH da solução de HCl ( =1), se C m =2∙10 -3 M
Solução: A dissociação do ácido clorídrico ocorre de acordo com a equação
HCl H + + Cl - , concentração de íons hidrogênio = C m =1∙2∙10 -3 = =2∙10 -3 mol/l. Indicador de hidrogênio pH = - log = - log2∙10 -3 = 2,7.
Problema 4. Determine a concentração molar de hidróxido de amônio se pH=11 e Kd=1,8∙10 -5.
Solução: Concentração de íons hidrogênio =10 - pH =10 -11 mol/l. A partir do produto iônico da água determinamos a concentração = K c / = 10 -14 /10 -11 =10 -3 mol/l. O hidróxido de amônio é uma base fraca e é caracterizado pela equação da reação de dissociação
NH 4 OH ↔ NH 4 + + OH - . Expressão para a constante de dissociação
Kd=. 
Da lei de Ostwald segue que = = ∙C m, uma PARA d = 2 C m. Combinando as equações, obtemos C m = 2 / K d = 10 -6 / 1,8∙10 -5 = 0,056 mol/l
Produto de solubilidade
As substâncias, dependendo de sua natureza, apresentam solubilidade diferente em água, que varia de frações de miligrama a centenas de gramas por litro. Eletrólitos pouco solúveis formam soluções saturadas de concentrações muito baixas, portanto podemos assumir que o grau de sua dissociação atinge a unidade. Assim, uma solução saturada de um eletrólito pouco solúvel é um sistema que consiste na própria solução, que está em equilíbrio com um precipitado da substância dissolvida. Sob condições externas constantes, a taxa de dissolução do precipitado é igual à taxa do processo de cristalização: K n A eu ↔ n K+ eu + eu A- n (1)
solução precipitada
Para descrever este processo de equilíbrio heterogêneo, é utilizada uma constante de equilíbrio, chamada de produto de solubilidade PR = n eu, onde e são as concentrações de íons em uma solução saturada (mol/l). Por exemplo:
AgCl= Ag + +Cl - , PR = ; Aqui n = m=1.
PbI 2 = Pb 2+ +2I - , PR = 2; Aqui n=1, eu=2.
PR depende da natureza da substância dissolvida e da temperatura. PR é um valor tabular. Conhecendo relações públicas , você pode calcular a concentração de uma solução saturada de uma substância, e também estimar sua solubilidade em g por 100 ml de água (valor é, indicado na literatura de referência) e determinar a possibilidade de precipitação da substância.
Para a equação (1), a relação entre a concentração de uma solução saturada de uma substância dificilmente solúvel (C m, mol/l) e o valor PR é determinada pela seguinte equação: 
 ,
,
Onde n E eu –coeficientes estequiométricos na eq. 1.
Tarefa 5. A concentração da solução saturada (C m)Mg(OH) 2 é 1,1 10 -4 mol/l. Escreva a expressão para PR e calcule seu valor.
Solução: Em uma solução saturada de Mg(OH) 2, o equilíbrio é estabelecido entre o precipitado e a solução Mg(OH) 2 ↔Mg 2+ + 2OH - , para a qual a expressão PR tem a forma PR = 2. Conhecendo a concentração de íons, você pode encontrar seu valor numérico. Dada a completa dissociação
Mg(OH) 2, sua concentração solução saturada C m = = 1,110 -4 mol/l, a = 2 = 2,210 -4 mol/l. Portanto, PR= 2 =1,1. 10 -4 (2,2 10 -4) 2 = 5,3. 10 -12.
Tarefa 6. Calcule a concentração da solução saturada e o PR do cromato de prata se 0,011 g de sal forem dissolvidos em 0,5 l de água.
Solução:
Para determinar a concentração molar de uma solução saturada Ag 2 CrO 4 usamos a fórmula C M =
 ,
Onde eu- massa do soluto (g), M - massa molar (g/mol), V- volume de solução (l). M (Ag 2
CrO 4
)
=332g/mol. cm=9,48. 10 -5 mol/l. A dissolução do cromato de prata (I) é acompanhada pela dissociação completa ( = 1) do sal: Ag 2 CrO 4 ↔ 2Ag + +CrO 4 2-, PR = 2, onde = C m = 9,48. 10 -5 mol/l, a = 2 =1,89610 -4.
,
Onde eu- massa do soluto (g), M - massa molar (g/mol), V- volume de solução (l). M (Ag 2
CrO 4
)
=332g/mol. cm=9,48. 10 -5 mol/l. A dissolução do cromato de prata (I) é acompanhada pela dissociação completa ( = 1) do sal: Ag 2 CrO 4 ↔ 2Ag + +CrO 4 2-, PR = 2, onde = C m = 9,48. 10 -5 mol/l, a = 2 =1,89610 -4.
Assim PR = (1,89610 -4) 2 (9,4810 -5) = 3,410 -12.
Problema 7. É possível preparar soluções de sal CaCO 3 com concentrações de CaCO 3 C 1 = 10 -2 M e C 2 = 10 -6 M, se PR CaCO 3 = 3,810 -9.
Solução: Conhecendo o valor PR, você pode calcular a concentração
solução salina saturada e compará-la com a proposta
concentrações, tirar uma conclusão sobre a possibilidade ou impossibilidade de preparação de soluções. A dissolução do carbonato de cálcio ocorre de acordo com o esquema CaCO 3 ↔Ca 2+ +CO 3 2- Nesta equação n = eu = 1 então
 =
=
 ≈ 6,2 10 -5 mol/l,
≈ 6,2 10 -5 mol/l,
C 1 > C m – a solução não pode ser preparada, pois se formará um precipitado;
C2< С м – раствор приготовить можно.
Reações de troca iônica
As soluções eletrolíticas são caracterizadas por reações de troca iônica. Um pré-requisito para que tais reações ocorram quase completamente é a remoção de certos íons da solução devido a:
1) formação de sedimentos
FeSO 4 + 2 NaOH Fe(OH) 2 + Na 2 SO 4 - equação molecular (MU)
Fe 2+ +SO 4 2- +2Na + +2OH - Fe(OH) 2 +2Na + +SO 4 2- equação íon-molecular (IMU).
Fe 2+ +2OH - Fe(OH) 2 (PR Fe (OH) 2 = 4,810 -16) – uma breve equação íon-molecular para a formação de precipitado;
2) liberação de gás
Na 2 CO 3 + 2H 2 SO 4 H 2 CO 3 + 2NaHSO 4 (MU)
2Na + +CO 3 2- + 2H + + 2HSO 4 - H 2 C0 3 + 2Na + + 2HSO 4 - (IMU)
2H + + CO 3 2- H 2 C0 3 H 2 O + C0 2 - íon - nível molecular
formação de um composto volátil.
3) formação de eletrólitos fracos
a) substâncias simples:
2KCN + H 2 SO 4 2HCN + K 2 SO 4 (MU)
2K + + 2CN - + 2H + +SO 4 2- 2HCN + 2K + +SO 4 2- (IMU)
CN - +H + HCN (K d HCN = 7,8 10 -10) – nível íon-molecular de formação do eletrólito fraco HCN.
b) compostos complexos:
ZnCl 2 + 4NH 3 Cl 2 (MU)
Zn 2+ + 2Cl - +4NH 3 2+ + 2Cl - -(IMU)
Zn 2+ +4NH 3 2+ - uma breve equação iônico-molecular para a formação de um cátion complexo.
Existem processos nos quais eletrólitos fracos ou compostos pouco solúveis estão entre os materiais de partida e produtos de reação. Neste caso, o equilíbrio se desloca para a formação de substâncias que possuem a menor constante de dissociação ou para a formação de uma substância menos solúvel:
A) NH 4 OH + HCl NH 4 Cl + H 2 O (MU)
NH 4 OH + H + + Cl - NH 4 + + Cl - + H 2 O
NH 4 OH + H + NH 4 + + H 2 O (IMU)
K d ( NH 4 OH) =1,8 10 -5 > K d ( H 2 O) =1,810 -16.
O equilíbrio é deslocado para a formação de moléculas de água.
B) AgCl + NaI AgI + NaCl (MU)
AgCl + Na + +I - AgI+ Na + +Cl -
AgCl + I - AgI + Cl - (IMU)
ETC. AgCl =1,7810 -10 > ETC. AgI =8,310 -17.
O equilíbrio é deslocado para a formação de um precipitado AgI.
C) Pode haver processos em cujas equações existe um composto pouco solúvel e um eletrólito fraco
MnS + 2HCl MnCl 2 + H 2 S (MU)
MnS + 2H + +2Cl - Mn 2+ + 2Cl - + H 2 S
MnS + 2 H + Mn 2+ + H 2 S (IMU)
PR MnS =2,510 -10 ; =  =1,58,10 -5 mol/l
=1,58,10 -5 mol/l
K d H 2 S = K 1 K 2 = 610 -22; =  =5,4,10 -8 mol/l
=5,4,10 -8 mol/l
A ligação dos íons S 2- às moléculas de H 2 S ocorre de forma mais completa do que em MnS, portanto a reação prossegue no sentido direto, em direção à formação de H 2 S
Hidrólise de sais
A hidrólise é o resultado da interação de polarização dos íons salinos com sua camada de hidratação. A hidrólise é uma reação de troca em solução entre moléculas de água e íons de sal. Como resultado da hidrólise, devido à formação de um eletrólito fraco (ácido fraco ou base fraca), o equilíbrio iônico H 2 O⇄H + + OH - muda devido à ligação de H + ou OH - e o pH do ambiente muda . Sais que contêm íons ácidos fracos ou bases fracas sofrem hidrólise. Os sais formados por íons de um ácido forte e uma base forte não sofrem hidrólise (NaCl, Na 2 SO 4). Os produtos da hidrólise podem ser eletrólitos fracos, substâncias pouco dissociadas, pouco solúveis e voláteis. A hidrólise é uma reação gradual; no caso de um íon com carga múltipla, o número de etapas é igual à sua carga. Hidrólise por cátion sais formados por ânions ácidos fortes e cátions básicos fracos são afetados. Por exemplo, bases fracas incluem hidróxidos p- E d-metais (K d 10 -4), bem como hidróxido de amônio.
O cloreto de zinco é um sal formado pela base fraca Zn(OH) 2 e pelo ácido forte HCl. O cátion zinco tem carga 2+, então a hidrólise ocorrerá em duas etapas:
Zn 2+ + HOH ↔ ZnOH + + H + estágio I
ZnOH + +HOH↔ Zn(OH) 2 +H + estágio II
Como resultado dessa interação, surge um excesso de íons H + ([H + ] [OH - ]), a solução é acidificada (pH<7).
Hidrólise por ânion. Este tipo de hidrólise é típico de sais formados por ânions de um ácido fraco (K d 10 -3) e cátions de uma base forte (K d >10 -3). Consideremos a hidrólise do carbonato de potássio - um sal formado por ácido carbônico fracoH 2 CO 3 (K d I = 4,5. 10 -7) e a base forte KOH, o ânion carboxo tem carga (2-). A hidrólise ocorre em duas etapas:
CO 3 2- +H 2 O↔HCO 3 - +OH - Estágio I
HCO 3 - +H 2 O↔H 2 CO 3 +OH - estágio II
Neste caso, são liberados íons OH - ([H + ] [OH - ]) - a solução torna-se alcalina (pH > 7).
Hidrólise irreversível. Os sais formados por uma base fraca e um ácido fraco hidrolisam no cátion e no ânion. O resultado da hidrólise dependerá do valor Para d bases e ácidos. Consideremos a hidrólise do fluoreto de amônio, um sal formado por compostos fracos
base NH 4 OH (K d = 1,8 . 10 -5) e ácido fraco HF (K d = 6,8 . 10 -4):
NH 4 F + HOH NH 4 OH + HF
Neste caso K d ( NH 4 OH) K d ( HF), portanto, a hidrólise (principalmente) ocorrerá ao longo do cátion e a reação do meio será levemente ácida.
Reações de troca entre soluções eletrolíticas
Reações que levam à formação de um precipitado. Despeje 3-4 ml de solução de sulfato de cobre (I) em um tubo de ensaio, a mesma quantidade de solução de cloreto de cálcio no segundo e sulfato de alumínio no terceiro. Adicione um pouco de solução de hidróxido de sódio ao primeiro tubo de ensaio, solução de ortofosfato de sódio ao segundo e solução de nitrato de bário ao terceiro. Os precipitados se formam em todos os tubos de ensaio.
Exercício. Escreva equações de reação na forma molecular, iônica e iônica abreviada. Explique por que a precipitação se formou. Soluções de que outras substâncias podem ser despejadas em tubos de ensaio para causar a formação de precipitação? Escreva equações para essas reações na forma molecular, iônica e iônica abreviada.
Reações que envolvem a liberação de gás. Despeje 3-4 ml de solução de sulfito de sódio em um tubo de ensaio e o mesmo volume de solução de carbonato de sódio no segundo. Adicione a mesma quantidade de ácido sulfúrico a cada um deles. O primeiro tubo de ensaio libera um gás com odor pungente, o segundo tubo de ensaio libera um gás inodoro.
Exercício. Escreva equações para as reações que ocorrem na forma molecular, iônica e iônica abreviada. Pense em quais outros ácidos poderiam ser aplicados a essas soluções para obter resultados semelhantes. Escreva equações para essas reações na forma molecular, iônica e iônica abreviada.
Reações que ocorrem com a formação de uma substância ligeiramente dissociada. Despeje 3-4 ml de solução de hidróxido de sódio em um tubo de ensaio e adicione duas ou três gotas de fenolftaleína. A solução adquire uma cor carmesim. Em seguida, adicione ácido clorídrico ou sulfúrico até que a cor fique descolorida.
Despeje cerca de 10 ml de sulfato de cobre (II) em outro tubo de ensaio e adicione um pouco de solução de hidróxido de sódio. Um precipitado azul de hidróxido de cobre (II) é formado. Despeje ácido sulfúrico no tubo de ensaio até que o precipitado se dissolva.
Exercício. Escreva equações para as reações que ocorrem na forma molecular, iônica e iônica abreviada. Explique por que ocorreu a descoloração no primeiro tubo de ensaio e a dissolução do precipitado no segundo. Quais propriedades comuns as bases solúveis e insolúveis têm?
Reação qualitativa ao íon cloreto. Despeje 1-2 ml de ácido clorídrico diluído em um tubo de ensaio, a mesma quantidade de solução de cloreto de sódio no segundo e solução de cloreto de cálcio no terceiro. Adicione algumas gotas de solução de nitrato de prata (I) AgNO3 a todos os tubos de ensaio. Verifique se o precipitado se dissolve em ácido nítrico concentrado.
Exercício. Escreva as equações para as reações químicas correspondentes na forma molecular, iônica e iônica abreviada. Pense em como você pode distinguir: a) o ácido clorídrico de outros ácidos; b) cloretos de outros sais; c) soluções de cloretos de ácido clorídrico. Por que você também pode usar uma solução de nitrato de chumbo(II) em vez de uma solução de nitrato de prata(I)?
A lição examinará as condições para que as reações de troca iônica sejam concluídas. Para entender melhor quais condições devem ser observadas para que as reações de troca iônica se completem, revisaremos o que são essas reações e sua essência. Exemplos são dados para reforçar esses conceitos.
Tópico: Ligação química. Dissociação eletrolítica
Lição: Condições de Fluxoreações de troca iônica até a conclusão
Se você tentar reagir o hidróxido de sódio com o cloreto de potássio, a reação não ocorrerá. Numa reação, há troca de íons, mas nenhum produto é formado. Vejamos as razões para isso. As substâncias formadas como resultado da atração mútua podem dissociar-se.
1. Reações de troca iônica que levam à formação de um precipitado.
Anteriormente, foram consideradas as equações de reação que resultaram na formação de um precipitado.
Todas essas reações pertenciam a reações de troca iônica. Pode-se concluir que uma das condições para que a reação de troca iônica prossiga até o fim é a formação de um precipitado.
BaCl 2 + Na 2 CO 3 → BaCO 3 ↓ + 2NaCl.
Ba 2+ +2Cl - + 2Na + + CO 3 2- →BaCO 3 ↓ + 2Na + +2Cl - equação iônica completa
Ba 2+ + CO 3 2- → BaCO 3 ↓ equação iônica encurtada.
Vamos escrever outra equação de reação que leva à formação de um precipitado.
CuSO 4 + 2NaOH → Cu(OH) 2 ↓ + Na 2 SO 4
Cu 2+ + SO 4 2- +2Na + + 2OH - → Cu(OH) 2 ↓ + 2Na + + SO 4 2- equação iônica completa
Cu 2+ + 2OH - → Cu(OH) 2 ↓ equação iônica abreviada.
Conclusão: As reações de troca iônica prosseguem até a conclusão se o resultado for um precipitado.
Arroz. 1. Reação de neutralização ()
Considere a reação de neutralização do hidróxido de sódio com ácido clorídrico.
NaOH + HCl → NaCl+ H2O
Na + + OH - + H + + Cl - →Na + + Cl - + H 2 O equação iônica completa
OH - + H + → H 2 O equação iônica reduzida
Esta reação prossegue até o fim, porque o resultado é uma substância ligeiramente dissociada - a água.
Conclusão: As reações de troca iônica terminam se o resultado for uma substância ligeiramente dissociada.
Você sabe que o carbonato de cálcio reage bem com o ácido clorídrico.
CaCO 3 +2HCl → CaCl 2 + H 2 O + CO 2
CaCO 3 +2H + + 2Cl - → Ca 2+ +2Cl - + H 2 O + CO 2 equação iônica completa
2H + + CaCO 3 → Ca 2+ + H 2 O + CO 2 equação iônica abreviada.
Como resultado desta reação, é produzido dióxido de carbono, que se forma durante a decomposição do ácido carbônico fraco. Observe que o carbonato de cálcio é uma substância insolúvel e não se decompõe em íons. Na equação iônica completa, escrevemos apenas cloreto de hidrogênio e cloreto de cálcio como íons. As restantes fórmulas permanecem inalteradas, uma vez que estas substâncias não estão expostas.
Conclusão: As reações de troca iônica prosseguem até a conclusão se resultarem em um gás.
Nesta lição, você examinou as condições para que as reações de troca iônica sejam concluídas. As reações de troca iônica prosseguem até a conclusão se o resultado for um precipitado, substância ou gás ligeiramente dissociado.
1. Rudzite G.E. Química inorgânica e orgânica. 9º ano: livro didático para instituições de ensino geral: nível básico / G. E. Rudzitis, F.G. Feldman. M.: Iluminismo. 2009 119 p.: doente.
2. Popel P.P. Química: 8ª série: livro didático para instituições de ensino geral / P.P. Popel, LS Krivlya. -K.: IC “Academia”, 2008.-240 p.: il.
3. Gabrielyan O.S. Química. 9 º ano. Livro didático. Editora: Abetarda: 2001. 224s.
1. Nº 3,4,5 (p.22) Rudzitis G.E. Química inorgânica e orgânica. 9º ano: livro didático para instituições de ensino geral: nível básico / G. E. Rudzitis, F.G. Feldman. M.: Iluminismo. 2009 119 p.: doente.
2. O que você observa ao fazer massa ao adicionar vinagre ao refrigerante? Escreva a equação da reação.
3. Por que se formam incrustações na chaleira? Como removê-lo? Escreva as equações de reação.
Metas:
- Os alunos deverão adquirir conhecimentos sobre as reações de troca iónica e as condições em que ocorrem.
- continuar a desenvolver as competências de escrita de equações de dissociações de substâncias;
- trabalhar com a tabela de solubilidade;
- desenvolver o pensamento lógico ao reconhecer eletrólitos e não eletrólitos, comparação, observação; desenvolver competências e habilidades práticas, tirar conclusões;
- escrever equações de reação nas formas molecular, iônica completa e iônica reduzida.
Métodos e técnicas metodológicas: trabalho laboratorial verbal-visual, heurístico, frontal em grupo.
Equipamento:
- nas carteiras dos alunos: H 2 SO 4, BaCl 2, Na 2 CO 3, fenolftaleína, NaOH, 4 seringas, comprimido, tabela de solubilidade, tabela para preencher.
- para o professor: H 2 SO 4, BaCl 2, Na 2 CO 3, fenolftaleína, NaOH, 3 tubos de ensaio, em 2 recipientes: refrigerante e sal, água, ácido acético.
Durante as aulas
1. Momento organizacional.
2. Estabelecimento de metas.
Professor. Pessoal, imaginem que na sua cozinha tem sal e refrigerante em 2 potes idênticos e sem rótulo. Como você pode reconhecer essas duas substâncias sem prová-las?
Professor. Para descobrir, precisamos nos familiarizar com as reações de troca iônica, determinar as condições para sua ocorrência e aprender a escrever equações iônicas completas e abreviadas. Para entender melhor o mecanismo das reações de troca iônica, vamos lembrar quais substâncias são chamadas de eletrólitos.
Estudante. Eletrólitos são substâncias que conduzem corrente elétrica em fundidos e soluções.
Professor. Por que os eletrólitos em soluções e fundidos conduzem corrente elétrica?
Estudante. Os eletrólitos conduzem eletricidade porque os íons são formados em soluções e derretem.
Professor. O que é dissociação eletrolítica?
Estudante. O processo de decomposição do eletrólito em íons é chamado de dissociação eletrolítica.
Professor. Vamos escrever as equações de dissociação para várias substâncias. (3 alunos trabalham nas cartas do quadro):
- Cartão nº 1. Escreva equações resumidas de dissociação para substâncias: H 2 SO 4, HCl.
- Mapa nº 2. Escreva as equações gerais de dissociação para as substâncias: Na 2 CO 3, BaCl 2.
- Cartão nº 3. Escreva as equações de dissociação total para substâncias: NaOH, Ba(OH) 2
Professor. Tarefa de aula: selecione eletrólitos e não eletrólitos nesta lista de substâncias.
KCl, CuO, CuSO 4, Cu(OH) 2, BaSO 4, K 2 SO 4. (de uma folha).
Para eletrólitos, escreva equações resumidas de dissociação. (no quadro-negro).
Professor. Vamos verificar as anotações no quadro.
Professor. Pessoal, qual é o nome de quais íons se forma a substância insolúvel BaSO 4?
Estudante. O sulfato de bário é formado a partir de íons de bário e íons sulfato.
Professor. Nomeie as substâncias, usando a tabela de solubilidade, cujas soluções contêm o íon Ba 2+ e SO 4 2- ?
Estudante. Por exemplo, cloreto de bário e ácido sulfúrico.
Professor. Vamos anotar a equação da reação entre H 2 SO 4 e BaCl 2 (aluno no quadro).
BaCl2 + H2SO4 = BaSO4 + 2HCl
Professor. As reações que ocorrem em soluções eletrolíticas são chamadas de reações de troca iônica. Para descobrir em que condições ocorrem as reações de troca iônica, vamos fazer um trabalho de laboratório:
Objetivo: Familiarizar-se com as condições para tais reações. (escrever no caderno)
Experiência nº 1. Obtenção de BaSO 4. (em vez de experiência, você pode usar um fragmento de uma lição da “escola virtual de Cirilo e Metódio”, lição nº 6 do 9º ano)
A professora faz o mesmo no quadro-negro.
A professora comenta: adicione uma solução de H 2 SO 4 à solução de BaCl 2. O que observamos?
Aluno: Caiu um precipitado branco.
Professor: Vamos escrever a equação iônica completa, para isso anotamos quais íons estavam nas soluções das substâncias tomadas e quais substâncias foram formadas.
2H 1+ + SO 4 2- + Ba 2+ +2Cl 1- - > BaSO 4v + 2H 1+ +2Cl 1-
Esta é a equação iônica completa.
Se reduzirmos os lados direito e esquerdo da equação por íons idênticos, obteremos a equação iônica abreviada.
SO 4 2- + Ba 2+ -> BaSO 4v
Discussão:
Perguntas para a aula:
- Quais íons estavam contidos na solução antes da reação?
- Quais íons permaneceram em solução após a reação?
- Qual é a essência dessas reações?
Conversa com a turma: discutimos que a essência da reação é que ocorreu a ligação dos íons Ba 2+ e SO 4 2-.
Esta equação mostra a essência desta reação.
Experiência nº 2. Obtenção de dióxido de carbono.
A professora comenta: adicione uma solução de H 2 SO 4 à solução de Na 2 CO 3. (1 aluno escreve a reação no quadro)
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + H 2 O + CO 2
O que estamos vendo?
Aluno: Liberação de bolhas de gás.
O professor anota a equação iônica completa e a equação iônica abreviada.
2Na 1+ +CO 3 2- +2H 1+ +SO 4 2- - >2Na 1+ + SO 4 2- + H 2 O+ CO 2
CO 3 2- +2H 1+ -> H 2 O+ CO 2
Experiência nº 3. Formação de H 2 O (substância de baixa dissociação).
O professor comenta: adicione 1-2 gotas de ftaleína fenol à solução de NaOH, a solução fica vermelha, adicione H 2 SO 4. (1 aluno escreve a reação no quadro)
2 NaOH + H 2 SO 4 = Na 2 SO 4 + 2 H 2 O
O que estamos vendo?
Estudante. A solução tornou-se incolor.
Professor. Vamos escrever a equação iônica completa e a equação iônica abreviada no quadro (1 aluno).
2Na 1+ +2OH 1- +2H 1+ + SO 4 2- ->2Na 1+ + SO 4 2- + 2H 2 O
2OH 1- +2H 1+ ->2H 2 O
| Condições de reação Entre soluções eletrolíticas (a preencher pelo aluno). |
Exemplos de reações de troca iônica. |
| 1. | Na 2 CO 3 +CaCl 2 =CaCO 3 +2NaCl 2Na + + CO 3 2- +Ca 2+ + 2Cl - = CaCO 3 +2Na + + 2Cl - Ca 2+ + CO 3 2- = CaCO 3 |
| 2. | K 2 CO 3 +2HCl =2KCl+H 2 O+CO 2 2K + + CO 3 2- +2H + +2Cl - =2K + +2Cl - +H 2 O+CO 2 CO 3 2- +2H + = CO 2 ^+H 2 O |
| 3. | NaOH+HNO 3 = NaNO 3 +H 2 O Na + +OH - +H + +NO 3 =Na + +NO 3 - + H 2 O H + + OH - =H 2 O |
Professor: Pessoal, realizamos reações de troca iônica. Concluímos: em que condições as reações de troca iônica chegam ao fim? (preencher as tabelas fornecidas)
Estudante: As reações de troca iônica terminam se, como resultado, um precipitado for formado, um gás for liberado e uma substância pouco dissociada, como a água, for formada.
Professor: Voltemos ao nosso problema. Sugira um método para reconhecer sal (NaCl) e refrigerante (Na 2 CO 3).
Aluno: Você precisa adicionar ácido a essas substâncias. Em qual recipiente será observada a evolução do gás, haverá refrigerante.
Fixando o material:
Tarefa no quadro: 1 Selecione nesta lista as reações que vão até o final (um aluno)
NaOH+ NaCl -> NaCl+ H2O
AgNO3 + NaCl ->NaNO3 + AgCl
CuCl2 +2NaOH ->Cu(OH)2 +2NaCl
KNO 3 +LiCl ->KCl+LiNO 3
Dado:
Equação iônica completa.
Fe 3+ +3Cl - +3Na + +3OH - = Fe(OH) 3 +3Na + +3Cl -
Escreva as equações moleculares e iônicas abreviadas de acordo.
Professor. Vamos resumir nossa lição: Que reações conhecemos na lição?
Estudante. Aprendemos sobre reações de troca iônica.
Professor. Sob quais condições é possível que essas reações se completem?
Estudante. As reações de troca iônica terminam se um precipitado se formar, um gás for liberado e uma substância ligeiramente dissociada for formada.
Professor. Lição de casa: exercício §37. 4, 5.
Literatura.
- Gabrielyan O.S. Química. 8º ano: Abetarda, 1999.
- “Escola Virtual de Cirilo e Metódio” Aulas de Química do 8º ao 9º ano, 2004.
O material proposto apresenta desenvolvimentos metodológicos de trabalhos práticos para o 9º ano: “Resolução de problemas experimentais sobre o tema “Nitrogênio e Fósforo”, “Determinação de fertilizantes minerais”, bem como experimentos laboratoriais sobre o tema “Reações de troca entre soluções eletrolíticas”.
Reações de troca entre soluções eletrolíticas
O desenvolvimento metodológico consiste em três partes: teoria, workshop, controle. A parte teórica fornece alguns exemplos de equações iônicas moleculares, completas e abreviadas de reações químicas que ocorrem com a formação de um precipitado, uma substância ligeiramente dissociada, e a liberação de gás. A parte prática contém tarefas e recomendações para os alunos sobre como realizar experiências laboratoriais. O controle consiste em tarefas de teste com escolha da resposta correta.
Teoria
1. Reações que levam à formação de um precipitado.
a) Quando o sulfato de cobre (II) reage com o hidróxido de sódio, forma-se um precipitado azul de hidróxido de cobre (II).
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4.
Cu 2+ + + 2Na + + 2OH – = Cu(OH) 2 + 2Na + + ,
Cu 2+ + 2OH – = Cu(OH) 2.
b) Quando o cloreto de bário reage com o sulfato de sódio, um precipitado branco leitoso de sulfato de bário precipita.
Equação molecular de uma reação química:
BaCl 2 + Na 2 SO 4 = 2NaCl + BaSO 4.
Equações de reação iônica completas e abreviadas:
Ba 2+ + 2Cl – + 2Na + + = 2Na + + 2Cl – + BaSO 4 ,
Ba 2+ + = BaSO 4 .
2.
Quando o carbonato ou bicarbonato de sódio (bicarbonato de sódio) interage com o ácido clorídrico ou outro ácido solúvel, observa-se ebulição ou liberação intensa de bolhas de gás. Isto libera dióxido de carbono CO 2, causando turvação na solução límpida de água de cal (hidróxido de cálcio). A água com cal fica turva porque... carbonato de cálcio insolúvel é formado.
a) Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2;
b) NaHCO 3 + HCl = NaCl + CO 2 + H 2 O;
Ca(OH)2 + CO2 = CaCO3 + H2O.
a) 2Na + + + 2H + + 2Cl – = 2Na + + 2Cl – + CO 2 + H 2 O,
2H + = CO 2 + H 2 O;
b) Na + + + H + + Cl – = Na + + Cl – + CO 2 + H 2 O,
H + = CO 2 + H 2 O.
3. Reações que ocorrem com a formação de uma substância ligeiramente dissociada.
Quando o hidróxido de sódio ou potássio reage com o ácido clorídrico ou outros ácidos solúveis na presença do indicador fenolftaleína, a solução alcalina torna-se incolor e, como resultado da reação de neutralização, forma-se uma substância H 2 O de baixa dissociação.
Equações moleculares de reações químicas:
a) NaOH + HCl = NaCl + H2O;
c) 3KOH + H 3 PO 4 = K 3 PO 4 + 3H 2 O.
Equações de reação iônica completas e abreviadas:
a) Na + + OH – + H + + Cl – = Na + + Cl – + H 2 O,
OH – + H + = H 2 O;
b) 2Na + + 2OH – + 2H + + = 2Na + + + 2H 2 O,
2OH – + 2H + = 2H 2 O;
c) 3K + + 3OH – +3H + + = 3K + + + 3H 2 O,
3OH – + 3H + = 3H 2 O.
Oficina
1. Reações de troca entre soluções eletrolíticas levando à formação de um precipitado.
a) Realize uma reação entre soluções de sulfato de cobre (II) e hidróxido de sódio. Escreva equações iônicas moleculares, completas e abreviadas de reações químicas, observe os sinais de uma reação química.
b) Realize uma reação entre soluções de cloreto de bário e sulfato de sódio. Escreva equações iônicas moleculares, completas e abreviadas de reações químicas, observe os sinais de uma reação química.
2. Reações que envolvem a liberação de gás.
Realize reações entre soluções de carbonato de sódio ou bicarbonato de sódio (bicarbonato de sódio) com ácido clorídrico ou outro ácido solúvel. Passe o gás liberado (usando um tubo de saída de gás) através de água de cal transparente despejada em outro tubo de ensaio até ficar turvo. Escreva equações iônicas moleculares, completas e abreviadas de reações químicas, observe os sinais dessas reações.
3. Reações que ocorrem com a formação de uma substância ligeiramente dissociada.
Realizar reações de neutralização entre um álcali (NaOH ou KOH) e um ácido (HCl, HNO 3 ou H 2 SO 4), após colocar a fenolftaleína na solução alcalina. Anote as observações e escreva equações iônicas moleculares, completas e abreviadas para reações químicas.
Sinais, acompanhando essas reações, podem ser selecionados na lista a seguir:
1) liberação de bolhas de gás; 2) sedimentação; 3) aparecimento de odor; 4) dissolução do sedimento; 5) liberação de calor; 6) mudança na cor da solução.
Controle (teste)
1. A equação iônica para a reação que produz o precipitado azul é:
a) Cu 2+ + 2OH – = Cu(OH) 2;
c) Fe 3+ + 3OH – = Fe(OH) 3;
d) Al 3+ + 3OH – = Al(OH) 3.
2. A equação iônica para a reação na qual o dióxido de carbono é liberado é:
a) CaCO 3 + CO 2 + H 2 O = Ca 2+ +;
b) 2H + + SO 2-3 = H 2 O + SO 2;
c) CO 2-3 + 2H + = CO 2 + H 2 O;
d) 2H + + 2OH – = 2H 2 O.
3. A equação iônica para a reação na qual uma substância de baixa dissociação é formada é:
a) Ag + + Cl – = AgCl;
b) OH – + H + = H 2 O;
c) Zn + 2H + = Zn 2+ + H 2;
d) Fe 3+ + 3OH – = Fe(OH) 3.
4. A equação iônica para a reação que produz o precipitado branco é:
a) Cu 2+ + 2OH – = Cu(OH) 2;
b) CuO + 2H + = Cu 2+ + H 2 O;
c) Fe 3+ + 3OH – = Fe(OH) 3;
d) Ba 2+ + SO 2- 4 = BaSO 4 .
5. A equação molecular que corresponde à equação iônica abreviada para a reação 3OH – + 3H + = 3H 2 O é:
a) NaOH + HCl = NaCl + H2O;
b) 2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O;
c) 3KOH + H 3 PO 4 = K 3 PO 4 + 3H 2 O;
d) Ba(OH)2 + 2HCl = BaCl2 + H2O.
6. Equação molecular que corresponde à equação abreviada da reação iônica
H + + = H 2 O + CO 2 , –
a) MgCO 3 + 2HCl = MgCl 2 + CO 2 + H 2 O;
b) Na 2 CO 3 + 2HCl = 2NaCl + CO 2 + H 2 O;
c) NaHCO 3 + HCl = NaCl + CO 2 + H 2 O;
d) Ca(OH)2 + CO2 = CaCO3 + H2O.
| Respostas. 1 -A; 2 -V; 3 -b; 4 -G; 5 -V; 6 -V. |
Resolvendo problemas experimentais sobre o tema “Nitrogênio e Fósforo”
Ao estudar novos materiais sobre o tema “Nitrogênio e Fósforo”, os alunos realizam uma série de experimentos relacionados à produção de amônia, determinação de nitratos, fosfatos e sais de amônio, e adquirem certas competências e habilidades. Este desenvolvimento metodológico contém seis tarefas. Para realizar o trabalho prático, bastam três tarefas: uma sobre a obtenção de uma substância, duas sobre o reconhecimento de substâncias. Na realização de trabalhos práticos, podem ser oferecidas aos alunos tarefas de forma que lhes facilite a preparação de um relatório (ver tarefas 1, 2). (As respostas são dadas ao professor.)
Exercício 1
Obtenha amônia e prove experimentalmente sua presença.
a) Produção de amônia.
Aqueça uma mistura de porções de volumes iguais de cloreto de amônio sólido e pó de hidróxido de cálcio em um tubo de ensaio com tubo de saída de gás. Neste caso será liberada amônia, que deverá ser coletada em outro tubo de ensaio seco localizado com furo ............ ( Por que?).
Escreva a equação da reação para a produção de amônia.
…………………………………………………..
b) Determinação de amônia.
Pode ser identificado pelo cheiro………… (nome da substância), bem como por alterações na cor do tornassol ou da fenolftaleína. Quando a amônia é dissolvida em água, forma-se ....... (nome da base), então o teste decisivo...... (especifique a cor), e a fenolftaleína incolor torna-se …………. (especifique a cor).
Em vez de pontos, insira palavras de acordo com seu significado. Escreva a equação da reação.
…………………………………………………..


* Amônia, uma solução aquosa de amônia, tem cheiro de amônia. – Observação Ed.
Tarefa 2
Prepare o nitrato de cobre de duas maneiras diferentes, tendo à disposição as seguintes substâncias: ácido nítrico concentrado, limalha de cobre, sulfato de cobre(II), hidróxido de sódio. Escreva equações para reações químicas na forma molecular e observe as mudanças. No método 1, para uma reação redox, escreva equações de equilíbrio de elétrons, determine o agente oxidante e o agente redutor. No método 2, escreva equações de reação iônica abreviadas.
1º s p o s o b. Cobre + ácido nítrico. Aqueça levemente o conteúdo do tubo de ensaio. A solução incolor torna-se….. (especifique a cor), porque é formado….. (nome da substância); gás é liberado……..colorido com um odor desagradável, isto é……. (nome da substância).
2º s p o s o b. Quando o sulfato de cobre(II) reage com o hidróxido de sódio, obtém-se um precipitado de ..... cor, isto é ...... (nome da substância). Adicione ácido nítrico até que o precipitado esteja completamente dissolvido......... (nome do sedimento). Uma solução azul clara é formada...... (nome do sal).


Tarefa 3
Prove experimentalmente que o sulfato de amônio contém íons NH 4 + e SO 2-4. Anote as observações e escreva equações moleculares e iônicas abreviadas para as reações.


Tarefa 4
Como determinar experimentalmente a presença de soluções de ortofosfato de sódio, cloreto de sódio, nitrato de sódio nos tubos de ensaio nº 1, nº 2, nº 3? Anote as observações e escreva equações moleculares e iônicas abreviadas para as reações.

Tarefa 5
Possuindo as seguintes substâncias: ácido nítrico, aparas ou fios de cobre, papel indicador universal ou laranja de metila, comprovam experimentalmente a composição do ácido nítrico. Escreva a equação para a dissociação do ácido nítrico; equação molecular para reação do cobre com ácido nítrico concentrado e equações de equilíbrio eletrônico, identificar o agente oxidante e o agente redutor.

Tarefa 6
Prepare uma solução de nitrato de cobre de diferentes formas, tendo como substâncias: ácido nítrico, óxido de cobre, carbonato de cobre básico ou carbonato de hidroxicocobre(II). Escreva equações iônicas moleculares, completas e abreviadas para reações químicas. Observe sinais de reações químicas.


Testes de referência
1. Dê a equação da reação onde se forma um precipitado amarelo.

2. A equação iônica da reação na qual o precipitado de queijo branco é formado é:

3. Para comprovar a presença de íon nitrato em nitratos, você precisa tomar:
a) ácido clorídrico e zinco;
b) ácido sulfúrico e cloreto de sódio;
c) ácido sulfúrico e cobre.
4. O reagente para íon cloreto é:
a) cobre e ácido sulfúrico;
b) nitrato de prata;
c) cloreto de bário.
5. Na equação de reação, cujo diagrama
HNO 3 + Cu -> Cu(NO 3) 2 + NO 2 + H 2 O,
Antes do agente oxidante você precisa colocar o coeficiente:
a) 2; b) 4; às 6.
6. Os sais básicos e ácidos correspondem aos pares:
a) Cu(OH)2, Mg(HCO3)2;
b) Cu(NO 3) 2, HNO 3;
c) 2 CO 3, Ca(HCO 3) 2.
|
Respostas. 1 -A; 2 -b; 3 -V; 4 -b; 5 -b; 6 -V. |
Determinação de fertilizantes minerais
O desenvolvimento metodológico deste trabalho prático consiste em três partes: teoria, workshop, controle. A parte teórica fornece informações gerais sobre a determinação qualitativa de cátions e ânions incluídos em fertilizantes minerais. O workshop fornece exemplos de sete fertilizantes minerais com uma descrição de suas características e também fornece equações para reações qualitativas. No texto, em vez de pontos e pontos de interrogação, você precisa inserir respostas com significado adequado. Para realizar o trabalho prático a critério do professor, basta levar quatro fertilizantes. A verificação dos conhecimentos dos alunos consiste em tarefas de teste para determinação de fórmulas de fertilizantes, que são apresentadas neste trabalho prático.
Teoria
1. O reagente para o íon cloreto é o nitrato de prata. A reação prossegue com a formação de um precipitado de queijo branco:
Ag + + Cl – = AgCl.
2. O íon amônio pode ser detectado usando álcali. Quando uma solução de sal de amônio é aquecida com uma solução alcalina, é liberada amônia, que possui um odor forte e característico:
NH + 4 + OH – = NH 3 + H 2 O.
Você também pode usar papel tornassol vermelho umedecido com água, um indicador universal ou uma tira de papel de fenolftaleína para determinar o íon amônio. O pedaço de papel deve ser colocado sobre os vapores liberados do tubo de ensaio. O tornassol vermelho fica azul, o indicador universal fica roxo e a fenolftaleína fica carmesim.
3. Para determinar os íons nitrato, lascas ou pedaços de cobre são adicionados à solução salina e, em seguida, ácido sulfúrico concentrado é adicionado e aquecido. Depois de algum tempo, um gás marrom com odor desagradável começa a ser liberado. A liberação de gás NO2 marrom indica a presença de íons.
Por exemplo:
NaNO 3 + H 2 SO 4 NaHSO 4 + HNO 3,
4HNO 3 + Cu = Cu(NO 3) 2 + 2NO 2 + 2H 2 O.
4. O reagente para o íon fosfato é o nitrato de prata. Quando é adicionado a uma solução de fosfato, um precipitado amarelo de fosfato de prata precipita:
3Ag + + PO 3- 4 = Ag 3 PO 4.
5. O reagente para o íon sulfato é o cloreto de bário. Um precipitado branco leitoso de sulfato de bário, insolúvel em ácido acético, precipita:
Ba 2+ + SO 2- 4 = BaSO 4 .
Oficina
1. Silvinita (NaCl KCl), cristais rosa, boa solubilidade em água. A chama fica amarela. Ao visualizar a chama através do vidro azul, uma cor violeta é perceptível. COM …….. (nome do reagente) dá um precipitado branco...... (nome do sal).
KCl + ? -> KNO3 + AgCl.
2. Nitrato de amônio NH 4 NO 3, ou …… .. (nome do fertilizante), cristais brancos, altamente solúveis em água. O gás marrom é liberado com ácido sulfúrico e cobre... (nome da substância). Com solução……. (nome do reagente) Quando aquecido, sente-se o cheiro de amônia, seu vapor transforma o tornassol vermelho em....... cor.
NH 4 NO 3 + H 2 SO 4 NH 4 HSO 4 + HNO 3,
HNO 3 + Cu -> Cu(NO 3) 2 + ? + ? .
NH 4 NÃO 3 + ? -> NH 3 + H 2 O + NaNO 3.
3. Nitrato de potássio (KNO 3), ou… (nome do fertilizante), com H 2 SO 4 e ……… (nome da substância) produz gás marrom. A chama fica roxa.
KNO 3 + H 2 SO 4 KHSO 4 + HNO 3,
4HNO3+? -> Cu(NÃO 3) 2 + ? +2H2O.
4. Cloreto de amônio NH 4 Cl com solução……. (nome do reagente) Quando aquecido, forma amônia, seus vapores tornam-se vermelhos e azuis. COM …… (nome do ânion reagente) a prata dá um precipitado branco e queijo.... (nome do sedimento).
NH4Cl+? = NH 4 NO 3 + AgCl,
NH4Cl+? = NH3 + H2O + NaCl.
5. Quando aquecido, o sulfato de amônio (NH 4) 2 SO 4 com uma solução alcalina forma amônia, seu vapor torna-se azul tornassol vermelho. COM …….. (nome do reagente) dá um sedimento leitoso branco......... (nome do sedimento).
(NH 4) 2 SO 4 + 2NaOH = 2NH 3 + 2H 2 O + ? ,
(NH 4) 2 SO 4 + ? ->NH4Cl+ ? .
6. Nitrato de sódio NaNO 3, ou… (nome do fertilizante), cristais brancos, boa solubilidade em água, produz um gás marrom com H 2 SO 4 e Cu. A chama fica amarela.
NaNO 3 + H 2 SO 4 NaHSO 4 + ? ,
Cu -> Cu(NÃO 3) 2 + ? +2H2O.
7. Dihidrogenofosfato de cálcio Ca(H 2 PO 4) 2, ou… (nome do fertilizante), pó ou grânulos cinza de grão fino, pouco solúvel em água, com ..... (nome do reagente) dá….. (especifique a cor) precipitado ……… (nome da substância) AgH 2 PO 4.
Ca(H 2 PO 4) 2 + ? -> 2AgH 2 PO 4 + Ca(NO 3) 2.

Controle (teste)
1. Cristais rosa, altamente solúveis em água, colorem a chama de amarelo; ao interagir com AgNO 3, forma-se um precipitado branco - isto é:
a) Ca(H 2 PO 4) 2; b) NaCl KCl;
c) KNO 3; d)NH4Cl.
2. Os cristais são altamente solúveis em água; em reação com H 2 SO 4 e cobre, um gás marrom é liberado; com uma solução alcalina, quando aquecido, produz amônia, cujos vapores ficam vermelhos com tornassol azul - isto é:
a) NaNO3; b) (NH 4) 2 SO 4;
c) NH4NO3; d) KNO 3.
3. Cristais leves, altamente solúveis em água; após interação com H 2 SO 4 e Cu, um gás marrom é liberado; a chama fica roxa - isto é:
a) KNO 3; b) NH4H2PO4;
c) Ca(H 2 PO 4) 2 CaSO 4; d) NH 4 NO 3.
4. Os cristais são altamente solúveis em água; com nitrato de prata dá um precipitado branco, com álcali quando aquecido dá amônia, cujos vapores ficam vermelho azul tornassol - isto é:
a) (NH 4) 2 SO 4; b) NH4H2PO4;
c) NaCl KCl; d)NH4Cl.
5. Cristais leves, altamente solúveis em água; com BaCl 2 dá um precipitado branco leitoso, com álcali dá amônia, cujos vapores ficam vermelho azul tornassol - isto é:
c) NH4Cl; d) NH 4 H 2 PO 4.
6. Cristais leves, altamente solúveis em água; ao interagir com H 2 SO 4 e Cu, produz um gás marrom, a chama fica amarela - isto é:
a) NH 4 NO 3; b) (NH 4) 2 SO 4;
c) KNO 3; d)NaNO3.
7. Pó ou grânulos cinzentos de grão fino, a solubilidade em água é fraca, com uma solução de nitrato de prata dá um precipitado amarelo - isto é:
a) (NH 4) 2 SO 4; b) NaCl KCl;
c) Ca(H 2 PO 4) 2; d) KNO 3.
| Respostas. 1 -b; 2 -V; 3 -A; 4 -G; 5 -b; 6 -G; 7 -V. |