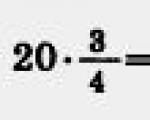Πίνακας ισοθερμικών διεργασιών. Νόμοι των ιδανικών αερίων
Οι κύριες διαδικασίες στη θερμοδυναμική είναι:
- ισοχωρικός, που ρέει σε σταθερό όγκο.
- ισοβαρήςπου ρέει σε σταθερή πίεση.
- ισόθερμος, που εμφανίζεται σε σταθερή θερμοκρασία.
- αδιαβατικός, στην οποία δεν υπάρχει ανταλλαγή θερμότητας με το περιβάλλον.
- πολυτροπικό, ικανοποιώντας την εξίσωση pvn= συνθ.
Οι ισοχωρικές, ισοβαρικές, ισόθερμες και αδιαβατικές διεργασίες είναι ειδικές περιπτώσεις μιας πολυτροπικής διεργασίας.
Στη μελέτη των θερμοδυναμικών διεργασιών προσδιορίστε:
- εξίσωση διαδικασίας σε Π— v Και Τ— μικρόσυντεταγμένες;
- σχέση μεταξύ των παραμέτρων κατάστασης αερίου.
- αλλαγή στην εσωτερική ενέργεια.
- το ποσό της εξωτερικής εργασίας·
- την ποσότητα θερμότητας που παρέχεται στη διαδικασία ή την ποσότητα θερμότητας που αφαιρέθηκε.
Ισοχωρική διαδικασία


Ισοχωρική διαδικασία σεΠ, v— , Τ, μικρό- ΚαιΕγώ, μικρό-συντεταγμένες (διαγράμματα)
Σε μια ισοχορική διαδικασία, η κατάσταση v= συνθ.
Από την εξίσωση ιδανικού αερίου κατάστασης ( pv = RT) ακολουθεί:
p/T = R/V= const,
Δηλαδή, η πίεση του αερίου είναι ευθέως ανάλογη με την απόλυτη θερμοκρασία του:
p2/p1 = T2 /T1.
Το έργο διαστολής σε μια ισοχορική διαδικασία είναι μηδέν ( μεγάλο= 0), αφού ο όγκος του ρευστού εργασίας δεν αλλάζει (Δ v= const).
Η ποσότητα θερμότητας που παρέχεται στο ρευστό εργασίας στη διαδικασία 1-2 στο βιογραφικό
q= βιογραφικό(Τ 2 — Τ 1 ).
Τ. να. μεγάλο= 0, τότε με βάση τον πρώτο θερμοδυναμικό νόμο Δ u = q, που σημαίνει ότι η αλλαγή στην εσωτερική ενέργεια μπορεί να προσδιοριστεί από τον τύπο:
Δ u = c v (T 2 - T 1).
Η μεταβολή της εντροπίας σε μια ισοχωρική διεργασία καθορίζεται από τον τύπο:
s2–s1= Δ μικρό = βιογραφικό ln( p2/p1) = βιογραφικό ln( T2 /T1).
ισοβαρική διαδικασία



ισοβαρική διαδικασία σεΠ, v— , Τ, μικρό- ΚαιΕγώ, μικρό-συντεταγμένες (διαγράμματα)
Ισόβαρη διαδικασία είναι αυτή που λαμβάνει χώρα σε σταθερή πίεση. Π= συνθ. Από την εξίσωση κατάστασης για ένα ιδανικό αέριο προκύπτει:
v/T = R/p= συνθ
v2/v1 = T 2 /T 1 ,
Δηλαδή, σε μια ισοβαρή διεργασία, ο όγκος ενός αερίου είναι ανάλογος της απόλυτης θερμοκρασίας του.
Η εργασία θα είναι:
μεγάλο = Π(v 2 – v 1 ).
Τ. να. pv 1 = RT 1 Και pv 2 = RT 2 , Οτι
μεγάλο = R(Τ2-Τ1).
Η ποσότητα θερμότητας σε cp= το const προσδιορίζεται από τον τύπο:
q = cp(Τ2-Τ1).
Η μεταβολή της εντροπίας θα είναι:
s2–s1= Δ μικρό = cp ln( T2 /T1).
Ισοθερμική διαδικασία



Ισοθερμική διαδικασία σεΠ, v— , Τ, μικρό- ΚαιΕγώ, μικρό-συντεταγμένες (διαγράμματα)
Σε μια ισοθερμική διαδικασία, η θερμοκρασία του ρευστού εργασίας παραμένει σταθερή Τ= const, άρα:
pv = RT= συνθ
p2/p1 = v1/v2,
Δηλαδή, η πίεση και ο όγκος είναι αντιστρόφως ανάλογα μεταξύ τους, έτσι ώστε κατά την ισοθερμική συμπίεση η πίεση του αερίου αυξάνεται και κατά τη διαστολή μειώνεται.
Το έργο της διαδικασίας θα είναι ίσο με:
μεγάλο = RT ln ( v2 – v1) = RT ln ( p1 – p2).
Εφόσον η θερμοκρασία παραμένει αμετάβλητη, η εσωτερική ενέργεια ενός ιδανικού αερίου σε μια ισοθερμική διεργασία παραμένει σταθερή (Δ u= 0) και όλη η θερμότητα που παρέχεται στο ρευστό εργασίας μετατρέπεται πλήρως σε έργο διαστολής:
q = μεγάλο.
Κατά τη διάρκεια της ισοθερμικής συμπίεσης, η θερμότητα αφαιρείται από το ρευστό εργασίας σε ποσότητα ίση με το έργο που δαπανάται για τη συμπίεση.
Η μεταβολή της εντροπίας είναι:
s2–s1= Δ μικρό = R ln( p1/p2) = R ln( v2/v1).
αδιαβατική διαδικασία



αδιαβατική διαδικασία σεΠ, v— , Τ, μικρό- ΚαιΕγώ, μικρό-συντεταγμένες (διαγράμματα)
Μια αδιαβατική διαδικασία είναι μια αλλαγή στην κατάσταση ενός αερίου που συμβαίνει χωρίς ανταλλαγή θερμότητας με το περιβάλλον. Από το δ q= 0, τότε η εξίσωση του πρώτου νόμου της θερμοδυναμικής για μια αδιαβατική διεργασία θα έχει τη μορφή:
ρε u + Πρε v = 0
Δ u+ μεγάλο = 0,
ως εκ τούτου
Δ u= —μεγάλο.
Στην αδιαβατική διαδικασία, το έργο της διαστολής εκτελείται μόνο λόγω της δαπάνης της εσωτερικής ενέργειας του αερίου και κατά τη συμπίεση, η οποία συμβαίνει λόγω της δράσης εξωτερικών δυνάμεων, όλη η εργασία που γίνεται από αυτές πηγαίνει στην αύξηση της εσωτερικής ενέργειας του αερίου.
Ας υποδηλώσουμε τη θερμοχωρητικότητα στην αδιαβατική διεργασία μέσω ντοκόλαση, και κατάσταση δ q= 0 εκφράζεται ως εξής:
ρε q = ντοκόλαση δ Τ = 0.
Αυτή η συνθήκη λέει ότι η θερμοχωρητικότητα στην αδιαβατική διαδικασία είναι μηδέν ( ντοκόλαση = 0).
Είναι γνωστό ότι
ΜεΠ/βιογραφικό= κ
και η εξίσωση της καμπύλης αδιαβατικής διεργασίας (αδιαβατική) σε Π, v- το διάγραμμα μοιάζει με:
p.v.k= συνθ.
Σε αυτή την έκφραση κλέγεται αδιαβατικός εκθέτης(ονομάζεται επίσης αναλογία Poisson).
Τιμές του αδιαβατικού εκθέτηκγια ορισμένα αέρια:
καέρας = 1,4
κυπέρθερμος ατμός = 1,3
κ ICE εξάτμιση = 1,33
κκορεσμένος υγρός ατμός = 1,135
Από τους προηγούμενους τύπους προκύπτει:
μεγάλο= — Δ u = βιογραφικό(Τ 1 – Τ 2 );
Εγώ 1 – Εγώ 2 = cp(Τ 1 – Τ 2 ).
Η τεχνική εργασία της αδιαβατικής διαδικασίας ( μεγάλο tech) ισούται με τη διαφορά μεταξύ των ενθαλπιών της αρχής και του τέλους της διαδικασίας ( Εγώ 1 – Εγώ 2 ).
Μια αδιαβατική διεργασία που συμβαίνει χωρίς εσωτερική τριβή στο ρευστό εργασίας ονομάζεται ισεντροπικό. ΣΕ Τ, μικρόστο διάγραμμα, αντιπροσωπεύεται από μια κάθετη γραμμή.
Συνήθως, οι πραγματικές αδιαβατικές διεργασίες προχωρούν παρουσία εσωτερικής τριβής στο ρευστό εργασίας, ως αποτέλεσμα της οποίας απελευθερώνεται πάντα θερμότητα, η οποία μεταδίδεται στο ίδιο το ρευστό εργασίας. Στην περίπτωση αυτή δ μικρό> 0 και καλείται η διαδικασία πραγματική αδιαβατική διαδικασία.
Πολυτροπική διαδικασία
Μια διαδικασία ονομάζεται πολυτροπική, η οποία περιγράφεται από την εξίσωση:
pvn= συνθ.
Πολυτροπικός δείκτης nμπορεί να πάρει οποιαδήποτε τιμή από -∞ έως +∞, αλλά για αυτή τη διαδικασία είναι μια σταθερή τιμή.
Από την εξίσωση της πολυτροπικής διεργασίας και την εξίσωση Claiperon, μπορεί κανείς να λάβει μια έκφραση που δημιουργεί μια σχέση μεταξύ Π, vΚαι Τσε οποιαδήποτε δύο σημεία του πολύτροπου:
p2/p1 = (v1/v2)n; T2 /T1 = (v1/v2) n-1; T2 /T1 = (p2/p1) (n-1)/n .
Το έργο της διαστολής αερίου σε μια πολυτροπική διεργασία είναι:

Στην περίπτωση ενός ιδανικού αερίου, αυτός ο τύπος μπορεί να μετασχηματιστεί:

Η ποσότητα θερμότητας που παρέχεται ή αφαιρείται στη διαδικασία προσδιορίζεται χρησιμοποιώντας τον πρώτο θερμοδυναμικό νόμο:
q = (u 2 – u 1) + μεγάλο.
Επειδή η

είναι η θερμοχωρητικότητα ενός ιδανικού αερίου σε μια πολυτροπική διεργασία.
Στο βιογραφικό, κΚαι n= συνθ c n= const, επομένως μια πολυτροπική διεργασία ορίζεται μερικές φορές ως μια διαδικασία με σταθερή θερμοχωρητικότητα.
Η πολυτροπική διεργασία έχει γενικευμένη σημασία, επειδή καλύπτει ολόκληρο το σύνολο των βασικών θερμοδυναμικών διεργασιών.
Γραφική αναπαράσταση ενός πολύτροπου σε Π, vσυντεταγμένες ανάλογα με τον δείκτη πολυτροπίας n.

pv 0= const ( n= 0) είναι το ισόβαρο.
pv= const ( n= 1) είναι η ισόθερμη.
p 0 v= const, p 1/∞ v= const, pv∞= const - ισόχωρη;
p.v.k= const ( n = κ) είναι ένα adiabat.
n > 0 – υπερβολικές καμπύλες,
n < 0 είναι παραβολές.
Με βάση τα υλικά των σημειώσεων της διάλεξής μου για τη θερμοδυναμική και το σχολικό βιβλίο «Βασικές αρχές της ενέργειας». Συγγραφέας G. F. Bystritsky. 2η έκδ., αναθ. και επιπλέον - Μ.: KNORUS, 2011. - 352 σελ.
Τι είναι μια ισοβαρική διαδικασία
Ορισμός
Μια ισοβαρική (ή ισοβαρική) διεργασία είναι μια διαδικασία που συμβαίνει σε μια σταθερή μάζα αερίου σε σταθερή πίεση.
Ας γράψουμε την εξίσωση για δύο καταστάσεις ενός ιδανικού αερίου:
\ \
Διαιρούμε την εξίσωση (2) με την εξίσωση (1), παίρνουμε την εξίσωση της ισοβαρικής διαδικασίας:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \αριστερά(4\δεξιά).\]
Η εξίσωση (4) ονομάζεται νόμος Gay-Lussac.
Εσωτερική ενέργεια και ποσότητα θερμότητας της ισοβαρικής διεργασίας
Αυτή η διαδικασία λαμβάνει χώρα με την εισαγωγή θερμότητας εάν η ένταση αυξάνεται ή με την αφαίρεση θερμότητας για τη μείωση της έντασης. Ας γράψουμε τον πρώτο νόμο της θερμοδυναμικής, θα λάβουμε διαδοχικά εκφράσεις για το έργο, την εσωτερική ενέργεια και την ποσότητα θερμότητας της ισοβαρικής διαδικασίας:
\[\δέλτα Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \αριστερά(5\δεξιά).\] \[\τρίγωνο Q=\int\limits^(T_2)_ (T_1)(dU)+\int\limits^(V_2)_(V_1)(dA)(6)\]
όπου $\δέλτα Q\ $ είναι η στοιχειώδης θερμότητα που παρέχεται στο σύστημα, $dU$ είναι η μεταβολή της εσωτερικής ενέργειας του αερίου στη συνεχιζόμενη διαδικασία, $dA$ είναι η στοιχειώδης εργασία που γίνεται από το αέριο στη διαδικασία, i είναι ο αριθμός των βαθμών ελευθερίας του μορίου αερίου, R είναι η καθολική σταθερά αερίου, d είναι ο αριθμός γραμμομορίων αερίου.
Μεταβολή της εσωτερικής ενέργειας του αερίου:
\[\τρίγωνο U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
Η εξίσωση (8) ορίζει το έργο για μια ισοβαρή διεργασία. Αφαιρούμε την εξίσωση (1) από το (2), παίρνουμε μια ακόμη εξίσωση για τη λειτουργία αερίου σε μια ισοβαρή διεργασία:
\ \[\τρίγωνο Q=\frac(i)(2)нR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \τρίγωνο T\ ( 10),\]
όπου $c_(\mu p)$ είναι η μοριακή θερμοχωρητικότητα του αερίου σε μια ισοβαρή διεργασία. Η εξίσωση (10) προσδιορίζει την ποσότητα θερμότητας που μεταδίδεται σε ένα αέριο μάζας m σε μια ισοβαρή διεργασία με αύξηση της θερμοκρασίας κατά $\τρίγωνο T.$
Οι ισοδιεργασίες συχνά απεικονίζονται σε θερμοδυναμικά διαγράμματα. Έτσι, μια γραμμή που απεικονίζει μια ισοβαρή διαδικασία σε ένα τέτοιο διάγραμμα ονομάζεται ισοβαρή (Εικ. 1).
Παράδειγμα 1
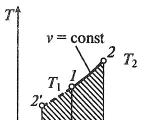
Εργασία: Προσδιορίστε πώς σχετίζονται οι πιέσεις $p_1$ και $p_2$ στο διάγραμμα V(T) στο σχήμα 1γ.
Σχεδιάστε την ισόθερμη $T_1$

Στα σημεία Α και Β, οι θερμοκρασίες είναι ίδιες, επομένως, το αέριο υπακούει στο νόμο Boyle-Mariotte:
\ \
Ας μετατρέψουμε αυτούς τους τόμους σε SI: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
Ας κάνουμε τους υπολογισμούς:
Απάντηση: Το έργο ενός αερίου σε μια ισοβαρή διεργασία είναι 600 J.
Παράδειγμα 3
Εργασία: Συγκρίνετε το έργο αερίου στη διαδικασία ABC και το έργο αερίου στη διαδικασία CDA Εικ. 3.

Ως βάση για τη λύση, παίρνουμε τον τύπο που καθορίζει το έργο του αερίου:
Από τη γεωμετρική σημασία του ορισμένου ολοκληρώματος, είναι γνωστό ότι το έργο είναι το εμβαδόν του σχήματος, το οποίο περιορίζεται από τη συνάρτηση του ολοκλήρωσης, τον άξονα της τετμημένης και τις ισοχόριες στα σημεία $V_1\ και\ V_2$ (άξονας p(V)). Μεταφράζουμε τα γραφήματα διεργασίας στους άξονες p(V).
Εξετάστε κάθε τμήμα των γραφημάτων των διεργασιών που φαίνονται στο σχήμα (3).
AB: Ισοχωρική διαδικασία (p=const), $V\uparrow \left(\ Volume\ grows\right),\ T\uparrow $;
VS: Ισοχωρική διεργασία (V =const), $T\uparrow $ (από το γράφημα), p$\uparrow $, από το νόμο για την ισοχορική διεργασία ($\frac(p)(T)=const$);
CD: (p=const), $V\downarrow ,\ T\downarrow ;$
DA: (V =const), $T\downarrow ,\ p\downarrow .$
Ας απεικονίσουμε τα γραφήματα των διεργασιών στους άξονες p(V) (Εικ. 4):

Εργασία αερίου $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- εμβαδόν ορθογωνίου ABFE) (Εικ. 3). Εργαστείτε στο αέριο $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -εμβαδόν\ ορθογωνίου\ $EFCD. Προφανώς $A_(CDA)>A_(ABC).$
, μια θερμοδυναμική διαδικασία είναι μια αλλαγή στην κατάσταση ενός συστήματος, με αποτέλεσμα τουλάχιστον μία από τις παραμέτρους του (θερμοκρασία, όγκος ή πίεση) να αλλάξει την τιμή του. Ωστόσο, αν λάβουμε υπόψη ότι όλες οι παράμετροι ενός θερμοδυναμικού συστήματος είναι άρρηκτα συνδεδεμένες, τότε μια αλλαγή σε οποιαδήποτε από αυτές συνεπάγεται αναπόφευκτα αλλαγή σε τουλάχιστον μία (ιδανικά) ή περισσότερες (στην πραγματικότητα) παραμέτρους. Στη γενική περίπτωση, μπορούμε να πούμε ότι η θερμοδυναμική διαδικασία σχετίζεται με παραβίαση της ισορροπίας του συστήματος και εάν το σύστημα βρίσκεται σε κατάσταση ισορροπίας, τότε δεν μπορούν να συμβούν θερμοδυναμικές διεργασίες σε αυτό.
Η κατάσταση ισορροπίας ενός συστήματος είναι μια αφηρημένη έννοια, καθώς είναι αδύνατο να απομονωθεί οτιδήποτε υλικό από τον περιβάλλοντα κόσμο, επομένως διάφορες θερμοδυναμικές διεργασίες συμβαίνουν αναπόφευκτα σε οποιοδήποτε πραγματικό σύστημα. Ταυτόχρονα, σε ορισμένα συστήματα μπορεί να συμβούν τόσο αργές, σχεδόν ανεπαίσθητες αλλαγές που οι διαδικασίες που σχετίζονται με αυτές μπορούν υπό όρους να θεωρηθούν ότι αποτελούνται από μια ακολουθία καταστάσεων ισορροπίας του συστήματος. Τέτοιες διαδικασίες ονομάζονται ισορροπία ή οιονεί στατικό.
Ένα άλλο πιθανό σενάριο διαδοχικών αλλαγών στο σύστημα, μετά από τις οποίες επιστρέφει στην αρχική του κατάσταση, ονομάζεται κυκλική διαδικασίαή ένας κύκλος. Οι έννοιες μιας ισορροπίας και μιας κυκλικής διαδικασίας αποτελούν τη βάση πολλών θεωρητικών συμπερασμάτων και εφαρμοσμένων μεθόδων θερμοδυναμικής.
Η μελέτη μιας θερμοδυναμικής διεργασίας συνίσταται στον προσδιορισμό του έργου που γίνεται σε αυτή τη διαδικασία, της αλλαγής της εσωτερικής ενέργειας, της ποσότητας θερμότητας, καθώς και στον καθορισμό μιας σχέσης μεταξύ μεμονωμένων ποσοτήτων που χαρακτηρίζουν την κατάσταση ενός αερίου.
Από όλες τις πιθανές θερμοδυναμικές διεργασίες, το μεγαλύτερο ενδιαφέρον παρουσιάζουν οι ισοχωρικές, ισοβαρικές, ισόθερμες, αδιαβατικές και πολυτροπικές διεργασίες.
Ισοχωρική διαδικασία
Μια ισοχωρική διεργασία είναι μια θερμοδυναμική διαδικασία που συμβαίνει σε σταθερό όγκο. Μια τέτοια διαδικασία μπορεί να πραγματοποιηθεί με θέρμανση ενός αερίου που τοποθετείται σε ένα κλειστό δοχείο. Το αέριο θερμαίνεται ως αποτέλεσμα της παροχής θερμότητας και η πίεσή του αυξάνεται.
Η αλλαγή στις παραμέτρους του αερίου σε μια ισοχορική διαδικασία περιγράφει τον νόμο του Charles: p 1 /T 1 \u003d p 2 /T 2, ή στη γενική περίπτωση:
p/T = const .
Η πίεση ενός αερίου στα τοιχώματα ενός δοχείου είναι ευθέως ανάλογη με την απόλυτη θερμοκρασία του αερίου.
Εφόσον σε μια ισοχορική διεργασία η μεταβολή του όγκου dV είναι ίση με μηδέν, μπορούμε να συμπεράνουμε ότι όλη η θερμότητα που παρέχεται στο αέριο δαπανάται για την αλλαγή της εσωτερικής ενέργειας του αερίου (δεν γίνεται δουλειά).
ισοβαρική διαδικασία
Μια ισοβαρική διεργασία είναι μια θερμοδυναμική διαδικασία που συμβαίνει σε σταθερή πίεση. Μια τέτοια διαδικασία μπορεί να πραγματοποιηθεί τοποθετώντας το αέριο σε έναν πυκνό κύλινδρο με ένα κινητό έμβολο, στον οποίο επενεργεί μια σταθερή εξωτερική δύναμη κατά την αφαίρεση και την παροχή θερμότητας.
Όταν η θερμοκρασία του αερίου αλλάζει, το έμβολο κινείται προς τη μία ή την άλλη κατεύθυνση. ενώ ο όγκος του αερίου αλλάζει σύμφωνα με το νόμο του Gay-Lussac:
V/T = const .
Αυτό σημαίνει ότι σε μια ισοβαρή διεργασία ο όγκος που καταλαμβάνει το αέριο είναι ευθέως ανάλογος της θερμοκρασίας.
Μπορεί να συναχθεί το συμπέρασμα ότι μια αλλαγή στη θερμοκρασία σε αυτή τη διαδικασία θα οδηγήσει αναπόφευκτα σε αλλαγή της εσωτερικής ενέργειας του αερίου και μια αλλαγή στον όγκο σχετίζεται με την απόδοση της εργασίας, δηλαδή, σε μια ισοβαρική διαδικασία, μέρος της θερμικής Η ενέργεια δαπανάται για την αλλαγή της εσωτερικής ενέργειας του αερίου και το άλλο μέρος δαπανάται για την απόδοση του έργου του αερίου για να ξεπεραστεί η δράση των εξωτερικών δυνάμεων. Στην περίπτωση αυτή, η αναλογία μεταξύ του κόστους θερμότητας για την αύξηση της εσωτερικής ενέργειας και για την εκτέλεση εργασιών εξαρτάται από τη θερμοχωρητικότητα του αερίου.
Ισοθερμική διαδικασία
Μια ισοθερμική διεργασία είναι μια θερμοδυναμική διαδικασία που συμβαίνει σε σταθερή θερμοκρασία.
Είναι πολύ δύσκολο να πραγματοποιηθεί μια ισοθερμική διαδικασία με αέριο στην πράξη. Εξάλλου, είναι απαραίτητο να συμμορφωθείτε με την προϋπόθεση ότι κατά τη διαδικασία συμπίεσης ή διαστολής, το αέριο έχει χρόνο να ανταλλάξει τη θερμοκρασία με το περιβάλλον, διατηρώντας τη δική του θερμοκρασία σταθερή.
Η ισοθερμική διαδικασία περιγράφεται από το νόμο Boyle-Mariotte: pV \u003d const, δηλαδή σε σταθερή θερμοκρασία, η πίεση του αερίου είναι αντιστρόφως ανάλογη με τον όγκο του.
Προφανώς, σε μια ισοθερμική διεργασία, η εσωτερική ενέργεια του αερίου δεν μεταβάλλεται, αφού η θερμοκρασία του είναι σταθερή.
Προκειμένου να εκπληρωθεί η συνθήκη σταθερότητας της θερμοκρασίας του αερίου, είναι απαραίτητο να αφαιρεθεί θερμότητα από αυτήν, ισοδύναμη με το έργο που δαπανάται για τη συμπίεση:
dq = dA = pdv .
Χρησιμοποιώντας την εξίσωση της κατάστασης του αερίου, έχοντας κάνει έναν αριθμό μετασχηματισμών και αντικαταστάσεων, μπορούμε να συμπεράνουμε ότι το έργο του αερίου σε μια ισοθερμική διεργασία καθορίζεται από την έκφραση:
A = RT ln(p 1 /p 2).
αδιαβατική διαδικασία
Μια αδιαβατική διαδικασία είναι μια θερμοδυναμική διαδικασία που προχωρά χωρίς ανταλλαγή θερμότητας μεταξύ του ρευστού εργασίας και του περιβάλλοντος. Όπως μια ισοθερμική διαδικασία, είναι πολύ δύσκολο να εφαρμοστεί μια αδιαβατική διαδικασία στην πράξη. Μια τέτοια διαδικασία μπορεί να προχωρήσει με το μέσο εργασίας τοποθετημένο σε ένα δοχείο, για παράδειγμα, έναν κύλινδρο με ένα έμβολο, που περιβάλλεται από ένα υψηλής ποιότητας θερμομονωτικό υλικό.
Αλλά ανεξάρτητα από τον υψηλής ποιότητας θερμομονωτικό που χρησιμοποιούμε σε αυτήν την περίπτωση, κάποια, ακόμη και αμελητέα, ποσότητα θερμότητας θα ανταλλάσσεται αναπόφευκτα μεταξύ του ρευστού εργασίας και του περιβάλλοντος.
Επομένως, στην πράξη, είναι δυνατό να δημιουργηθεί μόνο ένα κατά προσέγγιση μοντέλο της αδιαβατικής διαδικασίας. Ωστόσο, πολλές θερμοδυναμικές διεργασίες που πραγματοποιούνται στη μηχανική θερμότητας προχωρούν τόσο γρήγορα που το ρευστό εργασίας και το μέσο δεν έχουν χρόνο να ανταλλάξουν θερμότητα, επομένως, με κάποιο βαθμό σφάλματος, τέτοιες διεργασίες μπορούν να θεωρηθούν αδιαβατικές.
Να εξαχθεί μια εξίσωση που σχετίζεται με την πίεση και τον όγκο 1 κιλόαέριο σε μια αδιαβατική διαδικασία, γράφουμε την εξίσωση του πρώτου νόμου της θερμοδυναμικής:
dq = du + pdv .
Εφόσον για μια αδιαβατική διεργασία η μεταφορά θερμότητας dq είναι ίση με μηδέν και η μεταβολή της εσωτερικής ενέργειας είναι συνάρτηση της θερμικής αγωγιμότητας της θερμοκρασίας: du = c v dT , τότε μπορούμε να γράψουμε:
c v dT + pdv = 0 (3) .
Διαφοροποιώντας την εξίσωση Clapeyron pv = RT, παίρνουμε:
pdv + vdp = RdT .
Ας εκφράσουμε το dT από εδώ και ας το αντικαταστήσουμε στην εξίσωση (3) . Μετά από αναδιάταξη και μετασχηματισμούς, παίρνουμε:
pdvc v /(R + 1) + c v vdp/R = 0.
Λαμβάνοντας υπόψη την εξίσωση Mayer R = c p – c v, η τελευταία παράσταση μπορεί να ξαναγραφτεί ως:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
Διαιρώντας την παράσταση που προκύπτει με c v και δηλώνοντας την αναλογία c p / c v με το γράμμα k , μετά την ολοκλήρωση της εξίσωσης (4) παίρνουμε (στο k = const):
ln vk + ln p = const ή ln pvk = const ή pvk = const .
Η εξίσωση που προκύπτει είναι η εξίσωση μιας αδιαβατικής διαδικασίας, στην οποία k είναι ο αδιαβατικός εκθέτης.
Εάν υποθέσουμε ότι η ογκομετρική θερμοχωρητικότητα c v είναι μια σταθερή τιμή, δηλ. c v \u003d const, τότε το έργο της αδιαβατικής διαδικασίας μπορεί να αναπαρασταθεί ως ο τύπος (δίνεται χωρίς έξοδο):
l \u003d c v (T 1 - T 2) ή l \u003d (p 1 v 1 - p 2 v 2) / (k-1).
Πολυτροπική διαδικασία
Σε αντίθεση με τις θερμοδυναμικές διεργασίες που εξετάστηκαν παραπάνω, όταν οποιαδήποτε από τις παραμέτρους του αερίου παρέμεινε αμετάβλητη, η πολυτροπική διεργασία χαρακτηρίζεται από τη δυνατότητα αλλαγής οποιασδήποτε από τις κύριες παραμέτρους του αερίου. Όλες οι παραπάνω θερμοδυναμικές διεργασίες αποτελούν ειδικές περιπτώσεις πολυτροπικών διεργασιών.
Η γενική εξίσωση της πολυτροπικής διαδικασίας έχει τη μορφή pv n = const, όπου n είναι ο πολυτροπικός δείκτης - μια σταθερή τιμή για αυτήν τη διαδικασία, η οποία μπορεί να πάρει τιμές από - ∞ έως + ∞.
Είναι προφανές ότι δίνοντας ορισμένες τιμές στον πολυτροπικό δείκτη, μπορεί να ληφθεί μία ή άλλη θερμοδυναμική διεργασία - ισοχωρική, ισοβαρική, ισοθερμική ή αδιαβατική.
Έτσι, αν πάρουμε n = 0 , παίρνουμε p = const - μια ισοβαρή διεργασία, αν πάρουμε n = 1 , παίρνουμε μια ισοθερμική διαδικασία που περιγράφεται από την εξάρτηση pv = const ; για n = k η διαδικασία είναι αδιαβατική και για n ίση με - ∞ ή + ∞ . έχουμε μια ισοχορική διαδικασία.
Θέματα του κωδικοποιητή USE: ισοδιεργασίες - ισοθερμικές, ισοχωρικές, ισοβαρικές διεργασίες.
Σε όλο αυτό το φυλλάδιο, θα τηρούμε την ακόλουθη υπόθεση: η μάζα και η χημική σύσταση του αερίου παραμένουν αμετάβλητες. Με άλλα λόγια, πιστεύουμε ότι:
Δηλαδή, δεν υπάρχει διαρροή αερίου από το δοχείο ή, αντίθετα, εισροή αερίου στο δοχείο.
Δηλαδή, τα σωματίδια αερίου δεν υφίστανται καμία αλλαγή (ας πούμε, δεν υπάρχει διάσταση - διάσπαση των μορίων σε άτομα).
Αυτές οι δύο προϋποθέσεις ικανοποιούνται σε πάρα πολλές σωματικά ενδιαφέρουσες καταστάσεις (για παράδειγμα, σε απλά μοντέλα θερμικών μηχανών) και επομένως αξίζουν ξεχωριστή εξέταση.
Εάν η μάζα του αερίου και η μοριακή του μάζα είναι σταθερές, τότε η κατάσταση του αερίου προσδιορίζεται από το τρίαΜακροσκοπικές παράμετροι: πίεση, όγκοςΚαι θερμοκρασία. Αυτές οι παράμετροι σχετίζονται μεταξύ τους με την εξίσωση κατάστασης (η εξίσωση Mendeleev-Clapeyron).
Θερμοδυναμική διαδικασία(ή απλά επεξεργάζομαι, διαδικασία) είναι η μεταβολή της κατάστασης του αερίου με την πάροδο του χρόνου. Κατά τη διάρκεια της θερμοδυναμικής διαδικασίας, οι τιμές των μακροσκοπικών παραμέτρων - πίεση, όγκος και θερμοκρασία - αλλάζουν.
Ιδιαίτερο ενδιαφέρον παρουσιάζουν ισοδιεργασίες- θερμοδυναμικές διεργασίες στις οποίες η τιμή μιας από τις μακροσκοπικές παραμέτρους παραμένει αμετάβλητη. Καθορίζοντας καθεμία από τις τρεις παραμέτρους με τη σειρά, παίρνουμε τρεις τύπους ισοδιαδικασιών.
1. Ισοθερμική διαδικασίαπηγαίνει σε σταθερή θερμοκρασία αερίου: .
2. ισοβαρική διαδικασίαλειτουργεί σε σταθερή πίεση αερίου: .
3. Ισοχωρική διαδικασίαπηγαίνει σε σταθερό όγκο αερίου: .
Οι ισοδιεργασίες περιγράφονται από πολύ απλούς νόμους του Boyle - Mariotte, Gay-Lussac και Charles. Ας προχωρήσουμε στη μελέτη τους.
Ισοθερμική διαδικασία
Αφήστε ένα ιδανικό αέριο να εκτελέσει μια ισοθερμική διαδικασία σε μια θερμοκρασία. Κατά τη διάρκεια της διαδικασίας αλλάζει μόνο η πίεση του αερίου και ο όγκος του.
Εξετάστε δύο αυθαίρετες καταστάσεις του αερίου: σε μία από αυτές, οι τιμές των μακροσκοπικών παραμέτρων είναι , και στη δεύτερη, είναι . Αυτές οι τιμές σχετίζονται με την εξίσωση Mendeleev-Clapeyron:
Όπως είπαμε από την αρχή, η μάζα και η μοριακή μάζα θεωρούνται σταθερές.
Επομένως, τα σωστά μέρη των γραπτών εξισώσεων είναι ίσα. Επομένως, οι αριστερές πλευρές είναι επίσης ίσες:
(1)
Εφόσον οι δύο καταστάσεις του αερίου επιλέχθηκαν αυθαίρετα, μπορούμε να συμπεράνουμε ότι κατά τη διάρκεια μιας ισοθερμικής διεργασίας, το γινόμενο της πίεσης και του όγκου του αερίου παραμένει σταθερό:
(2)
Αυτή η δήλωση ονομάζεται Νόμος του Boyle - Mariotte.
Έχοντας γράψει το νόμο Boyle-Mariotte στη μορφή
(3)
μπορεί κανείς να το διατυπώσει και ως εξής: Σε μια ισοθερμική διεργασία, η πίεση ενός αερίου είναι αντιστρόφως ανάλογη του όγκου του.. Εάν, για παράδειγμα, κατά την ισοθερμική διαστολή ενός αερίου, ο όγκος του αυξηθεί τρεις φορές, τότε η πίεση του αερίου μειώνεται τρεις φορές.
Πώς εξηγείται η αντίστροφη σχέση μεταξύ πίεσης και όγκου από φυσική άποψη; Σε σταθερή θερμοκρασία, η μέση κινητική ενέργεια των μορίων αερίου παραμένει αμετάβλητη, δηλαδή, μιλώντας απλά, η δύναμη των κρούσεων των μορίων στα τοιχώματα του δοχείου δεν αλλάζει. Με την αύξηση του όγκου, η συγκέντρωση των μορίων μειώνεται και, κατά συνέπεια, ο αριθμός των μοριακών κρούσεων ανά μονάδα χρόνου ανά μονάδα επιφάνειας του τοιχώματος μειώνεται - η πίεση του αερίου πέφτει. Αντίθετα, με τη μείωση του όγκου αυξάνεται η συγκέντρωση των μορίων, οι επιπτώσεις τους είναι συχνότερες και η πίεση του αερίου αυξάνεται.
Γραφήματα ισοθερμικής διεργασίας
Γενικά, συνηθίζεται να απεικονίζονται γραφήματα θερμοδυναμικών διεργασιών στα ακόλουθα συστήματα συντεταγμένων:
-διάγραμμα: άξονας τετμημένης, άξονας τεταγμένων.
-διάγραμμα: άξονας τετμημένης, άξονας τεταγμένων.
Η γραφική παράσταση μιας ισοθερμικής διεργασίας ονομάζεται ισόθερμος γραμμή.
Μια ισόθερμη σε ένα διάγραμμα είναι μια αντιστρόφως ανάλογη γραφική παράσταση.
Ένα τέτοιο γράφημα είναι υπερβολή (θυμηθείτε άλγεβρα - γράφημα συνάρτησης). Η ισόθερμη-υπερβολή φαίνεται στο Σχ. 1 .

Ρύζι. 1. Ισόθερμος σε -διάγραμμα
Κάθε ισόθερμος αντιστοιχεί σε μια συγκεκριμένη σταθερή τιμή θερμοκρασίας. Τελικά φαίνεται πως Όσο υψηλότερη είναι η θερμοκρασία, τόσο υψηλότερη είναι η αντίστοιχη ισόθερμη -διάγραμμα.
Πράγματι, ας εξετάσουμε δύο ισοθερμικές διεργασίες που εκτελούνται από το ίδιο αέριο (Εικ. 2). Η πρώτη διαδικασία λαμβάνει χώρα σε θερμοκρασία, η δεύτερη - σε θερμοκρασία.

Ρύζι. 2. Όσο υψηλότερη είναι η θερμοκρασία, τόσο μεγαλύτερη είναι η ισόθερμη
Καθορίζουμε κάποια τιμή του όγκου . Στην πρώτη ισόθερμη αντιστοιχεί σε πίεση , στη δεύτερη - class="tex" alt="p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
Στα υπόλοιπα δύο συστήματα συντεταγμένων, η ισόθερμη φαίνεται πολύ απλή: είναι μια ευθεία γραμμή κάθετη στον άξονα (εικ. 3):

Ρύζι. 3. Ισόθερμες επί και -διαγράμματα
ισοβαρική διαδικασία
Θυμηθείτε για άλλη μια φορά ότι η ισοβαρική διαδικασία είναι μια διαδικασία που λαμβάνει χώρα σε σταθερή πίεση. Κατά την ισοβαρική διεργασία αλλάζει μόνο ο όγκος του αερίου και η θερμοκρασία του.
Χαρακτηριστικό παράδειγμα ισοβαρικής διεργασίας: το αέριο βρίσκεται κάτω από ένα τεράστιο έμβολο που μπορεί να κινείται ελεύθερα. Εάν η μάζα του εμβόλου και η διατομή του εμβόλου, τότε η πίεση του αερίου είναι σταθερή και ίση με
που είναι η ατμοσφαιρική πίεση.
Αφήστε ένα ιδανικό αέριο να εκτελέσει μια ισοβαρή διαδικασία υπό πίεση. Εξετάστε ξανά δύο αυθαίρετες καταστάσεις του αερίου. αυτή τη φορά οι τιμές των μακροσκοπικών παραμέτρων θα είναι ίσες με και .
Ας γράψουμε τις εξισώσεις κατάστασης:
Διαχωρίζοντάς τα μεταξύ τους, παίρνουμε:
Κατ 'αρχήν, αυτό θα μπορούσε ήδη να είναι αρκετό, αλλά θα πάμε λίγο παρακάτω. Ας ξαναγράψουμε τη σχέση που προκύπτει έτσι ώστε μόνο οι παράμετροι της πρώτης κατάστασης να εμφανίζονται στο ένα μέρος και μόνο οι παράμετροι της δεύτερης κατάστασης να εμφανίζονται στο άλλο μέρος (με άλλα λόγια, "χωρίζουμε τους δείκτες" σε διαφορετικά μέρη):
(4)
Και τώρα από εδώ - ενόψει της αυθαιρεσίας της επιλογής των κρατών! - παίρνουμε Ο νόμος του Gay-Lussac:
(5)
Με άλλα λόγια, Σε σταθερή πίεση, ο όγκος ενός αερίου είναι ευθέως ανάλογος με τη θερμοκρασία του.:
(6)
Γιατί αυξάνεται ο όγκος με τη θερμοκρασία; Καθώς η θερμοκρασία ανεβαίνει, τα μόρια αρχίζουν να χτυπούν πιο δυνατά και να ανεβάζουν το έμβολο. Ταυτόχρονα, η συγκέντρωση των μορίων μειώνεται, οι κρούσεις γίνονται λιγότερο συχνές, έτσι ώστε στο τέλος η πίεση να παραμένει ίδια.
Παραστάσεις της ισοβαρικής διαδικασίας
Η γραφική παράσταση της ισοβαρικής διεργασίας ονομάζεται ισοβαρής. Στο διάγραμμα, η ισοbar είναι μια ευθεία γραμμή (Εικ. 4):

Ρύζι. 4. Isobar σε -διάγραμμα
Το διακεκομμένο τμήμα του γραφήματος σημαίνει ότι στην περίπτωση ενός πραγματικού αερίου σε αρκετά χαμηλές θερμοκρασίες, το μοντέλο ιδανικού αερίου (και μαζί του ο νόμος Gay-Lussac) παύει να λειτουργεί. Πράγματι, καθώς η θερμοκρασία μειώνεται, τα σωματίδια αερίου κινούνται όλο και πιο αργά, και οι δυνάμεις της διαμοριακής αλληλεπίδρασης έχουν ολοένα και πιο σημαντική επίδραση στην κίνησή τους (μια αναλογία: μια αργή μπάλα είναι πιο εύκολο να πιαστεί από μια γρήγορη). Λοιπόν, σε πολύ χαμηλές θερμοκρασίες, τα αέρια μετατρέπονται σε υγρά.
Τώρα ας καταλάβουμε πώς αλλάζει η θέση του ισοbar με μια αλλαγή στην πίεση. Τελικά φαίνεται πως Όσο μεγαλύτερη είναι η πίεση, τόσο χαμηλότερη είναι η ισοβαρή. -διάγραμμα.
Για να το επαληθεύσετε, εξετάστε δύο ισοβαρείς με πιέσεις και (Εικ. 5):

Ρύζι. 5. Όσο χαμηλότερη είναι η ισοβαρή, τόσο μεγαλύτερη είναι η πίεση
Ας καθορίσουμε κάποια τιμή της θερμοκρασίας. Το βλέπουμε αυτό. Αλλά σε μια σταθερή θερμοκρασία, ο όγκος είναι όσο μικρότερος, τόσο μεγαλύτερη είναι η πίεση (νόμος του Boyle - Mariotte!).
Άρα class="tex" alt="p_2 > p_1"> .!}
Στα υπόλοιπα δύο συστήματα συντεταγμένων, η ισοβαρή είναι μια ευθεία γραμμή κάθετη στον άξονα (Εικ. 6):

Ρύζι. 6. Ισόβαρες επί και -διαγράμματα
Ισοχωρική διαδικασία
Μια ισοχορική διαδικασία, θυμόμαστε, είναι μια διαδικασία που λαμβάνει χώρα σε σταθερό όγκο. Σε μια ισοχωρική διεργασία αλλάζει μόνο η πίεση του αερίου και η θερμοκρασία του.
Μια ισοχορική διαδικασία είναι πολύ απλή να φανταστεί κανείς: είναι μια διαδικασία που λαμβάνει χώρα σε ένα άκαμπτο δοχείο σταθερού όγκου (ή σε έναν κύλινδρο κάτω από ένα έμβολο όταν το έμβολο είναι σταθερό).
Αφήστε ένα ιδανικό αέριο να εκτελέσει μια ισοχωρική διαδικασία σε ένα δοχείο όγκου. Και πάλι, θεωρήστε δύο αυθαίρετες καταστάσεις αερίου με παραμέτρους και . Εχουμε:
Χωρίζουμε αυτές τις εξισώσεις μεταξύ τους:
Όπως και στην εξαγωγή του νόμου Gay-Lussac, «χωρίζουμε» τους δείκτες σε διαφορετικά μέρη:
(7)
Ενόψει της αυθαιρεσίας της επιλογής των κρατών, φτάνουμε στο Ο νόμος του Καρόλου:
(8)
Με άλλα λόγια, Σε σταθερό όγκο ενός αερίου, η πίεσή του είναι ευθέως ανάλογη με τη θερμοκρασία του.:
(9)
Η αύξηση της πίεσης ενός αερίου σταθερού όγκου όταν θερμαίνεται είναι απολύτως προφανές από φυσική άποψη. Μπορείτε εύκολα να το εξηγήσετε μόνοι σας.
Οικόπεδα Ισοχωρικής Διαδικασίας
Η γραφική παράσταση της ισοχωρικής διαδικασίας ονομάζεται ισόχωρα. Στο διάγραμμα, η ισοχώρη είναι ευθεία γραμμή (εικ. 7):

Ρύζι. 7. Ισόχωρη σε -διάγραμμα
Η έννοια της διακεκομμένης περιοχής είναι η ίδια: η ανεπάρκεια του ιδανικού μοντέλου αερίου σε χαμηλές θερμοκρασίες.

Ρύζι. 8. Όσο χαμηλότερη είναι η ισοχώρη, τόσο μεγαλύτερη είναι η ένταση
Η απόδειξη είναι παρόμοια με την προηγούμενη. Φτιάχνουμε τη θερμοκρασία και το βλέπουμε. Αλλά σε μια σταθερή θερμοκρασία, η πίεση είναι όσο μικρότερη, τόσο μεγαλύτερος είναι ο όγκος (και πάλι, ο νόμος Boyle-Mariotte). Άρα class="tex" alt="V_2 > V_1"> .!}
Στα υπόλοιπα δύο συστήματα συντεταγμένων, η ισοχώρη είναι μια ευθεία γραμμή κάθετη στον άξονα (Εικ. 9):

Ρύζι. 9. Ισόχωρες επί και -διαγράμματα
Οι νόμοι του Boyle - Mariotte, Gay-Lussac και Charles ονομάζονται επίσης νόμοι για το φυσικό αέριο.
Εξάγαμε τους νόμους των αερίων από την εξίσωση Mendeleev-Clapeyron. Αλλά ιστορικά ήταν το αντίθετο: οι νόμοι των αερίων θεσπίστηκαν πειραματικά, και πολύ νωρίτερα. Η εξίσωση κατάστασης εμφανίστηκε στη συνέχεια ως γενίκευσή τους.
ισοβαρική διαδικασία
Διαγράμματα ισοδιαδικασιών σε διαφορετικά συστήματα συντεταγμένων
ισοβαρική διαδικασία(Άλλα ελληνικά ισος, isos - «ίδιο» + βαρος, baros - «βάρος») - η διαδικασία αλλαγής της κατάστασης ενός θερμοδυναμικού συστήματος σε σταθερή πίεση ()
Η εξάρτηση του όγκου του αερίου από τη θερμοκρασία σε σταθερή πίεση διερευνήθηκε πειραματικά το 1802 από τον Joseph Louis Gay-Lussac. Ο νόμος του Gay-Lussac: Σε σταθερή πίεση και σταθερές τιμές της μάζας ενός αερίου και της μοριακής του μάζας, ο λόγος του όγκου ενός αερίου προς την απόλυτη θερμοκρασία του παραμένει σταθερός: V / T = const.
Ισοχωρική διαδικασία
Ισοχωρική διαδικασία(από την ελληνική χορωδία - κατεχόμενο μέρος) - η διαδικασία αλλαγής της κατάστασης ενός θερμοδυναμικού συστήματος σε σταθερό όγκο (). Για τα ιδανικά αέρια, η ισοχωρική διαδικασία περιγράφεται από το νόμο του Charles: για μια δεδομένη μάζα αερίου σε σταθερό όγκο, η πίεση είναι ευθέως ανάλογη της θερμοκρασίας:
Η γραμμή που απεικονίζει μια ισοχωρική διεργασία σε ένα διάγραμμα ονομάζεται ισόχωρη.
Αξίζει επίσης να σημειωθεί ότι η ενέργεια που παρέχεται στο αέριο δαπανάται για την αλλαγή της εσωτερικής ενέργειας, δηλαδή Q = 3* ν*R*T/2=3*V*ΔP, όπου R είναι η καθολική σταθερά του αερίου, ν είναι ο αριθμός των mol στο αέριο, T είναι η θερμοκρασία σε Kelvin, V είναι ο όγκος του αερίου, ΔP είναι η αύξηση της μεταβολής της πίεσης. και η γραμμή που απεικονίζει την ισοχωρική διαδικασία στο διάγραμμα, στους άξονες P(T), θα πρέπει να επεκταθεί και να συνδεθεί με μια διακεκομμένη γραμμή στην αρχή, καθώς μπορεί να προκύψει παρεξήγηση.
Ισοθερμική διαδικασία
Ισοθερμική διαδικασία(από το ελληνικό "θερμός" - ζεστό, ζεστό) - η διαδικασία αλλαγής της κατάστασης ενός θερμοδυναμικού συστήματος σε σταθερή θερμοκρασία () (). Η ισοθερμική διαδικασία περιγράφεται από τον νόμο Boyle - Mariotte:
Σε σταθερή θερμοκρασία και σταθερές τιμές της μάζας του αερίου και της μοριακής του μάζας, το γινόμενο του όγκου του αερίου και της πίεσής του παραμένει σταθερό: PV = const.
Ισεντροπική διαδικασία
Ισεντροπική διαδικασία- η διαδικασία αλλαγής της κατάστασης ενός θερμοδυναμικού συστήματος σε σταθερή εντροπία (). Για παράδειγμα, μια αναστρέψιμη αδιαβατική διεργασία είναι ισεντροπική: σε μια τέτοια διαδικασία δεν υπάρχει ανταλλαγή θερμότητας με το περιβάλλον. Ένα ιδανικό αέριο σε μια τέτοια διαδικασία περιγράφεται από την ακόλουθη εξίσωση:
όπου είναι ο αδιαβατικός εκθέτης, που προσδιορίζεται από τον τύπο του αερίου.
Ίδρυμα Wikimedia. 2010 .
Δείτε τι είναι οι "Isoprocesses" σε άλλα λεξικά:
Οι ισοδιεργασίες είναι θερμοδυναμικές διεργασίες κατά τις οποίες η μάζα και ένα ακόμη από τα φυσικά μεγέθη των παραμέτρων κατάστασης: πίεση, όγκος ή θερμοκρασία παραμένουν αμετάβλητα. Άρα, μια ισοβαρική διαδικασία αντιστοιχεί σε μια σταθερή πίεση, έναν ισοχορικό όγκο ... Wikipedia
Η μοριακή κινητική θεωρία (συντομογραφία MKT) είναι μια θεωρία που εξετάζει τη δομή της ύλης από την άποψη τριών βασικών περίπου σωστών διατάξεων: όλα τα σώματα αποτελούνται από σωματίδια, το μέγεθος των οποίων μπορεί να παραμεληθεί: άτομα, μόρια και ιόντα. σωματίδια ... ... Wikipedia
- (συντομογραφία MKT) μια θεωρία που εξετάζει τη δομή της ύλης από την άποψη τριών βασικών περίπου σωστών διατάξεων: όλα τα σώματα αποτελούνται από σωματίδια των οποίων το μέγεθος μπορεί να παραμεληθεί: άτομα, μόρια και ιόντα. τα σωματίδια βρίσκονται σε συνεχή ... ... Wikipedia
Βιβλία
- Στατιστική πρόβλεψη χαρακτηριστικών παραμόρφωσης-αντοχής δομικών υλικών, G. Pluvinazh, VT Sapunov, Αυτό το βιβλίο παρουσιάζει μια νέα μέθοδο που προτείνει μια κοινή μεθοδολογία για την πρόβλεψη των χαρακτηριστικών των κινητικών διεργασιών, κοινή για μεταλλικά και πολυμερή υλικά. Μέθοδος… Κατηγορία: Σχολικά βιβλία για πανεπιστήμιαΕκδότης: