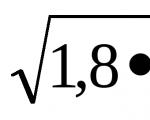Οι αντιδράσεις ανταλλαγής ιόντων θα ολοκληρωθούν. Εξισώσεις ιοντικής αντίδρασης
Πρόβλημα 1. Υπολογίστε τη συγκέντρωση ιόντων υδρογόνου στο διάλυμα HCN (C m = 10 -3 M), εάν = 4,2∙10 -3 .
Λύση: Η διάσταση του υδροκυανικού οξέος προχωρά σύμφωνα με την εξίσωση HCN ↔ H + + CN - ; οι συγκεντρώσεις των ιόντων και στο διάλυμα είναι ίσες μεταξύ τους (αφού H+: CN - = 1:1, όπου
- στοιχειομετρικοί συντελεστές) δηλ. = = Cm, mol/l; Τότε = = 4,2∙10 -3 ∙ 10 -3 = 4,210 -7 mol/l.
Λύση : Το υδροξείδιο του αμμωνίου διασπάται ως εξής:
NH 4 OH ↔ NH 4 + + OH -, η σταθερά διάστασης έχει τη μορφή
Κ δ =;
οι συγκεντρώσεις των ιόντων αμμωνίου και υδροξειδίου είναι ίδιες ( (NH4+) : (OH -) = 1:1), τα συμβολίζουμε ως Χ:
= = xφίλη αλήτη , τότε η έκφραση για το K d θα πάρει τη μορφή
1,810 -5 = Χ 2 / 0,01-Χ. Λαμβάνοντας υπ 'όψιν ότι Χ<< С м, решаем уравнение
1,810 -5 =x 2 / 0,01, σχετικό Χ:
Χ=
 =4,2∙10 -4 mol/l; = 4,2∙10 -4 mol/l.
=4,2∙10 -4 mol/l; = 4,2∙10 -4 mol/l.
Οι συγκεντρώσεις των ιόντων υδρογόνου και υδροξειδίου σχετίζονται μέσω του ιοντικού προϊόντος του νερού Κ w= =10 -14, ας εκφράσουμε τη συγκέντρωση ιόντων υδρογόνου = Κ w/ και υπολογίστε την τιμή του:
110 -14 /4,210 -4 = 2,310 -11 mol/l.
Πρόβλημα 3. Προσδιορίστε το pH του διαλύματος HCl ( =1), εάν C m =2∙10 -3 M
Λύση: Η διάσταση του υδροχλωρικού οξέος προχωρά σύμφωνα με την εξίσωση
HCl H + + Cl - , συγκέντρωση ιόντων υδρογόνου = C m =1∙2∙10 -3 = =2∙10 -3 mol/l. Δείκτης υδρογόνου pH = - log = - log2∙10 -3 = 2,7.
Πρόβλημα 4. Προσδιορίστε τη μοριακή συγκέντρωση του υδροξειδίου του αμμωνίου εάν pH=11 και Kd=1,8∙10 -5.
Λύση: Συγκέντρωση ιόντων υδρογόνου =10 - pH =10 -11 mol/l. Από το ιοντικό προϊόν του νερού προσδιορίζουμε τη συγκέντρωση = K w / = 10 -14 /10 -11 =10 -3 mol/l. Το υδροξείδιο του αμμωνίου είναι μια ασθενής βάση και χαρακτηρίζεται από την εξίσωση αντίδρασης διάστασης
NH 4 OH ↔ NH 4 + + OH - . Έκφραση για τη σταθερά διάστασης
K d =. 
Από το νόμο του Ostwald προκύπτει ότι = = ∙C m, a ΠΡΟΣ ΤΗΝ ρε = 2 C m. Συνδυάζοντας τις εξισώσεις, παίρνουμε C m = 2 / K d = 10 -6 / 1,8∙10 -5 = 0,056 mol/l
Προϊόν διαλυτότητας
Οι ουσίες, ανάλογα με τη φύση τους, έχουν διαφορετική διαλυτότητα στο νερό, η οποία κυμαίνεται από κλάσματα του χιλιοστού έως εκατοντάδες γραμμάρια ανά λίτρο. Οι δύσκολα διαλυτοί ηλεκτρολύτες σχηματίζουν κορεσμένα διαλύματα πολύ χαμηλών συγκεντρώσεων, άρα μπορούμε να υποθέσουμε ότι ο βαθμός διάστασής τους αγγίζει τη μονάδα. Έτσι, ένα κορεσμένο διάλυμα ενός ελάχιστα διαλυτού ηλεκτρολύτη είναι ένα σύστημα που αποτελείται από το ίδιο το διάλυμα, το οποίο βρίσκεται σε ισορροπία με ένα ίζημα της διαλυμένης ουσίας. Υπό σταθερές εξωτερικές συνθήκες, ο ρυθμός διάλυσης του ιζήματος είναι ίσος με τον ρυθμό της διαδικασίας κρυστάλλωσης: Κ nΕΝΑ Μ ↔ nΚ+ Μ + ΜΕΝΑ- n (1)
διάλυμα ιζήματος
Για να περιγραφεί αυτή η διαδικασία ετερογενούς ισορροπίας, χρησιμοποιείται μια σταθερά ισορροπίας, που ονομάζεται προϊόν διαλυτότητας PR = n Μ, όπου και είναι οι συγκεντρώσεις των ιόντων σε ένα κορεσμένο διάλυμα (mol/l). Για παράδειγμα:
AgCl= Ag + +Cl-, PR = ; Εδώ n=m=1.
PbI2 = Pb2+ +2I -, PR = 2; Εδώ n=1, Μ=2.
Το PR εξαρτάται από τη φύση της διαλυμένης ουσίας και τη θερμοκρασία. Το PR είναι μια τιμή πίνακα. Γνωρίζοντας PR , μπορείτε να υπολογίσετε τη συγκέντρωση ενός κορεσμένου διαλύματος μιας ουσίας και επίσης να υπολογίσετε τη διαλυτότητά του σε g ανά 100 ml νερού (τιμή μικρό, που δίνεται στη βιβλιογραφία αναφοράς) και να προσδιορίσετε την πιθανότητα καθίζησης της ουσίας.
Για την εξίσωση (1), η σχέση μεταξύ της συγκέντρωσης ενός κορεσμένου διαλύματος μιας δύσκολα διαλυτής ουσίας (C m, mol/l) και της τιμής PR προσδιορίζεται από την ακόλουθη εξίσωση: 
 ,
,
Οπου nΚαι Μ –στοιχειομετρικοί συντελεστές σε εξ. 1.
Εργασία 5. Η συγκέντρωση του κορεσμένου διαλύματος (C m)Mg(OH) 2 είναι 1,1 10 -4 mol/l. Γράψτε την έκφραση για PR και υπολογίστε την αξία του.
Λύση: Σε ένα κορεσμένο διάλυμα Mg(OH) 2, επιτυγχάνεται ισορροπία μεταξύ του ιζήματος και του διαλύματος Mg(OH) 2 ↔Mg 2+ + 2OH - , για το οποίο η έκφραση PR έχει τη μορφή PR = 2. Γνωρίζοντας τη συγκέντρωση των ιόντων, μπορείτε να βρείτε την αριθμητική τους τιμή. Δεδομένης της πλήρους διάσπασης
Mg(OH) 2, η συγκέντρωσή του κορεσμένο διάλυμα C m = = 1,110 -4 mol/l, a = 2 = 2,210 -4 mol/l. Επομένως, PR= 2 =1,1. 10 -4 (2,2 10 -4) 2 = 5,3. 10 -12.
Εργασία 6. Υπολογίστε τη συγκέντρωση του κορεσμένου διαλύματος και το PR του χρωμικού αργύρου εάν διαλυθούν 0,011 g άλατος σε 0,5 l νερού.
Λύση:
Για τον προσδιορισμό της μοριακής συγκέντρωσης ενός κορεσμένου διαλύματος Ag 2 CrO 4 χρησιμοποιούμε τον τύπο C M =
 ,
Οπου Μ- μάζα διαλυμένης ουσίας (g), M - μοριακή μάζα (g/mol), V- όγκος διαλύματος (l). Μ (Αγ 2
CrO 4
)
=332 g/mol. cm =9,48. 10 -5 mol/l. Η διάλυση του χρωμικού αργύρου (I) συνοδεύεται από πλήρη ( = 1) διάσταση του άλατος: Ag 2 CrO 4 ↔ 2Ag + +CrO 4 2-, PR = 2, όπου = C m = 9,48. 10 -5 mol/l, a = 2 =1,89610 -4.
,
Οπου Μ- μάζα διαλυμένης ουσίας (g), M - μοριακή μάζα (g/mol), V- όγκος διαλύματος (l). Μ (Αγ 2
CrO 4
)
=332 g/mol. cm =9,48. 10 -5 mol/l. Η διάλυση του χρωμικού αργύρου (I) συνοδεύεται από πλήρη ( = 1) διάσταση του άλατος: Ag 2 CrO 4 ↔ 2Ag + +CrO 4 2-, PR = 2, όπου = C m = 9,48. 10 -5 mol/l, a = 2 =1,89610 -4.
Έτσι PR = (1.89610 -4) 2 (9.4810 -5) = 3.410 -12.
Πρόβλημα 7. Είναι δυνατή η παρασκευή διαλυμάτων άλατος CaCO 3 με συγκεντρώσεις CaCO 3 C 1 = 10 -2 M και C 2 = 10 -6 M, εάν PR CaCO 3 = 3,810 -9.
Λύση: Γνωρίζοντας την τιμή PR, μπορείτε να υπολογίσετε τη συγκέντρωση
κορεσμένο διάλυμα άλατος και συγκρίνοντάς το με το προτεινόμενο
συγκεντρώσεις, εξάγετε συμπέρασμα σχετικά με τη δυνατότητα ή την αδυναμία παρασκευής διαλυμάτων. Η διάλυση του ανθρακικού ασβεστίου προχωρά σύμφωνα με το σχήμα CaCO 3 ↔Ca 2+ +CO 3 2- Σε αυτή την εξίσωση n = Μ = 1 τότε
 =
=
 ≈ 6,2 10 -5 mol/l,
≈ 6,2 10 -5 mol/l,
C 1 > C m – το διάλυμα δεν μπορεί να παρασκευαστεί, καθώς θα σχηματιστεί ίζημα.
Γ 2< С м – раствор приготовить можно.
Αντιδράσεις ανταλλαγής ιόντων
Τα διαλύματα ηλεκτρολυτών χαρακτηρίζονται από αντιδράσεις ανταλλαγής ιόντων. Προϋπόθεση για να συμβούν σχεδόν πλήρως τέτοιες αντιδράσεις είναι η απομάκρυνση ορισμένων ιόντων από το διάλυμα λόγω:
1) σχηματισμός ιζήματος
FeSO 4 + 2 NaOH Fe(OH) 2 + Na 2 SO 4 - μοριακή εξίσωση (MU)
Fe 2+ +SO 4 2- +2Na + +2OH - Fe(OH) 2 +2Na + +SO 4 2- ιόντων-μοριακή εξίσωση (IMU).
Fe 2+ +2OH - Fe(OH) 2 (PR Fe (OH) 2 = 4,810 -16) – μια σύντομη ιοντική-μοριακή εξίσωση για το σχηματισμό ιζήματος.
2) απελευθέρωση αερίου
Na 2 CO 3 + 2H 2 SO 4 H 2 CO 3 + 2NaHSO 4 (MU)
2Na + +CO 3 2- + 2H + + 2HSO 4 - H 2 C0 3 + 2Na + + 2HSO 4 - (IMU)
2H + + CO 3 2- H 2 C0 3 H 2 O + C0 2 - ιόν - μοριακό επίπεδο
σχηματισμός πτητικής ένωσης.
3) σχηματισμός ασθενών ηλεκτρολυτών
α) απλές ουσίες:
2KCN + H 2 SO 4 2HCN + K 2 SO 4 (MU)
2K + + 2CN - + 2H + +SO 4 2- 2HCN + 2K + +SO 4 2- (IMU)
CN - +H + HCN (K d HCN = 7,8 10 -10) – ιοντο-μοριακό επίπεδο σχηματισμού του ασθενούς ηλεκτρολύτη HCN.
β) σύνθετες ενώσεις:
ZnCl 2 + 4NH 3 Cl 2 (MU)
Zn 2+ + 2Cl - +4NH 3 2+ + 2Cl - -(IMU)
Zn 2+ +4NH 3 2+ - μια σύντομη ιοντική-μοριακή εξίσωση για το σχηματισμό ενός μιγαδικού κατιόντος.
Υπάρχουν διεργασίες στις οποίες οι ασθενείς ηλεκτρολύτες ή οι ελάχιστα διαλυτές ενώσεις είναι μεταξύ των πρώτων υλών και των προϊόντων αντίδρασης. Σε αυτή την περίπτωση, η ισορροπία μετατοπίζεται προς το σχηματισμό ουσιών που έχουν τη χαμηλότερη σταθερά διάστασης ή προς το σχηματισμό μιας λιγότερο διαλυτής ουσίας:
Α) NH 4 OH + HCl NH 4 Cl + H 2 O (MU)
NH 4 OH + H + + Cl - NH 4 + + Cl - + H 2 O
NH 4 OH + H + NH 4 + + H 2 O (IMU)
Κ δ ( NH 4 OH) =1,8 10 -5 > K d ( H 2 O) =1,810 -16.
Η ισορροπία μετατοπίζεται προς το σχηματισμό μορίων νερού.
Β) AgCl + NaI AgI + NaCl (MU)
AgCl + Na + +I - AgI+ Na + +Cl -
AgCl + I - AgI + Cl - (IMU)
ΚΑΙ ΤΑ ΛΟΙΠΑ AgCl =1,7810 -10 > ΚΑΙ ΤΑ ΛΟΙΠΑ AgI =8,310 -17.
Η ισορροπία μετατοπίζεται προς το σχηματισμό ενός ιζήματος AgI.
Γ) Ενδέχεται να υπάρχουν διεργασίες στις εξισώσεις των οποίων υπάρχει και μια κακώς διαλυτή ένωση και ένας ασθενής ηλεκτρολύτης
MnS + 2HCl MnCl 2 + H 2 S (MU)
MnS + 2H + +2Cl - Mn 2+ + 2Cl - + H 2 S
MnS + 2 H + Mn 2+ + H 2 S (IMU)
PR MnS =2,510 -10 ; =  =1,58,10 -5 mol/l
=1,58,10 -5 mol/l
K d H 2 S = K 1 K 2 = 610 -22; =  =5,4,10 -8 mol/l
=5,4,10 -8 mol/l
Η δέσμευση των ιόντων S 2- στα μόρια H 2 S συμβαίνει πληρέστερα από ό, τι στο MnS, επομένως η αντίδραση προχωρά προς τα εμπρός, προς το σχηματισμό του H 2 S
Υδρόλυση αλάτων
Η υδρόλυση είναι το αποτέλεσμα της αλληλεπίδρασης πόλωσης των ιόντων αλάτων με το κέλυφος ενυδάτωσης τους. Η υδρόλυση είναι μια αντίδραση ανταλλαγής σε διάλυμα μεταξύ μορίων νερού και ιόντων άλατος. Ως αποτέλεσμα της υδρόλυσης, λόγω του σχηματισμού ενός ασθενούς ηλεκτρολύτη (ασθενούς οξέος ή ασθενούς βάσης), η ιοντική ισορροπία H 2 O⇄H + + OH - αλλάζει λόγω της δέσμευσης του H + ή OH - και το περιβάλλον pH αλλάζει . Τα άλατα που περιέχουν ιόντα ασθενούς οξέος ή ασθενούς βάσης υποβάλλονται σε υδρόλυση. Τα άλατα που σχηματίζονται από ιόντα ενός ισχυρού οξέος και μιας ισχυρής βάσης δεν υφίστανται υδρόλυση (NaCl, Na 2 SO 4). Τα προϊόντα της υδρόλυσης μπορεί να είναι ασθενείς ηλεκτρολύτες, κακή διάσπαση, ελάχιστα διαλυτές και πτητικές ουσίες. Η υδρόλυση είναι μια σταδιακή αντίδραση· στην περίπτωση ενός πολλαπλά φορτισμένου ιόντος, ο αριθμός των βημάτων είναι ίσος με το φορτίο του. Υδρόλυση από κατιόνεπηρεάζονται τα άλατα που σχηματίζονται από ισχυρά όξινα ανιόντα και κατιόντα ασθενούς βάσης. Για παράδειγμα, οι ασθενείς βάσεις περιλαμβάνουν υδροξείδια Π- Και ρε-μέταλλα (K d 10 -4), καθώς και υδροξείδιο του αμμωνίου.
Ο χλωριούχος ψευδάργυρος είναι ένα άλας που σχηματίζεται από την ασθενή βάση Zn(OH) 2 και το ισχυρό οξύ HCl. Το κατιόν ψευδαργύρου έχει φορτίο 2+, επομένως η υδρόλυση θα γίνει σε δύο στάδια:
Zn 2+ + HOH ↔ ZnOH + + H + I στάδιο
ZnOH + +HOH↔ Zn(OH) 2 +H + II στάδιο
Ως αποτέλεσμα αυτής της αλληλεπίδρασης, εμφανίζεται περίσσεια ιόντων H + ([H + ] [OH - ]), το διάλυμα οξινίζεται (pH<7).
Υδρόλυση από ανιόν. Αυτός ο τύπος υδρόλυσης είναι τυπικός για άλατα που σχηματίζονται από ανιόντα ασθενούς οξέος (K d 10 -3) και κατιόντα ισχυρής βάσης (K d >10 -3). Ας εξετάσουμε την υδρόλυση του ανθρακικού καλίου - ενός άλατος που σχηματίζεται από ασθενές ανθρακικό οξύ H 2 CO 3 (K d I = 4,5. 10 -7) και η ισχυρή βάση ΚΟΗ, το καρβόξο ανιόν έχει φορτίο (2-). Η υδρόλυση γίνεται σε δύο στάδια:
CO 3 2- +H 2 O↔HCO 3 - +OH - Στάδιο Ι
HCO 3 - +H 2 O↔H 2 CO 3 +OH - II στάδιο
Στην περίπτωση αυτή απελευθερώνονται ιόντα ΟΗ - ([H + ] [OH - ]) - το διάλυμα γίνεται αλκαλικό (pH > 7).
Μη αναστρέψιμη υδρόλυση. Τα άλατα που σχηματίζονται από μια ασθενή βάση και ένα ασθενές οξύ υδρολύονται στο κατιόν και στο ανιόν. Το αποτέλεσμα της υδρόλυσης θα εξαρτηθεί από την τιμή Σε δ βάσεις και οξέα. Ας εξετάσουμε την υδρόλυση του φθοριούχου αμμωνίου, ενός άλατος που σχηματίζεται από αδύναμο
βάση NH 4 OH (Kd = 1,8 . 10 -5) και ασθενές οξύ HF (Kd = 6,8 . 10 -4):
NH 4 F + HOH NH 4 OH + HF
Στην περίπτωση αυτή ο Κ δ ( NH 4 OH) K d ( HF), επομένως, η υδρόλυση (κυρίως) θα προχωρήσει κατά μήκος του κατιόντος και η αντίδραση του μέσου θα είναι ελαφρώς όξινη.
Αντιδράσεις ανταλλαγής μεταξύ διαλυμάτων ηλεκτρολυτών
Αντιδράσεις που οδηγούν στο σχηματισμό ιζήματος. Ρίξτε 3-4 ml διαλύματος θειικού χαλκού (Ι) σε έναν δοκιμαστικό σωλήνα, την ίδια ποσότητα διαλύματος χλωριούχου ασβεστίου στον δεύτερο και θειικό αλουμίνιο στον τρίτο. Προσθέστε λίγο διάλυμα υδροξειδίου του νατρίου στον πρώτο δοκιμαστικό σωλήνα, διάλυμα ορθοφωσφορικού νατρίου στον δεύτερο και διάλυμα νιτρικού βαρίου στον τρίτο. Σε όλους τους δοκιμαστικούς σωλήνες σχηματίζονται ιζήματα.
Ασκηση. Να γράψετε τις εξισώσεις αντίδρασης σε μοριακή, ιοντική και συντομευμένη ιοντική μορφή. Εξηγήστε γιατί δημιουργήθηκε η βροχόπτωση. Διαλύματα από ποιες άλλες ουσίες μπορούν να χυθούν σε δοκιμαστικούς σωλήνες για να προκαλέσουν τη δημιουργία καθίζησης; Γράψτε εξισώσεις για αυτές τις αντιδράσεις σε μοριακή, ιοντική και συντομευμένη ιοντική μορφή.
Αντιδράσεις που περιλαμβάνουν την απελευθέρωση αερίου. Ρίξτε 3-4 ml διαλύματος θειώδους νατρίου σε έναν δοκιμαστικό σωλήνα και τον ίδιο όγκο διαλύματος ανθρακικού νατρίου στον δεύτερο. Προσθέστε την ίδια ποσότητα θειικού οξέος σε καθένα από αυτά. Ο πρώτος δοκιμαστικός σωλήνας απελευθερώνει ένα αέριο με έντονη οσμή, ο δεύτερος δοκιμαστικός σωλήνας απελευθερώνει ένα άοσμο αέριο.
Ασκηση. Να γράψετε εξισώσεις για τις αντιδράσεις που συμβαίνουν σε μοριακή, ιοντική και συντομευμένη ιοντική μορφή. Σκεφτείτε ποια άλλα οξέα θα μπορούσαν να εφαρμοστούν σε αυτά τα διαλύματα για να λάβετε παρόμοια αποτελέσματα. Γράψτε εξισώσεις για αυτές τις αντιδράσεις σε μοριακή, ιοντική και συντομευμένη ιοντική μορφή.
Αντιδράσεις που συμβαίνουν με το σχηματισμό μιας ελαφρώς διασπώμενης ουσίας. Ρίξτε 3-4 ml διαλύματος υδροξειδίου του νατρίου σε έναν δοκιμαστικό σωλήνα και προσθέστε δύο ή τρεις σταγόνες φαινολοφθαλεΐνη. Το διάλυμα παίρνει ένα κατακόκκινο χρώμα. Στη συνέχεια προσθέστε υδροχλωρικό ή θειικό οξύ μέχρι να αποχρωματιστεί το χρώμα.
Ρίξτε περίπου 10 ml θειικού χαλκού (II) σε άλλο δοκιμαστικό σωλήνα και προσθέστε λίγο διάλυμα υδροξειδίου του νατρίου. Σχηματίζεται ένα μπλε ίζημα υδροξειδίου του χαλκού(II). Ρίξτε θειικό οξύ στον δοκιμαστικό σωλήνα μέχρι να διαλυθεί το ίζημα.
Ασκηση. Να γράψετε εξισώσεις για τις αντιδράσεις που συμβαίνουν σε μοριακή, ιοντική και συντομευμένη ιοντική μορφή. Εξηγήστε γιατί παρουσιάστηκε αποχρωματισμός στον πρώτο δοκιμαστικό σωλήνα και διάλυση του ιζήματος στον δεύτερο. Ποιες κοινές ιδιότητες έχουν οι διαλυτές και οι αδιάλυτες βάσεις;
Ποιοτική αντίδραση σε ιόν χλωρίου. Ρίξτε 1-2 ml αραιού υδροχλωρικού οξέος σε έναν δοκιμαστικό σωλήνα, την ίδια ποσότητα διαλύματος χλωριούχου νατρίου στον δεύτερο και διάλυμα χλωριούχου ασβεστίου στον τρίτο. Προσθέστε μερικές σταγόνες διαλύματος νιτρικού αργύρου (I) AgNO3 σε όλους τους δοκιμαστικούς σωλήνες. Ελέγξτε εάν το ίζημα διαλύεται σε πυκνό νιτρικό οξύ.
Ασκηση. Να γράψετε τις εξισώσεις για τις αντίστοιχες χημικές αντιδράσεις σε μοριακή, ιοντική και συντομευμένη ιοντική μορφή. Σκεφτείτε πώς μπορείτε να διακρίνετε: α) το υδροχλωρικό οξύ από άλλα οξέα. β) χλωρίδια από άλλα άλατα. γ) διαλύματα χλωριδίων από υδροχλωρικό οξύ. Γιατί μπορείτε επίσης να χρησιμοποιήσετε ένα διάλυμα νιτρικού μολύβδου(II) αντί για ένα διάλυμα νιτρικού αργύρου(I);
Το μάθημα θα εξετάσει τις συνθήκες για την ολοκλήρωση των αντιδράσεων ανταλλαγής ιόντων. Για να κατανοήσουμε καλύτερα ποιες συνθήκες πρέπει να τηρούνται για να ολοκληρωθούν οι αντιδράσεις ανταλλαγής ιόντων, θα εξετάσουμε ποιες είναι αυτές οι αντιδράσεις και η ουσία τους. Δίνονται παραδείγματα για την ενίσχυση αυτών των εννοιών.
Θέμα: Χημικός δεσμός. Ηλεκτρολυτική διάσταση
Μάθημα: Συνθήκες ροήςαντιδράσεις ανταλλαγής ιόντων μέχρι την ολοκλήρωση
Εάν προσπαθήσετε να αντιδράσετε υδροξείδιο του νατρίου με χλωριούχο κάλιο, η αντίδραση δεν θα συμβεί. Σε μια αντίδραση, ανταλλάσσονται ιόντα, αλλά δεν σχηματίζονται προϊόντα. Ας δούμε τους λόγους για αυτό. Οι ουσίες που σχηματίζονται ως αποτέλεσμα της αμοιβαίας έλξης μπορούν να διαχωριστούν.
1. Αντιδράσεις ανταλλαγής ιόντων που οδηγούν στο σχηματισμό ιζήματος.
Προηγουμένως, ελήφθησαν υπόψη οι εξισώσεις αντίδρασης που είχαν ως αποτέλεσμα το σχηματισμό ενός ιζήματος.
Όλες αυτές οι αντιδράσεις ανήκαν σε αντιδράσεις ανταλλαγής ιόντων. Μπορούμε να συμπεράνουμε ότι μία από τις προϋποθέσεις για να ολοκληρωθεί η αντίδραση ανταλλαγής ιόντων είναι ο σχηματισμός ενός ιζήματος.
BaCl 2 + Na 2 CO 3 → BaCO 3 ↓ + 2NaCl.
Ba 2+ +2Cl - + 2Na + + CO 3 2- →BaCO 3 ↓ + 2Na + +2Cl - πλήρης ιοντική εξίσωση
Ba 2+ + CO 3 2- → BaCO 3 ↓ συντομευμένη ιοντική εξίσωση.
Ας γράψουμε μια άλλη εξίσωση αντίδρασης που οδηγεί στο σχηματισμό ενός ιζήματος.
CuSO 4 + 2NaOH → Cu(OH) 2 ↓ + Na 2 SO 4
Cu 2+ + SO 4 2- +2Na + + 2OH - → Cu(OH) 2 ↓ + 2Na + + SO 4 2- πλήρης ιοντική εξίσωση
Cu 2+ + 2OH - → Cu(OH) 2 ↓ συντομευμένη ιοντική εξίσωση.
Συμπέρασμα:Οι αντιδράσεις ανταλλαγής ιόντων ολοκληρώνονται εάν το αποτέλεσμα είναι ίζημα.
Ρύζι. 1. Αντίδραση εξουδετέρωσης ()
Εξετάστε την αντίδραση εξουδετέρωσης του υδροξειδίου του νατρίου με υδροχλωρικό οξύ.
NaOH + HCl → NaCl+ H 2 O
Na + + OH - + H + + Cl - →Na + + Cl - + H 2 O πλήρης ιοντική εξίσωση
OH - + H + → H 2 O ανηγμένη ιοντική εξίσωση
Αυτή η αντίδραση προχωρά στην ολοκλήρωση, γιατί το αποτέλεσμα είναι μια ελαφρώς διασπώμενη ουσία - νερό.
Συμπέρασμα:Οι αντιδράσεις ανταλλαγής ιόντων ολοκληρώνονται εάν το αποτέλεσμα είναι μια ελαφρώς διασπώμενη ουσία.
Γνωρίζετε ότι το ανθρακικό ασβέστιο αντιδρά καλά με το υδροχλωρικό οξύ.
CaCO 3 +2HCl → CaCl 2 + H 2 O + CO 2
CaCO 3 +2H + + 2Cl - → Ca 2+ +2Cl - + H 2 O + CO 2 πλήρης ιοντική εξίσωση
2H + + CaCO 3 → Ca 2+ + H 2 O + CO 2 συντομευμένη ιοντική εξίσωση.
Ως αποτέλεσμα αυτής της αντίδρασης, παράγεται διοξείδιο του άνθρακα, το οποίο σχηματίζεται κατά την αποσύνθεση του ασθενούς ανθρακικού οξέος. Σημειώστε ότι το ανθρακικό ασβέστιο είναι αδιάλυτη ουσία και δεν διασπάται σε ιόντα. Στην πλήρη ιοντική εξίσωση, γράφουμε μόνο υδροχλώριο και χλωριούχο ασβέστιο ως ιόντα. Οι υπόλοιπες φόρμουλες παραμένουν αμετάβλητες, καθώς αυτές οι ουσίες δεν εκτίθενται.
Συμπέρασμα:Οι αντιδράσεις ανταλλαγής ιόντων ολοκληρώνονται εάν οδηγήσουν σε αέριο.
Σε αυτό το μάθημα, εξετάσατε τις συνθήκες για την ολοκλήρωση των αντιδράσεων ανταλλαγής ιόντων. Οι αντιδράσεις ανταλλαγής ιόντων ολοκληρώνονται εάν το αποτέλεσμα είναι ένα ίζημα, μια ελαφρά διασπώμενη ουσία ή αέριο.
1. Ρουτζίτης Γ.Ε. Ανόργανη και οργανική χημεία. 9η τάξη: εγχειρίδιο για ιδρύματα γενικής εκπαίδευσης: βασικό επίπεδο / Γ. Ε. Ρουτζίτης, Φ.Γ. Φέλντμαν. Μ.: Διαφωτισμός. 2009 119 σελ.: ill.
2. Popel P.P. Χημεία: 8η τάξη: εγχειρίδιο για ιδρύματα γενικής εκπαίδευσης / Π.Π. Popel, L.S. Krivlya. -Κ.: IC “Academy”, 2008.-240 σελ.: ill.
3. Gabrielyan O.S. Χημεία. 9η τάξη. Σχολικό βιβλίο. Εκδότης: Bustard: 2001. 224 δευτ.
1. Αρ. 3,4,5 (σ.22) Ρουτζίτης Γ.Ε. Ανόργανη και οργανική χημεία. 9η τάξη: εγχειρίδιο για ιδρύματα γενικής εκπαίδευσης: βασικό επίπεδο / Γ. Ε. Ρουτζίτης, Φ.Γ. Φέλντμαν. Μ.: Διαφωτισμός. 2009 119 σελ.: ill.
2. Τι παρατηρείτε όταν φτιάχνετε ζύμη όταν προσθέτετε ξύδι στη σόδα; Γράψτε την εξίσωση της αντίδρασης.
3. Γιατί σχηματίζεται άλατα στον βραστήρα; Πώς να το αφαιρέσετε; Γράψτε τις εξισώσεις αντίδρασης.
Στόχοι:
- Οι μαθητές πρέπει να αποκτήσουν γνώσεις σχετικά με τις αντιδράσεις ανταλλαγής ιόντων και τις συνθήκες υπό τις οποίες συμβαίνουν.
- να συνεχίσει να αναπτύσσει τις δεξιότητες σύνταξης εξισώσεων διαχωρισμών ουσιών.
- εργαστείτε με τον πίνακα διαλυτότητας.
- ανάπτυξη λογικής σκέψης κατά την αναγνώριση ηλεκτρολυτών και μη ηλεκτρολυτών, σύγκριση, παρατήρηση. ανάπτυξη πρακτικών δεξιοτήτων και ικανοτήτων, εξαγωγή συμπερασμάτων.
- γράψτε τις εξισώσεις αντίδρασης σε μοριακή, πλήρη ιοντική και ανηγμένη ιοντική μορφή.
Μέθοδοι και μεθοδολογικές τεχνικές:λεκτική-οπτική, ευρετική, ομαδική μετωπική εργαστηριακή εργασία.
Εξοπλισμός:
- στα θρανία των μαθητών: H 2 SO 4, BaCl 2, Na 2 CO 3, φαινολοφθαλεΐνη, NaOH, 4 σύριγγες, δισκίο, πίνακας διαλυτότητας, πίνακας για συμπλήρωση.
- στον δάσκαλο: H 2 SO 4, BaCl 2, Na 2 CO 3, φαινολοφθαλεΐνη, NaOH, 3 δοκιμαστικοί σωλήνες, σε 2 δοχεία: σόδα και αλάτι, νερό, οξικό οξύ.
Κατά τη διάρκεια των μαθημάτων
1. Οργανωτική στιγμή.
2. Ορισμός στόχου.
Δάσκαλος. Παιδιά, φανταστείτε ότι στην κουζίνα σας υπάρχουν αλάτι και σόδα σε 2 πανομοιότυπα βάζα χωρίς ετικέτες. Πώς μπορείτε να αναγνωρίσετε αυτές τις δύο ουσίες χωρίς να τις δοκιμάσετε;
Δάσκαλος. Για να το μάθουμε, πρέπει να εξοικειωθούμε με τις αντιδράσεις ανταλλαγής ιόντων, να προσδιορίσουμε τις συνθήκες για την εμφάνισή τους και να μάθουμε να γράφουμε πλήρεις, συντομευμένες ιοντικές εξισώσεις. Για να κατανοήσουμε καλύτερα τον μηχανισμό των αντιδράσεων ανταλλαγής ιόντων, ας θυμηθούμε ποιες ουσίες ονομάζονται ηλεκτρολύτες.
Μαθητης σχολειου. Οι ηλεκτρολύτες είναι ουσίες που μεταφέρουν ηλεκτρικό ρεύμα σε τήγματα και διαλύματα.
Δάσκαλος. Γιατί οι ηλεκτρολύτες σε διαλύματα και τήγματα άγουν ηλεκτρικό ρεύμα;
Μαθητης σχολειου. Οι ηλεκτρολύτες αγώγουν ηλεκτρισμό επειδή τα ιόντα σχηματίζονται σε διαλύματα και λιώνουν.
Δάσκαλος. Τι είναι η ηλεκτρολυτική διάσταση;
Μαθητης σχολειου. Η διαδικασία διάσπασης του ηλεκτρολύτη σε ιόντα ονομάζεται ηλεκτρολυτική διάσταση.
Δάσκαλος. Ας γράψουμε τις εξισώσεις διάστασης για διάφορες ουσίες. (3 μαθητές δουλεύουν τις κάρτες στον πίνακα):
- Κάρτα Νο 1. Να γράψετε συνοπτικές εξισώσεις διάστασης για ουσίες: H 2 SO 4, HCl.
- Χάρτης Νο 2. Να γράψετε τις συνολικές εξισώσεις διάστασης για τις ουσίες: Na 2 CO 3, BaCl 2.
- Κάρτα Νο. 3. Γράψτε τις ολικές εξισώσεις διάστασης για ουσίες: NaOH, Ba(OH) 2
Δάσκαλος. Ανάθεση τάξης: επιλέξτε ηλεκτρολύτες και μη ηλεκτρολύτες από αυτήν τη λίστα ουσιών.
KCl, CuO, CuSO 4, Cu(OH) 2, BaSO 4, K 2 SO 4. (από φύλλο).
Για ηλεκτρολύτες, γράψτε συνοπτικές εξισώσεις διάστασης. (στον μαυροπίνακα).
Δάσκαλος. Ας ελέγξουμε τις σημειώσεις στον πίνακα.
Δάσκαλος. Παιδιά, ονομάστε από ποια ιόντα σχηματίζεται η αδιάλυτη ουσία BaSO 4;
Μαθητης σχολειου. Το θειικό βάριο σχηματίζεται από ιόντα βαρίου και θειικά ιόντα.
Δάσκαλος. Ονομάστε τις ουσίες, χρησιμοποιώντας τον πίνακα διαλυτότητας, των οποίων τα διαλύματα περιέχουν το ιόν Ba 2+ και SO 4 2- ;
Μαθητης σχολειου. Για παράδειγμα, χλωριούχο βάριο και θειικό οξύ.
Δάσκαλος. Ας γράψουμε την εξίσωση για την αντίδραση μεταξύ H 2 SO 4 και BaCl 2 (μαθητής στον πίνακα).
BaCl2 + H2SO4 = BaSO4 + 2HCl
Δάσκαλος. Οι αντιδράσεις που συμβαίνουν σε διαλύματα ηλεκτρολυτών ονομάζονται αντιδράσεις ανταλλαγής ιόντων. Για να μάθουμε υπό ποιες συνθήκες συμβαίνουν αντιδράσεις ανταλλαγής ιόντων, ας κάνουμε εργαστηριακή εργασία:
Σκοπός: Να εξοικειωθούν με τις συνθήκες για τέτοιες αντιδράσεις. (γράψτε στο σημειωματάριο)
Εμπειρία Νο. 1.Απόκτηση BaSO 4. (αντί για εμπειρία, μπορείτε να χρησιμοποιήσετε ένα απόσπασμα μαθήματος από το «εικονικό σχολείο Κυρίλλου και Μεθοδίου» μάθημα 9ης τάξης Νο. 6)
Ο δάσκαλος κάνει το ίδιο στον πίνακα.
Ο δάσκαλος σχολιάζει: προσθέστε ένα διάλυμα H 2 SO 4 στο διάλυμα BaCl 2. Τι παρατηρούμε;
Μαθητής: Έπεσε ένα λευκό ίζημα.
Δάσκαλος: Ας γράψουμε την πλήρη ιοντική εξίσωση· γι' αυτό γράφουμε ποια ιόντα υπήρχαν στα διαλύματα των ληφθέντων ουσιών και ποιες ουσίες σχηματίστηκαν.
2H 1+ + SO 4 2- + Ba 2+ +2Cl 1- - > BaSO 4v + 2H 1+ +2Cl 1-
Αυτή είναι η πλήρης ιοντική εξίσωση.
Αν μειώσουμε τη δεξιά και την αριστερή πλευρά της εξίσωσης με πανομοιότυπα ιόντα, παίρνουμε τη συντομευμένη ιοντική εξίσωση.
SO 4 2- + Ba 2+ -> BaSO 4v
Συζήτηση:
Ερωτήσεις για την τάξη:
- Ποια ιόντα περιείχαν το διάλυμα πριν την αντίδραση;
- Ποια ιόντα παρέμειναν σε διάλυμα μετά την αντίδραση;
- Ποια είναι η ουσία αυτών των αντιδράσεων;
Συζήτηση με την τάξη: συζητάμε ότι η ουσία της αντίδρασης είναι ότι έγινε η δέσμευση των ιόντων Ba 2+ και SO 4 2-.
Αυτή η εξίσωση δείχνει την ουσία αυτής της αντίδρασης.
Εμπειρία Νο 2.Λήψη διοξειδίου του άνθρακα.
Ο δάσκαλος σχολιάζει: προσθέστε ένα διάλυμα H 2 SO 4 στο διάλυμα Na 2 CO 3. (1 μαθητής γράφει την αντίδραση στον πίνακα)
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + H 2 O + CO 2
Τι βλέπουμε;
Μαθητής: Απελευθέρωση φυσαλίδων αερίου.
Ο δάσκαλος καταγράφει την πλήρη ιοντική εξίσωση και τη συντομευμένη ιοντική εξίσωση.
2Na 1+ +CO 3 2- +2H 1+ +SO 4 2- - >2Na 1+ + SO 4 2- + H 2 O+ CO 2
CO 3 2- +2H 1+ -> H 2 O + CO 2
Εμπειρία Νο 3.Σχηματισμός Η 2 Ο (ουσία χαμηλής διάστασης).
Ο δάσκαλος σχολιάζει: προσθέστε 1-2 σταγόνες φθαλεΐνης φαινόλης στο διάλυμα NaOH, το διάλυμα γίνεται κατακόκκινο, προσθέστε H 2 SO 4. (1 μαθητής γράφει την αντίδραση στον πίνακα)
2 NaOH + H 2 SO 4 = Na 2 SO 4 + 2 H 2 O
Τι βλέπουμε;
Μαθητης σχολειου. Το διάλυμα έγινε άχρωμο.
Δάσκαλος. Ας γράψουμε την πλήρη ιοντική εξίσωση και τη συντομευμένη ιοντική εξίσωση στον πίνακα (1 μαθητής).
2Na 1+ +2OH 1- +2H 1+ + SO 4 2- ->2Na 1+ + SO 4 2- + 2H 2 O
2OH 1- +2H 1+ ->2H2O
| Συνθήκες αντίδρασης Μεταξύ διαλυμάτων ηλεκτρολυτών (συμπληρώνεται από τον μαθητή). |
Παραδείγματα αντιδράσεων ανταλλαγής ιόντων. |
| 1. | Na 2 CO 3 +CaCl 2 =CaCO 3 +2NaCl 2Na + + CO 3 2- +Ca 2+ + 2Cl - = CaCO 3 +2Na + + 2Cl - Ca 2+ + CO 3 2- = CaCO 3 |
| 2. | K 2 CO 3 + 2 HCl = 2 KCl + H 2 O + CO 2 2K + + CO 3 2- +2H + +2Cl - =2K + +2Cl - +H 2 O+CO 2 CO 3 2- +2H + = CO 2 ^+H 2 O |
| 3. | NaOH+HNO 3 = NaNO 3 + H 2 O Na + +OH - +H + +NO 3 =Na + +NO 3 - + H 2 O H + + OH - =H 2 O |
Δάσκαλος: Παιδιά, πραγματοποιήσαμε αντιδράσεις ανταλλαγής ιόντων. Ας καταλήξουμε: κάτω από ποιες συνθήκες ολοκληρώνονται οι αντιδράσεις ανταλλαγής ιόντων; (συμπληρώστε τους πίνακες που παρέχονται)
Μαθητης σχολειου:Οι αντιδράσεις ανταλλαγής ιόντων ολοκληρώνονται εάν, ως αποτέλεσμα, σχηματίζεται ίζημα, απελευθερώνεται ένα αέριο και σχηματίζεται μια ουσία κακής διάσπασης, όπως το νερό.
Δάσκαλος: Ας επιστρέψουμε στο πρόβλημά μας. Προτείνετε μια μέθοδο για την αναγνώριση του αλατιού (NaCl) και της σόδας (Na 2 CO 3).
Μαθητής: Πρέπει να προσθέσετε οξύ σε αυτές τις ουσίες. Σε ποιο δοχείο θα παρατηρηθεί η έκλυση αερίου, θα υπάρχει σόδα.
Διόρθωση του υλικού:
Εργασία στον πίνακα: 1 Επιλέξτε από αυτή τη λίστα τις αντιδράσεις που καταλήγουν στο τέλος (ένας μαθητής)
NaOH+ NaCl -> NaCl+ H 2 O
AgNO 3 + NaCl ->NaNO 3 + AgCl
CuCl 2 +2NaOH ->Cu(OH) 2 +2NaCl
KNO 3 +LiCl ->KCl+LiNO 3
Δεδομένος:
Πλήρης ιοντική εξίσωση.
Fe 3+ +3Cl - +3Na + +3OH - = Fe(OH) 3 +3Na + +3Cl -
Να γράψετε αναλόγως τις μοριακές και συντομευμένες ιοντικές εξισώσεις.
Δάσκαλος.Ας συνοψίσουμε το μάθημά μας: Με ποιες αντιδράσεις γνωρίσαμε στο μάθημα;
Μαθητης σχολειου.Μάθαμε για τις αντιδράσεις ανταλλαγής ιόντων.
Δάσκαλος. Κάτω από ποιες συνθήκες είναι δυνατόν αυτές οι αντιδράσεις να προχωρήσουν στην ολοκλήρωση;
Μαθητης σχολειου. Οι αντιδράσεις ανταλλαγής ιόντων ολοκληρώνονται εάν σχηματιστεί ίζημα, απελευθερωθεί ένα αέριο και σχηματιστεί μια ελαφρώς διασπώμενη ουσία.
Δάσκαλος. Εργασία για το σπίτι: §37 άσκηση. 4, 5.
Βιβλιογραφία.
- Gabrielyan O.S. Χημεία. 8η τάξη: Bustard, 1999.
- «Εικονικό Σχολείο Κυρίλλου και Μεθοδίου» Μαθήματα Χημείας 8-9 τάξεις, 2004.
Το προτεινόμενο υλικό παρουσιάζει μεθοδολογικές εξελίξεις πρακτικής εργασίας για την 9η τάξη: «Επίλυση πειραματικών προβλημάτων με θέμα «Άζωτο και φώσφορος», «Προσδιορισμός ορυκτών λιπασμάτων», καθώς και εργαστηριακά πειράματα με θέμα «Αντιδράσεις ανταλλαγής διαλυμάτων ηλεκτρολυτών».
Αντιδράσεις ανταλλαγής μεταξύ διαλυμάτων ηλεκτρολυτών
Η μεθοδολογική ανάπτυξη αποτελείται από τρία μέρη: θεωρία, εργαστήριο, έλεγχος. Το θεωρητικό μέρος παρέχει μερικά παραδείγματα μοριακών, πλήρων και συντομευμένων ιοντικών εξισώσεων χημικών αντιδράσεων που συμβαίνουν με το σχηματισμό ενός ιζήματος, μιας ελαφρώς διασπώμενης ουσίας και την απελευθέρωση αερίου. Το πρακτικό μέρος περιέχει εργασίες και συστάσεις για τους μαθητές σχετικά με τον τρόπο εκτέλεσης εργαστηριακών πειραμάτων. Ο έλεγχος αποτελείται από δοκιμαστικές εργασίες με την επιλογή της σωστής απάντησης.
Θεωρία
1. Αντιδράσεις που οδηγούν στο σχηματισμό ιζήματος.
α) Όταν ο θειικός χαλκός (II) αντιδρά με το υδροξείδιο του νατρίου, σχηματίζεται ένα μπλε ίζημα υδροξειδίου του χαλκού (II).
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4.
Cu 2+ + + 2Na + + 2OH – = Cu(OH) 2 + 2Na + +,
Cu 2+ + 2OH – = Cu(OH) 2.
β) Όταν το χλωριούχο βάριο αντιδρά με το θειικό νάτριο, κατακρημνίζεται ένα λευκό γαλακτώδες ίζημα θειικού βαρίου.
Μοριακή εξίσωση μιας χημικής αντίδρασης:
BaCl 2 + Na 2 SO 4 = 2 NaCl + BaSO 4.
Πλήρεις και συντομευμένες εξισώσεις ιοντικής αντίδρασης:
Ba 2+ + 2Cl – + 2Na + + = 2Na + + 2Cl – + BaSO 4,
Ba 2+ + = BaSO 4 .
2.
Όταν το ανθρακικό ή διττανθρακικό νάτριο (μαγειρική σόδα) αλληλεπιδρά με υδροχλωρικό ή άλλο διαλυτό οξύ, παρατηρείται βρασμός ή έντονη απελευθέρωση φυσαλίδων αερίου. Αυτό απελευθερώνει διοξείδιο του άνθρακα CO 2, προκαλώντας θόλωση στο διαυγές διάλυμα ασβεστόνερου (υδροξείδιο του ασβεστίου). Το ασβεστόνερο γίνεται θολό γιατί... σχηματίζεται αδιάλυτο ανθρακικό ασβέστιο.
α) Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2;
β) NaHC03 + HCl = NaCl + CO 2 + H 2 O;
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O.
α) 2Na + + + 2H + + 2Cl – = 2Na + + 2Cl – + CO 2 + H 2 O,
2Η + = CO2 + Η2Ο;
β) Na + + + H + + Cl – = Na + + Cl – + CO 2 + H 2 O,
H + = CO 2 + H 2 O.
3. Αντιδράσεις που συμβαίνουν με το σχηματισμό μιας ελαφρώς διασπώμενης ουσίας.
Όταν το υδροξείδιο του νατρίου ή του καλίου αντιδρά με υδροχλωρικό οξύ ή άλλα διαλυτά οξέα παρουσία του δείκτη φαινολοφθαλεΐνης, το αλκαλικό διάλυμα γίνεται άχρωμο και ως αποτέλεσμα της αντίδρασης εξουδετέρωσης, σχηματίζεται μια ουσία χαμηλής διάστασης H 2 O.
Μοριακές εξισώσεις χημικών αντιδράσεων:
α) NaOH + HCl = NaCl + H 2 O;
γ) 3KOH + H 3 PO 4 = K 3 PO 4 + 3H 2 O.
Πλήρεις και συντομευμένες εξισώσεις ιοντικής αντίδρασης:
α) Na + + OH – + H + + Cl – = Na + + Cl – + H 2 O,
OH – + H + = H 2 O;
β) 2Na + + 2OH – + 2H + + = 2Na + + + 2H 2 O,
2OH – + 2H + = 2H 2 O;
γ) 3K + + 3OH – +3H + + = 3K + + + 3H 2 O,
3OH – + 3H + = 3H 2 O.
ΕΡΓΑΣΤΗΡΙ
1. Αντιδράσεις ανταλλαγής μεταξύ διαλυμάτων ηλεκτρολυτών που οδηγούν στο σχηματισμό ιζήματος.
α) Πραγματοποιήστε αντίδραση μεταξύ διαλυμάτων θειικού χαλκού(II) και υδροξειδίου του νατρίου. Να γράψετε μοριακές, πλήρεις και συντομευμένες ιοντικές εξισώσεις χημικών αντιδράσεων, σημειώστε τα σημάδια μιας χημικής αντίδρασης.
β) Πραγματοποιήστε αντίδραση μεταξύ διαλυμάτων χλωριούχου βαρίου και θειικού νατρίου. Να γράψετε μοριακές, πλήρεις και συντομευμένες ιοντικές εξισώσεις χημικών αντιδράσεων, σημειώστε τα σημάδια μιας χημικής αντίδρασης.
2. Αντιδράσεις που περιλαμβάνουν την απελευθέρωση αερίου.
Εκτελέστε αντιδράσεις μεταξύ διαλυμάτων ανθρακικού νατρίου ή διττανθρακικού νατρίου (μαγειρική σόδα) με υδροχλωρικό ή άλλο διαλυτό οξύ. Περάστε το απελευθερωμένο αέριο (χρησιμοποιώντας ένα σωλήνα εξόδου αερίου) μέσα από διαυγές ασβεστόνερο που χύνεται σε άλλο δοκιμαστικό σωλήνα μέχρι να γίνει θολό. Να γράψετε μοριακές, πλήρεις και συντομευμένες ιοντικές εξισώσεις χημικών αντιδράσεων, σημειώστε τα σημεία αυτών των αντιδράσεων.
3. Αντιδράσεις που συμβαίνουν με το σχηματισμό μιας ελαφρώς διασπώμενης ουσίας.
Πραγματοποιήστε αντιδράσεις εξουδετέρωσης μεταξύ ενός αλκαλίου (NaOH ή KOH) και ενός οξέος (HCl, HNO 3 ή H 2 SO 4), αφού τοποθετήσετε φαινολοφθαλεΐνη στο αλκαλικό διάλυμα. Σημειώστε παρατηρήσεις και γράψτε μοριακές, πλήρεις και συντομευμένες ιοντικές εξισώσεις για χημικές αντιδράσεις.
Σημάδια, που συνοδεύει αυτές τις αντιδράσεις, μπορεί να επιλεγεί από την ακόλουθη λίστα:
1) απελευθέρωση φυσαλίδων αερίου. 2) καθίζηση? 3) η εμφάνιση της οσμής? 4) διάλυση του ιζήματος. 5) απελευθέρωση θερμότητας? 6) αλλαγή στο χρώμα του διαλύματος.
Έλεγχος (δοκιμή)
1. Η ιοντική εξίσωση για την αντίδραση που παράγει το μπλε ίζημα είναι:
α) Cu 2+ + 2OH – = Cu(OH) 2;
γ) Fe 3+ + 3OH – = Fe(OH) 3;
δ) Al 3+ + 3OH – = Al(OH) 3.
2. Η ιοντική εξίσωση για την αντίδραση στην οποία απελευθερώνεται διοξείδιο του άνθρακα είναι:
α) CaCO 3 + CO 2 + H 2 O = Ca 2 + +;
β) 2H + + SO 2- 3 = H 2 O + SO 2;
γ) CO 2- 3 + 2H + = CO 2 + H 2 O;
δ) 2Η + + 2ΟΗ – = 2Η 2 Ο.
3. Η ιοντική εξίσωση για την αντίδραση στην οποία σχηματίζεται μια ουσία χαμηλής διάστασης είναι:
α) Ag + + Cl – = AgCl;
β) OH – + H + = H 2 O;
γ) Zn + 2H + = Zn 2+ + H2;
δ) Fe 3+ + 3OH – = Fe(OH) 3.
4. Η ιοντική εξίσωση για την αντίδραση που παράγει το λευκό ίζημα είναι:
α) Cu 2+ + 2OH – = Cu(OH) 2;
β) CuO + 2H + = Cu 2+ + H2O;
γ) Fe 3+ + 3OH – = Fe(OH) 3;
δ) Ba 2+ + SO 2- 4 = BaSO 4 .
5. Η μοριακή εξίσωση που αντιστοιχεί στη συντομευμένη ιοντική εξίσωση για την αντίδραση 3OH – + 3H + = 3H 2 O είναι:
α) NaOH + HCl = NaCl + H 2 O;
β) 2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O;
γ) 3KOH + H 3 PO 4 = K 3 PO 4 + 3H 2 O;
δ) Ba(OH) 2 + 2HCl = BaCl 2 + H 2 O.
6. Μοριακή εξίσωση που αντιστοιχεί στη συντομευμένη εξίσωση ιοντικής αντίδρασης
H + + = H 2 O + CO 2, -
α) MgCO 3 + 2HCl = MgCl 2 + CO 2 + H 2 O;
β) Na 2 CO 3 + 2HCl = 2NaCl + CO 2 + H 2 O;
γ) NaHC03 + HCl = NaCl + CO 2 + H 2 O;
δ) Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O.
| Απαντήσεις. 1 -ΕΝΑ; 2 -V; 3 -σι; 4 -ΣΟΛ; 5 -V; 6 -V. |
Επίλυση πειραματικών προβλημάτων με θέμα «Άζωτο και φώσφορος»
Όταν μελετούν νέο υλικό για το θέμα «Άζωτο και Φώσφορος», οι μαθητές εκτελούν μια σειρά πειραμάτων που σχετίζονται με την παραγωγή αμμωνίας, τον προσδιορισμό νιτρικών, φωσφορικών αλάτων και αλάτων αμμωνίου και αποκτούν ορισμένες δεξιότητες και ικανότητες. Αυτή η μεθοδολογική ανάπτυξη περιλαμβάνει έξι εργασίες. Για να ολοκληρωθεί η πρακτική εργασία, αρκούν τρεις εργασίες: μία για την απόκτηση μιας ουσίας, δύο για την αναγνώριση ουσιών. Κατά την εκτέλεση πρακτικής εργασίας, μπορούν να προσφερθούν στους μαθητές εργασίες με μια μορφή που θα τους διευκολύνει να προετοιμάσουν μια έκθεση (βλ. εργασίες 1, 2). (Οι απαντήσεις δίνονται για τον δάσκαλο.)
Ασκηση 1
Αποκτήστε αμμωνία και αποδείξτε πειραματικά την παρουσία της.
α) Παραγωγή αμμωνίας.
Θερμάνετε ένα μείγμα ίσου όγκου μερίδων στερεού χλωριούχου αμμωνίου και σκόνης υδροξειδίου του ασβεστίου σε δοκιμαστικό σωλήνα με σωλήνα εξόδου αερίου. Σε αυτή την περίπτωση, θα απελευθερωθεί αμμωνία, η οποία πρέπει να συλλεχθεί σε άλλο ξηρό δοκιμαστικό σωλήνα που βρίσκεται με τρύπα ............ ( Γιατί;).
Να γράψετε την εξίσωση αντίδρασης για την παραγωγή αμμωνίας.
…………………………………………………..
β) Προσδιορισμός αμμωνίας.
Μπορεί να αναγνωριστεί από τη μυρωδιά………… (ονομασία ουσίας), καθώς και από αλλαγές στο χρώμα της λακκούβας ή της φαινολοφθαλεΐνης. Όταν η αμμωνία διαλύεται στο νερό, σχηματίζεται ....... (όνομα βάσης), άρα η λυδία λίθος...... (καθορίστε το χρώμα)και η άχρωμη φαινολοφθαλεΐνη γίνεται …………. (καθορίστε το χρώμα).
Αντί για τελείες, εισάγετε λέξεις σύμφωνα με τη σημασία τους. Γράψτε την εξίσωση της αντίδρασης.
…………………………………………………..


* Η αμμωνία, ένα υδατικό διάλυμα αμμωνίας, μυρίζει σαν αμμωνία. – Σημείωση εκδ.
Εργασία 2
Παρασκευάστε τον νιτρικό χαλκό με δύο διαφορετικούς τρόπους, έχοντας τις ακόλουθες ουσίες διαθέσιμες: συμπυκνωμένο νιτρικό οξύ, ρινίσματα χαλκού, θειικός χαλκός(II), υδροξείδιο του νατρίου. Να γράψετε εξισώσεις για τις χημικές αντιδράσεις σε μοριακή μορφή και να σημειώσετε τις αλλαγές. Στη μέθοδο 1, για μια αντίδραση οξειδοαναγωγής, γράψτε τις εξισώσεις ισοζυγίου ηλεκτρονίων, προσδιορίστε τον οξειδωτικό και τον αναγωγικό παράγοντα. Στη μέθοδο 2, γράψτε τις συντομευμένες εξισώσεις ιοντικής αντίδρασης.
1ο s p o s o b. Χαλκός + νιτρικό οξύ. Θερμάνετε ελαφρά το περιεχόμενο του δοκιμαστικού σωλήνα. Το άχρωμο διάλυμα γίνεται….. (καθορίστε το χρώμα), επειδή σχηματίζεται….. (ονομασία ουσίας); απελευθερώνεται αέριο……..χρωματισμένο με δυσάρεστη οσμή, αυτό είναι……. (ονομασία ουσίας).
2ο s p o s o b. Όταν ο θειικός χαλκός(II) αντιδρά με το υδροξείδιο του νατρίου, προκύπτει ένα ίζημα ..... χρώματος, αυτό είναι ...... (ονομασία ουσίας). Προσθέστε νιτρικό οξύ σε αυτό μέχρι να διαλυθεί πλήρως το ίζημα......... (όνομα του ιζήματος). Σχηματίζεται ένα διαυγές μπλε διάλυμα...... (όνομα αλατιού).


Εργασία 3
Αποδείξτε πειραματικά ότι το θειικό αμμώνιο περιέχει ιόντα NH 4 + και SO 2- 4. Σημειώστε τις παρατηρήσεις και γράψτε μοριακές και συντομευμένες ιοντικές εξισώσεις για τις αντιδράσεις.


Εργασία 4
Πώς να προσδιορίσετε πειραματικά την παρουσία διαλυμάτων ορθοφωσφορικού νατρίου, χλωριούχου νατρίου, νιτρικού νατρίου στους δοκιμαστικούς σωλήνες Νο. 1, Νο. 2, Νο. 3; Σημειώστε τις παρατηρήσεις και γράψτε μοριακές και συντομευμένες ιοντικές εξισώσεις για τις αντιδράσεις.

Εργασία 5
Έχοντας τις ακόλουθες ουσίες: νιτρικό οξύ, ρινίσματα χαλκού ή σύρμα, χαρτί γενικής χρήσης ή μεθυλοπορτοκάλι, αποδεικνύουν πειραματικά τη σύνθεση του νιτρικού οξέος. Να γράψετε την εξίσωση για τη διάσταση του νιτρικού οξέος. μοριακή εξίσωση για την αντίδραση χαλκού με συμπυκνωμένο νιτρικό οξύ και εξισώσεις ισοζυγίου ηλεκτρονίων, ταυτοποιήστε τον οξειδωτικό και τον αναγωγικό παράγοντα.

Εργασία 6
Παρασκευάστε ένα διάλυμα νιτρικού χαλκού με διάφορους τρόπους, με τις ουσίες: νιτρικό οξύ, οξείδιο του χαλκού, βασικό ανθρακικό χαλκό ή ανθρακικό υδροξυχαλκό(II). Να γράψετε μοριακές, πλήρεις και συντομευμένες ιοντικές εξισώσεις για χημικές αντιδράσεις. Σημειώστε σημάδια χημικών αντιδράσεων.


Δοκιμές αναφοράς
1. Δώστε την εξίσωση αντίδρασης όπου σχηματίζεται κίτρινο ίζημα.

2. Η ιοντική εξίσωση της αντίδρασης κατά την οποία σχηματίζεται το λευκό τυρί ίζημα είναι:

3. Για να αποδείξετε την παρουσία νιτρικών ιόντων στα νιτρικά, πρέπει να λάβετε:
α) υδροχλωρικό οξύ και ψευδάργυρος.
β) θειικό οξύ και χλωριούχο νάτριο.
γ) θειικό οξύ και χαλκό.
4. Το αντιδραστήριο για τα ιόντα χλωρίου είναι:
α) χαλκός και θειικό οξύ.
β) νιτρικός άργυρος.
γ) χλωριούχο βάριο.
5. Στην εξίσωση αντίδρασης, το διάγραμμα της οποίας
HNO 3 + Cu -> Cu(NO 3) 2 + NO 2 + H 2 O,
Πριν από τον οξειδωτικό παράγοντα πρέπει να βάλετε τον συντελεστή:
Α2; β) 4; στις 6.
6. Τα βασικά και όξινα άλατα αντιστοιχούν στα ζεύγη:
α) Cu(OH) 2, Mg(HCO3) 2;
β) Cu(NO 3) 2, HNO 3;
γ) 2 CO 3, Ca(HCO 3) 2.
|
Απαντήσεις. 1 -ΕΝΑ; 2 -σι; 3 -V; 4 -σι; 5 -σι; 6 -V. |
Προσδιορισμός ορυκτών λιπασμάτων
Η μεθοδολογική ανάπτυξη αυτής της πρακτικής εργασίας αποτελείται από τρία μέρη: θεωρία, εργαστήριο, έλεγχος. Το θεωρητικό μέρος παρέχει γενικές πληροφορίες για τον ποιοτικό προσδιορισμό κατιόντων και ανιόντων που περιλαμβάνονται στα ορυκτά λιπάσματα. Το εργαστήριο παρέχει παραδείγματα επτά ορυκτών λιπασμάτων με περιγραφή των χαρακτηριστικών τους χαρακτηριστικών και επίσης δίνει εξισώσεις για ποιοτικές αντιδράσεις. Στο κείμενο, αντί για τελείες και ερωτηματικά, πρέπει να εισαγάγετε απαντήσεις που είναι κατάλληλες ως προς το νόημα. Για να ολοκληρωθεί η πρακτική εργασία κατά την κρίση του δασκάλου, αρκεί να ληφθούν τέσσερα λιπάσματα. Ο έλεγχος των γνώσεων των μαθητών αποτελείται από δοκιμαστικές εργασίες για τον προσδιορισμό των τύπων λιπασμάτων, οι οποίες δίνονται σε αυτήν την πρακτική εργασία.
Θεωρία
1. Το αντιδραστήριο για τα ιόντα χλωρίου είναι ο νιτρικός άργυρος. Η αντίδραση προχωρά με το σχηματισμό ενός λευκού τυρώδους ιζήματος:
Ag + + Cl – = AgCl.
2. Το ιόν αμμωνίου μπορεί να ανιχνευθεί χρησιμοποιώντας αλκάλια. Όταν ένα διάλυμα άλατος αμμωνίου θερμαίνεται με ένα αλκαλικό διάλυμα, απελευθερώνεται αμμωνία, η οποία έχει μια έντονη χαρακτηριστική οσμή:
NH + 4 + OH – = NH 3 + H 2 O.
Μπορείτε επίσης να χρησιμοποιήσετε κόκκινο χαρτί λακκούβας βρεγμένο με νερό, γενικό δείκτη ή λωρίδα χαρτιού φαινολοφθαλεΐνης για τον προσδιορισμό του ιόντος αμμωνίου. Το κομμάτι χαρτί πρέπει να συγκρατείται πάνω από τους ατμούς που απελευθερώνονται από τον δοκιμαστικό σωλήνα. Η κόκκινη λίθος γίνεται μπλε, ο γενικός δείκτης γίνεται μωβ και η φαινολοφθαλεΐνη γίνεται κατακόκκινη.
3. Για τον προσδιορισμό των νιτρικών ιόντων, ρινίσματα ή τεμάχια χαλκού προστίθενται στο διάλυμα άλατος, στη συνέχεια προστίθεται πυκνό θειικό οξύ και θερμαίνεται. Μετά από κάποιο χρονικό διάστημα, αρχίζει να απελευθερώνεται ένα καφέ αέριο με δυσάρεστη οσμή. Η απελευθέρωση καφέ αερίου NO2 υποδηλώνει την παρουσία ιόντων.
Για παράδειγμα:
NaNO 3 + H 2 SO 4 NaHSO 4 + HNO 3,
4HNO 3 + Cu = Cu(NO 3) 2 + 2NO 2 + 2H 2 O.
4. Το αντιδραστήριο για το φωσφορικό ιόν είναι ο νιτρικός άργυρος. Όταν προστίθεται σε διάλυμα φωσφορικού, κατακρημνίζεται ένα κίτρινο ίζημα φωσφορικού αργύρου:
3Ag + + PO 3- 4 = Ag 3 PO 4.
5. Το αντιδραστήριο για το θειικό ιόν είναι το χλωριούχο βάριο. Ένα λευκό γαλακτώδες ίζημα θειικού βαρίου, αδιάλυτο σε οξικό οξύ, καθιζάνει:
Ba 2+ + SO 2- 4 = BaSO 4 .
ΕΡΓΑΣΤΗΡΙ
1. Συλβινίτης (NaCl KCl), ροζ κρύσταλλοι, καλή διαλυτότητα στο νερό. Η φλόγα κιτρινίζει. Όταν βλέπετε τη φλόγα μέσα από μπλε γυαλί, παρατηρείται ένα ιώδες χρώμα. ΜΕ …….. (όνομα αντιδραστηρίου)δίνει λευκό ίζημα...... (όνομα αλατιού).
KCl + ? -> KNO 3 + AgCl.
2. Νιτρικό αμμώνιο NH 4 NO 3, ή…….. (όνομα λιπάσματος), λευκοί κρύσταλλοι, πολύ διαλυτοί στο νερό. Το καφέ αέριο απελευθερώνεται με θειικό οξύ και χαλκό... (ονομασία ουσίας). Με λύση……. (όνομα αντιδραστηρίου)Όταν θερμαίνεται, η μυρωδιά της αμμωνίας γίνεται αισθητή, ο ατμός της μετατρέπει την κόκκινη λακκούβα σε....... χρώμα.
NH 4 NO 3 + H 2 SO 4 NH 4 HSO 4 + HNO 3,
HNO 3 + Cu -> Cu(NO 3) 2 + ? + ? .
NH 4 NO 3 + ? -> NH 3 + H 2 O + NaNO 3.
3. Νιτρικό κάλιο (KNO 3), ή…… (όνομα λιπάσματος), με H 2 SO 4 και ……… (ονομασία ουσίας)παράγει καφέ αέριο. Η φλόγα γίνεται μοβ.
KNO 3 + H 2 SO 4 KHSO 4 + HNO 3,
4HNO 3 + ? -> Cu(NO 3) 2 + ? + 2Η2Ο.
4. Χλωριούχο αμμώνιο NH 4 Cl με διάλυμα……. (όνομα αντιδραστηρίου)Όταν θερμαίνεται, σχηματίζει αμμωνία, οι ατμοί του γίνονται κόκκινος μπλε λακκούβας. ΜΕ …… (όνομα του ανιόντος αντιδραστηρίου)το ασήμι δίνει ένα λευκό τυρώδες ίζημα...... (όνομα του ιζήματος).
NH 4 Cl + ? = NH 4 NO 3 + AgCl,
NH 4 Cl + ? = NH 3 + H 2 O + NaCl.
5. Όταν θερμαίνεται, το θειικό αμμώνιο (NH 4) 2 SO 4 με ένα αλκαλικό διάλυμα σχηματίζει αμμωνία· ο ατμός του γίνεται κόκκινος μπλε λακκούβας. ΜΕ …….. (όνομα αντιδραστηρίου)δίνει ένα λευκό γαλακτώδες ίζημα......... (όνομα του ιζήματος).
(NH 4) 2 SO 4 + 2NaOH = 2NH 3 + 2H 2 O + ? ,
(NH 4) 2 SO 4 + ? -> NH 4 Cl + ? .
6. Νιτρικό νάτριο NaNO 3 ή…… (όνομα λιπάσματος), λευκοί κρύσταλλοι, καλή διαλυτότητα στο νερό, παράγει ένα καφέ αέριο με H 2 SO 4 και Cu. Η φλόγα γίνεται κίτρινη.
NaNO 3 + H 2 SO 4 NaHSO 4 + ? ,
Cu -> Cu(NO 3) 2 + ? + 2Η2Ο.
7. Διόξινο φωσφορικό ασβέστιο Ca(H 2 PO 4) 2, ή…… (όνομα λιπάσματος), γκρίζα λεπτόκοκκη σκόνη ή κόκκοι, ελάχιστα διαλυτά στο νερό, με ..... (όνομα αντιδραστηρίου)δίνει ….. (καθορίστε το χρώμα) ίζημα ……… (ονομασία ουσίας) AgH 2 PO 4.
Ca(H 2 PO 4) 2 + ? -> 2AgH 2 PO 4 + Ca(NO 3) 2.

Έλεγχος (δοκιμή)
1. Ροζ κρύσταλλοι, πολύ διαλυτοί στο νερό, χρωματίζουν τη φλόγα κίτρινο. όταν αλληλεπιδρά με AgNO 3, σχηματίζεται ένα λευκό ίζημα - αυτό είναι:
α) Ca(H2PO4)2; β) NaCl KCl;
γ) KNO 3; δ) NH 4 Cl.
2. Οι κρύσταλλοι είναι πολύ διαλυτοί στο νερό. σε αντίδραση με H 2 SO 4 και χαλκό, απελευθερώνεται ένα καφέ αέριο · με ένα αλκαλικό διάλυμα, όταν θερμαίνεται, παράγει αμμωνία, οι ατμοί της οποίας γίνονται κόκκινος μπλε λακκούβας - αυτό είναι:
α) NaNO 3; β) (NH 4) 2 SO 4;
γ) NH 4 NO 3; δ) KNO 3.
3. Ελαφριά κρύσταλλα, πολύ διαλυτά στο νερό. Κατά την αλληλεπίδραση με H 2 SO 4 και Cu, απελευθερώνεται καφέ αέριο. η φλόγα γίνεται μοβ - αυτό είναι:
α) KNO 3; β) NH4H2PO4;
γ) Ca(H2PO4)2 CaS04; δ) NH 4 NO 3.
4. Οι κρύσταλλοι είναι πολύ διαλυτοί στο νερό. με το νιτρικό άργυρο δίνει λευκό ίζημα, με το αλκάλι όταν θερμαίνεται δίνει αμμωνία, οι ατμοί της οποίας γίνονται κόκκινος μπλε λακκούβας - αυτό είναι:
α) (NH 4) 2 SO 4; β) NH4H2PO4;
γ) NaCl KCl; δ) NH 4 Cl.
5. Ελαφριά κρύσταλλα, πολύ διαλυτά στο νερό. με BaCl 2 δίνει ένα λευκό γαλακτώδες ίζημα, με το αλκάλι δίνει αμμωνία, οι ατμοί της οποίας γίνονται κόκκινος μπλε λακκούβας - αυτό είναι:
γ) NH4Cl; δ) NH 4 H 2 PO 4.
6. Ελαφριά κρύσταλλα, πολύ διαλυτά στο νερό. όταν αλληλεπιδρά με H 2 SO 4 και Cu, παράγει ένα καφέ αέριο, η φλόγα γίνεται κίτρινη - αυτό είναι:
α) NH 4 NO 3; β) (NH 4) 2 SO 4;
γ) KNO 3; δ) NaNO 3.
7. Γκρι λεπτόκοκκη σκόνη ή κόκκοι, η διαλυτότητα στο νερό είναι φτωχή, με διάλυμα νιτρικού αργύρου δίνει ένα κίτρινο ίζημα - αυτό είναι:
α) (NH 4) 2 SO 4; β) NaCl KCl;
γ) Ca(H2PO4)2; δ) KNO 3.
| Απαντήσεις. 1 -σι; 2 -V; 3 -ΕΝΑ; 4 -ΣΟΛ; 5 -σι; 6 -ΣΟΛ; 7 -V. |