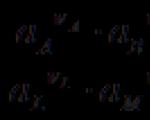इलेक्ट्रोकैमिस्ट्री। गैल्वेनिक सेल इलेक्ट्रोकेमिकल सेल
विद्युतरासायनिक तत्व. वैद्युतवाहक बल। गैल्वेनिक सेल की ऊष्मप्रवैगिकी. ईएमएफ माप।
इलेक्ट्रिक डबल परत, घटना और संरचना का तंत्र।
गैल्वेनिक तत्व। ईएमएफ.
जब विद्युत धारा किसी इलेक्ट्रोलाइट से होकर गुजरती है, तो इलेक्ट्रोड की सतह पर विद्युत रासायनिक प्रतिक्रियाएं होती हैं। विद्युत रासायनिक प्रतिक्रियाओं की घटना बाहरी वर्तमान स्रोत द्वारा उत्पन्न की जा सकती है। विपरीत घटना भी संभव है: इलेक्ट्रोलाइट में डूबे दो इलेक्ट्रोडों पर होने वाली विद्युत रासायनिक प्रतिक्रियाएं विद्युत प्रवाह उत्पन्न करती हैं, और प्रतिक्रियाएं केवल एक बंद सर्किट में होती हैं (जब करंट प्रवाहित होता है)।
इलेक्ट्रोकेमिकल (या गैल्वेनिक) सेल विद्युत रासायनिक प्रतिक्रियाओं के माध्यम से विद्युत धारा उत्पन्न करने के लिए एक उपकरण है। सबसे सरल इलेक्ट्रोकेमिकल तत्व में दो धातु इलेक्ट्रोड (पहली तरह के कंडक्टर) होते हैं, जो एक इलेक्ट्रोलाइट (दूसरे तरह के कंडक्टर) में उतारे जाते हैं और एक धातु संपर्क द्वारा एक दूसरे से जुड़े होते हैं। कई विद्युतरासायनिक तत्व श्रृंखलाबद्ध रूप में जुड़े हुए हैं इलेक्ट्रोकेमिकल सर्किट .
किसी विद्युत रासायनिक तत्व की सबसे महत्वपूर्ण मात्रात्मक विशेषता विद्युत वाहक बल है(ईएमएफ, ई), जो संभावित अंतर के बराबर है सही ढंग से खुला तत्व (जिसमें एक ही सामग्री से बने पहली तरह के कंडक्टर तत्व के अंतिम इलेक्ट्रोड से जुड़े होते हैं)।
यदि, जब विद्युत धारा अलग-अलग दिशाओं में प्रवाहित होती है, तो इलेक्ट्रोड की सतह पर एक ही प्रतिक्रिया होती है, लेकिन विपरीत दिशाओं में, तो ऐसे इलेक्ट्रोड, साथ ही उनसे बने तत्व या सर्किट को कहा जाता है प्रतिवर्ती . प्रतिवर्ती तत्वों का ईएमएफ उनकी थर्मोडायनामिक संपत्ति है, अर्थात। यह केवल टी, पी, इलेक्ट्रोड और समाधान बनाने वाले पदार्थों की प्रकृति और इन समाधानों की एकाग्रता पर निर्भर करता है। उत्क्रमणीय तत्व का एक उदाहरण है डेनियल-जैकोबी तत्व :
(-) Cu çZn çZnSO 4 ççCuSO 4 çCu (+)
जिसमें प्रत्येक इलेक्ट्रोड प्रतिवर्ती है। जब तत्व संचालित होता है, तो निम्नलिखित प्रतिक्रियाएं होती हैं: Zn® Zn 2+ + 2 इ, Cu 2+ + 2 इ® घन. जब किसी बाहरी स्रोत से असीम शक्ति की धारा प्रवाहित की जाती है, तो इलेक्ट्रोड पर विपरीत प्रतिक्रियाएँ होती हैं।
अपरिवर्तनीय तत्व का उदाहरण है वोल्टा तत्व :
(-) Zn ç H 2 SO 4 ç Cu (+)
जब तत्व संचालित होता है, तो निम्नलिखित प्रतिक्रियाएं होती हैं: Zn® Zn 2+ + 2 इ, 2H + + 2 इ® एच 2 . किसी बाहरी स्रोत से करंट प्रवाहित करते समय, इलेक्ट्रोड प्रतिक्रियाएँ होंगी: 2H + + 2 इ® एच 2, सीयू ® सीयू 2+ + 2 इ .
किसी विद्युत रासायनिक तत्व का EMF एक धनात्मक मान है, क्योंकि यह एक निश्चित सहज प्रक्रिया से मेल खाती है जो सकारात्मक कार्य उत्पन्न करती है। विपरीत प्रक्रिया, जो स्वतंत्र रूप से नहीं हो सकती, एक नकारात्मक ईएमएफ के अनुरूप होगी। इलेक्ट्रोकेमिकल तत्वों की एक श्रृंखला बनाते समय, तत्वों में से एक में प्रक्रिया को निर्देशित किया जा सकता है ताकि यह बाहर से काम के व्यय (गैर-सहज प्रक्रिया) के साथ हो, इसके लिए श्रृंखला के दूसरे तत्व के काम का उपयोग किया जा सके। जो एक स्वतःस्फूर्त प्रक्रिया घटित होती है। किसी भी सर्किट का कुल ईएमएफ धनात्मक और ऋणात्मक मात्राओं के बीजगणितीय योग के बराबर होता है। इसलिए, स्वीकृत नियमों का उपयोग करते हुए, सर्किट आरेख लिखते समय ईएमएफ के संकेतों को ध्यान में रखना बहुत महत्वपूर्ण है।
इलेक्ट्रोकेमिकल सर्किट का ईएमएफ सकारात्मक माना जाता है, यदि, सर्किट लिखते समय, दायां इलेक्ट्रोड बाईं ओर के सापेक्ष सकारात्मक रूप से चार्ज होता है (सर्किट के संचालन के दौरान, बाईं ओर लिखे इलेक्ट्रोड से समाधान में धनायन दाईं ओर लिखे इलेक्ट्रोड की ओर गुजरता है, और इलेक्ट्रॉन अंदर चले जाते हैं) बाहरी सर्किट में समान दिशा)। उदाहरण।
गैल्वेनिक सेल के थर्मोडायनामिक्स .
विद्युत रासायनिक प्रणाली में प्रतिक्रिया को विपरीत और समतापीय रूप से आगे बढ़ने दें:
एन ए ए + एन बी बी + ... ± एनएफ Û एन एल एल + एन एम एम + ... ±
तत्व द्वारा उत्पन्न विद्युत ऊर्जा कुल प्रक्रिया के उपयोगी कार्य A¢ के बराबर है। प्रतिवर्ती प्रक्रिया का उपयोगी कार्य A¢ अधिकतम है और P पर, T = स्थिरांक सिस्टम की आइसोबैरिक क्षमता में कमी के बराबर है:
डीजी पी, टी = एनएफई पी, टी
ई पी , टी - सिस्टम का प्रतिवर्ती ईएमएफ।
ई पी, टी = -डीजी पी, टी / एनएफ, ई वी, टी = -डीएफ वी, टी / एनएफ
इस प्रकार, तत्व की ईएमएफ और उसके तापमान गुणांक को मापकर, गैल्वेनिक सेल में होने वाली कुल प्रक्रिया के लिए डीजी और डीएस के मूल्यों का पता लगाना संभव है। यह प्रक्रिया स्वतःस्फूर्त है, अत: डी.जी< 0.
गिब्स-हेल्महोल्ट्ज़ समीकरण का उपयोग करके, हम प्रक्रिया की एन्थैल्पी में परिवर्तन की गणना कर सकते हैं:
डीएच = डीजी - टी = -एनएफई पी + टीएनएफ
एनएफई पी = -डीएच + एनएफटी = + एनएफटी
एनएफई वी = -डीयू + एनएफटी = + एनएफटी
समीकरणों से यह निष्कर्ष निकलता है कि विद्युत रासायनिक प्रणाली में उत्क्रमणीय रूप से उत्पन्न या अवशोषित विद्युत ऊर्जा और उसमें होने वाली प्रतिक्रिया के थर्मल प्रभाव के बीच संबंध ईएमएफ के तापमान गुणांक के संकेत और परिमाण पर निर्भर करता है। डे/ डीटी :
1. अगरडे / डीटी > 0 , फिर nFE > (DG > DH) और सिस्टम विद्युत ऊर्जा में न केवल गर्मी की मात्रा को परिवर्तित करेगा जो प्रतिक्रिया के थर्मल प्रभाव से मेल खाती है, बल्कि अतिरिक्त गर्मी भी - पेलेटियर की गर्माहट क्यू पी = एनएफटी डे/ डीटीपर्यावरण से उधार लिया गया। रुद्धोष्म परिस्थितियों में (थर्मल इन्सुलेशन की स्थितियों में, जब पर्यावरण के साथ आदान-प्रदान असंभव है), सिस्टम का टी कम हो जाता है। सिस्टम का ठंडा होना विशेष रूप से ध्यान देने योग्य है यदि डे/ डीटी > 0 < 0 (реакция эндотермична).
2. अगरडे / डीटी < 0 , फिर एनएफई< (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. अगरडे / डीटी = 0 , तो डीजी = डीएच और एनएफई = - सिस्टम द्वारा विपरीत रूप से उत्पादित विद्युत ऊर्जा रासायनिक प्रतिक्रिया के थर्मल प्रभाव के बराबर है। इस रिश्ते को कहा जाता है थॉमसन का सिद्धांत (नियम) .
ईएमएफ की गणना करने के लिए, समीकरणों को इस प्रकार फिर से लिखा जा सकता है:
समीकरणों का उपयोग करते समय, यह याद रखना चाहिए कि वे केवल प्रतिवर्ती विद्युत रासायनिक प्रणालियों के लिए मान्य हैइसलिए, टी पर ईएमएफ की निर्भरता का अध्ययन करते समय, तरल सीमाओं के साथ विद्युत रासायनिक प्रणालियों के उपयोग से बचना आवश्यक है, क्योंकि उन पर उत्पन्न होने वाली प्रसार क्षमताएँ संतुलन नहीं हैं।
आइए हम तत्व के EMF को तत्व में होने वाली प्रतिक्रिया के संतुलन स्थिरांक के साथ संबद्ध करें। रासायनिक प्रतिक्रिया इज़ोटेर्म समीकरण:
डीजी = आरटी एल.एनक ए - आरटी
ई = - = एल.एनक ए -
दिए गए P, T के लिए समीकरण के दाईं ओर पहला पद एक स्थिर मान है; इसे E o द्वारा दर्शाया जा सकता है। ई ओ - किसी तत्व का मानक ईएमएफ (इलेक्ट्रोकेमिकल सिस्टम) , अर्थात। बिल्कुल ईएमएफ एक मैं = 0.
ई = ई ओ + एल.एन
 = ई ओ + 2.303 एलजी
= ई ओ + 2.303 एलजी 
इस प्रकार, एक इलेक्ट्रोकेमिकल प्रणाली का ईएमएफ इलेक्ट्रोकेमिकल प्रतिक्रिया में प्रतिभागियों की गतिविधियों का एक कार्य है। उपरोक्त समीकरण DG और K के मानों की गणना करना संभव बनाते हैं एई के प्रायोगिक मूल्यों के आधार पर और, इसके विपरीत, रासायनिक प्रतिक्रिया की थर्मोडायनामिक विशेषताओं को जानते हुए, ई की गणना करें।
ईएमएफ माप .
किसी विद्युत रासायनिक तत्व के ईएमएफ के संतुलन (प्रतिवर्ती) मूल्य को मापने के लिए, यह आवश्यक है कि प्रक्रिया असीम रूप से धीरे-धीरे हो, यानी। ताकि तत्व एक अनंत लघु धारा पर संचालित हो। यह शर्त क्षतिपूर्ति पद्धति में पूरी की जाती है, जो इस तथ्य पर आधारित है कि तत्व बाहरी संभावित अंतर के विरुद्ध श्रृंखला में जुड़ा हुआ है और बाद वाले का चयन किया जाता है ताकि सर्किट में कोई करंट न हो। तब बाहरी संभावित अंतर सर्किट के ईएमएफ के बराबर होता है।
क्षतिपूर्ति विधि का उपयोग करके, आप सीधे ईएमएफ के मूल्य को माप सकते हैं, लेकिन यह एक जटिल ऑपरेशन है, इसलिए प्रयोगशाला अभ्यास में वे तथाकथित मानक (सामान्य) के ईएमएफ के साथ अध्ययन किए जा रहे तत्व के ईएमएफ की तुलना करना पसंद करते हैं। तत्वों को अलग-अलग टी पर सावधानीपूर्वक मापा जाता है। यह तुलनात्मक विधि भी मुआवजा है।
मूल सामान्य तत्व है संतृप्त वेस्टन तत्व .
(ईएमएफ माप सर्किट - स्वतंत्र रूप से)।
इलेक्ट्रोड सीमा की संरचना - समाधान। दोहरी विद्युत परत .
जब पहली तरह का कोई कंडक्टर इलेक्ट्रोलाइट के संपर्क में आता है, तो a विद्युत दोहरी परत . उदाहरण के तौर पर, CuSO4 घोल में डूबे तांबे के इलेक्ट्रोड पर विचार करें। किसी धातु में किसी दिए गए T पर कॉपर आयनों की रासायनिक क्षमता को स्थिर माना जा सकता है, जबकि घोल में कॉपर आयनों की रासायनिक क्षमता नमक की सांद्रता पर निर्भर करती है; सामान्य तौर पर, ये रासायनिक क्षमताएँ समान नहीं होती हैं।
माना CuSO 4 की सांद्रता ऐसी हो कि > फिर, जब धातु को घोल में डुबोया जाता है, तो घोल से कुछ Cu 2+ आयन निर्जलित हो जाते हैं और धातु में स्थानांतरित हो जाते हैं, जिससे उस पर सकारात्मक चार्ज बन जाता है। यह चार्ज विलयन से धातु में Cu 2+ आयनों के आगे स्थानांतरण को रोक देगा और इलेक्ट्रोड के पास SO 4 2- आकर्षित आयनों की एक परत के गठन को बढ़ावा देगा। कहा गया विद्युतरासायनिक संतुलन , जिस पर धातु और घोल में आयनों की रासायनिक क्षमता परिणामी दोहरी विद्युत परत (DEL) के संभावित अंतर के परिमाण से भिन्न होगी:
विद्युत संभावित अंतर और रासायनिक संभावित अंतर की भरपाई विद्युत रासायनिक संतुलन में की जाती है।
माना कि CuSO 4 की सांद्रता इतनी कम है< . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
आप एक इलेक्ट्रोलाइट सांद्रता चुन सकते हैं जिस पर धातु और समाधान में आयनों की रासायनिक क्षमता समान हो। इस सान्द्रता के विलयन कहलाते हैं शून्य समाधान . जब किसी धातु को उसके शून्य घोल में डुबोया जाता है, तो इलेक्ट्रोड की सतह पर कोई ईडीएल नहीं होता है; हालाँकि, इस मामले में भी, धातु और घोल के बीच संभावित अंतर शून्य नहीं होता है।
नर्नस्ट के अनुसार, इलेक्ट्रोकेमिकल सेल के ईएमएफ का एकमात्र स्रोत इलेक्ट्रोड की सतह पर ईएमएफ है। नर्नस्ट ने शून्य विलयन में धातुओं की क्षमता को पूर्ण शून्य क्षमता के रूप में परिभाषित किया। ए.एन. फ्रुम्किन के कार्यों में यह दिखाया गया कि नर्नस्ट के विचार गलत हैं। यह प्रयोगात्मक रूप से स्थापित किया गया है कि उनके शून्य समाधानों में डूबे दो अलग-अलग इलेक्ट्रोडों से बने तत्व का ईएमएफ शून्य (शायद 1 वी से अधिक) से काफी भिन्न होता है। शून्य विलयन में किसी धातु की क्षमता कहलाती है शून्य चार्ज क्षमता , को पूर्ण शून्य विभव नहीं माना जा सकता।
संघनित हेल्महोल्ट्ज़ दोहरी परत का सिद्धांत. धातु-समाधान इंटरफ़ेस पर DEL की संरचना का पहला मात्रात्मक सिद्धांत हेल्महोल्ट्ज़ (1853) द्वारा बनाया गया था। हेल्महोल्ट्ज़ के अनुसार, एक ईडीएल की तुलना एक फ्लैट कैपेसिटर से की जा सकती है, जिसमें से एक प्लेट धातु में सतह के आवेशों से गुजरने वाले विमान के साथ मेल खाती है, दूसरा समाधान में आयनों के आवेशों के केंद्रों को जोड़ने वाले विमान के साथ मेल खाता है। इलेक्ट्रोस्टैटिक बलों द्वारा धातु की सतह पर आकर्षित होना। दोहरी परत की मोटाई एलआयन त्रिज्या के बराबर आर. विद्युत तटस्थता की स्थिति के अनुसार, धातु की सतह पर आकर्षित आयनों की संख्या ऐसी होनी चाहिए कि उनके आवेश धातु के सतह आवेशों की भरपाई कर दें, अर्थात।
संघनित दोहरी परत का सिद्धांत ईडीएल कैपेसिटेंस के मूल्यों को प्राप्त करना संभव बनाता है जो प्रयोग और ईडीएल की भौतिक रूप से प्रशंसनीय मोटाई के अनुरूप हैं। हालाँकि, यह कई प्रायोगिक नियमितताओं की व्याख्या नहीं कर सकता है: इलेक्ट्रोकेनेटिक क्षमता (एक्स-पोटेंशियल) के प्रयोगात्मक रूप से पाए गए मान और इलेक्ट्रोलाइट एकाग्रता पर उनकी निर्भरता, एक सर्फेक्टेंट की उपस्थिति में धातु की सतह पर चार्ज के संकेत में परिवर्तन .
विसरित दोहरी परत जीयूआई का सिद्धांत- फेरीवाला. हेल्महोल्ट्ज़ का सिद्धांत इस बात पर ध्यान नहीं देता है कि डीईएस के गुण इलेक्ट्रोलाइट की सांद्रता के साथ बदलते हैं और टी. गौय (1910) और चैपमैन (1913) ने डीईएस में चार्ज घनत्व को समाधान की संरचना के साथ जोड़ने की कोशिश की। उन्होंने इस बात को ध्यान में रखा कि धातु और आयनों के बीच उत्पन्न होने वाले इलेक्ट्रोस्टैटिक बलों के अलावा, आयन थर्मल आणविक गति की ताकतों से भी प्रभावित होते हैं। जब इन दो बलों को लागू किया जाता है, तो समाधान में आयनों को धातु की सतह के सापेक्ष व्यापक रूप से वितरित किया जाना चाहिए - इससे दूरी के साथ वॉल्यूमेट्रिक चार्ज घनत्व कम हो जाता है।
गौय और चैपमैन का मानना था कि आयनों को भौतिक बिंदुओं के रूप में माना जा सकता है जिनकी अपनी मात्रा नहीं होती है, लेकिन एक चार्ज होता है, और इलेक्ट्रोड चार्ज क्षेत्र में उनका वितरण बोल्ट्जमान वितरण का पालन करता है।
गौ-चैपमैन सिद्धांत इलेक्ट्रोकेनेटिक घटना के नियमों के साथ हेल्महोल्त्ज़ सिद्धांत से बेहतर सहमत है। अगर हम मान लें कि एक निश्चित दूरी से शुरू करना है एल 1 आयन अब ठोस और तरल चरणों की सापेक्ष गति के साथ इलेक्ट्रोड सतह से मजबूती से बंधे नहीं हैं, तो इस दूरी के अनुरूप क्षमता को x-संभावित (x) माना जा सकता है< j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
इस प्रकार, जहां हेल्महोल्ट्ज़ सिद्धांत अनुपयुक्त हो जाता है, वहां गौ-चैपमैन सिद्धांत सर्वोत्तम रूप से उचित है, और, इसके विपरीत, बाद वाला उन मामलों में प्रयोग के साथ बेहतर अभिसरण देता है जहां पहला गलत परिणाम देता है। नतीजतन, डीईएस की संरचना को हेल्महोल्त्ज़ और गौ-चैपमैन द्वारा प्रस्तावित मॉडलों के कुछ संयोजन के अनुरूप होना चाहिए। यह धारणा स्टर्न (1924) ने DEL के अपने सोखना सिद्धांत में बनाई थी।
स्टर्न अधिशोषण सिद्धांत. स्टर्न का मानना था कि आयनों का एक निश्चित हिस्सा धातु-इलेक्ट्रोलाइट इंटरफ़ेस के पास बरकरार रहता है, जिससे इलेक्ट्रोलाइट आयनों की औसत त्रिज्या के अनुरूप मोटाई के साथ हेल्महोल्ट्ज़ या संघनित डबल-लेयर प्लेट बनती है। ईडीएल में शामिल शेष आयनों को धीरे-धीरे कम होते चार्ज घनत्व के साथ व्यापक रूप से वितरित किया जाता है। ईडीएल के फैले हुए भाग के लिए, गौय की तरह स्टर्न ने आयनों के आंतरिक आकार की उपेक्षा की। इसके अलावा, स्टर्न ने सुझाव दिया कि ईडीएल के घने हिस्से में, आयन न केवल इलेक्ट्रोस्टैटिक बलों, बल्कि विशिष्ट सोखना बलों, यानी के कारण भी बरकरार रहते हैं। गैर-कूलम्ब मूल की ताकतें। इसलिए, सतह-सक्रिय आयनों वाले समाधानों में, ईडीएल के घने हिस्से में उनकी संख्या आयनों के गुणों और धातु के चार्ज के आधार पर, धातु की सतह के चार्ज से एक निश्चित मात्रा से अधिक हो सकती है। इस प्रकार, स्टर्न के अनुसार, डीईएस के दो मॉडलों को प्रतिष्ठित किया जाना चाहिए, जिनमें से एक सतह-निष्क्रिय इलेक्ट्रोलाइट्स के समाधान से संबंधित है, दूसरा विशेष रूप से अधिशोषित आयनों वाले समाधानों से संबंधित है।
अधिशोषण सिद्धांत में समानता भी संरक्षित है:
क्यू एम = क्यू एल = क्यू 1 + क्यू 2
समाधान पक्ष q L पर आवेश घनत्व में दो भाग होते हैं: हेल्महोल्त्ज़ परत q 1 में आवेश घनत्व और विसरित परत q 2 में आवेश घनत्व।
स्टर्न का सिद्धांत हमें ईडीएल के फैले हुए हिस्से में संभावित गिरावट के रूप में एक्स-पोटेंशियल को परिभाषित करने की अनुमति देता है, जहां धातु और आयनों के बीच मजबूत बंधन पहले ही खो चुका है। इस परिभाषा के साथ, एक्स-पोटेंशियल को नेर्स्ट पोटेंशियल के साथ मेल नहीं खाना चाहिए, जैसा कि प्रयोगात्मक रूप से देखा गया है। स्टर्न का सिद्धांत एक ठोस पिंड की सतह के रिचार्जिंग को समझाने में सक्षम था।
अत्यंत सूक्ष्म सांद्रता पर, समाधान में सभी आवेश व्यापक रूप से वितरित होते हैं, और ईडीएल की संरचना का वर्णन गौ-चैपमैन सिद्धांत द्वारा किया गया है। इसके विपरीत, संकेंद्रित समाधानों में डीईएस की संरचना हेल्महोल्ट्ज़ द्वारा प्रस्तावित मॉडल के करीब पहुंचती है। औसत सांद्रता के क्षेत्र में, जहां x का परिमाण RT/F से तुलनीय है, एकाग्रता पर इसकी निर्भरता अनुमानित समीकरणों द्वारा व्यक्त की जा सकती है:
सकारात्मक मानों के लिए x: x = B - एल.एनसाथ
x के ऋणात्मक मानों के लिए: x = B¢ + एल.एनसाथ
स्टर्न का सिद्धांत DEL की गुणात्मक रूप से सही तस्वीर देता है। स्टर्न मॉडल का उपयोग करके कैपेसिटेंस का निर्धारण कैपेसिटेंस मूल्यों और इलेक्ट्रोड क्षमता और समाधान एकाग्रता पर इसकी निर्भरता की प्रकृति दोनों के संदर्भ में अनुभव के अनुरूप है। लेकिन स्टर्न का सिद्धांत कमियों से मुक्त नहीं है। इनमें कैपेसिटेंस वक्रों के मात्रात्मक विवरण की असंभवता शामिल है, खासकर जब शून्य चार्ज क्षमता से दूर जा रहे हों।
डेस स्टैंडिंग के सिद्धांत का और विकास. डीईएस के एक सिद्धांत को विकसित करने के लिए कई प्रयास किए गए हैं जो प्रयोगात्मक डेटा (राइस, फ्रुमकिन एट अल।, बॉक्रिस, देवनाथन, एसिन, मुलर, पार्सन्स, एर्शलर, आदि) के साथ मात्रात्मक रूप से सुसंगत है। सबसे व्यापक रूप से स्वीकृत मॉडल ग्राहम (1947) है। ग्राहम के अनुसार, समाधान में डीईएस कोटिंग में दो नहीं, बल्कि तीन भाग होते हैं। धातु की सतह से गिनती करने वाले पहले को आंतरिक हेल्महोल्ट्ज़ विमान कहा जाता है; इसमें केवल सतह-सक्रिय आयन होते हैं (विमान का आवेश q 1 है) या, यदि वे समाधान में नहीं हैं, तो विलायक अणु (q 1 = 0); समाधान से संबंधित इसकी क्षमता को y 1 द्वारा दर्शाया गया है। अगला, धातु की सतह से उस दूरी पर हटाया जाता है जहां तक आयन (उनके चार्ज केंद्र) पहुंच सकते हैं, बाहरी हेल्महोल्ट्ज़ विमान कहलाता है; इसका कुल चार्ज q 2 है, और विमान की क्षमता y 2 है। बाहरी हेल्महोल्त्ज़ तल के पीछे एक विसरित परत होती है जिसकी क्षमता y 2 से शून्य तक होती है और चार्ज घनत्व q 2 के साथ मेल खाता है।
ग्राहम का मॉडल धातु-इलेक्ट्रोलाइट डीईएस संरचना की मुख्य विशेषताओं और विशेषताओं को दर्शाता है। यह आपको किसी दिए गए इलेक्ट्रोलाइट की किसी भी सांद्रता के लिए अंतर समाई वक्र की गणना करने की अनुमति देता है यदि इसके कम से कम एक समाधान के लिए एक प्रयोगात्मक वक्र है। हालाँकि, यह मॉडल समस्या के सभी पहलुओं को कवर नहीं करता है।
जब किसी विलयन से विद्युत धारा प्रवाहित होती है, तो इलेक्ट्रोड की सतह पर विद्युत धारा प्रवाहित होती है। विद्युतरासायनिक प्रतिक्रियाएँ, जो इलेक्ट्रोड से या उससे इलेक्ट्रॉनों के प्रवाह के साथ होते हैं। विपरीत प्रक्रियाओं में, पहले और दूसरे प्रकार के कंडक्टरों के बीच इंटरफेस पर होने वाली विद्युत रासायनिक प्रतिक्रियाएं विद्युत प्रवाह की उत्पत्ति का कारण बनती हैं।
इलेक्ट्रोकेमिकल प्रक्रियाएं कई विशेषताओं में पारंपरिक रासायनिक प्रतिक्रियाओं से भिन्न होती हैं।
रासायनिक प्रतिक्रिया तभी संभव होती है जब प्रतिक्रिया करने वाले कण टकराते हैं। जब वे संपर्क में आते हैं, तो इलेक्ट्रॉनों का एक कण से दूसरे कण में स्थानांतरित होना संभव हो जाता है। ऐसा संक्रमण वास्तव में होता है या नहीं यह कणों की ऊर्जा और उनके पारस्परिक अभिविन्यास पर निर्भर करता है। सक्रियण ऊर्जा रासायनिक प्रतिक्रिया की प्रकृति पर निर्भर करती है, और आयनिक प्रतिक्रियाओं के लिए यह आमतौर पर कम होती है। इलेक्ट्रॉन संक्रमण पथ बहुत छोटा है, जो रासायनिक प्रतिक्रिया की एक विशेषता भी है। कणों की टक्कर प्रतिक्रिया स्थान के किसी भी बिंदु पर विभिन्न पारस्परिक स्थितियों में हो सकती है, इसलिए इलेक्ट्रॉनिक संक्रमण मनमाने ढंग से दिशाओं में हो सकते हैं, यानी। रासायनिक प्रक्रिया की विशेषताएं टकराव की यादृच्छिकता और इलेक्ट्रॉनिक संक्रमणों की दिशात्मकता की कमी हैं। परिणामस्वरूप, रासायनिक प्रतिक्रियाओं के ऊर्जावान प्रभाव मुख्य रूप से गर्मी के रूप में प्रकट होते हैं (विस्तार का एक छोटा कार्य भी संभव है)।
रासायनिक परिवर्तन के अनुरूप होने वाले ऊर्जा परिवर्तनों को विद्युत ऊर्जा के रूप में प्रकट करने के लिए, अर्थात। विद्युत रासायनिक प्रक्रिया को आगे बढ़ाने के लिए, प्रतिक्रिया स्थितियों को बदलना आवश्यक है।
विद्युत ऊर्जा हमेशा विद्युत धारा के प्रवाह से जुड़ी होती है, अर्थात। एक निश्चित दिशा में इलेक्ट्रॉनों का प्रवाह। इसलिए, प्रतिक्रिया इस तरह से की जानी चाहिए कि इलेक्ट्रॉनिक संक्रमण यादृच्छिक न हों, बल्कि एक दिशा में हों, और उनका पथ परमाणु आकार से काफी बड़ा होना चाहिए। इसलिए, इलेक्ट्रोकेमिकल प्रक्रियाओं में, एक प्रतिभागी से दूसरे प्रतिभागी तक इलेक्ट्रॉनों का संक्रमण काफी दूरी पर होना चाहिए, जिसके लिए प्रतिक्रिया प्रतिभागियों का स्थानिक पृथक्करण आवश्यक है। हालाँकि, अकेले स्थानिक पृथक्करण पर्याप्त नहीं है, क्योंकि इससे प्रतिक्रिया रुक जाएगी।
इलेक्ट्रोकेमिकल प्रक्रिया को पूरा करने के लिए, अतिरिक्त शर्तें आवश्यक हैं: इलेक्ट्रॉनों को कुछ कणों से अलग किया जाना चाहिए और एक सामान्य तरीके से दूसरों में स्थानांतरित किया जाना चाहिए। इसे प्रतिक्रिया में भाग लेने वालों के बीच सीधे संपर्क को एक धातु कंडक्टर द्वारा एक दूसरे से जुड़े दो धातुओं के साथ बदलकर प्राप्त किया जा सकता है। इलेक्ट्रॉनों के प्रवाह को निरंतर बनाए रखने के लिए, प्रतिक्रिया स्थान के माध्यम से विद्युत प्रवाह के पारित होने को सुनिश्चित करना भी आवश्यक है, जो आमतौर पर विद्युत रासायनिक प्रतिक्रिया में प्रतिभागियों द्वारा स्वयं किया जाता है (यदि वे आयनित अवस्था में हैं) या उच्च आयनिक चालकता वाले विशेष यौगिकों द्वारा।
विद्युत रासायनिक प्रतिक्रियाओं के माध्यम से विद्युत ऊर्जा उत्पन्न करने वाले उपकरण को कहा जाता है विद्युत(या बिजली उत्पन्न करनेवाली)तत्व. सबसे सरल विद्युत रासायनिक तत्व में दो धातु इलेक्ट्रोड (पहले प्रकार के कंडक्टर) होते हैं जो एक इलेक्ट्रोलाइट समाधान (दूसरे प्रकार के कंडक्टर) में डूबे होते हैं।
यदि, जब विद्युत धारा अलग-अलग दिशाओं में गुजरती है, तो इलेक्ट्रोड की सतह पर एक ही प्रतिक्रिया होती है, लेकिन विपरीत दिशाओं में, तो ऐसे इलेक्ट्रोड, साथ ही उनसे बने विद्युत रासायनिक तत्वों को कहा जाता है प्रतिवर्ती. प्रतिवर्ती तत्व का एक उदाहरण डैनियल-जैकोबी तत्व है
(-) Zn | ZnSO 4, समाधान || CuSO4, घोल | Cu(+)
जब ऐसा तत्व संचालित होता है, तो इलेक्ट्रोड पर विद्युत रासायनिक प्रतिक्रियाएं होती हैं:
Zn Zn 2 + + 2e
Cu 2 + + 2eCu
किसी तत्व में समग्र प्रतिक्रिया समीकरण को इस प्रकार दर्शाया जा सकता है
Zn + Cu 2 + Zn 2 + + Cu
जब किसी बाहरी स्रोत से एक अनंत लघु धारा तत्व के माध्यम से प्रवाहित की जाती है, तो ये प्रतिक्रियाएं विपरीत दिशा में आगे बढ़ती हैं।
उदाहरण अचलतत्व वोल्टा तत्व है
(-) Zn | H2SO4 | Cu(+)
जब ऐसा कोई तत्व संचालित होता है, तो इलेक्ट्रोड पर निम्नलिखित प्रतिक्रियाएँ होती हैं:
Zn Zn 2 + + 2e
2H + + 2eH 2 ,
और तत्व में प्रतिक्रिया को समीकरण द्वारा दर्शाया जाता है
Zn + 2H + Zn 2+ + H 2
जब किसी बाहरी स्रोत से करंट प्रवाहित किया जाता है, तो इलेक्ट्रोड पर अन्य प्रतिक्रियाएँ होती हैं:
Cu Cu 2 + + 2e,
वे। एक इलेक्ट्रोकेमिकल सेल में, हाइड्रोजन की रिहाई के साथ तांबा सल्फ्यूरिक एसिड में घुल जाता है:
Cu + 2H + Cu 2 + + H 2
विद्युत रासायनिक सेल का सबसे महत्वपूर्ण गुण है वैद्युतवाहक बल(ईएमएफ) इ- ठीक से खुले तत्व का संभावित अंतर, यानी गैल्वेनिक सेल के इलेक्ट्रोड से जुड़े समान सामग्री के पहले प्रकार के कंडक्टरों के सिरों के बीच संभावित अंतर। दूसरे शब्दों में, ईएमएफ संतुलन स्थितियों के तहत संभावित अंतर है जब सर्किट में कोई विद्युत प्रवाह प्रवाहित नहीं होता है। यदि आप इलेक्ट्रोड को बंद कर देते हैं, तो सर्किट में विद्युत प्रवाह प्रवाहित होगा, और संभावित अंतर दर्शाता है वोल्टेजएक विद्युत रासायनिक तत्व जो तत्व के आंतरिक प्रतिरोध में वोल्टेज ड्रॉप की मात्रा से ईएमएफ से भिन्न होता है।
इलेक्ट्रोकेमिकल तत्वों का उद्देश्य बाहरी सर्किट में इलेक्ट्रॉनों की गति को बढ़ावा देना है जिसमें उपयोगी तत्व शामिल है
भार। इस प्रकार, अपना कार्य करने के लिए, ईंधन सेल में एक स्रोत और इलेक्ट्रॉनों का एक सिंक होना चाहिए (चित्र 7.1)।
इलेक्ट्रोकेमिकल सेल में होने वाली प्रतिक्रियाओं को कमी-प्रतिक्रिया कहा जाता है, क्योंकि "ऑक्सीकरण" शब्द इलेक्ट्रॉनों को जारी करने की प्रक्रिया से मेल खाता है, और "कमी" शब्द इलेक्ट्रॉनों को जारी करने की प्रक्रिया से मेल खाता है।
कई पुरानी वैज्ञानिक अवधारणाओं का अर्थ अक्सर उनके नाम से स्पष्ट नहीं होता है। "ऑक्सीकरण" और "कमी" शब्दों को स्पष्टीकरण की आवश्यकता है। दक्षिणपूर्व में, ऑक्सीजन (ऑक्सीजन) लैटिन मूल ऑक्सस (खट्टा या गर्म, तीखा) से आती है और इसका अर्थ है "एसिड उत्पादक।" इस नाम का उपयोग पहली बार 1787 में प्रकाशित मोरव्यू और लावोइसियर के काम "नोमेनक्लेचर चिमिक" में किया गया था। उस समय, रसायनज्ञ एक गलत धारणा का पालन करते थे। ऑक्सीजन एसिड में शामिल मुख्य तत्व है; जब एक एसिड पानी में घुल जाता है, तो इसकी संरचना में शामिल हाइड्रोजन परमाणुओं का हिस्सा अपना इलेक्ट्रॉन खो देता है - पानी अम्लीय हो जाता है, और हाइड्रोजन ऑक्सीकृत हो जाता है। विश्लेषणात्मक रूप से, इलेक्ट्रॉन हानि की प्रक्रिया से जुड़ी किसी भी प्रतिक्रिया को ऑक्सीकरण कहा जाता है। विपरीत प्रतिक्रिया - इलेक्ट्रॉन ग्रहण प्रतिक्रिया - को ■बनना कहा जाता है।
प्रवाह
जे इलेक्ट्रॉन
इलेक्ट्रॉन स्रोत >
(ऑक्सीकरण)
सकारात्मक< -
विद्युत धारा की दिशा चित्र. 7.1. एक इलेक्ट्रोकेमिकल सेल में इलेक्ट्रॉनों का एक स्रोत और सिंक होना चाहिए
एक इलेक्ट्रोकेमिकल सेल में, समग्र प्रतिक्रिया को दो मध्यवर्ती प्रतिक्रियाओं में विभाजित किया जाता है जो डिवाइस के अलग-अलग क्षेत्रों में होती हैं। ये क्षेत्र इलेक्ट्रोलाइट द्वारा जुड़े हुए हैं, जो आयनों का संवाहक है, लेकिन मध्यवर्ती ऑक्सीकरण प्रतिक्रिया में जारी इलेक्ट्रॉनों का संचालन करता है, इलेक्ट्रॉन उस क्षेत्र में प्रवेश कर सकते हैं जहां कमी प्रतिक्रिया होती है, लेकिन एक बाहरी सर्किट के माध्यम से। इस प्रकार, बाहरी सर्किट में एक विद्युत प्रवाह उत्पन्न होता है, और इलेक्ट्रोकेमिकल सेल इसका स्रोत है - यही इसका उद्देश्य है। बाहरी सर्किट में विद्युत की सकारात्मक दिशा को तत्व के कम करने वाले ऑक्सीकरण क्षेत्र से दिशा माना गया था - विद्युत प्रवाह कटौती क्षेत्र के तत्व को छोड़ देता है, जो इस प्रकार ईंधन का कैथोड है - ओ तत्व, और ऑक्सीकरण क्षेत्र में प्रवेश करता है, जो एनोड है। किसी भी अन्य विद्युत स्रोत की तरह, कैथोड सकारात्मक रूप से चार्ज होता है
सक्रिय इलेक्ट्रोड, और एनोड एक नकारात्मक चार्ज वाला इलेक्ट्रोड है। जब विद्युत ऊर्जा (भार) के उपभोक्ताओं की बात आती है, तो नाम विपरीत में बदल जाते हैं। Ch के परिचय में. 6 "एनोड" और "कैथोड" शब्दों पर अधिक विस्तार से चर्चा की गई है।
इलेक्ट्रोकेमिकल सेल के उदाहरण के रूप में, एक झिल्ली पर विचार करें जो इलेक्ट्रोलाइट की भूमिका निभाती है। मान लीजिए कि झिल्लियों की एक पार्श्व सतह हाइड्रोजन के संपर्क में है। सामान्य परिस्थितियों में गैस में मुख्य रूप से आणविक हाइड्रोजन शामिल होगी, लेकिन अणुओं की एक छोटी संख्या परमाणुओं में विघटित हो सकती है
और कुछ परमाणु ऑक्सीकरण (आयनीकृत) कर देंगे, यानी अपना इलेक्ट्रॉन खो देंगे
एन -> एनटी + ई~।
चूँकि झिल्ली इलेक्ट्रॉनों के लिए अभेद्य है, वे सभी इसके एक तरफ रहेंगे, जबकि गठित आयन अलग-अलग होंगे; झिल्ली के माध्यम से वे स्वयं को दूसरी ओर पाएंगे। इस मामले में, आयन एक सकारात्मक चार्ज रखते हैं, इसलिए झिल्ली की सतह जिस पर हाइड्रोजन स्थित है, उस पर जमा हुए इलेक्ट्रॉनों की अधिकता के कारण नकारात्मक चार्ज हो जाएगी, और विपरीत सतह सकारात्मक के कारण सकारात्मक रूप से चार्ज हो जाएगी। आयन जो विसरण के कारण इस पर प्रकट हुए हैं। विद्युत क्षेत्र के कारण कुछ आयन झिल्ली की "हाइड्रोजन" सतह के विपरीत दिशा में चले जाते हैं। विचाराधीन प्रणाली में गतिशील संतुलन तब स्थापित होता है जब आयनों का प्रसार प्रवाह सेंट होता है। मैं विपरीत धारा के बराबर है।
अब झिल्ली की दोनों सतहों पर विद्युत प्रवाहकीय पाउडर लगाएं। इसके परिणामस्वरूप दो छिद्रपूर्ण विद्युत प्रवाहकीय परतें बन जाएंगी जो इलेक्ट्रोड के रूप में कार्य करेंगी। आइए इलेक्ट्रोड के विद्युत कनेक्शन को सुनिश्चित करते हुए, एक बाहरी हीटर1 को इलेक्ट्रोड से कनेक्ट करें। महत्वपूर्ण आरएल के लिए लोड प्रतिरोध। आयन बाहरी सर्किट में नहीं चल सकते हैं, और इलेक्ट्रॉन "हाइड्रोजन" भाग से, जहां उनकी अधिकता है, झिल्ली के विपरीत दिशा में जाना शुरू कर देते हैं, जिससे बाहरी सर्किट में विद्युत प्रवाह बनता है, जैसा कि चित्र में दिखाया गया है। 7.2. हमारे लिए रुचि की प्रतिक्रिया "पानी" इलेक्ट्रोड पर होती है और समीकरण द्वारा वर्णित है
2H2 -> 4H+ + 4e (एनोडिक प्रतिक्रिया)
तत्व के संचालन की वर्णित योजना में एक महत्वपूर्ण खामी है: यह थर्मोडायनामिक्स के पहले नियम का खंडन करती है। दरअसल, जब किसी बाहरी भार से विद्युत धारा प्रवाहित होती है, तो उसकी मात्रा निकलती है, जिसकी मात्रा उत्पाद I2RL द्वारा निर्धारित की जाती है। उसी समय, बिजली
कैथोड क्षेत्र में जाकर, H+ आयनों के साथ संयोजित होते हैं, जो झिल्ली के माध्यम से फैलते हैं, हाइड्रोजन परमाणु बनाते हैं, अंततः "ईंधन" के रूप में उपयोग की जाने वाली H2 गैस के अणुओं का निर्माण करते हैं। यदि प्रक्रिया दी गई योजना के अनुसार आगे बढ़ती है, तो हमें बिना किसी ईंधन खपत के गर्मी प्राप्त होगी।
बाहरी सर्किट केवल इलेक्ट्रॉनों की गति के लिए एक मार्ग बनाता है, लेकिन अपने आप में यह विद्युत प्रवाह की घटना का कारण नहीं हो सकता है। ठीक वैसे ही जैसे यदि आप किसी पाइप का एक सिरा झील में डाल दें तो पानी पाइप में नहीं बहेगा। पानी के प्रवाह के लिए, दूसरा सिरा पानी की सतह से नीचे होना चाहिए। इसी प्रकार, किसी बाहरी सर्किट में विद्युत धारा लाने के लिए कैथोड क्षेत्र में rhmodynamic क्षमता को कम करना आवश्यक है। ऐसा करने का सबसे आसान तरीका ऑक्सीजन जोड़ना है, जिसके अणु इलेक्ट्रॉनों और आयनों के साथ जुड़ते हैं, जिसके परिणामस्वरूप पानी बनता है:
4е" + 4Н+ + 02 -» 2Н20 (कैथोड प्रतिक्रिया)। (4)
प्रतिक्रिया एक्ज़ोथिर्मिक है, यानी, यह मुख्य रूप से विद्युत ऊर्जा की रिहाई के साथ आगे बढ़ती है, न कि थर्मल ऊर्जा, जैसा कि हाइड्रोजन को जलाने पर होता है। जाहिर है, यह वह ऊर्जा है जो ईंधन तत्व को शक्ति प्रदान करती है।
इलेक्ट्रोकेमिकल सेल का वर्णित आरेख चित्र में दिखाया गया है। 7.2.
सामान्य परिस्थितियों में, पूरे क्षेत्र में विघटित हाइड्रोजन अणुओं का अंश छोटा होता है। भौतिक मापदंडों को बदलकर इसे थोड़ा बढ़ाया जा सकता है
ले चैटेलियर के सिद्धांत के अनुसार मीटर। उदाहरण के लिए, सिस्टम का तापमान बढ़ाकर। उत्प्रेरकों की क्रिया का उपयोग करके हाइड्रोजन अणुओं के पृथक्करण की डिग्री को भी बढ़ाया जा सकता है1।
विद्युत रासायनिक सेल में होने वाली संपूर्ण प्रतिक्रिया को समीकरण द्वारा वर्णित किया गया है:
2H2 + 02 -> 2H?0.
एलेसेंड्रो वोल्टा (1745-1 1800 में) द्वारा आविष्कार किया गया इलेक्ट्रोकेमिकल सेल, निरंतर मोड में विद्युत प्रवाह उत्पन्न करने वाला पहला उपकरण था। इसमें नमक के घोल में भिगोए गए कागज की शीटों से अलग किए गए जस्ता और चांदी (या तांबे) के आधार शामिल थे। तत्वों को श्रृंखला में जोड़कर गैल्वेनिक बैटरी का निर्माण किया गया, एक तत्व के इलेक्ट्रोड को दूसरे तत्व के ZINC इलेक्ट्रोड से सीधे जोड़ा गया।
इस एसिड के तनु (उदाहरण के लिए, 10%) घोल में वेल्डेड और कॉपर इलेक्ट्रोड को डुबो कर एक इलेक्ट्रोकेमिकल वोल्टा सेल बनाया जा सकता है। जिंक ऑक्सीकरण करेगा:
Zn -> Zr,++ + 2e >
परिणामस्वरूप, मुक्त इलेक्ट्रॉन बनते हैं। जिंक आयनों को पानी में घोलें। सल्फ्यूरिक एसिड, एक मजबूत एसिड1) होने के कारण, आयनों में वियोजित हो जाता है:
H2S04 - "2Н+ + SOf"
जिंक आयन सल्फेट आयनों के साथ मिलकर जिंक सल्फेट बनाते हैं। हाइड्रोनियम आयन H" (H20)x के रूप में पोंस इलेक्ट्रोलाइट के माध्यम से इलेक्ट्रोड में चले जाएंगे, जिस पर उन्हें गैस बुलबुले के रूप में छोड़ा जाएगा (जब हाइड्रोनियम आयन II के बाहर से इलेक्ट्रोड में आने वाले इलेक्ट्रॉनों को पकड़ लेता है) सर्किट)। व्यवहार में इस प्रकार का इलेक्ट्रोकेमिकल सेल लगभग बेकार है, क्योंकि बहुत जल्दी तांबे का इलेक्ट्रोड इसकी सतह से चिपके हाइड्रोजन बुलबुले से ढक जाएगा, जिससे इलेक्ट्रोड में प्रवेश करने वाले आयनों का प्रवाह काफी कम हो जाएगा। तथाकथित "शुष्क कोशिकाएं" सतह पर एक इन्सुलेटिंग गैस परत के गठन को रोकने के लिए कुछ विधि का उपयोग करती हैं। हाइड्रोजन को अवशोषित करने के लिए उपयोग किए जाने वाले रासायनिक अभिकर्मक को डीपोलराइज़र कहा जाता है। उपभोग किए जाने वाले अभिकर्मकों में से एक आमतौर पर होता है
"> किसी एसिड की ताकत जलीय घोल में उसके अणुओं के पृथक्करण की डिग्री से निर्धारित होती है। C एसिड पूरी तरह से H+ और C1_ आयनों में अलग हो जाता है - यह एक मजबूत एसिड है। सल्फ्यूरिक एसिड कुछ हद तक कमजोर है, लेकिन मजबूत एसिड से भी संबंधित है आश्चर्यजनक रूप से, हाइड्रोफ्लोरोइक एसिड, इसकी उच्च संक्षारक गतिविधि के बावजूद, कमरे के तापमान पर एक कमजोर एसिड-एनटी समाधान है, न्यूट्रा एचएफ अणुओं की कुल एकाग्रता से एच + आयनों का अनुपात 3% से कम है।
पित्त, आसानी से ऑक्सीकरण के अधीन; जिंक का प्रयोग सबसे अधिक किया जाता है। ध्यान दें कि वोल्टा तत्व में कॉपर इलेक्ट्रोड रासायनिक प्रतिक्रियाओं में प्रवेश नहीं करता है, और इसलिए तांबे का उपभोग नहीं किया जाता है।
कुछ समय पहले तक, सस्ती गैल्वेनिक बैटरियों में लेक्लान्चेट कोशिकाओं का उपयोग किया जाता था, जिसमें एनोड जिंक से बना होता है और कैथोड एक ग्रेफाइट रॉड से बना होता है, जिसे ग्रेफाइट (विद्युत चालकता बढ़ाने के लिए) के साथ पाउडर मैंगनीज डाइऑक्साइड की एक परत के साथ लेपित किया जाता है। मैंगनीज डाइऑक्साइड जारी हाइड्रोजन को अवशोषित करता है, जो कैथोड सतह पर गैस परत के गठन को रोकता है। अमोनियम क्लोराइड का उपयोग इलेक्ट्रोलाइट के रूप में किया जाता है। आधुनिक (क्षारीय) बैटरियां क्षारीय इलेक्ट्रोलाइट का उपयोग करती हैं।
यदि एनोड सामग्री के लिए उपयोग किया जाने वाला जस्ता बिल्कुल शुद्ध होता, तो इसका उपभोग केवल तभी किया जाता जब तत्व के माध्यम से विद्युत प्रवाह प्रवाहित होता। अशुद्धियों की उपस्थिति इलेक्ट्रोड के क्षरण का कारण बनती है, तब भी जब तत्व का उपयोग नहीं किया जाता है (अशुद्धियाँ इलेक्ट्रोड सामग्री के अंदर कई सूक्ष्म विद्युत रासायनिक कोशिकाओं का निर्माण करती हैं)। ऐसी बैटरियों की लंबी शेल्फ लाइफ सुनिश्चित करने के लिए, एनोड जस्ता और पारा (समामेलित) के मिश्र धातु से बना होता है। वर्तमान में, लेक्लांश कोशिकाओं को लगभग पूरी तरह से क्षारीय बैटरियों द्वारा प्रतिस्थापित कर दिया गया है।
कई रासायनिक प्रतिक्रियाएँ तभी होती हैं जब ऊर्जा की आपूर्ति बाहर से की जाती है। इन्हें अक्सर बाहरी वर्तमान स्रोत से जुड़े इलेक्ट्रोड पर इलेक्ट्रोलाइटिक कोशिकाओं (इलेक्ट्रोलाइज़र) में किया जाता है। इन प्रतिक्रियाओं के अध्ययन से विभिन्न पदार्थों की प्रकृति और गुणों के बारे में जानकारी मिलती है, और इलेक्ट्रोसिंथेसिस का उपयोग करके नए रासायनिक यौगिक प्राप्त करना भी संभव हो जाता है। उद्योग में विद्युत रासायनिक प्रक्रियाओं का व्यापक रूप से उपयोग किया जाता है। उदाहरणों में क्लोरीन और एल्यूमीनियम उत्पादन, इलेक्ट्रोप्लेटिंग और विद्युत निष्कर्षण शामिल हैं। गैल्वेनिक कोशिकाएं, जो रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित करती हैं, वर्तमान स्रोतों - बैटरी और संचायक, साथ ही ईंधन कोशिकाओं का आधार बनती हैं। इलेक्ट्रोकैमिस्ट्री अन्य विद्युत घटनाओं का भी अध्ययन करती है: इलेक्ट्रोलाइट समाधानों में आयनों का व्यवहार और ऐसे समाधानों के माध्यम से विद्युत प्रवाह का पारित होना; विद्युत क्षेत्र में आयनों का पृथक्करण (वैद्युतकणसंचलन); धातुओं का क्षरण और निष्क्रियता; जैविक प्रणालियों में विद्युत प्रभाव (बायोइलेक्ट्रोकैमिस्ट्री); फोटोइलेक्ट्रोकेमिकल प्रक्रियाएं (कोशिकाओं में विद्युत रासायनिक प्रतिक्रियाओं पर प्रकाश का प्रभाव)।
ऐतिहासिक सन्दर्भ.
विद्युत प्रवाह के निरंतर, पर्याप्त शक्तिशाली स्रोत के निर्माण के बाद ही व्यवस्थित विद्युत रासायनिक अनुसंधान करना संभव हो गया। ऐसा स्रोत 18वीं-19वीं शताब्दी के मोड़ पर सामने आया। एल. गैलवानी और ए. वोल्टा के कार्य के परिणामस्वरूप। मेंढक के शारीरिक कार्यों का अध्ययन करते समय, गैलवानी ने गलती से एक इलेक्ट्रोकेमिकल सर्किट बनाया जिसमें दो अलग-अलग धातुएं और एक विच्छेदित मेंढक पैर की मांसपेशी शामिल थी। जब तांबे के होल्डर से सुरक्षित पंजे को लोहे के तार से छुआ गया, जो होल्डर से भी जुड़ा था, तो मांसपेशी सिकुड़ गई। इसी तरह के संकुचन विद्युत निर्वहन के प्रभाव में हुए। गैलवानी ने इस घटना को "पशु बिजली" के अस्तित्व से समझाया। इन प्रयोगों की एक अलग व्याख्या वोल्टा द्वारा दी गई थी, जिनका मानना था कि बिजली दो धातुओं के संपर्क बिंदु पर उत्पन्न होती है, और मेंढक की मांसपेशियों का संकुचन इसके माध्यम से विद्युत प्रवाह के पारित होने का परिणाम है। करंट तब भी उत्पन्न होता था जब नमक के पानी में भिगोया हुआ स्पंजी पदार्थ (कपड़ा या कागज) दो धातु डिस्क, उदाहरण के लिए जस्ता और तांबा, के बीच रखा जाता था और सर्किट बंद कर दिया जाता था। इनमें से 15-20 "तत्वों" को श्रृंखला में जोड़कर, वोल्टा ने 1800 में पहला रासायनिक वर्तमान स्रोत - "वोल्टाइक कॉलम" बनाया।
रासायनिक प्रणालियों पर बिजली के प्रभाव ने तुरंत कई वैज्ञानिकों को दिलचस्पी दिखाई। पहले से ही 1800 में, डब्ल्यू निकोलसन और ए कार्लाइल ने बताया था कि जब "वोल्टाइक कॉलम" से जुड़े प्लैटिनम और सोने के तारों का उपयोग करके विद्युत प्रवाह पारित किया जाता है तो पानी हाइड्रोजन और ऑक्सीजन में विघटित हो जाता है। प्रारंभिक इलेक्ट्रोकेमिकल अध्ययनों में सबसे महत्वपूर्ण अंग्रेजी रसायनज्ञ एच. डेवी का काम था। 1807 में, उन्होंने थोड़ा नम ठोस पोटेशियम हाइड्रॉक्साइड के माध्यम से विद्युत धारा प्रवाहित करके पोटेशियम तत्व को अलग कर दिया। वोल्टेज स्रोत 100 गैल्वेनिक कोशिकाओं की बैटरी थी। धात्विक सोडियम इसी प्रकार प्राप्त किया गया। बाद में डेवी ने पारा इलेक्ट्रोड का उपयोग करके इलेक्ट्रोलिसिस द्वारा मैग्नीशियम, कैल्शियम, स्ट्रोंटियम और बेरियम को अलग किया।
डेवी के सहायक एम. फैराडे ने इलेक्ट्रोड/समाधान इंटरफ़ेस के माध्यम से बहने वाली बिजली की मात्रा (वर्तमान समय समय) और इसके कारण होने वाले रासायनिक परिवर्तनों के बीच संबंध की जांच की। इलेक्ट्रोलाइटिक सेल में जारी हाइड्रोजन और ऑक्सीजन की मात्रा से बिजली की मात्रा को मापने के लिए एक उपकरण (जिसे अब गैस कूलोमीटर के रूप में जाना जाता है) बनाया गया था, और यह दिखाया गया था (1833) कि एक निश्चित मात्रा में बिजली प्राप्त करने के लिए कितनी बिजली की आवश्यकता होती है पदार्थ इलेक्ट्रोड के आकार, उनके बीच की दूरी और सेल को खिलाने वाली बैटरी में प्लेटों की संख्या पर निर्भर नहीं करता है। इसके अलावा, फैराडे ने पाया कि इलेक्ट्रोलिसिस के दौरान निकलने वाले पदार्थ की मात्रा उसके रासायनिक समकक्ष और इलेक्ट्रोलाइट से गुजरने वाली बिजली की मात्रा के सीधे आनुपातिक होती है। (रासायनिक समतुल्य किसी तत्व या यौगिक के ग्राम की संख्या है जो यौगिकों में हाइड्रोजन के एक मोल परमाणुओं (1.0078 ग्राम) के साथ प्रतिक्रिया करता है या प्रतिस्थापित करता है; सेमी. समतुल्य द्रव्यमान)। इन दो मूलभूत प्रावधानों को फैराडे के नियम कहा जाता है। अपने मित्र डब्ल्यू. व्हीवेल, जो शास्त्रीय भाषाशास्त्र के विशेषज्ञ थे, के साथ मिलकर फैराडे ने इलेक्ट्रोकैमिस्ट्री में एक नई शब्दावली भी विकसित की। उन्होंने घोल में डूबे कंडक्टरों को इलेक्ट्रोड कहा (पहले उन्हें ध्रुव कहा जाता था); "इलेक्ट्रोलिसिस" (करंट के पारित होने से जुड़े रासायनिक परिवर्तन), "इलेक्ट्रोलाइट" (इलेक्ट्रोकेमिकल कोशिकाओं में तरल का संचालन), "एनोड" (इलेक्ट्रोड जिस पर ऑक्सीकरण प्रतिक्रिया होती है) और "कैथोड" (इलेक्ट्रोड जिस पर विद्युत प्रवाह होता है) की अवधारणाओं को पेश किया। कमी प्रतिक्रिया होती है)। उन्होंने तरल पदार्थों में आवेश वाहकों को आयन (ग्रीक से "वांडरर", "वांडरर") कहा, और एनोड (सकारात्मक इलेक्ट्रोड) की ओर बढ़ने वाले आयनों को "आयन" कहा, और कैथोड की ओर बढ़ने वाले आयनों को - "धनायन" कहा। विद्युत चुम्बकीय प्रेरण पर फैराडे के शोध से विद्युत जनरेटर का निर्माण हुआ, जिससे औद्योगिक पैमाने पर विद्युत रासायनिक प्रक्रियाओं को पूरा करना संभव हो गया।
फैराडे ने समाधानों में विद्युत धारा प्रवाहित करने की क्षमता की व्याख्या उनमें आयनों की उपस्थिति से की, लेकिन वे स्वयं और आई. हिट्टोर्फ और एफ. कोहलराउश जैसे अन्य वैज्ञानिकों का मानना था कि आयन धारा के प्रभाव में प्रकट होते हैं। 1884 में, एस. अरहेनियस ने सुझाव दिया कि वास्तव में, आयन तब बनते हैं जब नमक पानी में घुल जाता है। एस. अरहेनियस, जे. वान्ट हॉफ और डब्ल्यू. ओस्टवाल्ड के कार्य इलेक्ट्रोलाइट्स के सिद्धांत और समाधानों के भौतिक रासायनिक गुणों और उनके थर्मोडायनामिक्स के बारे में विचारों के विकास में एक महत्वपूर्ण मील का पत्थर थे। समाधान में आयनिक चालकता और संतुलन पर सिद्धांत और प्रयोगात्मक डेटा के बीच पत्राचार पी. डेबी और ई. हकेल द्वारा 1923 में आयनों के बीच लंबी दूरी के इलेक्ट्रोस्टैटिक इंटरैक्शन को ध्यान में रखने के बाद अधिक पूर्ण हो गया।
इलेक्ट्रोकेमिकल थर्मोडायनामिक्स में और विशेष रूप से इलेक्ट्रोकेमिकल सेल में विद्युत क्षमता (वोल्टेज) की प्रकृति और विद्युत, रासायनिक और थर्मल ऊर्जा के बीच संतुलन को स्पष्ट करने में जे. गिब्स और डब्ल्यू. नर्नस्ट द्वारा एक बड़ा योगदान दिया गया था। विद्युत रासायनिक क्षमता कोशिका में होने वाली प्रक्रियाओं की रासायनिक ऊर्जा से निर्धारित होती है, लेकिन उनकी गति (गतिकी) पर भी निर्भर करती है। इलेक्ट्रोड पर गतिज प्रक्रियाओं की मॉडलिंग वाई. टैफेल (1905), जे. बटलर (1924), एम. वोल्मर (1930), ए. एन. फ्रुमकिन (1930-1933) द्वारा की गई थी।
विद्युतरासायनिक कोशिकाएँ।
एक इलेक्ट्रोकेमिकल सेल में आमतौर पर दो अर्ध-सेल होते हैं, जिनमें से प्रत्येक अपने स्वयं के इलेक्ट्रोलाइट में डूबा हुआ एक इलेक्ट्रोड होता है। इलेक्ट्रोड विद्युत प्रवाहकीय सामग्री (धातु या कार्बन) या कम अक्सर अर्धचालक से बने होते हैं। इलेक्ट्रोड में आवेश वाहक इलेक्ट्रॉन होते हैं, और इलेक्ट्रोलाइट में आवेश वाहक आयन होते हैं। टेबल नमक (सोडियम क्लोराइड NaCl) का एक जलीय घोल, जो एक इलेक्ट्रोलाइट है, में आवेशित कण होते हैं: सोडियम धनायन Na + और क्लोरीन आयन सीएल -। यदि आप ऐसे घोल को विद्युत क्षेत्र में रखते हैं, तो Na+ आयन ऋणात्मक ध्रुव की ओर चले जाएंगे, और सीएल-आयन धनात्मक ध्रुव की ओर चले जाएंगे। पिघला हुआ नमक, जैसे NaCl, भी इलेक्ट्रोलाइट्स हैं। उदाहरण के लिए, इलेक्ट्रोलाइट्स ठोस भी हो सकते हैं बी- एल्यूमिना (सोडियम पॉलीएल्यूमिनेट) जिसमें मोबाइल सोडियम आयन, या आयन-एक्सचेंज पॉलिमर होते हैं।
अर्ध-कोशिकाओं को एक विभाजन द्वारा अलग किया जाता है, जो आयनों की गति में हस्तक्षेप नहीं करता है, लेकिन इलेक्ट्रोलाइट्स के मिश्रण को रोकता है। इस तरह के विभाजन की भूमिका एक नमक पुल, कांच के ऊन के दोनों सिरों पर बंद जलीय घोल वाली एक ट्यूब, एक आयन एक्सचेंज झिल्ली, या एक झरझरा ग्लास प्लेट द्वारा की जा सकती है। इलेक्ट्रोलाइटिक सेल के दोनों इलेक्ट्रोड को एक ही इलेक्ट्रोलाइट में डुबोया जा सकता है।
इलेक्ट्रोकेमिकल सेल दो प्रकार के होते हैं: गैल्वेनिक सेल और इलेक्ट्रोलाइटिक सेल (इलेक्ट्रोलाइज़र)। गैल्वेनिक सेल में, इलेक्ट्रोड/इलेक्ट्रोलाइट इंटरफेस पर रासायनिक प्रतिक्रियाएं अनायास होती हैं, और इलेक्ट्रोड एक कंडक्टर द्वारा एक दूसरे से जुड़े होते हैं। श्रृंखला में जुड़े कई गैल्वेनिक सेल एक बैटरी बनाते हैं - करंट का एक रासायनिक स्रोत। इलेक्ट्रोलाइटिक सेल में, इलेक्ट्रोड/इलेक्ट्रोलाइट इंटरफेस पर प्रतिक्रियाएं विद्युत ऊर्जा के बाहरी स्रोत के कारण होती हैं; उत्तरार्द्ध इलेक्ट्रोड पर होने वाले प्रतिक्रिया उत्पादों की रासायनिक ऊर्जा में परिवर्तित हो जाता है। गैल्वेनिक सेल की संरचना चित्र में दिखाई गई है। 1, और इलेक्ट्रोलाइज़र - चित्र में। 2. ध्यान दें कि वही सेल, ऑपरेटिंग मोड के आधार पर, गैल्वेनिक सेल या इलेक्ट्रोलाइज़र के रूप में व्यवहार कर सकता है। इस प्रकार, एक लेड-एसिड कार बैटरी इंजन शुरू करने के लिए (इसे डिस्चार्ज करते समय) गैल्वेनिक सेल के रूप में कार्य करती है, और कार जनरेटर या चार्जर से चार्ज होने पर इलेक्ट्रोलाइज़र के रूप में कार्य करती है।
1836 में जे. डेनियल (चित्र 1) द्वारा निर्मित एक साधारण गैल्वेनिक सेल में दो इलेक्ट्रोड होते हैं: जिंक, जिंक सल्फेट के जलीय घोल में डूबा हुआ, और तांबा, कॉपर (II) सल्फेट के जलीय घोल में डूबा हुआ। ऐसा तत्व वोल्टाइक कॉलम में तांबे-जस्ता जोड़े के समान है। जब बाहरी सर्किट बंद हो जाता है, तो जिंक इलेक्ट्रोड की सतह पर जिंक परमाणु इलेक्ट्रॉनों की रिहाई के साथ आयनों में ऑक्सीकृत हो जाते हैं: Zn® Zn 2+ + 2e -। ये इलेक्ट्रॉन बाहरी सर्किट के साथ कॉपर इलेक्ट्रोड की ओर बढ़ते हैं और कॉपर आयनों को परमाणुओं में बदल देते हैं: Cu 2+ + 2e - ® Cu। बाहरी सर्किट में इलेक्ट्रॉनों का प्रवाह तत्व द्वारा उत्पन्न धारा है। रासायनिक परिवर्तन और विद्युत ऊर्जा के उत्पादन की ओर ले जाने वाली समग्र प्रतिक्रिया का रूप होता है
बिल्कुल वैसी ही प्रतिक्रिया तब होती है जब कॉपर सल्फेट के घोल में धात्विक जस्ता मिलाया जाता है, लेकिन इस मामले में रासायनिक ऊर्जा तापीय ऊर्जा में परिवर्तित हो जाती है।
इलेक्ट्रोकेमिकल कोशिकाओं को अक्सर इलेक्ट्रोड और इलेक्ट्रोलाइट के बीच की सीमा को एक ऊर्ध्वाधर या स्लैश (| या /) के साथ और नमक पुल को दो स्लैश (//) के साथ दर्शाते हुए योजनाबद्ध रूप से दर्शाया जाता है। तो, चित्र में गैल्वेनिक सेल। 1 उत्तर प्रविष्टि
जहाँ M विलयन की दाढ़ सांद्रता है।
चित्र में दिखाए गए इलेक्ट्रोलाइटिक सेल में। 2, क्लोरीन और क्षार के उत्पादन के लिए औद्योगिक इलेक्ट्रोलाइज़र के समान ही प्रतिक्रियाएँ होती हैं: नमकीन पानी (सोडियम क्लोराइड का एक केंद्रित जलीय घोल) का क्लोरीन और सोडियम हाइड्रॉक्साइड NaOH में रूपांतरण:
ग्रेफाइट इलेक्ट्रोड पर क्लोराइड आयन क्लोरीन गैस में ऑक्सीकृत हो जाते हैं, और लोहे के इलेक्ट्रोड पर पानी हाइड्रोजन और हाइड्रॉक्साइड आयन में अपचयित हो जाता है। इलेक्ट्रोलाइट्स एक विभाजन के माध्यम से सोडियम आयनों की गति के कारण विद्युत रूप से तटस्थ रहते हैं - एक आयन विनिमय झिल्ली। जिस इलेक्ट्रोड पर ऑक्सीकरण होता है (चित्र 1 में जिंक और चित्र 2 में ग्रेफाइट) को एनोड कहा जाता है, और जिस इलेक्ट्रोड पर ऑक्सीकरण होता है उसे कैथोड कहा जाता है।
इलेक्ट्रोड क्षमता.
इलेक्ट्रोकेमिकल कोशिकाओं के मुख्य विद्युत पैरामीटर वर्तमान (एम्पीयर, ए में मापा जाता है) और क्षमता (वोल्ट, वी में मापा जाता है) हैं। वर्तमान ताकत इलेक्ट्रोड प्रतिक्रियाओं की दर से निर्धारित होती है, और क्षमता सेल में होने वाली प्रक्रियाओं की रासायनिक ऊर्जा से निर्धारित होती है। यह ऊर्जा (जूल, जे में मापी गई) को बिजली की मात्रा (कूलॉम, सी में मापी गई) से विभाजित करने के बराबर है, यानी। 1 वी = 1 जे / सी.एल. इसलिए, किसी तत्व की क्षमता (इलेक्ट्रोमोटिव बल, ईएमएफ) उसमें होने वाली प्रतिक्रियाओं के दौरान उत्पन्न ऊर्जा का एक माप है। यदि बाहरी सर्किट खुला है, तो कोई इलेक्ट्रोड प्रतिक्रिया नहीं होती है।
एक खुले बाहरी सर्किट वाले गैल्वेनिक सेल की क्षमता इसकी प्रतिक्रियाओं की थर्मोडायनामिक्स के बारे में जानकारी प्रदान करती है। चित्र में दिखाए गए तत्व की क्षमता। 1, 1 एम की समाधान सांद्रता और 25 डिग्री सेल्सियस के तापमान पर - इसकी मानक क्षमता इ° - 1.10 वी के बराबर। संगत ऊर्जा, गिब्स थर्मोडायनामिक क्षमता, डी जी°, द्वारा दिया गया है
कहाँ एन- प्रतिक्रिया के दौरान स्थानांतरित इलेक्ट्रॉनों की संख्या (इस मामले में 2), एफ– फैराडे संख्या (96485 सी / तिल)। एक गैल्वेनिक सेल की क्षमता उसके दो अर्ध-सेलों के बीच संभावित अंतर के बराबर होती है, अर्थात। इसकी इलेक्ट्रोड क्षमता में अंतर। इलेक्ट्रोड क्षमता को संदर्भ इलेक्ट्रोड की क्षमता के सापेक्ष मापा जाता है, जिसे पारंपरिक रूप से शून्य माना जाता है ( सेमी. मेज़)। सहमति से, एक सामान्य हाइड्रोजन इलेक्ट्रोड (एन.एच.ई.) को मानक इलेक्ट्रोड के रूप में चुना गया था; यह एक प्लैटिनम प्लेट है, जिसे प्लैटिनम ब्लैक से लेपित किया जाता है, 1.01H 10 5 Pa (1 एटीएम) के दबाव पर हाइड्रोजन गैस से संतृप्त किया जाता है, और थर्मोडायनामिक गतिविधि के साथ H + आयन युक्त घोल में डुबोया जाता है। ए= 1. योजनाबद्ध रूप से, इस इलेक्ट्रोड को Pt/H 2 (1.01H 10 5 Pa)/H + ( ए= 1). इस पर प्रतिक्रिया 2H + + 2e – ® H 2 होती है। Cu/Cu 2+ कॉपर इलेक्ट्रोड की मानक क्षमता निर्धारित करने के लिए, निम्नलिखित गैल्वेनिक सेल को इकट्ठा करें:
और अर्ध-प्रतिक्रिया Cu 2+ + 2e - ® Cu के लिए माप देता है
इसी प्रकार, Zn/Zn 2+ अर्ध-सेल के लिए, जिसमें प्रतिक्रिया Zn 2+ + 2e - ® Zn होती है, हम प्राप्त करते हैं
इन दो मानक इलेक्ट्रोड क्षमता के बीच का अंतर Zn-Cu तत्व की मानक क्षमता के बराबर है।
वास्तव में, हाइड्रोजन इलेक्ट्रोड का उपयोग शायद ही कभी पोटेंशियोमेट्रिक माप में किया जाता है, क्योंकि यह एक आदर्श प्रणाली का प्रतिनिधित्व करता है जिसे व्यवहार में लागू करना मुश्किल है। बहुत अधिक बार, विभिन्न प्रकार के अधिक सुविधाजनक और कॉम्पैक्ट तुलना इलेक्ट्रोड का उपयोग किया जाता है, जिसमें वर्तमान के सापेक्ष एक विशिष्ट, सावधानीपूर्वक मापा गया संभावित मूल्य होता है। आमतौर पर वे कैलोमेल इलेक्ट्रोड (सीई) का उपयोग करते हैं, जिसमें धात्विक पारा, पारा क्लोराइड (कैलोमेल) और पोटेशियम क्लोराइड का एक समाधान होता है: एचजी /एचजी 2 सीएल 2 /केसीएल। इलेक्ट्रोड पर निम्नलिखित प्रतिक्रिया होती है:
संभावित k.e. पारा आयनों की सांद्रता पर निर्भर करता है, और बाद वाला KCl घोल की सांद्रता पर निर्भर करता है। संतृप्त KCl घोल के लिए इ° (k.e.) av = 0.2412 V (ne.) 25° C पर।
|
मानक इलेक्ट्रोड क्षमताएँ |
|
| इलेक्ट्रोड प्रतिक्रिया |
इओ , वी |
| ली + + ई - ® ली | |
| एमजी 2+ + 2ई - ® एमजी | |
| अल 3+ + 3e – ® अल | |
| Zn 2+ + 2e – ® Zn | |
| सीआर 3+ + ई - ® सीआर 2+ | |
| 2H + + 2e – ® H 2 | |
| Cu 2+ + 2e – ® Cu | |
| Fe 3+ + e – ® Fe 2+ | |
| O 2 + 4H + + 4e – ® 2H 2 O | |
| सीएल 2 + 2ई - ® 2सीएल - | |
| एफ 2 + 2ई - ® 2एफ - | |
ध्यान दें कि कुछ इलेक्ट्रोडों का पदार्थ संबंधित प्रतिक्रिया के समीकरण में शामिल नहीं है। हाँ, प्रतिक्रिया
वास्तव में यह Pt/Fe 3+, Fe 2+ सेल में प्लैटिनम इलेक्ट्रोड पर होता है। प्लैटिनम इलेक्ट्रोड निष्क्रिय है और केवल तत्व के ऑक्सीकृत और कम रूपों वाले इलेक्ट्रोलाइट के साथ संपर्क प्रदान करता है (इस मामले में, द्विसंयोजक और त्रिसंयोजक लौह आयन)। प्लैटिनम इलेक्ट्रोड एन.वी.ई. में समान भूमिका निभाता है।
इलेक्ट्रोड क्षमता की तालिकाएं आपको इलेक्ट्रोड क्षमता के आधार पर गैल्वेनिक सेल की ईएमएफ की गणना करने की अनुमति देती हैं। उनका उपयोग यह अनुमान लगाने के लिए भी किया जा सकता है कि कोई विशेष रेडॉक्स प्रतिक्रिया घटित होगी या नहीं। हम एक मानक इलेक्ट्रोड क्षमता के बारे में तभी बात कर सकते हैं जब प्रतिक्रिया में भाग लेने वाले घटकों की गतिविधि 1 के बराबर हो, यानी। घोल में उनकी सांद्रता 1M के करीब है। इलेक्ट्रोड क्षमता इविलयन में ऑक्सीकृत और अपचित रूपों की सांद्रता पर निर्भर करता है और उनसे और मानक क्षमता से संबंधित होता है इ° नर्नस्ट समीकरण। सामान्यीकृत प्रतिक्रिया के लिए
बैल + एनई - = लाल
इस समीकरण का रूप है
कहाँ आर- सार्वभौमिक गैस स्थिरांक, टी- पूर्ण तापमान, और - ऑक्सीकृत और कम रूपों की गतिविधियाँ। शुद्ध ठोस एवं द्रवों की क्रियाएँ 1. 25° C पर मानी जाती हैं आरटी/एफ= 0.025 वी। संदर्भ इलेक्ट्रोड की क्षमता के सापेक्ष इलेक्ट्रोड क्षमता को मापकर, समीकरण (10) का उपयोग करके समाधान में पदार्थों की सांद्रता निर्धारित करना संभव है; इस विधि को पोटेंशियोमेट्री कहा जाता है।
इलेक्ट्रोड प्रतिक्रियाएं.
पोटेंशियोमेट्रिक माप उन परिस्थितियों में किया जाता है जब इलेक्ट्रोकेमिकल सेल में कोई करंट नहीं होता है। इसका मतलब यह है कि इसमें कोई समग्र रासायनिक परिवर्तन नहीं होता है, और मापी गई क्षमता (संतुलन) प्रतिक्रियाओं के थर्मोडायनामिक्स द्वारा निर्धारित की जाती है। इन शर्तों के तहत, इलेक्ट्रोड के आकार और आकार या समाधान को हिलाने की तीव्रता जैसे कारक मापी गई क्षमता को प्रभावित नहीं करते हैं। यदि किसी इलेक्ट्रोकेमिकल सेल से धारा प्रवाहित होती है, तो इलेक्ट्रोड प्रतिक्रियाओं की दर न केवल थर्मोडायनामिक मापदंडों पर निर्भर करती है, बल्कि समीकरण के अनुसार वर्तमान ताकत पर भी निर्भर करती है।
कहाँ एन- किसी दिए गए इलेक्ट्रोड प्रतिक्रिया में भाग लेने वाले इलेक्ट्रॉनों की संख्या, एफ– फैराडे संख्या. इस मामले में, इलेक्ट्रोकेमिकल सेल की क्षमता गतिज कारकों के साथ-साथ उस सामग्री पर भी निर्भर करती है जिससे इलेक्ट्रोड बनाया जाता है, इलेक्ट्रोड का आकार और आकार, समाधान को हिलाने की तीव्रता और कई अन्य कारक। कोशिका के आंतरिक प्रतिरोध की उपेक्षा नहीं की जा सकती। दोनों इलेक्ट्रोड/इलेक्ट्रोलाइट सीमाओं पर संभावित अंतर के अलावा, इसके प्रतिरोध के कारण समाधान में वोल्टेज ड्रॉप भी होता है। यह वोल्टेज ड्रॉप दोनों इलेक्ट्रोडों पर होने वाली प्रतिक्रियाओं से जुड़े प्रभावों का अध्ययन करना मुश्किल बना देता है। आम तौर पर, प्रतिक्रिया का अध्ययन एक इलेक्ट्रोड पर किया जाता है, जिसे तीन-इलेक्ट्रोड सेल (चित्र 3) का उपयोग करके कार्यशील या संकेतक इलेक्ट्रोड कहा जाता है: तीसरा इलेक्ट्रोड (उदाहरण के लिए, संतृप्त कैलोमेल) को कार्यशील के समान डिब्बे में रखा जाता है। एक, ओमिक वोल्टेज ड्रॉप के प्रभाव को कम करने के लिए जितना संभव हो उतना करीब। संदर्भ इलेक्ट्रोड के सापेक्ष इस इलेक्ट्रोड की क्षमता के एक फ़ंक्शन के रूप में कार्यशील इलेक्ट्रोड के माध्यम से वर्तमान को मापकर, तथाकथित ध्रुवीकरण वक्र.
जब कोई बाहरी धारा प्रवाहित की जाती है, तो इलेक्ट्रोड क्षमता संतुलन क्षमता से भिन्न होती है। इस विचलन को ध्रुवीकरण कहा जाता है, और इसके परिमाण को ओवरवोल्टेज कहा जाता है। ओवरवॉल्टेज कई कारकों पर निर्भर करता है जो इलेक्ट्रोड प्रतिक्रियाओं की दर को सीमित करते हैं। किसी दिए गए वर्तमान घनत्व (प्रति यूनिट इलेक्ट्रोड सतह पर वर्तमान ताकत) पर तेज़ इलेक्ट्रोड प्रतिक्रियाएं थर्मोडायनामिक के करीब की क्षमता पर होती हैं, और इसलिए कम ओवरवोल्टेज पर होती हैं। धीमी प्रतिक्रियाओं की विशेषता उच्च ओवरवोल्टेज है। इलेक्ट्रोड प्रतिक्रियाओं की दर, और इसलिए ओवरवॉल्टेज, अभिकर्मकों की एकाग्रता, तापमान, विलायक, इलेक्ट्रोड सामग्री, बड़े पैमाने पर स्थानांतरण की विधि और गति और वर्तमान घनत्व पर निर्भर करती है। कुल ओवरवॉल्टेज को कई घटकों में विघटित किया जा सकता है: एकाग्रता, सक्रियण और प्रतिक्रिया।
सांद्रण ओवरवोल्टेज इस तथ्य के कारण होता है कि जब कोई करंट प्रवाहित होता है, तो इलेक्ट्रोड की सतह पर प्रतिक्रिया करने वाले आयन की सांद्रता बदल जाती है, क्योंकि इस क्षेत्र में इलेक्ट्रोएक्टिव पदार्थों की खपत होती है और प्रतिक्रिया उत्पाद बनते हैं। आइए तांबे के इलेक्ट्रोड पर Cu 2+ की कमी पर विचार करें। प्रारंभ में, घोल में Cu 2+ की सांद्रता 1M है। सर्किट में करंट की अनुपस्थिति में, कॉपर इलेक्ट्रोड की क्षमता Cu/Cu 2+ जोड़ी की मानक क्षमता के करीब है, यानी। एन.ई. के सापेक्ष 0.34 वी. [ सेमी. समीकरण (6)]। जैसे ही कैथोड करंट गुजरता है, इलेक्ट्रोड सतह पर Cu 2+ आयनों की सांद्रता कम हो जाती है, और नर्नस्ट समीकरण (10) के अनुसार कैथोड क्षमता तेजी से नकारात्मक हो जाती है। अभिकर्मक के ताजा हिस्से समाधान से इलेक्ट्रोड तक विभिन्न तरीकों से पहुंचते हैं: प्रसार, संवहन और प्रवासन के परिणामस्वरूप। इन प्रक्रियाओं की गति जितनी अधिक होगी (उदाहरण के लिए, मिश्रण जितना तीव्र होगा), सांद्रता ओवरवॉल्टेज उतना ही कम होगा। कुल ओवरवॉल्टेज के इस घटक की गणना अक्सर की जा सकती है। यदि सांद्रता ध्रुवीकरण कुल ओवरवोल्टेज में मुख्य योगदान देता है (इसका मतलब है कि इलेक्ट्रोड प्रतिक्रिया के शेष चरणों की दर अधिक है), तो प्रतिक्रिया को प्रतिवर्ती या नर्नस्टियन कहा जाता है।
सक्रियण ओवरवॉल्टेज इस तथ्य के परिणामस्वरूप होता है कि इलेक्ट्रोड सतह पर इलेक्ट्रॉन स्थानांतरण तुरंत नहीं होता है, बल्कि एक सीमित गति से होता है। आइए हम सामान्यीकृत इलेक्ट्रोड प्रतिक्रिया ox + पर विचार करें एनई - = लाल. एक निश्चित दर पर (यानी, किसी दिए गए वर्तमान घनत्व पर) ऑक्सीकृत यौगिकों में इलेक्ट्रॉनों को स्थानांतरित करने के लिए, इलेक्ट्रोड प्रतिक्रिया की सक्रियण ऊर्जा नामक ऊर्जा बाधा को दूर करना आवश्यक है। इस ऊर्जा की आपूर्ति लागू क्षमता द्वारा की जाती है। वर्तमान घनत्व और सक्रियण ओवरवॉल्टेज के बीच संबंध को बटलर-वोल्मर और टैफेल समीकरणों द्वारा वर्णित किया गया है, जिसका उपयोग इलेक्ट्रोड प्रतिक्रियाओं के गतिज मापदंडों को निर्धारित करने के लिए किया जा सकता है। कई इलेक्ट्रोड प्रतिक्रियाएं, जैसे पानी का हाइड्रोजन में अपचयन और इसका ऑक्सीजन में ऑक्सीकरण, धीरे-धीरे होती हैं। इलेक्ट्रोड प्रतिक्रिया की दर काफी हद तक उस सामग्री पर निर्भर हो सकती है जिससे इलेक्ट्रोड बनाया जाता है और उसकी सतह के गुणधर्म पर। उदाहरण के लिए, एक पारा इलेक्ट्रोड पर, पानी को हाइड्रोजन में कम करना काफी कठिन होता है: यह उच्च हाइड्रोजन ओवरवोल्टेज की विशेषता है। यह प्रतिक्रिया प्लैटिनम पर बहुत तेजी से और कम ओवरवॉल्टेज के साथ होती है; यही कारण है कि प्लैटिनम का उपयोग हाइड्रोजन संदर्भ इलेक्ट्रोड में किया जाता है। प्रतिक्रियाओं की दर उन पदार्थों पर भी निर्भर करती है जो इलेक्ट्रोड सतह पर सोख लिए जाते हैं या उससे बंधे होते हैं; इस प्रकार, साइनाइड आयन और कई कार्बनिक यौगिक प्लैटिनम इलेक्ट्रोड की सतह पर हाइड्रोजन के विकास की दर को कम कर देते हैं। साथ ही, कुछ सर्फेक्टेंट इलेक्ट्रोड प्रतिक्रिया की दर में काफी वृद्धि कर सकते हैं - उन्हें इलेक्ट्रोकैटलिस्ट कहा जाता है।
प्रतिक्रिया ओवरवोल्टेज तब होता है जब इलेक्ट्रोड पर इलेक्ट्रॉनों का स्थानांतरण समाधान में रासायनिक प्रतिक्रिया के साथ जुड़ा होता है। ऐसी प्रतिक्रिया इलेक्ट्रॉन स्थानांतरण में शामिल कणों के स्रोत के रूप में काम कर सकती है, और साथ ही संपूर्ण इलेक्ट्रोड प्रक्रिया की दर को सीमित कर सकती है। यही कारण है कि इलेक्ट्रोड प्रतिक्रियाओं के तंत्र (यानी, चरणों और मध्यवर्ती अवस्थाओं) का विवरण जानना बहुत महत्वपूर्ण है। कई मामलों में, प्रारंभिक सामग्री इलेक्ट्रोड पर अंतिम उत्पाद बनने से पहले कई परिवर्तनों से गुजरती है, जैसे कि पानी में ऑक्सीजन की कमी के मामले में, यह अत्यधिक व्यावहारिक महत्व की प्रक्रिया है। समग्र प्रतिक्रिया का स्वरूप होता है
और इसमें कई चरण होते हैं, जिनमें से एक में ऑक्सीजन-ऑक्सीजन बंधन टूट जाता है। इस बहु-चरण प्रतिक्रिया के कारण, अधिकांश इलेक्ट्रोड पर प्रतिक्रिया धीमी होती है, और औद्योगिक पैमाने पर इसे इलेक्ट्रोकैटलिस्ट की उपस्थिति में किया जाता है। इलेक्ट्रोड प्रतिक्रियाओं के तंत्र का अध्ययन नीचे वर्णित इलेक्ट्रोएनालिटिकल तरीकों का उपयोग करके किया जाता है। जब विलयन की संरचना और विलायक की प्रकृति बदल जाती है तो अक्सर प्रतिक्रिया की दिशा बदल जाती है। उदाहरण के लिए, एसीटोनिट्राइल में ऑक्सीजन की कमी, जहां प्रोटॉन की कमी होती है, एक सरल एक-इलेक्ट्रॉन तंत्र के अनुसार आगे बढ़ती है:
विश्लेषण के विद्युत रासायनिक तरीके।
रासायनिक पदार्थों के गुणात्मक और मात्रात्मक विश्लेषण के लिए विभिन्न इलेक्ट्रोकेमिकल विधियां विकसित की गई हैं, जो अक्सर इलेक्ट्रोड प्रतिक्रियाओं के थर्मोडायनामिक और गतिज मापदंडों को निर्धारित करने और उनके तंत्र का अध्ययन करने के लिए भी उपयोगी होती हैं।
कंडक्टोमेट्री
यह किसी विलयन की विद्युत चालकता को मापने पर आधारित है और इसका उपयोग लवण, अम्ल, क्षार आदि की सांद्रता निर्धारित करने के लिए किया जाता है। कंडक्टोमेट्रिक निर्धारण में, आमतौर पर समान सामग्रियों से बने इलेक्ट्रोड का उपयोग किया जाता है, और उनके संचालन के लिए शर्तों को इस तरह से चुना जाता है ताकि इलेक्ट्रोड/इलेक्ट्रोलाइट इंटरफेस दोनों पर संभावित छलांग के योगदान को कम किया जा सके (उदाहरण के लिए, उच्च आवृत्ति प्रत्यावर्ती धारा का उपयोग किया जाता है) ). इस मामले में, मापी गई सेल क्षमता में मुख्य योगदान ओमिक वोल्टेज ड्रॉप द्वारा किया जाता है आईआर, कहाँ आर- समाधान प्रतिरोध. एक-घटक समाधान की विद्युत चालकता इसकी एकाग्रता से संबंधित हो सकती है, और जटिल संरचना के इलेक्ट्रोलाइट्स की विद्युत चालकता को मापने से समाधान में कुल आयन सामग्री का अनुमान लगाया जा सकता है और इसका उपयोग किया जाता है, उदाहरण के लिए, आसुत की गुणवत्ता की निगरानी में या विआयनीकृत पानी. एक अन्य प्रकार की कंडक्टोमेट्री में - कंडक्टोमेट्रिक अनुमापन - एक ज्ञात अभिकर्मक को विश्लेषण किए गए समाधान में भागों में जोड़ा जाता है और विद्युत चालकता में परिवर्तन की निगरानी की जाती है। तुल्यता बिंदु, जिस पर विद्युत चालकता में तीव्र परिवर्तन नोट किया जाता है, जोड़े गए अभिकर्मक की मात्रा पर इस मान की निर्भरता के ग्राफ से निर्धारित होता है।
पोटेंशियोमेट्री
गैल्वेनिक सेल की क्षमता पर डेटा के आधार पर विभिन्न भौतिक रासायनिक मापदंडों को निर्धारित करने के लिए उपयोग किया जाता है। इलेक्ट्रोकेमिकल सर्किट में करंट की अनुपस्थिति में इलेक्ट्रोड क्षमता, संदर्भ इलेक्ट्रोड के सापेक्ष मापा जाता है, नर्नस्ट समीकरण द्वारा समाधान की एकाग्रता से संबंधित है। पोटेंशियोमेट्रिक माप में, आयन-चयनात्मक इलेक्ट्रोड का व्यापक रूप से उपयोग किया जाता है जो मुख्य रूप से समाधान में एक आयन के प्रति संवेदनशील होते हैं: पीएच को मापने के लिए एक ग्लास इलेक्ट्रोड और सोडियम, अमोनियम, फ्लोरीन, कैल्शियम, मैग्नीशियम, आदि आयनों के चयनात्मक निर्धारण के लिए इलेक्ट्रोड। सतह आयन-चयनात्मक इलेक्ट्रोड की परत में एंजाइम शामिल हो सकते हैं, और परिणाम एक प्रणाली है जो उपयुक्त सब्सट्रेट के प्रति संवेदनशील है। ध्यान दें कि आयन-चयनात्मक इलेक्ट्रोड की क्षमता इलेक्ट्रॉनों के स्थानांतरण से निर्धारित नहीं होती है, जैसा कि इलेक्ट्रॉनिक चालकता वाले पदार्थों के मामले में होता है, बल्कि मुख्य रूप से आयनों के स्थानांतरण या विनिमय से होता है। हालाँकि, नर्नस्ट समीकरण, जो समाधान में किसी पदार्थ की एकाग्रता (या गतिविधि) के लघुगणक के लिए इलेक्ट्रोड क्षमता से संबंधित है, ऐसे इलेक्ट्रोड पर भी लागू होता है। पोटेंशियोमेट्रिक अनुमापन में, अभिकर्मक को भागों में विश्लेषण किए जा रहे समाधान में जोड़ा जाता है और क्षमता में परिवर्तन की निगरानी की जाती है। इस प्रकार के अनुमापन की विशेषता वाले एस-आकार के वक्र किसी को समतुल्य बिंदु निर्धारित करने और संतुलन स्थिरांक और मानक क्षमता जैसे थर्मोडायनामिक मापदंडों को खोजने की अनुमति देते हैं।
वोल्टामेट्री।
वोल्टामेट्रिक विधियों की सभी किस्में 10-7-10-1 सेमी2 के सतह क्षेत्र के साथ एक कार्यशील माइक्रोइलेक्ट्रोड का उपयोग करती हैं। इसकी सहायता से प्राप्त वर्तमान-वोल्टेज वक्र विघटित पदार्थों की पहचान करना, उनकी एकाग्रता निर्धारित करना और अक्सर थर्मोडायनामिक और गतिज मापदंडों को निर्धारित करना संभव बनाते हैं। पहली वोल्टामेट्रिक विधि - पोलरोग्राफी - 1922 में चेक रसायनज्ञ जे. हेयरोव्स्की द्वारा प्रस्तावित की गई थी। उनके सेटअप में काम करने वाला इलेक्ट्रोड एक टपकता हुआ पारा इलेक्ट्रोड था। पारा में उच्च हाइड्रोजन ओवरवोल्टेज है, इसलिए पारा इलेक्ट्रोड नकारात्मक क्षमता पर होने वाली प्रक्रियाओं का अध्ययन करने के लिए सुविधाजनक है। माप प्रक्रिया के दौरान इलेक्ट्रोड की सतह को लगातार नवीनीकृत किया जाता है, जिससे इलेक्ट्रोड का संदूषण समाप्त हो जाता है। प्लैटिनम और कार्बन जैसे ठोस इलेक्ट्रोडों का उपयोग करके वोल्टामेट्रिक अध्ययन भी किए जाते हैं, और सकारात्मक क्षमता पर होने वाली प्रक्रियाओं का उपयोग किया जाता है। रैखिक संभावित स्वीप वोल्टामेट्री (क्रोनोएम्पेरोमेट्री) में, क्षमता समय के साथ रैखिक रूप से बदलती है और समाधान को हिलाया नहीं जाता है, ताकि बड़े पैमाने पर स्थानांतरण केवल प्रसार के कारण हो। चक्रीय वोल्टामेट्री में, बार-बार त्रिकोणीय वोल्टेज पल्स को एक इलेक्ट्रोड पर लागू किया जाता है। चक्र के आरोही भाग में बनने वाले पदार्थों का अध्ययन इसके अवरोही भाग में किया जाता है। यह विधि विभिन्न संभावित स्वीप दरों और विभिन्न समाधान सांद्रता पर ध्रुवीकरण वक्रों का विश्लेषण करके इलेक्ट्रोड प्रतिक्रियाओं के तंत्र का अध्ययन करने के लिए विशेष रूप से प्रभावी है। वोल्टामेट्री के अन्य प्रकार हैं - डिफरेंशियल पल्स और स्क्वायर वेव - जिसमें विभिन्न आकृतियों के वोल्टेज पल्स को रैखिक रूप से बढ़ती क्षमता पर आरोपित किया जाता है। समाधान में पदार्थों की छोटी सांद्रता निर्धारित करने के लिए इन विधियों का व्यापक रूप से उपयोग किया जाता है। यदि वोल्टामेट्रिक माप के दौरान समाधान मिलाया जाता है, जिसका अर्थ है कि संवहन और प्रसार का उपयोग करके बड़े पैमाने पर स्थानांतरण एक साथ होता है, तो हम हाइड्रोडायनामिक वोल्टामेट्री की बात करते हैं। इस मामले में, घूर्णन डिस्क इलेक्ट्रोड का उपयोग करना सुविधाजनक है, क्योंकि प्रयोगात्मक वर्तमान-वोल्टेज वक्रों की तुलना सीधे सैद्धांतिक लोगों से की जा सकती है।
एम्पेरोमेट्री।
यह विधि सूचक इलेक्ट्रोड और संदर्भ इलेक्ट्रोड के बीच एक निश्चित वोल्टेज पर एक समाधान के माध्यम से गुजरने वाली सीमित प्रसार धारा को मापने पर आधारित है। एम्परोमेट्रिक अनुमापन में, तुल्यता बिंदु वर्तमान वक्र में विराम द्वारा निर्धारित किया जाता है - जोड़े गए कार्यशील समाधान की मात्रा। क्रोनोएम्परोमेट्रिक विधियाँ समय पर धारा की निर्भरता को मापने पर आधारित हैं और मुख्य रूप से प्रसार गुणांक और दर स्थिरांक निर्धारित करने के लिए उपयोग की जाती हैं। लघु इलेक्ट्रोकेमिकल कोशिकाएं जो तरल क्रोमैटोग्राफ कॉलम के आउटपुट पर सेंसर के रूप में काम करती हैं, एम्परोमेट्री (साथ ही वोल्टामेट्री) के सिद्धांत पर काम करती हैं। गैल्वेनोस्टैटिक विधियां एम्परोमेट्रिक विधियों के समान हैं, लेकिन जब एक निश्चित मात्रा में करंट सेल से होकर गुजरता है तो वे क्षमता को मापते हैं। इस प्रकार, क्रोनोपोटेंटियोमेट्री में, समय के साथ क्षमता में परिवर्तन को नियंत्रित किया जाता है। इन विधियों का उपयोग मुख्य रूप से इलेक्ट्रोड प्रतिक्रियाओं की गतिशीलता का अध्ययन करने के लिए किया जाता है।
कूलोमेट्री।
कूलोमेट्री में, एक नियंत्रित क्षमता पर, किसी घोल का पूर्ण इलेक्ट्रोलिसिस अपेक्षाकृत बड़े कार्यशील इलेक्ट्रोड (निचला पारा या प्लैटिनम जाल) के साथ इलेक्ट्रोलाइज़र में गहनता से मिलाकर किया जाता है। बिजली की कुल मात्रा ( क्यू, सी) इलेक्ट्रोलिसिस के लिए आवश्यक पदार्थ बनाने वाले पदार्थ की मात्रा से संबंधित है ( ए, डी) फैराडे का नियम:
कहाँ एम- कहते हैं द्रव्यमान (जी/मोल), एफ- फैराडे संख्या. कूलोमेट्रिक अनुमापन में इलेक्ट्रोलाइटिक रूप से एक अभिकर्मक उत्पन्न करने के लिए निरंतर धारा का उपयोग करना शामिल होता है जो निर्धारित किए जा रहे पदार्थ के साथ प्रतिक्रिया करता है। अनुमापन की प्रगति को पोटेंशियोमेट्रिक या एम्परोमेट्रिक रूप से नियंत्रित किया जाता है। कूलोमेट्रिक विधियां सुविधाजनक हैं क्योंकि वे प्रकृति में निरपेक्ष हैं (यानी, वे आपको अंशांकन वक्रों का सहारा लिए बिना विश्लेषण की मात्रा की गणना करने की अनुमति देते हैं) और इलेक्ट्रोलिसिस स्थितियों और इलेक्ट्रोलाइज़र मापदंडों (इलेक्ट्रोड सतह क्षेत्र या सरगर्मी तीव्रता) में परिवर्तन के प्रति असंवेदनशील हैं। कूलोग्रैविमेट्री में, इलेक्ट्रोलिसिस से गुजरने वाले पदार्थ की मात्रा इलेक्ट्रोलिसिस से पहले और बाद में इलेक्ट्रोड का वजन करके निर्धारित की जाती है।
अन्य इलेक्ट्रोएनालिटिकल तरीके भी हैं। प्रत्यावर्ती धारा पोलारोग्राफी में, एक कम आयाम वाले साइनसॉइडल वोल्टेज को एक विस्तृत आवृत्ति रेंज पर रैखिक रूप से भिन्न क्षमता पर लागू किया जाता है और परिणामी प्रत्यावर्ती धारा या प्रतिबाधा के आयाम और चरण बदलाव को निर्धारित किया जाता है। इन आंकड़ों से, समाधान में पदार्थों की प्रकृति और इलेक्ट्रोड प्रतिक्रियाओं के तंत्र और गतिकी के बारे में जानकारी प्राप्त होती है। पतली परत विधियाँ 10-100 µm मोटी इलेक्ट्रोलाइट परत वाली इलेक्ट्रोकेमिकल कोशिकाओं का उपयोग करती हैं। ऐसी कोशिकाओं में, इलेक्ट्रोलिसिस पारंपरिक इलेक्ट्रोलाइज़र की तुलना में तेज़ी से आगे बढ़ता है। इलेक्ट्रोड प्रक्रियाओं का अध्ययन करने के लिए, स्पेक्ट्रोफोटोमेट्रिक पंजीकरण के साथ स्पेक्ट्रोकेमिकल विधियों का उपयोग किया जाता है। इलेक्ट्रोड की सतह पर बने पदार्थों का विश्लेषण करने के लिए, दृश्य, यूवी और आईआर क्षेत्रों में प्रकाश के उनके अवशोषण को मापा जाता है। इलेक्ट्रोड सतह और माध्यम के गुणों में परिवर्तन की निगरानी विद्युत प्रतिबिंब और एलिप्सोमेट्री विधियों का उपयोग करके की जाती है, जो इलेक्ट्रोड सतह से विकिरण के प्रतिबिंब को मापने पर आधारित होते हैं। इनमें स्पेक्युलर परावर्तन और प्रकाश के रमन प्रकीर्णन (रमन स्पेक्ट्रोस्कोपी), द्वितीय हार्मोनिक स्पेक्ट्रोस्कोपी (फूरियर स्पेक्ट्रोस्कोपी) की विधियाँ शामिल हैं।
अन्य विद्युत रासायनिक घटनाएँ और विधियाँ।
इलेक्ट्रोलाइट और आवेशित कणों या सतहों की सापेक्ष गति के साथ, इलेक्ट्रोकेनेटिक प्रभाव उत्पन्न होते हैं। इस प्रकार का एक महत्वपूर्ण उदाहरण वैद्युतकणसंचलन है, जिसमें विद्युत क्षेत्र में गतिमान आवेशित कणों (उदाहरण के लिए, प्रोटीन अणु या कोलाइडल कण) का पृथक्करण होता है। जैल में प्रोटीन या डीऑक्सीराइबोन्यूक्लिक एसिड (डीएनए) को अलग करने के लिए इलेक्ट्रोफोरेटिक तरीकों का व्यापक रूप से उपयोग किया जाता है। जीवित जीवों के कामकाज में विद्युत घटनाएं एक बड़ी भूमिका निभाती हैं: वे तंत्रिका आवेगों की उत्पत्ति और प्रसार, ट्रांसमेम्ब्रेन क्षमता की घटना आदि के लिए जिम्मेदार हैं। जैविक प्रणालियों और उनके घटकों का अध्ययन करने के लिए विभिन्न विद्युत रासायनिक विधियों का उपयोग किया जाता है। विद्युत रासायनिक प्रक्रियाओं पर प्रकाश के प्रभाव का अध्ययन करना भी रुचिकर है। इस प्रकार, फोटोइलेक्ट्रोकेमिकल अनुसंधान का विषय विद्युत ऊर्जा का उत्पादन और प्रकाश के प्रभाव में रासायनिक प्रतिक्रियाओं की शुरुआत है, जो सौर ऊर्जा को विद्युत ऊर्जा में परिवर्तित करने की दक्षता बढ़ाने के लिए बहुत महत्वपूर्ण है। टाइटेनियम डाइऑक्साइड, कैडमियम सल्फाइड, गैलियम आर्सेनाइड और सिलिकॉन से बने सेमीकंडक्टर इलेक्ट्रोड यहां आमतौर पर उपयोग किए जाते हैं। एक और दिलचस्प घटना इलेक्ट्रोकेमिलुमिनसेंस है, यानी। इलेक्ट्रोकेमिकल सेल में प्रकाश का उत्पादन। यह तब देखा जाता है जब इलेक्ट्रोड पर उच्च-ऊर्जा उत्पाद बनते हैं। किसी दिए गए यौगिक के ऑक्सीकृत और अपचित दोनों रूपों को प्राप्त करने के लिए अक्सर प्रक्रिया चक्रीय तरीके से की जाती है। एक-दूसरे के साथ उनकी अंतःक्रिया से उत्तेजित अणुओं का निर्माण होता है, जो प्रकाश के उत्सर्जन के साथ जमीनी अवस्था में चले जाते हैं।
एप्लाइड इलेक्ट्रोकैमिस्ट्री।
इलेक्ट्रोकैमिस्ट्री के कई व्यावहारिक अनुप्रयोग हैं। बैटरियों से जुड़े प्राथमिक गैल्वेनिक सेल (डिस्पोजेबल तत्व) की मदद से रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित किया जाता है। द्वितीयक धारा स्रोत - बैटरी - विद्युत ऊर्जा का भंडारण करते हैं। ईंधन सेल प्राथमिक ऊर्जा स्रोत हैं जो अभिकारकों (जैसे हाइड्रोजन और ऑक्सीजन) की निरंतर आपूर्ति के माध्यम से बिजली उत्पन्न करते हैं। ये सिद्धांत पोर्टेबल बिजली स्रोतों और अंतरिक्ष स्टेशनों, इलेक्ट्रिक वाहनों और इलेक्ट्रॉनिक उपकरणों पर उपयोग की जाने वाली बैटरियों पर आधारित हैं।
कई पदार्थों का बड़े पैमाने पर उत्पादन विद्युत रासायनिक संश्लेषण पर आधारित है। क्लोर-क्षार प्रक्रिया में नमकीन पानी के इलेक्ट्रोलिसिस से क्लोरीन और क्षार का उत्पादन होता है, जिसका उपयोग कार्बनिक यौगिकों और पॉलिमर के उत्पादन के साथ-साथ लुगदी और कागज उद्योग में भी किया जाता है। इलेक्ट्रोलिसिस के उत्पाद सोडियम क्लोरेट, परसल्फेट, सोडियम परमैंगनेट जैसे यौगिक हैं; औद्योगिक रूप से महत्वपूर्ण धातुएँ विद्युत निष्कर्षण द्वारा प्राप्त की जाती हैं: एल्यूमीनियम, मैग्नीशियम, लिथियम, सोडियम और टाइटेनियम। पिघले हुए नमक को इलेक्ट्रोलाइट्स के रूप में उपयोग करना बेहतर है, क्योंकि इस मामले में, जलीय घोल के विपरीत, हाइड्रोजन की रिहाई से धातुओं की कमी जटिल नहीं होती है। पिघले हुए नमक में इलेक्ट्रोलिसिस द्वारा फ्लोरीन का उत्पादन किया जाता है। विद्युत रासायनिक प्रक्रियाएँ कुछ कार्बनिक यौगिकों के संश्लेषण के आधार के रूप में कार्य करती हैं; उदाहरण के लिए, एडिपोनिट्राइल (नायलॉन के संश्लेषण में एक मध्यवर्ती) एक्रिलोनिट्राइल के हाइड्रोडिमराइजेशन द्वारा प्राप्त किया जाता है।
इलेक्ट्रॉनिक्स उद्योग में विद्युत कनेक्टर्स और मुद्रित सर्किट बोर्डों के निर्माण के लिए, सजावटी उद्देश्यों के लिए, स्टील उत्पादों को जंग से बचाने के लिए विभिन्न वस्तुओं पर चांदी, सोना, क्रोमियम, पीतल, कांस्य और अन्य धातुओं और मिश्र धातुओं की इलेक्ट्रोप्लेटिंग का व्यापक रूप से अभ्यास किया जाता है। इलेक्ट्रोकेमिकल विधियों का उपयोग धातुओं और मिश्र धातुओं से बने वर्कपीस के उच्च-सटीक आयामी प्रसंस्करण के लिए किया जाता है, विशेष रूप से जिन्हें पारंपरिक यांत्रिक तरीकों से संसाधित नहीं किया जा सकता है, साथ ही जटिल प्रोफाइल वाले भागों के निर्माण के लिए भी किया जाता है। जब एल्यूमीनियम और टाइटेनियम जैसी धातुओं की सतह को एनोडाइज किया जाता है, तो सुरक्षात्मक ऑक्साइड फिल्में बनती हैं। ऐसी फिल्में इलेक्ट्रोलाइटिक कैपेसिटर के निर्माण में और कभी-कभी सजावटी उद्देश्यों के लिए एल्यूमीनियम, टैंटलम और नाइओबियम से बने वर्कपीस की सतह पर बनाई जाती हैं।
इलेक्ट्रोकेमिकल विधियों का उपयोग अक्सर संक्षारण प्रक्रियाओं के अध्ययन और इन प्रक्रियाओं को धीमा करने वाली सामग्रियों के चयन के लिए किया जाता है। कैथोडिक सुरक्षा का उपयोग करके धातु संरचनाओं के क्षरण को रोका जा सकता है, जिसके लिए एक बाहरी स्रोत संरक्षित की जा रही संरचना और एनोड से जुड़ा होता है और संरचना को ऐसी क्षमता पर बनाए रखा जाता है कि इसका ऑक्सीकरण बाहर हो जाता है। अन्य विद्युत रासायनिक प्रक्रियाओं के व्यावहारिक अनुप्रयोग की संभावनाओं का पता लगाया जा रहा है। तो, पानी को शुद्ध करने के लिए इलेक्ट्रोलिसिस का उपयोग किया जा सकता है। फोटोकैमिकल विधियों का उपयोग करके सौर ऊर्जा का रूपांतरण एक बहुत ही आशाजनक दिशा है। इलेक्ट्रोकेमिकल मॉनिटर विकसित किए जा रहे हैं, जिनका संचालन सिद्धांत इलेक्ट्रोकेमिलुमिनसेंस पर आधारित है। आइए हम इलेक्ट्रोड प्रतिक्रियाओं के परिणामस्वरूप इलेक्ट्रोड सतह के रंग में प्रतिवर्ती परिवर्तनों के अध्ययन का भी उल्लेख करें।
साहित्य:
एग्लाडेज़ आर.आई. एप्लाइड इलेक्ट्रोकैमिस्ट्री।एम. - एल., 1975
इस्माइलोव एन.ए. समाधानों की इलेक्ट्रोकैमिस्ट्री।एम., 1976
इलेक्ट्रोकैमिस्ट्री में मापन विधियाँ, वॉल्यूम। 1-2. एम., 1977
कोरीटा आई. आयन, इलेक्ट्रोड, झिल्ली।एम., 1983
बगोत्स्की वी.एस. इलेक्ट्रोकैमिस्ट्री की मूल बातें।एम., 1988