Tablica izotermnih procesa. Zakoni idealnih plinova
Glavni procesi u termodinamici su:
- izohorni, teče konstantnim volumenom;
- izobarni teče pod stalnim pritiskom;
- izotermna, koji se javlja pri konstantnoj temperaturi;
- adijabatski, na kojem nema izmjene topline s okolinom;
- politropski, zadovoljavajući jednadžbu pvn= konst.
Izohorni, izobarni, izotermni i adijabatski procesi su posebni slučajevi politropskog procesa.
U proučavanju termodinamičkih procesa odredite:
- jednadžba procesa u str— v I T— s koordinate;
- odnos između parametara stanja plina;
- promjena unutarnje energije;
- količina vanjskog rada;
- količina topline dovedena u proces ili količina odvedene topline.
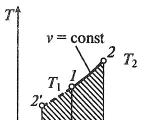
Izohorni proces


Izohorni proces ustr, v— , T, s- Ija, s-koordinate (dijagrami)
U izohornom procesu stanje v= konst.
Iz jednadžbe stanja idealnog plina ( pv = RT) slijedi:
p/T = R/V= konst,
tj. tlak plina izravno je proporcionalan njegovoj apsolutnoj temperaturi:
p2/p1 = T2 /T1.
Rad širenja u izohornom procesu je nula ( l= 0), budući da se volumen radne tekućine ne mijenja (Δ v= konst).
Količina topline koja se dovodi radnom fluidu u procesu 1-2 at c v
q= c v(T 2 — T 1 ).
T. do. l= 0, tada na temelju prvog zakona termodinamike Δ u = q, što znači da se promjena unutarnje energije može odrediti formulom:
Δ u = c v (T 2 - T 1).
Promjena entropije u izohornom procesu određena je formulom:
s2–s1= Δ s = c v ln( p2/p1) = c v ln( T2 /T1).
izobarni proces



izobarni proces ustr, v— , T, s- Ija, s-koordinate (dijagrami)
Izobarni proces je onaj koji se odvija pri konstantnom tlaku. str= konst. Iz jednadžbe stanja idealnog plina slijedi:
v/T = R/str= konst
v2/v1 = T 2 /T 1 ,
tj. u izobarnom procesu volumen plina proporcionalan je njegovoj apsolutnoj temperaturi.
Rad će biti:
l = str(v 2 – v 1 ).
T. do. pv 1 = RT 1 I pv 2 = RT 2 , To
l = R(T2-T1).
Količina topline pri cp= const određuje se formulom:
q = cp(T2-T1).
Promjena entropije bit će:
s2–s1= Δ s = cp ln( T2 /T1).
Izotermni proces



Izotermni proces ustr, v— , T, s- Ija, s-koordinate (dijagrami)
U izotermnom procesu temperatura radnog fluida ostaje konstantna T= const, dakle:
pv = RT= konst
p2/p1 = v1/v2,
tj. tlak i volumen međusobno su obrnuto proporcionalni, tako da tijekom izotermne kompresije tlak plina raste, a tijekom ekspanzije opada.
Rad procesa bit će jednak:
l = RT u ( v2 – v1) = RT u ( p1 – p2).
Budući da temperatura ostaje nepromijenjena, unutarnja energija idealnog plina u izotermnom procesu ostaje konstantna (Δ u= 0) i sva toplina dovedena radnom fluidu potpuno se pretvara u rad širenja:
q = l.
Tijekom izotermne kompresije radnom fluidu se oduzima toplina u količini koja je jednaka radu utrošenom na kompresiju.
Promjena entropije je:
s2–s1= Δ s = R ln( p1/p2) = R ln( v2/v1).
adijabatski proces



adijabatski proces ustr, v— , T, s- Ija, s-koordinate (dijagrami)
Adijabatski proces je promjena agregatnog stanja plina koja se odvija bez izmjene topline s okolinom. Od d q= 0, tada će jednadžba prvog zakona termodinamike za adijabatski proces imati oblik:
d u + str d v = 0
Δ u+ l = 0,
stoga
Δ u= —l.
U adijabatskom procesu rad širenja obavlja se samo zbog utroška unutarnje energije plina, a tijekom kompresije, koja nastaje djelovanjem vanjskih sila, sav njihov rad ide na povećanje unutarnje energije od plina.
Označimo toplinski kapacitet u adijabatskom procesu kroz c pakao, i stanje d q= 0 izražava se kako slijedi:
d q = c pakao d T = 0.
Ovaj uvjet govori da je toplinski kapacitet u adijabatskom procesu jednak nuli ( c pakao = 0).
Poznato je da
Sstr/cv= k
a jednadžba krivulje adijabatskog procesa (adijabata) u str, v- dijagram izgleda ovako:
p.v.k= konst.
U ovom izrazu k Zove se adijabatski eksponent(također se naziva Poissonov omjer).
Vrijednosti adijabatskog eksponentakza neke plinove:
k zrak = 1,4
k pregrijana para = 1,3
k ICE ispuh = 1,33
k zasićena mokra para = 1,135
Iz prethodnih formula slijedi:
l= — Δ u = c v(T 1 – T 2 );
ja 1 – ja 2 = cp(T 1 – T 2 ).
Tehnički rad adijabatskog procesa ( l tech) jednaka je razlici između entalpija početka i kraja procesa ( ja 1 – ja 2 ).
Naziva se adijabatski proces koji se odvija bez unutarnjeg trenja u radnom fluidu izentropski. U T, s na dijagramu je prikazan okomitom linijom.
Obično se pravi adijabatski procesi odvijaju uz unutarnje trenje u radnom fluidu, zbog čega se uvijek oslobađa toplina, koja se prenosi samom radnom fluidu. U ovom slučaju d s> 0 i proces se poziva pravi adijabatski proces.
Politropni proces
Proces se naziva politropski, a opisuje se jednadžbom:
pvn= konst.
Politropni indeks n može uzeti bilo koju vrijednost od -∞ do +∞, ali za ovaj proces to je konstantna vrijednost.
Iz jednadžbe politropskog procesa i Claiperonove jednadžbe može se dobiti izraz koji uspostavlja odnos između str, v I T u bilo koje dvije točke na politropu:
p2/p1 = (v1/v2)n; T2 /T1 = (v1/v2) n-1; T2 /T1 = (p2/p1) (n-1)/n .
Rad ekspanzije plina u politropskom procesu je:

U slučaju idealnog plina, ova se formula može transformirati:

Količina topline dovedena ili odvedena u procesu određena je pomoću prvog zakona termodinamike:
q = (u 2 – u 1) + l.
Jer

je toplinski kapacitet idealnog plina u politropskom procesu.
Na c v, k I n= konst c n= const, pa se politropski proces ponekad definira kao proces s konstantnim toplinskim kapacitetom.
Politropni proces ima generalizirajuće značenje, jer obuhvaća cijeli skup osnovnih termodinamičkih procesa.
Grafički prikaz politropa u str, v koordinate ovisno o indeksu politropa n.

pv 0= const ( n= 0) je izobara;
pv= const ( n= 1) je izoterma;
p 0 v= konst, p 1/∞ v= konst, pv∞= const - izohora;
p.v.k= const ( n = k) je adijabat.
n > 0 – hiperbolične krivulje,
n < 0 su parabole.
Na temelju materijala mojih bilježaka s predavanja iz termodinamike i udžbenika "Osnove energetike". Autor G. F. Bystritsky. 2. izdanje, rev. i dodatni - M.: KNORUS, 2011. - 352 str.
Što je izobarni proces
Definicija
Izobarni (ili izobarni) proces je proces koji se odvija u konstantnoj masi plina pri konstantnom tlaku.
Napišimo jednadžbu za dva stanja idealnog plina:
\ \
Podijelimo jednadžbu (2) s jednadžbom (1), dobivamo jednadžbu izobarnog procesa:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \lijevo(4\desno).\]
Jednadžba (4) se zove Gay-Lussacov zakon.
Unutarnja energija i količina topline izobarnog procesa
Ovaj se proces događa s unosom topline ako se volumen povećava ili uklanjanjem topline za smanjenje volumena. Zapišimo prvi zakon termodinamike, redom ćemo dobiti izraze za rad, unutarnju energiju i količinu topline izobarnog procesa:
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \lijevo(5\desno).\] \[\trokut Q=\int\limits^(T_2)_ (T_1)(dU)+\int\limits^(V_2)_(V_1)(dA)(6)\]
gdje je $\delta Q\ $ elementarna toplina dovedena u sustav, $dU$ je promjena unutarnje energije plina u procesu koji je u tijeku, $dA$ je elementarni rad koji obavlja plin u procesu, i je broj stupnjeva slobode molekule plina, R je univerzalna plinska konstanta, d je broj molova plina.
Promjena unutarnje energije plina:
\[\trokut U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
Jednadžba (8) definira rad za izobarni proces. Oduzmemo jednadžbu (1) od (2), dobivamo još jednu jednadžbu za rad plina u izobarnom procesu:
\ \[\trokut Q=\frac(i)(2)nR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \trokut T\ ( 10),\]
gdje je $c_(\mu p)$ molarni toplinski kapacitet plina u izobarnom procesu. Jednadžba (10) određuje količinu topline koja se prenosi plinu mase m u izobarnom procesu s povećanjem temperature za $\trokut T.$
Izoprocesi se često prikazuju u termodinamičkim dijagramima. Dakle, crta koja prikazuje izobarni proces na takvom dijagramu naziva se izobara (slika 1).
Primjer 1
Zadatak: Utvrdite kako su pritisci $p_1$ i $p_2$ povezani na V(T) dijagramu na slici 1c.
Nacrtajte izotermu $T_1$

U točkama A i B temperature su iste, stoga se plin pokorava Boyle-Mariotteovom zakonu:
\ \
Pretvorimo ove volumene u SI: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
Napravimo izračune:
Odgovor: Rad plina u izobarnom procesu je 600 J.
Primjer 3
Zadatak: Usporedite rad plina u procesu ABC i rad plina u procesu CDA sl. 3.

Kao temelj rješenja uzimamo formulu koja određuje rad plina:
Iz geometrijskog značenja određenog integrala poznato je da je rad površina figure koja je ograničena funkcijom integranda, osi apscisa i izohorama u točkama $V_1\ i\ V_2$ (os p(V)). Prevodimo grafove procesa u p(V) osi.
Razmotrimo svaki segment grafova procesa prikazanih na slici (3).
AB: Izohorni proces (p=const), $V\uparrow \lijevo(\ Volumen\ raste\desno),\ T\uparrow $;
VS: Izohorni proces (V =const), $T\uparrow $ (iz grafikona), p$\uparrow $, iz zakona za izohorni proces ($\frac(p)(T)=const$);
CD: (p=const), $V\downarrow ,\ T\downarrow ;$
DA: (V =konst), $T\strelica prema dolje ,\ p\strelica prema dolje .$
Prikažimo grafove procesa u p(V) osi (slika 4):

Plinski rad $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- površina pravokutnika ABFE) (Sl. 3). Rad na plinu $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -površina\ pravokutnika\ $EFCD. Očito $A_(CDA)>A_(ABC).$
, termodinamički proces je promjena stanja sustava, uslijed čega barem jedan njegov parametar (temperatura, volumen ili tlak) mijenja svoju vrijednost. Međutim, ako uzmemo u obzir da su svi parametri termodinamičkog sustava neraskidivo povezani, tada promjena bilo kojeg od njih neizbježno povlači za sobom promjenu barem jednog (idealno) ili više (u stvarnosti) parametara. U općem slučaju možemo reći da je termodinamički proces povezan s kršenjem ravnoteže sustava, a ako je sustav u stanju ravnoteže, tada se u njemu ne mogu dogoditi nikakvi termodinamički procesi.
Ravnotežno stanje sustava je apstraktan koncept, budući da je nemoguće izolirati bilo što materijalno od okolnog svijeta, stoga se različiti termodinamički procesi neizbježno događaju u svakom stvarnom sustavu. Istovremeno, u nekim sustavima mogu se događati tako spore, gotovo neprimjetne promjene da se s njima povezani procesi mogu uvjetno smatrati da se sastoje od niza ravnotežnih stanja sustava. Takvi se procesi nazivaju ravnotežni ili kvazistatičan.
Drugi mogući scenarij uzastopnih promjena u sustavu, nakon kojih se on vraća u prvobitno stanje, naziva se kružni proces ili ciklus. Koncepti ravnoteže i kružnog procesa temelj su mnogih teorijskih zaključaka i primijenjenih metoda termodinamike.
Proučavanje termodinamičkog procesa sastoji se u određivanju rada obavljenog u tom procesu, promjene unutarnje energije, količine topline, kao iu utvrđivanju odnosa između pojedinih veličina koje karakteriziraju stanje plina.
Od svih mogućih termodinamičkih procesa, izohorni, izobarni, izotermni, adijabatski i politropski procesi su od najvećeg interesa.
Izohorni proces
Izohorni proces je termodinamički proces koji se odvija pri konstantnom volumenu. Takav se proces može izvesti zagrijavanjem plina smještenog u zatvorenu posudu. Plin se zbog dovođenja topline zagrijava, a njegov tlak raste.
Promjena parametara plina u izohornom procesu opisuje Charlesov zakon: p 1 /T 1 \u003d p 2 /T 2, ili u općem slučaju:
p/T = konst.
Tlak plina na stijenke posude izravno je proporcionalan apsolutnoj temperaturi plina.
Budući da je u izohornom procesu promjena volumena dV jednaka nuli, možemo zaključiti da se sva toplina dovedena plinu troši na promjenu unutarnje energije plina. (posao nije obavljen).
izobarni proces
Izobarni proces je termodinamički proces koji se odvija pri konstantnom tlaku. Takav se proces može provesti stavljanjem plina u gusti cilindar s pomičnim klipom, na koji tijekom odvođenja i dovođenja topline djeluje stalna vanjska sila.
Kada se temperatura plina mijenja, klip se pomiče u jednom ili drugom smjeru; dok se volumen plina mijenja u skladu s Gay-Lussacovim zakonom:
V/T = konst.
To znači da je u izobarnom procesu volumen koji plin zauzima izravno proporcionalan temperaturi.
Može se zaključiti da će promjena temperature u ovom procesu neizbježno dovesti do promjene unutarnje energije plina, a promjena volumena povezana je s obavljanjem rada, tj. u izobarnom procesu dio je toplinske energija se troši na promjenu unutarnje energije plina, a drugi dio se troši na obavljanje rada plina za svladavanje djelovanja vanjskih sila. U tom slučaju omjer toplinskih troškova za povećanje unutarnje energije i za obavljanje rada ovisi o toplinskom kapacitetu plina.
Izotermni proces
Izotermni proces je termodinamički proces koji se odvija pri konstantnoj temperaturi.
U praksi je vrlo teško provesti izotermni proces s plinom. Uostalom, potrebno je pridržavati se uvjeta da u procesu kompresije ili ekspanzije plin ima vremena za razmjenu temperature s okolinom, održavajući vlastitu temperaturu konstantnom.
Izotermni proces opisan je Boyle-Mariotteovim zakonom: pV \u003d const, tj. Pri konstantnoj temperaturi tlak plina je obrnuto proporcionalan njegovom volumenu.
Očito je da se u izotermnom procesu unutarnja energija plina ne mijenja, jer je njegova temperatura konstantna.
Da bi se ispunio uvjet konstantnosti temperature plina, potrebno je od njega ukloniti toplinu, što je ekvivalentno radu utrošenom na kompresiju:
dq = dA = pdv.
Koristeći jednadžbu stanja plina, nakon niza transformacija i zamjena, možemo zaključiti da je rad plina u izotermnom procesu određen izrazom:
A = RT ln(p 1 /p 2).
adijabatski proces
Adijabatski proces je termodinamički proces koji se odvija bez izmjene topline između radnog fluida i okoline. Poput izotermnog procesa, adijabatski proces je vrlo teško provesti u praksi. Takav se proces može odvijati s radnim medijem smještenim u posudu, na primjer, cilindar s klipom, okružen visokokvalitetnim toplinsko-izolacijskim materijalom.
No, bez obzira kakav kvalitetan toplinski izolator koristimo u ovom slučaju, neka, čak i zanemariva, količina topline neizbježno će se izmijeniti između radnog medija i okoline.
Stoga je u praksi moguće stvoriti samo približan model adijabatskog procesa. Ipak, mnogi termodinamički procesi koji se provode u toplinskoj tehnici odvijaju se tako brzo da radni fluid i medij nemaju vremena za razmjenu topline, stoga se, uz određeni stupanj pogreške, takvi procesi mogu smatrati adijabatskim.
Izvesti jednadžbu koja povezuje tlak i volumen 1 kg plina u adijabatskom procesu, pišemo jednadžbu prvog zakona termodinamike:
dq = du + pdv.
Budući da je za adijabatski proces prijenos topline dq jednak nuli, a promjena unutarnje energije je funkcija toplinske vodljivosti temperature: du = c v dT, tada možemo napisati:
c v dT + pdv = 0 (3) .
Diferenciranjem Clapeyronove jednadžbe pv = RT dobivamo:
pdv + vdp = RdT.
Izrazimo dT odavde i zamijenimo ga u jednadžbu (3) . Nakon preslagivanja i transformacija dobivamo:
pdvc v /(R + 1) + c v vdp/R = 0.
Uzimajući u obzir Mayerovu jednadžbu R = c p – c v, posljednji izraz može se prepisati kao:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
Dijeljenje dobivenog izraza s c v i označavanje omjera c p / c v slovom k , nakon integriranja jednadžbe (4) dobivamo (at k = const):
ln vk + ln p = konst ili ln pvk = konst ili pvk = konst.
Rezultirajuća jednadžba je jednadžba adijabatskog procesa, u kojoj je k adijabatski eksponent.
Ako pretpostavimo da je volumetrijski toplinski kapacitet c v konstantna vrijednost, tj. c v \u003d const, tada se rad adijabatskog procesa može prikazati formulom (dano bez izlaza):
l \u003d c v (T 1 - T 2) ili l \u003d (p 1 v 1 - p 2 v 2) / (k-1).
Politropni proces
Za razliku od gore navedenih termodinamičkih procesa, kada je bilo koji od parametara plina ostao nepromijenjen, politropski proces karakterizira mogućnost promjene bilo kojeg od glavnih parametara plina. Svi navedeni termodinamički procesi su posebni slučajevi politropskih procesa.
Opća jednadžba politropskog procesa ima oblik pv n = const , gdje je n politropski indeks - konstantna vrijednost za ovaj proces, koja može poprimiti vrijednosti od - ∞ do + ∞ .
Očito je da se davanjem određenih vrijednosti politropskom indeksu može dobiti jedan ili drugi termodinamički proces - izohorni, izobarni, izotermni ili adijabatski.
Dakle, ako uzmemo n = 0 , dobivamo p = const - izobarni proces, ako uzmemo n = 1 , dobivamo izotermni proces koji opisuje ovisnost pv = const ; za n = k proces je adijabatski, a za n jednako - ∞ ili + ∞ . dobivamo izohorni proces.
Teme USE kodifikatora: izoprocesi - izotermni, izohorni, izobarni procesi.
Kroz ovu brošuru pridržavat ćemo se sljedeće pretpostavke: masa i kemijski sastav plina ostaju nepromijenjeni. Drugim riječima, vjerujemo da:
To jest, nema istjecanja plina iz posude ili, obrnuto, dotoka plina u posudu;
Odnosno, čestice plina ne doživljavaju nikakve promjene (recimo, nema disocijacije - raspada molekula na atome).
Ova su dva uvjeta zadovoljena u vrlo mnogo fizikalno zanimljivih situacija (na primjer, u jednostavnim modelima toplinskih strojeva) i stoga zaslužuju posebno razmatranje.
Ako su masa plina i njegova molarna masa fiksne, tada je stanje plina određeno prema tri makroskopski parametri: pritisak, volumen I temperatura. Ti su parametri međusobno povezani jednadžbom stanja (Mendeleev-Clapeyronova jednadžba).
Termodinamički proces(ili jednostavno postupak) je promjena stanja plina tijekom vremena. Tijekom termodinamičkog procesa mijenjaju se vrijednosti makroskopskih parametara - tlaka, volumena i temperature.
Posebno su zanimljivi izoprocesi- termodinamički procesi u kojima vrijednost jednog od makroskopskih parametara ostaje nepromijenjena. Redom popravljajući svaki od tri parametra, dobivamo tri vrste izoprocesa.
1. Izotermni proces ide pri konstantnoj temperaturi plina: .
2. izobarni proces radi pri konstantnom tlaku plina: .
3. Izohorni proces ide pri konstantnom volumenu plina: .
Izoprocesi su opisani vrlo jednostavnim zakonima Boyle - Mariotte, Gay-Lussac i Charles. Prijeđimo na njihovo proučavanje.
Izotermni proces
Neka idealni plin izvodi izotermni proces pri temperaturi . Tijekom procesa mijenja se samo tlak plina i njegov volumen.
Razmotrimo dva proizvoljna stanja plina: u jednom od njih vrijednosti makroskopskih parametara su , a u drugom su . Ove vrijednosti su povezane Mendeleev-Clapeyron jednadžbom:
Kao što smo rekli od samog početka, pretpostavlja se da su masa i molarna masa konstantne.
Dakle, desni dijelovi napisanih jednadžbi su jednaki. Stoga su i lijeve strane jednake:
(1)
Kako su dva stanja plina odabrana proizvoljno, možemo zaključiti da tijekom izotermnog procesa, umnožak tlaka plina i volumena ostaje konstantan:
(2)
Ova izjava se zove Boyleov zakon - Mariotte.
Napisavši Boyle-Mariotteov zakon u obliku
(3)
može se formulirati i ovako: U izotermnom procesu tlak plina je obrnuto proporcionalan njegovom volumenu.. Ako se npr. pri izotermnom širenju plina njegov volumen poveća tri puta, tada se tlak plina smanji tri puta.
Kako objasniti obrnuti odnos između tlaka i volumena s fizičke točke gledišta? Pri konstantnoj temperaturi prosječna kinetička energija molekula plina ostaje nepromijenjena, odnosno, jednostavno rečeno, ne mijenja se sila udara molekula o stijenke posude. S povećanjem volumena, koncentracija molekula se smanjuje, a time i broj molekularnih udara u jedinici vremena po jedinici površine stijenke - pada tlak plina. Naprotiv, smanjenjem volumena raste koncentracija molekula, češći su njihovi udari, a raste i tlak plina.
Grafikoni izotermnog procesa
Općenito, uobičajeno je prikazati grafove termodinamičkih procesa u sljedećim koordinatnim sustavima:
-dijagram: os apscisa, os ordinata;
-dijagram: os apscisa, os ordinata.
Graf izotermnog procesa naziva se izoterma.
Izoterma na -karti je obrnuto proporcionalan dijagram.
Takav graf je hiperbola (sjetimo se algebre – graf funkcije). Izoterma-hiperbola prikazana je na sl. 1 .

Riža. 1. Izoterma na -dijagramu
Svaka izoterma odgovara određenoj fiksnoj vrijednosti temperature. Ispostavilo se da što je viša temperatura, to više leži odgovarajuća izoterma -dijagram.
Doista, razmotrimo dva izotermna procesa koja izvodi isti plin (slika 2). Prvi proces odvija se na temperaturi , drugi - na temperaturi .

Riža. 2. Što je viša temperatura, to je izoterma viša
Fiksiramo neku vrijednost volumena. Na prvoj izotermi odgovara tlaku, na drugoj - class="tex" alt="p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
U preostala dva koordinatna sustava izoterma izgleda vrlo jednostavno: to je ravna linija okomita na os ( sl. 3):

Riža. 3. Izoterme na i -dijagramima
izobarni proces
Podsjetimo još jednom da je izobarni proces proces koji se odvija pri konstantnom tlaku. Tijekom izobarnog procesa mijenjaju se samo volumen plina i njegova temperatura.
Tipičan primjer izobarnog procesa: plin se nalazi ispod masivnog klipa koji se može slobodno kretati. Ako je masa klipa i presjek klipa , tada je tlak plina konstantan i jednak
gdje je atmosferski tlak.
Neka idealni plin izvodi izobarni proces pri tlaku. Razmotrimo ponovno dva proizvoljna stanja plina; ovaj put će vrijednosti makroskopskih parametara biti jednake i .
Napišimo jednadžbe stanja:
Dijeleći ih jedan s drugim, dobivamo:
U principu, ovo bi već moglo biti dovoljno, ali ćemo ići malo dalje. Prepišimo dobivenu relaciju tako da se u jednom dijelu pojavljuju samo parametri prvog stanja, a u drugom samo parametri drugog stanja (drugim riječima, “podijelimo indekse” na različite dijelove):
(4)
A sada odavde - s obzirom na proizvoljnost izbora država! - dobivamo Gay-Lussacov zakon:
(5)
Drugim riječima, Pri konstantnom tlaku volumen plina izravno je proporcionalan njegovoj temperaturi.:
(6)
Zašto se volumen povećava s temperaturom? Kako temperatura raste, molekule počinju jače udarati i podizati klip. Istodobno se koncentracija molekula smanjuje, udarci postaju sve rjeđi, tako da na kraju tlak ostaje isti.
Dijagrami izobarnog procesa
Graf izobarnog procesa naziva se izobara. Na -dijagramu izobara je ravna linija (slika 4):

Riža. 4. Izobara na -dijagramu
Točkasti dio grafikona znači da u slučaju stvarnog plina na dovoljno niskim temperaturama, model idealnog plina (a s njim i Gay-Lussacov zakon) prestaje funkcionirati. Dapače, kako se temperatura smanjuje, čestice plina se sve sporije gibaju, a sile međumolekularnog međudjelovanja imaju sve značajniji utjecaj na njihovo kretanje (analogija: sporu loptu lakše je uhvatiti nego brzu). Pa, na vrlo niskim temperaturama, plinovi se pretvaraju u tekućine.
Sada shvatimo kako se položaj izobare mijenja s promjenom tlaka. Ispostavilo se da Što je viši tlak, to je izobara niža. -dijagram.
Da biste to potvrdili, razmotrite dvije izobare s tlakovima i (slika 5):

Riža. 5. Što je niža izobara, to je veći tlak
Fiksirajmo neku vrijednost temperature. Vidimo to. Ali pri fiksnoj temperaturi volumen je to manji što je tlak veći (Boyleov zakon – Mariotte!).
Dakle class="tex" alt="p_2 > p_1"> .!}
U preostala dva koordinatna sustava izobara je ravna linija okomita na os (slika 6):

Riža. 6. Izobare na i -dijagramima
Izohorni proces
Podsjećamo, izohorni proces je proces koji se odvija pri konstantnom volumenu. U izohornom procesu mijenjaju se samo tlak plina i njegova temperatura.
Izohorni proces je vrlo jednostavno zamisliti: to je proces koji se odvija u krutoj posudi fiksnog volumena (ili u cilindru ispod klipa kada je klip fiksiran).
Neka idealni plin izvodi izohorni proces u posudi volumena . Opet, razmotrimo dva proizvoljna plinska stanja s parametrima i . Imamo:
Ove jednadžbe dijelimo jednu na drugu:
Kao i kod izvođenja Gay-Lussacovog zakona, "podijelili smo" indekse u različite dijelove:
(7)
S obzirom na proizvoljnost izbora stanja, dolazimo do Karlov zakon:
(8)
Drugim riječima, Pri konstantnom volumenu plina njegov je tlak izravno proporcionalan njegovoj temperaturi.:
(9)
Povećanje tlaka plina fiksnog volumena kada se zagrijava potpuno je očita stvar s fizičke točke gledišta. Možete to sami lako objasniti.
Dijagrami izohornog procesa
Graf izohornog procesa naziva se izohora. Na -dijagramu, izohora je ravna linija ( sl. 7):

Riža. 7. Izohora na -dijagramu
Značenje točkastog područja je isto: neadekvatnost modela idealnog plina pri niskim temperaturama.

Riža. 8. Što je niža izohora, to je veći volumen
Dokaz je sličan prethodnom. Fiksiramo temperaturu i vidimo to. Ali na fiksnoj temperaturi tlak je to manji što je volumen veći (opet Boyle-Mariotteov zakon). Dakle class="tex" alt="V_2 > V_1"> .!}
U preostala dva koordinatna sustava izohora je ravna linija okomita na os (slika 9):

Riža. 9. Izohore na i -dijagramima
Nazivaju se i Boyleovi zakoni - Mariotte, Gay-Lussac i Charles plinski zakoni.
Plinske zakone izveli smo iz Mendeleev-Clapeyronove jednadžbe. Ali povijesno je bilo suprotno: plinski zakoni su uspostavljeni eksperimentalno, i to mnogo ranije. Jednadžba stanja pojavila se naknadno kao njihova generalizacija.
izobarni proces
Prikazi izoprocesa u različitim koordinatnim sustavima
izobarni proces(Drugi grčki ισος, isos - "isti" + βαρος, baros - "težina") - proces promjene stanja termodinamičkog sustava pri konstantnom tlaku ()
Ovisnost volumena plina o temperaturi pri konstantnom tlaku eksperimentalno je istražio 1802. Joseph Louis Gay-Lussac. Gay-Lussacov zakon: Pri konstantnom tlaku i konstantnim vrijednostima mase plina i njegove molarne mase, omjer volumena plina i njegove apsolutne temperature ostaje konstantan: V / T = const.
Izohorni proces
Izohorni proces(od grčkog zbora - zauzeto mjesto) - proces promjene stanja termodinamičkog sustava pri konstantnom volumenu (). Za idealne plinove, izohorni proces opisan je Charlesovim zakonom: za danu masu plina pri konstantnom volumenu, tlak je izravno proporcionalan temperaturi:
Crta koja prikazuje izohorni proces u dijagramu naziva se izohora.
Također je vrijedno istaknuti da se energija koja se dovodi plinu troši na promjenu unutarnje energije, odnosno Q = 3* ν*R*T/2=3*V*ΔP, gdje je R univerzalna plinska konstanta, ν je broj molova u plinu, T je temperatura u Kelvinima, V je volumen plina, ΔP je inkrement promjene tlaka. a liniju koja prikazuje izohorni proces u dijagramu, u P(T) osi, treba produžiti i spojiti točkastom linijom s ishodištem, jer može doći do nesporazuma.
Izotermni proces
Izotermni proces(od grčkog "termos" - toplo, vruće) - proces promjene stanja termodinamičkog sustava pri konstantnoj temperaturi () (). Izotermni proces opisuje Boyle-Mariotteov zakon:
Pri konstantnoj temperaturi i konstantnim vrijednostima mase plina i njegove molarne mase, produkt volumena plina i njegovog tlaka ostaje konstantan: PV = const.
Izentropski proces
Izentropski proces- proces promjene stanja termodinamičkog sustava pri konstantnoj entropiji (). Na primjer, reverzibilni adijabatski proces je izentropski: u takvom procesu nema izmjene topline s okolinom. Idealni plin u takvom procesu opisan je sljedećom jednadžbom:
gdje je adijabatski eksponent određen vrstom plina.
Zaklada Wikimedia. 2010. godine.
Pogledajte što su "izoprocesi" u drugim rječnicima:
Izoprocesi su termodinamički procesi tijekom kojih masa i još jedna od fizikalnih veličina parametara stanja: tlak, volumen ili temperatura ostaju nepromijenjeni. Dakle, izobarni proces odgovara konstantnom tlaku, izohorni volumen ... Wikipedia
Molekularno kinetička teorija (skraćeno MKT) je teorija koja razmatra strukturu materije sa stajališta tri glavne približno točne odredbe: sva tijela se sastoje od čestica, čija se veličina može zanemariti: atoma, molekula i iona; čestice ... ... Wikipedia
- (skraćeno MKT) teorija koja razmatra strukturu materije sa stajališta tri glavne približno točne odredbe: sva tijela sastoje se od čestica čija se veličina može zanemariti: atoma, molekula i iona; čestice su u kontinuiranom ... ... Wikipedia
knjige
- Statističko predviđanje deformacijsko-čvrstočkih karakteristika konstrukcijskih materijala , G. Pluvinazh , VT Sapunov , Ova knjiga predstavlja novu metodu koja predlaže zajedničku metodologiju za predviđanje karakteristika kinetičkih procesa, zajedničkih za metalne i polimerne materijale. Metoda… Kategorija: Udžbenici za sveučilišta Izdavač: