Tabella dei processi isotermici. Leggi dei gas ideali
I principali processi in termodinamica sono:
- isocoro, che scorre a volume costante;
- isobarico che scorre a pressione costante;
- isotermico, che si verifica a temperatura costante;
- adiabatico, in cui non c'è scambio di calore con l'ambiente;
- politropico, soddisfacendo l'equazione pvn= cost.
I processi isocori, isobari, isotermici e adiabatici sono casi speciali di un processo politropico.
Nello studio dei processi termodinamici determinare:
- equazione di processo in P— v E T— S coordinate;
- relazione tra parametri di stato del gas;
- variazione dell'energia interna;
- la quantità di lavoro esterno;
- la quantità di calore fornita al processo o la quantità di calore rimossa.
Processo isocoro


Processo isocoro inP, v— , T, S- Eio, S-coordinate (diagrammi)
In un processo isocoro, la condizione v= cost.
Dall'equazione di stato dei gas ideali ( p.v = RT) segue:
p/t = R/V= cost,
cioè, la pressione del gas è direttamente proporzionale alla sua temperatura assoluta:
p2/p1 = T2/T1.
Il lavoro di espansione in un processo isocoro è zero ( l= 0), poiché il volume del fluido di lavoro non cambia (Δ v= cost).
La quantità di calore fornita al fluido di lavoro nel processo 1-2 a CV
Q= CV(T 2 — T 1 ).
T.a. l= 0, quindi in base alla prima legge della termodinamica Δ tu = Q, il che significa che la variazione di energia interna può essere determinata dalla formula:
Δ tu = cv (T2 - T1).
La variazione di entropia in un processo isocoro è determinata dalla formula:
s2–s1= Δ S = CV ln( p2/p1) = CV ln( T2/T1).
processo isobarico



processo isobarico inP, v— , T, S- Eio, S-coordinate (diagrammi)
Un processo isobarico è quello che avviene a pressione costante. P= cost. Dall'equazione di stato per un gas ideale segue:
V/T = R/pag= cost
v2/v1 = T2 /T1 ,
cioè, in una trasformazione isobara, il volume di un gas è proporzionale alla sua temperatura assoluta.
Il lavoro sarà:
l = P(v 2 – v 1 ).
T.a. p.v 1 = RT 1 E p.v 2 = RT 2 , Quello
l = R(T2-T1).
La quantità di calore a cp= cost è determinato dalla formula:
Q = cp(T2-T1).
La variazione di entropia sarà:
s2–s1= Δ S = cp ln( T2/T1).
Processo isotermico



Processo isotermico inP, v— , T, S- Eio, S-coordinate (diagrammi)
In un processo isotermico, la temperatura del fluido di lavoro rimane costante T= cost, quindi:
p.v = RT= cost
p2/p1 = v1/v2,
cioè, pressione e volume sono inversamente proporzionali tra loro, in modo che durante la compressione isotermica la pressione del gas aumenti e durante l'espansione diminuisca.
Il lavoro del processo sarà pari a:
l = RT ln ( v2 – v1) = RT ln ( p1 – p2).
Poiché la temperatura rimane invariata, l'energia interna di un gas ideale in un processo isotermico rimane costante (Δ tu= 0) e tutto il calore fornito al fluido di lavoro viene completamente convertito nel lavoro di espansione:
Q = l.
Durante la compressione isotermica, il calore viene rimosso dal fluido di lavoro in una quantità pari al lavoro speso per la compressione.
La variazione di entropia è:
s2–s1= Δ S = R ln( p1/p2) = R ln( v2/v1).
processo adiabatico



processo adiabatico inP, v— , T, S- Eio, S-coordinate (diagrammi)
Un processo adiabatico è un cambiamento nello stato di un gas che avviene senza scambio di calore con l'ambiente. Dal d Q= 0, allora l'equazione della prima legge della termodinamica per un processo adiabatico avrà la forma:
D tu + P D v = 0
Δ tu+ l = 0,
quindi
Δ tu= —l.
Nel processo adiabatico, il lavoro di espansione viene eseguito solo a causa del dispendio dell'energia interna del gas, e durante la compressione, che si verifica a causa dell'azione delle forze esterne, tutto il lavoro svolto da loro va ad aumentare l'energia interna del gas.
Indichiamo la capacità termica nel processo adiabatico attraverso C inferno, e condizione d Q= 0 è espresso come segue:
D Q = C diavolo d T = 0.
Questa condizione dice che la capacità termica nel processo adiabatico è zero ( C inferno = 0).
È risaputo che
ConP/CV= K
e l'equazione della curva del processo adiabatico (adiabatica) in P, v-diagramma assomiglia a:
pvk= cost.
In questa espressione Kè chiamato esponente adiabatico(chiamato anche rapporto di Poisson).
Valori dell'esponente adiabaticoKper alcuni gas:
K aria = 1,4
K vapore surriscaldato = 1,3
K Scarico ICE = 1,33
K vapore saturo umido = 1,135
Dalle formule precedenti segue:
l= — Δ tu = CV(T 1 – T 2 );
io 1 – io 2 = cp(T 1 – T 2 ).
Il lavoro tecnico del processo adiabatico ( l tech) è uguale alla differenza tra le entalpie di inizio e fine processo ( io 1 – io 2 ).
Viene chiamato un processo adiabatico che si verifica senza attrito interno nel fluido di lavoro isoentropico. IN T, S nel diagramma, è rappresentato da una linea verticale.
Solitamente i veri e propri processi adiabatici procedono in presenza di attriti interni al fluido di lavoro, per cui viene sempre rilasciato calore, che viene ceduto al fluido di lavoro stesso. In questo caso d S> 0 e il processo viene chiamato processo adiabatico reale.
Processo politropico
Un processo è chiamato politropico, che è descritto dall'equazione:
pvn= cost.
Indice politropico N può assumere qualsiasi valore da -∞ a +∞, ma per questo processo è un valore costante.
Dall'equazione del processo politropico e dall'equazione di Claiperon, si può ottenere un'espressione che stabilisce una relazione tra P, v E T in due punti qualsiasi del politropo:
p2/p1 = (v1/v2)N; T2/T1 = (v1/v2) n-1 ; T2/T1 = (p2/p1) (n-1)/n.
Il lavoro di espansione dei gas in un processo politropico è:

Nel caso di un gas ideale, questa formula può essere trasformata:

La quantità di calore fornita o rimossa nel processo è determinata utilizzando la prima legge della termodinamica:
Q = (u2 – u1) + l.
Perché il

è la capacità termica di un gas ideale in un processo politropico.
A CV, K E N= cost c n= const, quindi un processo politropico è talvolta definito come un processo con capacità termica costante.
Il processo politropico ha un significato generalizzante, perché copre l'intero insieme dei processi termodinamici di base.
Rappresentazione grafica di un politropo in P, v coordinate dipendenti dall'indice del politropo N.

pv 0= cost( N= 0) è l'isobara;
p.v= cost( N= 1) è l'isoterma;
p 0 v= cost, p1/∞v= cost, pv∞= const - isocora;
pvk= cost( N = K) è un adiabat.
N > 0 – curve iperboliche,
N < 0 sono parabole.
Basato sui materiali delle mie dispense sulla termodinamica e sul libro di testo "Fondamenti di energia". Autore G. F. Bystritsky. 2a ed., rev. e aggiuntivi - M.: KNORUS, 2011. - 352 p.
Che cos'è un processo isobarico
Definizione
Un processo isobarico (o isobarico) è un processo che avviene in una massa costante di gas a pressione costante.
Scriviamo l'equazione per due stati di un gas ideale:
\ \
Dividiamo l'equazione (2) per l'equazione (1), otteniamo l'equazione del processo isobarico:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \sinistra(4\destra).\]
L'equazione (4) è chiamata legge di Gay-Lussac.
Energia interna e quantità di calore del processo isobarico
Questo processo si verifica con l'apporto di calore se il volume è in aumento o con la rimozione del calore per diminuire il volume. Scriviamo la prima legge della termodinamica, otterremo successivamente espressioni per il lavoro, l'energia interna e la quantità di calore del processo isobarico:
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \left(5\right).\] \[\triangle Q=\int\limits^(T_2)_ (T_1)(dU)+\int\limiti^(V_2)_(V_1)(dA)(6)\]
dove $\delta Q\ $ è il calore elementare fornito al sistema, $dU$ è la variazione dell'energia interna del gas nel processo in corso, $dA$ è il lavoro elementare svolto dal gas nel processo, i è il numero di gradi di libertà della molecola del gas, R è la costante universale dei gas, d è il numero di moli di gas.
Variazione dell'energia interna del gas:
\[\triangolo U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
L'equazione (8) definisce il lavoro per un processo isobarico. Sottraiamo l'equazione (1) da (2), otteniamo un'altra equazione per il funzionamento del gas in un processo isobarico:
\ \[\triangle Q=\frac(i)(2)íR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \triangle T\ ( 10),\]
dove $c_(\mu p)$ è la capacità termica molare del gas in una trasformazione isobara. L'equazione (10) determina la quantità di calore impartita a un gas di massa m in una trasformazione isobara con un aumento di temperatura di $\triangle T.$
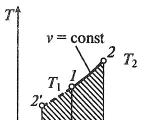
Gli isoprocessi sono spesso rappresentati nei diagrammi termodinamici. Quindi, una linea che rappresenta un processo isobare su un tale diagramma è chiamata isobara (Fig. 1).
Esempio 1
Compito: determinare in che modo le pressioni $p_1$ e $p_2$ sono correlate sul diagramma V(T) in Figura 1c.
Disegna l'isoterma $T_1$

Nei punti A e B le temperature sono le stesse, quindi il gas obbedisce alla legge di Boyle-Mariotte:
\ \
Convertiamo questi volumi in SI: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
Facciamo i calcoli:
Risposta: Il lavoro di un gas in una trasformazione isobara è di 600 J.
Esempio 3
Compito: confrontare il lavoro del gas nel processo ABC e il lavoro del gas nel processo CDA Fig. 3.

Come base per la soluzione, prendiamo la formula che determina il lavoro del gas:
Dal significato geometrico dell'integrale definito, si sa che il lavoro è l'area della figura, che è limitata dalla funzione dell'integranda, dell'asse delle ascisse e delle isocore nei punti $V_1\ e\ V_2$ (asse p(V)). Traduciamo i grafici di processo negli assi p(V).
Considera ogni segmento dei grafici dei processi mostrati nella Figura (3).
AB: Processo isocoro (p=const), $V\uparrow \sinistra(\ Volume\ cresce\destra),\ T\uparrow $;
VS: Processo isocoro (V =const), $T\uparrow $ (dal grafico), p$\uparrow $, dalla legge per il processo isocoro ($\frac(p)(T)=const$);
CD: (p=const), $V\downarrow ,\ T\downarrow ;$
DA: (V =cost), $T\downarrow ,\ p\downarrow .$
Descriviamo i grafici dei processi negli assi p(V) (Fig. 4):

Lavoro di gas $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- area del rettangolo ABFE) (Fig. 3). Lavoro sul gas $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -area\ del rettangolo\ $EFCD. Ovviamente $A_(CDA)>A_(ABC).$
, un processo termodinamico è un cambiamento nello stato di un sistema, a seguito della quale almeno uno dei suoi parametri (temperatura, volume o pressione) cambia il suo valore. Tuttavia, se prendiamo in considerazione che tutti i parametri di un sistema termodinamico sono indissolubilmente legati, allora un cambiamento in uno qualsiasi di essi comporta inevitabilmente un cambiamento in almeno uno (idealmente) o più parametri (in realtà). Nel caso generale, possiamo dire che il processo termodinamico è associato a una violazione dell'equilibrio del sistema e, se il sistema è in uno stato di equilibrio, in esso non possono verificarsi processi termodinamici.
Lo stato di equilibrio di un sistema è un concetto astratto, poiché è impossibile isolare qualcosa di materiale dal mondo circostante, quindi in ogni sistema reale si verificano inevitabilmente vari processi termodinamici. Allo stesso tempo, in alcuni sistemi possono verificarsi cambiamenti così lenti, quasi impercettibili che i processi ad essi associati possono essere considerati condizionatamente come costituiti da una sequenza di stati di equilibrio del sistema. Tali processi sono chiamati equilibrio o quasi statico.
Viene chiamato un altro possibile scenario di modifiche successive nel sistema, dopo di che ritorna al suo stato originale processo circolare o un ciclo. I concetti di equilibrio e processi circolari sono alla base di molte conclusioni teoriche e metodi applicati della termodinamica.
Lo studio di un processo termodinamico consiste nel determinare il lavoro svolto in questo processo, la variazione di energia interna, la quantità di calore, e anche nello stabilire una relazione tra le singole quantità che caratterizzano lo stato di un gas.
Di tutti i possibili processi termodinamici, i processi isocori, isobari, isotermici, adiabatici e politropici sono di maggiore interesse.
Processo isocoro
Un processo isocoro è un processo termodinamico che avviene a volume costante. Tale processo può essere eseguito riscaldando un gas posto in un recipiente chiuso. Il gas si riscalda a causa della fornitura di calore e la sua pressione aumenta.
Il cambiamento dei parametri del gas in un processo isocoro descrive la legge di Charles: p 1 /T 1 \u003d p 2 /T 2, o nel caso generale:
p/T = cost .
La pressione di un gas sulle pareti di un recipiente è direttamente proporzionale alla temperatura assoluta del gas.
Poiché in un processo isocoro la variazione di volume dV è uguale a zero, possiamo concludere che tutto il calore fornito al gas viene speso per modificare l'energia interna del gas (nessun lavoro è fatto).
processo isobarico
Un processo isobarico è un processo termodinamico che avviene a pressione costante. Tale processo può essere eseguito ponendo il gas in un cilindro denso con un pistone mobile, su cui agisce una forza esterna costante durante la rimozione e la fornitura di calore.
Quando la temperatura del gas cambia, il pistone si muove in una direzione o nell'altra; mentre il volume del gas cambia secondo la legge di Gay-Lussac:
V/T = cost.
Ciò significa che in una trasformazione isobara il volume occupato dal gas è direttamente proporzionale alla temperatura.
Si può concludere che un cambiamento di temperatura in questo processo porterà inevitabilmente a un cambiamento nell'energia interna del gas, e un cambiamento di volume è associato all'esecuzione del lavoro, cioè, in un processo isobarico, parte del termico l'energia viene spesa per modificare l'energia interna del gas e l'altra parte viene spesa per l'esecuzione del lavoro del gas per superare l'azione delle forze esterne. In questo caso, il rapporto tra i costi termici per l'aumento dell'energia interna e per l'esecuzione del lavoro dipende dalla capacità termica del gas.
Processo isotermico
Un processo isotermico è un processo termodinamico che avviene a temperatura costante.
Nella pratica è molto difficile eseguire un processo isotermico con gas. Dopotutto, è necessario rispettare la condizione che nel processo di compressione o espansione il gas abbia il tempo di scambiare temperatura con l'ambiente, mantenendo costante la propria temperatura.
Il processo isotermo è descritto dalla legge di Boyle-Mariotte: pV \u003d const, cioè a temperatura costante, la pressione del gas è inversamente proporzionale al suo volume.
Ovviamente, in un processo isotermo, l'energia interna del gas non cambia, poiché la sua temperatura è costante.
Per soddisfare la condizione di costanza della temperatura del gas, è necessario sottrarre calore ad esso, equivalente al lavoro svolto per compressione:
dq = dA = pdv .
Utilizzando l'equazione di stato del gas, dopo aver effettuato una serie di trasformazioni e sostituzioni, possiamo concludere che il lavoro del gas in un processo isotermo è determinato dall'espressione:
A = RT ln(p 1 /p 2).
processo adiabatico
Un processo adiabatico è un processo termodinamico che procede senza scambio di calore tra il fluido di lavoro e l'ambiente. Come un processo isotermico, è molto difficile implementare un processo adiabatico nella pratica. Tale processo può procedere con il mezzo di lavoro posto in un recipiente, ad esempio un cilindro con un pistone, circondato da un materiale termoisolante di alta qualità.
Ma non importa quale isolante termico di alta qualità usiamo in questo caso, una quantità di calore, anche se trascurabile, verrà inevitabilmente scambiata tra il fluido di lavoro e l'ambiente.
Pertanto, in pratica, è possibile creare solo un modello approssimato del processo adiabatico. Tuttavia, molti processi termodinamici eseguiti nell'ingegneria del calore procedono così rapidamente che il fluido di lavoro e il mezzo non hanno il tempo di scambiare calore, quindi, con un certo grado di errore, tali processi possono essere considerati adiabatici.
Ricavare un'equazione relativa a pressione e volume 1 kg gas in un processo adiabatico, scriviamo l'equazione della prima legge della termodinamica:
dq = du + pdv .
Poiché per un processo adiabatico il trasferimento di calore dq è uguale a zero, e la variazione di energia interna è funzione della conducibilità termica della temperatura: du = c v dT , allora possiamo scrivere:
c v dT + pdv = 0 (3) .
Differenziando l'equazione di Clapeyron pv = RT , otteniamo:
pdv + vdp = RdT .
Esprimiamo dT da qui e sostituiamolo nell'equazione (3) . Dopo il riarrangiamento e le trasformazioni, otteniamo:
pdvc v /(R + 1) + c v vdp/R = 0.
Tenendo conto dell'equazione di Mayer R = c p – c v, l'ultima espressione può essere riscritta come:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
Dividendo l'espressione risultante per c v e indicando il rapporto c p / c v con la lettera k , dopo aver integrato l'equazione (4) otteniamo (a k = cost):
ln vk + ln p = const o ln pvk = const o pvk = const .
L'equazione risultante è l'equazione di un processo adiabatico, in cui k è l'esponente adiabatico.
Se assumiamo che la capacità termica volumetrica c v sia un valore costante, ad es. c v \u003d const, allora il lavoro del processo adiabatico può essere rappresentato come la formula (dato senza uscita):
l \u003d c v (T 1 - T 2) o l \u003d (p 1 v 1 - p 2 v 2) / (k-1).
Processo politropico
A differenza dei processi termodinamici sopra considerati, quando uno qualsiasi dei parametri del gas è rimasto invariato, il processo politropico è caratterizzato dalla possibilità di modificare uno qualsiasi dei principali parametri del gas. Tutti i suddetti processi termodinamici sono casi speciali di processi politropici.
L'equazione generale del processo politropico ha la forma pv n = const , dove n è l'indice politropico - un valore costante per questo processo, che può assumere valori da - ∞ a + ∞ .
È ovvio che assegnando determinati valori all'indice politropico, è possibile ottenere l'uno o l'altro processo termodinamico: isocoro, isobarico, isotermico o adiabatico.
Quindi, se prendiamo n = 0 , otteniamo p = const - un processo isobarico, se prendiamo n = 1 , otteniamo un processo isotermo descritto dalla dipendenza pv = const ; per n = k il processo è adiabatico, e per n uguale a - ∞ o + ∞ . otteniamo un processo isocoro.
Argomenti del codificatore USE: isoprocessi - processi isotermici, isocori, isobari.
In tutto questo opuscolo, ci atterremo al seguente presupposto: la massa e la composizione chimica del gas rimangono invariate. In altre parole, crediamo che:
Cioè, non vi è alcuna perdita di gas dalla nave o, al contrario, afflusso di gas nella nave;
Cioè, le particelle di gas non subiscono alcun cambiamento (diciamo, non c'è dissociazione - il decadimento delle molecole in atomi).
Queste due condizioni sono soddisfatte in moltissime situazioni fisicamente interessanti (ad esempio, in semplici modelli di motori termici) e meritano quindi una considerazione a parte.
Se la massa del gas e la sua massa molare sono fisse, lo stato del gas è determinato da tre parametri macroscopici: pressione, volume E temperatura. Questi parametri sono correlati tra loro dall'equazione di stato (l'equazione di Mendeleev-Clapeyron).
Processo termodinamico(o semplicemente processi) è il cambiamento di stato del gas nel tempo. Durante il processo termodinamico, i valori dei parametri macroscopici - pressione, volume e temperatura - cambiano.
Di particolare interesse sono isoprocessi- processi termodinamici in cui il valore di uno dei parametri macroscopici rimane invariato. Fissando a turno ciascuno dei tre parametri, otteniamo tre tipi di isoprocessi.
1. Processo isotermico va a una temperatura del gas costante: .
2. processo isobarico funziona a pressione del gas costante: .
3. Processo isocoro va a volume costante di gas: .
Gli isoprocessi sono descritti da leggi molto semplici di Boyle - Mariotte, Gay-Lussac e Charles. Passiamo allo studio di loro.
Processo isotermico
Lascia che un gas ideale compia un processo isotermico a una temperatura . Durante il processo, cambiano solo la pressione del gas e il suo volume.
Considera due stati arbitrari del gas: in uno di essi i valori dei parametri macroscopici sono , e nel secondo sono . Questi valori sono correlati dall'equazione di Mendeleev-Clapeyron:
Come abbiamo detto fin dall'inizio, la massa e la massa molare sono assunte costanti.
Pertanto, le parti giuste delle equazioni scritte sono uguali. Pertanto, anche i membri di sinistra sono uguali:
(1)
Poiché i due stati del gas sono stati scelti arbitrariamente, possiamo concludere che durante un processo isotermico, il prodotto della pressione del gas e del volume rimane costante:
(2)
Questa dichiarazione è chiamata Legge di Boyle - Mariotte.
Dopo aver scritto la legge Boyle-Mariotte nella forma
(3)
si può anche formulare così: In una trasformazione isoterma la pressione di un gas è inversamente proporzionale al suo volume.. Se, ad esempio, durante l'espansione isotermica di un gas, il suo volume aumenta di tre volte, la pressione del gas diminuisce di tre volte.
Come spiegare la relazione inversa tra pressione e volume da un punto di vista fisico? A temperatura costante, l'energia cinetica media delle molecole di gas rimane invariata, cioè, semplicemente parlando, la forza degli impatti delle molecole sulle pareti del recipiente non cambia. Con un aumento del volume, la concentrazione di molecole diminuisce e, di conseguenza, diminuisce il numero di impatti molecolari per unità di tempo per unità di area del muro: la pressione del gas diminuisce. Al contrario, con una diminuzione del volume, la concentrazione delle molecole aumenta, i loro impatti sono più frequenti e la pressione del gas aumenta.
Grafici di processo isotermico
In generale, è consuetudine rappresentare grafici di processi termodinamici nei seguenti sistemi di coordinate:
-diagramma: asse delle ascisse, asse delle ordinate;
-diagramma: asse delle ascisse, asse delle ordinate.
Viene chiamato il grafico di un processo isotermico isoterma.
Un'isoterma su un grafico è un grafico inversamente proporzionale.
Tale grafico è un'iperbole (ricorda l'algebra - grafico delle funzioni). L'isoterma-iperbole è mostrata in fig. 1 .

Riso. 1. Isoterma sul diagramma
Ogni isoterma corrisponde a un determinato valore di temperatura fisso. Si scopre che maggiore è la temperatura, maggiore è l'isoterma corrispondente -diagramma.
Consideriamo infatti due processi isotermici compiuti dallo stesso gas (Fig. 2). Il primo processo avviene a una temperatura, il secondo a una temperatura.

Riso. 2. Maggiore è la temperatura, maggiore è l'isoterma
Fissiamo un valore del volume . Sulla prima isoterma corrisponde alla pressione , sulla seconda - class="tex" alt="p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
Nei restanti due sistemi di coordinate, l'isoterma sembra molto semplice: è una linea retta perpendicolare all'asse ( fig. 3):

Riso. 3. Isoterme su e -diagrammi
processo isobarico
Ricordiamo ancora una volta che il processo isobarico è un processo che avviene a pressione costante. Durante il processo isobarico, cambiano solo il volume del gas e la sua temperatura.
Un tipico esempio di processo isobarico: il gas si trova sotto un enorme pistone che può muoversi liberamente. Se la massa del pistone e la sezione trasversale del pistone , allora la pressione del gas è costante e uguale a
dove è la pressione atmosferica.
Si supponga che un gas ideale compia una trasformazione isobarica a pressione. Consideriamo ancora due stati arbitrari del gas; questa volta i valori dei parametri macroscopici saranno pari a e .
Scriviamo le equazioni di stato:
Dividendoli l'uno per l'altro, otteniamo:
In linea di principio, questo potrebbe già essere sufficiente, ma andremo un po' oltre. Riscriviamo la relazione risultante in modo che solo i parametri del primo stato appaiano in una parte e solo i parametri del secondo stato appaiano nell'altra (in altre parole, "dividiamo gli indici" in parti diverse):
(4)
E ora da qui - vista l'arbitrarietà della scelta degli stati! - noi abbiamo Legge di Gay-Lussac:
(5)
In altre parole, A pressione costante, il volume di un gas è direttamente proporzionale alla sua temperatura.:
(6)
Perché il volume aumenta con la temperatura? All'aumentare della temperatura, le molecole iniziano a colpire più forte e a sollevare il pistone. Allo stesso tempo, la concentrazione di molecole diminuisce, gli impatti diventano meno frequenti, così che alla fine la pressione rimane la stessa.
Grafici del processo isobarico
Viene chiamato il grafico del processo isobarico isobara. Sul diagramma, l'isobar è una linea retta (Fig. 4):

Riso. 4. Isobare sul diagramma
La sezione tratteggiata del grafico significa che nel caso di un gas reale a temperature sufficientemente basse, il modello del gas ideale (e con esso la legge di Gay-Lussac) cessa di funzionare. Infatti, al diminuire della temperatura, le particelle di gas si muovono sempre più lentamente e le forze di interazione intermolecolare hanno un'influenza sempre più significativa sul loro movimento (un'analogia: una palla lenta è più facile da prendere rispetto a una veloce). Bene, a temperature molto basse, i gas si trasformano in liquidi.
Ora scopriamo come cambia la posizione dell'isobare con un cambiamento di pressione. Si scopre che Maggiore è la pressione, minore è l'isobare. -diagramma.
Per verificarlo, si considerino due isobare con pressioni e (Fig. 5):

Riso. 5. Minore è l'isobare, maggiore è la pressione
Fissiamo un valore di temperatura . Lo vediamo . Ma a una temperatura fissa, il volume è tanto minore quanto maggiore è la pressione (legge di Boyle - Mariotte!).
Quindi class="tex" alt="p_2 > p_1"> .!}
Nei restanti due sistemi di coordinate, l'isobare è una linea retta perpendicolare all'asse (Fig. 6):

Riso. 6. Isobare su e -diagrammi
Processo isocoro
Un processo isocoro, ricordiamo, è un processo che avviene a volume costante. In una trasformazione isocora cambiano solo la pressione del gas e la sua temperatura.
Un processo isocoro è molto semplice da immaginare: è un processo che avviene in un recipiente rigido di volume fisso (o in un cilindro sotto un pistone quando il pistone è fisso).
Lascia che un gas ideale compia un processo isocoro in un recipiente di volume . Di nuovo, consideriamo due stati di gas arbitrari con parametri e . Abbiamo:
Dividiamo queste equazioni l'una nell'altra:
Come nella derivazione della legge di Gay-Lussac, abbiamo "diviso" gli indici in diverse parti:
(7)
Alla luce dell'arbitrarietà della scelta degli stati, arriviamo a Legge Carlo:
(8)
In altre parole, A volume costante di un gas, la sua pressione è direttamente proporzionale alla sua temperatura.:
(9)
Un aumento della pressione di un gas di volume fisso quando viene riscaldato è una cosa del tutto ovvia dal punto di vista fisico. Puoi spiegarlo facilmente da solo.
Grafici di processo isocoro
Viene chiamato il grafico del processo isocoro isocora. Sul diagramma, l'isocore è una linea retta ( fig. 7):

Riso. 7. Isocore su -diagramma
Il significato dell'area tratteggiata è lo stesso: l'inadeguatezza del modello di gas ideale alle basse temperature.

Riso. 8. Minore è l'isocore, maggiore è il volume
La dimostrazione è simile alla precedente. Fissiamo la temperatura e lo vediamo. Ma a una temperatura fissa, la pressione è minore, maggiore è il volume (di nuovo, la legge di Boyle-Mariotte). Quindi class="tex" alt="V_2 > V_1"> .!}
Nei restanti due sistemi di coordinate, l'isocore è una linea retta perpendicolare all'asse (Fig. 9):

Riso. 9. Isocore su e -diagrammi
Le leggi di Boyle: vengono anche chiamate Mariotte, Gay-Lussac e Charles leggi sui gas.
Abbiamo derivato le leggi dei gas dall'equazione di Mendeleev-Clapeyron. Ma storicamente è stato il contrario: le leggi sui gas sono state stabilite sperimentalmente, e molto prima. L'equazione di stato apparve successivamente come loro generalizzazione.
processo isobarico
Grafici di isoprocessi in diversi sistemi di coordinate
processo isobarico(Altro greco ισος, isos - "stesso" + βαρος, baros - "peso") - il processo di modifica dello stato di un sistema termodinamico a pressione costante ()
La dipendenza del volume del gas dalla temperatura a pressione costante fu studiata sperimentalmente nel 1802 da Joseph Louis Gay-Lussac. Legge di Gay-Lussac: A pressione costante e valori costanti della massa di un gas e della sua massa molare, il rapporto tra il volume di un gas e la sua temperatura assoluta rimane costante: V / T = const.
Processo isocoro
Processo isocoro(dal coro greco - luogo occupato) - il processo di modifica dello stato di un sistema termodinamico a volume costante (). Per i gas ideali, il processo isocoro è descritto dalla legge di Charles: per una data massa di gas a volume costante, la pressione è direttamente proporzionale alla temperatura:
La linea che rappresenta un processo isocoro in un diagramma è chiamata isocora.
Vale anche la pena sottolineare che l'energia fornita al gas viene spesa per cambiare l'energia interna, cioè Q = 3* ν*R*T/2=3*V*ΔP, dove R è la costante universale dei gas, ν è il numero di moli nel gas, T è la temperatura in Kelvin, V è il volume del gas, ΔP è l'incremento della variazione di pressione. e la linea che rappresenta il processo isocoro nel diagramma, negli assi P(T), dovrebbe essere prolungata e collegata con una linea tratteggiata all'origine, poiché potrebbero sorgere malintesi.
Processo isotermico
Processo isotermico(dal greco "thermos" - caldo, caldo) - il processo di modifica dello stato di un sistema termodinamico a temperatura costante () (). Il processo isotermico è descritto dalla legge di Boyle - Mariotte:
A temperatura costante e valori costanti della massa del gas e della sua massa molare, il prodotto del volume del gas e della sua pressione rimane costante: PV = const.
Processo isentropico
Processo isentropico- il processo di modifica dello stato di un sistema termodinamico a un'entropia costante (). Ad esempio, un processo adiabatico reversibile è isentropico: in tale processo non c'è scambio di calore con l'ambiente. Un gas ideale in un tale processo è descritto dalla seguente equazione:
dove è l'esponente adiabatico, determinato dal tipo di gas.
Fondazione Wikimedia. 2010 .
Guarda cosa sono gli "isoprocessi" in altri dizionari:
Gli isoprocessi sono processi termodinamici durante i quali la massa e un'altra delle quantità fisiche dei parametri di stato: pressione, volume o temperatura rimangono invariate. Quindi, un processo isobarico corrisponde a una pressione costante, un volume isocoro ... Wikipedia
La teoria cinetica molecolare (abbreviata in MKT) è una teoria che considera la struttura della materia dal punto di vista di tre disposizioni principali approssimativamente corrette: tutti i corpi sono costituiti da particelle, la cui dimensione può essere trascurata: atomi, molecole e ioni; particelle ... ... Wikipedia
- (abbreviato in MKT) una teoria che considera la struttura della materia dal punto di vista di tre disposizioni principali approssimativamente corrette: tutti i corpi sono costituiti da particelle le cui dimensioni possono essere trascurate: atomi, molecole e ioni; le particelle sono in continuo... ... Wikipedia
Libri
- Previsione statistica delle caratteristiche di resistenza alla deformazione dei materiali strutturali , G. Pluvinazh , VT Sapunov , Questo libro presenta un nuovo metodo che propone una metodologia comune per prevedere le caratteristiche dei processi cinetici, comuni per i materiali metallici e polimerici. Metodo… Categoria: Libri di testo per le università Editore: