Pagrindinės alkanų cheminės savybės. Alkanai: fizinės ir cheminės savybės, taikymas
Sočiųjų angliavandenilių chemines savybes lemia anglies ir vandenilio atomų bei $C-H$ ir $C-C$ jungčių buvimas jų molekulėse.
Paprasčiausio alkano – metano – molekulėje cheminius ryšius sudaro 8 valentiniai elektronai (4 elektronai iš anglies atomo ir 4 iš vandenilio atomų), išsidėstę keturiose jungiančiose molekulinėse orbitose.
Taigi metano molekulėje keturi $sp3-s (C-H)$ kovalentiniai ryšiai susidaro iš keturių $sp3$-hibridizuotų anglies atomo orbitalių ir keturių vandenilio atomų s-orbitalių (1 pav.).
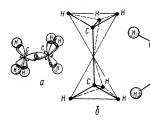
Etano molekulė susidaro iš dviejų anglies tetraedrų – vieno $sp3-sp3 (C-C)$ kovalentinio ryšio ir šešių $sp3-s (C-H)$ kovalentinių jungčių (2 pav.).

2 pav. Etano molekulės struktūra: a - $\sigma $ ryšių išdėstymas molekulėje; b - tetraedrinis molekulės modelis; c - molekulės rutulio ir lazdos modelis; d - molekulės mastelio modelis pagal Stewart - Briegleb
Cheminių ryšių ypatumai alkanuose
Nagrinėjamuose kovalentinių ryšių tipuose didžiausio elektronų tankio sritys yra tiesėje, jungiančioje atomo branduolius. Šiuos kovalentinius ryšius sudaro lokalizuotos $\sigma $-$(\rm M)$$(\rm O)$ ir jie vadinami $\sigma $ ryšiais. Svarbi šių ryšių ypatybė yra ta, kad elektronų tankis juose pasiskirsto simetriškai ašies, einančios per atomo branduolius, atžvilgiu (cilindrinė elektronų tankio simetrija). Dėl šios priežasties atomai ar atomų grupės, sujungtos šia jungtimi, gali laisvai suktis nesukeldami jungties deformacijos. Kampas tarp anglies atomų valentingumo krypčių alkano molekulėse yra $109^\circ 28"$. Todėl šių medžiagų molekulėse, net ir turinčiose tiesią anglies grandinę, anglies atomai iš tikrųjų nėra tiesioje linijoje. Ši grandinė yra zigzago formos, kuri yra susijusi su anglies atomų intervalo kampų išsaugojimu (3 pav.).

3 pav. Normalaus alkano anglies grandinės sandaros schema
Alkano molekulėse, turinčiose pakankamai ilgą anglies grandinę, šis kampas padidėja $2^\circ$ dėl to, kad atstumiami anglies atomai, kurie nėra valentiškai susieti vienas su kitu.
1 pastaba
Kiekviena cheminė jungtis pasižymi tam tikra energija. Eksperimentiškai nustatyta, kad $C-H$ ryšio energija metano molekulėje yra 422,9 kJ/mol, etano - 401,9 kJ/mol, o kitų alkanų - apie 419 kJ/mol. $C-C$ ryšio energija yra 350 kJ/mol.
Alkanų struktūros ir jų reaktyvumo ryšys
Didelė $C-C$ ir $C-H$ jungčių energija sukelia mažą sočiųjų angliavandenilių reaktyvumą kambario temperatūroje. Taigi alkanai neblunka bromo vandens, kalio permanganato tirpalo, nesąveikauja su joniniais reagentais (rūgštimis, šarmais), nereaguoja su oksiduojančiomis medžiagomis ar aktyviais metalais. Todėl, pavyzdžiui, natrio metalas gali būti laikomas žibale, kuris yra sočiųjų angliavandenilių mišinys. Net koncentruota sieros rūgštis, kuri suanglina daugybę organinių medžiagų, kambario temperatūroje neveikia alkanų. Atsižvelgiant į santykinai mažą sočiųjų angliavandenilių reaktyvumą, jie kažkada buvo vadinami parafinais. Alkanai neturi galimybės pridėti vandenilio, halogenų ir kitų reagentų. Todėl ši organinių medžiagų klasė buvo vadinama sočiaisiais angliavandeniliais.
Cheminės sočiųjų angliavandenilių reakcijos gali vykti dėl $C-C$ arba $C-H$ jungčių skilimo. $C-H$ jungčių plyšimas lydimas vandenilio atomų pašalinimo ir nesočiųjų junginių susidarymo arba vėlesnio vandenilio atomų pašalinimo pakeitimo kitais atomais ar atomų grupėmis.
Priklausomai nuo alkano struktūros ir reakcijos sąlygų sočiųjų angliavandenilių molekulėse, $C-H$ jungtis gali nutrūkti homolitiškai:

4 pav. Alkanų cheminės savybės
Ir heterolitinis su anijonų ir katijonų susidarymu:
5 pav. Alkanų cheminės savybės
Tokiu atveju gali susidaryti laisvieji radikalai, turintys neporinį elektroną, bet neturintys elektros krūvio, arba karbokationai ar karbanionai, turintys atitinkamus elektros krūvius. Laisvieji radikalai susidaro kaip tarpinės dalelės radikalinio mechanizmo reakcijose, o karbokationai ir karbanionai – joninio mechanizmo reakcijose.
Dėl to, kad $C-C$ ryšiai yra nepoliniai, o $C-H$ ryšiai yra žemo poliškumo, o šie $\sigma $-ryšiai turi mažą poliarizaciją, susidaro heterolitinis $\sigma $-jungčių skilimas alkano molekulėse. jonams reikia daug energijos. Šių jungčių hemoliziniam skilimui reikia mažiau energijos. Todėl sočiųjų angliavandenilių reakcijos, vykstančios radikaliniu mechanizmu, yra tipiškesnės. $\sigma $-ryšio $C-C$ padalijimas reikalauja mažiau energijos nei $C-H$ jungties padalijimas, nes $C-C$ jungties energija yra mažesnė už $C-H$ jungties energiją. Tačiau cheminės reakcijos dažniau apima $C-H$ jungčių skilimą, nes jos yra labiau prieinamos reagentams.
Alkanų šakojimosi ir dydžio įtaka jų reaktyvumui
$C-H$ jungties reaktyvumas pasikeičia pereinant nuo linijinės struktūros alkanų prie šakotos struktūros alkanų. Pavyzdžiui, $C-H$ jungties disociacijos energija (kJ/mol) formuojantis laisviesiems radikalams kinta taip:

6 pav. Alkanų cheminės savybės
Be to, alkanų jonizacijos energijos (IE) vertė rodo, kad padidėjus bendram $\sigma $-jungčių skaičiui, padidėja jų donorinės savybės ir tampa lengviau pašalinti elektroną didesnės molekulinės masės junginiams, pvz. :
7 pav. Cheminės alkanų savybės
Taigi laisvųjų radikalų procesuose reakcijos vyksta daugiausia tretiniame anglies atome, tada antriniame ir galiausiai pirminiame, kuris sutampa su laisvųjų radikalų stabilumo serija. Tačiau, kylant temperatūrai, stebima tendencija mažėja arba visiškai išsilygina.
Taigi alkanams būdingos dviejų tipų cheminės reakcijos:
- vandenilio pakeitimas, daugiausia radikaliniu mechanizmu ir
- molekulės, esančios už $C-C$ arba $C-H$ jungčių, skilimas.
Alkanai :
Alkanai yra sotieji angliavandeniliai, kurių molekulėse visi atomai yra sujungti viengubomis jungtimis. Formulė -
Fizinės savybės :
- Lydymosi ir virimo temperatūra didėja didėjant anglies stuburo molekulinei svoriui ir ilgiui
- Normaliomis sąlygomis nešakotieji alkanai nuo CH 4 iki C 4 H 10 yra dujos; nuo C5H12 iki C13H28 – skysčiai; po C 14 H 30 - kietosios medžiagos.
- Lydymosi ir virimo temperatūra mažėja nuo mažiau šakotos iki labiau šakotos. Taigi, pavyzdžiui, 20 ° C temperatūroje n-pentanas yra skystis, o neopetanas yra dujos.
Cheminės savybės:
· Halogeninimas
tai viena iš pakeitimo reakcijų. Pirmiausia halogeninamas mažiausiai hidrintas anglies atomas (tretinis atomas, po to antrinis, pirminiai atomai halogeninami paskutiniai). Alkanų halogeninimas vyksta etapais - vienu etapu pakeičiamas ne daugiau kaip vienas vandenilio atomas:
- CH 4 + Cl 2 → CH 3 Cl + HCl (chlormetanas)
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (dichlormetanas)
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (trichlormetanas)
- CHCl 3 + Cl 2 → CCl 4 + HCl (anglies tetrachloridas).
Šviesos veikiama chloro molekulė skyla į radikalus, tada jie puola alkano molekules, atimdami iš jų vandenilio atomą, dėl ko susidaro metilo radikalai CH 3, kurie susiduria su chloro molekulėmis, jas sunaikindami ir sudarydami. naujų radikalų.
· Degimas
Pagrindinė sočiųjų angliavandenilių cheminė savybė, lemianti jų naudojimą kaip kurą, yra degimo reakcija. Pavyzdys:
CH 4 + 2O 2 → CO 2 + 2H 2 O + K
Trūkstant deguonies, vietoj anglies dioksido (priklausomai nuo deguonies koncentracijos) susidaro anglies monoksidas arba anglis.
Apskritai alkanų degimo reakciją galima parašyti taip:
SU n H 2 n +2 +(1,5n+0,5)O2 = n CO 2 + ( n+1)H2O
· Skilimas
Skilimo reakcijos vyksta tik veikiant aukštai temperatūrai. Temperatūros padidėjimas sukelia anglies jungčių plyšimą ir laisvųjų radikalų susidarymą.
Pavyzdžiai:
CH4 → C + 2H 2 (t > 1000 °C)
C2H6 → 2C + 3H2
Alkenai :
Alkenai yra nesotieji angliavandeniliai, kurių molekulėje, be pavienių jungčių, yra ir viena anglies-anglies dviguba jungtis - C n H 2n
Angliavandenilio priklausymą alkenų klasei atspindi jo pavadinime esanti bendrinė priesaga –ene.
Fizinės savybės :
- Alkenų lydymosi ir virimo temperatūra (supaprastinta) didėja didėjant anglies stuburo molekulinei masei ir ilgiui.
- Normaliomis sąlygomis alkenai nuo C 2 H 4 iki C 4 H 8 yra dujos; nuo C 5 H 10 iki C 17 H 34 - skysčiai, po C 18 H 36 - kietos medžiagos. Alkenai netirpsta vandenyje, bet gerai tirpsta organiniuose tirpikliuose.
Cheminės savybės :
· Dehidratacija yra vandens molekulės atskyrimo nuo organinio junginio molekulės procesas.
· Polimerizacija yra cheminis procesas, kurio metu daugelis pradinių mažos molekulinės masės medžiagos molekulių sujungiamos į dideles polimero molekules.
Polimeras yra didelės molekulinės masės junginys, kurio molekulės susideda iš daugelio vienodų struktūrinių vienetų.
Alkadienai :
Alkadienai yra nesotieji angliavandeniliai, kurių molekulėje, be pavienių jungčių, yra ir dvigubų anglies-anglies jungčių.
. Dienai yra struktūriniai alkinų izomerai.Fizinės savybės :
Butadienas – dujos (virimo temperatūra –4,5 °C), izoprenas – 34 °C temperatūroje verdantis skystis, dimetilbutadienas – 70 °C temperatūroje verdantis skystis. Izoprenas ir kiti dieniniai angliavandeniliai gali polimerizuotis į gumą. Išgrynintas natūralus kaučiukas yra polimeras, kurio bendra formulė (C5H8)n ir gaunamas iš kai kurių atogrąžų augalų pieniškų sulčių.
Guma gerai tirpsta benzene, benzine ir anglies disulfide. Esant žemai temperatūrai, kaitinant jis tampa trapus ir lipnus. Siekiant pagerinti mechanines ir chemines gumos savybes, ji vulkanizavimo būdu paverčiama guma. Norint gauti guminius gaminius, jie pirmiausia liejami iš gumos ir sieros mišinio, taip pat užpildų: suodžių, kreidos, molio ir kai kurių organinių junginių, kurie padeda pagreitinti vulkanizaciją. Tada gaminiai pašildomi – karšta vulkanizacija. Vulkanizavimo metu siera chemiškai susijungia su guma. Be to, vulkanizuotoje gumoje yra laisvos sieros mažų dalelių pavidalu.
Dienos angliavandeniliai lengvai polimerizuojasi. Dienų angliavandenilių polimerizacijos reakcija yra kaučiuko sintezės pagrindas. Juose vyksta prisijungimo reakcijos (hidrinimas, halogeninimas, hidrohalogeninimas):
H2C=CH-CH=CH2 + H2 -> H3C-CH=CH-CH3
Alkinai :
Alkinai yra nesotieji angliavandeniliai, kurių molekulėse, be pavienių jungčių, yra ir vienas trigubas anglies-anglies ryšys, kurio formulė – C n H 2n-2
Fizinės savybės :
Alkinai savo fizinėmis savybėmis primena atitinkamus alkenus. Žemesnės (iki C 4) yra bespalvės ir bekvapės dujos, kurių virimo temperatūra yra aukštesnė nei jų analogų alkenuose.
Alkinai blogai tirpsta vandenyje, bet geriau organiniuose tirpikliuose.
Cheminės savybės :
Halogeninimo reakcijos
Alkinai gali pridėti vieną ar dvi halogeno molekules, kad susidarytų atitinkami halogeno dariniai:
Hidratacija
Esant gyvsidabrio druskoms, alkinai prideda vandens, kad susidarytų acetaldehidas (acetilenui) arba ketonas (kitiems alkinams).

Sotieji angliavandeniliai yra junginiai, sudaryti iš anglies atomų sp 3 hibridizacijos būsenoje. Jie yra sujungti vienas su kitu tik kovalentiniais sigma ryšiais. Pavadinimas „sotieji“ arba „sotieji“ angliavandeniliai kilo dėl to, kad šie junginiai neturi galimybės prijungti jokių atomų. Jie yra ekstremalūs, visiškai prisotinti. Išimtis yra cikloalkanai.
Kas yra alkanai?
Alkanai yra sotieji angliavandeniliai, o jų anglies grandinė yra atvira ir susideda iš anglies atomų, sujungtų vienas su kitu naudojant pavienius ryšius. Jame nėra kitų (ty dvigubų, kaip alkenai, arba trigubų, kaip alkilai) jungčių. Alkanai taip pat vadinami parafinais. Jie gavo šį pavadinimą, nes gerai žinomi parafinai yra daugiausia šių sočiųjų angliavandenilių C18-C35 mišinys, pasižymintis ypatingu inertiškumu.
Bendra informacija apie alkanus ir jų radikalus
Jų formulė: C n P 2 n +2, čia n yra didesnis arba lygus 1. Molinė masė apskaičiuojama pagal formulę: M = 14n + 2. Būdingas požymis: galūnės jų pavadinimuose yra „-an“. Jų molekulių liekanos, kurios susidaro pakeitus vandenilio atomus kitais atomais, vadinamos alifatiniais radikalais arba alkilais. Jie žymimi raide R. Bendroji vienavalenčių alifatinių radikalų formulė: C n P 2 n +1, čia n yra didesnis arba lygus 1. Alifatinių radikalų molinė masė apskaičiuojama pagal formulę: M = 14n + 1. Būdingas alifatinių radikalų bruožas: pavadinimų galūnės „- dumblas“. Alkanų molekulės turi savo struktūrines savybes:
- C-C jungtis pasižymi 0,154 nm ilgiu;
- CH-jungtis pasižymi 0,109 nm ilgiu;
- ryšio kampas (kampas tarp anglies-anglies ryšių) yra 109 laipsniai ir 28 minutės.

Alkanai pradeda homologines serijas: metanas, etanas, propanas, butanas ir kt.
Alkanų fizinės savybės
Alkanai yra bespalvės ir vandenyje netirpios medžiagos. Temperatūra, kurioje alkanai pradeda lydytis, ir temperatūra, kurioje jie verda, didėja priklausomai nuo molekulinės masės ir angliavandenilių grandinės ilgio padidėjimo. Nuo mažiau šakotų iki labiau šakotų alkanų virimo ir lydymosi temperatūra mažėja. Dujiniai alkanai gali degti blyškiai mėlyna arba bespalve liepsna ir pagaminti gana daug šilumos. CH 4 -C 4 H 10 yra dujos, kurios taip pat neturi kvapo. C 5 H 12 -C 15 H 32 yra skysčiai, turintys specifinį kvapą. C 15 H 32 ir tt yra kietos medžiagos, kurios taip pat yra bekvapės.
Alkanų cheminės savybės
Šie junginiai yra chemiškai neaktyvūs, o tai galima paaiškinti sunkiai nutrūkstančių sigma ryšių – C-C ir C-H – stiprumu. Taip pat verta atsižvelgti į tai, kad C-C ryšiai yra nepoliniai, o CH ryšiai yra žemo poliškumo. Tai yra mažai poliarizuoti ryšiai, priklausantys sigmos tipui, todėl greičiausiai jie bus nutraukti homolitiniu mechanizmu, dėl kurio susidarys radikalai. Taigi alkanų cheminės savybės daugiausia apsiriboja radikalų pakeitimo reakcijomis.

Nitravimo reakcijos
Alkanai dujinėje aplinkoje 140°C temperatūroje reaguoja tik su azoto rūgštimi, kurios koncentracija yra 10 %, arba su keturiavalenčiu azoto oksidu. Alkanų nitrinimo reakcija vadinama Konovalovo reakcija. Dėl to susidaro nitro junginiai ir vanduo: CH 4 + azoto rūgštis (praskiesta) = CH 3 - NO 2 (nitrometanas) + vanduo.
Degimo reakcijos
Sotieji angliavandeniliai labai dažnai naudojami kaip kuras, o tai pateisinama jų gebėjimu degti: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
Oksidacijos reakcijos
Alkanų cheminės savybės taip pat apima jų gebėjimą oksiduotis. Priklausomai nuo to, kokios sąlygos lydi reakciją ir kaip jos keičiamos, iš tos pačios medžiagos galima gauti skirtingus galutinius produktus. Lengvas metano oksidavimas deguonimi esant katalizatoriui, greitinančiam reakciją ir esant maždaug 200 °C temperatūrai, gali sukelti šias medžiagas:
1) 2CH 4 (oksidacija deguonimi) = 2CH 3 OH (alkoholis – metanolis).
2) CH 4 (oksidavimas deguonimi) = CH 2 O (aldehidas – metanalis arba formaldehidas) + H 2 O.
3) 2CH 4 (oksidacija deguonimi) = 2HCOOH (karboksirūgštis – metanas arba skruzdžių rūgštis) + 2H 2 O.

Taip pat alkanų oksidacija gali būti atliekama dujinėje arba skystoje terpėje su oru. Dėl tokių reakcijų susidaro aukštesni riebalų alkoholiai ir atitinkamos rūgštys.
Ryšys su šiluma
Ne aukštesnėje kaip +150-250°C temperatūroje, visada esant katalizatoriui, vyksta organinių medžiagų struktūrinis persitvarkymas, kuris susideda iš atomų jungimosi tvarkos pasikeitimo. Šis procesas vadinamas izomerizacija, o reakcijos metu susidarančios medžiagos – izomerai. Taigi iš įprasto butano gaunamas jo izomeras – izobutanas. Esant 300-600°C temperatūrai ir esant katalizatoriui, C-H ryšiai nutrūksta susidarant vandenilio molekulėms (dehidrinimo reakcijos), vandenilio molekulėms užsidarius anglies grandinei į ciklą (alkanų ciklizacijos arba aromatinimo reakcijos). :
1) 2CH4 = C2H4 (etenas) + 2H2.
2) 2CH4 = C2H2 (etinas) + 3H2.
3) C 7 H 16 (normalus heptanas) = C 6 H 5 - CH 3 (toluenas) + 4 H 2.

Halogeninimo reakcijos
Tokios reakcijos apima halogenų (jų atomų) patekimą į organinės medžiagos molekulę, dėl ko susidaro C-halogeninė jungtis. Alkanams reaguojant su halogenais susidaro halogeno dariniai. Ši reakcija turi specifinių savybių. Jis vyksta pagal radikalų mechanizmą, o norint jį inicijuoti, halogenų ir alkanų mišinį reikia paveikti ultravioletine spinduliuote arba tiesiog šildyti. Alkanų savybės leidžia halogeninimo reakcijai vykti tol, kol pasiekiamas visiškas pakeitimas halogeno atomais. Tai reiškia, kad metano chlorinimas nesibaigs vienu etapu ir metilchlorido gamyba. Reakcija vyks toliau, susidarys visi galimi pakaitų produktai, pradedant chlormetanu ir baigiant anglies tetrachloridu. Tokiomis sąlygomis veikiant chlorui kitus alkanus, dėl vandenilio pakeitimo skirtinguose anglies atomuose susidarys įvairūs produktai. Temperatūra, kurioje vyksta reakcija, nulems galutinių produktų santykį ir jų susidarymo greitį. Kuo ilgesnė alkano angliavandenilių grandinė, tuo lengviau vyks reakcija. Halogeninimo metu pirmiausia bus pakeistas mažiausiai hidrintas (tretinis) anglies atomas. Pirminis reaguos po visų kitų. Halogeninimo reakcija vyks etapais. Pirmajame etape pakeičiamas tik vienas vandenilio atomas. Alkanai nesąveikauja su halogeno tirpalais (chloro ir bromo vandeniu).

Sulfochlorinimo reakcijos
Alkanų chemines savybes taip pat papildo sulfochlorinimo reakcija (vadinama Reed reakcija). Veikiami ultravioletinių spindulių, alkanai gali reaguoti su chloro ir sieros dioksido mišiniu. Dėl to susidaro vandenilio chloridas, taip pat alkilo radikalas, kuris prideda sieros dioksido. Rezultatas yra sudėtingas junginys, kuris tampa stabilus dėl chloro atomo gaudymo ir kitos jo molekulės sunaikinimo: R-H + SO 2 + Cl 2 + ultravioletinė spinduliuotė = R-SO 2 Cl + HCl. Reakcijos metu susidarę sulfonilchloridai plačiai naudojami paviršinio aktyvumo medžiagų gamyboje.
Alkanų panaudojimas gana įvairus – jie naudojami kaip kuras, taip pat mechanikoje, medicinoje ir kt. Šių cheminių junginių vaidmuo šiuolaikinio žmogaus gyvenime vargu ar gali būti pervertintas.
Alkanai: savybės ir trumpas aprašymas
Alkanai yra necikliniai anglies junginiai, kuriuose anglies atomai yra sujungti paprastais sočiosiomis jungtimis. Šios medžiagos yra visas asortimentas, pasižymintis tam tikromis savybėmis ir savybėmis. taip:
N čia reiškia anglies atomų skaičių. Pavyzdžiui, CH3, C2H6.
Pirmieji keturi alkanų serijos atstovai yra dujinės medžiagos: metanas, etanas, propanas ir butanas. Šie junginiai (C5–C17) yra skysčiai. Serija tęsiama su junginiais, kurie normaliomis sąlygomis yra kieti.
Kalbant apie chemines savybes, alkanai yra mažai aktyvūs - jie praktiškai nesąveikauja su šarmais ir rūgštimis. Beje, būtent cheminės savybės lemia alkanų panaudojimą.
Tačiau šiems junginiams būdingos tam tikros reakcijos, įskaitant vandenilio atomų pakeitimą, taip pat molekulinio skilimo procesus.
- Būdingiausia reakcija yra halogeninimas, kurio metu vandenilio atomai pakeičiami halogenais. Šių junginių chlorinimo ir brominimo reakcijos turi didelę reikšmę.
- Nitrinimas – tai vandenilio atomo pakeitimas nitro grupe vykstant reakcijai su praskiesta (10 % koncentracija) Normaliomis sąlygomis alkanai nereaguoja su rūgštimis. Norint atlikti tokią reakciją, reikia 140 °C temperatūros.
- Oksidacija – normaliomis sąlygomis alkanams neveikia deguonis. Tačiau užsidegus ore šios medžiagos patenka į galutinius produktus, kurių yra vanduo ir
- Krekingas – ši reakcija vyksta tik esant reikalingiems katalizatoriams. Procesas apima stabilių homologinių ryšių tarp anglies atomų skilimą. Pavyzdžiui, kai butanas krekingo, reakcijos metu gali susidaryti etanas ir etilenas.
- Izomerizacija - dėl tam tikrų katalizatorių veikimo galimas alkano anglies skeleto pertvarkymas.
Alkanų taikymas
Pagrindinis natūralus šių medžiagų šaltinis yra tokie vertingi produktai kaip gamtinės dujos ir nafta. Alkanų panaudojimo sritys šiandien yra labai plačios ir įvairios.
Pavyzdžiui, dujinių medžiagų naudojamas kaip vertingas kuro šaltinis. Pavyzdys yra metanas, iš kurio gaminamos gamtinės dujos, taip pat propano-butano mišinys.
Kitas alkanų šaltinis yra Alyva , kurio svarbą šiuolaikinei žmonijai sunku pervertinti. Naftos produktai apima:
- benzinas – naudojamas kaip kuras;
- žibalo;
- dyzelinis kuras arba lengvasis gazolis;
- sunkioji gazolė, naudojama kaip tepalinė alyva;
- liekanos naudojamos asfaltui gaminti.
Iš naftos produktų taip pat gaminami plastikai, sintetinis pluoštas, guma ir kai kurie plovikliai.
Vazelinas ir vazelinas yra produktai, sudaryti iš alkanų mišinio. Jie naudojami medicinoje ir kosmetologijoje (daugiausia tepalams ir kremams ruošti), taip pat parfumerijoje.
Parafinas yra dar vienas gerai žinomas produktas, kuris yra kietųjų alkanų mišinys. Tai vientisa balta masė, kurios kaitinimo temperatūra yra 50 - 70 laipsnių. Šiuolaikinėje gamyboje parafinas naudojamas žvakėms gaminti. Degtukai impregnuoti ta pačia medžiaga. Medicinoje įvairios terminės procedūros atliekamos naudojant parafiną.
Būtų naudinga pradėti nuo alkanų sąvokos apibrėžimo. Tai yra sotieji arba sotieji. Taip pat galime pasakyti, kad tai yra anglies atomai, kuriuose C atomai sujungiami paprastais ryšiais. Bendroji formulė yra: CnH₂n+ 2.
Yra žinoma, kad H ir C atomų skaičiaus santykis jų molekulėse yra didžiausias, palyginti su kitomis klasėmis. Dėl to, kad visus valentus užima arba C, arba H, alkanų cheminės savybės nėra aiškiai išreikštos, todėl antrasis jų pavadinimas yra frazė sotieji arba sotieji angliavandeniliai.
Taip pat yra senesnis pavadinimas, kuris geriausiai atspindi jų santykinį cheminį inertiškumą – parafinai, o tai reiškia „be giminingumo“.
Taigi, mūsų pokalbio tema šiandien yra: „Alkanai: homologinės serijos, nomenklatūra, struktūra, izomerizmas“. Taip pat bus pateikti duomenys apie jų fizines savybes.
Alkanai: struktūra, nomenklatūra
Juose C atomai yra tokioje būsenoje, kuri vadinama sp3 hibridizacija. Šiuo atžvilgiu alkano molekulė gali būti parodyta kaip tetraedrinių C struktūrų rinkinys, sujungtas ne tik viena su kita, bet ir su H.
Tarp C ir H atomų yra stiprios, labai mažos polinės s-jungtys. Atomai visada sukasi aplink paprastus ryšius, todėl alkano molekulės įgauna įvairias formas, o ryšio ilgis ir kampas tarp jų yra pastovios reikšmės. Formos, kurios virsta viena į kitą dėl molekulės sukimosi aplink σ ryšius, dažniausiai vadinamos konformacijomis.

H atomo abstrahavimo procese iš nagrinėjamos molekulės susidaro 1-valentės rūšys, vadinamos angliavandenilių radikalais. Jie atsiranda ne tik dėl neorganinių junginių, bet ir dėl. Jei iš sočiųjų angliavandenilių molekulės atimsite 2 vandenilio atomus, gausite 2-valenčių radikalus.
Taigi alkanų nomenklatūra gali būti tokia:
- radialinis (senoji versija);
- pakeitimas (tarptautinis, sisteminis). Jį pasiūlė IUPAC.
Radialinės nomenklatūros ypatybės
Pirmuoju atveju alkanų nomenklatūra apibūdinama taip:
- Angliavandenilių svarstymas kaip metano dariniai, kuriuose 1 ar keli H atomai pakeisti radikalais.
- Didelis patogumo laipsnis ne itin sudėtingų jungčių atveju.
Pakaitinės nomenklatūros ypatumai
Pakaitinė alkanų nomenklatūra turi šias savybes:
- Pavadinimo pagrindas yra 1 anglies grandinė, o likę molekuliniai fragmentai laikomi pakaitais.
- Jei yra keli identiški radikalai, skaičius nurodomas prieš jų pavadinimą (griežtai žodžiais), o radikalų skaičiai atskiriami kableliais.
Chemija: alkanų nomenklatūra
Patogumui informacija pateikiama lentelės forma.
Medžiagos pavadinimas | Vardo pagrindas (šaknis) | Molekulinė formulė | Anglies pakaitalo pavadinimas | Anglies pakaitalų formulė |
Aukščiau pateikta alkanų nomenklatūra apima istoriškai susiklosčiusius pavadinimus (pirmieji 4 sočiųjų angliavandenilių serijos nariai).
Neišsiplėtusių alkanų, turinčių 5 ar daugiau C atomų, pavadinimai yra kilę iš graikiškų skaitmenų, kurie atspindi nurodytą C atomų skaičių. Taigi priesaga -an rodo, kad medžiaga yra iš sočiųjų junginių.

Sudarant nesulankstytų alkanų pavadinimus, pagrindinė grandinė yra ta, kurioje yra didžiausias C atomų skaičius. Ji numeruojama taip, kad pakaitų skaičius būtų mažesnis. Dviejų ar daugiau vienodo ilgio grandinių atveju pagrindinė tampa ta, kurioje yra didžiausias pakaitų skaičius.
Alkanų izomerizmas
Pagrindinis jų serijos angliavandenilis yra metanas CH₄. Su kiekvienu paskesniu metano serijos atstovu metileno grupėje - CH₂ pastebimas skirtumas nuo ankstesnio. Šį modelį galima atsekti visoje alkanų serijoje.
Vokiečių mokslininkas Schielis pateikė pasiūlymą šią seriją pavadinti homologine. Išvertus iš graikų kalbos, tai reiškia „panašus, panašus“.
Taigi, homologinė serija yra susijusių organinių junginių, turinčių tą pačią struktūrą ir panašias chemines savybes, rinkinys. Homologai yra tam tikros serijos nariai. Homologinis skirtumas yra metileno grupė, kurioje skiriasi 2 gretimi homologai.
Kaip minėta anksčiau, bet kurio sočiųjų angliavandenilių sudėtis gali būti išreikšta naudojant bendrą formulę CnH₂n + 2. Taigi, kitas homologinės serijos narys po metano yra etanas - C2H₆. Norint paversti jo struktūrą iš metano, 1 H atomą reikia pakeisti CH3 (paveikslas žemiau).

Kiekvieno paskesnio homologo struktūra gali būti išvedama iš ankstesnio vienodai. Dėl to iš etano - C3H8 susidaro propanas.
Kas yra izomerai?
Tai medžiagos, turinčios vienodą kokybinę ir kiekybinę molekulinę sudėtį (identišką molekulinę formulę), bet skirtingą cheminę struktūrą, taip pat turinčias skirtingas chemines savybes.
Aukščiau aptarti angliavandeniliai skiriasi tokiu parametru kaip virimo temperatūra: -0,5° - butanas, -10° - izobutanas. Šis izomerijos tipas vadinamas anglies skeleto izomerija, jis priklauso struktūriniam tipui.
Didėjant anglies atomų skaičiui, struktūrinių izomerų skaičius sparčiai didėja. Taigi, C10H22 atitiks 75 izomerus (neįskaitant erdvinių), o C15H3₂ jau žinomi 4347 izomerai, o C20H42 - 366 319.
Taigi, jau tapo aišku, kas yra alkanai, homologinės serijos, izomerija, nomenklatūra. Dabar verta pereiti prie pavadinimų sudarymo pagal IUPAC taisyklių.

IUPAC nomenklatūra: pavadinimų formavimo taisyklės
Pirma, angliavandenilio struktūroje reikia rasti ilgiausią anglies grandinę, kurioje yra didžiausias pakaitų skaičius. Tada reikia sunumeruoti grandinės C atomus, pradedant nuo galo, kuriam pakaitalas yra arčiausiai.
Antra, bazė yra neišsišakojusio sočiojo angliavandenilio, kuris pagal C atomų skaičių atitinka pagrindinę grandinę, pavadinimas.
Trečia, prieš bazę būtina nurodyti lokantų, šalia kurių yra pakaitai, numerius. Po jų brūkšneliu rašomi pakaitų pavadinimai.
Ketvirta, jei skirtinguose C atomuose yra identiškų pakaitų, lokantai sujungiami, o prieš pavadinimą atsiranda dauginamasis priešdėlis: di - dviem identiškiems pakaitams, trys - trims, tetra - keturi, penta - penkiems. ir tt Skaičiai turi būti atskirti vienas nuo kito kableliu, o nuo žodžių – brūkšneliu.
Jei tame pačiame C atome iš karto yra du pakaitai, lokantas taip pat rašomas du kartus.
Pagal šias taisykles formuojama tarptautinė alkanų nomenklatūra.

Newmano projekcijos
Šis amerikiečių mokslininkas pasiūlė specialias projekcijų formules grafiniam konformacijų demonstravimui – Newmano projekcijas. Jie atitinka A ir B formas ir pateikiami toliau pateiktame paveikslėlyje.

Pirmuoju atveju tai yra A užkimšta konformacija, o antruoju - B slopinama konformacija. A padėtyje H atomai yra mažiausiu atstumu vienas nuo kito. Ši forma atitinka didžiausią energetinę vertę dėl to, kad atstūmimas tarp jų yra didžiausias. Tai energetiškai nepalanki būsena, dėl kurios molekulė linkusi ją palikti ir pereiti į stabilesnę padėtį B. Čia H atomai yra kuo toliau vienas nuo kito. Taigi energijos skirtumas tarp šių padėčių yra 12 kJ/mol, dėl to laisvas sukimasis aplink ašį etano molekulėje, jungiančioje metilo grupes, yra netolygus. Patekusi į energetiškai palankią padėtį, molekulė ten pasilieka, kitaip tariant, „sulėtėja“. Štai kodėl jis vadinamas slopintu. Rezultatas yra toks, kad kambario temperatūroje 10 tūkstančių etano molekulių yra slopintos konformacijos formos. Tik vienas kitokios formos – užtemdytas.
Sočiųjų angliavandenilių gavimas
Iš straipsnio jau tapo žinoma, kad tai alkanai (jų struktūra ir nomenklatūra buvo išsamiai aprašyta anksčiau). Būtų naudinga apsvarstyti būdus, kaip juos gauti. Jie išsiskiria iš natūralių šaltinių, tokių kaip nafta, natūralūs ir anglis. Taip pat naudojami sintetiniai metodai. Pavyzdžiui, H₂ 2H₂:
- Hidrinimo procesas CnH₂n (alkenai) → CnH₂n+2 (alkanai)← CnH₂n-2 (alkinai).
- Iš C ir H monoksido mišinio - sintezės dujos: nCO+(2n+1)H₂→ CnH₂n+2+nH2O.
- Iš karboksirūgščių (jų druskų): elektrolizė prie anodo, prie katodo:
- Kolbės elektrolizė: 2RCOONa+2H₂O→R-R+2CO₂+H2+2NaOH;
- Dumas reakcija (lydinys su šarmu): CH3COONa+NaOH (t)→CH₄+Na2CO3.
- Alyvos krekingas: CnH₂n+2 (450-700°) → CmH₂m+2+ Cn-mH₂(n-m).
- Kuro dujinimas (kietas): C+2H₂→CH4.
- Kompleksinių alkanų (halogeno darinių), turinčių mažiau C atomų, sintezė: 2CH3Cl (chlormetanas) +2Na →CH3- CH3 (etanas) +2NaCl.
- Metanidų (metalų karbidų) skaidymas vandeniu: Al₄C3+12H₂O→4Al(OH3)↓+3CH4.
Sočiųjų angliavandenilių fizinės savybės
Patogumui duomenys sugrupuojami į lentelę.
Formulė | Alkanas | Lydymosi temperatūra °C | Virimo temperatūra °C | Tankis, g/ml |
0,415 esant t = -165°С |
||||
0,561 esant t= -100°C |
||||
0,583, kai t = -45°C |
||||
0,579, kai t = 0 °C |
||||
2-metilpropanas | 0,557, kai t = -25°C |
|||
2,2-dimetilpropanas | ||||
2-metilbutanas | ||||
2-metilpentanas | ||||
2,2,3,3-tetrametilbutanas | ||||
2,2,4-trimetilpentanas | ||||
n-C10H22 | ||||
n-C11H24 | n-Undecane | |||
n-C12H26 | n-dodekanas | |||
n-C13H28 | n-Tridekanas | |||
n-C14H30 | n-tetradekanas | |||
n-C15H32 | n-pentadekanas | |||
n-C16H34 | n-heksadekanas | |||
n-C20H₄2 | n-eikozanas | |||
n-C3₀H₆2 | n-Triakontanas | 1 mmHg Šv | ||
n-C40H82 | n-tetrakontanas | 3 mmHg Art. | ||
n-C5₀H₂₀₂ | n-pentakontanas | 15 mmHg Art. | ||
n-C6₀H₂22 | n-heksakontanas | |||
n-C7₀H₁42 | n-heptakontanas | |||
n-C100H202 |
Išvada
Straipsnyje buvo nagrinėjama tokia sąvoka kaip alkanai (struktūra, nomenklatūra, izomerija, homologinės serijos ir kt.). Šiek tiek kalbama apie radialinės ir pakaitinės nomenklatūros ypatybes. Aprašomi alkanų gavimo būdai.
Be to, straipsnyje išsamiai išvardijama visa alkanų nomenklatūra (testas gali padėti įsisavinti gautą informaciją).