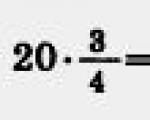Izoterminių procesų lentelė. Idealiųjų dujų dėsniai
Pagrindiniai termodinamikos procesai yra šie:
- izochorinis, teka pastoviu tūriu;
- izobarinis teka esant pastoviam slėgiui;
- izoterminis, vykstantis pastovioje temperatūroje;
- adiabatinis, kurioje nėra šilumos mainų su aplinka;
- politropinis, tenkinantis lygtį pvn= konst.
Izochoriniai, izobariniai, izoterminiai ir adiabatiniai procesai yra ypatingi politropinio proceso atvejai.
Tirdami termodinaminius procesus, nustatykite:
- proceso lygtis p— v Ir T— s koordinates;
- ryšys tarp dujų būsenos parametrų;
- vidinės energijos pasikeitimas;
- išorės darbų kiekis;
- procesui tiekiamas šilumos kiekis arba pašalintas šilumos kiekis.
Izochorinis procesas


Izochorinis procesasp, v— , T, s- Iri, s- koordinatės (schemos)
Izochoriniame procese būklė v= konst.
Iš idealiųjų dujų būsenos lygties ( pv = RT) taip:
p/T = R/V= const,
y., dujų slėgis yra tiesiogiai proporcingas jų absoliučiai temperatūrai:
p2/p1 = T2 / T1.
Izochorinio proceso plėtimosi darbas yra lygus nuliui ( l= 0), nes darbinio skysčio tūris nesikeičia (Δ v= const).
Darbiniam skysčiui tiekiamas šilumos kiekis procese 1-2 at cv
q= cv(T 2 — T 1 ).
T. iki. l= 0, tada remiantis pirmuoju termodinamikos dėsniu Δ u = q, o tai reiškia, kad vidinės energijos pokytį galima nustatyti pagal formulę:
Δ u = c v (T 2 – T 1).
Entropijos pokytis izochoriniame procese nustatomas pagal formulę:
s2–s1= Δ s = cv ln( p2/p1) = cv ln( T2 / T1).
izobarinis procesas



izobarinis procesasp, v— , T, s- Iri, s- koordinatės (schemos)
Izobarinis procesas vyksta esant pastoviam slėgiui. p= konst. Iš idealių dujų būsenos lygties išplaukia:
v/T = R/p= konst
v2/v1 = T 2 / T 1 ,
y., izobariniame procese dujų tūris yra proporcingas jų absoliučiai temperatūrai.
Darbas bus:
l = p(v 2 – v 1 ).
T. iki. pv 1 = RT 1 Ir pv 2 = RT 2 , Tai
l = R(T2-T1).
Šilumos kiekis esant cp= const nustatoma pagal formulę:
q = cp(T2-T1).
Entropijos pokytis bus toks:
s2–s1= Δ s = cp ln( T2 / T1).
Izoterminis procesas



Izoterminis procesasp, v— , T, s- Iri, s- koordinatės (schemos)
Izoterminio proceso metu darbinio skysčio temperatūra išlieka pastovi T= const, taigi:
pv = RT= konst
p2/p1 = v1/v2,
y., slėgis ir tūris yra atvirkščiai proporcingi vienas kitam, todėl izoterminio suspaudimo metu dujų slėgis didėja, o plėtimosi metu mažėja.
Proceso darbas bus lygus:
l = RT ln( v2 – v1) = RT ln( p1 – p2).
Kadangi temperatūra nesikeičia, idealių dujų vidinė energija izoterminiame procese išlieka pastovi (Δ u= 0) ir visa į darbinį skystį tiekiama šiluma visiškai paverčiama plėtimosi darbu:
q = l.
Izoterminio suspaudimo metu iš darbinio skysčio pašalinama šilumos kiekis, lygus suspaudimo darbui.
Entropijos pokytis yra toks:
s2–s1= Δ s = R ln( p1/p2) = R ln( v2/v1).
adiabatinis procesas



adiabatinis procesasp, v— , T, s- Iri, s- koordinatės (schemos)
Adiabatinis procesas – tai dujų būsenos pokytis, vykstantis be šilumos mainų su aplinka. Nuo d q= 0, tada pirmojo termodinamikos dėsnio lygtis adiabatiniam procesui bus tokia:
d u + p d v = 0
Δ u+ l = 0,
vadinasi
Δ u= —l.
Adiabatiniame procese plėtimosi darbas atliekamas tik dėl vidinės dujų energijos sąnaudų, o suspaudimo metu, kuris atsiranda dėl išorinių jėgų veikimo, visas jų atliktas darbas eina vidinei energijai didinti. dujų.
Pažymime šilumos talpą adiabatiniame procese per c pragaras ir sąlyga d q= 0 išreiškiamas taip:
d q = c pragaras d T = 0.
Ši sąlyga sako, kad šiluminė talpa adiabatiniame procese yra lygi nuliui ( c pragaras = 0).
Yra žinoma, kad
Sup/c v= k
ir adiabatinio proceso kreivės lygtis (adiabatinė) in p, v- diagrama atrodo taip:
p.v.k= konst.
Šioje išraiškoje k vadinamas adiabatinis eksponentas(taip pat vadinamas Puasono koeficientu).
Adiabatinio eksponento reikšmėskkai kurioms dujoms:
k oras = 1,4
k perkaitinti garai = 1,3
k ICE išmetimas = 1,33
k prisotintas šlapias garas = 1,135
Iš ankstesnių formulių seka:
l= — Δ u = cv(T 1 – T 2 );
i 1 – i 2 = cp(T 1 – T 2 ).
Techninis adiabatinio proceso darbas ( l tech) yra lygus skirtumui tarp proceso pradžios ir pabaigos entalpijų ( i 1 – i 2 ).
Adiabatinis procesas, vykstantis be vidinės trinties darbiniame skystyje, vadinamas izentropinis. IN T, s diagramoje jis pavaizduotas vertikalia linija.
Paprastai tikri adiabatiniai procesai vyksta esant vidinei darbo skysčio trinčiai, dėl kurios visada išsiskiria šiluma, kuri perduodama pačiam darbiniam skysčiui. Šiuo atveju d s> 0 ir procesas vadinamas tikras adiabatinis procesas.
Politropinis procesas
Procesas vadinamas politropiniu, kuris apibūdinamas lygtimi:
pvn= konst.
Politropinis indeksas n gali gauti bet kokią reikšmę nuo -∞ iki +∞, tačiau šiam procesui tai yra pastovi reikšmė.
Iš politropinio proceso lygties ir Claiperon lygties galima gauti išraišką, kuri nustato ryšį tarp p, v Ir T bet kuriuose dviejuose politropo taškuose:
p2/p1 = (v1/v2)n; T2 / T1 = (v1/v2) n-1; T2 / T1 = (p2/p1) (n-1)/n .
Dujų plėtimosi darbas politropiniame procese yra toks:

Idealių dujų atveju šią formulę galima paversti:

Proceso metu tiekiamos arba pašalinamos šilumos kiekis nustatomas naudojant pirmąjį termodinamikos dėsnį:
q = (u 2 – u 1) + l.
Nes

yra idealių dujų šiluminė talpa politropiniame procese.
At cv, k Ir n= konst c n= const, todėl politropinis procesas kartais apibrėžiamas kaip pastovios šiluminės talpos procesas.
Politropinis procesas turi apibendrinančią reikšmę, nes apima visą pagrindinių termodinaminių procesų visumą.
Grafinis politropo vaizdas in p, v koordinates priklausomai nuo politropo indekso n.

pv 0= const( n= 0) yra izobaras;
pv= const( n= 1) yra izoterma;
p 0 v= const, p 1/∞v= const, pv∞= const - izochoras;
p.v.k= const( n = k) yra adiabatas.
n > 0 – hiperbolinės kreivės,
n < 0 yra parabolės.
Remiantis mano termodinamikos paskaitų konspektų ir vadovėlio „Energijos pagrindai“ medžiaga. Autorius G. F. Bystritsky. 2 leidimas, red. ir papildomas - M.: KNORUS, 2011. - 352 p.
Kas yra izobarinis procesas
Apibrėžimas
Izobarinis (arba izobarinis) procesas yra procesas, vykstantis pastovioje dujų masėje esant pastoviam slėgiui.
Parašykime dviejų idealių dujų būsenų lygtį:
\ \
Lygtį (2) padaliname iš lygties (1), gauname izobarinio proceso lygtį:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \left(4\right).\]
(4) lygtis vadinama Gay-Lussac įstatymu.
Izobarinio proceso vidinė energija ir šilumos kiekis
Šis procesas vyksta įvedant šilumą, jei tūris didėja, arba šalinant šilumą, kad tūris mažėtų. Užrašykime pirmąjį termodinamikos dėsnį, iš eilės gausime izobarinio proceso darbo, vidinės energijos ir šilumos kiekio išraiškas:
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \left(5\right).\] \[\trikampis Q=\int\limits^(T_2)_ (T_1)(dU)+\int\limits^(V_2)_(V_1)(dA)(6)\]
kur $\delta Q\ $ – į sistemą tiekiama elementari šiluma, $dU$ – dujų vidinės energijos pokytis vykstančiame procese, $dA$ – elementarus darbas, kurį atlieka dujos procese, i yra dujų molekulės laisvės laipsnių skaičius, R yra yra universali dujų konstanta, d yra dujų molių skaičius.
Dujų vidinės energijos pokytis:
\[\trikampis U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
(8) lygtis apibrėžia izobarinio proceso darbą. Iš (2) atimame (1) lygtį, gauname dar vieną dujų veikimo lygtį izobariniame procese:
\ \[\trikampis Q=\frac(i)(2)нR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \trikampis T\ ( 10),\]
čia $c_(\mu p)$ yra dujų molinė šiluminė talpa izobariniame procese. (10) lygtis apibrėžia šilumos kiekį, perduodamą dujoms, kurių masė m, izobariniame procese, kai temperatūra padidėja $\trikampiu T.$
Izoprocesai dažnai vaizduojami termodinaminėse diagramose. Taigi, linija, vaizduojanti izobarinį procesą tokioje diagramoje, vadinama izobara (1 pav.).
1 pavyzdys
Užduotis: Nustatykite, kaip slėgiai $p_1$ ir $p_2$ yra susiję V(T) diagramoje 1c paveiksle.
Nubrėžkite izotermą $T_1$

Taškuose A ir B temperatūra yra vienoda, todėl dujos paklūsta Boyle-Mariotte dėsniui:
\ \
Konvertuokime šiuos tūrius į SI: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4(10)^(-3)m^3$
Atlikime skaičiavimus:
Atsakymas: Dujų darbas izobariniame procese yra 600 J.
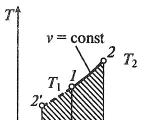
3 pavyzdys
Užduotis: Palyginkite dujų darbą ABC procese ir dujų darbą CDA procese 3 pav.

Kaip sprendimo pagrindą imame formulę, kuri nustato dujų darbą:
Iš geometrinės apibrėžtojo integralo reikšmės žinoma, kad kūrinys yra figūros plotas, kurį riboja integrando funkcija, abscisių ašis ir izochorai taškuose $V_1\ ir\ V_2$ (ašis p(V)). Proceso grafikus verčiame į p(V) ašis.
Apsvarstykite kiekvieną (3) paveiksle parodytų procesų grafikų segmentą.
AB: izochorinis procesas (p=const), $V\uparrow \left(\ Volume\ auga\right),\ T\uparrow $;
VS: Izochorinis procesas (V =const), $T\uparrow $ (iš grafiko), p$\uparrow $, iš izochorinio proceso dėsnio ($\frac(p)(T)=const$);
CD: (p=const), $V\downarrow ,\ T\downarrow ;$
DA: (V =const), $T\downarrow ,\p\downarrow .$
Pavaizduokime procesų grafikus p(V) ašyse (4 pav.):

Dujų darbas $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- stačiakampio ABFE plotas) (3 pav.). Darbas su dujomis $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -stačiakampio plotas\ $EFCD.Akivaizdu, kad $A_(CDA)>A_(ABC).$
, termodinaminis procesas – tai sistemos būsenos pasikeitimas, dėl ko bent vienas iš jo parametrų (temperatūra, tūris ar slėgis) keičia savo reikšmę. Tačiau jei atsižvelgsime į tai, kad visi termodinaminės sistemos parametrai yra neatsiejamai susiję, tai pasikeitus bet kuriam iš jų neišvengiamai pasikeičia bent vienas (idealiu atveju) arba keli (realiai) parametrai. Bendru atveju galime teigti, kad termodinaminis procesas yra susijęs su sistemos pusiausvyros pažeidimu, o jei sistema yra pusiausvyros būsenoje, tai joje negali vykti jokie termodinaminiai procesai.
Sistemos pusiausvyros būsena yra abstrakti sąvoka, nes neįmanoma atskirti nieko materialaus nuo supančio pasaulio, todėl bet kurioje realioje sistemoje neišvengiamai vyksta įvairūs termodinaminiai procesai. Tuo pačiu kai kuriose sistemose gali vykti tokie lėti, beveik nepastebimi pokyčiai, kad su jais susijusius procesus galima sąlygiškai laikyti susidedančiais iš sistemos pusiausvyros būsenų sekos. Tokie procesai vadinami pusiausvyros arba kvazistatinis.
Vadinamas kitas galimas nuoseklių sistemos pakeitimų, po kurių ji grįžta į pradinę būseną, scenarijus žiedinis procesas arba ciklas. Pusiausvyros ir žiedinių procesų sampratos yra daugelio teorinių išvadų ir taikomų termodinamikos metodų pagrindas.
Termodinaminio proceso tyrimas susideda iš šio proceso atlikto darbo, vidinės energijos pokyčio, šilumos kiekio nustatymo, taip pat santykio tarp atskirų dydžių, apibūdinančių dujų būseną, nustatymo.
Iš visų galimų termodinaminių procesų didžiausią susidomėjimą kelia izochoriniai, izobariniai, izoterminiai, adiabatiniai ir politropiniai procesai.
Izochorinis procesas
Izochorinis procesas yra termodinaminis procesas, vykstantis esant pastoviam tūriui. Tokį procesą galima atlikti kaitinant dujas, įdėtas į uždarą indą. Dujos įkaista dėl šilumos tiekimo, didėja jų slėgis.
Dujų parametrų pokytis izochoriniame procese apibūdina Charleso dėsnį: p 1 /T 1 \u003d p 2 /T 2 arba bendruoju atveju:
p/T = pastovus .
Dujų slėgis ant indo sienelių yra tiesiogiai proporcingas absoliučiai dujų temperatūrai.
Kadangi izochoriniame procese tūrio pokytis dV yra lygus nuliui, galime daryti išvadą, kad visa dujoms tiekiama šiluma išleidžiama dujų vidinei energijai keisti. (darbas neatliekamas).
izobarinis procesas
Izobarinis procesas yra termodinaminis procesas, vykstantis esant pastoviam slėgiui. Tokį procesą galima atlikti dedant dujas į tankų cilindrą su judančiu stūmokliu, kurį šalinant ir tiekiant šilumą veikia nuolatinė išorinė jėga.
Keičiantis dujų temperatūrai, stūmoklis juda viena ar kita kryptimi; o dujų tūris keičiasi pagal Gay-Lussac dėsnį:
V/T = pastovus .
Tai reiškia, kad izobariniame procese dujų užimamas tūris yra tiesiogiai proporcingas temperatūrai.
Galima daryti išvadą, kad temperatūros pokytis šiame procese neišvengiamai lems dujų vidinės energijos pasikeitimą, o tūrio pokytis yra susijęs su darbo atlikimu, t.y., izobariniame procese, dalis šiluminės energijos energija eikvojama dujų vidinei energijai keisti, o kita dalis – dujų darbui atlikti, siekiant įveikti išorinių jėgų veikimą. Šiuo atveju šilumos sąnaudų santykis vidaus energijai didinti ir darbams atlikti priklauso nuo dujų šiluminės talpos.
Izoterminis procesas
Izoterminis procesas yra termodinaminis procesas, vykstantis esant pastoviai temperatūrai.
Praktiškai labai sunku atlikti izoterminį procesą su dujomis. Galų gale, būtina laikytis sąlygos, kad suspaudimo ar plėtimosi procese dujos turi laiko keistis temperatūra su aplinka, išlaikydamos savo temperatūrą pastovią.
Izoterminį procesą apibūdina Boyle-Mariotte dėsnis: pV \u003d const, t.y. esant pastoviai temperatūrai, dujų slėgis yra atvirkščiai proporcingas jų tūriui.
Akivaizdu, kad izoterminiame procese dujų vidinė energija nekinta, nes jų temperatūra yra pastovi.
Norint įvykdyti dujų temperatūros pastovumo sąlygą, būtina iš jų pašalinti šilumą, lygiavertį suspaudimo darbui:
dq = dA = pdv .
Naudodami dujų būsenos lygtį, atlikę daugybę transformacijų ir pakeitimų, galime daryti išvadą, kad dujų darbą izoterminiame procese lemia išraiška:
A = RT ln(p 1 /p 2).
adiabatinis procesas
Adiabatinis procesas yra termodinaminis procesas, vykstantis be šilumos mainų tarp darbinio skysčio ir aplinkos. Kaip ir izoterminį procesą, labai sunku praktiškai įgyvendinti adiabatinį procesą. Toks procesas gali vykti, kai darbinė terpė dedama į indą, pavyzdžiui, cilindrą su stūmokliu, apsuptą aukštos kokybės šilumą izoliuojančia medžiaga.
Bet kad ir kokį kokybišką šilumos izoliatorių šiuo atveju naudotume, dalis, net ir nereikšminga, šilumos kiekis neišvengiamai pasikeis tarp darbinio skysčio ir aplinkos.
Todėl praktiškai galima sukurti tik apytikslį adiabatinio proceso modelį. Nepaisant to, daugelis termodinaminių procesų, atliekamų šilumos inžinerijoje, vyksta taip greitai, kad darbinis skystis ir terpė nespėja keistis šiluma, todėl su tam tikra paklaida tokie procesai gali būti laikomi adiabatiniais.
Išvesti lygtį, susijusią su slėgiu ir tūriu 1 kg dujos adiabatiniame procese, parašome pirmojo termodinamikos dėsnio lygtį:
dq = du + pdv .
Kadangi adiabatiniam procesui šilumos perdavimas dq lygus nuliui, o vidinės energijos pokytis priklauso nuo temperatūros šilumos laidumo: du = c v dT , tai galime parašyti:
c v dT + pdv = 0 (3) .
Diferencijuodami Clapeyron lygtį pv = RT , gauname:
pdv + vdp = RdT .
Iš čia išreikškime dT ir pakeiskime jį (3) lygtimi. Po pertvarkymo ir transformacijų gauname:
pdvc v /(R + 1) + c v vdp/R = 0.
Atsižvelgiant į Mayer lygtį R = c p – c v, paskutinę išraišką galima perrašyti taip:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
Gautą išraišką padalijus iš c v ir santykį c p/c v pažymėjus raide k , integravus lygtį (4) gauname (at k = const):
ln vk + ln p = const arba ln pvk = const arba pvk = const .
Gauta lygtis yra adiabatinio proceso lygtis, kurioje k yra adiabatinis eksponentas.
Jei darysime prielaidą, kad tūrinė šiluminė talpa c v yra pastovi reikšmė, ty c v \u003d const, tada adiabatinio proceso darbą galima pavaizduoti kaip formulę (duota be išvesties):
l \u003d c v (T 1 - T 2) arba l \u003d (p 1 prieš 1 – p 2 prieš 2) / (k-1).
Politropinis procesas
Skirtingai nuo aukščiau aptartų termodinaminių procesų, kai kuris nors iš dujų parametrų išliko nepakitęs, politropiniam procesui būdinga galimybė keisti bet kurį iš pagrindinių dujų parametrų. Visi minėti termodinaminiai procesai yra ypatingi politropinių procesų atvejai.
Bendroji politropinio proceso lygtis turi formą pv n = const , kur n yra politropinis indeksas - pastovi šio proceso reikšmė, kurios reikšmės gali būti nuo - ∞ iki + ∞ .
Akivaizdu, kad politropiniam indeksui suteikus tam tikras reikšmes, galima gauti vienokį ar kitokį termodinaminį procesą – izochorinį, izobarinį, izoterminį ar adiabatinį.
Taigi, jei imame n = 0 , gauname p = const - izobarinį procesą, jei n = 1 , gauname izoterminį procesą, aprašytą priklausomybe pv = const ; n = k procesas yra adiabatinis, o n lygus - ∞ arba + ∞ . gauname izochorinį procesą.
USE kodifikatoriaus temos: izoprocesai - izoterminiai, izochoriniai, izobariniai procesai.
Šiame lapelyje laikysimės šios prielaidos: dujų masė ir cheminė sudėtis nesikeičia. Kitaip tariant, mes tikime, kad:
Tai yra, nėra dujų nuotėkio iš indo arba, atvirkščiai, dujų įtekėjimo į indą nėra;
Tai yra, dujų dalelės nepatiria jokių pokyčių (tarkim, nėra disociacijos – molekulių skilimo į atomus).
Šios dvi sąlygos tenkinamos labai daug fiziškai įdomių situacijų (pavyzdžiui, paprastų šiluminių variklių modeliuose) ir todėl nusipelno atskiro svarstymo.
Jei dujų masė ir jų molinė masė yra fiksuotos, tai dujų būsena nustatoma pagal trys Makroskopiniai parametrai: slėgis, tūris Ir temperatūros. Šie parametrai yra susieti vienas su kitu būsenos lygtimi (Mendelejevo-Clapeyrono lygtis).
Termodinaminis procesas(arba tiesiog procesas) yra dujų būsenos pokytis laikui bėgant. Termodinaminio proceso metu keičiasi makroskopinių parametrų reikšmės – slėgis, tūris ir temperatūra.
Ypatingą susidomėjimą kelia izoprocesai- termodinaminiai procesai, kurių metu vieno iš makroskopinių parametrų reikšmė išlieka nepakitusi. Paeiliui nustatę kiekvieną iš trijų parametrų, gauname trijų tipų izoprocesus.
1. Izoterminis procesas eina esant pastoviai dujų temperatūrai: .
2. izobarinis procesas veikia esant pastoviam dujų slėgiui: .
3. Izochorinis procesas eina esant pastoviam dujų tūriui: .
Izoprocesus apibūdina labai paprasti Boilio dėsniai – Mariotte, Gay-Lussac ir Charles. Pereikime prie jų tyrimo.
Izoterminis procesas
Tegul idealios dujos atlieka izoterminį procesą esant temperatūrai. Proceso metu kinta tik dujų slėgis ir jų tūris.
Apsvarstykite dvi savavališkas dujų būsenas: vienoje iš jų makroskopinių parametrų reikšmės yra , o antroje - . Šios vertės yra susietos su Mendelejevo-Clapeyrono lygtimi:
Kaip minėjome nuo pat pradžių, laikoma, kad masė ir molinė masė yra pastovios.
Todėl parašytų lygčių dešinės dalys yra lygios. Todėl kairiosios pusės taip pat yra lygios:
(1)
Kadangi dvi dujų būsenos buvo pasirinktos savavališkai, galime daryti tokią išvadą izoterminio proceso metu dujų slėgio ir tūrio sandauga išlieka pastovi:
(2)
Šis teiginys vadinamas Boilio dėsnis – Mariotė.
Surašęs Boyle-Mariotte dėsnį formoje
(3)
taip pat galima suformuluoti taip: Izoterminio proceso metu dujų slėgis yra atvirkščiai proporcingas jų tūriui.. Jei, pavyzdžiui, izoterminio dujų plėtimosi metu jų tūris padidėja tris kartus, tai dujų slėgis sumažėja tris kartus.
Kaip paaiškinti atvirkštinį slėgio ir tūrio ryšį fiziniu požiūriu? Esant pastoviai temperatūrai, vidutinė dujų molekulių kinetinė energija išlieka nepakitusi, tai yra, paprasčiausiai tariant, molekulių smūgių į indo sieneles jėga nekinta. Didėjant tūriui, mažėja molekulių koncentracija, atitinkamai mažėja molekulinių smūgių skaičius per laiko vienetą sienos ploto vienetui - mažėja dujų slėgis. Priešingai, mažėjant tūriui, didėja molekulių koncentracija, dažnesnis jų poveikis, didėja dujų slėgis.
Izoterminių procesų grafikai
Paprastai termodinaminių procesų grafikus įprasta vaizduoti šiose koordinačių sistemose:
-diagrama: abscisių ašis, ordinačių ašis;
-diagrama: abscisių ašis, ordinačių ašis.
Izoterminio proceso grafikas vadinamas izoterma.
Izoterma diagramoje yra atvirkščiai proporcinga diagrama.
Toks grafikas yra hiperbolė (prisiminkime algebrą – funkcijų grafiką). Izoterma-hiperbolė parodyta fig. 1 .

Ryžiai. 1. Izoterma diagramoje
Kiekviena izoterma atitinka tam tikrą fiksuotą temperatūros reikšmę. Paaiškėjo, kad kuo aukštesnė temperatūra, tuo aukštesnė yra atitinkama izoterma -diagrama.
Iš tiesų, panagrinėkime du izoterminius procesus, atliekamus tomis pačiomis dujomis (2 pav.). Pirmasis procesas vyksta temperatūroje, antrasis – temperatūroje.

Ryžiai. 2. Kuo aukštesnė temperatūra, tuo didesnė izoterma
Mes nustatome tam tikrą tūrio reikšmę. Pirmoje izotermoje jis atitinka slėgį , antroje - class="tex" alt="p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
Likusiose dviejose koordinačių sistemose izoterma atrodo labai paprasta: tai tiesi linija, statmena ašiai (3 pav.):

Ryžiai. 3. Izotermos ant ir -diagramos
izobarinis procesas
Dar kartą prisiminkite, kad izobarinis procesas yra procesas, vykstantis esant pastoviam slėgiui. Izobarinio proceso metu kinta tik dujų tūris ir jų temperatūra.
Tipiškas izobarinio proceso pavyzdys: dujos yra po masyviu stūmokliu, kuris gali laisvai judėti. Jei stūmoklio masė ir stūmoklio skerspjūvis , tai dujų slėgis yra pastovus ir lygus
kur yra atmosferos slėgis.
Tegul idealios dujos atlieka izobarinį procesą esant slėgiui . Dar kartą apsvarstykite dvi savavališkas dujų būsenas; šį kartą makroskopinių parametrų reikšmės bus lygios ir .
Užrašykime būsenų lygtis:
Padalinę juos vieną iš kito, gauname:
Iš principo to jau galėtų pakakti, bet eisime šiek tiek toliau. Perrašykime gautą ryšį taip, kad vienoje dalyje atsirastų tik pirmosios būsenos parametrai, o kitoje – tik antrosios būsenos parametrai (kitaip tariant, indeksus „suskirstome“ į skirtingas dalis):
(4)
O dabar iš čia – atsižvelgiant į valstybių pasirinkimo savivalę! - mes gauname Gay-Lussac dėsnis:
(5)
Kitaip tariant, Esant pastoviam slėgiui, dujų tūris yra tiesiogiai proporcingas jų temperatūrai.:
(6)
Kodėl tūris didėja didėjant temperatūrai? Kylant temperatūrai, molekulės pradeda stipriau smūgiuoti ir pakelti stūmoklį. Tuo pačiu metu molekulių koncentracija mažėja, smūgiai retėja, todėl galiausiai slėgis išlieka toks pat.
Izobarinio proceso siužetai
Izobarinio proceso grafikas vadinamas izobaras. Diagramoje izobaras yra tiesi linija (4 pav.):

Ryžiai. 4. Isobar ant -diagramos
Taškinė grafiko dalis reiškia, kad esant tikroms dujoms pakankamai žemoje temperatūroje, idealus dujų modelis (o kartu ir Gay-Lussac dėsnis) nustoja veikti. Iš tiesų, mažėjant temperatūrai, dujų dalelės juda vis lėčiau, o tarpmolekulinės sąveikos jėgos daro vis didesnę įtaką jų judėjimui (analogija: lėtą kamuoliuką pagauti lengviau nei greitą). Na, o esant labai žemai temperatūrai, dujos virsta skysčiais.
Dabar išsiaiškinkime, kaip keičiasi izobaro padėtis pasikeitus slėgiui. Paaiškėjo, kad Kuo didesnis slėgis, tuo žemesnis izobaras. -diagrama.
Norėdami tai patikrinti, apsvarstykite du izobarus su slėgiais ir (5 pav.):

Ryžiai. 5. Kuo mažesnis izobaras, tuo didesnis slėgis
Nustatykime tam tikrą temperatūros reikšmę. Mes tai matome. Tačiau esant fiksuotai temperatūrai tūris mažesnis, tuo didesnis slėgis (Boilio dėsnis – Mariotė!).
Taigi class="tex" alt="p_2 > p_1"> .!}
Likusiose dviejose koordinačių sistemose izo juosta yra tiesi linija, statmena ašiai (6 pav.):

Ryžiai. 6. Isobars ant ir -diagramos
Izochorinis procesas
Izochorinis procesas, mes prisimename, yra procesas, vykstantis pastoviu tūriu. Izochoriniame procese keičiasi tik dujų slėgis ir jų temperatūra.
Izochorinį procesą įsivaizduoti labai paprasta: tai procesas, vykstantis standžiame fiksuoto tūrio inde (arba cilindre po stūmokliu, kai stūmoklis fiksuotas).
Tegul idealios dujos atlieka izochorinį procesą tūrio inde. Vėlgi, apsvarstykite dvi savavališkas dujų būsenas su parametrais ir . Mes turime:
Mes padalijame šias lygtis viena į kitą:
Kaip ir išvedant Gay-Lussac dėsnį, indeksus „suskirstome“ į skirtingas dalis:
(7)
Atsižvelgdami į valstybių pasirinkimo savavališkumą, pasiekiame Karolio įstatymas:
(8)
Kitaip tariant, Esant pastoviam dujų tūriui, jų slėgis yra tiesiogiai proporcingas jų temperatūrai.:
(9)
Fiksuoto tūrio dujų slėgio padidėjimas jas kaitinant yra visiškai akivaizdus dalykas fizikiniu požiūriu. Jūs galite lengvai tai paaiškinti patys.
Izochoriniai proceso brėžiniai
Izochorinio proceso grafikas vadinamas izochoras. Diagramoje izochoras yra tiesi linija (7 pav.):

Ryžiai. 7. Isochore ant -diagramos
Taškinio ploto reikšmė ta pati: idealių dujų modelio netinkamumas esant žemai temperatūrai.

Ryžiai. 8. Kuo žemesnis izochoras, tuo didesnis garsumas
Įrodymas yra panašus į ankstesnį. Mes nustatome temperatūrą ir matome. Tačiau esant fiksuotai temperatūrai, slėgis yra mažesnis, tuo didesnis tūris (vėlgi Boyle-Mariotte dėsnis). Taigi class="tex" alt="V_2 > V_1"> .!}
Likusiose dviejose koordinačių sistemose izochoras yra tiesi linija, statmena ašiai (9 pav.):

Ryžiai. 9. Izochorai ant ir -diagramų
Taip pat vadinami Boyle'o dėsniai – Mariotte, Gay-Lussac ir Charles dujų įstatymai.
Dujų dėsnius išvedėme iš Mendelejevo-Klapeirono lygties. Tačiau istoriškai viskas buvo priešingai: dujų įstatymai buvo nustatyti eksperimentiškai ir daug anksčiau. Būsenos lygtis vėliau pasirodė kaip jų apibendrinimas.
izobarinis procesas
Izoprocesų brėžiniai skirtingose koordinačių sistemose
izobarinis procesas(Kita graikų kalba ισος, isos - „tas pats“ + βαρος, baros - „svoris“) - termodinaminės sistemos būsenos keitimo esant pastoviam slėgiui procesas ()
Dujų tūrio priklausomybę nuo temperatūros esant pastoviam slėgiui eksperimentiškai ištyrė Joseph Louis Gay-Lussac 1802 m. Gay-Lussac dėsnis: Esant pastoviam slėgiui ir pastovioms dujų masės bei jų molinės masės vertėms, dujų tūrio ir absoliučios temperatūros santykis išlieka pastovus: V / T = konst.
Izochorinis procesas
Izochorinis procesas(iš graikų choro - užimta vieta) - termodinaminės sistemos būsenos keitimo procesas esant pastoviam tūriui (). Idealioms dujoms izochorinį procesą apibūdina Charleso dėsnis: tam tikrai dujų masei esant pastoviam tūriui slėgis yra tiesiogiai proporcingas temperatūrai:
Linija, vaizduojanti izochorinį procesą diagramoje, vadinama izochoru.
Taip pat verta paminėti, kad dujoms tiekiama energija išleidžiama keičiant vidinę energiją, ty Q = 3* ν*R*T/2=3*V*ΔP, kur R yra universali dujų konstanta, ν – molių skaičius dujose, T – temperatūra kelvinais, V – dujų tūris, ΔP – slėgio pokyčio prieaugis. o linija, vaizduojanti izochorinį procesą diagramoje, P(T) ašyse, turėtų būti pratęsta ir sujungta su punktyrine linija prie pradžios, nes gali kilti nesusipratimų.
Izoterminis procesas
Izoterminis procesas(iš graikų kalbos „termosas“ - šiltas, karštas) - termodinaminės sistemos būsenos keitimo procesas esant pastoviai temperatūrai () (). Izoterminis procesas aprašytas Boyle – Mariotte dėsniu:
Esant pastoviai temperatūrai ir pastovioms dujų masės bei jų molinės masės vertėms, dujų tūrio ir jų slėgio sandauga išlieka pastovi: PV = konst.
Izentropinis procesas
Izentropinis procesas- termodinaminės sistemos būsenos keitimo procesas esant pastoviai entropijai (). Pavyzdžiui, grįžtamasis adiabatinis procesas yra izentropinis: tokiame procese nevyksta šilumos mainai su aplinka. Idealios dujos tokiame procese apibūdinamos tokia lygtimi:
kur yra adiabatinis eksponentas, nustatomas pagal dujų rūšį.
Wikimedia fondas. 2010 m.
Pažiūrėkite, kas yra „izoprocesai“ kituose žodynuose:
Izoprocesai – tai termodinaminiai procesai, kurių metu masė ir dar vienas fizinis būsenos parametrų dydis: slėgis, tūris ar temperatūra išlieka nepakitę. Taigi, izobarinis procesas atitinka pastovų slėgį, izochorinį tūrį... Vikipedija
Molekulinė kinetinė teorija (sutrumpintai MKT) – tai teorija, nagrinėjanti materijos sandarą trijų pagrindinių maždaug teisingų nuostatų požiūriu: visi kūnai susideda iš dalelių, kurių dydžio galima nepaisyti: atomų, molekulių ir jonų; dalelės ... ... Vikipedija
- (sutrumpintai MKT) teorija, nagrinėjanti materijos sandarą trijų pagrindinių maždaug teisingų nuostatų požiūriu: visi kūnai susideda iš dalelių, kurių dydžio galima nepaisyti: atomų, molekulių ir jonų; dalelės yra nuolatinėje ... ... Vikipedijoje
Knygos
- Konstrukcinių medžiagų deformacijos-stiprumo charakteristikų statistinis prognozavimas, G. Pluvinazh, VT Sapunov, Šioje knygoje pateikiamas naujas metodas, siūlantis bendrą metalinių ir polimerinių medžiagų kinetinių procesų charakteristikų prognozavimo metodiką. Metodas… Kategorija: Vadovėliai universitetams Leidėjas: