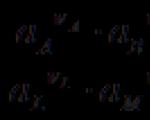ഇലക്ട്രോകെമിസ്ട്രി. ഗാൽവാനിക് സെൽ ഇലക്ട്രോകെമിക്കൽ സെൽ
ഇലക്ട്രോകെമിക്കൽ ഘടകങ്ങൾ. ഇലക്ട്രോമോട്ടീവ് ഫോഴ്സ്. ഒരു ഗാൽവാനിക് സെല്ലിന്റെ തെർമോഡൈനാമിക്സ്. EMF അളവ്.
ഇലക്ട്രിക് ഡബിൾ ലെയർ, സംഭവിക്കുന്നതിന്റെയും ഘടനയുടെയും മെക്കാനിസം.
ഗാൽവാനിക് മൂലകങ്ങൾ. EMF.
ഒരു വൈദ്യുത പ്രവാഹം ഒരു ഇലക്ട്രോലൈറ്റിലൂടെ കടന്നുപോകുമ്പോൾ, ഇലക്ട്രോഡുകളുടെ ഉപരിതലത്തിൽ ഇലക്ട്രോകെമിക്കൽ പ്രതിപ്രവർത്തനങ്ങൾ സംഭവിക്കുന്നു. ഇലക്ട്രോകെമിക്കൽ പ്രതിപ്രവർത്തനങ്ങൾ ഉണ്ടാകുന്നത് ഒരു ബാഹ്യ കറന്റ് സ്രോതസ്സ് വഴി സൃഷ്ടിക്കാൻ കഴിയും. വിപരീത പ്രതിഭാസവും സാധ്യമാണ്: ഒരു ഇലക്ട്രോലൈറ്റിൽ മുഴുകിയിരിക്കുന്ന രണ്ട് ഇലക്ട്രോഡുകളിൽ സംഭവിക്കുന്ന ഇലക്ട്രോകെമിക്കൽ പ്രതിപ്രവർത്തനങ്ങൾ ഒരു വൈദ്യുത പ്രവാഹം സൃഷ്ടിക്കുന്നു, കൂടാതെ പ്രതികരണങ്ങൾ ഒരു ക്ലോസ്ഡ് സർക്യൂട്ടിൽ മാത്രമേ സംഭവിക്കൂ (നിലവിലെ കടന്നുപോകുമ്പോൾ).
ഇലക്ട്രോകെമിക്കൽ (അല്ലെങ്കിൽ ഗാൽവാനിക്) സെൽ ഇലക്ട്രോകെമിക്കൽ പ്രതിപ്രവർത്തനങ്ങളിലൂടെ വൈദ്യുത പ്രവാഹം ഉൽപ്പാദിപ്പിക്കുന്നതിനുള്ള ഒരു ഉപകരണമാണ്. ഏറ്റവും ലളിതമായ ഇലക്ട്രോകെമിക്കൽ മൂലകത്തിൽ രണ്ട് ലോഹ ഇലക്ട്രോഡുകൾ (ആദ്യ തരത്തിലുള്ള കണ്ടക്ടറുകൾ) അടങ്ങിയിരിക്കുന്നു, ഒരു ഇലക്ട്രോലൈറ്റിലേക്ക് (രണ്ടാം തരത്തിലുള്ള കണ്ടക്ടർ) താഴ്ത്തുകയും ഒരു ലോഹ സമ്പർക്കത്തിലൂടെ പരസ്പരം ബന്ധിപ്പിക്കുകയും ചെയ്യുന്നു. നിരവധി ഇലക്ട്രോകെമിക്കൽ ഘടകങ്ങൾ പരമ്പര രൂപത്തിൽ ബന്ധിപ്പിച്ചിരിക്കുന്നു ഇലക്ട്രോകെമിക്കൽ സർക്യൂട്ട് .
ഇലക്ട്രോകെമിക്കൽ മൂലകത്തിന്റെ ഏറ്റവും പ്രധാനപ്പെട്ട അളവ് സ്വഭാവം ഇലക്ട്രോമോട്ടീവ് ഫോഴ്സാണ്(EMF, E), ഇത് പൊട്ടൻഷ്യൽ വ്യത്യാസത്തിന് തുല്യമാണ് ശരിയായി തുറന്ന ഘടകം (ഒരേ മെറ്റീരിയലിൽ നിന്നുള്ള ആദ്യ തരത്തിലുള്ള കണ്ടക്ടറുകൾ മൂലകത്തിന്റെ അന്തിമ ഇലക്ട്രോഡുകളുമായി ബന്ധിപ്പിച്ചിരിക്കുന്ന ഒന്ന്).
ഒരു വൈദ്യുത പ്രവാഹം വ്യത്യസ്ത ദിശകളിൽ കടന്നുപോകുമ്പോൾ, അതേ പ്രതികരണം ഇലക്ട്രോഡിന്റെ ഉപരിതലത്തിൽ സംഭവിക്കുന്നു, എന്നാൽ വിപരീത ദിശകളിൽ, അത്തരം ഇലക്ട്രോഡുകളും അവയിൽ നിർമ്മിച്ച മൂലകവും സർക്യൂട്ടും വിളിക്കപ്പെടുന്നു. തിരിച്ചുള്ള . റിവേഴ്സബിൾ മൂലകങ്ങളുടെ emf അവയുടെ തെർമോഡൈനാമിക് പ്രോപ്പർട്ടി ആണ്, അതായത്. ടി, പി, ഇലക്ട്രോഡുകളും ലായനികളും ഉണ്ടാക്കുന്ന പദാർത്ഥങ്ങളുടെ സ്വഭാവം, ഈ പരിഹാരങ്ങളുടെ സാന്ദ്രത എന്നിവയെ മാത്രം ആശ്രയിച്ചിരിക്കുന്നു. റിവേഴ്സിബിൾ എലമെന്റിന്റെ ഒരു ഉദാഹരണം ഡാനിയൽ-ജേക്കബി ഘടകം :
(-) Cu çZn çZnSO 4 ççCuSO 4 çCu (+)
അതിൽ ഓരോ ഇലക്ട്രോഡും റിവേഴ്സിബിൾ ആണ്. മൂലകം പ്രവർത്തിക്കുമ്പോൾ, ഇനിപ്പറയുന്ന പ്രതികരണങ്ങൾ സംഭവിക്കുന്നു: Zn ® Zn 2+ + 2 ഇ, Cu 2+ + 2 ഇ® Cu. ഒരു ബാഹ്യ സ്രോതസ്സിൽ നിന്ന് അനന്തമായ ശക്തിയുടെ ഒരു വൈദ്യുതധാര കടന്നുപോകുമ്പോൾ, ഇലക്ട്രോഡുകളിൽ വിപരീത പ്രതികരണങ്ങൾ സംഭവിക്കുന്നു.
മാറ്റാനാവാത്ത മൂലകത്തിന്റെ ഒരു ഉദാഹരണം വോൾട്ട ഘടകം :
(-) Zn ç H 2 SO 4 ç Cu (+)
മൂലകം പ്രവർത്തിക്കുമ്പോൾ, ഇനിപ്പറയുന്ന പ്രതികരണങ്ങൾ സംഭവിക്കുന്നു: Zn ® Zn 2+ + 2 ഇ, 2H + + 2 ഇ® H 2 . ഒരു ബാഹ്യ ഉറവിടത്തിൽ നിന്ന് കറന്റ് കടന്നുപോകുമ്പോൾ, ഇലക്ട്രോഡ് പ്രതികരണങ്ങൾ ഇതായിരിക്കും: 2H + + 2 ഇ® H 2 , Cu ® Cu 2+ + 2 ഇ .
ഒരു ഇലക്ട്രോകെമിക്കൽ മൂലകത്തിന്റെ EMF ഒരു പോസിറ്റീവ് മൂല്യമാണ്, കാരണം പോസിറ്റീവ് വർക്ക് ഉണ്ടാക്കുന്ന ഒരു നിശ്ചിത സ്വതസിദ്ധമായ പ്രക്രിയയുമായി ഇത് യോജിക്കുന്നു. സ്വതന്ത്രമായി സംഭവിക്കാൻ കഴിയാത്ത റിവേഴ്സ് പ്രക്രിയ, ഒരു നെഗറ്റീവ് EMF ന് യോജിക്കും. ഇലക്ട്രോകെമിക്കൽ മൂലകങ്ങളുടെ ഒരു ശൃംഖല രചിക്കുമ്പോൾ, ഒരു മൂലകത്തിലെ പ്രക്രിയയെ നയിക്കാൻ കഴിയും, അതുവഴി പുറത്തുനിന്നുള്ള ജോലിയുടെ ചിലവുകൾ (സ്വതസിദ്ധമല്ലാത്ത പ്രക്രിയ), ഇതിനായി മറ്റൊരു ശൃംഖലയുടെ പ്രവർത്തനം ഉപയോഗിക്കുന്നു. ഒരു സ്വാഭാവിക പ്രക്രിയ സംഭവിക്കുന്നത്. ഏതൊരു സർക്യൂട്ടിന്റെയും ആകെ emf പോസിറ്റീവ്, നെഗറ്റീവ് അളവുകളുടെ ബീജഗണിത തുകയ്ക്ക് തുല്യമാണ്. അതിനാൽ, അംഗീകൃത നിയമങ്ങൾ ഉപയോഗിച്ച്, EMF ന്റെ അടയാളങ്ങൾ കണക്കിലെടുക്കാൻ ഒരു സർക്യൂട്ട് ഡയഗ്രം എഴുതുമ്പോൾ അത് വളരെ പ്രധാനമാണ്.
ഇലക്ട്രോകെമിക്കൽ സർക്യൂട്ടിന്റെ emf പോസിറ്റീവ് ആയി കണക്കാക്കപ്പെടുന്നു, സർക്യൂട്ട് എഴുതുമ്പോൾ, വലത് ഇലക്ട്രോഡ് ഇടത്തോട് ആപേക്ഷികമായി പോസിറ്റീവ് ആയി ചാർജ്ജ് ചെയ്യപ്പെടുകയാണെങ്കിൽ (സർക്യൂട്ട് പ്രവർത്തിക്കുമ്പോൾ, ഇടതുവശത്ത് എഴുതിയ ഇലക്ട്രോഡിൽ നിന്നുള്ള ലായനിയിൽ കാറ്റേഷനുകൾ വലതുവശത്ത് എഴുതിയ ഇലക്ട്രോഡിലേക്ക് കടന്നുപോകുകയും ഇലക്ട്രോണുകൾ അകത്തേക്ക് നീങ്ങുകയും ചെയ്യുന്നു. ബാഹ്യ സർക്യൂട്ടിലെ അതേ ദിശയിൽ). ഉദാഹരണം.
ഒരു ഗാൽവാനിക് സെല്ലിന്റെ തെർമോഡൈനാമിക്സ് .
ഒരു ഇലക്ട്രോകെമിക്കൽ സിസ്റ്റത്തിൽ പ്രതിപ്രവർത്തനം വിപരീതമായും ഐസോതെർമലായും തുടരട്ടെ:
n A A + n B B + ... ± nF Û n L L + n M M + ... ±
മൂലകം സൃഷ്ടിക്കുന്ന വൈദ്യുതോർജ്ജം മൊത്തം പ്രക്രിയയുടെ ഉപയോഗപ്രദമായ A¢ ന് തുല്യമാണ്. റിവേഴ്സിബിൾ പ്രോസസിന്റെ ഉപയോഗപ്രദമായ വർക്ക് A¢ പരമാവധി ആണ്, P,T = const എന്നത് സിസ്റ്റത്തിന്റെ ഐസോബാറിക് പൊട്ടൻഷ്യൽ കുറയുന്നതിന് തുല്യമാണ്:
ഡിജി പി, ടി = എൻഎഫ്ഇ പി, ടി
ഇ പി, ടി - സിസ്റ്റത്തിന്റെ റിവേഴ്സബിൾ ഇഎംഎഫ്.
E P,T = -DG P,T / nF , E V,T = -DF V,T / nF
അതിനാൽ, മൂലകത്തിന്റെ ഇഎംഎഫും അതിന്റെ താപനില ഗുണകവും അളക്കുന്നതിലൂടെ, ഗാൽവാനിക് സെല്ലിൽ സംഭവിക്കുന്ന മൊത്തം പ്രക്രിയയ്ക്കായി ഡിജി, ഡിഎസ് എന്നിവയുടെ മൂല്യങ്ങൾ കണ്ടെത്താൻ കഴിയും. ഈ പ്രക്രിയ സ്വയമേവയുള്ളതാണ്, അതിനാൽ ഡി.ജി< 0.
ഗിബ്സ്-ഹെൽംഹോൾട്ട്സ് സമവാക്യം ഉപയോഗിച്ച്, ഈ പ്രക്രിയയുടെ എൻതാൽപ്പിയിലെ മാറ്റം നമുക്ക് കണക്കാക്കാം:
DH = DG - T = -nFE P + TnF
nFE P = -DH + nFT = + nFT
nFE V = -DU + nFT = + nFT
ഒരു ഇലക്ട്രോകെമിക്കൽ സിസ്റ്റത്തിൽ റിവേഴ്സിബിൾ ആയി ജനറേറ്റുചെയ്യുന്നതോ ആഗിരണം ചെയ്യുന്നതോ ആയ വൈദ്യുതോർജ്ജവും അതിൽ സംഭവിക്കുന്ന പ്രതിപ്രവർത്തനത്തിന്റെ താപ ഫലവും തമ്മിലുള്ള ബന്ധവും emf ന്റെ താപനില ഗുണകത്തിന്റെ അടയാളത്തെയും വ്യാപ്തിയെയും ആശ്രയിച്ചിരിക്കുന്നുവെന്ന് സമവാക്യങ്ങളിൽ നിന്ന് ഇത് പിന്തുടരുന്നു. dE/ dT :
1. എങ്കിൽdE / dT > 0 , പിന്നെ nFE > (DG > DH) ഉം സിസ്റ്റവും വൈദ്യുതോർജ്ജമായി പരിവർത്തനം ചെയ്യും, പ്രതികരണത്തിന്റെ താപ പ്രഭാവവുമായി പൊരുത്തപ്പെടുന്ന താപത്തിന്റെ അളവ് മാത്രമല്ല, അധിക താപവും - പെലെറ്റിയറിന്റെ ചൂട് Q P = nFT dE/ dTപരിസ്ഥിതിയിൽ നിന്ന് കടമെടുത്തത്. അഡിയബാറ്റിക് സാഹചര്യങ്ങളിൽ (താപ ഇൻസുലേഷന്റെ സാഹചര്യങ്ങളിൽ, പരിസ്ഥിതിയുമായി കൈമാറ്റം അസാധ്യമാകുമ്പോൾ), സിസ്റ്റത്തിന്റെ ടി കുറയുന്നു. സിസ്റ്റത്തിന്റെ തണുപ്പിക്കൽ പ്രത്യേകിച്ചും ശ്രദ്ധേയമാണ് എങ്കിൽ dE/ dT > 0 < 0 (реакция эндотермична).
2. എങ്കിൽdE / dT < 0 , പിന്നെ nFE< (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. എങ്കിൽdE / dT = 0 , പിന്നെ DG = DH, nFE = - സിസ്റ്റം റിവേഴ്സിബിൾ ആയി ഉൽപ്പാദിപ്പിക്കുന്ന വൈദ്യുതോർജ്ജം രാസപ്രവർത്തനത്തിന്റെ താപ പ്രഭാവത്തിന് തുല്യമാണ്. ഈ ബന്ധം അറിയപ്പെടുന്നത് തോംസന്റെ തത്വം (നിയമം) .
EMF കണക്കാക്കാൻ, സമവാക്യങ്ങൾ ഇങ്ങനെ മാറ്റിയെഴുതാം:
സമവാക്യങ്ങൾ ഉപയോഗിക്കുമ്പോൾ, അവ ഓർമ്മിക്കേണ്ടതാണ് റിവേഴ്സിബിൾ ഇലക്ട്രോകെമിക്കൽ സിസ്റ്റങ്ങൾക്ക് മാത്രമേ സാധുതയുള്ളൂഅതിനാൽ, ടിയിൽ ഇഎംഎഫിന്റെ ആശ്രിതത്വം പഠിക്കുമ്പോൾ, ദ്രാവക അതിരുകളുള്ള ഇലക്ട്രോകെമിക്കൽ സംവിധാനങ്ങളുടെ ഉപയോഗം ഒഴിവാക്കേണ്ടത് ആവശ്യമാണ്, കാരണം അവയിൽ ഉണ്ടാകുന്ന വ്യാപന സാധ്യതകൾ സന്തുലിതമല്ല.
മൂലകത്തിന്റെ ഇഎംഎഫിനെ മൂലകത്തിൽ സംഭവിക്കുന്ന പ്രതിപ്രവർത്തനത്തിന്റെ സന്തുലിത സ്ഥിരാങ്കവുമായി നമുക്ക് ബന്ധപ്പെടുത്താം. രാസപ്രവർത്തന ഐസോതെർം സമവാക്യം:
DG = RT lnകെ എ - ആർ.ടി
ഇ = - = lnകെ എ -
നൽകിയിരിക്കുന്ന P, T എന്ന സമവാക്യത്തിന്റെ വലതുവശത്തുള്ള ആദ്യ പദം ഒരു സ്ഥിരമായ മൂല്യമാണ്; ഇതിനെ Eo കൊണ്ട് സൂചിപ്പിക്കാൻ കഴിയും. ഇ ഒ - ഒരു മൂലകത്തിന്റെ സാധാരണ EMF (ഇലക്ട്രോകെമിക്കൽ സിസ്റ്റം) , അതായത്. EMF എല്ലാം ഒരു ഐ = 0.
E = E o + ln
 = ഇ ഒ + 2.303 lg
= ഇ ഒ + 2.303 lg 
അങ്ങനെ, ഇലക്ട്രോകെമിക്കൽ സംവിധാനത്തിന്റെ EMF എന്നത് ഇലക്ട്രോകെമിക്കൽ പ്രതികരണത്തിൽ പങ്കെടുക്കുന്നവരുടെ പ്രവർത്തനങ്ങളുടെ പ്രവർത്തനമാണ്. മുകളിലുള്ള സമവാക്യങ്ങൾ DG, K എന്നിവയുടെ മൂല്യങ്ങൾ കണക്കാക്കുന്നത് സാധ്യമാക്കുന്നു എ E യുടെ പരീക്ഷണാത്മക മൂല്യങ്ങളെ അടിസ്ഥാനമാക്കി, രാസപ്രവർത്തനത്തിന്റെ തെർമോഡൈനാമിക് സവിശേഷതകൾ അറിഞ്ഞുകൊണ്ട്, E കണക്കാക്കുക.
EMF അളവ് .
ഒരു ഇലക്ട്രോകെമിക്കൽ മൂലകത്തിന്റെ EMF ന്റെ സന്തുലിതാവസ്ഥ (റിവേഴ്സിബിൾ) മൂല്യം അളക്കുന്നതിന്, പ്രക്രിയ അനന്തമായി സാവധാനത്തിൽ സംഭവിക്കേണ്ടത് ആവശ്യമാണ്, അതായത്. അങ്ങനെ മൂലകം അനന്തമായ വൈദ്യുതധാരയിൽ പ്രവർത്തിക്കുന്നു. നഷ്ടപരിഹാര രീതിയിലാണ് ഈ അവസ്ഥ നിറവേറ്റുന്നത്, ഇത് ഒരു ബാഹ്യ പൊട്ടൻഷ്യൽ വ്യത്യാസത്തിനെതിരെ ശ്രേണിയിൽ മൂലകം ബന്ധിപ്പിച്ചിരിക്കുന്നു എന്ന വസ്തുതയെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്, രണ്ടാമത്തേത് തിരഞ്ഞെടുക്കപ്പെട്ടതിനാൽ സർക്യൂട്ടിൽ കറന്റ് ഇല്ല. അപ്പോൾ ബാഹ്യ പൊട്ടൻഷ്യൽ വ്യത്യാസം സർക്യൂട്ടിന്റെ EMF ന് തുല്യമാണ്.
നഷ്ടപരിഹാര രീതി ഉപയോഗിച്ച്, നിങ്ങൾക്ക് ഇഎംഎഫിന്റെ മൂല്യം നേരിട്ട് അളക്കാൻ കഴിയും, പക്ഷേ ഇത് തികച്ചും സങ്കീർണ്ണമായ ഒരു പ്രവർത്തനമാണ്, അതിനാൽ ലബോറട്ടറി പ്രാക്ടീസിൽ അവർ പഠിക്കുന്ന മൂലകത്തിന്റെ ഇഎംഎഫിനെ സ്റ്റാൻഡേർഡ് (സാധാരണ) എന്ന് വിളിക്കപ്പെടുന്ന ഇഎംഎഫുമായി താരതമ്യം ചെയ്യാൻ ഇഷ്ടപ്പെടുന്നു. മൂലകങ്ങൾ, ഇത് വ്യത്യസ്ത ടിയിൽ ശ്രദ്ധാപൂർവ്വം അളക്കുന്നു. ഈ താരതമ്യ രീതിയും നഷ്ടപരിഹാരമാണ്.
അടിസ്ഥാന സാധാരണ ഘടകം ആണ് പൂരിത വെസ്റ്റൺ മൂലകം .
(EMF മെഷർമെന്റ് സർക്യൂട്ട് - സ്വതന്ത്രമായി).
ഇലക്ട്രോഡ് ബൗണ്ടറിയുടെ ഘടന - പരിഹാരം. ഇരട്ട ഇലക്ട്രിക് ലെയർ .
ആദ്യ തരത്തിലുള്ള ഒരു കണ്ടക്ടർ ഒരു ഇലക്ട്രോലൈറ്റുമായി സമ്പർക്കം പുലർത്തുമ്പോൾ, a ഇലക്ട്രിക്കൽ ഇരട്ട പാളി . ഒരു ഉദാഹരണമായി, ഒരു CuSO 4 ലായനിയിൽ മുക്കിയ ഒരു ചെമ്പ് ഇലക്ട്രോഡ് പരിഗണിക്കുക. ഒരു ലോഹത്തിലെ കോപ്പർ അയോണുകളുടെ രാസസാധ്യത സ്ഥിരമായി കണക്കാക്കാം, അതേസമയം ലായനിയിലെ കോപ്പർ അയോണുകളുടെ രാസസാധ്യത ഉപ്പ് സാന്ദ്രതയെ ആശ്രയിച്ചിരിക്കുന്നു; പൊതുവേ, ഈ രാസ സാധ്യതകൾ സമാനമല്ല.
CuSO 4 ന്റെ സാന്ദ്രത അങ്ങനെയായിരിക്കട്ടെ > . തുടർന്ന്, ലോഹം ലായനിയിൽ മുക്കുമ്പോൾ, ലായനിയിൽ നിന്നുള്ള ചില Cu 2+ അയോണുകൾ നിർജ്ജലീകരണം ചെയ്യപ്പെടുകയും ലോഹത്തിലേക്ക് മാറ്റുകയും അതിൽ പോസിറ്റീവ് ചാർജ് സൃഷ്ടിക്കുകയും ചെയ്യുന്നു. ഈ ചാർജ് Cu 2+ അയോണുകൾ ലായനിയിൽ നിന്ന് ലോഹത്തിലേക്ക് കൂടുതൽ കൈമാറ്റം ചെയ്യുന്നത് തടയുകയും ഇലക്ട്രോഡിന് സമീപം SO 4 2- അയോണുകളുടെ ഒരു പാളി രൂപപ്പെടുന്നതിലേക്ക് നയിക്കുകയും ചെയ്യും. വിളിക്കപ്പെടുന്ന ഇലക്ട്രോകെമിക്കൽ സന്തുലിതാവസ്ഥ , ലോഹത്തിലെയും ലായനിയിലെയും അയോണുകളുടെ കെമിക്കൽ പൊട്ടൻഷ്യലുകൾ തത്ഫലമായുണ്ടാകുന്ന ഇരട്ട വൈദ്യുത പാളിയുടെ (DEL) പൊട്ടൻഷ്യൽ വ്യത്യാസത്തിന്റെ വ്യാപ്തിയിൽ വ്യത്യാസപ്പെട്ടിരിക്കും:
വൈദ്യുത പൊട്ടൻഷ്യൽ വ്യത്യാസവും കെമിക്കൽ പൊട്ടൻഷ്യൽ വ്യത്യാസവും ഇലക്ട്രോകെമിക്കൽ സന്തുലിതാവസ്ഥയിൽ നികത്തപ്പെടുന്നു.
CuSO 4 ന്റെ സാന്ദ്രത വളരെ കുറവായിരിക്കട്ടെ< . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
ലോഹത്തിലും ലായനിയിലും ഉള്ള അയോണുകളുടെ കെമിക്കൽ പൊട്ടൻഷ്യലുകൾ തുല്യമായ ഒരു ഇലക്ട്രോലൈറ്റ് കോൺസൺട്രേഷൻ നിങ്ങൾക്ക് തിരഞ്ഞെടുക്കാം. ഈ ഏകാഗ്രതയുടെ പരിഹാരങ്ങളെ വിളിക്കുന്നു പൂജ്യം പരിഹാരങ്ങൾ . ഒരു ലോഹം അതിന്റെ പൂജ്യം ലായനിയിൽ മുക്കുമ്പോൾ, ഇലക്ട്രോഡിന്റെ ഉപരിതലത്തിൽ EDL സംഭവിക്കുന്നില്ല; എന്നിരുന്നാലും, ഈ സാഹചര്യത്തിൽ പോലും, ലോഹവും ലായനിയും തമ്മിലുള്ള പൊട്ടൻഷ്യൽ വ്യത്യാസം പൂജ്യമല്ല.
നേർൺസ്റ്റിന്റെ അഭിപ്രായത്തിൽ, ഇലക്ട്രോകെമിക്കൽ സെല്ലിന്റെ EMF ന്റെ ഏക ഉറവിടം ഇലക്ട്രോഡുകളുടെ ഉപരിതലത്തിലുള്ള EMF ആണ്. പൂജ്യം ലായനിയിലെ ലോഹങ്ങളുടെ സാധ്യതയെ കേവല പൂജ്യം പൊട്ടൻഷ്യൽ എന്ന് നേർൻസ്റ്റ് നിർവചിച്ചു. A.N. ഫ്രംകിന്റെ കൃതികളിൽ, നേൺസ്റ്റിന്റെ ആശയങ്ങൾ തെറ്റാണെന്ന് കാണിക്കുന്നു. അവയുടെ പൂജ്യം ലായനികളിൽ മുഴുകിയിരിക്കുന്ന രണ്ട് വ്യത്യസ്ത ഇലക്ട്രോഡുകൾ അടങ്ങിയ മൂലകത്തിന്റെ EMF പൂജ്യത്തിൽ നിന്ന് വളരെ വ്യത്യാസപ്പെട്ടിരിക്കുന്നു (ഒരുപക്ഷേ 1 V-ൽ കൂടുതൽ). പൂജ്യം ലായനിയിൽ ലോഹത്തിന്റെ സാധ്യത, വിളിക്കുന്നു പൂജ്യം ചാർജ് സാധ്യത , കേവല പൂജ്യം സാധ്യതയായി കണക്കാക്കാനാവില്ല.
ഘനീഭവിച്ച ഹെൽംഹോൾട്ട്സ് ഡബിൾ ലെയറിന്റെ സിദ്ധാന്തം. മെറ്റൽ-സൊല്യൂഷൻ ഇന്റർഫേസിൽ DEL-ന്റെ ഘടനയുടെ ആദ്യത്തെ അളവ് സിദ്ധാന്തം സൃഷ്ടിച്ചത് ഹെൽംഹോൾട്ട്സ് (1853). Helmholtz അനുസരിച്ച്, ഒരു EDL നെ ഒരു ഫ്ലാറ്റ് കപ്പാസിറ്ററിനോട് ഉപമിക്കാം, അതിലൊന്ന് ലോഹത്തിലെ ഉപരിതല ചാർജുകളിലൂടെ കടന്നുപോകുന്ന വിമാനവുമായി പൊരുത്തപ്പെടുന്നു, മറ്റൊന്ന് ലായനിയിലെ അയോണുകളുടെ ചാർജുകളുടെ കേന്ദ്രങ്ങളെ ബന്ധിപ്പിക്കുന്ന തലം, ഇലക്ട്രോസ്റ്റാറ്റിക് ശക്തികളാൽ ലോഹത്തിന്റെ ഉപരിതലത്തിലേക്ക് ആകർഷിക്കപ്പെടുന്നു. ഇരട്ട പാളി കനം എൽഅയോൺ ആരത്തിന് തുല്യമാണ് ആർ. ഇലക്ട്രിക്കൽ ന്യൂട്രാലിറ്റിയുടെ അവസ്ഥ അനുസരിച്ച്, ലോഹത്തിന്റെ ഉപരിതലത്തിലേക്ക് ആകർഷിക്കപ്പെടുന്ന അയോണുകളുടെ എണ്ണം അവയുടെ ചാർജുകൾ ലോഹത്തിന്റെ ഉപരിതല ചാർജുകൾക്ക് നഷ്ടപരിഹാരം നൽകുന്നതായിരിക്കണം, അതായത്.
ഘനീഭവിച്ച ഇരട്ട പാളിയുടെ സിദ്ധാന്തം പരീക്ഷണവുമായി പൊരുത്തപ്പെടുന്ന EDL കപ്പാസിറ്റൻസിന്റെ മൂല്യങ്ങളും EDL ന്റെ ഭൗതികമായി വിശ്വസനീയമായ കനവും നേടുന്നത് സാധ്യമാക്കുന്നു. എന്നിരുന്നാലും, ഇതിന് നിരവധി പരീക്ഷണാത്മക ക്രമങ്ങളെ വ്യാഖ്യാനിക്കാൻ കഴിയില്ല: ഇലക്ട്രോകൈനറ്റിക് പൊട്ടൻഷ്യലിന്റെ (എക്സ്-പൊട്ടൻഷ്യൽ) പരീക്ഷണാത്മകമായി കണ്ടെത്തിയ മൂല്യങ്ങളും ഇലക്ട്രോലൈറ്റ് സാന്ദ്രതയെ ആശ്രയിക്കുന്നതും, ഒരു സർഫാക്റ്റന്റിന്റെ സാന്നിധ്യത്തിൽ ലോഹ പ്രതലത്തിലെ ചാർജിന്റെ അടയാളത്തിലെ മാറ്റം. .
ഡിഫ്യൂസ് ഡബിൾ ലെയർ ജിയുഐയുടെ സിദ്ധാന്തം- ചാപ്മാൻ. ഇലക്ട്രോലൈറ്റിന്റെ സാന്ദ്രതയനുസരിച്ച് DES ന്റെ ഗുണങ്ങൾ മാറുന്നുവെന്നത് ഹെൽംഹോൾട്ട്സിന്റെ സിദ്ധാന്തം കണക്കിലെടുക്കുന്നില്ല, കൂടാതെ T. Gouy (1910), Chapman (1913) എന്നിവർ DES ലെ ചാർജ് സാന്ദ്രതയെ പരിഹാരത്തിന്റെ ഘടനയുമായി ബന്ധപ്പെടുത്താൻ ശ്രമിച്ചു. ലോഹത്തിനും അയോണുകൾക്കുമിടയിൽ ഉണ്ടാകുന്ന ഇലക്ട്രോസ്റ്റാറ്റിക് ശക്തികൾക്ക് പുറമേ, താപ തന്മാത്രാ ചലനത്തിന്റെ ശക്തികളും അയോണുകളെ ബാധിക്കുന്നുവെന്ന് അവർ കണക്കിലെടുത്തിട്ടുണ്ട്. ഈ രണ്ട് ശക്തികളും പ്രയോഗിക്കുമ്പോൾ, ലായനിയിലെ അയോണുകൾ ലോഹ പ്രതലവുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ വ്യാപകമായി വിതരണം ചെയ്യണം - അതിൽ നിന്നുള്ള ദൂരത്തിനനുസരിച്ച് വോള്യൂമെട്രിക് ചാർജ് സാന്ദ്രത കുറയുന്നു.
ഗോയിയും ചാപ്മാനും അയോണുകളെ അവയുടെ സ്വന്തം വോളിയം ഇല്ലാത്തതും എന്നാൽ ചാർജ് ഉള്ളതുമായ മെറ്റീരിയൽ പോയിന്റുകളായി കണക്കാക്കാമെന്നും ഇലക്ട്രോഡ് ചാർജ് ഫീൽഡിലെ അവയുടെ വിതരണം ബോൾട്ട്സ്മാൻ വിതരണത്തെ അനുസരിക്കുന്നുവെന്നും വിശ്വസിച്ചു.
ഇലക്ട്രോകൈനറ്റിക് പ്രതിഭാസങ്ങളുടെ നിയമങ്ങളുമായി ഹെൽംഹോൾട്ട്സ് സിദ്ധാന്തത്തേക്കാൾ നന്നായി യോജിക്കുന്നത് ഗൗയ്-ചാപ്മാൻ സിദ്ധാന്തമാണ്. ഒരു നിശ്ചിത ദൂരത്തിൽ നിന്ന് ആരംഭിക്കുമെന്ന് ഞങ്ങൾ അനുമാനിക്കുകയാണെങ്കിൽ എൽഖര-ദ്രവ ഘട്ടങ്ങളുടെ ആപേക്ഷിക ചലനത്തോടൊപ്പം 1 അയോണുകൾ ഇലക്ട്രോഡ് പ്രതലവുമായി ദൃഢമായി ബന്ധിക്കപ്പെട്ടിട്ടില്ല, അപ്പോൾ ഈ ദൂരവുമായി ബന്ധപ്പെട്ട പൊട്ടൻഷ്യൽ x-പൊട്ടൻഷ്യൽ (x) ആയി കണക്കാക്കാം.< j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
അതിനാൽ, ഗൗയ്-ചാപ്മാൻ സിദ്ധാന്തം ഏറ്റവും നന്നായി ന്യായീകരിക്കപ്പെടുന്നു, അവിടെ ഹെൽംഹോൾട്ട്സ് സിദ്ധാന്തം അപ്രായോഗികമായി മാറുന്നു, കൂടാതെ, ആദ്യത്തേത് തെറ്റായ ഫലങ്ങൾ നൽകുന്ന സന്ദർഭങ്ങളിൽ രണ്ടാമത്തേത് പരീക്ഷണവുമായി മികച്ച സംയോജനം നൽകുന്നു. തൽഫലമായി, DES ന്റെ ഘടന ഹെൽംഹോൾട്ട്സും ഗൗയ്-ചാപ്മാനും നിർദ്ദേശിച്ച മോഡലുകളുടെ ചില സംയോജനവുമായി പൊരുത്തപ്പെടണം. ഈ അനുമാനം സ്റ്റെർൺ (1924) തന്റെ DEL-ന്റെ അഡോർപ്ഷൻ സിദ്ധാന്തത്തിൽ ഉണ്ടാക്കി.
സ്റ്റേൺ അഡോർപ്ഷൻ സിദ്ധാന്തം. അയോണുകളുടെ ഒരു നിശ്ചിത ഭാഗം ലോഹ-ഇലക്ട്രോലൈറ്റ് ഇന്റർഫേസിനടുത്ത് നിലനിർത്തി, ഇലക്ട്രോലൈറ്റ് അയോണുകളുടെ ശരാശരി ആരത്തിന് അനുയോജ്യമായ കട്ടിയുള്ള ഒരു ഹെൽംഹോൾട്ട്സ് അല്ലെങ്കിൽ ഘനീഭവിച്ച ഇരട്ട-പാളി പ്ലേറ്റ് ഉണ്ടാക്കുന്നു. EDL-ൽ ഉൾപ്പെടുത്തിയിരിക്കുന്ന ശേഷിക്കുന്ന അയോണുകൾ ക്രമേണ കുറയുന്ന ചാർജ് സാന്ദ്രതയോടെ വ്യാപകമായി വിതരണം ചെയ്യപ്പെടുന്നു. EDL-ന്റെ വ്യാപിക്കുന്ന ഭാഗത്തിന്, ഗൗയിയെപ്പോലെ സ്റ്റെർൺ അയോണുകളുടെ ആന്തരിക വലുപ്പങ്ങളെ അവഗണിച്ചു. കൂടാതെ, EDL ന്റെ ഇടതൂർന്ന ഭാഗത്ത്, ഇലക്ട്രോസ്റ്റാറ്റിക് ശക്തികൾ മാത്രമല്ല, പ്രത്യേക അഡോർപ്ഷൻ ശക്തികളും കാരണം അയോണുകൾ നിലനിർത്തുമെന്ന് സ്റ്റെർൺ നിർദ്ദേശിച്ചു, അതായത്. കൊളംബ് അല്ലാത്ത ഉത്ഭവ ശക്തികൾ. അതിനാൽ, ഉപരിതല-സജീവ അയോണുകൾ അടങ്ങിയിരിക്കുന്ന പരിഹാരങ്ങളിൽ, EDL ന്റെ ഇടതൂർന്ന ഭാഗത്ത് അവയുടെ എണ്ണം ലോഹത്തിന്റെ പ്രതലത്തിന്റെ ചാർജിനെ ഒരു നിശ്ചിത അളവിൽ കവിയാൻ കഴിയും, അയോണുകളുടെ ഗുണങ്ങളും ലോഹത്തിന്റെ ചാർജും അനുസരിച്ച്. അതിനാൽ, സ്റ്റെർന്റെ അഭിപ്രായത്തിൽ, DES ന്റെ രണ്ട് മോഡലുകൾ വേർതിരിച്ചറിയണം, അവയിലൊന്ന് ഉപരിതല-നിർജ്ജീവ ഇലക്ട്രോലൈറ്റുകളുടെ പരിഹാരങ്ങളുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു, മറ്റൊന്ന് പ്രത്യേകമായി ആഗിരണം ചെയ്യപ്പെടുന്ന അയോണുകൾ അടങ്ങിയ പരിഹാരങ്ങളുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു.
അഡോർപ്ഷൻ സിദ്ധാന്തത്തിൽ സമത്വവും സംരക്ഷിക്കപ്പെടുന്നു:
Q M = q L = q 1 + q 2
ലായനി വശത്തുള്ള q L-ലെ ചാർജ് സാന്ദ്രത രണ്ട് ഭാഗങ്ങൾ ഉൾക്കൊള്ളുന്നു: ഹെൽംഹോൾട്ട്സ് ലെയർ q 1 ലെ ചാർജ് സാന്ദ്രത, ഡിഫ്യൂസ് ലെയർ q 2 ലെ ചാർജ് സാന്ദ്രത.
ലോഹവും അയോണുകളും തമ്മിലുള്ള ശക്തമായ ബന്ധം ഇതിനകം നഷ്ടപ്പെട്ട EDL-ന്റെ വ്യാപിക്കുന്ന ഭാഗത്തെ പൊട്ടൻഷ്യൽ ഡ്രോപ്പ് ആയി x-പൊട്ടൻഷ്യൽ നിർവചിക്കാൻ സ്റ്റേണിന്റെ സിദ്ധാന്തം നമ്മെ അനുവദിക്കുന്നു. ഈ നിർവ്വചനം ഉപയോഗിച്ച്, പരീക്ഷണാത്മകമായി നിരീക്ഷിക്കുന്നത് പോലെ, x-പൊട്ടൻഷ്യൽ നെർസ്റ്റ് പൊട്ടൻഷ്യലുമായി പൊരുത്തപ്പെടരുത്. ഒരു സോളിഡ് ബോഡിയുടെ ഉപരിതലത്തിന്റെ റീചാർജ്ജിംഗ് വിശദീകരിക്കാൻ സ്റ്റേണിന്റെ സിദ്ധാന്തത്തിന് കഴിഞ്ഞു.
അനന്തമായ ഏകാഗ്രതയിൽ, ലായനിയിലെ എല്ലാ ചാർജുകളും വ്യാപകമായി വിതരണം ചെയ്യപ്പെടുന്നു, കൂടാതെ EDL-ന്റെ ഘടന ഗൗയ്-ചാപ്മാൻ സിദ്ധാന്തം വിവരിക്കുന്നു. നേരെമറിച്ച്, കേന്ദ്രീകൃത പരിഹാരങ്ങളിൽ DES ന്റെ ഘടന ഹെൽംഹോൾട്ട്സ് നിർദ്ദേശിച്ച മാതൃകയെ സമീപിക്കുന്നു. ശരാശരി സാന്ദ്രതയുടെ മേഖലയിൽ, x നെ RT/F മായി താരതമ്യപ്പെടുത്താവുന്നതാണ്, ഏകാഗ്രതയെ ആശ്രയിക്കുന്നത് ഏകദേശ സമവാക്യങ്ങളാൽ പ്രകടിപ്പിക്കാം:
പോസിറ്റീവ് മൂല്യങ്ങൾക്ക് x: x = B - lnകൂടെ
x ന്റെ നെഗറ്റീവ് മൂല്യങ്ങൾക്ക്: x = B¢ + lnകൂടെ
സ്റ്റേണിന്റെ സിദ്ധാന്തം DEL-ന്റെ ഗുണപരമായി ശരിയായ ചിത്രം നൽകുന്നു. സ്റ്റെർൺ മോഡൽ ഉപയോഗിച്ച് കപ്പാസിറ്റൻസ് നിർണ്ണയിക്കുന്നത് കപ്പാസിറ്റൻസ് മൂല്യങ്ങളുടെ കാര്യത്തിലും ഇലക്ട്രോഡ് സാധ്യതയെയും പരിഹാര സാന്ദ്രതയെയും ആശ്രയിക്കുന്നതിന്റെ സ്വഭാവത്തിലും അനുഭവവുമായി പൊരുത്തപ്പെടുന്നു. എന്നാൽ സ്റ്റേണിന്റെ സിദ്ധാന്തം പോരായ്മകളിൽ നിന്ന് മുക്തമല്ല. കപ്പാസിറ്റൻസ് കർവുകളുടെ അളവ് വിവരണത്തിന്റെ അസാധ്യത ഇതിൽ ഉൾപ്പെടുന്നു, പ്രത്യേകിച്ചും പൂജ്യം ചാർജ് പൊട്ടൻഷ്യലിൽ നിന്ന് മാറുമ്പോൾ.
ഡെസ് സ്റ്റാൻഡിംഗ് സിദ്ധാന്തത്തിന്റെ കൂടുതൽ വികസനം. പരീക്ഷണാത്മക ഡാറ്റയുമായി (റൈസ്, ഫ്രംകിൻ et al., Bockris, Devanathan, Esin, Muller, Parsons, Ershler, etc.) അളവനുസരിച്ച് പൊരുത്തപ്പെടുന്ന DES-ന്റെ ഒരു സിദ്ധാന്തം വികസിപ്പിക്കാൻ നിരവധി ശ്രമങ്ങൾ നടന്നിട്ടുണ്ട്. ഏറ്റവും വ്യാപകമായി അംഗീകരിക്കപ്പെട്ട മോഡൽ ഗ്രഹാം (1947) ആണ്. ഗ്രഹാമിന്റെ അഭിപ്രായത്തിൽ, ലായനിയിലെ DES കോട്ടിംഗ് രണ്ടല്ല, മൂന്ന് ഭാഗങ്ങളാണ്. ആദ്യത്തേത്, ലോഹത്തിന്റെ ഉപരിതലത്തിൽ നിന്ന് എണ്ണുന്നത്, ആന്തരിക ഹെൽംഹോൾട്ട്സ് തലം എന്ന് വിളിക്കുന്നു; അതിൽ ഉപരിതല-സജീവ അയോണുകൾ മാത്രമേ അടങ്ങിയിട്ടുള്ളൂ (വിമാനത്തിന്റെ ചാർജ് q 1 ആണ്) അല്ലെങ്കിൽ, അവ ലായനിയിൽ ഇല്ലെങ്കിൽ, ലായക തന്മാത്രകൾ (q 1 = 0); പരിഹാരവുമായി ബന്ധപ്പെട്ട അതിന്റെ സാധ്യത y 1 കൊണ്ട് സൂചിപ്പിച്ചിരിക്കുന്നു. അയോണുകൾക്ക് (അവയുടെ ചാർജ് കേന്ദ്രങ്ങൾ) സമീപിക്കാൻ കഴിയുന്ന അകലത്തിൽ ലോഹ പ്രതലത്തിൽ നിന്ന് നീക്കം ചെയ്ത അടുത്തതിനെ ബാഹ്യ ഹെൽംഹോൾട്ട്സ് തലം എന്ന് വിളിക്കുന്നു; അതിന്റെ മൊത്തം ചാർജ് q 2 ആണ്, വിമാനത്തിന്റെ സാധ്യത y 2 ആണ്. പുറത്തെ ഹെൽംഹോൾട്സ് വിമാനത്തിന് പിന്നിൽ y 2 മുതൽ പൂജ്യം വരെ വ്യത്യാസപ്പെടുന്ന ഒരു ഡിഫ്യൂസ് ലെയർ ഉണ്ട്, കൂടാതെ q 2 ന് യോജിക്കുന്ന ചാർജ് സാന്ദ്രതയും ഉണ്ട്.
ലോഹ-ഇലക്ട്രോലൈറ്റ് DES ഘടനയുടെ പ്രധാന സവിശേഷതകളും സവിശേഷതകളും ഗ്രഹാമിന്റെ മാതൃക പ്രതിഫലിപ്പിക്കുന്നു. തന്നിരിക്കുന്ന ഇലക്ട്രോലൈറ്റിന്റെ ഏതെങ്കിലും കോൺസൺട്രേഷനായി ഡിഫറൻഷ്യൽ കപ്പാസിറ്റൻസ് കർവുകൾ കണക്കാക്കാൻ ഇത് നിങ്ങളെ അനുവദിക്കുന്നു, അതിന്റെ പരിഹാരങ്ങളിലൊന്നെങ്കിലും പരീക്ഷണാത്മക വക്രം ഉണ്ടെങ്കിൽ. എന്നിരുന്നാലും, ഈ മോഡൽ പ്രശ്നത്തിന്റെ എല്ലാ വശങ്ങളും ഉൾക്കൊള്ളുന്നില്ല.
ഒരു വൈദ്യുത പ്രവാഹം ഒരു പരിഹാരത്തിലൂടെ കടന്നുപോകുമ്പോൾ, ഇലക്ട്രോഡുകളുടെ ഉപരിതലത്തിൽ വൈദ്യുതധാരകൾ ഒഴുകുന്നു. ഇലക്ട്രോകെമിക്കൽ പ്രതികരണങ്ങൾ, ഇലക്ട്രോഡിലേക്കോ പുറത്തേക്കോ ഇലക്ട്രോണുകളുടെ പ്രവാഹത്തോടൊപ്പമുണ്ട്. വിപരീത പ്രക്രിയകളിൽ, ഒന്നും രണ്ടും തരത്തിലുള്ള കണ്ടക്ടറുകൾ തമ്മിലുള്ള ഇന്റർഫേസുകളിൽ സംഭവിക്കുന്ന ഇലക്ട്രോകെമിക്കൽ പ്രതിപ്രവർത്തനങ്ങൾ ഒരു വൈദ്യുത പ്രവാഹത്തിന്റെ ഉൽപാദനത്തിലേക്ക് നയിക്കുന്നു.
ഇലക്ട്രോകെമിക്കൽ പ്രക്രിയകൾ നിരവധി സവിശേഷതകളിൽ പരമ്പരാഗത രാസപ്രവർത്തനങ്ങളിൽ നിന്ന് വ്യത്യസ്തമാണ്.
പ്രതിപ്രവർത്തന കണങ്ങൾ കൂട്ടിമുട്ടുമ്പോൾ മാത്രമേ ഒരു രാസപ്രവർത്തനം സാധ്യമാകൂ. അവ സമ്പർക്കത്തിൽ വരുമ്പോൾ, ഇലക്ട്രോണുകൾക്ക് ഒരു കണത്തിൽ നിന്ന് മറ്റൊന്നിലേക്ക് കൈമാറ്റം ചെയ്യാൻ സാധിക്കും. അത്തരമൊരു പരിവർത്തനം യഥാർത്ഥത്തിൽ സംഭവിക്കുന്നുണ്ടോ എന്നത് കണങ്ങളുടെ ഊർജ്ജത്തെയും അവയുടെ പരസ്പര ഓറിയന്റേഷനെയും ആശ്രയിച്ചിരിക്കുന്നു. സജീവമാക്കൽ ഊർജ്ജം രാസപ്രവർത്തനത്തിന്റെ സ്വഭാവത്തെ ആശ്രയിച്ചിരിക്കുന്നു, അയോണിക് പ്രതിപ്രവർത്തനങ്ങൾക്ക് ഇത് സാധാരണയായി കുറവാണ്. ഇലക്ട്രോൺ സംക്രമണ പാത വളരെ ചെറുതാണ്, ഇത് രാസപ്രവർത്തനത്തിന്റെ സവിശേഷത കൂടിയാണ്. കണങ്ങളുടെ കൂട്ടിയിടികൾ പ്രതികരണ സ്ഥലത്തിന്റെ ഏത് പോയിന്റിലും വ്യത്യസ്ത പരസ്പര സ്ഥാനങ്ങളിൽ സംഭവിക്കാം, അതിനാൽ ഇലക്ട്രോണിക് സംക്രമണങ്ങൾ ഏകപക്ഷീയമായ ദിശകളിൽ സംഭവിക്കാം, അതായത്. രാസപ്രക്രിയയുടെ സവിശേഷതകൾ കൂട്ടിയിടികളുടെ ക്രമരഹിതതയും ഇലക്ട്രോണിക് സംക്രമണങ്ങളുടെ ദിശാബോധത്തിന്റെ അഭാവവുമാണ്. തൽഫലമായി, രാസപ്രവർത്തനങ്ങളുടെ ഊർജ്ജസ്വലമായ ഇഫക്റ്റുകൾ പ്രാഥമികമായി താപത്തിന്റെ രൂപത്തിൽ പ്രത്യക്ഷപ്പെടുന്നു (വിപുലീകരണത്തിന്റെ ഒരു ചെറിയ ജോലിയും സാധ്യമാണ്).
ഒരു രാസ പരിവർത്തനവുമായി ബന്ധപ്പെട്ട ഊർജ്ജ മാറ്റങ്ങൾ വൈദ്യുതോർജ്ജത്തിന്റെ രൂപത്തിൽ സ്വയം പ്രത്യക്ഷപ്പെടുന്നതിന്, അതായത്. ഇലക്ട്രോകെമിക്കൽ പ്രക്രിയ തുടരുന്നതിന്, പ്രതികരണ വ്യവസ്ഥകൾ മാറ്റേണ്ടത് ആവശ്യമാണ്.
വൈദ്യുതോർജ്ജം എല്ലായ്പ്പോഴും വൈദ്യുത പ്രവാഹത്തിന്റെ പാസുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു, അതായത്. ഒരു നിശ്ചിത ദിശയിൽ ഇലക്ട്രോണുകളുടെ ഒഴുക്ക്. അതിനാൽ, ഇലക്ട്രോണിക് സംക്രമണങ്ങൾ ക്രമരഹിതമല്ല, മറിച്ച് ഒരു ദിശയിൽ സംഭവിക്കുന്ന വിധത്തിലാണ് പ്രതികരണം നടത്തേണ്ടത്, അവയുടെ പാത ആറ്റോമിക വലുപ്പത്തേക്കാൾ വളരെ വലുതായിരിക്കണം. അതിനാൽ, ഇലക്ട്രോകെമിക്കൽ പ്രക്രിയകളിൽ, ഒരു പങ്കാളിയിൽ നിന്ന് മറ്റൊന്നിലേക്ക് ഇലക്ട്രോണുകളുടെ പരിവർത്തനം ഗണ്യമായ അകലത്തിൽ സംഭവിക്കണം, ഇതിന് പ്രതിപ്രവർത്തന പങ്കാളികളുടെ സ്പേഷ്യൽ വേർതിരിവ് ആവശ്യമാണ്. എന്നിരുന്നാലും, സ്പേഷ്യൽ വേർപിരിയൽ മാത്രം പോരാ, കാരണം ഇത് പ്രതികരണം നിർത്താൻ ഇടയാക്കും.
ഇലക്ട്രോകെമിക്കൽ പ്രക്രിയ നടപ്പിലാക്കുന്നതിന്, അധിക വ്യവസ്ഥകൾ ആവശ്യമാണ്: ഇലക്ട്രോണുകൾ ചില കണങ്ങളിൽ നിന്ന് കീറുകയും മറ്റുള്ളവയിലേക്ക് ഒരു പൊതു രീതിയിൽ മാറ്റുകയും വേണം. പ്രതിപ്രവർത്തനത്തിൽ പങ്കെടുക്കുന്നവർ തമ്മിലുള്ള നേരിട്ടുള്ള സമ്പർക്കം ഒരു ലോഹ കണ്ടക്ടർ ഉപയോഗിച്ച് പരസ്പരം ബന്ധിപ്പിച്ചിരിക്കുന്ന രണ്ട് ലോഹങ്ങളുമായുള്ള അവരുടെ സമ്പർക്കം ഉപയോഗിച്ച് മാറ്റിസ്ഥാപിക്കുന്നതിലൂടെ ഇത് നേടാനാകും. ഇലക്ട്രോണുകളുടെ ഒഴുക്ക് തുടർച്ചയായിരിക്കുന്നതിന്, പ്രതിപ്രവർത്തന സ്ഥലത്തിലൂടെ വൈദ്യുത പ്രവാഹം കടന്നുപോകുന്നത് ഉറപ്പാക്കേണ്ടത് ആവശ്യമാണ്, ഇത് സാധാരണയായി ഇലക്ട്രോകെമിക്കൽ പ്രതിപ്രവർത്തനത്തിൽ പങ്കെടുക്കുന്നവർ തന്നെ (അവർ അയോണൈസ്ഡ് അവസ്ഥയിലാണെങ്കിൽ) അല്ലെങ്കിൽ ഉയർന്ന അയോണിക് ചാലകതയുള്ള പ്രത്യേക സംയുക്തങ്ങൾ വഴി.
ഇലക്ട്രോകെമിക്കൽ പ്രതിപ്രവർത്തനങ്ങളിലൂടെ വൈദ്യുതോർജ്ജം ഉൽപ്പാദിപ്പിക്കുന്നതിനുള്ള ഒരു ഉപകരണത്തെ വിളിക്കുന്നു ഇലക്ട്രോകെമിക്കൽ(അഥവാ ഗാൽവാനിക്)ഘടകം. ഏറ്റവും ലളിതമായ ഇലക്ട്രോകെമിക്കൽ മൂലകത്തിൽ രണ്ട് ലോഹ ഇലക്ട്രോഡുകൾ (ആദ്യ തരത്തിലുള്ള കണ്ടക്ടറുകൾ) ഒരു ഇലക്ട്രോലൈറ്റ് ലായനിയിൽ (രണ്ടാം തരത്തിലുള്ള കണ്ടക്ടർ) മുഴുകിയിരിക്കുന്നു.
ഒരു വൈദ്യുത പ്രവാഹം വ്യത്യസ്ത ദിശകളിലേക്ക് കടന്നുപോകുമ്പോൾ, അതേ പ്രതികരണം ഇലക്ട്രോഡിന്റെ ഉപരിതലത്തിൽ സംഭവിക്കുന്നു, എന്നാൽ വിപരീത ദിശകളിൽ, അത്തരം ഇലക്ട്രോഡുകളും അവയിൽ അടങ്ങിയിരിക്കുന്ന ഇലക്ട്രോകെമിക്കൽ ഘടകങ്ങളും വിളിക്കപ്പെടുന്നു. തിരിച്ചുള്ള. റിവേഴ്സിബിൾ മൂലകത്തിന്റെ ഒരു ഉദാഹരണം ഡാനിയൽ-ജക്കോബി മൂലകമാണ്
(–) Zn | ZnSO 4, പരിഹാരം || CuSO 4, പരിഹാരം | Cu(+)
അത്തരമൊരു ഘടകം പ്രവർത്തിക്കുമ്പോൾ, ഇലക്ട്രോഡുകളിൽ ഇലക്ട്രോകെമിക്കൽ പ്രതിപ്രവർത്തനങ്ങൾ സംഭവിക്കുന്നു:
Zn Zn 2 + + 2e
Cu 2 + + 2eCu
ഒരു മൂലകത്തിലെ മൊത്തത്തിലുള്ള പ്രതികരണ സമവാക്യം ഇങ്ങനെ പ്രതിനിധീകരിക്കാം
Zn + Cu 2 + Zn 2 + + Cu
ഒരു ബാഹ്യ സ്രോതസ്സിൽ നിന്നുള്ള ഒരു അനന്തമായ വൈദ്യുതധാര മൂലകത്തിലൂടെ കടന്നുപോകുമ്പോൾ, ഈ പ്രതിപ്രവർത്തനങ്ങൾ വിപരീത ദിശയിലേക്ക് നീങ്ങുന്നു.
ഉദാഹരണം മാറ്റാനാവാത്തമൂലകം വോൾട്ട മൂലകമാണ്
(–) Zn | H2SO4 | Cu(+)
അത്തരമൊരു ഘടകം പ്രവർത്തിക്കുമ്പോൾ, ഇലക്ട്രോഡുകളിൽ ഇനിപ്പറയുന്ന പ്രതികരണങ്ങൾ സംഭവിക്കുന്നു:
Zn Zn 2 + + 2e
2H + + 2eH 2,
മൂലകത്തിലെ പ്രതികരണത്തെ സമവാക്യം പ്രതിനിധീകരിക്കുന്നു
Zn + 2H + Zn 2+ + H 2
ഒരു ബാഹ്യ സ്രോതസ്സിൽ നിന്ന് കറന്റ് കടന്നുപോകുമ്പോൾ, ഇലക്ട്രോഡുകളിൽ മറ്റ് പ്രതികരണങ്ങൾ സംഭവിക്കുന്നു:
Cu Cu 2 + + 2e,
ആ. ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിൽ, ഹൈഡ്രജന്റെ പ്രകാശനത്തോടെ ചെമ്പ് സൾഫ്യൂറിക് ആസിഡിൽ ലയിക്കുന്നു:
Cu + 2H + Cu 2 + + H 2
ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിന്റെ ഏറ്റവും പ്രധാനപ്പെട്ട സ്വഭാവം അതിന്റെതാണ് ഇലക്ട്രോമോട്ടീവ് ഫോഴ്സ്(EMF) ഇ- ശരിയായി തുറന്ന മൂലകത്തിന്റെ സാധ്യതയുള്ള വ്യത്യാസം, അതായത്. ഗാൽവാനിക് സെല്ലിന്റെ ഇലക്ട്രോഡുകളുമായി ബന്ധിപ്പിച്ചിരിക്കുന്ന അതേ മെറ്റീരിയലിന്റെ ആദ്യ തരം കണ്ടക്ടറുകളുടെ അറ്റങ്ങൾ തമ്മിലുള്ള സാധ്യതയുള്ള വ്യത്യാസം. മറ്റൊരു വിധത്തിൽ പറഞ്ഞാൽ, സർക്യൂട്ടിൽ വൈദ്യുത പ്രവാഹം ഉണ്ടാകാത്തപ്പോൾ സന്തുലിതാവസ്ഥയിൽ സാധ്യമായ വ്യത്യാസമാണ് EMF. നിങ്ങൾ ഇലക്ട്രോഡുകൾ അടയ്ക്കുകയാണെങ്കിൽ, ഒരു വൈദ്യുത പ്രവാഹം സർക്യൂട്ടിൽ ഒഴുകും, സാധ്യതയുള്ള വ്യത്യാസം പ്രതിനിധീകരിക്കുന്നു വോൾട്ടേജ്മൂലകത്തിന്റെ ആന്തരിക പ്രതിരോധത്തിലുടനീളമുള്ള വോൾട്ടേജ് ഡ്രോപ്പിന്റെ അളവനുസരിച്ച് EMF ൽ നിന്ന് വ്യത്യസ്തമായ ഒരു ഇലക്ട്രോകെമിക്കൽ ഘടകം.
ഇലക്ട്രോകെമിക്കൽ മൂലകങ്ങളുടെ ഉദ്ദേശ്യം ഉപയോഗപ്രദമായ മൂലകം ഉൾപ്പെടുന്ന ബാഹ്യ സർക്യൂട്ടിലെ ഇലക്ട്രോണുകളുടെ ചലനത്തെ പ്രോത്സാഹിപ്പിക്കുക എന്നതാണ്.
ലോഡ്. അങ്ങനെ, അതിന്റെ ചുമതല നിർവഹിക്കുന്നതിന്, ഒരു ഇന്ധന സെല്ലിൽ ഇലക്ട്രോണുകളുടെ ഉറവിടവും സിങ്കും അടങ്ങിയിരിക്കണം (ചിത്രം 7.1).
ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിൽ സംഭവിക്കുന്ന പ്രതിപ്രവർത്തനങ്ങളെ റിഡക്ഷൻ-റിയാക്ഷൻ എന്ന് വിളിക്കുന്നു, കാരണം “ഓക്സിഡേഷൻ” എന്ന പദം ഇലക്ട്രോണുകൾ പുറത്തുവിടുന്ന പ്രക്രിയയുമായി യോജിക്കുന്നു, കൂടാതെ “റിഡക്ഷൻ” എന്ന പദം ഇലക്ട്രോണുകൾ റിലീസ് ചെയ്യുന്ന പ്രക്രിയയുമായി യോജിക്കുന്നു.
കാലഹരണപ്പെട്ട നിരവധി ശാസ്ത്ര സങ്കൽപ്പങ്ങളുടെ അർത്ഥം അവയുടെ പേരുകളിൽ നിന്ന് പലപ്പോഴും വ്യക്തമല്ല "ഓക്സിഡേഷൻ", "റിഡക്ഷൻ" എന്നീ പദങ്ങൾക്ക് വിശദീകരണം ആവശ്യമാണ്. തെക്കുകിഴക്കൻ ഭാഗത്ത്, ഓക്സിജൻ (ഓക്സിജൻ) ലാറ്റിൻ റൂട്ട് ഓക്സസിൽ നിന്നാണ് വരുന്നത് (പുളിച്ചതോ ചൂടുള്ളതോ, മൂർച്ചയുള്ളതോ) "ആസിഡ് ഉത്പാദകം" എന്നാണ് അർത്ഥമാക്കുന്നത്. 1787-ൽ പ്രസിദ്ധീകരിച്ച മോർവോയുടെയും ലാവോസിയറിന്റെയും "നാമകരണം ചിമിക്" എന്ന കൃതിയിലാണ് ഈ പേര് ആദ്യമായി ഉപയോഗിച്ചത്. അക്കാലത്ത്, രസതന്ത്രജ്ഞർ തെറ്റായ ഒരു വിശ്വാസത്തിൽ ഉറച്ചുനിന്നു. ആസിഡുകളിൽ ഉൾപ്പെടുന്ന പ്രധാന മൂലകമാണ് ഓക്സിജൻ; ഒരു ആസിഡ് വെള്ളത്തിൽ ലയിക്കുമ്പോൾ, അതിന്റെ ഘടനയിൽ ഉൾപ്പെടുത്തിയിരിക്കുന്ന ഹൈഡ്രജൻ ആറ്റങ്ങളുടെ ഒരു ഭാഗം അതിന്റെ ഇലക്ട്രോണിനെ നഷ്ടപ്പെടുത്തുന്നു - വെള്ളം അസിഡിക് ആകുകയും ഹൈഡ്രജൻ ഓക്സിഡൈസ് ചെയ്യുകയും ചെയ്യുന്നു. വിശകലനപരമായി, ഇലക്ട്രോൺ നഷ്ടപ്പെടുന്ന പ്രക്രിയയുമായി ബന്ധപ്പെട്ട ഏത് പ്രതിപ്രവർത്തനത്തെയും ഓക്സിഡേഷൻ എന്ന് വിളിക്കുന്നു. വിപരീത പ്രതിപ്രവർത്തനം - ഇലക്ട്രോൺ ക്യാപ്ചർ പ്രതികരണം - ■ബികമിംഗ് എന്ന് വിളിക്കുന്നു.
ഒഴുക്ക്
ജെ ഇലക്ട്രോണുകൾ
ഇലക്ട്രോൺ ഉറവിടം >
(ഓക്സിഡേഷൻ)
പോസിറ്റീവ്< -
വൈദ്യുത പ്രവാഹത്തിന്റെ ദിശ ചിത്രം. 7.1 ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിൽ ഇലക്ട്രോണുകളുടെ ഉറവിടവും സിങ്കും ഉണ്ടായിരിക്കണം
ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിൽ, മൊത്തത്തിലുള്ള പ്രതികരണം ഉപകരണത്തിന്റെ പ്രത്യേക മേഖലകളിൽ സംഭവിക്കുന്ന രണ്ട് ഇന്റർമീഡിയറ്റ് പ്രതിപ്രവർത്തനങ്ങളായി തിരിച്ചിരിക്കുന്നു. ഈ പ്രദേശങ്ങൾ അയോണുകളുടെ കണ്ടക്ടറായ ഇലക്ട്രോലൈറ്റ് ഉപയോഗിച്ച് സംയോജിപ്പിച്ചിരിക്കുന്നു, പക്ഷേ ഇന്റർമീഡിയറ്റ് ഓക്സിഡേഷൻ പ്രതികരണത്തിൽ പുറത്തുവിടുന്ന ഇലക്ട്രോണുകൾ നടത്തുന്നു, ഇലക്ട്രോണുകൾക്ക് റിഡക്ഷൻ പ്രതികരണം സംഭവിക്കുന്ന സ്ഥലത്ത് പ്രവേശിക്കാൻ കഴിയും, പക്ഷേ ഒരു ബാഹ്യ സർക്യൂട്ട് വഴി. അങ്ങനെ, ബാഹ്യ സർക്യൂട്ടിൽ ഒരു വൈദ്യുത പ്രവാഹം ഉണ്ടാകുന്നു, ഇലക്ട്രോകെമിക്കൽ സെൽ അതിന്റെ ഉറവിടമാണ് - ഇതാണ് അതിന്റെ ഉദ്ദേശ്യം. ബാഹ്യ സർക്യൂട്ടിലെ വൈദ്യുത a യുടെ പോസിറ്റീവ് ദിശ മൂലകത്തിന്റെ ഓക്സിഡേഷൻ കുറയ്ക്കുന്ന മേഖലയിൽ നിന്നുള്ള ദിശയാണെന്ന് സമ്മതിച്ചു - വൈദ്യുത പ്രവാഹം റിഡക്ഷൻ മേഖലയുടെ മൂലകത്തെ ഉപേക്ഷിക്കുന്നു, അത് ഇന്ധനത്തിന്റെ കാഥോഡാണ് - ഒ മൂലകം, കൂടാതെ ആനോഡായ ഓക്സിഡേഷൻ മേഖലയിൽ പ്രവേശിക്കുന്നു. മറ്റേതൊരു വൈദ്യുത സ്രോതസ്സിലേയും പോലെ, കാഥോഡ് പോസിറ്റീവ് ചാർജാണ്
സജീവ ഇലക്ട്രോഡ്, കൂടാതെ ആനോഡ് ഒരു നെഗറ്റീവ് ചാർജ്ഡ് ഇലക്ട്രോഡ് ആണ്. വൈദ്യുതോർജ്ജത്തിന്റെ (ലോഡ്) ഉപഭോക്താക്കളുടെ കാര്യം വരുമ്പോൾ, പേരുകൾ വിപരീതമായി മാറുന്നു. സിയുടെ ആമുഖത്തിൽ. 6 "ആനോഡ്", "കാഥോഡ്" എന്നീ പദങ്ങൾ കൂടുതൽ വിശദമായി ചർച്ചചെയ്യുന്നു.
ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിന്റെ ഉദാഹരണമായി, ഒരു ഇലക്ട്രോലൈറ്റിന്റെ പങ്ക് വഹിക്കുന്ന ഒരു മെംബ്രൺ പരിഗണിക്കുക. മെംബ്രണുകളുടെ ഒരു വശത്തെ ഉപരിതലം ഹൈഡ്രജനുമായി സമ്പർക്കം പുലർത്തട്ടെ. സാധാരണ അവസ്ഥയിൽ വാതകത്തിൽ പ്രധാനമായും മോളിക്യുലാർ ഹൈഡ്രജൻ അടങ്ങിയിരിക്കും, എന്നാൽ ഒരു ചെറിയ എണ്ണം തന്മാത്രകൾ ആറ്റങ്ങളായി വിഘടിച്ചേക്കാം.
ചില ആറ്റങ്ങൾ ഓക്സിഡൈസ് ചെയ്യും (അയണീകരിക്കപ്പെടും), അതായത് ഇലക്ട്രോൺ നഷ്ടപ്പെടും
N -> Nt + e~ .
മെംബ്രൺ ഇലക്ട്രോണുകൾക്ക് അപ്രസക്തമായതിനാൽ, അവയെല്ലാം അതിന്റെ ഒരു വശത്ത് നിലനിൽക്കും, അതേസമയം അയോണുകൾ വ്യത്യാസത്തിലൂടെ രൂപം കൊള്ളുന്നു; മെംബ്രണിലൂടെ അവർ മറുവശത്ത് സ്വയം കണ്ടെത്തും. ഈ സാഹചര്യത്തിൽ, അയോണുകൾ പോസിറ്റീവ് ചാർജ് വഹിക്കുന്നു, അതിനാൽ ഹൈഡ്രജൻ സ്ഥിതിചെയ്യുന്ന മെംബ്രണിന്റെ ഉപരിതലത്തിൽ അധികമായി അടിഞ്ഞുകൂടിയ ഇലക്ട്രോണുകൾ കാരണം നെഗറ്റീവ് ചാർജ്ജ് ആകും, കൂടാതെ പോസിറ്റീവ് കാരണം വിപരീത ഉപരിതലം പോസിറ്റീവ് ചാർജ്ജ് ആകും. വ്യാപനം കാരണം അതിൽ പ്രത്യക്ഷപ്പെട്ട അയോണുകൾ. വൈദ്യുത മണ്ഡലം ചില അയോണുകൾ മെംബ്രണിന്റെ "ഹൈഡ്രജൻ" ഉപരിതലത്തിന് വിപരീത ദിശയിലേക്ക് നീങ്ങുന്നു. അയോണുകളുടെ വ്യാപന പ്രവാഹം സെന്റ് ആയിരിക്കുമ്പോൾ, പരിഗണനയിലുള്ള സിസ്റ്റത്തിലെ ഡൈനാമിക് സന്തുലിതാവസ്ഥ സ്ഥാപിക്കപ്പെടുന്നു. ഞാൻ റിവേഴ്സ് കറന്റിന് തുല്യമാണ്.
ഇനി നമുക്ക് മെംബ്രണിന്റെ രണ്ട് പ്രതലങ്ങളിലും വൈദ്യുതചാലക പൊടി പ്രയോഗിക്കാം, ഇത് ഇലക്ട്രോഡുകളായി പ്രവർത്തിക്കുന്ന രണ്ട് പോറസ് വൈദ്യുതചാലക പാളികൾക്ക് കാരണമാകും. ഇലക്ട്രോഡുകളുടെ വൈദ്യുത കണക്ഷൻ ഉറപ്പാക്കിക്കൊണ്ട് ഒരു ബാഹ്യ ഹീറ്റർ1 ഇലക്ട്രോഡുകളിലേക്ക് ബന്ധിപ്പിക്കാം. കാര്യമായ Rl ലേക്ക് ലോഡ് പ്രതിരോധം. ബാഹ്യ സർക്യൂട്ടിൽ അയോണുകൾക്ക് നീങ്ങാൻ കഴിയില്ല, കൂടാതെ ഇലക്ട്രോണുകൾ "ഹൈഡ്രജൻ" ഭാഗത്ത് നിന്ന് നീങ്ങാൻ തുടങ്ങുന്നു, അവിടെ അവയിൽ അധികമായി, മെംബ്രണിന്റെ എതിർ വശത്തേക്ക്, ചിത്രം പോലെ, ബാഹ്യ സർക്യൂട്ടിൽ ഒരു വൈദ്യുത പ്രവാഹം രൂപപ്പെടുന്നു. 7.2 ഞങ്ങൾക്ക് താൽപ്പര്യമുള്ള പ്രതികരണം "വെള്ളം" ഇലക്ട്രോഡിൽ സംഭവിക്കുന്നു, ഇത് സമവാക്യം വിവരിക്കുന്നു
2H2 -> 4H+ + 4e (അനോഡിക് പ്രതികരണം)
മൂലകത്തിന്റെ പ്രവർത്തനത്തിന്റെ വിവരിച്ച സ്കീമിന് ഒരു പ്രധാന പോരായ്മയുണ്ട്: ഇത് തെർമോഡൈനാമിക്സിന്റെ ആദ്യ നിയമത്തിന് വിരുദ്ധമാണ്. തീർച്ചയായും, ഒരു വൈദ്യുത പ്രവാഹം ഒരു ബാഹ്യ ലോഡിലൂടെ ഒഴുകുമ്പോൾ, അതിന്റെ അളവ് പുറത്തുവിടുന്നു, അതിന്റെ അളവ് നിർണ്ണയിക്കുന്നത് ഉൽപ്പന്നം I2RL ആണ്. അതേ സമയം, ഇലക്ട്രിക്
കാഥോഡ് മേഖലയിൽ പ്രവേശിച്ച്, H+ അയോണുകളുമായി സംയോജിപ്പിച്ച്, മെംബ്രണിലൂടെ വ്യാപിക്കുകയും ഹൈഡ്രജൻ ആറ്റങ്ങൾ രൂപപ്പെടുകയും ചെയ്യുന്നു, ആത്യന്തികമായി "ഇന്ധനം" ആയി ഉപയോഗിക്കുന്ന H2 വാതകത്തിന്റെ തന്മാത്രകൾ സൃഷ്ടിക്കുന്നു. തന്നിരിക്കുന്ന സ്കീം അനുസരിച്ച് പ്രക്രിയ തുടരുകയാണെങ്കിൽ, ഇന്ധന ഉപഭോഗം കൂടാതെ ഞങ്ങൾക്ക് ചൂട് ലഭിക്കും.
ബാഹ്യ സർക്യൂട്ട് ഇലക്ട്രോണുകളുടെ ചലനത്തിനുള്ള ഒരു പാത രൂപപ്പെടുത്തുന്നു, പക്ഷേ അതിൽ തന്നെ അത് വൈദ്യുത പ്രവാഹത്തിന്റെ കാരണമായിരിക്കില്ല. പൈപ്പിന്റെ ഒരറ്റം തടാകത്തിലേക്ക് താഴ്ത്തിയാൽ വെള്ളം തന്നെ പൈപ്പിലേക്ക് ഒഴുകുകയില്ല. വെള്ളം ഒഴുകുന്നതിന്, മറ്റേ അറ്റം ജലത്തിന്റെ ഉപരിതലത്തിന് താഴെയായിരിക്കണം. അതുപോലെ, ഒരു ബാഹ്യ സർക്യൂട്ടിൽ ഒരു വൈദ്യുത പ്രവാഹം അവതരിപ്പിക്കുന്നതിന്, കാഥോഡ് മേഖലയിലെ rhmodynamic സാധ്യത കുറയ്ക്കേണ്ടത് ആവശ്യമാണ്. ഇതിനുള്ള ഏറ്റവും എളുപ്പമുള്ള മാർഗം ഓക്സിജൻ ചേർക്കുക എന്നതാണ്, അതിന്റെ തന്മാത്രകൾ ഇലക്ട്രോണുകളും അയോണുകളും സംയോജിപ്പിച്ച് ജലത്തിന്റെ രൂപീകരണത്തിന് കാരണമാകുന്നു:
4е“ + 4N+ + 02 -» 2N20 (കാഥോഡ് പ്രതികരണം). (4)
പ്രതികരണം എക്സോതെർമിക് ആണ്, അതായത്, ഇത് പ്രധാനമായും വൈദ്യുതോർജ്ജത്തിന്റെ പ്രകാശനത്തിലൂടെയാണ് മുന്നോട്ട് പോകുന്നത്, ഹൈഡ്രജൻ കത്തുമ്പോൾ സംഭവിക്കുന്നത് പോലെ താപ ഊർജ്ജമല്ല. വ്യക്തമായും, ഈ ഊർജ്ജമാണ് ഇന്ധന മൂലകത്തെ ശക്തിപ്പെടുത്തുന്നത്.
ഇലക്ട്രോകെമിക്കൽ സെല്ലിന്റെ വിവരിച്ച ഡയഗ്രം ചിത്രത്തിൽ കാണിച്ചിരിക്കുന്നു. 7.2
സാധാരണ അവസ്ഥയിൽ, മുഴുവൻ പ്രദേശത്തും * ചിതറിപ്പോകുന്ന ഹൈഡ്രജൻ തന്മാത്രകളുടെ അംശം ചെറുതാണ്. ഫിസിക്കൽ പാരാമീറ്ററുകൾ മാറ്റുന്നതിലൂടെ ഇത് ചെറുതായി വർദ്ധിപ്പിക്കാൻ കഴിയും
Le Chatelier ന്റെ തത്വം അനുസരിച്ച് മീറ്റർ. ഉദാഹരണത്തിന്, സിസ്റ്റത്തിന്റെ താപനില വർദ്ധിപ്പിക്കുന്നതിലൂടെ. കാറ്റലിസ്റ്റുകളുടെ പ്രവർത്തനം ഉപയോഗിച്ച് ഹൈഡ്രജൻ തന്മാത്രകളുടെ വിഘടനത്തിന്റെ അളവ് വർദ്ധിപ്പിക്കാനും കഴിയും.
ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിൽ സംഭവിക്കുന്ന സമ്പൂർണ്ണ പ്രതികരണം സമവാക്യം വിവരിക്കുന്നു:
2H2 + 02 -> 2H?0.
അലസ്സാൻഡ്രോ വോൾട്ട (1800-ൽ 1745-1) കണ്ടുപിടിച്ച ഇലക്ട്രോകെമിക്കൽ സെൽ, തുടർച്ചയായ മോഡിൽ വൈദ്യുത പ്രവാഹം സൃഷ്ടിക്കുന്ന ആദ്യത്തെ ഉപകരണമായിരുന്നു, ഉപ്പ് ലായനിയിൽ മുക്കിയ കടലാസ് ഷീറ്റുകൾ കൊണ്ട് വേർതിരിച്ചെടുത്ത സിങ്ക്, സിൽവർ (അല്ലെങ്കിൽ ചെമ്പ്) ബേസുകൾ ഇതിൽ അടങ്ങിയിരിക്കുന്നു. ഒരു മൂലകത്തിന്റെ ഇലക്ട്രോഡ് മറ്റൊരു മൂലകത്തിന്റെ ZINC ഇലക്ട്രോഡുമായി നേരിട്ട് ബന്ധിപ്പിച്ചാണ് ഗാൽവാനിക് ബാറ്ററി രൂപീകരിച്ചത്.
ഈ ആസിഡിന്റെ നേർപ്പിച്ച (ഉദാഹരണത്തിന്, 10%) ലായനിയിൽ വെൽഡിഡ്, ചെമ്പ് ഇലക്ട്രോഡുകൾ മുക്കി ഒരു ഇലക്ട്രോകെമിക്കൽ വോൾട്ട സെൽ നിർമ്മിക്കാം. സിങ്ക് ഓക്സിഡൈസ് ചെയ്യും:
Zn -> Zr,++ + 2e >
തൽഫലമായി, സ്വതന്ത്ര ഇലക്ട്രോണുകൾ രൂപം കൊള്ളുന്നു. സിങ്ക് അയോണുകൾ വെള്ളത്തിൽ ലയിപ്പിക്കുക. സൾഫ്യൂറിക് ആസിഡ്, ശക്തമായ ആസിഡ്1 ആയതിനാൽ, അയോണുകളായി വിഘടിക്കുന്നു:
H2S04 - "2N+ + SOf"
സിങ്ക് അയോണുകൾ സൾഫേറ്റ് അയോണുകളുമായി ചേർന്ന് സിങ്ക് സൾഫേറ്റ് ഉണ്ടാക്കുന്നു. ഹൈഡ്രോണിയം അയോൺ H" (H20)x രൂപത്തിലുള്ള പോൺസ് ഇലക്ട്രോലൈറ്റിലൂടെ ഇലക്ട്രോഡിലേക്ക് നീങ്ങും, അവ വാതക കുമിളകളുടെ രൂപത്തിൽ പുറത്തുവരും (II ന് പുറത്ത് നിന്ന് ഇലക്ട്രോഡിലേക്ക് വരുന്ന ഇലക്ട്രോണുകളെ ഹൈഡ്രോണിയം അയോൺ പിടിച്ചെടുക്കുമ്പോൾ. സർക്യൂട്ട്) ഇത്തരത്തിലുള്ള ഇലക്ട്രോകെമിക്കൽ സെൽ പ്രായോഗികമായി ഉപയോഗശൂന്യമാണ്, കാരണം വളരെ വേഗം ചെമ്പ് ഇലക്ട്രോഡ് അതിന്റെ ഉപരിതലത്തോട് ചേർന്നുനിൽക്കുന്ന ഹൈഡ്രജൻ കുമിളകളാൽ മൂടപ്പെടും, ഇത് ഇലക്ട്രോഡിലേക്ക് പ്രവേശിക്കുന്ന അയോണുകളുടെ ഒഴുക്ക് ഗണ്യമായി കുറയ്ക്കും. "ഡ്രൈ സെല്ലുകൾ" എന്ന് വിളിക്കപ്പെടുന്നവ ഉപരിതലത്തിൽ ഒരു ഇൻസുലേറ്റിംഗ് വാതക പാളി രൂപപ്പെടുന്നത് തടയാൻ ചില മാർഗ്ഗങ്ങൾ ഉപയോഗിക്കുന്നു
"> ഒരു ആസിഡിന്റെ ശക്തി നിർണ്ണയിക്കുന്നത് ജലീയ ലായനിയിലെ തന്മാത്രകളുടെ വിഘടനത്തിന്റെ അളവാണ്. C ആസിഡ് പൂർണ്ണമായും H+, C1_ അയോണുകളായി വിഘടിക്കുന്നു - ഇതൊരു ശക്തമായ ആസിഡാണ്. സൾഫ്യൂറിക് ആസിഡ് കുറച്ച് ദുർബലമാണ്, മാത്രമല്ല ശക്തമായ ആസിഡുകളുടേതുമാണ്. .ആശ്ചര്യകരമെന്നു പറയട്ടെ, ഹൈഡ്രോഫ്ലൂറിക് ആസിഡ്, ഉയർന്ന നാശനഷ്ട പ്രവർത്തനം ഉണ്ടായിരുന്നിട്ടും, ഒരു ദുർബലമായ ആസിഡാണ് - ഊഷ്മാവിൽ n t പരിഹാരം, ന്യൂട്ര HF തന്മാത്രകളുടെ ആകെ സാന്ദ്രതയിൽ നിന്ന് H+ അയോണുകളുടെ അനുപാതം 3% ൽ താഴെയാണ്.
പിത്താശയം, എളുപ്പത്തിൽ ഓക്സീകരണത്തിന് വിധേയമാണ്; സിങ്ക് ആണ് മിക്കപ്പോഴും ഉപയോഗിക്കുന്നത്. വോൾട്ട മൂലകത്തിലെ ചെമ്പ് ഇലക്ട്രോഡ് രാസപ്രവർത്തനങ്ങളിൽ പ്രവേശിക്കുന്നില്ല, അതിനാൽ ചെമ്പ് ഉപഭോഗം ചെയ്യുന്നില്ല.
അടുത്തിടെ വരെ, വിലകുറഞ്ഞ ഗാൽവാനിക് ബാറ്ററികൾ ലെക്ലാഞ്ചെറ്റ് സെല്ലുകൾ ഉപയോഗിച്ചിരുന്നു, അതിൽ ആനോഡ് സിങ്ക് കൊണ്ടാണ് നിർമ്മിച്ചിരിക്കുന്നത്, കൂടാതെ ഗ്രാഫൈറ്റ് ചേർത്ത് പൊടിച്ച മാംഗനീസ് ഡയോക്സൈഡിന്റെ ഒരു പാളി പൊതിഞ്ഞ ഗ്രാഫൈറ്റ് വടി കൊണ്ടാണ് കാഥോഡ് നിർമ്മിച്ചിരിക്കുന്നത് (വൈദ്യുത ചാലകത വർദ്ധിപ്പിക്കുന്നതിന്). മാംഗനീസ് ഡയോക്സൈഡ് പുറത്തുവിടുന്ന ഹൈഡ്രജനെ ആഗിരണം ചെയ്യുന്നു, ഇത് കാഥോഡ് ഉപരിതലത്തിൽ ഒരു വാതക പാളി രൂപപ്പെടുന്നത് തടയുന്നു. അമോണിയം ക്ലോറൈഡ് ഒരു ഇലക്ട്രോലൈറ്റായി ഉപയോഗിക്കുന്നു. ആധുനിക (ആൽക്കലൈൻ) ബാറ്ററികൾ ഒരു ആൽക്കലൈൻ ഇലക്ട്രോലൈറ്റ് ഉപയോഗിക്കുന്നു.
ആനോഡ് മെറ്റീരിയലിനായി ഉപയോഗിക്കുന്ന സിങ്ക് തികച്ചും ശുദ്ധമാണെങ്കിൽ, മൂലകത്തിലൂടെ വൈദ്യുത പ്രവാഹം പ്രവഹിക്കുമ്പോൾ മാത്രമേ അത് ഉപഭോഗം ചെയ്യപ്പെടുകയുള്ളൂ. മൂലകം ഉപയോഗിക്കാത്തപ്പോൾ പോലും മാലിന്യങ്ങളുടെ സാന്നിധ്യം ഇലക്ട്രോഡിന്റെ നാശത്തിന് കാരണമാകുന്നു (ഇലക്ട്രോഡ് മെറ്റീരിയലിനുള്ളിൽ മാലിന്യങ്ങൾ നിരവധി മൈക്രോസ്കോപ്പിക് ഇലക്ട്രോകെമിക്കൽ സെല്ലുകൾ ഉണ്ടാക്കുന്നു). അത്തരം ബാറ്ററികളുടെ ദീർഘകാല ഷെൽഫ് ആയുസ്സ് ഉറപ്പാക്കാൻ, ആനോഡ് നിർമ്മിച്ചിരിക്കുന്നത് സിങ്കിന്റെയും മെർക്കുറിയുടെയും (അമൽഗമേറ്റഡ്) ഒരു അലോയ് ഉപയോഗിച്ചാണ്. നിലവിൽ, ലെക്ലാഞ്ചെ സെല്ലുകൾ പൂർണ്ണമായും ആൽക്കലൈൻ ബാറ്ററികളാൽ മാറ്റിസ്ഥാപിക്കപ്പെട്ടു.
പുറത്തുനിന്ന് ഊർജം നൽകുമ്പോൾ മാത്രമാണ് പല രാസപ്രവർത്തനങ്ങളും സംഭവിക്കുന്നത്. അവ പലപ്പോഴും വൈദ്യുതവിശ്ലേഷണ കോശങ്ങളിൽ (ഇലക്ട്രോലൈസറുകൾ) ഒരു ബാഹ്യ നിലവിലെ ഉറവിടവുമായി ബന്ധിപ്പിച്ചിട്ടുള്ള ഇലക്ട്രോഡുകളിൽ നടത്തപ്പെടുന്നു. ഈ പ്രതിപ്രവർത്തനങ്ങളെക്കുറിച്ചുള്ള പഠനം വിവിധ വസ്തുക്കളുടെ സ്വഭാവത്തെയും ഗുണങ്ങളെയും കുറിച്ചുള്ള വിവരങ്ങൾ നൽകുന്നു, കൂടാതെ ഇലക്ട്രോസിന്തസിസ് ഉപയോഗിച്ച് പുതിയ രാസ സംയുക്തങ്ങൾ ലഭിക്കുന്നത് സാധ്യമാക്കുന്നു. ഇലക്ട്രോകെമിക്കൽ പ്രക്രിയകൾ വ്യവസായത്തിൽ വ്യാപകമായി ഉപയോഗിക്കുന്നു. ക്ലോറിൻ, അലുമിനിയം ഉൽപ്പാദനം, ഇലക്ട്രോപ്ലേറ്റിംഗ്, ഇലക്ട്രിക്കൽ എക്സ്ട്രാക്ഷൻ എന്നിവ ഉദാഹരണങ്ങളാണ്. കെമിക്കൽ ഊർജ്ജത്തെ വൈദ്യുതോർജ്ജമാക്കി മാറ്റുന്ന ഗാൽവാനിക് സെല്ലുകൾ, നിലവിലെ സ്രോതസ്സുകളുടെ അടിസ്ഥാനം - ബാറ്ററികളും അക്യുമുലേറ്ററുകളും, അതുപോലെ ഇന്ധന സെല്ലുകളും. ഇലക്ട്രോകെമിസ്ട്രി മറ്റ് വൈദ്യുത പ്രതിഭാസങ്ങളെയും പഠിക്കുന്നു: ഇലക്ട്രോലൈറ്റ് ലായനികളിലെ അയോണുകളുടെ സ്വഭാവവും അത്തരം പരിഹാരങ്ങളിലൂടെ വൈദ്യുതധാര കടന്നുപോകുന്നതും; ഒരു വൈദ്യുത മണ്ഡലത്തിലെ അയോണുകളുടെ വേർതിരിവ് (ഇലക്ട്രോഫോറെസിസ്); ലോഹങ്ങളുടെ നാശവും നിഷ്ക്രിയത്വവും; ബയോളജിക്കൽ സിസ്റ്റങ്ങളിൽ ഇലക്ട്രിക്കൽ ഇഫക്റ്റുകൾ (ബയോ ഇലക്ട്രോകെമിസ്ട്രി); ഫോട്ടോ ഇലക്ട്രോകെമിക്കൽ പ്രക്രിയകൾ (കോശങ്ങളിലെ ഇലക്ട്രോകെമിക്കൽ പ്രതിപ്രവർത്തനങ്ങളിൽ പ്രകാശത്തിന്റെ പ്രഭാവം).
ചരിത്രപരമായ പരാമർശം.
വൈദ്യുത പ്രവാഹത്തിന്റെ സ്ഥിരവും മതിയായതുമായ ശക്തമായ ഉറവിടം സൃഷ്ടിച്ചതിനുശേഷം മാത്രമേ ചിട്ടയായ ഇലക്ട്രോകെമിക്കൽ ഗവേഷണം നടത്താൻ കഴിയൂ. അത്തരമൊരു ഉറവിടം 18-19 നൂറ്റാണ്ടുകളുടെ തുടക്കത്തിൽ പ്രത്യക്ഷപ്പെട്ടു. എൽ.ഗാൽവാനിയുടെയും എ.വോൾട്ടയുടെയും പ്രവർത്തനത്തിന്റെ ഫലമായി. തവളയുടെ ശാരീരിക പ്രവർത്തനങ്ങൾ പഠിക്കുന്നതിനിടയിൽ, ഗാൽവാനി ആകസ്മികമായി രണ്ട് വ്യത്യസ്ത ലോഹങ്ങളും ഒരു തവള കാലിന്റെ പേശിയും അടങ്ങുന്ന ഒരു ഇലക്ട്രോകെമിക്കൽ സർക്യൂട്ട് സൃഷ്ടിച്ചു. ഒരു ചെമ്പ് ഹോൾഡർ ഉപയോഗിച്ച് ഉറപ്പിച്ച കൈകാലിൽ ഇരുമ്പ് വയർ ഉപയോഗിച്ച് സ്പർശിച്ചപ്പോൾ, ഹോൾഡറുമായി ബന്ധിപ്പിച്ചപ്പോൾ, പേശി ചുരുങ്ങി. ഒരു ഇലക്ട്രിക് ഡിസ്ചാർജിന്റെ സ്വാധീനത്തിൽ സമാനമായ സങ്കോചങ്ങൾ സംഭവിച്ചു. ഗാൽവാനി ഈ പ്രതിഭാസത്തെ വിശദീകരിച്ചത് "മൃഗ വൈദ്യുതി" യുടെ അസ്തിത്വത്തിലൂടെയാണ്. ഈ പരീക്ഷണങ്ങളുടെ മറ്റൊരു വ്യാഖ്യാനം വോൾട്ട നൽകി, രണ്ട് ലോഹങ്ങളുടെ സമ്പർക്ക ഘട്ടത്തിൽ വൈദ്യുതി ഉണ്ടാകുന്നു, തവള പേശിയുടെ സങ്കോചം അതിലൂടെ വൈദ്യുത പ്രവാഹം കടന്നുപോകുന്നതിന്റെ ഫലമാണ്. ഉപ്പുവെള്ളത്തിൽ മുക്കിയ സ്പോഞ്ച് മെറ്റീരിയൽ (തുണി അല്ലെങ്കിൽ പേപ്പർ) രണ്ട് മെറ്റൽ ഡിസ്കുകൾക്കിടയിൽ സ്ഥാപിക്കുമ്പോൾ ഒരു കറന്റ് സംഭവിച്ചു, ഉദാഹരണത്തിന് സിങ്ക്, കോപ്പർ, സർക്യൂട്ട് അടച്ചു. ഈ "മൂലകങ്ങളിൽ" 15-20 എണ്ണം ശ്രേണിയിൽ ബന്ധിപ്പിച്ചുകൊണ്ട്, 1800-ൽ വോൾട്ട ആദ്യത്തെ കെമിക്കൽ കറന്റ് സ്രോതസ്സ് സൃഷ്ടിച്ചു - "വോൾട്ടായിക് കോളം".
രാസ സംവിധാനങ്ങളിൽ വൈദ്യുതിയുടെ സ്വാധീനം പല ശാസ്ത്രജ്ഞർക്കും ഉടനടി താൽപ്പര്യമുണ്ടാക്കി. 1800-ൽ, ഡബ്ല്യു. നിക്കോൾസണും എ. കാർലൈലും, "വോൾട്ടായിക് കോളവുമായി" ബന്ധിപ്പിച്ചിരിക്കുന്ന പ്ലാറ്റിനവും സ്വർണ്ണ വയറുകളും ഉപയോഗിച്ച് ഒരു വൈദ്യുത പ്രവാഹം കടന്നുപോകുമ്പോൾ വെള്ളം ഹൈഡ്രജനും ഓക്സിജനുമായി വിഘടിക്കുന്നു എന്ന് റിപ്പോർട്ട് ചെയ്തു. ആദ്യകാല ഇലക്ട്രോകെമിക്കൽ പഠനങ്ങളിൽ ഏറ്റവും പ്രധാനപ്പെട്ടത് ഇംഗ്ലീഷ് രസതന്ത്രജ്ഞനായ എച്ച്. ഡേവിയുടെ കൃതിയാണ്. 1807-ൽ, ചെറുതായി ഈർപ്പമുള്ള ഖര പൊട്ടാസ്യം ഹൈഡ്രോക്സൈഡിലൂടെ വൈദ്യുത പ്രവാഹം കടത്തിവിട്ടുകൊണ്ട് അദ്ദേഹം പൊട്ടാസ്യം മൂലകത്തെ വേർതിരിച്ചു. 100 ഗാൽവാനിക് സെല്ലുകളുടെ ബാറ്ററിയായിരുന്നു വോൾട്ടേജ് ഉറവിടം. മെറ്റാലിക് സോഡിയം സമാനമായ രീതിയിൽ ലഭിച്ചു. ഡേവി പിന്നീട് മെർക്കുറി ഇലക്ട്രോഡ് ഉപയോഗിച്ച് വൈദ്യുതവിശ്ലേഷണം നടത്തി മഗ്നീഷ്യം, കാൽസ്യം, സ്ട്രോൺഷ്യം, ബേരിയം എന്നിവ വേർതിരിച്ചു.
ഡേവിയുടെ അസിസ്റ്റന്റ് എം. ഫാരഡെ ഇലക്ട്രോഡ്/സൊല്യൂഷൻ ഇന്റർഫേസിലൂടെ പ്രവഹിക്കുന്ന വൈദ്യുതിയുടെ അളവും (ഇപ്പോഴത്തെ സമയം) അതുമൂലമുണ്ടാകുന്ന രാസമാറ്റങ്ങളും തമ്മിലുള്ള ബന്ധം അന്വേഷിച്ചു. ഒരു ഇലക്ട്രോലൈറ്റിക് സെല്ലിൽ പുറത്തുവിടുന്ന ഹൈഡ്രജന്റെയും ഓക്സിജന്റെയും അളവിൽ നിന്നുള്ള വൈദ്യുതിയുടെ അളവ് അളക്കാൻ ഒരു ഉപകരണം (ഇപ്പോൾ ഗ്യാസ് കൂലോമീറ്റർ എന്നറിയപ്പെടുന്നു) സൃഷ്ടിച്ചു, ഒരു നിശ്ചിത തുക ലഭിക്കുന്നതിന് ആവശ്യമായ വൈദ്യുതിയുടെ അളവ് (1833) കാണിക്കുന്നു പദാർത്ഥം ഇലക്ട്രോഡുകളുടെ വലിപ്പം, അവ തമ്മിലുള്ള ദൂരം, സെല്ലിന് ഭക്ഷണം നൽകുന്ന ബാറ്ററിയിലെ പ്ലേറ്റുകളുടെ എണ്ണം എന്നിവയെ ആശ്രയിക്കുന്നില്ല. കൂടാതെ, വൈദ്യുതവിശ്ലേഷണ സമയത്ത് പുറത്തുവിടുന്ന ഒരു പദാർത്ഥത്തിന്റെ അളവ് അതിന്റെ രാസ തുല്യതയ്ക്കും ഇലക്ട്രോലൈറ്റിലൂടെ കടന്നുപോകുന്ന വൈദ്യുതിയുടെ അളവിനും നേരിട്ട് ആനുപാതികമാണെന്ന് ഫാരഡെ കണ്ടെത്തി. (1.0078 ഗ്രാം) ആറ്റങ്ങളുടെ (1.0078 ഗ്രാം) സംയുക്തങ്ങളിൽ പ്രതിപ്രവർത്തിക്കുന്നതോ പകരം വയ്ക്കുന്നതോ ആയ ഒരു മൂലകത്തിന്റെയോ സംയുക്തത്തിന്റെയോ ഗ്രാമുകളുടെ എണ്ണമാണ് ഒരു രാസ തത്തുല്യം; സെമി. തുല്യ പിണ്ഡം). ഈ രണ്ട് അടിസ്ഥാന വ്യവസ്ഥകളെ ഫാരഡെയുടെ നിയമങ്ങൾ എന്ന് വിളിക്കുന്നു. ക്ലാസിക്കൽ ഫിലോളജിയിൽ വിദഗ്ധനായ തന്റെ സുഹൃത്ത് ഡബ്ല്യു. വീവലിനൊപ്പം ഫാരഡെ ഇലക്ട്രോകെമിസ്ട്രിയിൽ ഒരു പുതിയ പദാവലി വികസിപ്പിച്ചെടുത്തു. ഒരു പരിഹാരം ഇലക്ട്രോഡുകളിൽ മുഴുകിയിരിക്കുന്ന കണ്ടക്ടർമാരെ അദ്ദേഹം വിളിച്ചു (മുമ്പ് അവയെ ധ്രുവങ്ങൾ എന്ന് വിളിച്ചിരുന്നു); "വൈദ്യുതവിശ്ലേഷണം" (കറന്റ് കടന്നുപോകുന്നതുമായി ബന്ധപ്പെട്ട രാസ മാറ്റങ്ങൾ), "ഇലക്ട്രോലൈറ്റ്" (ഇലക്ട്രോകെമിക്കൽ സെല്ലുകളിൽ ദ്രാവകം നടത്തുന്നു), "ആനോഡ്" (ഓക്സിഡേഷൻ പ്രതികരണം സംഭവിക്കുന്ന ഇലക്ട്രോഡ്), "കാഥോഡ്" (ഇലക്ട്രോഡ്" എന്നീ ആശയങ്ങൾ അവതരിപ്പിച്ചു. റിഡക്ഷൻ പ്രതികരണം സംഭവിക്കുന്നു). ലിക്വിഡ് അയോണുകളിലെ ചാർജ് കാരിയറുകളെ അദ്ദേഹം വിളിച്ചു (ഗ്രീക്കിൽ നിന്ന് "വാണ്ടറർ", "വാണ്ടറർ"), കൂടാതെ ആനോഡിലേക്ക് (പോസിറ്റീവ് ഇലക്ട്രോഡ്) നീങ്ങുന്ന അയോണുകളെ "അയോണുകൾ" എന്നും കാഥോഡിലേക്ക് നീങ്ങുന്നവ - "കാറ്റേഷനുകൾ" എന്നും വിളിക്കുന്നു. വൈദ്യുതകാന്തിക പ്രേരണയെക്കുറിച്ചുള്ള ഫാരഡെയുടെ ഗവേഷണം വൈദ്യുത ജനറേറ്ററുകൾ സൃഷ്ടിക്കുന്നതിലേക്ക് നയിച്ചു, ഇത് ഒരു വ്യാവസായിക തലത്തിൽ ഇലക്ട്രോകെമിക്കൽ പ്രക്രിയകൾ നടത്തുന്നത് സാധ്യമാക്കി.
അയോണുകളുടെ സാന്നിധ്യത്താൽ വൈദ്യുത പ്രവാഹം കടത്തിവിടാനുള്ള പരിഹാരങ്ങളുടെ കഴിവ് ഫാരഡെ വിശദീകരിച്ചു, എന്നാൽ അദ്ദേഹവും മറ്റ് ശാസ്ത്രജ്ഞരായ I. ഹിറ്റോർഫ്, എഫ്. കോഹ്റൗഷ് എന്നിവരും വൈദ്യുതധാരയുടെ സ്വാധീനത്തിലാണ് അയോണുകൾ പ്രത്യക്ഷപ്പെടുന്നതെന്ന് വിശ്വസിച്ചു. 1884-ൽ, S. Arrhenius അഭിപ്രായപ്പെട്ടു, വാസ്തവത്തിൽ, ഉപ്പ് വെള്ളത്തിൽ ലയിക്കുമ്പോൾ അയോണുകൾ രൂപം കൊള്ളുന്നു. ഇലക്ട്രോലൈറ്റുകളുടെ സിദ്ധാന്തവും ലായനികളുടെ ഭൗതിക രാസ ഗുണങ്ങളെയും അവയുടെ തെർമോഡൈനാമിക്സിനെയും കുറിച്ചുള്ള ആശയങ്ങളും വികസിപ്പിക്കുന്നതിലെ സുപ്രധാന നാഴികക്കല്ലായിരുന്നു എസ്.അർഹേനിയസ്, ജെ. വാന്റ് ഹോഫ്, ഡബ്ല്യു. ഓസ്റ്റ്വാൾഡ് എന്നിവരുടെ കൃതികൾ. 1923-ൽ പി. ഡെബിയും ഇ. ഹക്കലും അയോണുകൾ തമ്മിലുള്ള ദീർഘദൂര ഇലക്ട്രോസ്റ്റാറ്റിക് ഇടപെടലുകൾ കണക്കിലെടുത്തതിന് ശേഷം അയോണിക് ചാലകതയെയും ലായനിയിലെ സന്തുലിതാവസ്ഥയെയും കുറിച്ചുള്ള സിദ്ധാന്തവും പരീക്ഷണാത്മക ഡാറ്റയും തമ്മിലുള്ള കത്തിടപാടുകൾ കൂടുതൽ പൂർത്തിയായി.
ഇലക്ട്രോകെമിക്കൽ തെർമോഡൈനാമിക്സിലും പ്രത്യേകിച്ച് ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിലെ വൈദ്യുത പൊട്ടൻഷ്യലിന്റെ (വോൾട്ടേജ്) സ്വഭാവവും വൈദ്യുത, രാസ, താപ ഊർജ്ജവും തമ്മിലുള്ള സന്തുലിതാവസ്ഥ വ്യക്തമാക്കുന്നതിലും ഒരു പ്രധാന സംഭാവന നൽകിയത് ജെ. ഗിബ്സും ഡബ്ല്യു. നേർനസ്റ്റും ആണ്. ഇലക്ട്രോകെമിക്കൽ പൊട്ടൻഷ്യൽ നിർണ്ണയിക്കുന്നത് സെല്ലിൽ സംഭവിക്കുന്ന പ്രക്രിയകളുടെ രാസ ഊർജ്ജമാണ്, മാത്രമല്ല അവയുടെ വേഗതയെ (കൈനറ്റിക്സ്) ആശ്രയിച്ചിരിക്കുന്നു. ഇലക്ട്രോഡുകളിലെ ചലനാത്മക പ്രക്രിയകളുടെ മോഡലിംഗ് Y. Tafel (1905), J. ബട്ട്ലർ (1924), M. Volmer (1930), A. N. Frumkin (1930-1933) എന്നിവർ നടത്തി.
ഇലക്ട്രോകെമിക്കൽ സെല്ലുകൾ.
ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിൽ സാധാരണയായി രണ്ട് അർദ്ധകോശങ്ങൾ അടങ്ങിയിരിക്കുന്നു, അവയിൽ ഓരോന്നും സ്വന്തം ഇലക്ട്രോലൈറ്റിൽ മുഴുകിയിരിക്കുന്ന ഒരു ഇലക്ട്രോഡാണ്. ഇലക്ട്രോഡുകൾ നിർമ്മിച്ചിരിക്കുന്നത് വൈദ്യുതചാലക പദാർത്ഥങ്ങൾ (ലോഹം അല്ലെങ്കിൽ കാർബൺ), അല്ലെങ്കിൽ പലപ്പോഴും അർദ്ധചാലകമാണ്. ഇലക്ട്രോഡുകളിലെ ചാർജ് കാരിയറുകൾ ഇലക്ട്രോണുകളും ഇലക്ട്രോലൈറ്റിലെ ചാർജ് കാരിയറുകൾ അയോണുകളുമാണ്. ഇലക്ട്രോലൈറ്റായ ടേബിൾ സാൾട്ടിന്റെ (സോഡിയം ക്ലോറൈഡ് NaCl) ജലീയ ലായനിയിൽ ചാർജ്ജ് ചെയ്ത കണങ്ങൾ അടങ്ങിയിരിക്കുന്നു: സോഡിയം കാറ്റേഷനുകൾ Na +, ക്ലോറിൻ അയോണുകൾ Cl –. നിങ്ങൾ ഒരു വൈദ്യുത മണ്ഡലത്തിൽ അത്തരമൊരു പരിഹാരം സ്ഥാപിക്കുകയാണെങ്കിൽ, Na + അയോണുകൾ നെഗറ്റീവ് ധ്രുവത്തിലേക്കും Cl - അയോണുകൾ പോസിറ്റീവ് പോൾയിലേക്കും നീങ്ങും. NaCl പോലുള്ള ഉരുകിയ ലവണങ്ങളും ഇലക്ട്രോലൈറ്റുകളാണ്. ഇലക്ട്രോലൈറ്റുകൾ ഖരപദാർഥങ്ങളാകാം, ഉദാഹരണത്തിന് ബി- മൊബൈൽ സോഡിയം അയോണുകൾ അല്ലെങ്കിൽ അയോൺ എക്സ്ചേഞ്ച് പോളിമറുകൾ അടങ്ങിയ അലുമിന (സോഡിയം പോളിഅലുമിനേറ്റ്).
അയോണുകളുടെ ചലനത്തെ തടസ്സപ്പെടുത്താതെ, ഇലക്ട്രോലൈറ്റുകളുടെ മിശ്രിതം തടയുന്ന ഒരു വിഭജനം വഴി അർദ്ധകോശങ്ങൾ വേർതിരിക്കുന്നു. അത്തരമൊരു വിഭജനത്തിന്റെ പങ്ക് ഒരു ഉപ്പ് പാലം, രണ്ട് അറ്റത്തും ഗ്ലാസ് കമ്പിളി, ഒരു അയോൺ എക്സ്ചേഞ്ച് മെംബ്രൺ അല്ലെങ്കിൽ ഒരു പോറസ് ഗ്ലാസ് പ്ലേറ്റ് എന്നിവ ഉപയോഗിച്ച് അടച്ച ജലീയ ലായനി ഉള്ള ഒരു ട്യൂബ് നിർവ്വഹിക്കാം. ഇലക്ട്രോലൈറ്റിക് സെല്ലിന്റെ രണ്ട് ഇലക്ട്രോഡുകളും ഒരേ ഇലക്ട്രോലൈറ്റിൽ മുങ്ങാം.
രണ്ട് തരം ഇലക്ട്രോകെമിക്കൽ സെല്ലുകൾ ഉണ്ട്: ഗാൽവാനിക് സെല്ലുകളും ഇലക്ട്രോലൈറ്റിക് സെല്ലുകളും (ഇലക്ട്രോലൈസറുകൾ). ഒരു ഗാൽവാനിക് സെല്ലിൽ, ഇലക്ട്രോഡ്/ഇലക്ട്രോലൈറ്റ് ഇന്റർഫേസിൽ രാസപ്രവർത്തനങ്ങൾ സ്വയമേവ സംഭവിക്കുന്നു, കൂടാതെ ഇലക്ട്രോഡുകൾ ഒരു ചാലകത്തിലൂടെ പരസ്പരം ബന്ധിപ്പിച്ചിരിക്കുന്നു. ശ്രേണിയിൽ ബന്ധിപ്പിച്ചിരിക്കുന്ന നിരവധി ഗാൽവാനിക് സെല്ലുകൾ ഒരു ബാറ്ററിയായി മാറുന്നു - വൈദ്യുതധാരയുടെ ഒരു രാസ സ്രോതസ്സ്. ഒരു ഇലക്ട്രോലൈറ്റിക് സെല്ലിൽ, ഇലക്ട്രോഡ്/ഇലക്ട്രോലൈറ്റ് ഇന്റർഫേസിലെ പ്രതിപ്രവർത്തനങ്ങൾ വൈദ്യുതോർജ്ജത്തിന്റെ ബാഹ്യ സ്രോതസ്സ് കാരണം സംഭവിക്കുന്നു; രണ്ടാമത്തേത് ഇലക്ട്രോഡുകളിൽ സംഭവിക്കുന്ന പ്രതിപ്രവർത്തന ഉൽപ്പന്നങ്ങളുടെ രാസ ഊർജ്ജമായി പരിവർത്തനം ചെയ്യപ്പെടുന്നു. ഗാൽവാനിക് സെല്ലിന്റെ ഘടന ചിത്രത്തിൽ കാണിച്ചിരിക്കുന്നു. 1, ഇലക്ട്രോലൈസർ - ചിത്രത്തിൽ. 2. ഒരേ സെല്ലിന്, ഓപ്പറേറ്റിംഗ് മോഡിനെ ആശ്രയിച്ച്, ഒരു ഗാൽവാനിക് സെല്ലായി അല്ലെങ്കിൽ ഒരു ഇലക്ട്രോലൈസർ ആയി പ്രവർത്തിക്കാൻ കഴിയും. അങ്ങനെ, ഒരു ലെഡ്-ആസിഡ് കാർ ബാറ്ററി എഞ്ചിൻ ആരംഭിക്കാൻ ഉപയോഗിക്കുമ്പോൾ (അത് ഡിസ്ചാർജ് ചെയ്യുമ്പോൾ) ഗാൽവാനിക് സെല്ലായും കാർ ജനറേറ്ററിൽ നിന്നോ ചാർജറിൽ നിന്നോ ചാർജ് ചെയ്യുമ്പോൾ ഇലക്ട്രോലൈസറായും പ്രവർത്തിക്കുന്നു.
1836-ൽ ജെ. ഡാനിയൽ (ചിത്രം 1) സൃഷ്ടിച്ച ഒരു ലളിതമായ ഗാൽവാനിക് സെൽ, രണ്ട് ഇലക്ട്രോഡുകൾ ഉൾക്കൊള്ളുന്നു: സിങ്ക്, സിങ്ക് സൾഫേറ്റിന്റെ ജലീയ ലായനിയിൽ മുക്കിയ സിങ്ക്, കോപ്പർ (II) സൾഫേറ്റിന്റെ ജലീയ ലായനിയിൽ മുക്കിയ ചെമ്പ്. അത്തരമൊരു മൂലകം വോൾട്ടായിക് കോളത്തിൽ ചെമ്പ്-സിങ്ക് ജോഡികൾക്ക് സമാനമാണ്. ബാഹ്യ സർക്യൂട്ട് അടയ്ക്കുമ്പോൾ, സിങ്ക് ഇലക്ട്രോഡിന്റെ ഉപരിതലത്തിലുള്ള സിങ്ക് ആറ്റങ്ങൾ ഇലക്ട്രോണുകളുടെ പ്രകാശനത്തോടെ അയോണുകളിലേക്ക് ഓക്സിഡൈസ് ചെയ്യപ്പെടുന്നു: Zn ® Zn 2+ + 2e - . ഈ ഇലക്ട്രോണുകൾ ബാഹ്യ സർക്യൂട്ടിലൂടെ ചെമ്പ് ഇലക്ട്രോഡിലേക്ക് നീങ്ങുകയും ചെമ്പ് അയോണുകൾ ആറ്റങ്ങളായി കുറയ്ക്കുകയും ചെയ്യുന്നു: Cu 2+ + 2e - ® Cu. ബാഹ്യ സർക്യൂട്ടിലെ ഇലക്ട്രോണുകളുടെ ഒഴുക്ക് മൂലകം സൃഷ്ടിക്കുന്ന വൈദ്യുതധാരയാണ്. ഒരു രാസ പരിവർത്തനത്തിലേക്കും വൈദ്യുതോർജ്ജത്തിന്റെ ഉൽപാദനത്തിലേക്കും നയിക്കുന്ന മൊത്തത്തിലുള്ള പ്രതികരണത്തിന് ഒരു രൂപമുണ്ട്
ചെമ്പ് സൾഫേറ്റിന്റെ ലായനിയിൽ മെറ്റാലിക് സിങ്ക് ചേർക്കുമ്പോൾ അതേ പ്രതികരണം സംഭവിക്കുന്നു, എന്നാൽ ഈ സാഹചര്യത്തിൽ രാസ ഊർജ്ജം താപ ഊർജ്ജമായി പരിവർത്തനം ചെയ്യപ്പെടുന്നു.
ഇലക്ട്രോഡും ഇലക്ട്രോലൈറ്റും തമ്മിലുള്ള അതിർത്തി ലംബമായ അല്ലെങ്കിൽ സ്ലാഷ് (| അല്ലെങ്കിൽ /), രണ്ട് സ്ലാഷുകളുള്ള ഉപ്പ് പാലം (//) എന്നിവ ഉപയോഗിച്ച് പലപ്പോഴും ഇലക്ട്രോകെമിക്കൽ സെല്ലുകളെ സ്കീമാറ്റിക്കായി പ്രതിനിധീകരിക്കുന്നു. അതിനാൽ, ചിത്രത്തിലെ ഗാൽവാനിക് സെൽ. 1 ഉത്തര എൻട്രി
ഇവിടെ M എന്നത് ലായനിയുടെ മോളാർ സാന്ദ്രതയാണ്.
ചിത്രത്തിൽ കാണിച്ചിരിക്കുന്ന ഇലക്ട്രോലൈറ്റിക് സെല്ലിൽ. 2, ക്ലോറിൻ, ആൽക്കലി എന്നിവ ഉൽപ്പാദിപ്പിക്കുന്നതിനുള്ള വ്യാവസായിക ഇലക്ട്രോലൈസറുകളിലെ അതേ പ്രതികരണങ്ങൾ സംഭവിക്കുന്നു: ഉപ്പുവെള്ളം (സോഡിയം ക്ലോറൈഡിന്റെ ഒരു സാന്ദ്രീകൃത ജലീയ ലായനി) ക്ലോറിൻ, സോഡിയം ഹൈഡ്രോക്സൈഡ് NaOH എന്നിവയിലേക്ക് പരിവർത്തനം ചെയ്യുന്നു:
ഗ്രാഫൈറ്റ് ഇലക്ട്രോഡിലെ ക്ലോറൈഡ് അയോണുകൾ ക്ലോറിൻ വാതകമായി ഓക്സിഡൈസ് ചെയ്യപ്പെടുന്നു, ഇരുമ്പ് ഇലക്ട്രോഡിലെ വെള്ളം ഹൈഡ്രജൻ, ഹൈഡ്രോക്സൈഡ് അയോണുകളായി ചുരുങ്ങുന്നു. ഒരു വിഭജനത്തിലൂടെ സോഡിയം അയോണുകളുടെ ചലനം കാരണം ഇലക്ട്രോലൈറ്റുകൾ വൈദ്യുതപരമായി നിഷ്പക്ഷമായി നിലകൊള്ളുന്നു - ഒരു അയോൺ എക്സ്ചേഞ്ച് മെംബ്രൺ. ഓക്സിഡേഷൻ സംഭവിക്കുന്ന ഇലക്ട്രോഡിനെ (ചിത്രം 1 ലെ സിങ്ക്, ചിത്രം 2 ലെ ഗ്രാഫൈറ്റ്) ആനോഡ് എന്നും റിഡക്ഷൻ സംഭവിക്കുന്ന ഇലക്ട്രോഡിനെ കാഥോഡ് എന്നും വിളിക്കുന്നു.
ഇലക്ട്രോഡ് സാധ്യത.
ഇലക്ട്രോകെമിക്കൽ സെല്ലുകളുടെ പ്രധാന വൈദ്യുത പാരാമീറ്ററുകൾ കറന്റ് (ആമ്പിയറുകളിൽ അളക്കുന്നത്, എ), പൊട്ടൻഷ്യൽ (വോൾട്ടുകളിൽ അളക്കുന്നത്, വി) എന്നിവയാണ്. നിലവിലെ ശക്തി നിർണ്ണയിക്കുന്നത് ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ നിരക്ക് അനുസരിച്ചാണ്, കൂടാതെ സെല്ലിൽ സംഭവിക്കുന്ന പ്രക്രിയകളുടെ രാസ ഊർജ്ജമാണ് സാധ്യതകൾ നിർണ്ണയിക്കുന്നത്. ഇത് ഊർജ്ജത്തിന് തുല്യമാണ് (ജൂളുകളിൽ അളക്കുന്നത്, ജെ) വൈദ്യുതിയുടെ അളവ് കൊണ്ട് ഹരിച്ചാൽ (കൂലോംബ്സ്, സിയിൽ അളക്കുന്നത്), അതായത്. 1 വി = 1 ജെ / Cl. അതിനാൽ, ഒരു മൂലകത്തിന്റെ പൊട്ടൻഷ്യൽ (ഇലക്ട്രോമോട്ടീവ് ഫോഴ്സ്, ഇഎംഎഫ്) അതിൽ സംഭവിക്കുന്ന പ്രതിപ്രവർത്തനങ്ങളിൽ ഉണ്ടാകുന്ന ഊർജ്ജത്തിന്റെ അളവാണ്. ബാഹ്യ സർക്യൂട്ട് തുറന്നിട്ടുണ്ടെങ്കിൽ, ഇലക്ട്രോഡ് പ്രതികരണങ്ങളൊന്നും സംഭവിക്കുന്നില്ല.
തുറന്ന ബാഹ്യ സർക്യൂട്ട് ഉള്ള ഒരു ഗാൽവാനിക് സെല്ലിന്റെ സാധ്യത അതിന്റെ പ്രതിപ്രവർത്തനങ്ങളുടെ തെർമോഡൈനാമിക്സിനെക്കുറിച്ചുള്ള വിവരങ്ങൾ നൽകുന്നു. ചിത്രത്തിൽ കാണിച്ചിരിക്കുന്ന മൂലകത്തിന്റെ സാധ്യത. 1, 1 M ന്റെ ലായനി സാന്ദ്രതയിലും 25 ° C താപനിലയിലും - അതിന്റെ സ്റ്റാൻഡേർഡ് പൊട്ടൻഷ്യൽ ഇ° – 1.10 V ന് തുല്യമാണ്. അനുബന്ധ ഊർജ്ജം, ഗിബ്സ് തെർമോഡൈനാമിക് പൊട്ടൻഷ്യൽ, D ജി°, നൽകിയത്
എവിടെ എൻപ്രതിപ്രവർത്തന സമയത്ത് കൈമാറ്റം ചെയ്യപ്പെടുന്ന ഇലക്ട്രോണുകളുടെ എണ്ണം (ഈ സാഹചര്യത്തിൽ 2), എഫ്– ഫാരഡെ നമ്പർ (96 485 സി / മോൾ). ഒരു ഗാൽവാനിക് സെല്ലിന്റെ സാധ്യത അതിന്റെ രണ്ട് അർദ്ധകോശങ്ങൾ തമ്മിലുള്ള പൊട്ടൻഷ്യൽ വ്യത്യാസത്തിന് തുല്യമാണ്, അതായത്. അതിന്റെ ഇലക്ട്രോഡ് സാധ്യതകളിലെ വ്യത്യാസം. ഇലക്ട്രോഡ് പൊട്ടൻഷ്യലുകൾ റഫറൻസ് ഇലക്ട്രോഡിന്റെ സാധ്യതയുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ അളക്കുന്നു, ഇത് പരമ്പരാഗതമായി പൂജ്യമായി കണക്കാക്കുന്നു ( സെമി. മേശ). കരാർ പ്രകാരം, ഒരു സാധാരണ ഹൈഡ്രജൻ ഇലക്ട്രോഡ് (N.H.E.) സാധാരണ ഇലക്ട്രോഡായി തിരഞ്ഞെടുത്തു; 1.01H 10 5 Pa (1 atm.) മർദ്ദത്തിൽ ഹൈഡ്രജൻ വാതകം കൊണ്ട് പൂരിത പ്ലാറ്റിനം കറുപ്പ് കൊണ്ട് പൊതിഞ്ഞ പ്ലാറ്റിനം പ്ലേറ്റ് ആണ്, കൂടാതെ തെർമോഡൈനാമിക് പ്രവർത്തനമുള്ള H + അയോണുകൾ അടങ്ങിയ ലായനിയിൽ മുഴുകിയിരിക്കുന്നു. എ= 1. ആസൂത്രിതമായി, ഈ ഇലക്ട്രോഡിനെ Pt/H 2 (1.01H 10 5 Pa)/H + ( എ= 1). 2H + + 2e - ® H 2 എന്ന പ്രതികരണം അതിൽ സംഭവിക്കുന്നു. ഒരു Cu/Cu 2+ കോപ്പർ ഇലക്ട്രോഡിന്റെ സ്റ്റാൻഡേർഡ് പൊട്ടൻഷ്യൽ നിർണ്ണയിക്കാൻ, ഇനിപ്പറയുന്ന ഗാൽവാനിക് സെൽ കൂട്ടിച്ചേർക്കുക:
കൂടാതെ പകുതി-പ്രതികരണത്തിന് Cu 2+ + 2e – ® Cu അളവ് നൽകുന്നു
അതുപോലെ, Zn 2+ + 2e – ® Zn എന്ന പ്രതികരണം സംഭവിക്കുന്ന Zn/Zn 2+ അർദ്ധ സെല്ലിന്, നമുക്ക് ലഭിക്കും
ഈ രണ്ട് സ്റ്റാൻഡേർഡ് ഇലക്ട്രോഡ് പൊട്ടൻഷ്യലുകൾ തമ്മിലുള്ള വ്യത്യാസം Zn-Cu മൂലകത്തിന്റെ സ്റ്റാൻഡേർഡ് പൊട്ടൻഷ്യലിന് തുല്യമാണ്.
വാസ്തവത്തിൽ, ഹൈഡ്രജൻ ഇലക്ട്രോഡ് പൊട്ടൻറിയോമെട്രിക് അളവുകളിൽ വളരെ അപൂർവമായി മാത്രമേ ഉപയോഗിക്കുന്നുള്ളൂ, കാരണം ഇത് പ്രായോഗികമായി നടപ്പിലാക്കാൻ ബുദ്ധിമുട്ടുള്ള ഒരു അനുയോജ്യമായ സംവിധാനത്തെ പ്രതിനിധീകരിക്കുന്നു. മിക്കപ്പോഴും, വിവിധ തരത്തിലുള്ള കൂടുതൽ സൗകര്യപ്രദവും ഒതുക്കമുള്ളതുമായ താരതമ്യ ഇലക്ട്രോഡുകൾ ഉപയോഗിക്കുന്നു, കറന്റുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ ഒരു നിർദ്ദിഷ്ട, ശ്രദ്ധാപൂർവ്വം അളന്ന സാധ്യതയുള്ള മൂല്യമുണ്ട്. സാധാരണയായി അവർ മെറ്റാലിക് മെർക്കുറി, മെർക്കുറി ക്ലോറൈഡ് (കലോമെൽ), പൊട്ടാസ്യം ക്ലോറൈഡിന്റെ ലായനി എന്നിവ അടങ്ങിയ ഒരു കലോമെൽ ഇലക്ട്രോഡ് (CE) ഉപയോഗിക്കുന്നു: Hg /Hg 2 Cl 2 /KCl. ഇലക്ട്രോഡിൽ ഇനിപ്പറയുന്ന പ്രതികരണം സംഭവിക്കുന്നു:
സാധ്യതയുള്ള കെ.ഇ. മെർക്കുറി അയോണുകളുടെ സാന്ദ്രതയെ ആശ്രയിച്ചിരിക്കുന്നു, രണ്ടാമത്തേത് KCl ലായനിയുടെ സാന്ദ്രതയെ ആശ്രയിച്ചിരിക്കുന്നു. പൂരിത KCl പരിഹാരത്തിനായി ഇ° (k.e.) av = 0.2412 V (n.e.) 25 ° C.
|
സ്റ്റാൻഡേർഡ് ഇലക്ട്രോഡ് സാധ്യതകൾ |
|
| ഇലക്ട്രോഡ് പ്രതികരണം |
ഇഒ, വി |
| Li + + e – ® Li | |
| Mg 2+ + 2e – ® Mg | |
| Al 3+ + 3e – ® Al | |
| Zn 2+ + 2e - ® Zn | |
| Cr 3+ + e – ® Cr 2+ | |
| 2H + + 2e – ® H 2 | |
| Cu 2+ + 2e – ® Cu | |
| Fe 3+ + e – ® Fe 2+ | |
| O 2 + 4H + + 4e – ® 2H 2 O | |
| Cl 2 + 2e - ® 2Cl - | |
| F 2 + 2e – ® 2F – | |
ചില ഇലക്ട്രോഡുകളുടെ പദാർത്ഥം അനുബന്ധ പ്രതിപ്രവർത്തനത്തിന്റെ സമവാക്യത്തിൽ ഉൾപ്പെടുത്തിയിട്ടില്ല എന്നത് ശ്രദ്ധിക്കുക. അതെ, പ്രതികരണം
Pt/Fe 3+, Fe 2+ സെല്ലിലെ പ്ലാറ്റിനം ഇലക്ട്രോഡിലാണ് യഥാർത്ഥത്തിൽ സംഭവിക്കുന്നത്. പ്ലാറ്റിനം ഇലക്ട്രോഡ് നിഷ്ക്രിയമാണ്, മൂലകത്തിന്റെ ഓക്സിഡൈസ് ചെയ്തതും കുറഞ്ഞതുമായ രൂപങ്ങൾ അടങ്ങിയ ഇലക്ട്രോലൈറ്റുമായി മാത്രം സമ്പർക്കം നൽകുന്നു (ഈ സാഹചര്യത്തിൽ, ഡൈവാലന്റ്, ട്രൈവാലന്റ് ഇരുമ്പ് അയോണുകൾ). പ്ലാറ്റിനം ഇലക്ട്രോഡ് എൻ.വി.ഇ.യിൽ അതേ പങ്ക് വഹിക്കുന്നു.
ഇലക്ട്രോഡ് സാധ്യതകളുടെ പട്ടികകൾ അതിന്റെ ഇലക്ട്രോഡ് സാധ്യതകളെ അടിസ്ഥാനമാക്കി ഒരു ഗാൽവാനിക് സെല്ലിന്റെ EMF കണക്കാക്കാൻ നിങ്ങളെ അനുവദിക്കുന്നു. ഒരു പ്രത്യേക റെഡോക്സ് പ്രതികരണം സംഭവിക്കുമോ എന്ന് പ്രവചിക്കാനും അവ ഉപയോഗിക്കാം. പ്രതികരണത്തിൽ പങ്കെടുക്കുന്ന ഘടകങ്ങളുടെ പ്രവർത്തനം 1 ന് തുല്യമാകുമ്പോൾ മാത്രമേ നമുക്ക് ഒരു സാധാരണ ഇലക്ട്രോഡ് സാധ്യതയെക്കുറിച്ച് സംസാരിക്കാൻ കഴിയൂ, അതായത്. ലായനിയിൽ അവയുടെ സാന്ദ്രത 1M ന് അടുത്താണ്. ഇലക്ട്രോഡ് സാധ്യത ഇലായനിയിൽ ഓക്സിഡൈസ് ചെയ്തതും കുറഞ്ഞതുമായ രൂപങ്ങളുടെ സാന്ദ്രതയെ ആശ്രയിച്ചിരിക്കുന്നു, അവയും സ്റ്റാൻഡേർഡ് സാധ്യതയുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു ഇ° Nernst സമവാക്യം. ഒരു പൊതു പ്രതികരണത്തിനായി
കാള + എൻഇ - = ചുവപ്പ്
ഈ സമവാക്യത്തിന് ഒരു രൂപമുണ്ട്
എവിടെ ആർ- സാർവത്രിക വാതക സ്ഥിരാങ്കം, ടി- കേവല താപനില, കൂടാതെ - ഓക്സിഡൈസ് ചെയ്തതും കുറഞ്ഞതുമായ രൂപങ്ങളുടെ പ്രവർത്തനങ്ങൾ. ശുദ്ധമായ ഖരവസ്തുക്കളുടെയും ദ്രാവകങ്ങളുടെയും പ്രവർത്തനങ്ങൾ 1. 25 ഡിഗ്രി സെൽഷ്യസിൽ കണക്കാക്കുന്നു RT/F= 0.025 V. റഫറൻസ് ഇലക്ട്രോഡിന്റെ സാധ്യതയുമായി ബന്ധപ്പെട്ട ഇലക്ട്രോഡ് പൊട്ടൻഷ്യലുകൾ അളക്കുന്നതിലൂടെ, സമവാക്യം (10) ഉപയോഗിച്ച് ലായനിയിലെ പദാർത്ഥങ്ങളുടെ സാന്ദ്രത നിർണ്ണയിക്കാൻ കഴിയും; ഈ രീതിയെ പൊട്ടൻഷിയോമെട്രി എന്ന് വിളിക്കുന്നു.
ഇലക്ട്രോഡ് പ്രതികരണങ്ങൾ.
ഇലക്ട്രോകെമിക്കൽ സെല്ലിൽ വൈദ്യുത പ്രവാഹം ഇല്ലാതിരിക്കുമ്പോൾ പൊട്ടൻറിയോമെട്രിക് അളവുകൾ നടത്തുന്നു. ഇതിനർത്ഥം അതിൽ മൊത്തത്തിലുള്ള രാസമാറ്റങ്ങളൊന്നും സംഭവിക്കുന്നില്ല, കൂടാതെ പ്രതിപ്രവർത്തനങ്ങളുടെ തെർമോഡൈനാമിക്സ് അളന്ന പൊട്ടൻഷ്യൽ (സന്തുലിതാവസ്ഥ) നിർണ്ണയിക്കപ്പെടുന്നു. ഈ സാഹചര്യങ്ങളിൽ, ഇലക്ട്രോഡുകളുടെ വലുപ്പവും രൂപവും അല്ലെങ്കിൽ പരിഹാരം ഇളക്കുന്നതിന്റെ തീവ്രത പോലുള്ള ഘടകങ്ങൾ അളന്ന സാധ്യതയെ ബാധിക്കില്ല. ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിലൂടെ കറന്റ് ഒഴുകുകയാണെങ്കിൽ, ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ നിരക്ക് തെർമോഡൈനാമിക് പാരാമീറ്ററുകളെ മാത്രമല്ല, സമവാക്യത്തിന് അനുസൃതമായി നിലവിലെ ശക്തിയെയും ആശ്രയിച്ചിരിക്കുന്നു.
എവിടെ എൻ- തന്നിരിക്കുന്ന ഇലക്ട്രോഡ് പ്രതികരണത്തിൽ പങ്കെടുക്കുന്ന ഇലക്ട്രോണുകളുടെ എണ്ണം, എഫ്- ഫാരഡെ നമ്പർ. ഈ സാഹചര്യത്തിൽ, ഇലക്ട്രോകെമിക്കൽ സെല്ലിന്റെ സാധ്യതകൾ ചലനാത്മക ഘടകങ്ങളെ ആശ്രയിച്ചിരിക്കുന്നു, അതുപോലെ തന്നെ ഇലക്ട്രോഡ് നിർമ്മിച്ച മെറ്റീരിയൽ, ഇലക്ട്രോഡിന്റെ വലുപ്പവും ആകൃതിയും, ലായനി ഇളക്കുന്നതിന്റെ തീവ്രതയും മറ്റ് പല ഘടകങ്ങളും. കോശത്തിന്റെ ആന്തരിക പ്രതിരോധം അവഗണിക്കാനാവില്ല. ഇലക്ട്രോഡ്/ഇലക്ട്രോലൈറ്റ് ബൗണ്ടറികളിലെ പൊട്ടൻഷ്യൽ വ്യത്യാസത്തിന് പുറമേ, അതിന്റെ പ്രതിരോധം കാരണം, ലായനിയിൽ തന്നെ ഒരു വോൾട്ടേജ് ഡ്രോപ്പ് സംഭവിക്കുന്നു. ഈ വോൾട്ടേജ് ഡ്രോപ്പ് രണ്ട് ഇലക്ട്രോഡുകളിലും സംഭവിക്കുന്ന പ്രതിപ്രവർത്തനങ്ങളുമായി ബന്ധപ്പെട്ട ഫലങ്ങൾ പഠിക്കുന്നത് ബുദ്ധിമുട്ടാക്കുന്നു. സാധാരണയായി, മൂന്ന് ഇലക്ട്രോഡ് സെൽ (ചിത്രം 3) ഉപയോഗിച്ച് വർക്കിംഗ് അല്ലെങ്കിൽ ഇൻഡിക്കേറ്റർ ഇലക്ട്രോഡ് എന്ന് വിളിക്കുന്ന ഒരു ഇലക്ട്രോഡിലാണ് പ്രതികരണം പഠിക്കുന്നത്: മൂന്നാമത്തെ ഇലക്ട്രോഡ് (ഉദാഹരണത്തിന്, പൂരിത കാലോമെൽ) ജോലി ചെയ്യുന്ന അതേ കമ്പാർട്ട്മെന്റിൽ സ്ഥാപിച്ചിരിക്കുന്നു. ഒന്ന്, ഓമിക് വോൾട്ടേജ് ഡ്രോപ്പിന്റെ പ്രഭാവം കുറയ്ക്കുന്നതിന് അതിനോട് കഴിയുന്നത്ര അടുത്ത്. റഫറൻസ് ഇലക്ട്രോഡുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ ഈ ഇലക്ട്രോഡിന്റെ സാധ്യതയുടെ പ്രവർത്തനമായി പ്രവർത്തിക്കുന്ന ഇലക്ട്രോഡിലൂടെ വൈദ്യുതധാര അളക്കുന്നതിലൂടെ, വിളിക്കപ്പെടുന്നവ ധ്രുവീകരണ വക്രം.
ഒരു ബാഹ്യ കറന്റ് കടന്നുപോകുമ്പോൾ, ഇലക്ട്രോഡ് പൊട്ടൻഷ്യൽ സന്തുലിതാവസ്ഥയിൽ നിന്ന് വ്യത്യാസപ്പെട്ടിരിക്കുന്നു. ഈ വ്യതിയാനത്തെ ധ്രുവീകരണം എന്നും അതിന്റെ വ്യാപ്തിയെ അമിത വോൾട്ടേജ് എന്നും വിളിക്കുന്നു. അമിത വോൾട്ടേജ് ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ നിരക്ക് പരിമിതപ്പെടുത്തുന്ന നിരവധി ഘടകങ്ങളെ ആശ്രയിച്ചിരിക്കുന്നു. ഒരു നിശ്ചിത വൈദ്യുത സാന്ദ്രതയിൽ (യൂണിറ്റ് ഇലക്ട്രോഡ് പ്രതലത്തിൽ നിലവിലുള്ള ശക്തി) വേഗത്തിലുള്ള ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങൾ തെർമോഡൈനാമിക്സിന് അടുത്തുള്ള പൊട്ടൻഷ്യലുകളിൽ സംഭവിക്കുന്നു, അതിനാൽ കുറഞ്ഞ ഓവർ വോൾട്ടേജിൽ. മന്ദഗതിയിലുള്ള പ്രതികരണങ്ങൾ ഉയർന്ന വോൾട്ടേജിന്റെ സവിശേഷതയാണ്. ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ നിരക്ക്, അതിനാൽ അമിത വോൾട്ടേജ്, റിയാക്ടറുകളുടെ സാന്ദ്രത, താപനില, ലായകങ്ങൾ, ഇലക്ട്രോഡ് മെറ്റീരിയൽ, പിണ്ഡം കൈമാറ്റം ചെയ്യുന്ന രീതി, വേഗത, നിലവിലെ സാന്ദ്രത എന്നിവയെ ആശ്രയിച്ചിരിക്കുന്നു. മൊത്തം അമിത വോൾട്ടേജ് പല ഘടകങ്ങളായി വിഘടിപ്പിക്കാം: ഏകാഗ്രത, സജീവമാക്കൽ, പ്രതികരണം.
ഒരു കറന്റ് കടന്നുപോകുമ്പോൾ, ഇലക്ട്രോഡിന്റെ ഉപരിതലത്തിൽ പ്രതിപ്രവർത്തിക്കുന്ന അയോണിന്റെ സാന്ദ്രത മാറുന്നു എന്ന വസ്തുതയാണ് കോൺസൺട്രേഷൻ ഓവർ വോൾട്ടേജിന് കാരണമാകുന്നത്, കാരണം ഈ പ്രദേശത്ത് ഇലക്ട്രോ ആക്റ്റീവ് പദാർത്ഥങ്ങൾ കഴിക്കുകയും പ്രതികരണ ഉൽപ്പന്നങ്ങൾ രൂപപ്പെടുകയും ചെയ്യുന്നു. ഒരു ചെമ്പ് ഇലക്ട്രോഡിൽ Cu 2+ ന്റെ കുറവ് നമുക്ക് പരിഗണിക്കാം. തുടക്കത്തിൽ, ലായനിയിലെ Cu 2+ ന്റെ സാന്ദ്രത 1M ആണ്. സർക്യൂട്ടിലെ നിലവിലെ അഭാവത്തിൽ, ചെമ്പ് ഇലക്ട്രോഡിന്റെ സാധ്യത Cu / Cu 2+ ജോഡിയുടെ സ്റ്റാൻഡേർഡ് പൊട്ടൻഷ്യലിന് അടുത്താണ്, അതായത്. 0.34 V ആപേക്ഷികമായി N.E. [ സെമി. സമവാക്യം (6)]. കാഥോഡ് കറന്റ് കടന്നുപോകുമ്പോൾ, ഇലക്ട്രോഡ് പ്രതലത്തിൽ Cu 2+ അയോണുകളുടെ സാന്ദ്രത കുറയുന്നു, കൂടാതെ Nernst സമവാക്യം (10) അനുസരിച്ച് കാഥോഡ് പൊട്ടൻഷ്യൽ കൂടുതൽ നെഗറ്റീവ് ആയി മാറുന്നു. ലായനിയിൽ നിന്ന് ഇലക്ട്രോഡിലേക്ക് റിയാജന്റെ പുതിയ ഭാഗങ്ങൾ വ്യത്യസ്ത രീതികളിൽ എത്തിച്ചേരുന്നു: വ്യാപനം, സംവഹനം, മൈഗ്രേഷൻ എന്നിവയുടെ ഫലമായി. ഈ പ്രക്രിയകളുടെ ഉയർന്ന വേഗത (ഉദാഹരണത്തിന്, കൂടുതൽ തീവ്രമായ മിശ്രിതം), കോൺസൺട്രേഷൻ അമിത വോൾട്ടേജ് കുറയുന്നു. മൊത്തം അമിത വോൾട്ടേജിന്റെ ഈ ഘടകം പലപ്പോഴും കണക്കാക്കാം. ഏകാഗ്രത ധ്രുവീകരണം മൊത്തം അമിത വോൾട്ടേജിലേക്ക് പ്രധാന സംഭാവന നൽകുന്നുവെങ്കിൽ (ഇതിനർത്ഥം ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനത്തിന്റെ ശേഷിക്കുന്ന ഘട്ടങ്ങളുടെ നിരക്ക് ഉയർന്നതാണെന്നാണ്), അപ്പോൾ പ്രതികരണത്തെ റിവേഴ്സിബിൾ അല്ലെങ്കിൽ നേർൺസ്റ്റിയൻ എന്ന് വിളിക്കുന്നു.
ഇലക്ട്രോഡ് ഉപരിതലത്തിൽ ഇലക്ട്രോൺ കൈമാറ്റം തൽക്ഷണം സംഭവിക്കുന്നില്ല, പക്ഷേ ഒരു നിശ്ചിത വേഗതയിൽ സംഭവിക്കുന്ന വസ്തുതയുടെ ഫലമായാണ് ആക്ടിവേഷൻ ഓവർവോൾട്ടേജ് സംഭവിക്കുന്നത്. നമുക്ക് സാമാന്യവൽക്കരിച്ച ഇലക്ട്രോഡ് പ്രതികരണം ഓക്സ് + പരിഗണിക്കാം എൻഇ - = ചുവപ്പ്. ഒരു നിശ്ചിത നിരക്കിൽ (അതായത്, ഒരു നിശ്ചിത നിലവിലെ സാന്ദ്രതയിൽ) ഇലക്ട്രോണുകളെ ഓക്സിഡൈസ്ഡ് സംയുക്തങ്ങളിലേക്ക് മാറ്റുന്നതിന്, ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനത്തിന്റെ സജീവമാക്കൽ ഊർജ്ജം എന്ന് വിളിക്കപ്പെടുന്ന ഒരു ഊർജ്ജ തടസ്സം മറികടക്കാൻ അത് ആവശ്യമാണ്. ഈ ഊർജ്ജം നൽകുന്നത് പ്രയോഗിച്ച പൊട്ടൻഷ്യൽ വഴിയാണ്. നിലവിലെ സാന്ദ്രതയും ആക്റ്റിവേഷൻ ഓവർ വോൾട്ടേജും തമ്മിലുള്ള ബന്ധം ബട്ട്ലർ-വോൾമർ, ടാഫെൽ സമവാക്യങ്ങൾ വിവരിക്കുന്നു, ഇത് ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ ചലനാത്മക പാരാമീറ്ററുകൾ നിർണ്ണയിക്കാൻ ഉപയോഗിക്കാം. ജലത്തെ ഹൈഡ്രജനിലേക്ക് കുറയ്ക്കുന്നതും ഓക്സിജനിലേക്കുള്ള ഓക്സീകരണം പോലെയുള്ള പല ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളും സാവധാനത്തിൽ സംഭവിക്കുന്നു. ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനത്തിന്റെ നിരക്ക് ഇലക്ട്രോഡ് നിർമ്മിച്ച മെറ്റീരിയലിനെയും അതിന്റെ ഉപരിതലത്തിന്റെ ഗുണങ്ങളെയും ആശ്രയിച്ചിരിക്കുന്നു. ഉദാഹരണത്തിന്, ഒരു മെർക്കുറി ഇലക്ട്രോഡിൽ, ജലത്തെ ഹൈഡ്രജനിലേക്ക് കുറയ്ക്കുന്നത് വളരെ ബുദ്ധിമുട്ടാണ്: ഉയർന്ന ഹൈഡ്രജൻ അമിത വോൾട്ടേജാണ് ഇതിന്റെ സവിശേഷത. ഈ പ്രതികരണം വളരെ വേഗത്തിലും പ്ലാറ്റിനത്തിൽ കുറഞ്ഞ ഓവർ വോൾട്ടേജിലും സംഭവിക്കുന്നു; ഈ കാരണത്താലാണ് ഹൈഡ്രജൻ റഫറൻസ് ഇലക്ട്രോഡിൽ പ്ലാറ്റിനം ഉപയോഗിക്കുന്നത്. പ്രതിപ്രവർത്തനങ്ങളുടെ നിരക്ക് ഇലക്ട്രോഡ് ഉപരിതലത്തിലേക്ക് ആഗിരണം ചെയ്യപ്പെടുന്നതോ ബന്ധിക്കപ്പെട്ടതോ ആയ പദാർത്ഥങ്ങളെ ആശ്രയിച്ചിരിക്കുന്നു; അങ്ങനെ, സയനൈഡ് അയോണും നിരവധി ജൈവ സംയുക്തങ്ങളും പ്ലാറ്റിനം ഇലക്ട്രോഡിന്റെ ഉപരിതലത്തിൽ ഹൈഡ്രജൻ പരിണാമത്തിന്റെ നിരക്ക് കുറയ്ക്കുന്നു. അതേ സമയം, ചില സർഫക്ടാന്റുകൾക്ക് ഇലക്ട്രോഡ് പ്രതികരണത്തിന്റെ നിരക്ക് ഗണ്യമായി വർദ്ധിപ്പിക്കാൻ കഴിയും - അവയെ ഇലക്ട്രോകാറ്റലിസ്റ്റുകൾ എന്ന് വിളിക്കുന്നു.
ഇലക്ട്രോഡിലെ ഇലക്ട്രോണുകളുടെ കൈമാറ്റം ലായനിയിലെ ഒരു രാസപ്രവർത്തനത്തോടൊപ്പം ചേരുമ്പോൾ പ്രതിപ്രവർത്തന അമിത വോൾട്ടേജ് സംഭവിക്കുന്നു. അത്തരം ഒരു പ്രതികരണം ഇലക്ട്രോൺ കൈമാറ്റത്തിൽ ഉൾപ്പെട്ടിരിക്കുന്ന കണങ്ങളുടെ ഉറവിടമായി വർത്തിക്കും, അതേ സമയം മുഴുവൻ ഇലക്ട്രോഡ് പ്രക്രിയയുടെ നിരക്ക് പരിമിതപ്പെടുത്തുന്നു. അതുകൊണ്ടാണ് ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ മെക്കാനിസത്തിന്റെ (അതായത്, ഘട്ടങ്ങളും ഇന്റർമീഡിയറ്റ് അവസ്ഥകളും) വിശദാംശങ്ങൾ അറിയേണ്ടത് വളരെ പ്രധാനമായത്. മിക്ക കേസുകളിലും, ഇലക്ട്രോഡിലെ അന്തിമ ഉൽപ്പന്നമാകുന്നതിന് മുമ്പ് ആരംഭ മെറ്റീരിയൽ നിരവധി പരിവർത്തനങ്ങൾക്ക് വിധേയമാകുന്നു, ജലത്തിലേക്ക് ഓക്സിജൻ കുറയ്ക്കുന്ന കാര്യത്തിലെന്നപോലെ, വലിയ പ്രായോഗിക പ്രാധാന്യമുള്ള ഒരു പ്രക്രിയ. മൊത്തം പ്രതികരണത്തിന് ഒരു രൂപമുണ്ട്
കൂടാതെ നിരവധി ഘട്ടങ്ങൾ ഉൾക്കൊള്ളുന്നു, അവയിലൊന്നിൽ ഓക്സിജൻ-ഓക്സിജൻ ബന്ധനം തകരാറിലാകുന്നു. ഈ മൾട്ടി-സ്റ്റേജ് പ്രതികരണം കാരണം, മിക്ക ഇലക്ട്രോഡുകളിലെയും പ്രതികരണം മന്ദഗതിയിലാണ്, കൂടാതെ വ്യാവസായിക തലത്തിൽ ഇത് ഇലക്ട്രോകാറ്റലിസ്റ്റുകളുടെ സാന്നിധ്യത്തിൽ നടക്കുന്നു. താഴെ വിവരിച്ചിരിക്കുന്ന ഇലക്ട്രോ അനലിറ്റിക്കൽ രീതികൾ ഉപയോഗിച്ച് ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ സംവിധാനം പഠിക്കുന്നു. ലായനിയുടെ ഘടനയും ലായകത്തിന്റെ സ്വഭാവവും മാറുമ്പോൾ പലപ്പോഴും പ്രതികരണത്തിന്റെ ഗതി മാറുന്നു. ഉദാഹരണത്തിന്, പ്രോട്ടോണുകളുടെ കുറവുള്ള അസെറ്റോണിട്രൈലിലെ ഓക്സിജന്റെ കുറവ് ലളിതമായ ഒരു ഇലക്ട്രോൺ മെക്കാനിസത്തിന് അനുസൃതമായി നടക്കുന്നു:
വിശകലനത്തിന്റെ ഇലക്ട്രോകെമിക്കൽ രീതികൾ.
രാസവസ്തുക്കളുടെ ഗുണപരവും അളവ്പരവുമായ വിശകലനത്തിനായി വിവിധ ഇലക്ട്രോകെമിക്കൽ രീതികൾ വികസിപ്പിച്ചെടുത്തിട്ടുണ്ട്, ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ തെർമോഡൈനാമിക്, ഗതികോർജ്ജ പാരാമീറ്ററുകൾ നിർണ്ണയിക്കുന്നതിനും അവയുടെ സംവിധാനങ്ങൾ പഠിക്കുന്നതിനും ഇത് പലപ്പോഴും ഉപയോഗപ്രദമാണ്.
കണ്ടക്റ്റോമെട്രി
ഒരു ലായനിയുടെ വൈദ്യുതചാലകത അളക്കുന്നതിനെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്, ലവണങ്ങൾ, ആസിഡുകൾ, ബേസുകൾ മുതലായവയുടെ സാന്ദ്രത നിർണ്ണയിക്കാൻ ഇത് ഉപയോഗിക്കുന്നു. കണ്ടക്ടോമെട്രിക് നിർണ്ണയങ്ങളിൽ, സമാന പദാർത്ഥങ്ങളാൽ നിർമ്മിച്ച ഇലക്ട്രോഡുകൾ സാധാരണയായി ഉപയോഗിക്കുന്നു, ഇലക്ട്രോഡ്/ഇലക്ട്രോലൈറ്റ് ഇന്റർഫേസുകളിലെ പൊട്ടൻഷ്യൽ ജമ്പുകളുടെ സംഭാവന കുറയ്ക്കുന്ന തരത്തിൽ അവയുടെ പെരുമാറ്റത്തിനുള്ള വ്യവസ്ഥകൾ തിരഞ്ഞെടുക്കപ്പെടുന്നു (ഉദാഹരണത്തിന്, ഉയർന്ന ഫ്രീക്വൻസി ആൾട്ടർനേറ്റിംഗ് കറന്റ് ഉപയോഗിക്കുന്നു. ). ഈ സാഹചര്യത്തിൽ, അളന്ന സെൽ സാധ്യതകളിലേക്കുള്ള പ്രധാന സംഭാവന ഓമിക് വോൾട്ടേജ് ഡ്രോപ്പ് ആണ് ഐ.ആർ, എവിടെ ആർ- പരിഹാര പ്രതിരോധം. ഒരു ഘടക ലായനിയുടെ വൈദ്യുതചാലകത അതിന്റെ ഏകാഗ്രതയുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു, കൂടാതെ സങ്കീർണ്ണമായ ഘടനയുടെ ഇലക്ട്രോലൈറ്റുകളുടെ വൈദ്യുതചാലകത അളക്കുന്നത് ലായനിയിലെ മൊത്തം അയോണിന്റെ ഉള്ളടക്കം കണക്കാക്കാൻ ഒരാളെ അനുവദിക്കുന്നു, ഉദാഹരണത്തിന്, വാറ്റിയെടുത്തതിന്റെ ഗുണനിലവാരം നിരീക്ഷിക്കാൻ ഇത് ഉപയോഗിക്കുന്നു. അല്ലെങ്കിൽ ഡീയോണൈസ്ഡ് വെള്ളം. മറ്റൊരു തരം കണ്ടക്ടോമെട്രിയിൽ - കണ്ടക്ടോമെട്രിക് ടൈറ്ററേഷൻ - വിശകലനം ചെയ്ത ലായനിയിൽ അറിയപ്പെടുന്ന ഒരു റിയാജൻറ് ഭാഗങ്ങളിൽ ചേർക്കുന്നു, കൂടാതെ വൈദ്യുതചാലകതയിലെ മാറ്റം നിരീക്ഷിക്കുന്നു. വൈദ്യുതചാലകതയിൽ മൂർച്ചയുള്ള മാറ്റം രേഖപ്പെടുത്തുന്ന തുല്യതാ പോയിന്റ്, ചേർത്ത റീജന്റെ അളവിലുള്ള ഈ മൂല്യത്തിന്റെ ആശ്രിതത്വത്തിന്റെ ഗ്രാഫിൽ നിന്നാണ് നിർണ്ണയിക്കുന്നത്.
പൊട്ടൻഷ്യോമെട്രി
ഗാൽവാനിക് സെല്ലിന്റെ സാധ്യതയെക്കുറിച്ചുള്ള ഡാറ്റയെ അടിസ്ഥാനമാക്കി വിവിധ ഫിസിക്കോകെമിക്കൽ പാരാമീറ്ററുകൾ നിർണ്ണയിക്കാൻ ഉപയോഗിക്കുന്നു. ഇലക്ട്രോകെമിക്കൽ സർക്യൂട്ടിലെ വൈദ്യുതധാരയുടെ അഭാവത്തിൽ ഇലക്ട്രോഡ് സാധ്യത, റഫറൻസ് ഇലക്ട്രോഡുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ അളക്കുന്നത്, നേർൺസ്റ്റ് സമവാക്യം വഴിയുള്ള പരിഹാരത്തിന്റെ സാന്ദ്രതയുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു. പൊട്ടൻറിയോമെട്രിക് അളവുകളിൽ, അയോൺ-സെലക്ടീവ് ഇലക്ട്രോഡുകൾ വ്യാപകമായി ഉപയോഗിക്കപ്പെടുന്നു, അത് ലായനിയിലെ ഒരു അയോണിനോട് പ്രാഥമികമായി സെൻസിറ്റീവ് ആണ്: പിഎച്ച് അളക്കുന്നതിനുള്ള ഒരു ഗ്ലാസ് ഇലക്ട്രോഡും സോഡിയം, അമോണിയം, ഫ്ലൂറിൻ, കാൽസ്യം, മഗ്നീഷ്യം മുതലായവ തിരഞ്ഞെടുക്കുന്നതിനുള്ള ഇലക്ട്രോഡുകളും. അയോൺ-സെലക്ടീവ് ഇലക്ട്രോഡിന്റെ പാളിയിൽ എൻസൈമുകൾ ഉൾപ്പെടാം, ഫലം ഉചിതമായ അടിവസ്ത്രത്തോട് സംവേദനക്ഷമതയുള്ള ഒരു സംവിധാനമാണ്. ഒരു അയോൺ-സെലക്ടീവ് ഇലക്ട്രോഡിന്റെ സാധ്യത നിർണ്ണയിക്കുന്നത് ഇലക്ട്രോണിക് ചാലകതയുള്ള പദാർത്ഥങ്ങളുടെ കാര്യത്തിലെന്നപോലെ ഇലക്ട്രോണുകളുടെ കൈമാറ്റം കൊണ്ടല്ല, മറിച്ച് പ്രധാനമായും അയോണുകളുടെ കൈമാറ്റം അല്ലെങ്കിൽ കൈമാറ്റം വഴിയാണ്. എന്നിരുന്നാലും, ലായനിയിലെ ഒരു പദാർത്ഥത്തിന്റെ സാന്ദ്രതയുടെ (അല്ലെങ്കിൽ പ്രവർത്തനത്തിന്റെ) ലോഗരിതവുമായി ഇലക്ട്രോഡ് സാധ്യതയെ ബന്ധപ്പെടുത്തുന്ന നേർൺസ്റ്റ് സമവാക്യം അത്തരം ഒരു ഇലക്ട്രോഡിനും ബാധകമാണ്. പൊട്ടൻറിയോമെട്രിക് ടൈറ്ററേഷനിൽ, ഭാഗങ്ങളിൽ വിശകലനം ചെയ്യുന്ന ലായനിയിൽ റിയാജന്റ് ചേർക്കുന്നു, സാധ്യതയിലെ മാറ്റം നിരീക്ഷിക്കുന്നു. ഇത്തരത്തിലുള്ള ടൈറ്ററേഷന്റെ സവിശേഷതയായ എസ്-ആകൃതിയിലുള്ള വളവുകൾ തുല്യതാ പോയിന്റ് നിർണ്ണയിക്കാനും സന്തുലിത സ്ഥിരാങ്കവും സ്റ്റാൻഡേർഡ് പൊട്ടൻഷ്യൽ പോലുള്ള തെർമോഡൈനാമിക് പാരാമീറ്ററുകൾ കണ്ടെത്താനും അനുവദിക്കുന്നു.
വോൾട്ടമെട്രി.
എല്ലാ തരത്തിലുള്ള വോൾട്ടമെട്രിക് രീതികളും 10-7-10-1 സെന്റീമീറ്റർ വിസ്തീർണ്ണമുള്ള ഒരു പ്രവർത്തന മൈക്രോഇലക്ട്രോഡ് ഉപയോഗിക്കുന്നു. അതിന്റെ സഹായത്തോടെ ലഭിച്ച നിലവിലെ വോൾട്ടേജ് കർവുകൾ അലിഞ്ഞുചേർന്ന പദാർത്ഥങ്ങളെ തിരിച്ചറിയാനും അവയുടെ സാന്ദ്രത നിർണ്ണയിക്കാനും പലപ്പോഴും തെർമോഡൈനാമിക്, ചലനാത്മക പാരാമീറ്ററുകൾ സാധ്യമാക്കുന്നു. ആദ്യത്തെ വോൾട്ടമെട്രിക് രീതി - പോളറോഗ്രാഫി - 1922 ൽ ചെക്ക് രസതന്ത്രജ്ഞനായ ജെ ഹെയ്റോവ്സ്കി നിർദ്ദേശിച്ചു. അദ്ദേഹത്തിന്റെ സജ്ജീകരണത്തിലെ പ്രവർത്തിക്കുന്ന ഇലക്ട്രോഡ് ഒരു തുള്ളി മെർക്കുറി ഇലക്ട്രോഡായിരുന്നു. മെർക്കുറിക്ക് ഉയർന്ന ഹൈഡ്രജൻ അമിത വോൾട്ടേജ് ഉണ്ട്, അതിനാൽ നെഗറ്റീവ് പൊട്ടൻഷ്യലിൽ സംഭവിക്കുന്ന പ്രക്രിയകൾ പഠിക്കാൻ മെർക്കുറി ഇലക്ട്രോഡ് സൗകര്യപ്രദമാണ്. അളവെടുപ്പ് പ്രക്രിയയിൽ ഇലക്ട്രോഡ് ഉപരിതലം നിരന്തരം പുതുക്കുന്നു, ഇത് ഇലക്ട്രോഡിന്റെ മലിനീകരണം ഇല്ലാതാക്കുന്നു. പ്ലാറ്റിനം, കാർബൺ തുടങ്ങിയ സോളിഡ് ഇലക്ട്രോഡുകൾ ഉപയോഗിച്ചും പോസിറ്റീവ് സാധ്യതകളിൽ സംഭവിക്കുന്ന പ്രക്രിയകൾ ഉപയോഗിച്ചും വോൾട്ടമെട്രിക് പഠനങ്ങൾ നടത്തുന്നു. ലീനിയർ പൊട്ടൻഷ്യൽ സ്വീപ്പ് വോൾട്ടാമെട്രിയിൽ (ക്രോണോആംപെറോമെട്രി), സമയത്തിനനുസരിച്ച് പൊട്ടൻഷ്യൽ രേഖീയമായി മാറുന്നു, പരിഹാരം ഇളക്കിവിടുന്നില്ല, അതിനാൽ പിണ്ഡം കൈമാറ്റം സംഭവിക്കുന്നത് വ്യാപനം മൂലമാണ്. ചാക്രിക വോൾട്ടമിട്രിയിൽ, ആവർത്തിച്ചുള്ള ത്രികോണ വോൾട്ടേജ് പൾസുകൾ ഒരു ഇലക്ട്രോഡിൽ പ്രയോഗിക്കുന്നു. സൈക്കിളിന്റെ ആരോഹണ വിഭാഗത്തിൽ രൂപപ്പെടുന്ന പദാർത്ഥങ്ങൾ അതിന്റെ അവരോഹണ വിഭാഗത്തിൽ പഠിക്കുന്നു. വ്യത്യസ്ത സാധ്യതയുള്ള സ്വീപ്പ് നിരക്കുകളിലും വ്യത്യസ്ത പരിഹാര സാന്ദ്രതകളിലും ധ്രുവീകരണ കർവുകൾ വിശകലനം ചെയ്തുകൊണ്ട് ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ സംവിധാനം പഠിക്കാൻ ഈ രീതി പ്രത്യേകിച്ചും ഫലപ്രദമാണ്. മറ്റ് തരത്തിലുള്ള വോൾട്ടാമെട്രി ഉണ്ട് - ഡിഫറൻഷ്യൽ പൾസ്, സ്ക്വയർ വേവ് - ഇതിൽ വ്യത്യസ്ത ആകൃതിയിലുള്ള വോൾട്ടേജ് പൾസുകൾ രേഖീയമായി വർദ്ധിക്കുന്ന സാധ്യതയിൽ സൂപ്പർഇമ്പോസ് ചെയ്യുന്നു. ലായനിയിലെ പദാർത്ഥങ്ങളുടെ ചെറിയ സാന്ദ്രത നിർണ്ണയിക്കാൻ ഈ രീതികൾ വ്യാപകമായി ഉപയോഗിക്കുന്നു. ഒരു വോൾട്ടാമെട്രിക് അളക്കൽ സമയത്ത് പരിഹാരം മിക്സഡ് ആണെങ്കിൽ, അതായത് സംവഹനവും വ്യാപനവും ഉപയോഗിച്ച് ഒരേസമയം പിണ്ഡ കൈമാറ്റം സംഭവിക്കുന്നു, ഞങ്ങൾ ഹൈഡ്രോഡൈനാമിക് വോൾട്ടാമെട്രിയെക്കുറിച്ച് സംസാരിക്കുന്നു. ഈ സാഹചര്യത്തിൽ, ഒരു കറങ്ങുന്ന ഡിസ്ക് ഇലക്ട്രോഡ് ഉപയോഗിക്കുന്നത് സൗകര്യപ്രദമാണ്, കാരണം പരീക്ഷണാത്മക കറന്റ്-വോൾട്ടേജ് കർവുകൾ സൈദ്ധാന്തികവയുമായി നേരിട്ട് താരതമ്യം ചെയ്യാം.
ആമ്പറോമെട്രി.
ഇൻഡിക്കേറ്റർ ഇലക്ട്രോഡിനും റഫറൻസ് ഇലക്ട്രോഡിനും ഇടയിലുള്ള ഒരു നിശ്ചിത വോൾട്ടേജിൽ ഒരു ലായനിയിലൂടെ കടന്നുപോകുന്ന പരിമിതപ്പെടുത്തുന്ന ഡിഫ്യൂഷൻ കറന്റ് അളക്കുന്നതിനെ അടിസ്ഥാനമാക്കിയുള്ളതാണ് ഈ രീതി. ആംപിറോമെട്രിക് ടൈറ്ററേഷനിൽ, നിലവിലെ വക്രതയിലെ ഇടവേളയാണ് തുല്യത പോയിന്റ് നിർണ്ണയിക്കുന്നത് - ചേർത്ത പ്രവർത്തന പരിഹാരത്തിന്റെ അളവ്. ക്രോണോഅമ്പറോമെട്രിക് രീതികൾ സമയത്തെ വൈദ്യുതധാരയുടെ ആശ്രിതത്വം അളക്കുന്നതിനെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്, അവ പ്രധാനമായും ഡിഫ്യൂഷൻ കോഫിഫിഷ്യന്റുകളും റേറ്റ് കോൺസ്റ്റന്റുകളും നിർണ്ണയിക്കാൻ ഉപയോഗിക്കുന്നു. ലിക്വിഡ് ക്രോമാറ്റോഗ്രാഫ് നിരകളുടെ ഔട്ട്പുട്ടിൽ സെൻസറുകളായി പ്രവർത്തിക്കുന്ന മിനിയേച്ചർ ഇലക്ട്രോകെമിക്കൽ സെല്ലുകൾ ആംപിറോമെട്രി (അതുപോലെ വോൾട്ടാമെട്രി) തത്വത്തിൽ പ്രവർത്തിക്കുന്നു. ഗാൽവനോസ്റ്റാറ്റിക് രീതികൾ ആമ്പറോമെട്രിക് രീതികൾക്ക് സമാനമാണ്, എന്നാൽ സെല്ലിലൂടെ ഒരു നിശ്ചിത അളവ് കറന്റ് കടന്നുപോകുമ്പോൾ അവ സാധ്യതകൾ അളക്കുന്നു. അങ്ങനെ, ക്രോണോപൊട്ടൻഷിയോമെട്രിയിൽ, കാലക്രമേണ സാധ്യതയിലെ മാറ്റം നിയന്ത്രിക്കപ്പെടുന്നു. ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ ചലനാത്മകത പഠിക്കാൻ ഈ രീതികൾ പ്രധാനമായും ഉപയോഗിക്കുന്നു.
കൂലോമെട്രി.
കൂലോമെട്രിയിൽ, ഒരു നിയന്ത്രിത ശേഷിയിൽ, ഒരു ലായനിയുടെ സമ്പൂർണ്ണ വൈദ്യുതവിശ്ലേഷണം ഒരു ഇലക്ട്രോലൈസറിൽ താരതമ്യേന വലിയ പ്രവർത്തന ഇലക്ട്രോഡുമായി (താഴെ മെർക്കുറി അല്ലെങ്കിൽ പ്ലാറ്റിനം മെഷ്) കലർത്തിയാണ് നടത്തുന്നത്. വൈദ്യുതിയുടെ ആകെ തുക ( ക്യു, സി) വൈദ്യുതവിശ്ലേഷണത്തിന് ആവശ്യമായ പദാർത്ഥത്തിന്റെ അളവുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു ( എ, d) ഫാരഡെയുടെ നിയമം:
എവിടെ എം- അവർ പറയുന്നു പിണ്ഡം (g/mol), എഫ്- ഫാരഡെ നമ്പർ. നിർണ്ണയിച്ചിരിക്കുന്ന പദാർത്ഥവുമായി പ്രതിപ്രവർത്തിക്കുന്ന ഒരു റിയാഗെന്റ് വൈദ്യുതവിശ്ലേഷണമായി സൃഷ്ടിക്കുന്നതിന് സ്ഥിരമായ വൈദ്യുതധാര ഉപയോഗിക്കുന്നത് കൂലോമെട്രിക് ടൈറ്ററേഷനിൽ ഉൾപ്പെടുന്നു. ടൈറ്ററേഷന്റെ പുരോഗതി പൊട്ടൻറിയോമെട്രിക് അല്ലെങ്കിൽ ആംപിറോമെട്രിക് ആയി നിയന്ത്രിക്കപ്പെടുന്നു. കൂലോമെട്രിക് രീതികൾ സൗകര്യപ്രദമാണ്, കാരണം അവ കേവല സ്വഭാവമുള്ളതാണ് (അതായത്, കാലിബ്രേഷൻ കർവുകൾ അവലംബിക്കാതെ തന്നെ അനലിറ്റിന്റെ അളവ് കണക്കാക്കാൻ അവ നിങ്ങളെ അനുവദിക്കുന്നു) കൂടാതെ വൈദ്യുതവിശ്ലേഷണ അവസ്ഥകളിലെയും ഇലക്ട്രോലൈസർ പാരാമീറ്ററുകളിലെയും (ഇലക്ട്രോഡ് ഉപരിതല വിസ്തീർണ്ണം അല്ലെങ്കിൽ ഇളക്കിവിടുന്ന തീവ്രത) മാറ്റങ്ങളോട് സംവേദനക്ഷമതയില്ലാത്തവയാണ്. കൊളോഗ്രാവിമെട്രിയിൽ, വൈദ്യുതവിശ്ലേഷണത്തിന് വിധേയമായ പദാർത്ഥത്തിന്റെ അളവ് നിർണ്ണയിക്കുന്നത് വൈദ്യുതവിശ്ലേഷണത്തിന് മുമ്പും ശേഷവും ഇലക്ട്രോഡ് തൂക്കിക്കൊണ്ടാണ്.
മറ്റ് ഇലക്ട്രോ അനലിറ്റിക്കൽ രീതികളുണ്ട്. ആൾട്ടർനേറ്റിംഗ് കറന്റ് പോലറോഗ്രാഫിയിൽ, ഒരു ലോ ആംപ്ലിറ്റ്യൂഡ് സൈനുസോയ്ഡൽ വോൾട്ടേജ് വിശാലമായ ഫ്രീക്വൻസി ശ്രേണിയിൽ രേഖീയമായി വ്യത്യസ്തമായ പൊട്ടൻഷ്യലിലേക്ക് പ്രയോഗിക്കുന്നു, തത്ഫലമായുണ്ടാകുന്ന ആൾട്ടർനേറ്റിംഗ് കറന്റിന്റെ വ്യാപ്തിയും ഘട്ടം ഷിഫ്റ്റും അല്ലെങ്കിൽ ഇംപെഡൻസും നിർണ്ണയിക്കപ്പെടുന്നു. ഈ ഡാറ്റയിൽ നിന്ന്, ലായനിയിലെ പദാർത്ഥങ്ങളുടെ സ്വഭാവത്തെക്കുറിച്ചും ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ മെക്കാനിസത്തെക്കുറിച്ചും ചലനാത്മകതയെക്കുറിച്ചും വിവരങ്ങൾ ലഭിക്കും. 10-100 µm കട്ടിയുള്ള ഇലക്ട്രോലൈറ്റ് പാളിയുള്ള ഇലക്ട്രോകെമിക്കൽ സെല്ലുകളാണ് നേർത്ത പാളികൾ ഉപയോഗിക്കുന്നത്. അത്തരം കോശങ്ങളിൽ, വൈദ്യുതവിശ്ലേഷണം പരമ്പരാഗത ഇലക്ട്രോലൈസറുകളേക്കാൾ വേഗത്തിൽ നടക്കുന്നു. ഇലക്ട്രോഡ് പ്രക്രിയകൾ പഠിക്കാൻ, സ്പെക്ട്രോഫോട്ടോമെട്രിക് രജിസ്ട്രേഷനുള്ള സ്പെക്ട്രോകെമിക്കൽ രീതികൾ ഉപയോഗിക്കുന്നു. ഇലക്ട്രോഡിന്റെ ഉപരിതലത്തിൽ രൂപം കൊള്ളുന്ന പദാർത്ഥങ്ങളെ വിശകലനം ചെയ്യുന്നതിന്, ദൃശ്യ, യുവി, ഐആർ മേഖലകളിലെ പ്രകാശത്തിന്റെ ആഗിരണം അളക്കുന്നു. ഇലക്ട്രോഡ് പ്രതലത്തിന്റെയും മീഡിയത്തിന്റെയും ഗുണങ്ങളിലുള്ള മാറ്റങ്ങൾ വൈദ്യുത പ്രതിഫലനവും എലിപ്സോമെട്രി രീതികളും ഉപയോഗിച്ച് നിരീക്ഷിക്കുന്നു, അവ ഇലക്ട്രോഡ് ഉപരിതലത്തിൽ നിന്നുള്ള വികിരണത്തിന്റെ പ്രതിഫലനം അളക്കുന്നതിനെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്. സ്പെക്യുലർ റിഫ്ളക്ഷൻ, രാമൻ സ്കാറ്ററിംഗ് ഓഫ് ലൈറ്റ് (രാമൻ സ്പെക്ട്രോസ്കോപ്പി), സെക്കന്റ് ഹാർമോണിക് സ്പെക്ട്രോസ്കോപ്പി (ഫോറിയർ സ്പെക്ട്രോസ്കോപ്പി) എന്നിവ ഇതിൽ ഉൾപ്പെടുന്നു.
മറ്റ് ഇലക്ട്രോകെമിക്കൽ പ്രതിഭാസങ്ങളും രീതികളും.
ഇലക്ട്രോലൈറ്റിന്റെയും ചാർജ്ജ് ചെയ്ത കണങ്ങളുടെയും ഉപരിതലങ്ങളുടെയും ആപേക്ഷിക ചലനത്തിലൂടെ, ഇലക്ട്രോകൈനറ്റിക് ഇഫക്റ്റുകൾ സംഭവിക്കുന്നു. ഇത്തരത്തിലുള്ള ഒരു പ്രധാന ഉദാഹരണം ഇലക്ട്രോഫോറെസിസ് ആണ്, അതിൽ ഒരു വൈദ്യുത മണ്ഡലത്തിൽ ചലിക്കുന്ന ചാർജ്ജ് കണങ്ങളുടെ (ഉദാഹരണത്തിന്, പ്രോട്ടീൻ തന്മാത്രകൾ അല്ലെങ്കിൽ കൊളോയ്ഡൽ കണികകൾ) വേർപിരിയൽ സംഭവിക്കുന്നു. ജെല്ലുകളിലെ പ്രോട്ടീനുകൾ അല്ലെങ്കിൽ ഡിഓക്സിറൈബോ ന്യൂക്ലിക് ആസിഡുകൾ (ഡിഎൻഎ) വേർതിരിക്കുന്നതിന് ഇലക്ട്രോഫോറെറ്റിക് രീതികൾ വ്യാപകമായി ഉപയോഗിക്കുന്നു. ജീവജാലങ്ങളുടെ പ്രവർത്തനത്തിൽ വൈദ്യുത പ്രതിഭാസങ്ങൾ ഒരു വലിയ പങ്ക് വഹിക്കുന്നു: നാഡീ പ്രേരണകളുടെ ഉൽപാദനത്തിനും വ്യാപനത്തിനും, ട്രാൻസ്മെംബ്രെൻ സാധ്യതകൾ ഉണ്ടാകുന്നതിനും അവ ഉത്തരവാദികളാണ്. ബയോളജിക്കൽ സിസ്റ്റങ്ങളെയും അവയുടെ ഘടകങ്ങളെയും പഠിക്കാൻ വിവിധ ഇലക്ട്രോകെമിക്കൽ രീതികൾ ഉപയോഗിക്കുന്നു. ഇലക്ട്രോകെമിക്കൽ പ്രക്രിയകളിൽ പ്രകാശത്തിന്റെ സ്വാധീനം പഠിക്കാനും താൽപ്പര്യമുണ്ട്. അതിനാൽ, ഫോട്ടോ ഇലക്ട്രോകെമിക്കൽ ഗവേഷണത്തിന്റെ വിഷയം വൈദ്യുതോർജ്ജത്തിന്റെ ഉത്പാദനവും പ്രകാശത്തിന്റെ സ്വാധീനത്തിൽ രാസപ്രവർത്തനങ്ങളുടെ തുടക്കവുമാണ്, ഇത് സൗരോർജ്ജത്തെ വൈദ്യുതോർജ്ജമാക്കി മാറ്റുന്നതിനുള്ള കാര്യക്ഷമത വർദ്ധിപ്പിക്കുന്നതിന് വളരെ പ്രധാനമാണ്. ടൈറ്റാനിയം ഡയോക്സൈഡ്, കാഡ്മിയം സൾഫൈഡ്, ഗാലിയം ആർസെനൈഡ്, സിലിക്കൺ എന്നിവകൊണ്ട് നിർമ്മിച്ച അർദ്ധചാലക ഇലക്ട്രോഡുകളാണ് ഇവിടെ സാധാരണയായി ഉപയോഗിക്കുന്നത്. മറ്റൊരു രസകരമായ പ്രതിഭാസം ഇലക്ട്രോകെമിലുമിനെസെൻസ് ആണ്, അതായത്. ഒരു ഇലക്ട്രോകെമിക്കൽ സെല്ലിൽ പ്രകാശത്തിന്റെ ഉത്പാദനം. ഇലക്ട്രോഡുകളിൽ ഉയർന്ന ഊർജ്ജ ഉൽപന്നങ്ങൾ രൂപപ്പെടുമ്പോൾ അത് നിരീക്ഷിക്കപ്പെടുന്നു. നൽകിയിരിക്കുന്ന സംയുക്തത്തിന്റെ ഓക്സിഡൈസ്ഡ്, കുറച്ച രൂപങ്ങൾ ലഭിക്കുന്നതിന് പലപ്പോഴും പ്രക്രിയ ഒരു ചാക്രിക രീതിയിലാണ് നടത്തുന്നത്. അവ പരസ്പരം ഇടപഴകുന്നത് ആവേശകരമായ തന്മാത്രകളുടെ രൂപീകരണത്തിലേക്ക് നയിക്കുന്നു, അത് പ്രകാശത്തിന്റെ ഉദ്വമനത്തോടെ ഭൂമിയുടെ അവസ്ഥയിലേക്ക് കടന്നുപോകുന്നു.
അപ്ലൈഡ് ഇലക്ട്രോകെമിസ്ട്രി.
ഇലക്ട്രോകെമിസ്ട്രിക്ക് ധാരാളം പ്രായോഗിക പ്രയോഗങ്ങളുണ്ട്. ബാറ്ററികളുമായി ബന്ധിപ്പിച്ചിരിക്കുന്ന പ്രാഥമിക ഗാൽവാനിക് സെല്ലുകളുടെ (ഡിസ്പോസിബിൾ മൂലകങ്ങൾ) സഹായത്തോടെ രാസ ഊർജ്ജം വൈദ്യുതോർജ്ജമായി പരിവർത്തനം ചെയ്യപ്പെടുന്നു. ദ്വിതീയ നിലവിലെ ഉറവിടങ്ങൾ - ബാറ്ററികൾ - വൈദ്യുതോർജ്ജം സംഭരിക്കുന്നു. റിയാക്ടന്റുകളുടെ (ഹൈഡ്രജനും ഓക്സിജനും പോലുള്ളവ) തുടർച്ചയായ വിതരണത്തിലൂടെ വൈദ്യുതി ഉത്പാദിപ്പിക്കുന്ന പ്രാഥമിക ഊർജ്ജ സ്രോതസ്സുകളാണ് ഇന്ധന സെല്ലുകൾ. ബഹിരാകാശ നിലയങ്ങൾ, ഇലക്ട്രിക് വാഹനങ്ങൾ, ഇലക്ട്രോണിക് ഉപകരണങ്ങൾ എന്നിവയിൽ ഉപയോഗിക്കുന്ന പോർട്ടബിൾ പവർ സ്രോതസ്സുകൾക്കും ബാറ്ററികൾക്കും ഈ തത്വങ്ങൾ അടിവരയിടുന്നു.
പല വസ്തുക്കളുടെയും വലിയ തോതിലുള്ള ഉത്പാദനം ഇലക്ട്രോകെമിക്കൽ സിന്തസിസിനെ അടിസ്ഥാനമാക്കിയുള്ളതാണ്. ക്ലോർ-ആൽക്കലി പ്രക്രിയയിൽ ഉപ്പുവെള്ളത്തിന്റെ വൈദ്യുതവിശ്ലേഷണം ക്ലോറിൻ, ആൽക്കലി എന്നിവ ഉത്പാദിപ്പിക്കുന്നു, അവ പിന്നീട് ജൈവ സംയുക്തങ്ങളും പോളിമറുകളും ഉത്പാദിപ്പിക്കാനും പൾപ്പ്, പേപ്പർ വ്യവസായത്തിലും ഉപയോഗിക്കുന്നു. സോഡിയം ക്ലോറേറ്റ്, പെർസൾഫേറ്റ്, സോഡിയം പെർമാങ്കനേറ്റ് തുടങ്ങിയ സംയുക്തങ്ങളാണ് വൈദ്യുതവിശ്ലേഷണത്തിന്റെ ഉൽപ്പന്നങ്ങൾ; വ്യാവസായിക പ്രാധാന്യമുള്ള ലോഹങ്ങൾ ഇലക്ട്രോ എക്സ്ട്രാക്ഷൻ വഴിയാണ് ലഭിക്കുന്നത്: അലുമിനിയം, മഗ്നീഷ്യം, ലിഥിയം, സോഡിയം, ടൈറ്റാനിയം. ഉരുകിയ ലവണങ്ങൾ ഇലക്ട്രോലൈറ്റുകളായി ഉപയോഗിക്കുന്നതാണ് നല്ലത്, കാരണം ഈ സാഹചര്യത്തിൽ, ജലീയ ലായനികളിൽ നിന്ന് വ്യത്യസ്തമായി, ലോഹങ്ങളുടെ കുറവ് ഹൈഡ്രജന്റെ പ്രകാശനം വഴി സങ്കീർണ്ണമല്ല. ഉരുകിയ ഉപ്പിലെ വൈദ്യുതവിശ്ലേഷണത്തിലൂടെയാണ് ഫ്ലൂറിൻ ഉത്പാദിപ്പിക്കുന്നത്. ചില ഓർഗാനിക് സംയുക്തങ്ങളുടെ സമന്വയത്തിന്റെ അടിസ്ഥാനമായി ഇലക്ട്രോകെമിക്കൽ പ്രക്രിയകൾ പ്രവർത്തിക്കുന്നു; ഉദാഹരണത്തിന്, അക്രിലോണിട്രൈലിന്റെ ഹൈഡ്രോഡൈമറൈസേഷൻ വഴിയാണ് അഡിപോണിട്രൈൽ (നൈലോണിന്റെ സമന്വയത്തിലെ ഒരു ഇന്റർമീഡിയറ്റ്) ലഭിക്കുന്നത്.
വെള്ളി, സ്വർണ്ണം, ക്രോമിയം, താമ്രം, വെങ്കലം, മറ്റ് ലോഹങ്ങൾ, ലോഹസങ്കരങ്ങൾ എന്നിവയുടെ ഇലക്ട്രോപ്ലേറ്റിംഗ് വിവിധ വസ്തുക്കളിൽ വ്യാപകമായി പ്രയോഗിക്കുന്നു, സ്റ്റീൽ ഉൽപ്പന്നങ്ങൾ നാശത്തിൽ നിന്ന് സംരക്ഷിക്കുന്നതിനും അലങ്കാര ആവശ്യങ്ങൾക്കും ഇലക്ട്രിക്കൽ കണക്ടറുകളുടെയും പ്രിന്റഡ് സർക്യൂട്ട് ബോർഡുകളുടെയും നിർമ്മാണത്തിനായി ഇലക്ട്രോണിക്സ് വ്യവസായത്തിൽ. ലോഹങ്ങളും അലോയ്കളും ഉപയോഗിച്ച് നിർമ്മിച്ച വർക്ക്പീസുകളുടെ ഉയർന്ന കൃത്യതയുള്ള ഡൈമൻഷണൽ പ്രോസസ്സിംഗിനായി ഇലക്ട്രോകെമിക്കൽ രീതികൾ ഉപയോഗിക്കുന്നു, പ്രത്യേകിച്ചും പരമ്പരാഗത മെക്കാനിക്കൽ രീതികളാൽ പ്രോസസ്സ് ചെയ്യാൻ കഴിയാത്തവ, അതുപോലെ തന്നെ സങ്കീർണ്ണമായ പ്രൊഫൈലുകളുള്ള ഭാഗങ്ങളുടെ നിർമ്മാണത്തിനും. അലൂമിനിയം, ടൈറ്റാനിയം തുടങ്ങിയ ലോഹങ്ങളുടെ ഉപരിതലം ആനോഡൈസ് ചെയ്യുമ്പോൾ, സംരക്ഷിത ഓക്സൈഡ് ഫിലിമുകൾ രൂപം കൊള്ളുന്നു. ഇലക്ട്രോലൈറ്റിക് കപ്പാസിറ്ററുകളുടെ നിർമ്മാണത്തിലും ചിലപ്പോൾ അലങ്കാര ആവശ്യങ്ങൾക്കായി അലുമിനിയം, ടാന്റലം, നിയോബിയം എന്നിവ ഉപയോഗിച്ച് നിർമ്മിച്ച വർക്ക്പീസുകളുടെ ഉപരിതലത്തിലാണ് ഇത്തരം ഫിലിമുകൾ സൃഷ്ടിക്കുന്നത്.
ഇലക്ട്രോകെമിക്കൽ രീതികൾ പലപ്പോഴും തുരുമ്പെടുക്കൽ പ്രക്രിയകളുടെ അടിസ്ഥാന പഠനങ്ങൾക്കും ഈ പ്രക്രിയകളെ മന്ദഗതിയിലാക്കുന്ന വസ്തുക്കളുടെ തിരഞ്ഞെടുപ്പിനും ഉപയോഗിക്കുന്നു. കാഥോഡിക് സംരക്ഷണം ഉപയോഗിച്ച് ലോഹഘടനകളുടെ നാശം തടയാൻ കഴിയും, ഇതിനായി ഒരു ബാഹ്യ സ്രോതസ്സ് സംരക്ഷിക്കപ്പെടുന്ന ഘടനയുമായി ബന്ധിപ്പിച്ചിരിക്കുന്നു, കൂടാതെ ആനോഡും ഘടനയും അതിന്റെ ഓക്സിഡേഷൻ ഒഴിവാക്കപ്പെടുന്ന ഒരു സാധ്യതയിൽ നിലനിർത്തുന്നു. മറ്റ് ഇലക്ട്രോകെമിക്കൽ പ്രക്രിയകളുടെ പ്രായോഗിക പ്രയോഗത്തിന്റെ സാധ്യതകൾ പര്യവേക്ഷണം ചെയ്യപ്പെടുന്നു. അതിനാൽ, വെള്ളം ശുദ്ധീകരിക്കാൻ വൈദ്യുതവിശ്ലേഷണം ഉപയോഗിക്കാം. ഫോട്ടോകെമിക്കൽ രീതികൾ ഉപയോഗിച്ച് സൗരോർജ്ജത്തിന്റെ പരിവർത്തനം വളരെ പ്രതീക്ഷ നൽകുന്ന ഒരു ദിശയാണ്. ഇലക്ട്രോകെമിക്കൽ മോണിറ്ററുകൾ വികസിപ്പിച്ചുകൊണ്ടിരിക്കുന്നു, ഇതിന്റെ പ്രവർത്തന തത്വം ഇലക്ട്രോകെമിലുമിനസെൻസ് അടിസ്ഥാനമാക്കിയുള്ളതാണ്. ഇലക്ട്രോഡ് പ്രതിപ്രവർത്തനങ്ങളുടെ ഫലമായി ഇലക്ട്രോഡ് ഉപരിതലത്തിന്റെ നിറത്തിലുള്ള റിവേഴ്സിബിൾ മാറ്റങ്ങളെക്കുറിച്ചുള്ള പഠനവും നമുക്ക് സൂചിപ്പിക്കാം.
സാഹിത്യം:
അഗ്ലാഡ്സെ ആർ.ഐ. അപ്ലൈഡ് ഇലക്ട്രോകെമിസ്ട്രി.എം. - എൽ., 1975
ഇസ്മായിലോവ് എൻ.എ. പരിഹാരങ്ങളുടെ ഇലക്ട്രോകെമിസ്ട്രി.എം., 1976
ഇലക്ട്രോകെമിസ്ട്രിയിലെ അളക്കൽ രീതികൾ, വാല്യം. 1-2. എം., 1977
കൊരിറ്റ ഐ. അയോണുകൾ, ഇലക്ട്രോഡുകൾ, മെംബ്രണുകൾ.എം., 1983
ബാഗോട്സ്കി വി.എസ്. ഇലക്ട്രോകെമിസ്ട്രിയുടെ അടിസ്ഥാനങ്ങൾ.എം., 1988