Изотерм процессуудын хүснэгт. Идеал хийн хуулиуд
Термодинамикийн үндсэн процессууд нь:
- изохорик, тогтмол эзэлхүүнтэй урсах;
- изобартогтмол даралтаар урсах;
- изотерм, тогтмол температурт тохиолддог;
- адиабат, энэ үед хүрээлэн буй орчинтой дулааны солилцоо байхгүй;
- политропик, тэгшитгэлийг хангаж байна pvn= const.
Изохор, изобар, изотерм ба адиабат процессууд нь политроп процессын онцгой тохиолдол юм.
Термодинамик процессыг судлахдаа дараахь зүйлийг тодорхойлно.
- дахь процессын тэгшитгэл х— v Тэгээд Т— скоординат;
- хийн төлөвийн параметрүүдийн хоорондын хамаарал;
- дотоод энергийн өөрчлөлт;
- гадаад ажлын хэмжээ;
- процесст нийлүүлсэн дулааны хэмжээ эсвэл зайлуулах дулааны хэмжээ.
Изохорик процесс


Изохорик процессх, v— , Т, с- Тэгээдби, с- координат (диаграмм)
Изохорик процесст нөхцөл байдал v= const.
Идеал хийн төлөвийн тэгшитгэлээс ( pv = RT) дараах:
p/T = R/V= const,
өөрөөр хэлбэл, хийн даралт нь түүний үнэмлэхүй температуртай шууд пропорциональ байна:
p2/p1 = T2 /T1.
Изохорик процесс дахь тэлэлтийн ажил тэг байна ( л= 0), учир нь ажлын шингэний хэмжээ өөрчлөгддөггүй (Δ v= const).
Ажлын шингэнд өгөх дулааны хэмжээ 1-2 at cv
q= cv(Т 2 — Т 1 ).
T. to. л= 0, дараа нь термодинамикийн Δ нэгдүгээр хуульд үндэслэнэ у = q, энэ нь дотоод энергийн өөрчлөлтийг дараах томъёогоор тодорхойлж болно гэсэн үг юм.
Δ у = c v (T 2 - T 1).
Изохорик процесс дахь энтропийн өөрчлөлтийг дараах томъёогоор тодорхойлно.
s2–s1= Δ с = cv ln( p2/p1) = cv ln( T2 /T1).
изобар процесс



дахь изобар процессх, v— , Т, с- Тэгээдби, с- координат (диаграмм)
Тогтмол даралтын дор явагддаг процессыг изобар гэнэ. х= const. Идеал хийн төлөвийн тэгшитгэлээс дараах байдалтай байна.
v/T = R/p= const
v2/v1 = T 2 /T 1 ,
өөрөөр хэлбэл изобар процесст хийн эзэлхүүн нь түүний үнэмлэхүй температуртай пропорциональ байна.
Ажил нь:
л = х(v 2 – v 1 ).
T. to. pv 1 = RT 1 Тэгээд pv 2 = RT 2 , Тэр
л = Р(T2-T1).
дулааны хэмжээ cp= const нь дараах томъёогоор тодорхойлогдоно.
q = cp(T2-T1).
Энтропийн өөрчлөлт нь:
s2–s1= Δ с = cp ln( T2 /T1).
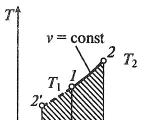
Изотерм процесс



Изотерм процессх, v— , Т, с- Тэгээдби, с- координат (диаграмм)
Изотермийн процесст ажлын шингэний температур тогтмол хэвээр байна Т= const, тэгэхээр:
pv = RT= const
p2/p1 = v1/v2,
өөрөөр хэлбэл, даралт ба эзэлхүүн нь хоорондоо урвуу хамааралтай байдаг тул изотерм шахалтын үед хийн даралт нэмэгдэж, тэлэлтийн үед буурдаг.
Процессын ажил нь дараахь байдалтай тэнцүү байх болно.
л = RT ln( v2 - v1) = RT ln( p1 - p2).
Температур өөрчлөгдөөгүй тул изотерм процесс дахь идеал хийн дотоод энерги тогтмол хэвээр байна (Δ). у= 0) бөгөөд ажлын шингэнд нийлүүлсэн бүх дулаан нь өргөтгөлийн ажилд бүрэн хувирдаг.
q = л.
Изотермийн шахалтын үед ажлын шингэнээс дулааныг шахахад зарцуулсан ажилтай тэнцүү хэмжээгээр авдаг.
Энтропийн өөрчлөлт нь:
s2–s1= Δ с = Р ln( p1/p2) = Р ln( v2/v1).
адиабат процесс



дахь адиабат процессх, v— , Т, с- Тэгээдби, с- координат (диаграмм)
Адиабат процесс гэдэг нь хүрээлэн буй орчинтой дулаан солилцоогүйгээр явагддаг хийн төлөвийн өөрчлөлт юм. оноос хойш d q= 0 бол адиабат процессын термодинамикийн нэгдүгээр хуулийн тэгшитгэл нь дараах хэлбэртэй байна.
г у + хг v = 0
Δ у+ л = 0,
тиймээс
Δ у= —л.
Адиабатын процесст тэлэлтийн ажил нь зөвхөн хийн дотоод энерги зарцуулалтаас болж хийгддэг бөгөөд гадны хүчний үйл ажиллагааны улмаас үүссэн шахалтын үед тэдгээрийн хийсэн бүх ажил нь дотоод энергийг нэмэгдүүлэхэд чиглэгддэг. хийн.
Адиабат процесс дахь дулааны багтаамжийг дамжуулан тэмдэглэе втам, нөхцөл байдал d q= 0-ийг дараах байдлаар илэрхийлнэ.
г q = втам г Т = 0.
Энэ нөхцөл нь адиабат процесс дахь дулааны багтаамж нь тэг байна ( втам = 0).
Энэ нь мэдэгдэж байна
-тайх/cv= к
болон адиабат процессын муруй (адиабат) -ийн тэгшитгэл х, v-диаграмм дараах байдлаар харагдаж байна.
p.v.k= const.
Энэ илэрхийлэлд кгэж нэрлэдэг адиабат илтгэгч(мөн Пуассоны харьцаа гэж нэрлэдэг).
Адиабат экспонентын утгуудкзарим хийн хувьд:
кагаар = 1.4
кхэт халсан уур = 1.3
к ICE утаа = 1.33
кханасан нойтон уур = 1.135
Өмнөх томъёоноос дараах байдалтай байна.
л= — Δ у = cv(Т 1 – Т 2 );
би 1 – би 2 = cp(Т 1 – Т 2 ).
Адиабат процессын техникийн ажил ( лтехнологи) нь үйл явцын эхлэл ба төгсгөлийн энтальпийн зөрүүтэй тэнцүү байна ( би 1 – би 2 ).
Ажлын шингэний дотоод үрэлтгүйгээр явагддаг адиабат процессыг нэрлэдэг изотропик. IN Т, сдиаграммд босоо шугамаар дүрслэгдсэн байна.
Ихэвчлэн жинхэнэ адиабат процессууд нь ажлын шингэн дэх дотоод үрэлтийн үед явагддаг бөгөөд үүний үр дүнд дулааныг үргэлж ялгаруулж, ажлын шингэнд өөрөө өгдөг. Энэ тохиолдолд d с> 0 ба процесс дуудагдана жинхэнэ адиабат процесс.
Политроп процесс
Процессыг политропик гэж нэрлэдэг бөгөөд энэ нь тэгшитгэлээр тодорхойлогддог.
pvn= const.
Политропик индекс n-∞-аас +∞ хүртэл ямар ч утгыг авч болох боловч энэ процессын хувьд энэ нь тогтмол утга юм.
Политропик процессын тэгшитгэл ба Клайпероны тэгшитгэлээс хооронд хамаарлыг бий болгох илэрхийлэлийг олж авч болно. х, vТэгээд ТПолитропын дурын хоёр цэг дээр:
p2/p1 = (v1/v2)n; T2 /T1 = (v1/v2) n-1; T2 /T1 = (p2/p1) (n-1)/n .
Политропик процесс дахь хийн тэлэлтийн ажил нь:

Хамгийн тохиромжтой хийн хувьд энэ томъёог дараах байдлаар өөрчилж болно.

Процессын явцад нийлүүлсэн эсвэл зайлуулсан дулааны хэмжээг термодинамикийн нэгдүгээр хуулийг ашиглан тодорхойлно.
q = (u 2 – u 1) + л.
Учир нь

нь политропик процесс дахь хамгийн тохиромжтой хийн дулаан багтаамж юм.
At cv, кТэгээд n= const c n= const, тиймээс политроп процессыг заримдаа тогтмол дулаан багтаамжтай процесс гэж тодорхойлдог.
Политропик процесс нь термодинамикийн үндсэн процессуудыг бүхэлд нь хамардаг тул ерөнхий утгатай байдаг.
Политропын график дүрслэл х, vполитропын индексээс хамаарч координатууд n.

pv 0= const ( n= 0) нь изобар;
pv= const ( n= 1) изотерм;
p 0 v= const, p 1/∞ v= const, pv∞= const - изохор;
p.v.k= const ( n = к) нь адиабат юм.
n > 0 - гипербол муруй,
n < 0 нь парабол.
Миний термодинамикийн лекцийн тэмдэглэл болон "Эрчим хүчний үндэс" сурах бичгийн материалд үндэслэсэн. Зохиолч Г.Ф.Быстрицкий. 2-р хэвлэл, Илч. болон нэмэлт - М.: KNORUS, 2011. - 352 х.
Изобар процесс гэж юу вэ
Тодорхойлолт
Изобар (эсвэл изобар) процесс нь тогтмол даралттай хийн тогтмол массад явагддаг процесс юм.
Идеал хийн хоёр төлөвийн тэгшитгэлийг бичье.
\ \
Бид (2) тэгшитгэлийг (1) тэгшитгэлээр хувааж, изобар процессын тэгшитгэлийг олж авна.
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \left(4\баруун).\]
(4) тэгшитгэлийг Гей-Люссакийн хууль гэж нэрлэдэг.
Изобарын процессын дотоод энерги ба дулааны хэмжээ
Энэ процесс нь эзэлхүүнийг нэмэгдүүлэх эсвэл эзлэхүүнийг багасгахын тулд дулааныг зайлуулах тохиолдолд дулааны оролттой үед тохиолддог. Термодинамикийн эхний хуулийг бичье, бид ажил, дотоод энерги, изобар үйл явцын дулааны хэмжээг дараалан илэрхийлнэ.
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \зүүн(5\баруун).\] \[\гурвалжин Q=\int\limits^(T_2)_ (T_1)(dU)+\int\limits^(V_2)_(V_1)(dA)(6)\]
Энд $\дельта Q\ $ нь системд нийлүүлсэн анхан шатны дулаан, $dU$ нь явагдаж буй процесс дахь хийн дотоод энергийн өөрчлөлт, $dA$ нь процесст хийн гүйцэтгэсэн үндсэн ажил, i хийн молекулын эрх чөлөөний градусын тоо, R нь бүх нийтийн хийн тогтмол, d нь хийн моль тоо юм.
Хийн дотоод энергийн өөрчлөлт:
\[\гурвалжин U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
Тэгшитгэл (8) нь изобар процессын ажлыг тодорхойлно. Бид (1) тэгшитгэлийг (2) хасаад изобар процесс дахь хийн үйл ажиллагааны өөр нэг тэгшитгэлийг олж авна.
\ \[\ гурвалжин Q=\frac(i)(2)нR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \гурвалжин T\ ( 10),\]
Энд $c_(\mu p)$ нь изобар процесс дахь хийн молийн дулаан багтаамж юм. Тэгшитгэл (10) нь температурыг $\гурвалжин T.$-аар нэмэгдүүлэх изобар процесст m масстай хийд өгөх дулааны хэмжээг тодорхойлно.
Изопроцессыг ихэвчлэн термодинамик диаграммд дүрсэлсэн байдаг. Тиймээс ийм диаграмм дээр изобар процессыг дүрсэлсэн шугамыг изобар гэж нэрлэдэг (Зураг 1).
Жишээ 1
Даалгавар: Зураг 1в-ийн V(T) диаграмм дээр $p_1$ ба $p_2$ даралт хэрхэн хамааралтай болохыг тодорхойл.
$T_1$ изотермийг зур

А ба В цэгүүдэд температур ижил байдаг тул хий нь Бойл-Мариотын хуулийг дагаж мөрддөг.
\ \
Эдгээр хэмжээг SI болгон хөрвүүлье: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
Тооцооллыг хийцгээе:
Хариулт: Изобар процесс дахь хийн ажил 600 Ж.
Жишээ 3
Даалгавар: ABC процесс дахь хийн ажил болон CDA процесс дахь хийн ажлыг харьцуулах Зураг 3.

Уусмалын үндэс болгон бид хийн ажлыг тодорхойлдог томъёог авна.
Тодорхой интегралын геометрийн утгаас харахад ажил нь интеграл, абсцисса тэнхлэг, $ V_1 \ ба \ V_2 $ цэгүүд дэх изохоруудын функцээр хязгаарлагддаг зургийн талбай гэдгийг мэддэг. (тэнхлэг p(V)). Бид процессын графикуудыг p(V) тэнхлэгт хөрвүүлдэг.
Зураг (3)-т үзүүлсэн процессуудын графикуудын сегмент бүрийг авч үзье.
AB: Isochoric процесс (p=const), $V\uparrow \left(\ Volume\ ургадаг\баруун),\ T\uparrow $;
VS: Изохорик процесс (V =const), $T\uparrow $ (графикаас), p$\uparrow $, изохорын процессын хуулиас ($\frac(p)(T)=const$);
CD: (p=const), $V\downarrow,\ T\downarrow ;$
DA: (V =const), $T\downarrow ,\ p\downarrow .$
p(V) тэнхлэг дэх процессуудын графикуудыг дүрсэлцгээе (Зураг 4):

Хийн ажил $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- ABFE тэгш өнцөгтийн талбай) (Зураг 3). Хийн дээр ажиллах $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -тэгш өнцөгтийн талбай\ $EFCD. Мэдээж $A_(CDA)>A_(ABC).$
, Термодинамик процесс нь системийн төлөв байдлын өөрчлөлт юм, үүний үр дүнд түүний параметрүүдийн дор хаяж нэг нь (температур, эзэлхүүн эсвэл даралт) утгыг өөрчилдөг. Гэсэн хэдий ч, хэрэв бид термодинамик системийн бүх параметрүүд нь салшгүй холбоотой гэдгийг харгалзан үзвэл тэдгээрийн аль нэгнийх нь өөрчлөлт нь дор хаяж нэг (хамгийн тохиромжтой) эсвэл хэд хэдэн (бодит байдал дээр) параметрийн өөрчлөлтийг зайлшгүй шаарддаг. Ерөнхий тохиолдолд бид термодинамик процесс нь системийн тэнцвэрт байдлын зөрчилтэй холбоотой гэж хэлж болно, хэрэв систем тэнцвэрт байдалд байгаа бол термодинамик процессууд үүн дотор явагдахгүй.
Системийн тэнцвэрт байдал нь хийсвэр ойлголт бөгөөд аливаа материалыг хүрээлэн буй ертөнцөөс тусгаарлах боломжгүй тул аливаа бодит системд янз бүрийн термодинамик процессууд зайлшгүй явагддаг. Үүний зэрэгцээ зарим системд ийм удаан, бараг үл үзэгдэх өөрчлөлтүүд явагддаг тул тэдгээртэй холбоотой үйл явц нь системийн тэнцвэрт байдлын дарааллаас бүрддэг гэж нөхцөлт байдлаар тооцож болно. Ийм процессыг тэнцвэрт байдал эсвэл гэж нэрлэдэг бараг статик.
Систем дэх дараалсан өөрчлөлтүүдийн өөр нэг хувилбарыг нэрлэж, дараа нь анхны төлөвтөө буцаж ирдэг дугуй процессэсвэл мөчлөг. Термодинамикийн олон онолын дүгнэлт, хэрэглээний аргуудын үндэс нь тэнцвэр ба дугуй процессын тухай ойлголт юм.
Термодинамик процессыг судлах нь энэ процесст хийсэн ажил, дотоод энергийн өөрчлөлт, дулааны хэмжээг тодорхойлох, мөн хийн төлөв байдлыг тодорхойлдог бие даасан хэмжигдэхүүнүүдийн хоорондын хамаарлыг тогтооход оршино.
Бүх боломжит термодинамик процессуудаас изохор, изобар, изотерм, адиабат, политроп процессууд хамгийн их сонирхол татдаг.
Изохорик процесс
Тогтмол эзэлхүүнтэй үед тохиолддог термодинамик процессыг изохорик процесс гэнэ. Ийм процессыг хаалттай саванд байрлуулсан хийг халаах замаар хийж болно. Дулааны нийлүүлэлтийн үр дүнд хий халж, даралт нь нэмэгддэг.
Изохорик процесс дахь хийн параметрүүдийн өөрчлөлт нь Чарльзын хуулийг тодорхойлдог: p 1 / T 1 \u003d p 2 / T 2, эсвэл ерөнхий тохиолдолд:
p/T = const .
Савны ханан дээрх хийн даралт нь хийн үнэмлэхүй температуртай шууд пропорциональ байна.
Изохорик процесст dV эзлэхүүний өөрчлөлт тэгтэй тэнцүү байдаг тул хийн дотоод энергийг өөрчлөхөд хийн бүх дулааныг зарцуулдаг гэж дүгнэж болно. (ямар ч ажил хийгдээгүй).
изобар процесс
Тогтмол даралтын дор явагддаг термодинамик процесс нь изобар процесс юм. Ийм процессыг дулааныг зайлуулах, нийлүүлэх явцад тогтмол гадны хүчээр үйлчилдэг хөдөлгөөнт поршений нягт цилиндрт хий байрлуулах замаар хийж болно.
Хийн температур өөрчлөгдөхөд поршений нэг чиглэлд эсвэл өөр чиглэлд хөдөлдөг; Гей-Люссакийн хуулийн дагуу хийн хэмжээ өөрчлөгддөг.
V/T = const.
Энэ нь изобар процесст хийн эзэлхүүн нь температуртай шууд пропорциональ байна гэсэн үг юм.
Энэ процесс дахь температурын өөрчлөлт нь хийн дотоод энерги өөрчлөгдөхөд зайлшгүй хүргэдэг бөгөөд эзэлхүүний өөрчлөлт нь ажлын гүйцэтгэлтэй холбоотой, өөрөөр хэлбэл изобарын процесст дулааны нэг хэсэг юм гэж дүгнэж болно. энерги нь хийн дотоод энергийг өөрчлөхөд, нөгөө хэсэг нь гадны хүчний үйлдлийг даван туулах хийн ажлын гүйцэтгэлд зарцуулагддаг. Энэ тохиолдолд дотоод энергийг нэмэгдүүлэх, ажил гүйцэтгэх дулааны зардлын харьцаа нь хийн дулааны багтаамжаас хамаарна.
Изотерм процесс
Изотерм процесс нь тогтмол температурт явагддаг термодинамик процесс юм.
Практикт хийтэй изотермийн процесс явуулах нь маш хэцүү байдаг. Эцсийн эцэст, шахах эсвэл тэлэх явцад хий нь өөрийн температурыг тогтмол байлгаж, хүрээлэн буй орчинтой температур солилцох цаг хугацаатай байх нөхцлийг дагаж мөрдөх шаардлагатай.
Изотермийн процессыг Бойл-Мариотын хуулиар тодорхойлсон: pV \u003d const, өөрөөр хэлбэл тогтмол температурт хийн даралт нь түүний эзэлхүүнтэй урвуу хамааралтай байдаг.
Мэдээжийн хэрэг изотерм процесст хийн дотоод энерги өөрчлөгдөхгүй, учир нь түүний температур тогтмол байдаг.
Хийн температурын тогтмол байдлын нөхцлийг биелүүлэхийн тулд шахалтанд зарцуулсан ажилтай тэнцэх дулааныг түүнээс зайлуулах шаардлагатай.
dq = dA = pdv .
Хийн төлөв байдлын тэгшитгэлийг ашиглан хэд хэдэн хувиргалт, орлуулалт хийсний дараа изотерм процесс дахь хийн ажлыг дараахь илэрхийлэлээр тодорхойлно гэж дүгнэж болно.
A = RT ln (p 1 / p 2).
адиабат процесс
Адиабат процесс нь ажлын шингэн ба хүрээлэн буй орчны хооронд дулаан солилцоогүйгээр явагддаг термодинамик процесс юм. Изотерм процессын нэгэн адил адиабат процессыг практикт хэрэгжүүлэхэд маш хэцүү байдаг. Ийм процессыг саванд байрлуулсан ажлын орчин, жишээлбэл, өндөр чанартай дулаан тусгаарлагч материалаар хүрээлэгдсэн поршений цилиндртэй хамт үргэлжлүүлж болно.
Гэхдээ энэ тохиолдолд бид ямар ч өндөр чанартай дулаан тусгаарлагчийг ашигладаг байсан ч ажлын шингэн болон хүрээлэн буй орчны хооронд бага хэмжээний дулааныг зайлшгүй солилцох болно.
Тиймээс практик дээр адиабат процессын зөвхөн ойролцоо загварыг бий болгох боломжтой. Гэсэн хэдий ч дулааны инженерчлэлд хийгдсэн олон термодинамик процессууд маш хурдан явагддаг тул ажлын шингэн ба орчин нь дулаан солилцох цаг байхгүй тул тодорхой хэмжээний алдаатай ийм процессыг адиабат гэж үзэж болно.
Даралт ба эзэлхүүнтэй холбоотой тэгшитгэлийг гаргах 1 кгАдиабат процесс дахь хийг бид термодинамикийн нэгдүгээр хуулийн тэгшитгэлийг бичнэ.
dq = du + pdv .
Адиабат процессын хувьд дулаан дамжуулах dq нь 0-тэй тэнцүү бөгөөд дотоод энергийн өөрчлөлт нь температурын дулаан дамжуулалтын функц юм: du = c v dT , тэгвэл бид дараахь зүйлийг бичиж болно.
c v dT + pdv = 0 (3) .
Клапейроны pv = RT тэгшитгэлийг ялгаж үзвэл бид:
pdv + vdp = RdT.
Эндээс dT-г илэрхийлж (3) тэгшитгэлд орлуулъя. Дахин зохион байгуулалт, өөрчлөлт хийсний дараа бид дараахь зүйлийг авна.
pdvc v /(R + 1) + c v vdp/R = 0.
Майерын R = c p – c v тэгшитгэлийг харгалзан сүүлийн илэрхийллийг дараах байдлаар дахин бичиж болно.
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
Тэгшитгэлийг нэгтгэсний дараа үүссэн илэрхийллийг c v -д хувааж, c p / c v харьцааг k үсгээр тэмдэглэнэ. (4) бид авдаг (цагт k = const):
ln vk + ln p = const эсвэл ln pvk = const эсвэл pvk = const .
Үүссэн тэгшитгэл нь адиабат процессын тэгшитгэл бөгөөд k нь адиабатын илтгэгч юм.
Хэрэв бид эзэлхүүний дулаан багтаамжийг c v тогтмол утга, өөрөөр хэлбэл c v \u003d const гэж үзвэл адиабат процессын ажлыг томъёогоор илэрхийлж болно. (гаралтгүйгээр өгсөн):
l \u003d c v (T 1 - T 2) эсвэл l \u003d (p 1 v 1 - p 2 v 2) / (k-1).
Политроп процесс
Дээр дурдсан термодинамик процессуудаас ялгаатай нь хийн параметрүүдийн аль нэг нь өөрчлөгдөөгүй хэвээр байвал политроп процесс нь хийн үндсэн параметрүүдийн аль нэгийг өөрчлөх боломжоор тодорхойлогддог. Дээрх бүх термодинамик процессууд нь политроп процессын онцгой тохиолдол юм.
Политроп процессын ерөнхий тэгшитгэл нь pv n = const хэлбэртэй байна, энд n нь политропын индекс - энэ процессын тогтмол утга бөгөөд энэ нь - ∞-аас + ∞ хүртэлх утгыг авч болно.
Политропийн индексийн тодорхой утгыг өгснөөр изохор, изобар, изотерм эсвэл адиабат гэсэн нэг буюу өөр термодинамик процессыг олж авах боломжтой нь ойлгомжтой.
Тэгэхээр n = 0 -г авбал p = const - изобар процесс, n = 1 -ийг авбал pv = const хамаарлаар дүрслэгдсэн изотерм процессыг авна; n = k-ийн хувьд процесс адиабат, n-ийн хувьд - ∞ эсвэл + ∞-тэй тэнцүү байна. Бид изохорик процессыг авдаг.
USE кодлогчийн сэдвүүд: изопроцессууд - изотерм, изохор, изобар процессууд.
Энэхүү ухуулах хуудасны туршид бид дараах таамаглалыг баримтлах болно. хийн масс ба химийн найрлага өөрчлөгдөөгүй хэвээр байна. Өөрөөр хэлбэл, бид:
Өөрөөр хэлбэл, савнаас хий гоожихгүй, эсвэл эсрэгээр сав руу хий орохгүй;
Өөрөөр хэлбэл, хийн хэсгүүд ямар ч өөрчлөлтийг мэдэрдэггүй (ямар ч диссоциаци байхгүй - молекулуудыг атом болгон задлах).
Эдгээр хоёр нөхцөл нь бие махбодийн хувьд маш олон сонирхолтой нөхцөл байдалд (жишээлбэл, дулааны хөдөлгүүрийн энгийн загварт) хангагдсан байдаг тул тусад нь авч үзэх шаардлагатай.
Хэрэв хийн масс ба түүний молийн масс тогтмол байвал хийн төлөвийг тодорхойлно гуравмакроскопийн үзүүлэлтүүд: даралт, эзэлхүүнТэгээд температур. Эдгээр параметрүүд нь төлөвийн тэгшитгэлээр (Менделеев-Клапейроны тэгшитгэл) өөр хоорондоо холбоотой байдаг.
Термодинамик процесс(эсвэл зүгээр л үйл явц) нь хийн төлөвийн цаг хугацааны өөрчлөлт юм. Термодинамик процессын явцад макроскопийн параметрүүдийн утга - даралт, эзэлхүүн, температур өөрчлөгддөг.
Ялангуяа сонирхолтой байдаг изопроцессууд- макроскопийн аль нэг параметрийн утга өөрчлөгдөхгүй байх термодинамик процессууд. Гурван параметр бүрийг ээлжлэн засснаар бид гурван төрлийн изопроцессыг олж авдаг.
1. Изотерм процесстогтмол хийн температурт явдаг: .
2. изобар процесстогтмол хийн даралтаар ажилладаг: .
3. Изохорик процессхийн тогтмол эзэлхүүнтэй явдаг: .
Изопроцессыг Бойлийн маш энгийн хуулиар дүрсэлсэн байдаг - Мариотт, Гей-Люссак, Чарльз. Тэднийг судлах ажлыг үргэлжлүүлье.
Изотерм процесс
Идеал хий нь температурт изотермийн процесс хийцгээе. Процессын явцад зөвхөн хийн даралт, түүний эзэлхүүн өөрчлөгддөг.
Хийн дурын хоёр төлөвийг авч үзье: тэдгээрийн аль нэгэнд макроскопийн параметрүүдийн утгууд нь , хоёр дахь нь . Эдгээр утгыг Менделеев-Клапейроны тэгшитгэлээр холбоно.
Бид анхнаасаа хэлсэнчлэн масс ба молийн массыг тогтмол гэж үздэг.
Тиймээс бичсэн тэгшитгэлийн зөв хэсгүүд тэнцүү байна. Тиймээс зүүн тал нь мөн тэнцүү байна:
(1)
Хийн хоёр төлөвийг дур зоргоороо сонгосон тул бид ингэж дүгнэж болно изотерм процессын үед хийн даралт ба эзэлхүүний бүтээгдэхүүн тогтмол хэвээр байна:
(2)
Энэ мэдэгдлийг гэж нэрлэдэг Бойлийн хууль - Мариотт.
Бойл-Мариотын хуулийг маягтаар бичсэн
(3)
Үүнийг мөн дараах байдлаар томъёолж болно. Изотерм процесст хийн даралт нь түүний эзэлхүүнтэй урвуу хамааралтай байдаг.. Жишээлбэл, хийн изотерм тэлэлтийн үед түүний эзэлхүүн 3 дахин нэмэгддэг бол хийн даралт 3 дахин буурдаг.
Даралт ба эзэлхүүний урвуу хамаарлыг физикийн үүднээс хэрхэн тайлбарлах вэ? Тогтмол температурт хийн молекулуудын дундаж кинетик энерги өөрчлөгдөөгүй хэвээр байна, өөрөөр хэлбэл, савны хананд молекулуудын нөлөөллийн хүч өөрчлөгддөггүй. Эзлэхүүн нэмэгдэхийн хэрээр молекулуудын концентраци буурч, улмаар хананы нэгж талбайд ногдох молекулын нөлөөллийн тоо буурч, хийн даралт буурдаг. Эсрэгээр, эзэлхүүн багасах тусам молекулуудын концентраци нэмэгдэж, тэдгээрийн нөлөөлөл улам бүр нэмэгдэж, хийн даралт нэмэгддэг.
Изотерм процессын графикууд
Ерөнхийдөө термодинамик процессын графикийг дараахь координатын системд дүрслэх нь заншилтай байдаг.
-диаграмм: абсцисса тэнхлэг, ординатын тэнхлэг;
-диаграмм: абсцисса тэнхлэг, ординатын тэнхлэг.
Изотерм процессын графикийг нэрлэнэ изотерм.
Диаграм дээрх изотерм нь урвуу пропорциональ график юм.
Ийм график нь гипербол (алгебр - функцийн графикийг санаарай) юм. Изотерм-гиперболыг Зураг дээр үзүүлэв. 1 .

Цагаан будаа. 1. изотерм дээр -диаграмм
Изотерм бүр нь тодорхой тогтмол температурын утгатай тохирч байна. Энэ нь харагдаж байна температур өндөр байх тусам харгалзах изотерм өндөр байх болно -диаграм.
Үнэн хэрэгтээ, ижил хийгээр гүйцэтгэсэн хоёр изотерм процессыг авч үзье (Зураг 2). Эхний процесс нь температурт, хоёр дахь нь температурт явагддаг.

Цагаан будаа. 2. Температур өндөр байх тусам изотерм өндөр байна
Бид эзлэхүүний зарим утгыг засдаг. Эхний изотерм дээр энэ нь даралттай тохирч, хоёр дахь нь - class="tex" alt="p_2 > p_1)"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
Үлдсэн хоёр координатын системд изотерм нь маш энгийн харагддаг: энэ нь тэнхлэгт перпендикуляр шулуун шугам юм (зураг 3):

Цагаан будаа. 3. Изотермууд ба -диаграммууд
изобар процесс
Изобарын процесс нь тогтмол даралтаар явагддаг процесс гэдгийг дахин санаарай. Изобарын процессын үед зөвхөн хийн эзэлхүүн ба түүний температур өөрчлөгддөг.
Изобар процессын ердийн жишээ: хий нь чөлөөтэй хөдөлж чадах асар том поршений дор байдаг. Хэрэв поршений масс ба поршений хөндлөн огтлол нь хийн даралт тогтмол бөгөөд тэнцүү байна
атмосферийн даралт хаана байна.
Идеал хий нь даралтын дор изобар процесс хийцгээе. Хийн дурын хоёр төлөвийг дахин авч үзье; Энэ удаад макроскопийн параметрүүдийн утга нь ба -тай тэнцүү байх болно.
Төлөвийн тэгшитгэлийг бичье:
Тэдгээрийг бие биенээсээ хуваахад бид дараахь зүйлийг олж авна.
Зарчмын хувьд энэ нь аль хэдийн хангалттай байж болох ч бид жаахан цааш явах болно. Нэг хэсэгт зөвхөн эхний төлөвийн параметрүүд, нөгөө хэсэгт зөвхөн хоёр дахь төлөвийн параметрүүд гарч ирэхийн тулд үүссэн хамаарлыг дахин бичье (өөрөөр хэлбэл бид "индексүүдийг өөр өөр хэсгүүдэд хуваадаг"):
(4)
Одоо эндээс - мужуудын дур зоргоороо сонгогдсон байдлыг харгалзан! - бид авдаг Гей-Луссакийн хууль:
(5)
Өөрөөр хэлбэл, Тогтмол даралттай үед хийн эзэлхүүн нь түүний температуртай шууд пропорциональ байна.:
(6)
Температурын нөлөөгөөр эзлэхүүн яагаад нэмэгддэг вэ? Температур өсөхийн хэрээр молекулууд хүчтэй цохиж, бүлүүрийг дээшлүүлж эхэлдэг. Үүний зэрэгцээ молекулуудын концентраци буурч, нөлөөлөл нь багасч, эцэст нь даралт ижил хэвээр байна.
Изобарын процессын графикууд
Изобар процессын графикийг нэрлэнэ изобар. -диаграмм дээр изобар нь шулуун шугам юм (Зураг 4):

Цагаан будаа. 4. Isobar on -диаграмм
Графикийн тасархай хэсэг нь хангалттай бага температурт бодит хийн хувьд хамгийн тохиромжтой хийн загвар (мөн түүнтэй хамт Гей-Люссак хууль) ажиллахаа болино гэсэн үг юм. Үнэн хэрэгтээ, температур буурах тусам хийн хэсгүүд улам удаан хөдөлж, молекул хоорондын харилцан үйлчлэлийн хүч нь тэдний хөдөлгөөнд улам бүр чухал нөлөө үзүүлдэг (үүнтэй адил төстэй байдал: удаан бөмбөгийг хурдан барихаас илүү барих нь илүү хялбар байдаг). Маш бага температурт хий нь шингэн болж хувирдаг.
Одоо даралтын өөрчлөлтөөр изобарын байрлал хэрхэн өөрчлөгдөхийг олж мэдье. Энэ нь харагдаж байна Даралт ихсэх тусам изобар багасна. -диаграм.
Үүнийг шалгахын тулд даралттай хоёр изобарыг авч үзье (Зураг 5):

Цагаан будаа. 5. Изобар бага байх тусам даралт ихсэх болно
Температурын зарим утгыг засъя. Бид үүнийг харж байна. Гэхдээ тогтмол температурт эзэлхүүн нь бага байх тусам даралт ихсэх болно (Бойлийн хууль - Мариотт!).
Тиймээс class="tex" alt="p_2 > p_1"> .!}
Үлдсэн хоёр координатын системд изобар нь тэнхлэгт перпендикуляр шулуун шугам юм (Зураг 6):

Цагаан будаа. 6. изобарууд ба -диаграммууд
Изохорик процесс
Изохорик процесс нь тогтмол эзэлхүүнтэй явагддаг процесс гэдгийг бид санаж байна. Изохорик процесст зөвхөн хийн даралт ба түүний температур өөрчлөгддөг.
Изохорик процессыг төсөөлөхөд маш энгийн: энэ нь тогтсон эзэлхүүнтэй хатуу саванд (эсвэл поршений бэхэлгээний үед поршений доорх цилиндрт) явагддаг процесс юм.
Идеал хий нь эзэлхүүнтэй саванд изохорик процесс хийцгээе. Дахин хэлэхэд, параметрүүдтэй дурын хоёр хийн төлөвийг авч үзье. Бидэнд байгаа:
Бид эдгээр тэгшитгэлийг бие биендээ хуваадаг.
Гей-Люссакийн хуулийн гарал үүслийн нэгэн адил бид индексүүдийг өөр өөр хэсгүүдэд хуваадаг.
(7)
Мужийн сонголтын дур зоргыг харгалзан бид энд хүрч байна Чарльзын хууль:
(8)
Өөрөөр хэлбэл, Тогтмол эзэлхүүнтэй хийн даралт нь түүний температуртай шууд пропорциональ байна.:
(9)
Тогтмол эзэлхүүнтэй хийн даралтыг халаах үед ихсэх нь физикийн үүднээс бүрэн тодорхой зүйл юм. Та өөрөө үүнийг хялбархан тайлбарлаж чадна.
Изохорик процессын графикууд
Изохорик процессын графикийг нэрлэнэ изохор. Диаграмм дээр изохор нь шулуун шугам юм (зураг 7):

Цагаан будаа. 7. Isochore on -диаграмм
Цэгтэй талбайн утга нь адилхан: бага температурт хамгийн тохиромжтой хийн загварын хангалтгүй байдал.

Цагаан будаа. 8. Изохор бага байх тусам эзэлхүүн нэмэгдэнэ
Нотолгоо нь өмнөхтэй төстэй юм. Бид температурыг тохируулж, үүнийг хардаг. Гэхдээ тогтмол температурт даралт бага байх тусам эзэлхүүн нь их байх болно (дахин Бойл-Мариотт хууль). Тиймээс class="tex" alt="V_2 > V_1"> .!}
Үлдсэн хоёр координатын системд изохор нь тэнхлэгт перпендикуляр шулуун шугам юм (Зураг 9):

Цагаан будаа. 9. изохорууд ба -диаграммууд
Бойлийн хуулиуд - Мариотт, Гей-Люссак, Чарльз нарыг мөн нэрлэдэг хийн хууль.
Бид хийн хуулиудыг Менделеев-Клапейроны тэгшитгэлээс гаргаж авсан. Гэвч түүхэнд энэ нь эсрэгээрээ байсан: хийн хуулийг туршилтаар тогтоосон бөгөөд үүнээс хамаагүй эрт. Дараа нь төлөв байдлын тэгшитгэл нь тэдгээрийн ерөнхий ойлголт болж гарч ирэв.
изобар процесс
Өөр өөр координатын систем дэх изопроцессын графикууд
изобар процесс(Бусад Грек хэлээр ισος, isos - "ижил" + βαρος, baros - "жин") - тогтмол даралттай термодинамик системийн төлөвийг өөрчлөх үйл явц ()
Тогтмол даралт дахь хийн эзэлхүүний температураас хамаарлыг 1802 онд Жозеф Луис Гэй-Люссак туршилтаар судалжээ. Гей-Люссакийн хууль: Хийн масс ба түүний молийн массын тогтмол даралт ба тогтмол утгын үед хийн эзэлхүүнийг абсолют температуртай харьцуулсан харьцаа тогтмол хэвээр байна: V / T = const.
Изохорик процесс
Изохорик процесс(Грекийн найрал дуунаас - эзлэгдсэн газар) - термодинамик системийн төлөвийг тогтмол эзэлхүүнтэй өөрчлөх үйл явц (). Тогтмол эзэлхүүнтэй хийн өгөгдсөн массын хувьд даралт нь температуртай шууд пропорциональ байдаг: Идеал хийн хувьд изохорын процессыг Чарльзын хуулиар тодорхойлдог.
Диаграммд изохорын процессыг дүрсэлсэн мөрийг изохор гэж нэрлэдэг.
Хийд нийлүүлсэн энерги нь дотоод энергийг өөрчлөхөд зарцуулагддаг гэдгийг тэмдэглэх нь зүйтэй, өөрөөр хэлбэл Q = 3* ν*R*T/2=3*V*ΔP, R нь бүх нийтийн хийн тогтмол, ν нь хийн молийн тоо, T нь Кельвин дэх температур, V нь хийн эзэлхүүн, ΔP нь даралтын өөрчлөлтийн өсөлт юм. ба диаграммд P(T) тэнхлэгт байгаа изохорын процессыг дүрсэлсэн шугамыг сунгаж, тасархай шугамаар гарал үүсэл рүү холбоно, учир нь үл ойлголцол үүсч болзошгүй.
Изотерм процесс
Изотерм процесс(Грек хэлнээс "термос" - дулаан, халуун) - тогтмол температурт термодинамик системийн төлөвийг өөрчлөх үйл явц () (). Изотермийн процессыг Бойл-Мариоттын хуулиар тайлбарлав.
Тогтмол температур ба хийн масс ба түүний молийн массын тогтмол утгын үед хийн эзэлхүүн ба түүний даралтын бүтээгдэхүүн тогтмол хэвээр байна: PV = const.
Изентропик үйл явц
Изентропик үйл явц- тогтмол энтропи үед термодинамик системийн төлөвийг өөрчлөх үйл явц (). Жишээлбэл, буцах боломжтой адиабат процесс нь изонтропик байдаг: ийм процесст хүрээлэн буй орчинтой дулаан солилцоо байдаггүй. Ийм процесс дахь хамгийн тохиромжтой хийг дараахь тэгшитгэлээр тодорхойлно.
хийн төрлөөр тодорхойлогддог адиабат экспонент хаана байна.
Викимедиа сан. 2010 он.
Бусад толь бичгүүдэд "Изопроцессууд" гэж юу болохыг харна уу:
Изопроцессууд нь термодинамик процессууд бөгөөд энэ үед төлөвийн параметрүүдийн масс ба өөр физик хэмжигдэхүүнүүд: даралт, эзэлхүүн эсвэл температур өөрчлөгдөөгүй хэвээр байна. Тиймээс изобар процесс нь тогтмол даралттай, изохорик эзэлхүүнтэй тохирч байна ... Википедиа
Молекулын кинетик онол (товчилсон MKT) нь гурван үндсэн зөв заалтын үүднээс материйн бүтцийг авч үздэг онол юм: бүх бие нь тоосонцороос тогтдог бөгөөд тэдгээрийн хэмжээг үл тоомсорлож болно: атом, молекул, ион; тоосонцор ... ... Википедиа
- (MKT гэж товчилсон) материйн бүтцийг гурван үндсэн зөв заалтын үүднээс авч үздэг онол: бүх бие нь хэмжээсийг үл тоомсорлож болох бөөмсөөс бүрддэг: атом, молекул, ион; тоосонцор тасралтгүй ... ... Википедиа
Номууд
- Бүтцийн материалын хэв гажилт-хүч чадлын үзүүлэлтүүдийн статистикийн таамаглал, Г.Плювинаж, В.Т. Сапунов, Энэ ном нь метал болон полимер материалын хувьд нийтлэг байдаг кинетик үйл явцын шинж чанарыг урьдчилан таамаглах нийтлэг аргачлалыг санал болгодог шинэ аргыг танилцуулж байна. Арга… Ангилал: Их дээд сургуулийн сурах бичигНийтлэгч: