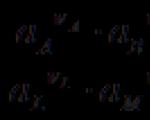Цахилгаан хими. Галваник эс Цахилгаан химийн элемент
Цахилгаан химийн элементүүд. Цахилгаан хөдөлгөгч хүч. Галваник эсийн термодинамик. EMF хэмжилт.
Цахилгаан давхар давхарга, үүсэх механизм, бүтэц.
ГАЛВАНИЙН ЭЛЕМЕНТҮҮД. EMF.
Цахилгаан гүйдэл электролитээр дамжих үед электродын гадаргуу дээр цахилгаан химийн урвал явагдана. Цахилгаан химийн урвалын илрэлийг гадны гүйдлийн эх үүсвэрээс үүсгэж болно. Эсрэг үзэгдэл бас боломжтой: электролитэд дүрсэн хоёр электрод дээр үүсэх цахилгаан химийн урвал нь цахилгаан гүйдэл үүсгэдэг бөгөөд урвал нь зөвхөн хаалттай хэлхээнд (гүйдэл өнгөрөх үед) тохиолддог.
Цахилгаан химийн (эсвэл гальваник) эс цахилгаан химийн урвалаар цахилгаан гүйдэл үүсгэх төхөөрөмж юм. Хамгийн энгийн цахилгаан химийн элемент нь электролит (хоёр дахь төрлийн дамжуулагч) руу буулгаж, бие биетэйгээ металл контактаар холбогдсон хоёр металл электрод (эхний төрлийн дамжуулагч) -аас бүрдэнэ. Цуврал хэлбэрээр холбогдсон хэд хэдэн цахилгаан химийн элементүүд цахилгаан химийн хэлхээ .
Цахилгаан химийн элементийн хамгийн чухал тоон шинж чанар бол цахилгаан хөдөлгөх хүч юм(EMF, E), боломжит зөрүүтэй тэнцүү байна зөв нээх элемент (ижил материалаас эхний төрлийн дамжуулагчийг элементийн эцсийн электродуудтай холбосон нэг).
Хэрэв цахилгаан гүйдэл өөр өөр чиглэлд дамжих үед электродын гадаргуу дээр ижил урвал явагдах боловч эсрэг чиглэлд байвал ийм электродууд, түүнчлэн тэдгээрээс бүрдсэн элемент эсвэл хэлхээг гэнэ. буцаах боломжтой . Урвуу элементүүдийн emf нь тэдний термодинамик шинж чанар, i.e. зөвхөн T, P, электрод ба уусмалыг бүрдүүлдэг бодисын шинж чанар, эдгээр уусмалын концентрациас хамаарна. Урвуу элементийн жишээ бол Даниел-Жакоби элемент :
(-) Cu çZn çZnSO 4 çCuSO 4 çCu (+)
электрод бүр нь эргэх боломжтой байдаг. Элемент ажиллах үед дараах урвал явагдана: Zn ® Zn 2+ + 2 д, Cu 2+ + 2 д® Cu. Гадны эх үүсвэрээс хязгааргүй бага хүч чадлын гүйдэл дамжих үед электродууд дээр урвуу урвал явагдана.
Буцахгүй элементийн жишээ бол Volta элемент :
(-) Zn ç H 2 SO 4 ç Cu (+)
Элемент ажиллах үед дараах урвал явагдана: Zn ® Zn 2+ + 2 д, 2H + + 2 д® H 2. Гадны эх үүсвэрээс гүйдэл дамжуулах үед электродын урвалууд: 2H + + 2 байна д® H 2 , Cu ® Cu 2+ + 2 д .
Цахилгаан химийн элементийн EMF нь эерэг утгатай, учир нь энэ нь эерэг ажил үүсгэдэг тодорхой аяндаа явагддаг үйл явцтай тохирч байна. Бие даан үүсэх боломжгүй урвуу үйл явц нь сөрөг EMF-тэй тохирно. Цахилгаан химийн элементүүдийн гинжийг бүрдүүлэхдээ аль нэг элемент дэх процессыг чиглүүлж, гаднаас нь ажлын зарцуулалт (аяндаа бус үйл явц) дагалдаж, үүний тулд гинжин хэлхээний өөр элементийн ажлыг ашиглана. аяндаа үүсэх үйл явц. Аливаа хэлхээний нийт emf нь эерэг ба сөрөг хэмжигдэхүүний алгебрийн нийлбэртэй тэнцүү байна. Тиймээс хэлхээний диаграм бичихдээ хүлээн зөвшөөрөгдсөн дүрмийг ашиглан EMF-ийн шинж тэмдгийг анхаарч үзэх нь маш чухал юм.
Цахилгаан химийн хэлхээний emf нь эерэг гэж тооцогддог, хэрэв хэлхээг бичих үед баруун электрод зүүн талтай харьцуулахад эерэг цэнэгтэй бол (хэлхээний ажиллагааны явцад зүүн талд бичигдсэн электродоос уусмалд катионууд баруун талд бичигдсэн электрод руу шилжиж, электронууд шилжинэ. гадаад хэлхээнд ижил чиглэл). Жишээ.
ГАЛВАН ЭСИЙН ТЕРМОДИНАМИК .
Цахилгаан химийн системд урвалыг урвуу ба изотерм байдлаар явуулна:
n A A + n B B + ... ± nF Û n L L + n M M + ... ±
Элементээс үүссэн цахилгаан энерги нь нийт процессын ашигтай ажил A¢-тай тэнцүү байна. Урвуу процессын ашигтай ажил A¢ хамгийн их байх ба P, T = const үед системийн изобар потенциалын бууралттай тэнцүү байна.
DG P, T = nFE P, T
E P , T - системийн урвуу EMF.
E P,T = -DG P,T / nF , E V,T = -DF V,T / nF
Тиймээс элементийн EMF ба түүний температурын коэффициентийг хэмжсэнээр гальваник элементэд тохиолддог нийт процессын DG ба DS утгыг олох боломжтой. Энэ үйл явц нь аяндаа явагддаг тул DG< 0.
Гиббс-Хелмгольцын тэгшитгэлийг ашиглан бид үйл явцын энтальпийн өөрчлөлтийг тооцоолж болно.
DH = DG - T = -nFE P + TnF
nFE P = -DH + nFT = + nFT
nFE V = -DU + nFT = + nFT
Тэгшитгэлээс харахад цахилгаан химийн системд урвуу хэлбэрээр үүссэн эсвэл шингээгдсэн цахилгаан энерги ба түүн дэх урвалын дулааны нөлөөллийн хоорондын хамаарал нь emf-ийн температурын коэффициентийн тэмдэг ба хэмжээнээс хамаарна. dE/ дТ :
1. ХэрэвdE / дТ > 0 , дараа нь nFE > (DG > DH) ба систем нь зөвхөн урвалын дулааны нөлөөнд тохирох дулааны хэмжээг төдийгүй нэмэлт дулааныг цахилгаан энерги болгон хувиргах болно. Пелетьегийн халуун дулаан байдал Q P = nFT dE/ дТорчноос зээлсэн. Адиабатын нөхцөлд (дулаан тусгаарлах нөхцөлд, хүрээлэн буй орчинтой солилцох боломжгүй үед) системийн T буурдаг. Хэрэв систем хөргөх нь ялангуяа мэдэгдэхүйц юм dE/ дТ > 0 < 0 (реакция эндотермична).
2. ХэрэвdE / дТ < 0 , дараа нь nFE< (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. ХэрэвdE / дТ = 0 , дараа нь DG = DH ба nFE = - системээс урвуу байдлаар үйлдвэрлэсэн цахилгаан энерги нь химийн урвалын дулааны эффекттэй тэнцүү байна. Энэ харилцааг гэж нэрлэдэг Томсоны зарчим (дүрэм) .
EMF-ийг тооцоолохын тулд тэгшитгэлийг дараах байдлаар дахин бичиж болно.
Тэгшитгэлийг ашиглахдаа тэдгээрийг санаж байх ёстой зөвхөн буцах боломжтой цахилгаан химийн системд хүчинтэйТиймээс EMF-ийн T-ээс хамаарлыг судлахдаа шингэний хил хязгаартай цахилгаан химийн системийг ашиглахаас зайлсхийх хэрэгтэй. тэдгээр дээр үүсэх тархалтын потенциал нь тэнцвэрт байдал биш юм.
Элементийн EMF-ийг тухайн элементэд үүсэх урвалын тэнцвэрийн тогтмолтой холбоно. Химийн урвалын изотермийн тэгшитгэл:
DG = RT lnК а - RT
E = - = lnК а -
Өгөгдсөн P, T-ийн тэгшитгэлийн баруун талд байгаа эхний гишүүн нь тогтмол утга бөгөөд үүнийг E o гэж тэмдэглэж болно. Э о - элементийн стандарт EMF (цахилгаан химийн систем) , өөрөөр хэлбэл Ер нь EMF a i = 0.
E = E o + ln
 = E o + 2.303 lg
= E o + 2.303 lg 
Тиймээс цахилгаан химийн системийн EMF нь цахилгаан химийн урвалд оролцогчдын үйл ажиллагааны функц юм. Дээрх тэгшитгэлүүд нь DG ба K-ийн утгыг тооцоолох боломжтой болгодог А E-ийн туршилтын утгууд дээр үндэслэн химийн урвалын термодинамик шинж чанарыг мэдэж, эсрэгээр E-г тооцоолно.
EMF хэмжилт .
Цахилгаан химийн элементийн EMF-ийн тэнцвэрт (буцах) утгыг хэмжихийн тулд процесс нь хязгааргүй удаан явагдах шаардлагатай, өөрөөр хэлбэл. ингэснээр элемент нь хязгааргүй бага гүйдлээр ажилладаг. Энэ нөхцөлийг нөхөн олговрын аргад хангасан бөгөөд энэ нь элементийг гадны потенциалын зөрүүний эсрэг цуваа холбож, хэлхээнд ямар ч гүйдэл байхгүй байхаар сонгоход суурилдаг. Дараа нь гадаад потенциалын зөрүү нь хэлхээний EMF-тэй тэнцүү байна.
Нөхөн олговрын аргыг ашиглан та EMF-ийн утгыг шууд хэмжиж болно, гэхдээ энэ нь нэлээд төвөгтэй ажиллагаа тул лабораторийн практикт судалж буй элементийн EMF-ийг стандарт (хэвийн) гэж нэрлэгддэг EMF-тэй харьцуулахыг илүүд үздэг. янз бүрийн Т-д нарийн хэмждэг элементүүд. Энэхүү харьцуулсан арга нь мөн нөхөн олговор юм.
Үндсэн хэвийн элемент нь ханасан Уэстон элемент .
(EMF хэмжилтийн хэлхээ - бие даасан).
ЭЛЕКТРОДЫН ХИЛИЙН БҮТЭЦ - ШИЙДЭЛ. ДАВХАР ЦАХИЛГААН ДАВХАР .
Эхний төрлийн дамжуулагч электролиттэй шүргэлцэх үед а цахилгаан давхар давхарга . Жишээ болгон CuSO 4 уусмалд дүрсэн зэс электродыг авч үзье. Өгөгдсөн T дахь метал дахь зэсийн ионы химийн потенциалыг тогтмол гэж үзэж болох бөгөөд уусмал дахь зэсийн ионы химийн потенциал нь давсны концентрацаас хамаардаг; Ерөнхийдөө эдгээр химийн потенциалууд нь ижил биш юм.
CuSO 4-ийн концентрацийг >. Дараа нь металыг уусмалд дүрэх үед уусмал дахь Cu 2+ ионуудын зарим нь усгүйжүүлээд метал руу шилжиж, дээр нь эерэг цэнэг үүсгэдэг. Энэ цэнэг нь уусмалаас Cu 2+ ионыг металл руу шилжүүлэхээс сэргийлж, электродын ойролцоо түүнд татагдсан SO 4 2- анионуудын давхарга үүсэхэд хүргэдэг. гэж нэрлэгддэг цахилгаан химийн тэнцвэрт байдал , энэ үед металл болон уусмал дахь ионуудын химийн потенциал нь үүссэн давхар цахилгаан давхаргын (DEL) потенциалын зөрүүний хэмжээгээр ялгаатай байх болно:
Цахилгаан химийн тэнцвэрт байдалд цахилгаан потенциалын зөрүү ба химийн потенциалын зөрүүг нөхдөг.
CuSO 4-ийн концентраци маш бага байх ёстой< . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
Металл болон уусмал дахь ионуудын химийн потенциал ижил байх электролитийн концентрацийг сонгож болно. Энэ концентрацийн уусмалыг нэрлэдэг тэг шийдэл . Металлыг тэг уусмалд дүрэх үед электродын гадаргуу дээр EDL үүсэхгүй, гэхдээ энэ тохиолдолд ч металл ба уусмалын хоорондох боломжит ялгаа тэг биш байна.
Нернстийн хэлснээр цахилгаан химийн эсийн EMF-ийн цорын ганц эх үүсвэр нь электродын гадаргуу дээрх EMF юм. Нернст тэг уусмал дахь металлын потенциалыг үнэмлэхүй тэг потенциал гэж тодорхойлсон. А.Н.Фрумкины бүтээлүүдэд Нернстийн санаа буруу болохыг харуулсан. Хоёр өөр электродын тэг уусмалд дүрсэн элементийн EMF нь тэгээс (магадгүй 1 В-оос их) ялгаатай болохыг туршилтаар тогтоосон. Тэг уусмал дахь металлын потенциал гэж нэрлэдэг тэг цэнэгийн боломж , үнэмлэхүй тэг потенциал гэж үзэх боломжгүй.
ХЕЛЬМГОЛЬЦИЙН ӨГҮҮРДЭГДСЭН ДАВХАР ДАВХРАГЫН ОНОЛ. Металл уусмалын интерфейс дэх DEL-ийн бүтцийн анхны тоон онолыг Хельмгольц (1853) бүтээсэн. Helmholtz-ийн хэлснээр EDL-ийг хавтгай конденсатортай адилтгаж болох бөгөөд түүний хавтангийн нэг нь металл дахь гадаргуугийн цэнэгүүдийг дайран өнгөрөх онгоцтой, нөгөө нь уусмал дахь ионуудын цэнэгийн төвүүдийг холбосон хавтгайтай давхцдаг. цахилгаан статик хүчээр металлын гадаргууд татагдана. Давхар давхаргын зузаан лионы радиустай тэнцүү байна r. Цахилгаан саармаг байдлын нөхцлийн дагуу металлын гадаргууд татагдсан ионуудын тоо нь тэдгээрийн цэнэг нь металын гадаргуугийн цэнэгийг нөхөх ёстой.
Өтгөрүүлсэн давхар давхаргын онол нь туршилтанд нийцсэн EDL багтаамжийн утгыг олж авах, EDL-ийн физикийн хувьд үнэмшилтэй зузааныг олж авах боломжийг олгодог. Гэсэн хэдий ч энэ нь олон туршилтын зүй тогтлыг тайлбарлаж чадахгүй: туршилтаар олдсон электрокинетик потенциал (х-потенциал) ба тэдгээрийн электролитийн концентрацаас хамаарах хамаарал, гадаргуун идэвхтэй бодис байгаа тохиолдолд металлын гадаргуу дээрх цэнэгийн тэмдгийн өөрчлөлт. .
ДИФФУЗ ДАВХАРЛАГЫН ОНОЛ- ЧАПМАН. Хельмгольцын онол нь электролитийн концентрацитай хамт DES-ийн шинж чанар өөрчлөгддөгийг харгалздаггүй бөгөөд Т.Гуи (1910), Чапман (1913) нар ДЭС дахь цэнэгийн нягтыг уусмалын найрлагатай холбохыг оролдсон. Металл ба ионуудын хооронд үүсдэг электростатик хүчнээс гадна ионууд нь дулааны молекулын хөдөлгөөний хүчинд нөлөөлдөг гэдгийг тэд анхаарч үзсэн. Эдгээр хоёр хүчийг хэрэглэх үед уусмал дахь ионууд нь металлын гадаргуутай харьцуулахад тархсан байх ёстой - зайнаас холдох тусам эзэлхүүний цэнэгийн нягт буурдаг.
Гоуи, Чапман нар ионуудыг өөрийн эзэлхүүнгүй, харин цэнэгтэй материаллаг цэг гэж үзэж болох ба электродын цэнэгийн талбар дахь тархалт нь Больцманы хуваарилалтад захирагддаг гэж үздэг.
Гоуи-Чапманы онол нь Гельмгольцын онолоос илүү цахилгаан кинетик үзэгдлийн хуулиудтай нийцдэг. Хэрэв бид тодорхой зайнаас эхэлдэг гэж үзвэл л 1 ион нь хатуу ба шингэн фазын харьцангуй хөдөлгөөнөөр электродын гадаргуутай нягт холбогддоггүй бол энэ зайд тохирох потенциалыг x-потенциал (x) гэж үзэж болно.< j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
Тиймээс Гельмгольцын онолыг хэрэглэх боломжгүй гэж үзвэл Гуй-Чапманы онолыг хамгийн сайн зөвтгөдөг бөгөөд эсрэгээр нь эхнийх нь буруу үр дүн өгсөн тохиолдолд туршилттай илүү сайн нийцдэг. Иймээс DES-ийн бүтэц нь Хельмгольц, Гоуи-Чапман нарын санал болгосон загваруудын зарим хослолтой тохирч байх ёстой. Энэхүү таамаглалыг Штерн (1924) DEL-ийн шингээлтийн онолдоо хийсэн.
СТЕРН АДСОРБЦИЙН ОНОЛ. Стерн ионуудын тодорхой хэсэг нь металл-электролитийн интерфейсийн ойролцоо хадгалагдаж, электролитийн ионуудын дундаж радиустай тохирох зузаантай Гельмгольц эсвэл конденсацсан давхар давхарга үүсгэдэг гэж үздэг. EDL-д багтсан үлдсэн ионууд нь цэнэгийн нягтрал аажмаар буурч сарнисан байдлаар тархдаг. EDL-ийн сарнисан хэсгийн хувьд Стерн нь Гоуи шиг ионы дотоод хэмжээг үл тоомсорлосон. Нэмж дурдахад, Стерн EDL-ийн өтгөн хэсэгт ионууд нь зөвхөн цахилгаан статик хүчнээс гадна шингээх тусгай хүчнээс болж хадгалагддаг гэж санал болгов. Кулоноос гаралтай бус хүчнүүд. Иймээс гадаргуугийн идэвхтэй ион агуулсан уусмалд EDL-ийн нягт хэсэг дэх тэдгээрийн тоо нь ионуудын шинж чанар, металлын цэнэгээс хамаарч металлын гадаргуугийн цэнэгээс тодорхой хэмжээгээр давж болно. Тиймээс Стернийн хэлснээр DES-ийн хоёр загварыг ялгах ёстой бөгөөд тэдгээрийн нэг нь гадаргуугийн идэвхгүй электролитийн уусмал, нөгөө нь тусгай шингэсэн ион агуулсан уусмалуудтай холбоотой байдаг.
Адсорбцийн онолд тэгш байдал мөн хадгалагдана:
Q M = q L = q 1 + q 2
Уусмалын тал дахь цэнэгийн нягт q L нь Гельмгольцын давхаргын цэнэгийн нягт q 1 ба сарнисан давхарга дахь цэнэгийн нягт q 2 гэсэн хоёр хэсгээс бүрдэнэ.
Стернийн онол нь х-потенциалыг металл ба ионуудын хоорондох хүчтэй холбоо аль хэдийн алдагдсан EDL-ийн сарнисан хэсгийн боломжит уналт гэж тодорхойлох боломжийг бидэнд олгодог. Энэ тодорхойлолтоор х-потенциал нь туршилтаар ажиглагдсан шиг Нерстийн потенциалтай давхцах ёсгүй. Стернийн онол нь хатуу биетийн гадаргууг дахин цэнэглэж байгааг тайлбарлаж чадсан.
Хязгааргүй бага концентрацитай үед уусмал дахь бүх цэнэгүүд сарнисан байдлаар тархдаг бөгөөд EDL-ийн бүтцийг Гоуи-Чапманы онолоор дүрсэлсэн байдаг. Эсрэгээр, төвлөрсөн уусмалуудад DES-ийн бүтэц нь Хельмгольцын санал болгосон загварт ойртдог. Дундаж концентрацийн бүсэд x нь RT/F-тэй харьцуулж болох бөгөөд түүний концентрацаас хамаарах хамаарлыг ойролцоогоор тэгшитгэлээр илэрхийлж болно.
эерэг утгуудын хувьд x: x = B - ln-тай
x-ийн сөрөг утгуудын хувьд: x = B¢ + ln-тай
Стернийн онол нь DEL-ийн чанарын зөв дүр зургийг өгдөг. Стерн загварыг ашиглан багтаамжийг тодорхойлох нь багтаамжийн утгууд болон электродын потенциал ба уусмалын концентрацаас хамаарах шинж чанарын хувьд туршлагатай нийцэж байна. Гэхдээ Стернийн онол дутагдалтай зүйлээс ангид биш юм. Үүнд багтаамжийн муруйн тоон тодорхойлолтыг хийх боломжгүй, ялангуяа тэг цэнэгийн потенциалаас холдох үед багтана.
DES STANDING ОНОЛЫН ЦААШД ХӨГЖҮҮЛЭХ. Туршилтын өгөгдөлтэй тоон хувьд нийцсэн DES-ийн онолыг боловсруулах олон оролдлого хийсэн (Райс, Фрумкин нар, Бокрис, Деванатан, Эсин, Мюллер, Парсонс, Эршлер гэх мэт). Хамгийн их хүлээн зөвшөөрөгдсөн загвар бол Graham (1947) юм. Грахамын хэлснээр уусмал дахь DES бүрхүүл нь хоёр биш, харин гурван хэсгээс бүрддэг. Металлын гадаргуугаас эхнийх нь дотоод Гельмгольцын хавтгай гэж нэрлэгддэг; энэ нь зөвхөн гадаргуугийн идэвхтэй ионуудыг агуулдаг (онгоцны цэнэг q 1) эсвэл хэрэв тэдгээр нь уусмалд байхгүй бол уусгагчийн молекулууд (q 1 = 0); уусмалтай холбоотой түүний потенциалыг y 1-ээр тэмдэглэнэ. Металл гадаргуугаас ионууд (тэдгээрийн цэнэгийн төвүүд) ойртох зайд зайлуулсан дараагийнхыг Гельмгольцын гаднах хавтгай гэж нэрлэдэг; түүний нийт цэнэг q 2, онгоцны потенциал нь y 2 байна. Гельмгольцын гадна талын хавтгайн ард y 2-оос тэг хүртэл хэлбэлзэх потенциалтай, q 2-той давхцах цэнэгийн нягттай сарнисан давхарга байдаг.
Грахамын загвар нь металл-электролитийн DES бүтцийн үндсэн шинж чанар, шинж чанарыг тусгасан байдаг. Энэ нь ядаж нэг уусмалын туршилтын муруй байгаа тохиолдолд өгөгдсөн электролитийн аливаа концентрацийн дифференциал багтаамжийн муруйг тооцоолох боломжийг танд олгоно. Гэсэн хэдий ч энэ загвар нь асуудлын бүх талыг хамардаггүй.
Цахилгаан гүйдэл нь уусмалаар дамжин өнгөрөхөд электродын гадаргуу дээр гүйдэл гүйдэг. цахилгаан химийн урвал, тэдгээр нь электрод руу эсвэл электродоос гарах электронуудын урсгал дагалддаг. Урвуу үйл явцын хувьд эхний ба хоёр дахь төрлийн дамжуулагчийн хоорондох интерфэйс дээр үүсэх цахилгаан химийн урвал нь цахилгаан гүйдэл үүсгэхэд хүргэдэг.
Цахилгаан химийн процессууд нь ердийн химийн урвалаас хэд хэдэн шинж чанараараа ялгаатай байдаг.
Химийн урвал нь зөвхөн урвалд орж буй тоосонцор мөргөлдөх үед л боломжтой байдаг. Тэд хүрэлцэх үед электронууд нэг бөөмсөөс нөгөөд шилжих боломжтой болдог. Ийм шилжилт үнэхээр тохиолдох эсэх нь бөөмсийн энерги, тэдгээрийн харилцан чиг хандлагаас хамаарна. Идэвхжүүлэх энерги нь химийн урвалын шинж чанараас хамаардаг бөгөөд ионы урвалын хувьд энэ нь ихэвчлэн бага байдаг. Электрон шилжилтийн зам маш богино байдаг нь химийн урвалын нэг онцлог юм. Бөөмүүдийн мөргөлдөөн нь урвалын орон зайн аль ч цэг дээр өөр өөр байрлалд тохиолдож болох тул электрон шилжилт нь дурын чиглэлд тохиолдож болно, жишээлбэл. Химийн процессын онцлог нь мөргөлдөөний санамсаргүй байдал, электрон шилжилтийн чиглэлгүй байдал юм. Үүний үр дүнд химийн урвалын эрч хүчтэй нөлөө нь голчлон дулааны хэлбэрээр илэрдэг (бага зэргийн тэлэлтийн ажил бас боломжтой).
Химийн хувиргалттай харгалзах энергийн өөрчлөлт нь цахилгаан энерги хэлбэрээр илрэхийн тулд, өөрөөр хэлбэл. Цахилгаан химийн процессыг үргэлжлүүлэхийн тулд урвалын нөхцлийг өөрчлөх шаардлагатай.
Цахилгаан эрчим хүч нь цахилгаан гүйдэл дамжихтай үргэлж холбоотой байдаг, өөрөөр хэлбэл. тодорхой чиглэлд электронуудын урсгал. Иймд электрон шилжилтүүд санамсаргүй бус, нэг чиглэлд явагдах, тэдгээрийн зам нь атомын хэмжээнээс хамаагүй том байхаар урвалыг явуулах ёстой. Тиймээс электрохимийн процесст электронуудын нэг оролцогчоос нөгөөд шилжих нь нэлээд зайд явагдах ёстой бөгөөд үүний тулд урвалд оролцогчдыг орон зайн тусгаарлах шаардлагатай байдаг. Гэсэн хэдий ч орон зайн тусгаарлалт нь дангаараа хангалтгүй, учир нь энэ нь зүгээр л урвалыг зогсооход хүргэдэг.
Цахилгаан химийн процессыг явуулахын тулд нэмэлт нөхцөл шаардлагатай: электронуудыг зарим бөөмсөөс салгаж, нэг нийтлэг аргаар бусдад шилжүүлэх ёстой. Энэ нь урвалд оролцогчдын хоорондох шууд холбоог металл дамжуулагчаар бие биетэйгээ холбосон хоёр металлтай харьцах замаар солих замаар хүрч болно. Электронуудын урсгал тасралтгүй байхын тулд цахилгаан гүйдлийг цахилгаан химийн урвалд оролцогчид өөрсдөө хийдэг (хэрэв тэдгээр нь ионжсон төлөвт байгаа бол) урвалын орон зайгаар дамжин өнгөрөхийг баталгаажуулах шаардлагатай. ионы дамжуулалт өндөртэй тусгай нэгдлээр .
Цахилгаан химийн урвалаар цахилгаан эрчим хүч үйлдвэрлэх төхөөрөмжийг нэрлэдэг цахилгаан химийн(эсвэл гальваник)бүрэлдэхүүн. Хамгийн энгийн цахилгаан химийн элемент нь электролитийн уусмалд (хоёр дахь төрлийн дамжуулагч) дүрсэн хоёр металл электродоос (эхний төрлийн дамжуулагч) бүрдэнэ.
Хэрэв цахилгаан гүйдэл өөр өөр чиглэлд дамжих үед электродын гадаргуу дээр ижил урвал явагдах боловч эсрэг чиглэлд байвал ийм электродууд, түүнчлэн тэдгээрээс бүрдсэн цахилгаан химийн элементүүдийг нэрлэдэг. буцаах боломжтой. Урвуу элементийн жишээ бол Даниел-Жакоби элемент юм
(–) Zn | ZnSO 4, уусмал || CuSO 4, уусмал | Cu(+)
Ийм элемент ажиллах үед электродууд дээр цахилгаан химийн урвал явагдана.
Zn Zn 2 + + 2e
Cu 2 + + 2eCu
Элемент дэх урвалын ерөнхий тэгшитгэлийг дараах байдлаар илэрхийлж болно
Zn + Cu 2 + Zn 2 + + Cu
Гадны эх үүсвэрээс хязгааргүй жижиг гүйдэл нь элементээр дамжих үед эдгээр урвалууд эсрэг чиглэлд явагдана.
Жишээ эргэлт буцалтгүйэлемент нь Вольта элемент юм
(–) Zn | H2SO4 | Cu(+)
Ийм элемент ажиллах үед электродууд дээр дараах урвал явагдана.
Zn Zn 2 + + 2e
2H + + 2eH 2,
ба элемент дэх урвалыг тэгшитгэлээр илэрхийлнэ
Zn + 2H + Zn 2+ + H 2
Гадны эх үүсвэрээс гүйдэл дамжуулах үед электродууд дээр бусад урвал явагдана.
Cu Cu 2 + + 2e,
тэдгээр. цахилгаан химийн үүрэнд зэс нь хүхрийн хүчилд уусдаг бөгөөд устөрөгч ялгардаг.
Cu + 2H + Cu 2 + + H 2
Цахилгаан химийн эсийн хамгийн чухал шинж чанар нь түүний цахилгаан хөдөлгөгч хүч(EMF) Э– зөв нээлттэй элементийн боломжит зөрүү, өөрөөр хэлбэл. гальваник элементийн электродуудтай холбогдсон ижил материалын эхний төрлийн дамжуулагчийн төгсгөлүүдийн боломжийн зөрүү. Өөрөөр хэлбэл, EMF нь хэлхээнд цахилгаан гүйдэл урсахгүй байх үед тэнцвэрийн нөхцөл дэх боломжит зөрүү юм. Хэрэв та электродыг хаавал хэлхээнд цахилгаан гүйдэл урсах ба боломжит ялгаа нь илэрхийлэгддэг хүчдэлэлементийн дотоод эсэргүүцлийн хүчдэлийн уналтын хэмжээгээр EMF-ээс ялгаатай цахилгаан химийн элемент.
Цахилгаан химийн элементүүдийн зорилго нь ашигтай элемент орсон гадаад хэлхээнд электронуудын хөдөлгөөнийг дэмжих явдал юм.
ачаалал. Тиймээс, даалгавраа биелүүлэхийн тулд түлшний эс нь электронуудын эх үүсвэр ба шингээгчийг агуулсан байх ёстой (Зураг 7.1).
"Исэлдүүлэх" гэсэн нэр томьёо нь электрон ялгаруулах үйл явцтай, "багасгах" гэсэн нэр томьёо нь электрон ялгаруулах үйл явцтай тохирдог тул цахилгаан химийн эсэд тохиолддог урвалыг бууралт-урвал гэж нэрлэдэг.
Олон тооны хоцрогдсон шинжлэх ухааны ойлголтуудын утга нь нэрнээс нь ойлгомжгүй байдаг.“Исэлдүүлэх”, “багасгах” гэсэн нэр томьёо нь тайлбар шаарддаг. Зүүн өмнөд хэсэгт хүчилтөрөгч (хүчилтөрөгч) нь латин хэлний oxus (исгэлэн эсвэл халуун, хурц) язгуураас гаралтай бөгөөд "хүчил үйлдвэрлэгч" гэсэн утгатай. Энэ нэрийг 1787 онд хэвлэгдсэн Морве, Лавуазье нарын "Химикийн нэршил" хэмээх бүтээлд анх ашигласан. Тухайн үед химич нар буруу итгэл үнэмшлийг баримталж байжээ. Хүчилтөрөгч нь хүчилд агуулагддаг гол элемент бөгөөд хүчил усанд уусвал түүний найрлагад орсон устөрөгчийн атомын нэг хэсэг нь электроноо алддаг - ус хүчиллэг болж, устөрөгч исэлддэг. Шинжилгээгээр электрон алдагдах үйл явцтай холбоотой аливаа урвалыг исэлдэлт гэж нэрлэдэг. Урвуу урвал - электрон барих урвалыг ■болох гэж нэрлэдэг.
Урсгал
J электронууд
Электрон эх үүсвэр >
(исэлдэлт)
Эерэг< -
цахилгаан гүйдлийн чиглэл Зураг. 7.1. Цахилгаан химийн эс нь электронуудын эх үүсвэр ба шингээгчийг агуулсан байх ёстой
Цахилгаан химийн үүрэнд ерөнхий урвал нь төхөөрөмжийн тусдаа хэсэгт тохиолддог хоёр завсрын урвалд хуваагддаг. Эдгээр хэсгүүд нь ионуудын дамжуулагч болох электролитээр нийлдэг боловч завсрын исэлдэлтийн урвалаар ялгардаг электронуудыг дамжуулдаг бөгөөд электронууд нь бууралтын урвал явагдах хэсэгт нэвтэрч болно, гэхдээ гадаад хэлхээгээр. Тиймээс гадаад хэлхээнд цахилгаан гүйдэл үүсдэг бөгөөд цахилгаан химийн эс нь түүний эх үүсвэр юм - энэ бол түүний зорилго юм. Гаднах хэлхээн дэх цахилгааны эерэг чиглэл нь элементийн исэлдэлтийн бууралтын бүсээс чиглэсэн чиглэл байхаар тохиролцсон - цахилгаан гүйдэл нь бууралтын бүсийн элементийг орхиж, улмаар түлшний катод - o элемент, ба исэлдэлтийн мужид ордог бөгөөд энэ нь анод юм. Бусад цахилгаан эх үүсвэрүүдийн нэгэн адил катод нь эерэг цэнэгтэй байдаг
идэвхтэй электрод бөгөөд анод нь сөрөг цэнэгтэй электрод юм. Цахилгаан эрчим хүч (ачаалал) хэрэглэгчдийн тухай ярихад нэрс нь эсрэгээрээ өөрчлөгддөг. Танилцуулгад Ч. 6 "Анод" ба "катод" гэсэн нэр томъёог илүү нарийвчлан авч үзсэн болно.
Электрохимийн эсийн жишээ болгон электролитийн үүрэг гүйцэтгэдэг мембраныг авч үзье. Мембраны хажуугийн гадаргуугийн аль нэг нь устөрөгчтэй холбоо тогтооно. Хэвийн нөхцөлд хий нь голчлон молекул устөрөгчөөс бүрдэх боловч цөөн тооны молекулууд атомуудад задарч болно.
мөн зарим атомууд исэлдэх (иончлох), өөрөөр хэлбэл электроноо алдах болно
N -> Nt + e~ .
Мембран нь электроныг нэвчүүлэхгүй тул тэдгээр нь бүгд түүний нэг талд үлдэж, үүссэн ионууд нь дифференциар дамждаг; мембранаар дамжуулан тэд өөрсдийгөө нөгөө талд олох болно. Энэ тохиолдолд ионууд эерэг цэнэг тээдэг тул устөрөгч байрладаг мембраны гадаргуу дээр хуримтлагдсан электронуудын илүүдэлээс болж сөрөг цэнэгтэй, харин эсрэг талын гадаргуу эерэг цэнэгийн улмаас эерэг цэнэгтэй болно. тархалтын улмаас үүн дээр гарч ирсэн ионууд. Цахилгаан орон нь ионуудын заримыг мембраны "устөрөгч" гадаргуутай эсрэг чиглэлд хөдөлгөдөг. Ионуудын тархалтын урсгал st байх үед авч үзэж буй систем дэх динамик тэнцвэрт байдал тогтоогддог. i нь урвуу гүйдэлтэй тэнцүү байна.
Одоо мембраны хоёр гадаргуу дээр цахилгаан дамжуулагч нунтаг түрхье. Ингэснээр электродын үүрэг гүйцэтгэх хоёр сүвэрхэг цахилгаан дамжуулагч давхарга үүсэх болно. Электродуудын цахилгаан холболтыг ханган гадаад халаагуур1-ийг электродуудад холбоно. Чухал ач холбогдол бүхий Rl хүртэл ачааллын эсэргүүцэл. Ионууд гадаад хэлхээнд хөдөлж чадахгүй бөгөөд электронууд илүүдэл байгаа "устөрөгч" хэсгээс мембраны эсрэг тал руу шилжиж, гадаад хэлхээнд цахилгаан гүйдэл үүсгэдэг. 7.2. Бидний сонирхож буй урвал нь "ус" электрод дээр тохиолддог бөгөөд тэгшитгэлээр тодорхойлогддог
2H2 -> 4H+ + 4e (анод урвал)
Элементийн үйл ажиллагааны тодорхойлсон схем нь нэг чухал сул талтай: энэ нь термодинамикийн эхний хуультай зөрчилдөж байна. Үнэн хэрэгтээ, цахилгаан гүйдэл гадны ачааллаар урсах үед түүний хэмжээ нь I2RL бүтээгдэхүүнээр тодорхойлогддог. Үүний зэрэгцээ цахилгаан
катодын бүсэд очиж, мембранаар дамжин тархдаг H+ ионуудтай нэгдэж, устөрөгчийн атомыг үүсгэж, эцэст нь "түлш" болгон ашигладаг H2 хийн молекулуудыг үүсгэдэг. Хэрэв процесс өгөгдсөн схемийн дагуу явагдсан бол бид түлшний зарцуулалтгүйгээр дулааныг авах болно.
Гаднах хэлхээ нь зөвхөн электронуудын хөдөлгөөний замыг үүсгэдэг боловч энэ нь өөрөө цахилгаан гүйдэл үүсэх шалтгаан болж чадахгүй. Яг л хоолойны нэг үзүүрийг нуур руу буулгавал ус өөрөө хоолой руу урсахгүй. Ус урсахын тулд нөгөө үзүүр нь усны гадаргуугаас доогуур байх ёстой. Үүний нэгэн адил гадаад хэлхээнд цахилгаан гүйдэл нэвтрүүлэхийн тулд катодын бүс дэх rhmodynamic потенциалыг багасгах шаардлагатай. Үүнийг хийх хамгийн хялбар арга бол молекулууд нь электрон ба ионуудтай нийлж ус үүсгэдэг хүчилтөрөгч нэмэх явдал юм.
4е“ + 4Н+ + 02 -» 2Н20 (катодын урвал). (4)
Урвал нь экзотермик, өөрөөр хэлбэл устөрөгчийг шатаах үед тохиолддог шиг дулааны энерги биш харин голчлон цахилгаан энерги ялгардаг. Энэ энерги нь түлшний элементийг тэжээдэг нь ойлгомжтой.
Цахилгаан химийн эсийн дүрсэлсэн диаграммыг Зураг дээр үзүүлэв. 7.2.
Хэвийн нөхцөлд сарнисан устөрөгчийн молекулын * хэсэг нь бүтэн бүсэд бага байдаг. Физик параметрүүдийг өөрчлөх замаар үүнийг бага зэрэг нэмэгдүүлэх боломжтой
метрийг Le Chatelier-ийн зарчмын дагуу . жишээлбэл, системийн температурыг нэмэгдүүлэх замаар. Устөрөгчийн молекулуудын диссоциацийн түвшинг катализаторын нөлөөгөөр нэмэгдүүлэх боломжтой.
Цахилгаан химийн эсэд тохиолддог бүрэн урвалыг тэгшитгэлээр тодорхойлно.
2H2 + 02 -> 2H?0.
Алессандро Вольтагийн (1745-1800 онд) зохион бүтээсэн цахилгаан химийн элемент нь тасралтгүй горимд цахилгаан гүйдэл үүсгэдэг анхны төхөөрөмж бөгөөд давсны уусмалд дэвтээсэн цаасаар тусгаарлагдсан цайр, мөнгө (эсвэл зэс) сууриудаас бүрддэг. .Гальваник батарей үүссэн.Элементүүдийг цуваа холбосноор нэг элементийн электродыг өөр элементийн ЦИНК электродтой шууд холбосон.
Энэ хүчлийн шингэрүүлсэн (жишээ нь 10%) уусмалд гагнасан болон зэс электродуудыг дүрэх замаар цахилгаан химийн Вольта эсийг хийж болно. Цайр исэлдүүлнэ:
Zn -> Zr,++ + 2e >
Үүний үр дүнд чөлөөт электронууд үүсдэг. Цайрын ионыг усанд уусгана. Хүхрийн хүчил нь хүчтэй хүчил1) нь ион болон хуваагдана:
H2S04 - "2Н+ + SOf"
Цайрын ионууд нь сульфатын ионуудтай нийлж цайрын сульфат үүсгэдэг. H" (H20)x гидронийн ион хэлбэрийн понтууд нь электролитээр дамжин электрод руу шилжих бөгөөд үүн дээр хийн бөмбөлөг хэлбэрээр ялгарах болно (гидронийн ион нь электрод руу II-ийн гаднаас ирж буй электронуудыг барьж авах үед). Энэ төрлийн цахилгаан химийн элемент нь практикт бараг ашиггүй, учир нь зэс электрод нь түүний гадаргуу дээр наалдсан устөрөгчийн бөмбөлөгүүдээр бүрхэгдэж, электрод руу орох ионуудын урсгалыг мэдэгдэхүйц бууруулна. "Хуурай эсүүд" гэж нэрлэгддэг бодисууд нь гадаргуу дээр тусгаарлах хийн давхарга үүсэхээс урьдчилан сэргийлэхийн тулд ямар нэг аргыг хэрэглэдэг.Устөрөгчийг шингээхэд ашигладаг химийн урвалжийг деполяризатор гэж нэрлэдэг.Хэрэглэсэн урвалжуудын нэг нь ихэвчлэн байдаг.
"> Хүчлийн хүч нь түүний молекулуудын усан уусмал дахь диссоциацийн түвшингээр тодорхойлогддог. С хүчил нь H+ ба C1_ ионуудад бүрэн задардаг - энэ нь хүчтэй хүчил юм. Хүхрийн хүчил нь арай сул боловч хүчтэй хүчлүүдэд хамаарна. Гайхалтай нь, флуоритын хүчил нь идэмхий чанар өндөртэй хэдий ч сул хүчил - n t уусмал бөгөөд тасалгааны температурт H+ ионуудын саармаг HF молекулуудын нийт концентрацид эзлэх хувь 3% -иас бага байна.
цөс, исэлдэлтэнд амархан өртдөг; Цайрыг ихэвчлэн хэрэглэдэг. Вольта элемент дэх зэс электрод нь химийн урвалд ордоггүй тул зэсийг хэрэглэдэггүй гэдгийг анхаарна уу.
Саяхныг хүртэл хямд гальваник батерейнууд нь анод нь цайраар хийгдсэн, катод нь бал чулуу нэмсэн (цахилгаан дамжуулалтыг нэмэгдүүлэхийн тулд) нунтаг манганы давхар ислийн давхаргаар бүрсэн бал чулуун саваагаар хийгдсэн Leclanchet эсийг ашигладаг байсан. Манганы давхар исэл нь ялгарсан устөрөгчийг шингээдэг бөгөөд энэ нь катодын гадаргуу дээр хийн давхарга үүсэхээс сэргийлдэг. Аммонийн хлоридыг электролит болгон ашигладаг. Орчин үеийн (шүлтлэг) батерейнууд нь шүлтлэг электролит ашигладаг.
Хэрэв анодын материалд ашигласан цайр нь туйлын цэвэр байсан бол энэ нь зөвхөн цахилгаан гүйдэл элементээр дамжих үед л хэрэглэгдэх болно. Бохирдол байгаа нь элемент ашиглаагүй байсан ч электродын зэврэлт үүсгэдэг (хольцууд нь электродын материалын дотор олон тооны микроскопийн цахилгаан химийн эсүүдийг үүсгэдэг). Ийм батерейг удаан хугацаагаар хадгалахын тулд анодыг цайр, мөнгөн усны хайлшаар хийдэг. Одоогоор Leclanche эсийг шүлтлэг батерейгаар бараг бүрэн сольсон.
Гаднаас эрчим хүч авах үед л олон химийн урвал явагддаг. Тэдгээрийг ихэвчлэн гадны гүйдлийн эх үүсвэрт холбосон электродууд дээр электролитийн эсүүд (электролизер) -д гүйцэтгэдэг. Эдгээр урвалыг судлах нь янз бүрийн бодисын шинж чанар, шинж чанарын талаар мэдээлэл өгөхөөс гадна электросинтез ашиглан шинэ химийн нэгдлүүдийг олж авах боломжийг олгодог. Аж үйлдвэрт цахилгаан химийн процессыг өргөн ашигладаг. Жишээ нь хлор, хөнгөн цагааны үйлдвэрлэл, цахилгаанаар бүрэх, цахилгаан олборлолт зэрэг орно. Химийн энергийг цахилгаан энерги болгон хувиргадаг гальваник эсүүд нь одоогийн эх үүсвэр болох батерей, аккумлятор, түүнчлэн түлшний эсүүдийн үндэс суурийг бүрдүүлдэг. Электрохими нь бусад цахилгаан үзэгдлүүдийг судалдаг: электролитийн уусмал дахь ионуудын зан байдал, ийм уусмалаар гүйдэл дамжих; цахилгаан орон дахь ионуудыг салгах (электрофорез); металлын зэврэлт, идэвхгүй байдал; биологийн систем дэх цахилгаан нөлөө (биоэлектрохими); фотоэлектрохимийн процесс (эс дэх цахилгаан химийн урвалд гэрлийн нөлөөлөл).
Түүхийн лавлагаа.
Тогтмол, хангалттай хүчтэй цахилгаан гүйдлийн эх үүсвэрийг бий болгосны дараа л системчилсэн цахилгаан химийн судалгаа хийх боломжтой болсон. Ийм эх сурвалж 18-19-р зууны төгсгөлд гарч ирэв. Л.Галвани, А.Вольта нарын ажлын үр дүнд. Галвани мэлхийний физиологийн үйл ажиллагааг судалж байхдаа санамсаргүйгээр хоёр өөр металл болон задалсан мэлхийн хөлний булчингаас бүрдсэн цахилгаан химийн хэлхээг бүтээжээ. Зэс тогтоогчоор бэхлэгдсэн сарвууг төмөр утсаар шүргэх үед булчин агшиж байв. Үүнтэй төстэй агшилт нь цахилгаан цэнэгийн нөлөөн дор үүссэн. Галвани энэ үзэгдлийг "амьтны цахилгаан" байгаатай холбон тайлбарлав. Эдгээр туршилтуудын өөр тайлбарыг Вольта өгсөн бөгөөд цахилгаан нь хоёр металлын холбоо барих цэг дээр үүсдэг бөгөөд мэлхийн булчингийн агшилт нь цахилгаан гүйдэл дамжин өнгөрсний үр дүн юм. Мөн цайр, зэс гэх мэт хоёр металл дискний хооронд давстай усанд дэвтээсэн хөвөн материал (даавуу эсвэл цаас) байрлуулж, хэлхээг хаасан үед гүйдэл үүссэн. Эдгээр "элементүүдийн" 15-20-ийг цувралаар холбосноор 1800 онд Вольта анхны химийн гүйдлийн эх үүсвэр болох "цахилгаан багана" -ыг бүтээжээ.
Химийн системд цахилгаан эрчим хүчний нөлөөлөл олон эрдэмтдийн сонирхлыг татав. Аль хэдийн 1800 онд В.Николсон, А.Карлайл нар "цахилгаан багана" -д холбогдсон цагаан алт, алтан утсыг ашиглан цахилгаан гүйдэл дамжуулахад ус устөрөгч, хүчилтөрөгч болж задардаг гэж мэдээлсэн. Эрт үеийн цахилгаан химийн судалгаануудаас хамгийн чухал нь Английн химич Х.Дэвигийн бүтээл байв. 1807 онд тэрээр бага зэрэг чийгшүүлсэн хатуу калийн гидроксидоор гүйдэл дамжуулж калийн элементийг тусгаарласан. Хүчдэлийн эх үүсвэр нь 100 гальван эсийн зай байсан. Металл натрийг ижил төстэй аргаар олж авсан. Дараа нь Дэви мөнгөн усны электрод ашиглан магни, кальци, стронци, бари зэргийг электролизээр тусгаарласан.
Дэвигийн туслах М.Фарадей электрод/уусмалын интерфейсээр урсах цахилгааны хэмжээ (одоо цагийн цаг) болон түүний үүсгэсэн химийн өөрчлөлтүүдийн хоорондын хамаарлыг судалжээ. Электролитийн эсэд ялгарах устөрөгч ба хүчилтөрөгчийн эзэлхүүнээс цахилгааны хэмжээг хэмжих хэрэгсэл (одоо хийн кулометр гэгддэг) бүтээгдсэн бөгөөд өгөгдсөн хэмжээг олж авахад шаардагдах цахилгааны хэмжээг (1833) харуулсан. Энэ бодис нь электродын хэмжээ, тэдгээрийн хоорондох зай, эсийг тэжээж буй батерейны ялтсуудын тоо зэргээс хамаардаггүй. Үүнээс гадна Фарадей электролизийн явцад ялгарах бодисын хэмжээ нь түүний химийн эквивалент болон электролитээр дамжин өнгөрөх цахилгааны хэмжээтэй шууд пропорциональ байдгийг олж мэдсэн. (Химийн эквивалент гэдэг нь нэг моль атом (1.0078 г) устөрөгчтэй урвалд орох буюу нэгдлүүдийн нэгдлүүдийг орлуулах элемент эсвэл нэгдлүүдийн граммын тоо юм; см. ЭКВАЛЕНТ МАСС). Эдгээр хоёр үндсэн заалтыг Фарадейгийн хууль гэж нэрлэдэг. Фарадей сонгодог филологийн чиглэлээр мэргэшсэн найз В.Вуэллийнхээ хамтаар цахилгаан химийн салбарт шинэ нэр томьёо боловсруулжээ. Тэрээр уусмалд дүрсэн дамжуулагчийг электрод гэж нэрлэдэг (өмнө нь тэдгээрийг туйл гэж нэрлэдэг байсан); "электролиз" (гүйдэл дамжихтай холбоотой химийн өөрчлөлтүүд), "электролит" (цахилгаан химийн эсийн доторх шингэн дамжуулагч), "анод" (исэлдэлтийн урвал явагддаг электрод), "катод" (электрод) гэсэн ойлголтуудыг нэвтрүүлсэн. бууруулах урвал үүсдэг). Тэрээр шингэн дэх цэнэг зөөгчийг ион (Грек хэлнээс "тэнүүчлэгч", "тэнүүчлэгч") гэж нэрлэдэг бөгөөд анод руу чиглэсэн ионуудыг (эерэг электрод) "анионууд", катод руу хөдөлж буй ионуудыг "катионууд" гэж нэрлэдэг. Фарадейгийн цахилгаан соронзон индукцийн судалгаа нь цахилгаан үүсгүүрийг бий болгоход хүргэсэн бөгөөд энэ нь цахилгаан химийн процессыг үйлдвэрлэлийн хэмжээнд явуулах боломжтой болгосон.
Фарадей уусмалуудын цахилгаан гүйдэл дамжуулах чадварыг тэдгээрт ион байгаагаар тайлбарласан боловч өөрөө болон И.Хитторф, Ф.Кольрауш зэрэг эрдэмтэд ионууд гүйдлийн нөлөөн дор үүсдэг гэж үздэг. 1884 онд С.Аррениус үнэндээ давсыг усанд уусгахад л ион үүсдэг гэж үзсэн. С.Аррениус, Ж.вант Хофф, В.Оствальд нарын бүтээлүүд нь электролитийн онол, уусмалын физик-химийн шинж чанар, түүний термодинамикийн талаархи санаа бодлыг хөгжүүлэх чухал үе шат байв. Уусмал дахь ионы дамжуулалт ба тэнцвэрийн талаархи онол болон туршилтын өгөгдлүүдийн хоорондын уялдаа холбоо нь 1923 онд П.Дебай, Э.Хюкель нар ионуудын хоорондох алсын зайн электростатик харилцан үйлчлэлийг харгалзан үзсэний дараа илүү бүрэн болов.
Электрохимийн термодинамик, ялангуяа цахилгаан химийн элементийн цахилгаан потенциал (хүчдэл) болон цахилгаан, химийн болон дулааны энергийн тэнцвэрт байдлыг тодруулахад томоохон хувь нэмэр оруулсан нь Ж.Гиббс, В.Нернст нар юм. Электрохимийн потенциал нь эсэд тохиолддог үйл явцын химийн энергиээр тодорхойлогддог боловч тэдгээрийн хурдаас (кинетик) хамаардаг. Электродууд дээрх кинетик процессын загварчлалыг Y. Tafel (1905), J. Butler (1924), M. Volmer (1930), A. N. Frumkin (1930–1933) нар хийсэн.
Цахилгаан химийн эсүүд.
Цахилгаан химийн элемент нь ихэвчлэн хоёр хагас эсээс бүрддэг бөгөөд тус бүр нь өөрийн электролитэд дүрэгдсэн электрод юм. Электродууд нь цахилгаан дамжуулагч материал (металл эсвэл нүүрстөрөгч) эсвэл хагас дамжуулагчаас бага байдаг. Электрод дахь цэнэг зөөгч нь электронууд, электролитийн цэнэг зөөгч нь ионууд юм. Электролит болох ширээний давсны усан уусмал (натри хлорид NaCl) нь цэнэгтэй хэсгүүдийг агуулдаг: натрийн катионууд Na + ба хлорын анионууд Cl -. Хэрэв та ийм уусмалыг цахилгаан талбайд байрлуулах юм бол Na + ионууд сөрөг туйл руу, Cl - ионууд эерэг туйл руу шилжинэ. NaCl зэрэг хайлсан давс нь мөн электролит юм. Жишээлбэл, электролитууд нь хатуу байж болно б- хөдөлгөөнт натрийн ион, эсвэл ион солилцооны полимер агуулсан хөнгөн цагаан исэл (натрийн полиалюминат).
Хагас эсүүд нь хуваалтаар тусгаарлагдсан бөгөөд энэ нь ионуудын хөдөлгөөнд саад болохгүй, харин электролитийг холихоос сэргийлдэг. Ийм хуваалтын үүргийг давсны гүүр, шилэн ноосоор хоёр төгсгөлд нь хаалттай усан уусмал бүхий хоолой, ион солилцооны мембран эсвэл сүвэрхэг шилэн хавтангаар гүйцэтгэж болно. Электролитийн эсийн хоёр электродыг нэг электролитэд дүрж болно.
Хоёр төрлийн цахилгаан химийн элемент байдаг: гальваник эс ба электролитийн эс (электролизер). Гальваник эсэд химийн урвалууд нь электрод/электролитийн интерфейс дээр аяндаа явагддаг бөгөөд электродууд хоорондоо дамжуулагчаар холбогддог. Цуврал холбосон хэд хэдэн гальваник эсүүд нь гүйдлийн химийн эх үүсвэр болох зайг үүсгэдэг. Электролитийн эсэд электрод/электролитийн интерфэйс дэх урвалууд нь цахилгаан эрчим хүчний гадаад эх үүсвэрийн улмаас үүсдэг; Сүүлийнх нь электродуудад үүсэх урвалын бүтээгдэхүүний химийн энерги болж хувирдаг. Гальваник эсийн бүтцийг Зураг дээр үзүүлэв. 1 ба электролизер - Зураг дээр. 2. Ашиглалтын горимоос хамааран ижил үүр нь гальван элемент эсвэл электролизерийн үүрэг гүйцэтгэдэг болохыг анхаарна уу. Тиймээс хар тугалганы хүчлийн машины аккумулятор нь хөдөлгүүрийг асаахад (цэнэглэх үед) гальваник элементийн үүрэг гүйцэтгэдэг бөгөөд машины генератор эсвэл цэнэглэгчээс цэнэглэх үед электролизерийн үүрэг гүйцэтгэдэг.
1836 онд Ж.Дэниел (1-р зураг) бүтээсэн энгийн гальваник элемент нь цайрын сульфатын усан уусмалд дүрсэн цайр, зэс (II) сульфатын усан уусмалд дүрсэн зэс гэсэн хоёр электродоос бүрдэнэ. Ийм элемент нь вольтийн баганад зэс-цайрын хостой төстэй. Гаднах хэлхээг хаах үед цайрын электродын гадаргуу дээрх цайрын атомууд электрон ялгарснаар ион болж исэлддэг: Zn ® Zn 2+ + 2e – . Эдгээр электронууд нь гадаад хэлхээний дагуу зэс электрод руу шилжиж, зэсийн ионуудыг атом болгон бууруулдаг: Cu 2+ + 2e – ® Cu. Гадаад хэлхээний электронуудын урсгал нь элементийн үүсгэсэн гүйдэл юм. Химийн хувирал, цахилгаан энерги үүсэхэд хүргэдэг ерөнхий урвал нь хэлбэртэй байдаг
Зэсийн сульфатын уусмалд металл цайр нэмэхэд яг ижил урвал явагддаг боловч энэ тохиолдолд химийн энерги нь дулааны энерги болж хувирдаг.
Электрохимийн эсүүдийг ихэвчлэн схемийн дагуу электрод ба электролитийн хоорондох хилийг босоо буюу налуу зураасаар (| эсвэл /) болон давсны гүүрийг хоёр налуу зураасаар (//) тэмдэглэдэг. Тиймээс, Зураг дээрх гальваник эс. 1 хариултын оруулга
Энд M нь уусмалын молийн концентраци юм.
Зурагт үзүүлсэн электролитийн үүрэнд. 2-т хлор ба шүлтийг үйлдвэрлэх үйлдвэрлэлийн электролизерийн нэгэн адил урвал явагдана: давсны уусмал (натри хлоридын төвлөрсөн усан уусмал) хлор ба натрийн гидроксид NaOH болгон хувиргах:
Графит электрод дээрх хлоридын ионууд нь хлорын хий болж исэлддэг ба төмрийн электрод дээрх ус нь устөрөгч ба гидроксидын ионууд болж буурдаг. Натрийн ионууд нь хуваалт - ион солилцооны мембранаар дамждаг тул электролит нь цахилгаан саармаг хэвээр байна. Исэлдэлт үүсэх электродыг (1-р зурагт цайр, 2-р зурагт бал чулуу) анод, бууралт үүсэх электродыг катод гэнэ.
Электродын потенциал.
Цахилгаан химийн элементүүдийн цахилгааны үндсэн үзүүлэлтүүд нь гүйдэл (ампераар хэмжигддэг, А) ба потенциал (вольтоор хэмжигддэг, V) юм. Одоогийн хүч нь электродын урвалын хурдаар тодорхойлогддог ба потенциал нь эсэд явагдаж буй үйл явцын химийн энергиээр тодорхойлогддог. Энэ нь энерги (жоуль, J-ээр хэмжигддэг) -ийг цахилгаан эрчим хүчний хэмжээгээр (кулоноор хэмжсэн, C) хуваасантай тэнцүү, i.e. 1 V = 1 Ж / Cl. Тиймээс элементийн потенциал (цахилгаан хөдөлгөгч хүч, EMF) нь түүний доторх урвалын үед үүссэн энергийн хэмжүүр юм. Хэрэв гадаад хэлхээ нээлттэй бол электродын урвал явагдахгүй.
Нээлттэй гадаад хэлхээтэй гальваник эсийн потенциал нь түүний урвалын термодинамикийн талаар мэдээлэл өгдөг. Зурагт үзүүлсэн элементийн потенциал. 1, 1 М-ийн уусмалын концентраци ба 25 ° C-ийн температурт - түүний стандарт боломж Э° – 1.10 В-тэй тэнцүү. Харгалзах энерги, Гиббсийн термодинамик потенциал, Д Г°, өгсөн байна
Хаана n- урвалын явцад шилжүүлсэн электронуудын тоо (энэ тохиолдолд 2), Ф- Фарадей дугаар (96 485 С / мэнгэ). Гальваник эсийн потенциал нь түүний хоёр хагас элементийн потенциалын зөрүүтэй тэнцүү, өөрөөр хэлбэл. түүний электродын потенциалын ялгаа. Электродын потенциалыг жишиг электродын потенциалтай харьцуулан хэмждэг бөгөөд үүнийг уламжлалт байдлаар тэг гэж үздэг ( см. хүснэгт). Зөвшилцлийн дагуу ердийн устөрөгчийн электродыг (N.H.E.) стандарт электродоор сонгосон; Энэ нь цагаан алтаар бүрсэн, 1.01H 10 5 Па (1 атм.) даралттай устөрөгчийн хийгээр ханасан, термодинамик идэвхжилтэй H + ион агуулсан уусмалд дүрсэн цагаан алтны хавтан юм. а= 1. Схемийн хувьд энэ электродыг Pt/H 2 (1.01H 10 5 Pa)/H + ( а= 1). Үүн дээр 2H + + 2e – ® H 2 урвал явагдана. Cu/Cu 2+ зэс электродын стандарт потенциалыг тодорхойлохын тулд дараах гальван элементийг угсарна.
ба хагас урвалын хувьд Cu 2+ + 2e – ® Cu хэмжилт өгдөг
Үүний нэгэн адил Zn 2+ + 2e – ® Zn урвал явагдах Zn/Zn 2+ хагас эсийн хувьд бид дараахийг олж авна.
Эдгээр хоёр стандарт электродын потенциалын ялгаа нь Zn-Cu элементийн стандарт потенциалтай тэнцүү байна.
Үнэн хэрэгтээ устөрөгчийн электродыг потенциометрийн хэмжилтэд бараг ашигладаггүй, учир нь энэ нь практикт хэрэгжүүлэхэд хэцүү хамгийн тохиромжтой системийг төлөөлдөг. Ихэнх тохиолдолд гүйдэлтэй харьцуулахад тодорхой, сайтар хэмжсэн боломжит утгатай янз бүрийн төрлийн илүү тохиромжтой, авсаархан харьцуулах электродуудыг ашигладаг. Ихэвчлэн тэд металл мөнгөн ус, мөнгөн усны хлорид (каломель) ба калийн хлоридын уусмалаас бүрдсэн каломель электрод (CE) ашигладаг: Hg / Hg 2 Cl 2 / KCl. Электрод дээр дараах урвал явагдана.
Боломжит k.e. мөнгөн усны ионы концентрацаас хамаарах ба сүүлийнх нь KCl уусмалын концентрацаас хамаарна. Ханасан KCl уусмалын хувьд Э° (k.e.) av = 0.2412 V (n.e.) 25 ° C-д.
|
СТАНДАРТ ЭЛЕКТРОДЫН БОЛОМЖТОЙ |
|
| Электродын урвал |
Эо, В |
| Li + + e – ® Li | |
| Mg 2+ + 2e – ® Mg | |
| Al 3+ + 3e – ® Al | |
| Zn 2+ + 2e – ® Zn | |
| Cr 3+ + e – ® Cr 2+ | |
| 2H + + 2e – ® H 2 | |
| Cu 2+ + 2e – ® Cu | |
| Fe 3+ + e – ® Fe 2+ | |
| O 2 + 4H + + 4e – ® 2H 2 O | |
| Cl 2 + 2e – ® 2Cl – | |
| F 2 + 2e – ® 2F – | |
Зарим электродын бодисыг харгалзах урвалын тэгшитгэлд оруулаагүй болохыг анхаарна уу. Тийм ээ, хариу үйлдэл
үнэндээ Pt/Fe 3+, Fe 2+ эсийн цагаан алт электрод дээр үүсдэг. Платинум электрод нь идэвхгүй бөгөөд зөвхөн элементийн исэлдсэн ба бууруулсан хэлбэрийг агуулсан электролиттэй (энэ тохиолдолд хоёр ба гурван валент төмрийн ионууд) холбоо барих боломжийг олгодог. Платин электрод нь N.V.E.-д ижил үүрэг гүйцэтгэдэг.
Электродын потенциалын хүснэгтүүд нь электродын потенциал дээр үндэслэн гальваник эсийн EMF-ийг тооцоолох боломжийг танд олгоно. Тэдгээрийг мөн тодорхой исэлдэлтийн урвал үүсэх эсэхийг урьдчилан таамаглахад ашиглаж болно. Урвалд оролцож буй бүрэлдэхүүн хэсгүүдийн идэвхжил 1-тэй тэнцүү байх үед л бид стандарт электродын потенциалын тухай ярьж болно. Тэдний уусмал дахь концентраци 1М-тэй ойролцоо байна. Электродын потенциал Эуусмал дахь исэлдсэн ба бууруулсан хэлбэрийн концентрацаас хамаарах ба тэдгээртэй болон стандарт потенциалтай холбоотой Э° Нернстийн тэгшитгэл. Ерөнхий урвалын хувьд
үхэр + n e - = улаан
Энэ тэгшитгэл нь хэлбэртэй байна
Хаана Р- бүх нийтийн хийн тогтмол, Т– үнэмлэхүй температур, – исэлдсэн ба бууруулсан хэлбэрийн үйл ажиллагаа. Цэвэр хатуу ба шингэний үйл ажиллагааг 1. 25°С-д тооцно RT/F= 0.025 В. Электродын потенциалыг жишиг электродын потенциалтай харьцуулан хэмжих замаар (10) тэгшитгэлийг ашиглан уусмал дахь бодисын концентрацийг тодорхойлох боломжтой; Энэ аргыг потенциометр гэж нэрлэдэг.
Электродын урвал.
Потенциометрийн хэмжилтийг цахилгаан химийн үүрэнд гүйдэл байхгүй нөхцөлд гүйцэтгэдэг. Энэ нь түүнд химийн ерөнхий өөрчлөлт гарахгүй бөгөөд хэмжсэн потенциал (тэнцвэр) нь урвалын термодинамикаар тодорхойлогддог гэсэн үг юм. Ийм нөхцөлд электродын хэмжээ, хэлбэр, уусмалыг хутгах эрч хүч зэрэг хүчин зүйлүүд хэмжсэн потенциалд нөлөөлдөггүй. Хэрэв гүйдэл цахилгаан химийн элементээр дамждаг бол электродын урвалын хурд нь зөвхөн термодинамик үзүүлэлтээс гадна тэгшитгэлийн дагуу гүйдлийн хүчнээс хамаарна.
Хаана n- өгөгдсөн электродын урвалд оролцож буй электронуудын тоо; Ф- Фарадей тоо. Энэ тохиолдолд цахилгаан химийн эсийн потенциал нь кинетик хүчин зүйлээс гадна электродыг хийсэн материал, электродын хэмжээ, хэлбэр, уусмалыг хутгах эрч хүч болон бусад олон хүчин зүйлээс хамаарна. Эсийн дотоод эсэргүүцлийг үл тоомсорлож болохгүй. Электрод/электролитийн хилийн аль алиных нь боломжит зөрүүгээс гадна уусмалын эсэргүүцэлтэй холбоотойгоор хүчдэлийн уналт нь өөрөө үүсдэг. Энэ хүчдэлийн уналт нь хоёр электрод дээр үүсэх урвалтай холбоотой нөлөөллийг судлахад хэцүү болгодог. Ихэвчлэн гурван электродын эсийг (3-р зураг) ашиглан ажлын буюу заагч электрод гэж нэрлэдэг нэг электрод дээр урвалыг судалдаг: гурав дахь электрод (жишээлбэл, ханасан каломель) нь ажлын нэг тасалгаанд байрладаг. нэг, омын хүчдэлийн уналтын нөлөөг багасгахын тулд аль болох ойртуулна. Ажлын электродоор дамжин өнгөрөх гүйдлийг энэ электродын лавлагаа электродтой харьцуулахад потенциалын функцээр хэмжсэнээр туйлшралын муруй.
Гадны гүйдэл дамжих үед электродын потенциал тэнцвэрт байдлаас ялгаатай байна. Энэ хазайлтыг туйлшрал гэж нэрлэдэг бөгөөд түүний хэмжээг хэт хүчдэл гэж нэрлэдэг. Хэт хүчдэл нь электродын урвалын хурдыг хязгаарладаг хэд хэдэн хүчин зүйлээс хамаардаг. Өгөгдсөн гүйдлийн нягт (нэгж электродын гадаргууд ногдох гүйдлийн хүч) хурдан электродын урвал нь термодинамиктай ойролцоо потенциалууд, тиймээс бага хэт хүчдэлийн үед тохиолддог. Удаан урвал нь өндөр хэт хүчдэлээр тодорхойлогддог. Электродын урвалын хурд, улмаар хэт хүчдэл нь урвалжийн концентраци, температур, уусгагч, электродын материал, масс дамжуулах арга, хурд, гүйдлийн нягтаас хамаарна. Нийт хэт хүчдэлийг хэд хэдэн бүрэлдэхүүн хэсэг болгон задалж болно: концентраци, идэвхжүүлэлт, урвал.
Гүйдэл өнгөрөхөд электродын гадаргуу дээрх урвалд орж буй ионы концентраци өөрчлөгддөг тул энэ хэсэгт цахилгаан идэвхтэй бодисууд идэгдэж, урвалын бүтээгдэхүүн үүсдэг. Зэс электрод дээр Cu 2+-ийн бууралтыг авч үзье. Эхлээд уусмал дахь Cu 2+ концентраци 1М байна. Хэлхээнд гүйдэл байхгүй тохиолдолд зэс электродын потенциал нь Cu / Cu 2+ хосын стандарт потенциалтай ойролцоо байна, өөрөөр хэлбэл. N.E-тэй харьцуулахад 0.34 В. [ см. тэгшитгэл (6)]. Катодын гүйдэл өнгөрөх тусам электродын гадаргуу дээрх Cu 2+ ионы концентраци буурч, Нернстийн тэгшитгэлийн (10) дагуу катодын потенциал улам бүр сөрөг болж байна. Урвалжийн шинэ хэсгүүд нь уусмалаас электрод руу янз бүрийн аргаар ирдэг: тархалт, конвекц, шилжилт хөдөлгөөний үр дүнд. Эдгээр үйл явцын хурд өндөр байх тусам (жишээлбэл, холих илүү эрчимтэй) концентрацийн хэт хүчдэл бага байх болно. Нийт хэт хүчдэлийн энэ бүрэлдэхүүнийг ихэвчлэн тооцоолж болно. Хэрэв концентрацийн туйлшрал нь нийт хэт хүчдэлд гол хувь нэмэр оруулдаг бол (энэ нь электродын урвалын үлдсэн үе шатуудын хурд өндөр гэсэн үг) бол урвалыг урвуу эсвэл Нернстиан гэж нэрлэдэг.
Идэвхжүүлэлтийн хэт хүчдэл нь электродын гадаргуу дээрх электрон дамжуулалт тэр даруй биш, харин хязгаарлагдмал хурдтай явагддаг тул үүсдэг. Ок + электродын ерөнхий урвалыг авч үзье n e - = улаан. Электроныг исэлдсэн нэгдлүүд рүү өгөгдсөн хурдаар (өөрөөр хэлбэл, өгөгдсөн гүйдлийн нягтар) шилжүүлэхийн тулд электродын урвалын идэвхжүүлэх энерги гэж нэрлэгддэг энергийн саадыг даван туулах шаардлагатай. Энэ энергийг хэрэглэсэн потенциалаар хангадаг. Гүйдлийн нягт ба идэвхжүүлэлтийн хэт хүчдэлийн хоорондын хамаарлыг Батлер-Волмер ба Тафелийн тэгшитгэлээр тодорхойлсон бөгөөд электродын урвалын кинетик параметрүүдийг тодорхойлоход ашиглаж болно. Усыг устөрөгч болон исэлдүүлэх зэрэг электродын олон урвалууд аажмаар явагддаг. Электродын урвалын хурд нь электродыг хийсэн материал, түүний гадаргуугийн шинж чанараас ихээхэн хамаардаг. Жишээлбэл, мөнгөн усны электрод дээр усыг устөрөгч болгон бууруулах нь нэлээд хэцүү байдаг: энэ нь устөрөгчийн хэт хүчдэлээр тодорхойлогддог. Энэ урвал нь илүү хурдан бөгөөд цагаан алтны хэт хүчдэл багатай явагддаг; Ийм учраас устөрөгчийн лавлагаа электрод цагаан алт хэрэглэдэг. Урвалын хурд нь электродын гадаргууд шингэсэн эсвэл холбогдсон бодисоос хамаарна; Тиймээс цианидын ион болон олон тооны органик нэгдлүүд нь цагаан алтны электродын гадаргуу дээрх устөрөгчийн ялгарлын хурдыг бууруулдаг. Үүний зэрэгцээ зарим гадаргуугийн идэвхтэй бодисууд электродын урвалын хурдыг ихээхэн нэмэгдүүлэх боломжтой - тэдгээрийг цахилгаан катализатор гэж нэрлэдэг.
Электрод дахь электрон дамжуулалтыг уусмал дахь химийн урвалтай хослуулах үед урвалын хэт хүчдэл үүсдэг. Ийм урвал нь электрон дамжуулалтад оролцдог бөөмсийн эх үүсвэр болж чаддаг бөгөөд нэгэн зэрэг электродын бүх процессын хурдыг хязгаарладаг. Ийм учраас электродын урвалын механизмын (жишээ нь, үе шат ба завсрын төлөв) нарийвчилсан мэдээллийг мэдэх нь маш чухал юм. Ихэнх тохиолдолд анхны материал нь электрод дахь эцсийн бүтээгдэхүүн болохоос өмнө хэд хэдэн өөрчлөлтөд ордог бөгөөд энэ нь хүчилтөрөгчийг ус болгон бууруулах үйл явцтай адил практик ач холбогдолтой үйл явц юм. Нийт урвал нь хэлбэртэй байна
Энэ нь хэд хэдэн үе шатаас бүрдэх ба нэг үе шатанд хүчилтөрөгч-хүчилтөрөгчийн холбоо тасардаг. Энэхүү олон үе шаттай урвалын улмаас ихэнх электродуудын урвал удаан байдаг бөгөөд үйлдвэрлэлийн хэмжээнд энэ нь цахилгаан катализаторын оролцоотойгоор явагддаг. Электродын урвалын механизмыг доор тайлбарласан цахилгаан аналитик аргуудыг ашиглан судалдаг. Уусмалын найрлага, уусгагчийн шинж чанар өөрчлөгдөхөд урвалын явц ихэвчлэн өөрчлөгддөг. Жишээлбэл, протоны дутагдалтай ацетонитрил дэх хүчилтөрөгчийн бууралт нь энгийн нэг электрон механизмын дагуу явагддаг.
Шинжилгээний цахилгаан химийн аргууд.
Химийн бодисын чанарын болон тоон шинжилгээнд зориулж янз бүрийн цахилгаан химийн аргуудыг боловсруулсан бөгөөд энэ нь электродын урвалын термодинамик ба кинетик параметрүүдийг тодорхойлох, тэдгээрийн механизмыг судлахад ихэвчлэн хэрэгтэй байдаг.
Кондуктометр
уусмалын цахилгаан дамжуулах чанарыг хэмжихэд үндэслэсэн бөгөөд давс, хүчил, суурь гэх мэт концентрацийг тодорхойлоход ашигладаг. Кондуктометрийн тодорхойлолтод ихэвчлэн ижил материалаар хийгдсэн электродуудыг ашигладаг бөгөөд тэдгээрийн ажиллах нөхцлийг электрод/электролитийн интерфэйсүүдийн аль алинд нь боломжит үсрэлтүүдийн хувь нэмрийг хамгийн бага байлгахаар сонгодог (жишээлбэл, өндөр давтамжийн ээлжит гүйдлийг ашигладаг). ). Энэ тохиолдолд хэмжсэн эсийн потенциалд гол хувь нэмэр нь омын хүчдэлийн уналтаар хийгддэг IR, Хаана Р- уусмалын эсэргүүцэл. Нэг бүрэлдэхүүн хэсэгтэй уусмалын цахилгаан дамжуулах чанар нь түүний концентрацтай холбоотой байж болох бөгөөд нарийн төвөгтэй найрлагатай электролитийн цахилгаан дамжуулах чанарыг хэмжих нь уусмал дахь нийт ионы агууламжийг тооцоолох боломжийг олгодог бөгөөд жишээлбэл, нэрмэлийн чанарыг хянахад ашигладаг. эсвэл ионгүйжүүлсэн ус. Кондуктометрийн өөр төрлийн - кондуктометрийн титрлэлт - тодорхой урвалжийг шинжилж буй уусмалд хэсэгчлэн нэмж, цахилгаан дамжуулалтын өөрчлөлтийг хянадаг. Цахилгаан дамжуулалтын огцом өөрчлөлтийг тэмдэглэсэн эквивалент цэгийг энэ утгын нэмэлт урвалжийн эзэлхүүнээс хамаарах графикаас тодорхойлно.
Потенциометр
гальваник эсийн потенциалын мэдээлэлд үндэслэн янз бүрийн физик-химийн үзүүлэлтүүдийг тодорхойлоход ашигладаг. Электрохимийн хэлхээнд гүйдэл байхгүй үед электродын потенциал нь жишиг электродтой харьцуулахад хэмжигдэхүүн нь Nernst тэгшитгэлээр уусмалын концентрацтай холбоотой байдаг. Потенциометрийн хэмжилтэнд уусмал дахь нэг ионыг голчлон мэдэрдэг ион сонгомол электродуудыг өргөн ашигладаг: рН хэмжих шилэн электрод, натри, аммони, фтор, кальци, магни гэх мэт ионуудыг сонгон тодорхойлох электродууд Гадаргуу ион сонгомол электродын давхарга нь ферментийг агуулж болох ба үр дүн нь тохирох субстратад мэдрэмтгий систем юм. Ион сонгомол электродын потенциал нь электрон дамжуулалттай бодисын хувьд электрон дамжуулалтаар тодорхойлогддоггүй, харин голчлон ионуудын шилжилт эсвэл солилцоогоор тодорхойлогддог гэдгийг анхаарна уу. Гэсэн хэдий ч электродын потенциалыг уусмал дахь бодисын концентрацийн (эсвэл үйл ажиллагааны) логарифмтай холбодог Нернстийн тэгшитгэл нь ийм электродод мөн хамаарна. Потенциометрийн титрлэлтийн үед урвалжийг хэсэг хэсгээр нь шинжилж буй уусмалд нэмж, потенциалын өөрчлөлтийг хянадаг. Энэ төрлийн титрлэлтийн шинж чанар бүхий S хэлбэрийн муруйнууд нь эквивалентийн цэгийг тодорхойлж, тэнцвэрийн тогтмол ба стандарт потенциал зэрэг термодинамик параметрүүдийг олох боломжийг олгодог.
Вольтметри.
Бүх төрлийн вольтметрийн аргууд нь 10-7-10-1 см2 гадаргуутай ажлын микроэлектрод ашигладаг. Түүний тусламжтайгаар олж авсан гүйдлийн хүчдэлийн муруй нь ууссан бодисыг тодорхойлох, тэдгээрийн концентрацийг тодорхойлох, ихэвчлэн термодинамик ба кинетик параметрүүдийг тодорхойлох боломжийг олгодог. Анхны вольтметрийн арга - полярографийг 1922 онд Чехийн химич Я.Хейровский санал болгосон. Түүний суурилуулсан ажлын электрод нь мөнгөн усны дуслын электрод байв. Мөнгөн ус нь устөрөгчийн хэт хүчдэлтэй байдаг тул мөнгөн усны электрод нь сөрөг потенциалтай үед тохиолддог үйл явцыг судлахад тохиромжтой. Хэмжилтийн явцад электродын гадаргуу байнга шинэчлэгддэг бөгөөд энэ нь электродын бохирдлыг арилгадаг. Мөн вольтметрийн судалгааг цагаан алт, нүүрстөрөгч зэрэг хатуу электродуудыг ашиглан хийж, эерэг потенциалтай үед тохиолддог процессуудыг ашигладаг. Шугаман боломжит вольтамметрийн (хроноамперометр) потенциал нь цаг хугацааны явцад шугаман өөрчлөгдөж, уусмалыг хутгахгүй тул массын шилжилт нь зөвхөн тархалтын улмаас явагддаг. Цикл вольтметрийн хувьд электрод дээр давтан гурвалжин хүчдэлийн импульсийг хэрэглэнэ. Циклийн өсөх хэсэгт үүссэн бодисыг түүний буурах хэсэгт судалдаг. Энэ арга нь ялангуяа янз бүрийн боломжит шүүрэлтийн хурд, өөр өөр уусмалын концентраци дахь туйлшралын муруйг шинжлэх замаар электродын урвалын механизмыг судлахад үр дүнтэй байдаг. Өөр өөр хэлбэрийн хүчдэлийн импульс нь шугаман өсөн нэмэгдэж буй потенциал дээр суурилдаг өөр төрлийн вольтметрийн төрөл байдаг - дифференциал импульс ба квадрат долгион. Эдгээр аргууд нь уусмал дахь бодисын бага концентрацийг тодорхойлоход өргөн хэрэглэгддэг. Хэрэв вольтметрийн хэмжилтийн явцад уусмал холилдсон бол конвекц ба диффузийг ашиглан массын дамжуулалт нэгэн зэрэг явагддаг бол бид гидродинамик вольтамметрийн тухай ярьдаг. Энэ тохиолдолд туршилтын гүйдлийн хүчдэлийн муруйг онолынхтай шууд харьцуулж болох тул эргэдэг дискний электродыг ашиглах нь тохиромжтой.
Амперометр.
Энэ арга нь индикатор электрод ба жишиг электродын хооронд тогтмол хүчдэлийн уусмалаар дамжин өнгөрөх хязгаарлагдмал тархалтын гүйдлийг хэмжихэд суурилдаг. Амперометрийн титрлэлтийн үед эквивалентийн цэгийг одоогийн муруйн завсарлага - нэмсэн ажлын уусмалын эзэлхүүнээр тодорхойлно. Хроноамперометрийн аргууд нь гүйдлийн цаг хугацааны хамаарлыг хэмжихэд суурилдаг бөгөөд голчлон тархалтын коэффициент ба хурдны тогтмолыг тодорхойлоход ашиглагддаг. Шингэн хроматографийн баганын гаралтын үед мэдрэгч болж ажилладаг бяцхан цахилгаан химийн эсүүд нь амперометрийн (түүнчлэн вольтметрийн) зарчмаар ажилладаг. Гальваностатик аргууд нь амперометрийн аргуудтай төстэй боловч тодорхой хэмжээний гүйдэл эсээр дамжин өнгөрөх үед потенциалыг хэмждэг. Тиймээс хронопотенциометрийн хувьд цаг хугацааны явцад потенциалын өөрчлөлтийг хянадаг. Эдгээр аргуудыг голчлон электродын урвалын кинетикийг судлахад ашигладаг.
Кулометр.
Кулометрийн хувьд хяналттай потенциалын үед уусмалын бүрэн электролизийг харьцангуй том ажлын электрод (доод мөнгөн ус эсвэл цагаан алтны тор) бүхий электролизерт эрчимтэй холих замаар гүйцэтгэдэг. Цахилгаан эрчим хүчний нийт хэмжээ ( Q, C) электролизд шаардагдах хэмжээ нь үүсгэгч бодисын хэмжээтэй холбоотой ( А, d) Фарадейн хууль:
Хаана М- Тэд хэлэхдээ масс (г/моль), Ф- Фарадей тоо. Кулометрийн титрлэлт нь тодорхойлогдож буй бодистой урвалд орох урвалжийг электролитийн аргаар үүсгэхийн тулд тогтмол гүйдлийг ашиглах явдал юм. Титрлэлтийн явцыг потенциометр эсвэл амперометрээр хянадаг. Кулометрийн аргууд нь туйлын шинж чанартай (өөрөөр хэлбэл шалгалт тохируулгын муруйг ашиглахгүйгээр анализийн хэмжээг тооцоолох боломжийг олгодог) бөгөөд электролизийн нөхцөл, электролизийн параметрийн өөрчлөлтөд (электродын гадаргуугийн талбай эсвэл хутгах эрчим) мэдрэмтгий байдаггүй тул тохиромжтой байдаг. Кулогравиметрийн хувьд электролизийн өмнө ба дараа электролизийг жинлэх замаар электролизэнд орсон бодисын хэмжээг тодорхойлно.
Бусад цахилгаан аналитик аргууд байдаг. Хувьсах гүйдлийн туйлшралд бага далайцтай синусоид хүчдэлийг өргөн давтамжийн муж дахь шугаман хувьсах потенциалд хэрэглэж, хувьсах гүйдлийн далайц ба фазын шилжилтийг эсвэл эсэргүүцлийг тодорхойлно. Эдгээр өгөгдлөөс уусмал дахь бодисын шинж чанар, электродын урвалын механизм, кинетикийн талаархи мэдээллийг олж авдаг. Нимгэн давхаргын аргууд нь 10-100 мкм зузаантай электролитийн давхарга бүхий цахилгаан химийн эсүүдийг ашигладаг. Ийм эсүүдэд электролиз нь ердийн электролизерээс илүү хурдан явагддаг. Электродын процессыг судлахын тулд спектрофотометрийн бүртгэлтэй спектр химийн аргыг ашигладаг. Электродын гадаргуу дээр үүссэн бодисыг шинжлэхийн тулд тэдгээрийн харагдахуйц, хэт ягаан туяаны болон IR бүсэд гэрлийн шингээлтийг хэмждэг. Электродын гадаргуу болон орчны шинж чанарын өөрчлөлтийг электродын гадаргуугаас цацрагийн тусгалыг хэмжихэд үндэслэсэн цахилгаан тусгал, эллипсометрийн аргуудыг ашиглан хянадаг. Эдгээрт гэрлийн тусгал, Раман сарнилын аргууд (Раман спектроскопи), хоёр дахь гармоник спектроскопи (Фурье спектроскопи) орно.
Бусад цахилгаан химийн үзэгдэл ба аргууд.
Электролит ба цэнэглэгдсэн хэсгүүд эсвэл гадаргуугийн харьцангуй хөдөлгөөнөөр электрокинетик нөлөө үүсдэг. Энэ төрлийн чухал жишээ бол цахилгаан талбарт хөдөлж буй цэнэгтэй хэсгүүдийг (жишээлбэл, уургийн молекулууд эсвэл коллоид хэсгүүд) салгах электрофорез юм. Гель дэх уураг буюу дезоксирибонуклеины хүчлийг (ДНХ) ялгахад электрофоретик аргыг өргөн ашигладаг. Цахилгаан үзэгдлүүд нь амьд организмын үйл ажиллагаанд ихээхэн үүрэг гүйцэтгэдэг: мэдрэлийн импульс үүсгэх, тараах, мембраны мембраны потенциал үүсэх гэх мэт. Биологийн систем, тэдгээрийн бүрэлдэхүүн хэсгүүдийг судлахын тулд янз бүрийн цахилгаан химийн аргуудыг ашигладаг. Цахилгаан химийн процесст гэрлийн нөлөөг судлах нь бас сонирхолтой юм. Тиймээс фотоэлектрохимийн судалгааны сэдэв нь гэрлийн нөлөөн дор цахилгаан эрчим хүч үйлдвэрлэх, химийн урвалыг эхлүүлэх явдал бөгөөд энэ нь нарны энергийг цахилгаан энерги болгон хувиргах үр ашгийг нэмэгдүүлэхэд маш чухал юм. Титаны давхар исэл, кадми сульфид, галлийн арсенид, цахиураар хийсэн хагас дамжуулагч электродуудыг энд ихэвчлэн ашигладаг. Өөр нэг сонирхолтой үзэгдэл бол электрохимилюминесценц, i.e. цахилгаан химийн үүрэнд гэрэл үүсэх. Энэ нь электродууд дээр өндөр энергитэй бүтээгдэхүүн үүсэх үед ажиглагддаг. Ихэнхдээ өгөгдсөн нэгдлийн исэлдсэн болон бууруулсан хэлбэрийг олж авахын тулд процессыг мөчлөгийн дагуу явуулдаг. Тэдний харилцан үйлчлэл нь гэрлийн ялгаралтаар үндсэн төлөвт шилждэг өдөөгдсөн молекулууд үүсэхэд хүргэдэг.
Хэрэглээний цахилгаан химийн.
Электрохими нь олон практик хэрэглээтэй. Батерейнд холбогдсон анхдагч гальван эсийн (нэг удаагийн элемент) тусламжтайгаар химийн энергийг цахилгаан энерги болгон хувиргадаг. Хоёрдогч гүйдлийн эх үүсвэрүүд - батерейнууд - цахилгаан эрчим хүчийг хуримтлуулдаг. Түлшний эсүүд нь урвалд орж буй бодисуудыг (устөрөгч, хүчилтөрөгч гэх мэт) тасралтгүй нийлүүлэх замаар цахилгаан эрчим хүчийг үүсгэдэг эрчим хүчний үндсэн эх үүсвэр юм. Эдгээр зарчмууд нь зөөврийн эрчим хүчний эх үүсвэр, сансрын станц, цахилгаан машин, электрон төхөөрөмжид ашиглагддаг батерейны үндэс суурь юм.
Олон тооны бодисыг их хэмжээгээр үйлдвэрлэх нь цахилгаан химийн синтез дээр суурилдаг. Хлор шүлтийн процесс дахь давсны уусмалын электролиз нь хлор, шүлтийг үүсгэдэг бөгөөд дараа нь органик нэгдлүүд болон полимерүүдийг үйлдвэрлэх, түүнчлэн целлюлоз, цаасны үйлдвэрт ашигладаг. Электролизийн бүтээгдэхүүн нь натрийн хлорат, персульфат, натрийн перманганат зэрэг нэгдлүүд юм; Аж үйлдвэрийн чухал металлыг цахилгаан олборлолтоор олж авдаг: хөнгөн цагаан, магни, лити, натри, титан. Хайлсан давсыг электролит болгон ашиглах нь илүү дээр юм, учир нь энэ тохиолдолд усан уусмалаас ялгаатай нь металлын бууралт нь устөрөгч ялгарахад хүндрэл учруулдаггүй. Фторыг хайлсан давс дахь электролизээр гаргаж авдаг. Цахилгаан химийн процессууд нь зарим органик нэгдлүүдийн нийлэгжилтийн үндэс болдог; жишээлбэл, адипонитрил (нейлон нийлэгжилтийн завсрын бүтээгдэхүүн) нь акрилонитрилийг гидродимержуулах замаар олж авдаг.
Мөнгө, алт, хром, гууль, хүрэл болон бусад металл, хайлшийг цахилгаанаар бүрэх ажлыг ган бүтээгдэхүүнийг зэврэлтээс хамгаалах, гоёл чимэглэлийн зориулалтаар ашиглах, электроникийн үйлдвэрт цахилгаан холбогч, хэвлэмэл хэлхээний самбар үйлдвэрлэх зорилгоор янз бүрийн объектуудад өргөн ашигладаг. Металл ба хайлшаар хийсэн бэлдэцийг өндөр нарийвчлалтай хэмжээст боловсруулах, ялангуяа ердийн механик аргаар боловсруулах боломжгүй, түүнчлэн нарийн төвөгтэй профиль бүхий эд анги үйлдвэрлэхэд цахилгаан химийн аргыг ашигладаг. Хөнгөн цагаан, титан зэрэг металлын гадаргууг аноджуулах үед хамгаалалтын ислийн хальс үүсдэг. Ийм хальсыг хөнгөн цагаан, тантал, ниобиумаар хийсэн ажлын хэсгүүдийн гадаргуу дээр электролитийн конденсатор үйлдвэрлэхэд, заримдаа гоёл чимэглэлийн зориулалтаар бүтээдэг.
Зэврэлтийн үйл явцын судалгаа, эдгээр процессыг удаашруулдаг материалыг сонгохдоо цахилгаан химийн аргыг ихэвчлэн ашигладаг. Металл хийцийг зэврэлтээс хамгаалж, катодын хамгаалалтыг ашиглан хамгаалж болох бөгөөд үүний тулд гадны эх үүсвэрийг хамгаалж байгаа бүтэцтэй холбож, анод ба бүтцийг исэлдэлтээс хамгаалах чадвартай байлгах боломжтой. Бусад цахилгаан химийн процессуудыг практикт ашиглах боломжуудыг судалж байна. Тиймээс усыг цэвэршүүлэхийн тулд электролизийг ашиглаж болно. Маш ирээдүйтэй чиглэл бол фотохимийн аргаар нарны энергийг хувиргах явдал юм. Үйл ажиллагааны зарчим нь электрохимилюминесценц дээр суурилдаг цахилгаан химийн мониторуудыг боловсруулж байна. Электродын урвалын үр дүнд электродын гадаргуугийн өнгөний урвуу өөрчлөлтийн судалгааг мөн дурдъя.
Уран зохиол:
Агладзе Р.И. Хэрэглээний цахилгаан химийн.М. – Л., 1975 он
Измайлов Н.А. Уусмалын цахилгаан хими.М., 1976
Цахилгаан химийн хэмжилтийн аргууд, боть. 1–2. М., 1977
Корыта И. Ион, электрод, мембран.М., 1983
Багатский В.С. Цахилгаан химийн үндэс.М., 1988