Tabela de processos isotérmicos. Leis dos gases ideais
Os principais processos em termodinâmica são:
- isocórico, fluindo a volume constante;
- isobárica fluindo a pressão constante;
- isotérmico, ocorrendo a uma temperatura constante;
- adiabático, em que não há troca de calor com o ambiente;
- politrópico, satisfazendo a equação pvn= const.
Processos isocóricos, isobáricos, isotérmicos e adiabáticos são casos especiais de um processo politrópico.
No estudo dos processos termodinâmicos determine:
- equação do processo em p— v E T— s coordenadas;
- relação entre os parâmetros do estado do gás;
- mudança na energia interna;
- a quantidade de trabalho externo;
- a quantidade de calor fornecida ao processo ou a quantidade de calor removido.
processo isocórico


processo isocórico emp, v— , T, s- Eeu, s-coordenadas (diagramas)
Em um processo isocórico, a condição v= const.
Da equação de estado do gás ideal ( pv = RT) segue:
p/T = R/V= const,
ou seja, a pressão do gás é diretamente proporcional à sua temperatura absoluta:
p2/p1 = T2 /T1.
O trabalho de expansão em um processo isocórico é zero ( eu= 0), pois o volume do fluido de trabalho não varia (Δ v= const).
A quantidade de calor fornecida ao fluido de trabalho no processo 1-2 em cv
q= cv(T 2 — T 1 ).
T. a. eu= 0, então com base na primeira lei da termodinâmica Δ você = q, o que significa que a variação da energia interna pode ser determinada pela fórmula:
Δ você = cv (T 2 - T 1).
A mudança na entropia em um processo isocórico é determinada pela fórmula:
s2–s1= Δ s = cv ln( p2/p1) = cv ln( T2 /T1).
processo isobárico



processo isobárico emp, v— , T, s- Eeu, s-coordenadas (diagramas)
Um processo isobárico é aquele que ocorre a pressão constante. p= const. Da equação de estado para um gás ideal segue:
v/T = R/p= const
v2/v1 = T 2 /T 1 ,
ou seja, em um processo isobárico, o volume de um gás é proporcional à sua temperatura absoluta.
O trabalho será:
eu = p(v 2 – v 1 ).
T. a. pv 1 = RT 1 E pv 2 = RT 2 , Que
eu = R(T2-T1).
A quantidade de calor em cp= const é determinado pela fórmula:
q = cp(T2-T1).
A variação de entropia será:
s2–s1= Δ s = cp ln( T2 /T1).
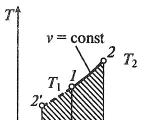
processo isotérmico



Processo isotérmico emp, v— , T, s- Eeu, s-coordenadas (diagramas)
Em um processo isotérmico, a temperatura do fluido de trabalho permanece constante T= const, então:
pv = RT= const
p2/p1 = v1/v2,
ou seja, a pressão e o volume são inversamente proporcionais entre si, de modo que durante a compressão isotérmica a pressão do gás aumenta e durante a expansão diminui.
O trabalho do processo será igual a:
eu = RT ln ( v2 – v1) = RT ln ( p1 – p2).
Como a temperatura permanece inalterada, a energia interna de um gás ideal em um processo isotérmico permanece constante (Δ você= 0) e todo o calor fornecido ao fluido de trabalho é completamente convertido em trabalho de expansão:
q = eu.
Durante a compressão isotérmica, o calor é removido do fluido de trabalho em uma quantidade igual ao trabalho gasto na compressão.
A variação de entropia é:
s2–s1= Δ s = R ln( p1/p2) = R ln( v2/v1).
processo adiabático



processo adiabático emp, v— , T, s- Eeu, s-coordenadas (diagramas)
Um processo adiabático é uma mudança no estado de um gás que ocorre sem troca de calor com o ambiente. Desde d q= 0, então a equação da primeira lei da termodinâmica para um processo adiabático terá a forma:
d você + p d v = 0
Δ você+ eu = 0,
por isso
Δ você= —eu.
No processo adiabático, o trabalho de expansão é realizado apenas devido ao gasto da energia interna do gás, e durante a compressão, que ocorre devido à ação de forças externas, todo o trabalho realizado por elas vai para aumentar a energia interna do gás.
Vamos denotar a capacidade de calor no processo adiabático através de c inferno, e condição d q= 0 é expresso da seguinte forma:
d q = c inferno d T = 0.
Esta condição diz que a capacidade de calor no processo adiabático é zero ( c inferno = 0).
Sabe-se que
Comp/cv= k
e a equação da curva de processo adiabático (adiabática) em p, v-diagrama se parece com:
p.v.k= const.
nesta expressão ké chamado expoente adiabático(também chamado de razão de Poisson).
Valores do expoente adiabáticokpara alguns gases:
k ar = 1,4
k vapor superaquecido = 1,3
k Escape ICE = 1,33
k vapor úmido saturado = 1,135
Das fórmulas anteriores segue:
eu= — Δ você = cv(T 1 – T 2 );
eu 1 – eu 2 = cp(T 1 – T 2 ).
O trabalho técnico do processo adiabático ( eu tech) é igual à diferença entre as entalpias do início e do fim do processo ( eu 1 – eu 2 ).
Um processo adiabático que ocorre sem atrito interno no fluido de trabalho é chamado isentrópico. EM T, s no diagrama, é representado por uma linha vertical.
Normalmente, processos adiabáticos reais ocorrem na presença de atrito interno no fluido de trabalho, como resultado do qual sempre é liberado calor, que é transmitido ao próprio fluido de trabalho. neste caso d s> 0 e o processo é chamado processo adiabático real.
processo politrópico
Um processo é chamado politrópico, que é descrito pela equação:
pvn= const.
índice politrópico n pode assumir qualquer valor de -∞ a +∞, mas para este processo é um valor constante.
A partir da equação do processo politrópico e da equação de Claiperon, pode-se obter uma expressão que estabelece uma relação entre p, v E T em quaisquer dois pontos no polítropo:
p2/p1 = (v1/v2)n; T2 /T1 = (v1/v2) n-1 ; T2 /T1 = (p2/p1) (n-1)/n .
O trabalho de expansão do gás em um processo politrópico é:

No caso de um gás ideal, esta fórmula pode ser transformada:

A quantidade de calor fornecida ou removida no processo é determinada usando a primeira lei da termodinâmica:
q = (você 2 – você 1) + eu.
Porque o

é a capacidade térmica de um gás ideal em um processo politrópico.
No cv, k E n= const c n= const, portanto, um processo politrópico às vezes é definido como um processo com capacidade térmica constante.
O processo politrópico tem um significado generalizante, pois abrange todo o conjunto de processos termodinâmicos básicos.
Representação gráfica de um politrópio em p, v coordenadas dependendo do índice politrópico n.

pv 0= const ( n= 0) é a isóbara;
pv= const ( n= 1) é a isoterma;
p 0 v= const, p 1/∞ v= const, pv∞= const - isócora;
p.v.k= const ( n = k) é um adiabá.
n > 0 - curvas hiperbólicas,
n < 0 são parábolas.
Com base nos materiais de minhas notas de aula sobre termodinâmica e no livro "Fundamentos da Energia". Autor G. F. Bystritsky. 2ª ed., rev. e adicional - M.: KNORUS, 2011. - 352 p.
O que é um processo isobárico
Definição
Um processo isobárico (ou isobárico) é um processo que ocorre em uma massa constante de gás a pressão constante.
Vamos escrever a equação para dois estados de um gás ideal:
\ \
Dividimos a equação (2) pela equação (1), obtemos a equação do processo isobárico:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \left(4\right).\]
A equação (4) é chamada de lei de Gay-Lussac.
Energia interna e a quantidade de calor do processo isobárico
Este processo ocorre com entrada de calor se o volume estiver aumentando ou remoção de calor para diminuir o volume. Vamos anotar a primeira lei da termodinâmica, obteremos sucessivamente expressões para trabalho, energia interna e quantidade de calor do processo isobárico:
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \left(5\right).\] \[\triangle Q=\int\limits^(T_2)_ (T_1)(dU)+\int\limits^(V_2)_(V_1)(dA)(6)\]
onde $\delta Q\ $ é o calor elementar fornecido ao sistema, $dU$ é a variação da energia interna do gás no processo em andamento, $dA$ é o trabalho elementar realizado pelo gás no processo, i é o número de graus de liberdade da molécula do gás, R é a constante universal dos gases, d é o número de moles do gás.
Variação da energia interna do gás:
\[\triângulo U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
A equação (8) define o trabalho para um processo isobárico. Subtraindo a equação (1) de (2), obtemos mais uma equação para operação a gás em um processo isobárico:
\ \[\triângulo Q=\frac(i)(2)нR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \triângulo T\ ( 10),\]
onde $c_(\mu p)$ é a capacidade térmica molar do gás em um processo isobárico. A equação (10) determina a quantidade de calor transmitida a um gás de massa m em um processo isobárico com aumento de temperatura de $\triângulo T.$
Os isoprocessos são frequentemente representados em diagramas termodinâmicos. Portanto, uma linha representando um processo isobárico em tal diagrama é chamada de isóbara (Fig. 1).
Exemplo 1
Tarefa: Determine como as pressões $p_1$ e $p_2$ estão relacionadas no diagrama V(T) da Figura 1c.
Desenhe a isoterma $T_1$

Nos pontos A e B, as temperaturas são iguais, portanto, o gás obedece à lei de Boyle-Mariotte:
\ \
Vamos converter esses volumes para SI: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
Vamos fazer os cálculos:
Resposta: O trabalho de um gás em um processo isobárico é 600 J.
Exemplo 3
Tarefa: Compare o trabalho com gás no processo ABC e o trabalho com gás no processo CDA Fig. 3.

Como base para a solução, tomamos a fórmula que determina o trabalho do gás:
Pelo significado geométrico da integral definida, sabe-se que o trabalho é a área da figura, que é limitada pela função do integrando, do eixo das abcissas e das isócoras nos pontos $V_1\ e\ V_2$ (eixo p(V)). Traduzimos os gráficos do processo nos eixos p(V).
Considere cada segmento dos gráficos dos processos mostrados na Figura (3).
AB: Processo isocórico (p=const), $V\uparrow \left(\ Volume\ cresce\right),\ T\uparrow $;
VS: Processo isocórico (V =const), $T\uparrow $ (do gráfico), p$\uparrow $, da lei do processo isocórico ($\frac(p)(T)=const$);
CD: (p=const), $V\downarrow ,\ T\downarrow ;$
DA: (V =const), $T\downarrow ,\ p\downarrow .$
Vamos representar os gráficos dos processos nos eixos p(V) (Fig. 4):

Trabalho de gás $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- área do retângulo ABFE) (Fig. 3). Trabalhe no gás $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -área\ do retângulo\ $EFCD.Obviamente $A_(CDA)>A_(ABC).$
, um processo termodinâmico é uma mudança no estado de um sistema, pelo que pelo menos um dos seus parâmetros (temperatura, volume ou pressão) altera o seu valor. No entanto, se levarmos em conta que todos os parâmetros de um sistema termodinâmico estão inextricavelmente ligados, uma mudança em qualquer um deles implica inevitavelmente uma mudança em pelo menos um (idealmente) ou vários (na realidade) parâmetros. No caso geral, podemos dizer que o processo termodinâmico está associado a uma violação do equilíbrio do sistema e, se o sistema estiver em estado de equilíbrio, nenhum processo termodinâmico poderá ocorrer nele.
O estado de equilíbrio de um sistema é um conceito abstrato, pois é impossível isolar qualquer coisa material do mundo circundante, portanto vários processos termodinâmicos inevitavelmente ocorrem em qualquer sistema real. Ao mesmo tempo, em alguns sistemas, mudanças tão lentas e quase imperceptíveis podem ocorrer que os processos associados a eles podem ser considerados condicionalmente como consistindo em uma sequência de estados de equilíbrio do sistema. Tais processos são chamados de equilíbrio ou quase estático.
Outro cenário possível de mudanças sucessivas no sistema, após as quais ele retorna ao seu estado original, é chamado de processo circular ou um ciclo. Os conceitos de equilíbrio e processos circulares fundamentam muitas conclusões teóricas e métodos aplicados da termodinâmica.
O estudo de um processo termodinâmico consiste em determinar o trabalho realizado nesse processo, a variação da energia interna, a quantidade de calor e também estabelecer uma relação entre as grandezas individuais que caracterizam o estado de um gás.
De todos os processos termodinâmicos possíveis, os processos isocóricos, isobáricos, isotérmicos, adiabáticos e politrópicos são os de maior interesse.
processo isocórico
Um processo isocórico é um processo termodinâmico que ocorre a volume constante. Tal processo pode ser realizado aquecendo um gás colocado em um recipiente fechado. O gás aquece como resultado do fornecimento de calor e sua pressão aumenta.
A mudança nos parâmetros do gás em um processo isocórico descreve a lei de Charles: p 1 /T 1 \u003d p 2 /T 2, ou no caso geral:
p/T = const.
A pressão de um gás nas paredes de um recipiente é diretamente proporcional à temperatura absoluta do gás.
Como em um processo isocórico a variação do volume dV é igual a zero, podemos concluir que todo o calor fornecido ao gás é gasto na variação da energia interna do gás (nenhum trabalho é feito).
processo isobárico
Um processo isobárico é um processo termodinâmico que ocorre a pressão constante. Tal processo pode ser realizado colocando o gás em um cilindro denso com um pistão móvel, que é acionado por uma força externa constante durante a remoção e fornecimento de calor.
Quando a temperatura do gás muda, o pistão se move em uma direção ou outra; enquanto o volume do gás muda de acordo com a lei de Gay-Lussac:
V/T = const.
Isso significa que em um processo isobárico o volume ocupado pelo gás é diretamente proporcional à temperatura.
Pode-se concluir que uma mudança de temperatura neste processo levará inevitavelmente a uma mudança na energia interna do gás, e uma mudança de volume está associada à realização de trabalho, ou seja, em um processo isobárico, parte da energia térmica é gasto na mudança da energia interna do gás, e a outra parte é gasta no desempenho do trabalho do gás para superar a ação de forças externas. Nesse caso, a relação entre os custos de calor para aumentar a energia interna e para realizar o trabalho depende da capacidade de calor do gás.
processo isotérmico
Um processo isotérmico é um processo termodinâmico que ocorre a uma temperatura constante.
É muito difícil realizar um processo isotérmico com gás na prática. Afinal, é preciso cumprir a condição de que, no processo de compressão ou expansão, o gás tenha tempo para trocar de temperatura com o ambiente, mantendo sua própria temperatura constante.
O processo isotérmico é descrito pela lei de Boyle-Mariotte: pV \u003d const, ou seja, a uma temperatura constante, a pressão do gás é inversamente proporcional ao seu volume.
Obviamente, em um processo isotérmico, a energia interna do gás não varia, pois sua temperatura é constante.
Para cumprir a condição de constância da temperatura do gás, é necessário retirar dele calor, equivalente ao trabalho despendido na compressão:
dq = dA = pdv .
Usando a equação de estado do gás, tendo feito uma série de transformações e substituições, podemos concluir que o trabalho do gás em um processo isotérmico é determinado pela expressão:
A = RT ln(p 1 /p 2).
processo adiabático
Um processo adiabático é um processo termodinâmico que ocorre sem troca de calor entre o fluido de trabalho e o ambiente. Como um processo isotérmico, é muito difícil implementar um processo adiabático na prática. Esse processo pode ocorrer com o meio de trabalho colocado em um recipiente, por exemplo, um cilindro com um pistão, cercado por um material isolante de calor de alta qualidade.
Mas não importa qual isolante térmico de alta qualidade usamos neste caso, alguma quantidade, mesmo que insignificante, de calor será inevitavelmente trocada entre o fluido de trabalho e o ambiente.
Portanto, na prática, é possível criar apenas um modelo aproximado do processo adiabático. No entanto, muitos processos termodinâmicos realizados na engenharia térmica ocorrem tão rapidamente que o fluido de trabalho e o meio não têm tempo para trocar calor; portanto, com certo grau de erro, esses processos podem ser considerados adiabáticos.
Para derivar uma equação relacionando pressão e volume 1 kg gás em um processo adiabático, escrevemos a equação da primeira lei da termodinâmica:
dq = du + pdv .
Como para um processo adiabático a transferência de calor dq é igual a zero e a mudança na energia interna é uma função da condutividade térmica da temperatura: du = c v dT , então podemos escrever:
c v dT + pdv = 0 (3) .
Diferenciando a equação de Clapeyron pv = RT , obtemos:
pdv + vdp = RdT .
Vamos expressar dT a partir daqui e substituí-lo na equação (3). Após o rearranjo e as transformações, obtemos:
pdvc v /(R + 1) + c v vdp/R = 0.
Levando em consideração a equação de Mayer R = c p – c v, a última expressão pode ser reescrita como:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
Dividindo a expressão resultante por c v e denotando a razão c p / c v pela letra k , após integrar a equação (4) obtemos (em k = constante):
ln vk + ln p = const ou ln pvk = const ou pvk = const .
A equação resultante é a equação de um processo adiabático, no qual k é o expoente adiabático.
Se assumirmos que a capacidade térmica volumétrica c v é um valor constante, ou seja, c v \u003d const, o trabalho do processo adiabático pode ser representado como a fórmula (dado sem saída):
l \u003d c v (T 1 - T 2) ou l \u003d (p 1 v 1 - p 2 v 2) / (k-1).
processo politrópico
Ao contrário dos processos termodinâmicos considerados acima, quando algum dos parâmetros do gás permaneceu inalterado, o processo politrópico é caracterizado pela possibilidade de alterar qualquer um dos principais parâmetros do gás. Todos os processos termodinâmicos acima são casos especiais de processos politrópicos.
A equação geral do processo politrópico tem a forma pv n = const , onde n é o índice politrópico - um valor constante para esse processo, que pode assumir valores de - ∞ a + ∞ .
É óbvio que, dando certos valores ao índice politrópico, pode-se obter um ou outro processo termodinâmico - isocórico, isobárico, isotérmico ou adiabático.
Assim, se tomarmos n = 0 , obtemos p = const - um processo isobárico, se tomarmos n = 1 , obtemos um processo isotérmico descrito pela dependência pv = const ; para n = k o processo é adiabático, e para n igual a - ∞ ou + ∞ . obtemos um processo isocórico.
Tópicos do codificador USE: isoprocessos - processos isotérmicos, isocóricos, isobáricos.
Ao longo deste folheto, iremos aderir ao seguinte pressuposto: a massa e a composição química do gás permanecem inalteradas. Em outras palavras, acreditamos que:
Ou seja, não há vazamento de gás do vaso ou, inversamente, entrada de gás no vaso;
Ou seja, as partículas de gás não sofrem nenhuma alteração (digamos, não há dissociação - a decomposição de moléculas em átomos).
Essas duas condições são satisfeitas em muitas situações fisicamente interessantes (por exemplo, em modelos simples de máquinas térmicas) e, portanto, merecem uma consideração separada.
Se a massa de um gás e sua massa molar são fixas, então o estado do gás é determinado por três parâmetros macroscópicos: pressão, volume E temperatura. Esses parâmetros estão relacionados entre si pela equação de estado (a equação de Mendeleev-Clapeyron).
processo termodinâmico(ou simplesmente processo) é a mudança no estado do gás ao longo do tempo. Durante o processo termodinâmico, os valores dos parâmetros macroscópicos mudam - pressão, volume e temperatura.
De particular interesse são isoprocessos- processos termodinâmicos em que o valor de um dos parâmetros macroscópicos permanece inalterado. Fixando cada um dos três parâmetros por vez, obtemos três tipos de isoprocessos.
1. processo isotérmico vai a uma temperatura de gás constante: .
2. processo isobárico funciona com pressão de gás constante: .
3. processo isocórico vai a um volume constante de gás: .
Os isoprocessos são descritos por leis muito simples de Boyle - Mariotte, Gay-Lussac e Charles. Vamos passar a estudá-los.
processo isotérmico
Deixe um gás ideal realizar um processo isotérmico a uma temperatura . Durante o processo, apenas a pressão do gás e seu volume mudam.
Considere dois estados arbitrários do gás: em um deles, os valores dos parâmetros macroscópicos são , e no segundo, são . Esses valores são relacionados pela equação de Mendeleev-Clapeyron:
Como dissemos desde o início, a massa e a massa molar são consideradas constantes.
Portanto, as partes certas das equações escritas são iguais. Portanto, os lados esquerdos também são iguais:
(1)
Como os dois estados do gás foram escolhidos arbitrariamente, podemos concluir que durante um processo isotérmico, o produto da pressão e do volume do gás permanece constante:
(2)
Esta declaração é chamada Lei de Boyle - Mariotte.
Tendo escrito a lei de Boyle-Mariotte na forma
(3)
pode-se também formular assim: Em um processo isotérmico, a pressão de um gás é inversamente proporcional ao seu volume.. Se, por exemplo, durante a expansão isotérmica de um gás, seu volume aumenta três vezes, então a pressão do gás diminui três vezes.
Como explicar a relação inversa entre pressão e volume do ponto de vista físico? A uma temperatura constante, a energia cinética média das moléculas de gás permanece inalterada, ou seja, simplesmente falando, a força dos impactos das moléculas nas paredes do vaso não muda. Com o aumento do volume, a concentração de moléculas diminui e, consequentemente, o número de impactos moleculares por unidade de tempo por unidade de área da parede diminui - a pressão do gás cai. Ao contrário, com a diminuição do volume, a concentração das moléculas aumenta, seus impactos são mais frequentes e a pressão do gás aumenta.
Gráficos de Processo Isotérmico
Em geral, é comum representar gráficos de processos termodinâmicos nos seguintes sistemas de coordenadas:
-diagrama: eixo de abcissas, eixo de ordenadas;
-diagrama: eixo de abcissas, eixo de ordenadas.
O gráfico de um processo isotérmico é chamado isotérmica.
Uma isoterma em um gráfico é um gráfico inversamente proporcional.
Tal gráfico é uma hipérbole (lembre-se de álgebra - gráfico de funções). A isotérmica-hipérbole é mostrada na fig. 1 .

Arroz. 1. Isoterma no diagrama
Cada isoterma corresponde a um determinado valor fixo de temperatura. Acontece que quanto maior a temperatura, maior a isoterma correspondente -diagrama.
De fato, vamos considerar dois processos isotérmicos realizados pelo mesmo gás (Fig. 2). O primeiro processo ocorre a uma temperatura, o segundo - a uma temperatura.

Arroz. 2. Quanto maior a temperatura, maior a isoterma
Fixamos algum valor do volume. Na primeira isoterma corresponde à pressão , na segunda - class="tex" alt="p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
Nos dois sistemas de coordenadas restantes, a isoterma parece muito simples: é uma linha reta perpendicular ao eixo ( fig. 3):

Arroz. 3. Isotermas em e -diagramas
processo isobárico
Lembre-se mais uma vez que o processo isobárico é um processo que ocorre a pressão constante. Durante o processo isobárico, apenas o volume do gás e sua temperatura mudam.
Um exemplo típico de um processo isobárico: o gás está sob um pistão maciço que pode se mover livremente. Se a massa do pistão e a seção transversal do pistão , então a pressão do gás é constante e igual a
onde é a pressão atmosférica.
Deixe um gás ideal realizar um processo isobárico à pressão. Considere novamente dois estados arbitrários do gás; desta vez os valores dos parâmetros macroscópicos serão iguais a e .
Vamos escrever as equações de estado:
Dividindo-os entre si, obtemos:
Em princípio, isso já poderia ser suficiente, mas iremos um pouco mais longe. Vamos reescrever a relação resultante para que apenas os parâmetros do primeiro estado apareçam em uma parte e apenas os parâmetros do segundo estado apareçam na outra parte (em outras palavras, “dividimos os índices” em diferentes partes):
(4)
E agora daqui - em vista da arbitrariedade da escolha dos estados! - Nós temos Lei de Gay-Lussac:
(5)
Em outras palavras, A pressão constante, o volume de um gás é diretamente proporcional à sua temperatura.:
(6)
Por que o volume aumenta com a temperatura? À medida que a temperatura aumenta, as moléculas começam a bater com mais força e a elevar o pistão. Ao mesmo tempo, a concentração de moléculas diminui, os impactos tornam-se menos frequentes, de modo que no final a pressão permanece a mesma.
Gráficos do processo isobárico
O gráfico do processo isobárico é chamado isobar. No diagrama, a isóbara é uma linha reta (Fig. 4):

Arroz. 4. Isobar no diagrama
A seção pontilhada do gráfico significa que, no caso de um gás real a temperaturas suficientemente baixas, o modelo de gás ideal (e com ele a lei de Gay-Lussac) deixa de funcionar. De fato, à medida que a temperatura diminui, as partículas de gás se movem cada vez mais lentamente, e as forças de interação intermolecular têm uma influência cada vez mais significativa em seu movimento (uma analogia: uma bola lenta é mais fácil de pegar do que uma rápida). Bem, em temperaturas muito baixas, os gases se transformam em líquidos.
Agora vamos descobrir como a posição da isóbara muda com uma mudança na pressão. Acontece que Quanto maior a pressão, menor a isóbara vai. -diagrama.
Para verificar isso, considere duas isóbaras com pressões e (Fig. 5):

Arroz. 5. Quanto menor a isóbara, maior a pressão
Vamos fixar algum valor de temperatura. Nós vemos que . Mas a uma temperatura fixa, o volume é tanto menor quanto maior for a pressão (Lei de Boyle - Mariotte!).
Então class="tex" alt="p_2 > p_1"> .!}
Nos dois sistemas de coordenadas restantes, a isóbara é uma linha reta perpendicular ao eixo (Fig. 6):

Arroz. 6. Isóbaras em e -diagramas
processo isocórico
Um processo isocórico, lembramos, é um processo que ocorre a um volume constante. Em um processo isocórico, apenas a pressão do gás e sua temperatura mudam.
Um processo isocórico é muito simples de imaginar: é um processo que ocorre em um vaso rígido de volume fixo (ou em um cilindro sob um pistão quando o pistão é fixo).
Deixe um gás ideal realizar um processo isocórico em um recipiente de volume . Novamente, considere dois estados de gás arbitrários com parâmetros e . Nós temos:
Dividimos essas equações entre si:
Como na derivação da lei de Gay-Lussac, “dividimos” os índices em diferentes partes:
(7)
Tendo em vista a arbitrariedade da escolha dos estados, chegamos a lei de Charles:
(8)
Em outras palavras, A um volume constante de um gás, sua pressão é diretamente proporcional à sua temperatura.:
(9)
Um aumento na pressão de um gás de volume fixo quando ele é aquecido é uma coisa completamente óbvia do ponto de vista físico. Você mesmo pode facilmente explicar.
Gráficos de processos isocóricos
O gráfico do processo isocórico é chamado isócora. No diagrama, a isócora é uma linha reta ( fig. 7):

Arroz. 7. Isócora no diagrama
O significado da área pontilhada é o mesmo: a inadequação do modelo de gás ideal em baixas temperaturas.

Arroz. 8. Quanto menor a isócora, maior o volume
A prova é semelhante à anterior. Fixamos a temperatura e vemos isso. Mas a uma temperatura fixa, a pressão é tanto menor quanto maior o volume (novamente, a lei de Boyle-Mariotte). Então class="tex" alt="V_2 > V_1"> .!}
Nos dois sistemas de coordenadas restantes, a isócora é uma linha reta perpendicular ao eixo (Fig. 9):

Arroz. 9. Isócores em e -diagramas
Leis de Boyle - Mariotte, Gay-Lussac e Charles também são chamadas leis do gás.
Derivamos as leis dos gases da equação de Mendeleev-Clapeyron. Mas historicamente foi o contrário: as leis dos gases foram estabelecidas experimentalmente e muito antes. A equação de estado apareceu posteriormente como sua generalização.
processo isobárico
Gráficos de isoprocessos em diferentes sistemas de coordenadas
processo isobárico(Outro grego ισος, isos - "mesmo" + βαρος, baros - "peso") - o processo de mudança do estado de um sistema termodinâmico a pressão constante ()
A dependência do volume do gás com a temperatura a pressão constante foi investigada experimentalmente em 1802 por Joseph Louis Gay-Lussac. Lei de Gay-Lussac: A pressão constante e valores constantesda massa de um gás e sua massa molar, a razão entre o volume de um gás e sua temperatura absoluta permanece constante: V / T = const.
processo isocórico
processo isocórico(do coro grego - lugar ocupado) - o processo de mudança do estado de um sistema termodinâmico a um volume constante (). Para gases ideais, o processo isocórico é descrito pela lei de Charles: para uma dada massa de gás a um volume constante, a pressão é diretamente proporcional à temperatura:
A linha que descreve um processo isocórico em um diagrama é chamada de isocórica.
Vale ressaltar também que a energia fornecida ao gás é gasta na alteração da energia interna, ou seja, Q = 3* ν*R*T/2=3*V*ΔP, onde R é a constante universal dos gases, ν é o número de moles no gás, T é a temperatura em Kelvin , V é o volume do gás, ΔP é o incremento da mudança de pressão. e a linha que representa o processo isocórico no diagrama, nos eixos P(T), deve ser estendida e conectada com uma linha pontilhada até a origem, pois pode haver mal-entendidos.
processo isotérmico
processo isotérmico(do grego "thermos" - morno, quente) - o processo de mudança do estado de um sistema termodinâmico a uma temperatura constante () (). O processo isotérmico é descrito pela lei de Boyle-Mariotte:
A uma temperatura constante e valores constantes da massa do gás e sua massa molar, o produto do volume do gás e sua pressão permanece constante: PV = const.
processo isentrópico
processo isentrópico- o processo de mudança de estado de um sistema termodinâmico a uma entropia constante (). Por exemplo, um processo adiabático reversível é isentrópico: nesse processo não há troca de calor com o ambiente. Um gás ideal em tal processo é descrito pela seguinte equação:
onde é o expoente adiabático, determinado pelo tipo de gás.
Fundação Wikimedia. 2010 .
Veja o que são "Isoprocessos" em outros dicionários:
Isoprocessos são processos termodinâmicos durante os quais a massa e mais uma das quantidades físicas dos parâmetros de estado: pressão, volume ou temperatura permanecem inalterados. Assim, um processo isobárico corresponde a uma pressão constante, um volume isocórico ... Wikipedia
A teoria cinética molecular (abreviada como MKT) é uma teoria que considera a estrutura da matéria do ponto de vista de três principais disposições aproximadamente corretas: todos os corpos consistem em partículas cujo tamanho pode ser desprezado: átomos, moléculas e íons; partículas ... ... Wikipédia
- (abreviado como MKT) uma teoria que considera a estrutura da matéria do ponto de vista de três principais disposições aproximadamente corretas: todos os corpos consistem em partículas cujo tamanho pode ser desprezado: átomos, moléculas e íons; as partículas estão em contínuo ... ... Wikipedia
livros
- Previsão estatística de características de resistência à deformação de materiais estruturais, G. Pluvinazh, VT Sapunov, Este livro apresenta um novo método que propõe uma metodologia comum para prever as características de processos cinéticos, comuns para materiais metálicos e poliméricos. Método… Categoria: Livros didáticos para universidades Editor: