Строение металлов. Внутреннее строение металлов и сплавов кристаллическое строение металлов Внутреннее строение и свойства металлов и сплавов
Оглавление книги Следующая страница>>§ 2. Строение металлов и сплавов и методы его изучения
Кристаллическое строение металлов . Изучением внутреннего строения и свойств металлов и сплавов занимается наука, называемая металловедением.
Все металлы и сплавы построены из атомов, у которых внешние электроны слабо связаны с ядром. Электроны заряжены отрицательно и если создать незначительную разность потенциалов, то электроны направятся к положительному полюсу, образуя электрический ток. Этим и объясняется электропроводность металлических веществ.
Все металлы и сплавы в твердом состоянии имеют кристаллическое строение. В отличие от некристаллических (аморфных) тел, у металлов атомы (ионы) расположены в строго геометрическом порядке, образуя пространственную кристаллическую решетку. Взаимное расположение атомов в пространстве и расстояния между ними устанавливаются рентгеноструктурным анализом. Расстояние между узлами в кристаллической решетке называется параметром решетки и измеряется в ангстремах Å (10 -8 см). Параметры решетки различных металлов колеблются от 2,8 до 6 Å (рис. 23).


а — кубическая объемноцентрированная; б — кубическая гранецентрированная; в —гексагональная
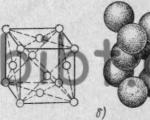
Для наглядного представления о расположении атомов в кристалле используют пространственные схемы в виде элементарных кристаллических ячеек. Наиболее распространенными типами кристаллических решеток являются кубическая объемноцентрированная, кубическая гранецентрированная и гексагональная.
В кубической объемноцентрированной решетке расположено девять атомов. Такую решетку имеют хром, вольфрам, молибден, ванадий и железо при температуре до 910° С.
В кубической гранецентрированной решетке расположено 14 атомов. Такую решетку имеют: медь, свинец, алюминий, золото, никель и железо при температуре 910—1400° С.
В гексагональной плотноупакованной решетке расположено 17 атомов. Такую решетку имеют: магний, цинк, кадмий и другие металлы.
Взаимное расположение атомов в пространстве, количество атомов в решетке и междуатомные пространства характеризуют свойства металла (электропроводность, теплопроводность, плавкость, пластичность и т. д.).
Расстояние между атомами в кристаллической решетке может быть различным по разным направлениям. Поэтому и свойства кристалла по разным направлениям не одинаковы. Такое явление называется анизотропией. Все металлы — тела кристаллические, поэтому они являются телами анизотропными. Тела, у которых свойства во всех направлениях одинаковые, называются изотропными.
Кусок металла, состоящий из множества кристаллов, обладает в среднем свойствами, одинаковыми во всех направлениях, поэтому он называется квазиизотропным (мнимая изотропность).
Анизотропность имеет большое практическое значение. Например, путем ковки, штамповки, прокатки в деталях получают правильную ориентацию кристаллов, в результате чего вдоль и поперек детали достигаются различные механические свойства. С помощью холодной прокатки добиваются высоких магнитных и электрических свойств в определенном направлении детали.
Введение
Металлы -- простые вещества, обладающие в обычных условиях характерными свойствами: высокой электро - и теплопроводностью, отрицательным температурным коэффициентом электропроводности, способностью хорошо отражать электромагнитные волны (блеск и непрозрачность), высокой прочностью и пластичностью.
Свойства металлов могут значительно измениться при очень высоких давлениях. Многие металлы в зависимости от температуры и давления могут существовать в виде нескольких кристаллических модификаций.
Подобными металлическими свойствами обладают более 80 химических элементов и множество металлических сплавов. Число металлических сплавов, применяемых в технике, исчисляется тысячами и постоянно возрастает в соответствии с возникающими новыми и разнообразными требованиями, предъявляемыми многими отраслями промышленности.
Свойства металлов обусловлены их кристаллическим строением и наличием в их кристаллической решетке многочисленных не связанных с атомными ядрами подвижных электронов проводимости.
Металлические сплавы по свойствам имеют много общего с металлами, поэтому их нередко относят к металлам.
Металлы (сплавы) в промышленности разделяют на две основные группы: черные и цветные металлы.
Черные металлы -- сплав железа с углеродом, в котором могут содержаться в большем или меньшем количестве и другие химические элементы. Кобальт, никель, а также близкий к ним по свойствам марганец нередко относят к черным металлам. Черные металлы получили наибольшее распространение, что обусловлено относительно высоким содержанием железа в земной коре, его низкой стоимостью, высокими механическими и технологическими свойствами.
Цветные металлы по свойствам подразделяют на следующие группы:
легкие (Be, Mg, Al, Ti), обладающие сравнительно малой плотностью -- до 5000 кг/м 3 ;
тугоплавкие (Ti, Сг, Zr, Nb, Mo, W, V и др.) с температурой плавления выше, чем у железа (1539°С);
благородные (Ph, Pd, Ag, Os, Pt, Аи и др.), обладающие химическойинертностью:
урановые (U, Th, Pa) -- актиноиды, используемые в атомной технике;
редкоземельные металлы (РЗМ), лантаноиды (Се, Рг, Nd, Sm и др.) и сходные с ними иттрий и скандий, применяемые как присадки к различным сплавам;
щелочноземельные металлы (Li, Na, К), используемые в качестве теплоносителей в ядерных реакторах.
Классификация металлических сплавов по химическому составу, основанная на указании главного компонента сплава (железо, медь, алюминий и др.), имеет традиционный характер, и получила наибольшее распространение.
Макро-, микро- и атомную структуру металлов и сплавов изучает металлография.
Макроструктура - это строение металла, видимое невооруженным глазом или с помощью лупы в изломе или на протравленном шлифе. Микроструктура строения металла, наблюдаемое под оптическим или электронным микроскопами, позволяющими увеличить рассматриваемый участок от десяти раз до сотен тысяч раз.
Атомная структура металлов - это пространственное расположение атомов в кристаллической решетке. Этот вид структуры исследуется с помощью рентгено- графического структурного анализа.
Строение металла
Все металлы имеют кристаллическое строение. Располагаясь тем или иным способом, атомы образуют элементарную ячейку пространственной кристаллической решетки. Тип ячейки зависит от химической природы и состояния металла. Кристаллическое состояние, прежде всего, характеризуется определенным, закономерным расположением атомов в пространстве. Это обусловливает то, что в кристалле каждый атом имеет одно и то же количество ближайших атомов -- соседей, расположенных на одинаковом от него расстоянии. В процессе кристаллизации положительно заряженные ионы, располагаясь последовательно в виде элементарных кристаллических решеток, образуют кристаллы в виде зерен или дендритов. Все металлы и сплавы имеют кристаллическое строение. Образующиеся кристаллы растут, кристаллизуются из жидкого расплава сначала свободно, не мешают один другому, потом они сталкиваются и рост кристаллов продолжается только в тех направлениях, где есть свободный доступ жидкого металла. В результате первоначальная геометрически правильная форма кристаллов нарушается. После затвердевания зерна и дендриты имеют неправильную, геометрически искаженную форму.
Рисунок 1. Схема кристаллизации: а - в виде зерен; б - в виде дендритов.
Стремление атомов (ионов) металла расположиться, возможно, ближе друг к другу, плотнее, приводит к тому, что число встречающихся комбинаций взаимного расположения атомов металла в кристаллах невелико.
Существует ряд схем и способов описания вариантов взаимного расположения атомов в кристалле. Взаимное расположение атомов в одной из плоскостей показано на схеме размещения атомов (рисунок 2) .

Рисунок 2. Элементарная кристаллическая ячейка (простая кубическая).
Воображаемые линии, проведенные через центры атомов, образуют решетку, в узлах которой располагаются атомы (положительно заряженные ионы); это так называемая кристаллографическая плоскость. Многократное повторение кристаллографических плоскостей, расположенных параллельно, воспроизводит пространственную кристаллическую решетку, узлы которой являются местом расположения атомов (ионов). Расстояния между центрами соседних атомов измеряются ангстремами (1 А= 1 * 10 -8 см) или в килоисках -- kX (1kX = 1,00202 А). Взаимное расположение атомов в пространстве и величину между атомных расстояний определяют рентгеноструктурным анализом. Расположение атомов в кристалле весьма удобно изображать в виде пространственных схем, в виде так называемых элементарных кристаллических ячеек. Под элементарной кристаллической ячейкой подразумевается наименьший комплекс атомов, который при многократном повторении в пространстве позволяет воспроизвести пространственную кристаллическую решетку. Простейшим типом кристаллической ячейки является кубическая решетка. В простой кубической решетке атомы расположены (упакованы) недостаточно плотно. Стремление атомов металла занять места, наиболее близкие друг к другу, приводит к образованию решеток других типов: кубической объемноцентрированной (рисунок 3, а), кубической гранецентрированной (рисунок 3, б) и гексагональной плотноупакованной (рисунок 3, в).

Рисунок 3. Элементарные кристаллические ячейки: а - кубическая объемноцентрированная; б - кубическая гранецентрированная; в - гексагональная плотноупакованная.
металл теплопроводность электромагнитный температурный
Кружки, отображающие атомы, располагаются в центре куба и по его вершинам (куб объемноцентрированный), или в центрах граней и по вершинам куба (куб гранецентрированный), или в виде шестигранника, внутрь которого наполовину вставлен также шестигранник, три атома верхней плоскости которого находятся внутри шестигранной призмы (гексагональная решетка).
Метод изображения кристаллической решетки, приведенный на рисунке 3, является условным (как в любой другой). Может быть, более правильно изображение атомов в кристаллической решетке в виде соприкасающихся шаров (левые схемы на рисунке 3). Однако такое изображение кристаллической решетки не всегда удобно, чем принятое (правые схемы на рисунке 3).
Размеры кристаллической решетки характеризуются параметрами, или периодами решетки. Кубическую решетку определяет один параметр -- длина ребра куба а (рисунок 3, а, б). Параметры имеют величины порядка атомных размеров и измеряются в ангстремах.
Так например, параметр решетки хрома, имеющего структуру объемноцентрированного куба, равен 2,878 А, а параметр решетки алюминия, имеющего структуру гранецентрированного куба, 4,041 А.
Параметр решетки -- чрезвычайно важная характеристика. Современные методы рентгеновского исследования позволяют измерить параметр с точностью до четвертого или даже пятого знака после запятой, т. е. одной десятитысячной -- одной стотысячной доли ангстрема.
Из рассмотрения схем кристаллических решеток (рисунок 3), если считать, что атомы являются как бы упругими, касающимися друг друга шарами, вытекает, что параметр решетки а и атомный диаметр d связаны простыми геометрическими соотношениями.
Для объемноцентрированного куба
Для гранецентрированного куба
Принимая для атома форму шара, можно подсчитать, что в кубической объемноцентрированной решетке атомы занимают 68% объема, а в кубической гранецентрированной (как и в гексагональной плотноупакованной) 74%, т.е. во втором случае атомы располагаются более плотно, более компактно.
Для металлов распространена гексагональная решетка (рисунок 3, в).
Если слои атомов касаются друг друга, т. е. три атома, изображенные внутри решетки (рисунок 3, в), касаются атомов, расположенных на верхней и нижней плоскостях, то имеем так называемую гексагональную плотноупакованную решетку.
Размеры гексагональной плотноупакованной решетки характеризуются постоянным значением с/а=1,633. При иных значениях с/а получается неплотлоупакованная гексагональная решетка.
Кубическая гранецентрированная и гексагональная решетки представляют самый плотный способ укладки шаров одного диаметра.
Некоторые металлы имеют тетрагональную решетку (рисунок 4); она характеризуется тем, что ребро с не равно ребру а. Отношение этих параметров характеризует так называемую степень тетрагональности. При с/а = 1 получается кубическая решетка. В зависимости от пространственного расположения атомов тетрагональная решетка (как и кубическая) может быть простой, объемноцентрированной и гранецентрированной.

Рисунок 4. Тетрагональная решетка
Существенное значение для свойств данного металла или сплава имеет число атомов, находящихся во взаимном контакте. Это определяется числом атомов, равноотстоящих на ближайшем расстоянии от любого атома.
Число атомов, находящихся на наиболее близком и равном расстоянии от данного атома, называется координационным числом. Так, например, атом в простой кубической решетке имеет шесть ближайших равноотстоящих соседей, т. е. координационное число этой решетки равно 6.
Центральный атом в объемноцентрированной решетке имеет восемь ближайших равноотстоящих соседей, т. е. координационное число этой решетки равно 8. Координационное число для гранецентрированной решетки равно 12. В случае гексагональной плотноупакованной решетки координационное число равно 12, а в случае с/а? 1,633 каждый атом имеет шесть атомов на одном расстоянии и шесть на другом (координационное число 6).
Для краткого обозначения кристаллической решетки с указанием в этом обозначении типа кристаллической решетки и координационного числа была принята одна из следующих систем (таблица 1).
Таблица 1
Каждый металл обладает определенной кристаллической решеткой.
Существенной характеристикой кристаллической структуры является число атомов, приходящихся на элементарную ячейку.
В о. ц. к. решетке атомы, находящиеся в вершине, принадлежат восьми элементарным ячейкам. Следовательно, каждый атом вносит в данную элементарную ячейку только одну восьмую часть своего объема. Центральный атом полностью принадлежит данной элементарной ячейке. Следовательно, на одну элементарную ячейку приходятся 1/8 * 8+1=2 атома.
В гранецентрированном кубе на одну элементарную ячейку приходятся четыре атома (1/8 ? 8 атом от числа расположенных в вершинах куба + 1/2 ? 6=3 атома из числа центрирующих грани).
Типично металлические элементы, расположенные в левой части таблицы Д. И. Менделеева, кристаллизуются в плотной упаковке, т. е. в простые кристаллические ячейки с большим координационным числом. Типично металлическими решетками являются, как указывалось, решетки о. ц. к., г. ц. к. и г. п. у. Действительно, почти все металлы, начиная от цинка, кадмия и ртути и левее имеют в большинстве случаев простые решетки.
Для неметаллических элементов характерно малое значение координационного числа (К4 и меньше). Неметаллы обладают меньшей плотностью и меньшим удельным весом, чем металлы.
Заключение
Металлы -- простые вещества, обладающие свободными, не связанными с определенными атомами электронами, которые способны перемещаться по всему объему тела. Эта особенность состояния металлического вещества определяет собой свойства металлов.
Атомы металлов легко отдают внешние (валентные) электроны, превращаясь при этом в положительно заряженные ноны. Отданные атомами свободные электроны непрерывно хаотически, т. е. беспорядочно, перемещаются по всему объему металла. Такие свободные электроны часто называют электронным газом. Положительно заряженные ионы при столкновении со свободными электронами на некоторое время могут превращаться в нейтральные атомы.
Таким образом, металлы состоят из упорядоченно расположенных в пространстве положительно заряженных ионов, перемещающихся среди них электронов и небольшого количества нейтральных атомов. Металлами являются алюминий, железо, медь, никель, хром и т.д.
Сплавы представляют собой системы, состоящие из двух или нескольких металлов или металлов и неметаллов. Сплавы обладают всеми характерными свойствами металлов. Например, сталь и чугун - сплавы железа с углеродом, кремнием, марганцем, фосфором и серой; бронза - сплав меди с оловом или другими элементами; латунь - сплав меди с цинком и другими элементами.
В промышленности широко применяют сплавы, получаемые сплавлением составляющих с последующей кристаллизацией из жидкого состояния, значительно меньше - сплавы, получаемые спеканием.
В процессе кристаллизации из расплавленного (жидкого) состояния металла или сплава положительно заряженные ионы и нейтральные атомы группируются в строго определенной последовательности, образуя кристаллические решетки - правильное упорядоченное расположение атомов в элементарной ячейке. Кристаллические решетки у металлов и сплавов могут быть различных типов: объемно-концентрированные кубические (о. ц. к.), гранецентрированные кубические (г. ц. к.), гексагональные плотноупакованные (г. п. у.). Объемно-концентрированную кубическую решетку образуют железо, медь, алюминий, свинец и др.; гексагональную плотноупакованную- цинк, магний, кобальт и др.
Для характеристики кристаллической решетки необходимо знать периоды решетки - расстояние а и с между центрами атомов или ионов, находящихся в узлах решетки. Период решетки измеряется в ангстремах (1А=10 -8 см).
В процессе кристаллизации положительно заряженные ионы, располагаясь последовательно в виде элементарных кристаллических решеток, образуют кристаллы в виде зерен или дендритов. Все металлы и сплавы имеют кристаллическое строение. Образующиеся кристаллы растут, кристаллизуются из жидкого расплава сначала свободно, не мешают один другому, потом они сталкиваются и рост кристаллов продолжается только в тех направлениях, где есть свободный доступ жидкого металла. В результате первоначальная геометрически правильная форма кристаллов нарушается. После затвердевания зерна и дендриты имеют неправильную, геометрически искаженную форму.
При нагревании поглощаемое металлами тепло расходуется на колебательные движения атомов и вследствие этого на тепловое расширение металла. При плавлении объем металлов увеличивается на 3-4%. С повышением температуры колебательные движения атомов или ионов возрастают, кристаллические зерна распадаются и сплав, проходя через твердо-жидкое состояние, превращается в расплав.
Переход в жидкое состояние не приводит к полному уничтожению кристаллической структуры. В расплаве металлов и сплавов всегда находятся мельчайшие участки, в которых сохраняется первоначальное, наследственное строение металла, близкое к кристаллическому. Кроме того, всегда присутствуют тугоплавкие частицы (остатки футеровки печи, примеси других элементов), которые могут образовывать дополнительные центры кристаллизации и вызывать начало кристаллизации. На искусственном создании центров кристаллизации в расплаве с одновременным изменением его скорости охлаждения основано управление кристаллизации сплава с целью получения заданной структуры сплава в твердом состоянии.
Литература
1. Гуляев А.П. Металловедение.- 5-е изд., перераб. и доп. - М.: Издательство "металлургия", 1977.
2. Материаловедение для слесарей-сантехников, слесарей-монтажников, машинистов строительных машин: Учебник для сред. проф.-тех. училищ /Ю.Г.Виноградов, К.С.Орлов, Л.А.Попова. - М.: Высш. школа, 2-е изд., 1989.
3. Материаловедение. Лекция 5. З.О.
4. Мойзберг Р.К. Материаловедение, 1991.
5. Ханапетов М.В. Сварка и резка металлов. - 3-е изд., перераб. и доп. - М.: Стройиздат, 1988.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Внутреннее строение металлов и сплавов
1. Атомное строение металлов
2. Полиморфизм. Анизотропия
3. Строение реальных кристаллов и дефекты кристаллической решетки
1 . Атомное строение металлов
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого - в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы - один из классов конструкционных материалов, характеризующийся определенным набором свойств:
· «металлический блеск» (хорошая отражательная способность);
· пластичность;
· высокая теплопроводность;
· высокая электропроводность.
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком - периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка - элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
Рис.1.1. Схема кристаллической решетки
размеры ребер элементарной ячейки. a, b, c - периоды решетки - расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определенными.
углы между осями ().
координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки.
плотность упаковки атомов в кристаллической решетке - объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки - 0,68, для гранецентрированной кубической решетки - 0,74)
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
Рис. 1.2. Основные типы кристаллических решеток: а - объемно-центрированная кубическая; б- гранецентрированная кубическая; в - гексагональная плотноупакованная
примитивный - узлы решетки совпадают с вершинами элементарных ячеек;
базоцентрированный - атомы занимают вершины ячеек и два места в противоположных гранях;
объемно-центрированный - атомы занимают вершины ячеек и ее центр;
гранецентрированный - атомы занимают вершины ячейки и центры всех шести граней
Основными типами кристаллических решеток являются:
1. Объемно-центрированная кубическая (ОЦК) (см. рис.1.2а), атомы располагаются в вершинах куба и в его центре (V, W, Ti,)
2. Гранецентрированная кубическая (ГЦК) (см. рис. 1.2б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Ag, Au,)
3. Гексагональная, в основании которой лежит шестиугольник:
o простая - атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
o плотноупакованная (ГПУ) - имеется 3 дополнительных атома в средней плоскости (цинк).
2 . Полиморфизм. Анизотропия
металл кристаллический атомный полиморфизм
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. Силы взаимодействия между атомами в значительной степени определяются расстояниями между ними. В аморфных телах с хаотическим расположением атомов в пространстве расстояния между атомами в различных направлениях равны, следовательно, свойства будут одинаковые, то есть аморфные тела изотропны.
В кристаллических телах атомы правильно располагаются в пространстве, причем по разным направлениям расстояния между атомами неодинаковы, что предопределяет существенные различия в силах взаимодействия между ними и, в конечном результате, разные свойства. Зависимость свойств от направления называется анизотропией
Чтобы понять явление анизотропии необходимо выделить кристаллографические плоскости и кристаллографические направления в кристалле.
Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью.
Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением.
Для обозначения кристаллографических плоскостей и направлений пользуются индексами Миллера. Чтобы установить индексы Миллера, элементарную ячейку вписывают в пространственную систему координат (оси X,Y, Z - кристаллографические оси). За единицу измерения принимается период решетки.
Рис.1.3. Примеры обозначения кристаллографических плоскостей (а) и кристаллографических направлений (б)
Для определения индексов кристаллографической кристалло-графической плоскости необходимо:
установить координаты точек пересечения плоскости с осями координат в единицах периода решетки;
взять обратные значения этих величин;
привести их к наименьшему целому кратному, каждому из полученных чисел.
Полученные значения простых целых чисел, не имеющие общего множителя, являются индексами Миллера для плоскости, указываются в круглых скобках. Примеры обозначения кристаллографических плоскостей на рис. 1.3 а.
Другими словами, индекс по оси показывает на сколько частей плоскость делит осевую единицу по данной оси. Плоскости,параллельные оси, имеют по ней индекс 0 (110)
Ориентация прямой определяется координатами двух точек. Для определения индексов кристаллографического направления необходимо:
одну точку направления совместить с началом координат;
установить координаты любой другой точки, лежащей на прямой, в единицах периода решетки
привести отношение этих координат к отношению трех наименьших целых чисел.
Индексы кристаллографических направлений указываются в квадратных скобкаж
В кубической решетке индексы направления, перпендикулярного плоскости (hkl) имеют те же индексы .
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Fe: - ОЦК - ;
ОЦК - ; (высокотемпературное)
Превращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких - алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
3 . Строение реальных кристаллов и дефекты кристаллической решетки
Из жидкого расплава можно вырастить монокристалл. Их обычно используют в лабораториях для изучения свойств того или иного вещества.
Металлы и сплавы, полученные в обычных условиях, состоят из большого количества кристаллов, то есть, имеют поликристаллическое строение. Эти кристаллы называются зернами. Они имеют неправильную форму и различно ориентированы в пространстве. Каждое зерно имеет свою ориентировку кристаллической решетки, отличную от ориентировки соседних зерен, вследствие чего свойства реальных металлов усредняются, и явления анизотропии не наблюдается. В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают следующие структурные несовершенства:
· точечные - малые во всех трех измерениях;
· линейные - малые в двух измерениях и сколь угодно протяженные в третьем;
· поверхностные - малые в одном измерении.
Точеные дефекты
Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей. (рис. 2.1.)
Рис.2.1. Точечные дефекты
Вакансия - отсутствие атомов в узлах кристаллической решетки, «дырки», которые образовались в результате различных причин. Образуется при переходе атомов с поверхности в окружающую среду или из узлов решетки на поверхность (границы зерен, пустоты, трещины и т. д.), в результате пластической деформации, при бомбардировке тела атомами или частицами высоких энергий (облучение в циклотроне или нейтронной облучение в ядерном реакторе). Концентрация вакансий в значительной степени определяется температурой тела. Перемещаясь по кристаллу, одиночные вакансии могут встречаться. И объединяться в дивакансии. Скопление многих вакансий может привести к образованию пор и пустот.
Дислоцированный атом - это атом, вышедший из узла решетки и занявший место в междоузлие. Концентрация дислоцированных атомов значительно меньше, чем вакансий, так как для их образования требуются существенные затраты энергии. При этом на месте переместившегося атома образуется вакансия.
Примесные атомы всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл. Они могут иметь размеры больше или меньше размеров основных атомов и располагаются в узлах решетки или междоузлиях.
Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. При перемещении по материалу дефекты могут взаимодействовать.
Линейные дефекты:
Основными линейными дефектами являются дислокации. Априорное представление о дислокациях впервые использовано в 1934 году Орованом и Тейлером при исследовании пластической деформации кристаллических материалов, для объяснения большой разницы между практической и теоретической прочностью металла.
Дислокация - это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей.
Простейшие виды дислокаций - краевые и винтовые.
Краевая дислокация представляет собой линию, вдоль которой обрывается внутри кристалла край “лишней“ полуплоскости (рис. 2.2)
Рис. 2.2. Краевая дислокация (а) и механизм ее образования (б)
Неполная плоскость называется экстраплоскостью.
Большинство дислокаций образуются путем сдвигового механизма. Ее образование можно описать при помощи следующей операции. Надрезать кристалл по плоскости АВСD, сдвинуть нижнюю часть относительно верхней на один период решетки в направлении, перпендикулярном АВ, а затем вновь сблизить атомы на краях разреза внизу.
Наибольшие искажения в расположении атомов в кристалле имеют место вблизи нижнего края экстраплоскости. Вправо и влево от края экстраплоскости эти искажения малы (несколько периодов решетки), а вдоль края экстраплоскости искажения простираются через весь кристалл и могут быть очень велики (тысячи периодов решетки) (рис. 2.3).
Если экстраплоскость находится в верхней части кристалла, то краевая дислокация - положительная (), если в нижней, то - отрицательная (). Дислокации одного знака отталкиваются, а противоположные притягиваются.
Рис. 2.3. Искажения в кристаллической решетке при наличии краевой дислокации
Другой тип дислокаций был описан Бюргерсом, и получил название винтовая дислокация
Винтовая дислокация получена при помощи частичного сдвига по плоскости Q вокруг линии EF (рис. 2.4) На поверхности кристалла образуется ступенька, проходящая от точки Е до края кристалла. Такой частичный сдвиг нарушает параллельность атомных слоев, кристалл превращается в одну атомную плоскость, закрученную по винту в виде полого геликоида вокруг линии EF, которая представляет границу, отделяющую часть плоскости скольжения, где сдвиг уже произошел, от части, где сдвиг не начинался. Вдоль линии EF наблюдается макроскопический характер области несовершенства, в других направлениях ее размеры составляют несколько периодов.
Если переход от верхних горизонтов к нижним осуществляется поворотом по часовой стрелке, то дислокация правая, а если поворотом против часовой стрелки - левая.
Рис. 2.4. Механизм образования винтовой дислокации
Винтовая дислокация не связана с какой-либо плоскостью скольжения, она может перемещаться по любой плоскости, проходящей через линию дислокации. Вакансии и дислоцированные атомы к винтовой дислокации не стекают.
В процессе кристаллизации атомы вещества, выпадающие из пара или раствора, легко присоединяются к ступеньке, что приводит к спиральному механизму роста кристалла.
Линии дислокаций не могут обрываться внутри кристалла, они должны либо быть замкнутыми, образуя петлю, либо разветвляться на несколько дислокаций, либо выходить на поверхность кристалла.
Дислокационная структура материала характеризуется плотностью дислокаций.
Плотность дислокаций в кристалле определяется как среднее число линий дислокаций, пересекающих внутри тела площадку площадью 1 м 2 , или как суммарная длина линий дислокаций в объеме 1 м 3
(см -2 ; м -2)
Плотность дислокаций изменяется в широких пределах и зависит от состояния материала. После тщательного отжига плотность дислокаций составляет 10 5 …10 7 м -2 , в кристаллах с сильно деформированной кристаллической решеткой плотность дислокаций достигает 10 15 …10 16 м -2 .
Плотность дислокации в значительной мере определяет пластичность и прочность материала (рис. 2.5)
Рис. 2.5. Влияние плотности дислокаций на прочность
Минимальная прочность определяется критической плотностью дислокаций
Если плотность меньше значения а, то сопротивление деформированию резко возрастает, а прочность приближается к теоретической. Повышение прочности достигается созданием металла с бездефектной структурой, а также повышением плотности дислокаций, затрудняющим их движение. В настоящее время созданы кристаллы без дефектов - нитевидные кристаллы длиной до 2 мм, толщиной 0,5…20 мкм - “усы“ с прочностью, близкой к теоретической: для железа = 13000 МПа, для меди =30000 МПа. При упрочнении металлов увеличением плотности дислокаций, она не должна превышать значений 10 15 …10 16 м -2 . В противном случае образуются трещины.
Дислокации влияют не только на прочность и пластичность, но и на другие свойства кристаллов. С увеличением плотности дислокаций возрастает внутреннее, изменяются оптические свойства, повышается электросопротивление металла. Дислокации увеличивают среднюю скорость диффузии в кристалле, ускоряют старение и другие процессы, уменьшают химическую стойкость, поэтому в результате обработки поверхности кристалла специальными веществами в местах выхода дислокаций образуются ямки.
Дислокации образуются при образовании кристаллов из расплава или газообразной фазы, при срастании блоков с малыми углами разориентировки. При перемещении вакансий внутри кристалла, они концентрируются, образуя полости в виде дисков. Если такие диски велики, то энергетически выгодно “захлопывание” их с образованием по краю диска краевой дислокации. Образуются дислокации при деформации, в процессе кристаллизации, при термической обработке.
Поверхностные дефекты- границы зерен, фрагментов и блоков (рис. 2.6).
Рис. 2.6. Разориентация зерен и блоков в металле
Размеры зерен составляют до 1000 мкм. Углы разориентации составляют до нескольких десятков градусов ().
Граница между зернами представляет собой тонкую в 5 - 10 атомных диаметров поверхностную зону с максимальным нарушением порядка в расположении атомов.
Строение переходного слоя способствует скоплению в нем дислокаций. На границах зерен повышена концентрация примесей, которые понижают поверхностную энергию. Однако и внутри зерна никогда не наблюдается идеального строения кристаллической решетки. Имеются участки, разориентированные один относительно другого на несколько градусов (). Эти участки называются фрагментами. Процесс деления зерен на фрагменты называется фрагментацией или полигонизацией.
В свою очередь каждый фрагмент состоит из блоков, размерами менее 10 мкм, разориентированных на угол менее одного градуса (). Такую структуру называют блочной или мозаичной.
Размещено на Allbest.ru
Подобные документы
Основные типы решеток, точечные и линейные дефекты. Связь строения кристаллической решетки с механическими и физическими свойствами материала. Реальное строение кристаллов, формы пластической деформации. Свойства металлов, применяемых в строительстве.
реферат , добавлен 30.07.2014
Классификация дефектов кристаллической решетки металлов. Схема точечных дефектов в кристалле. Дислокация при кристаллизации или сдвиге. Расположение атомов в области винтовой дислокации. Поверхностные или двухмерные дефекты. Схема блочной структуры.
лекция , добавлен 08.08.2009
Направления и этапы исследований в сфере строения и свойств металлов, их отражение в трудах отечественных и зарубежных ученых разных эпох. Типы кристаллических решеток металлов, принципы их формирования. Основные физические и химические свойства сплавов.
презентация , добавлен 29.09.2013
Точечные дефекты в кристаллической решетке реальных металлов: вакансии, дислоцированные атомы и примеси. Образование линейных дефектов (дислокаций). Роль винтовой дислокации в формировании растущего кристалла. Влияние плотности дислокаций на прочность.
презентация , добавлен 14.10.2013
Характеристика химических и физических свойств металлов. Отношение металлов к окислителям - простым веществам. Физический смысл внутреннего трения материалов. Примеры применения метода внутреннего трения в металловедении. Поиск динамического модуля.
курсовая работа , добавлен 30.10.2014
Свойства и атомно-кристаллическое строение металлов. Энергетические условия процесса кристаллизации. Строение металлического слитка. Изучение связи между свойствами сплавов и типом диаграммы состояния. Компоненты и фазы железоуглеродистых сплавов.
курсовая работа , добавлен 03.07.2015
Распространенность металлов в природе. Содержание металлов в земной коре в свободном состоянии и в виде сплавов. Классификация областей современной металлургии в зависимости от методов выделения металлов. Характеристика металлургических процессов.
презентация , добавлен 19.02.2015
Классификация металлов по основному компоненту, по температуре плавления. Характерные признаки, отличающие металлы от неметаллов: внешний блеск, высокая прочность. Характерные особенности черных и цветных металлов. Анализ сплавов цветных металлов.
контрольная работа , добавлен 04.08.2012
Определение механических свойств конструкционных материалов путем испытания их на растяжение. Методы исследования качества, структуры и свойств металлов и сплавов, определение их твердости. Термическая обработка деформируемых алюминиевых сплавов.
учебное пособие , добавлен 29.01.2011
Сущность и назначение термической обработки металлов, порядок и правила ее проведения, разновидности и отличительные признаки. Термомеханическая обработка как новый метод упрочнения металлов и сплавов. Цели химико-термической обработки металлов.
В изготовлении машин и рабочих установок, наиболее применяемыми стали металлы и их сплавы.
Металлы
– это вещества, которые обладают высокой электропроводностью и теплопроводностью, блеском, ковкостью и другими свойствами, которые легко и не очень поддаются металлообработке .
В промышленности все металлы и сплавы делят на две категории: цветные и черные . Так называемые черные металлы – это чистое железо и сплавы на основе его материала. К цветным – относятся остальные виды металлов. Для правильного выбора металла для изготовления конструкций механизмов с дальнейшим анализом ее использования, механических и других свойст, которые влияют на надежность и работоспособность машин – нужно знать внутреннее строение, механические, физико-химические и технологические свойства, а также каким методом проделывать обработку металла и нуждается ли материал в резке металла (если материал нужно обработать резкой, то лучше это сделать при помощи плазменной резки металла).

В твердом состоянии все металлы и сплавы имеют кристаллическое строение. Молекулы металлов (атомы, ионы) в пространстве располагаются в строго определенном порядке и между собой образуют кристаллическую решетку
.
Образуется кристаллическая решетка посредством обработки металла , т.е. перехода его состояния из жидкого в твердое. Такой процесс носит название – кристаллизация
. Впервые эти процессы были изучены ученым из России - Д.К. Черновым.
Процесс кристаллизации
:
Сам процесс состоит из двух частей. У металла, который находится в жидком состоянии, атомы непрерывно двигаются. Если понизить температуру, то скорость передвижения атомов уменьшается, они сближаются и группируются в кристаллы (поэтому для того, чтобы изменить форму и структуру изделия, его подвергают металлообработке при помощи нагревания) – это первая часть, при ней образуются центры кристаллизации.
Затем идет рост вокруг центров кристаллизации – это уже вторая часть процесса. В самом начале рост кристаллов протекает свободно, но потом, рост одних – мешает росту другим, в результате формируется неправильная форма группы кристаллов, которые называются зёрнами. Размер полученных зёрен, значительно влияет на дальнейшую металлообработку изделий. Металл, состоящий из крупных зёрен - имеет низкую сопротивляемость к удару, если производится резка металла , то появляется трудность в получении низкой шероховатости на поверхности такого металла. Размеры зёрен зависят от условий кристаллизации и свойств самого металла.
Способы изучения металлической структуры
:
Исследование структуры металлов и сплавов производится посредством макро и микро – анализов, а также и другими способами.
При помощи макро-анализа изучается строение металла, которое можно увидеть невооруженным глазом или при помощи лупы. Эта структура определяется по макрошлифам или изломам. Макрошлиф
– это образец металла, одна из сторон которого травлена кислотой и отшлифована.
При микро-анализе изучается размеры и формы зёрен, их структурные составляющие, выявляют микродефекты и качество термической обработки металла . Этот анализ производится по микрошлифам при помощи микроскопа. Микрошлиф
– это некий образец металла, который имеет плоскую отполированную поверхность, травленую слабым раствором кислоты.
Свойства металлов
:
Металлические свойства подразделяются на физико-химические, технологические и механические. Под механическими свойствами понимается сопротивляемость металла к воздействию на него внешней силы. К механическим свойствам относятся вязкость
, прочность
, стойкость
и другие.
Прочность
– это свойства металла в определенных условия не разрушаться, но воспринимать воздействие внешних сил. Это свойство является важным показателем при выборе метода обработки металла .
Вязкость
– это сопротивление материала при ударной нагрузке.
Твердость
– свойства материала к сопротивлению внедрения в него другого материала.

К основными технологическими свойствами относятся - ковкость
, свариваемость
, свойства плавления
, обрабатываемость резанием
и другие.
Ковкость
– это свойства материала подвергаться металлообработке ковкой и другим методам обработки давлением.
Свариваемость
– свойства материала создавать прочные сварные соединения.
Свойства плавления
– свойства материала в расплавленном виде заполнять литейные формы и создавать плотные отливки с нужной конфигурацией.
Обрабатываемость резанием
– свойства материала подвергаться резке металла для того, чтобы придать детали нужную форму, размер и шероховатость поверхности. Лучшим методом резки металлов является плазменная резка металла . После этого процесса металла практически не нуждается в дальнейшей металлообработке .
Для того, чтобы получать качественное изделие с хорошим внешним и внутренним строением, нужно хорошо разбираться в строении металлов, ведь только так можно получить отличный результат.
Строение металлов 4.33 /5 (86.67%) проголосовало 3
Строение металлов
Металлы под микроскопом
Все металлы состоят из огромного количества кристаллических зерен, которые соединяются между собой. Такое зернистое кристаллическое строение вещества можно увидеть, применяя специальные микроскопы, получившие название металлографических. Они отличаются от обычных тем, что здесь применяется боковое освещение металла, потому что металлы непрозрачны и их невозможно освещать снизу. В таких микроскопах источник света располагается так, чтобы часть лучей отражалась от поверхности металлов и попадала в объектив.

Рис. 1. Металломикроскоп.
Справа сверху — лучи света, отраженные от поверхности шлифа, идут в объектив микроскопа. Справа внизу — поверхность чистого железа, видимая с помощью металломикроскопа.
На рисунке 1 представлен один из таких микроскопов. Прежде чем рассматривать в нем образец, поверхность металла тщательно очищают наждачной бумагой, шлифуют и полируют до зеркального блеска. Такой образец называют шлифом. Затем поверхность шлифа подвергают так называемому травлению, для чего он смачивается в течение 2-3 мин раствором, чаще всего содержащим азотную кислоту и этиловый спирт. Применяют и другие растворы для травления шлифов. Делают это вот для чего: различные зерна сплава неодинаково растворяются кислотой, вследствие чего на поверхности металла выступают отдельные грани кристаллов, и когда протравленную часть шлифа освещают, то часть зерен отражает падающий на них свет прямо на объектив. Эти места под микроскопом кажутся светлыми. Другие зерна отражают свет в сторону, поэтому кажутся темными. Другой оттенок и даже окраску приобретают под микроскопом места сцепления отдельных кристаллических зерен, так называемые межкристаллитные участки (рис. 2).

Рис. 2. Шлифованная пластинка под микроскопом (травление стали 2-процентным спиртовым раствором азотной кислоты).
Применение металломикроскопа дало возможность установить, какое строение имеют металлы, как расположены в сплаве отдельные зерна, какие неметаллические включения содержат сплавы, отражение трещин на поверхности сплавов и т. д. На рисунке 3 приведена микрофотография чугуна, где ясно видны отдельные включения графита.
 />
/>
Рис. 3. Графит в чугуне (темные включения):
а-крупнопластинчатый графит в обычном сером чугуне; б-мелкопластинчатый графит в модифицированном сером чугуне (модификация 0.15%); в-шаровидные графитовые включения в чугуне, модифицированном магнием (×100).
Металломикроскоп в настоящее время является одним из приборов любой лаборатории, где изучают свойства различных металлов и сплавов.
Кристаллическая решетка металлов
С кристаллами вы уже знакомы. Так, например, изучая поваренную соль, вы знаете, что она состоит из 8 отдельных кристаллов кубической формы. Само слово «кристалл» происходит от греческого слова «кристаллос», означающее «лед». В будущем так стали называть все твердые тела, которые имеют определенную геометрическую форму. В природе подавляющее большинство твердых тел находится в кристаллическом состоянии. Железо как одно из твердых тел при застывании также образует кристаллы. Кристалл железа имеет кубическую решетку. Однако, рассматривая под микроскопом поверхность металла, мы не увидим этой правильной кубической формы кристаллов. Неправильная форма кристаллов возникает потому, что в расплаве при его затвердевании возникает много мельчайших зародышей, которые образуют более крупные кристаллы. Эти крупные кристаллы, сталкиваясь, начинают теснить, сдавливать друг друга. Следовательно, в затвердевающем слитке металла одновременно находится огромное количество кристаллов. Нарушению их формы способствует не только то, что они теснят друг друга, но также неодинаковая температура в различных местах остывания. Отдельные кристаллические зерна в застывшем металле имеют различную форму и величину. Они отделены друг от друга прослойкой, которая состоит из различных неметаллических включений. Эти неметаллические включения всегда присутствуют в том или другом количестве в металле.
Строение металлов
На рисунке 4 представлена схема образования зернистой структуры металла при его застывании.

Рис. 4. Схема роста кристаллов в застывающем расплаве:
а-образуются зародыши; б-растут кристаллы; в-кристаллы начинают теснить друг друга; г-отдельные зерна сращиваются.
Вещества, входящие в состав стали, имеют различную температуру плавления, а, следовательно, и затвердевания. Например, чистое железо становится твердым уже при температуре 1539° С, а в соединении с серой или другими элементами температура затвердевания более низкая. Поэтому слой металла, затвердевающий в первую очередь, состоит из наиболее тугоплавких элементов, например, железа и углерода. Такие примеси, как сера и фосфор, дают более легкоплавкие сплавы и затвердевают в последнюю очередь. Сера и фосфор - вредные примеси потому что их присутствие значительно уменьшает прочность сплава, делает его хрупким и малопригодным для изделий.
При затвердевании сплава более легкоплавкие соединения железа с серой и фосфором концентрируются в верхней части слитка и застывают в последнюю очередь, поэтому сплав железа с фосфором и серой собирается в верхней части слитка.
В кристаллах атомы каждого металла распределяются в строго определенном порядке. Они образуют так называемую пространственную решетку, которую нельзя увидеть ни в один из существующих микроскопов. Однако с помощью рентгеновских установок и других современных приборов можно изучить расположение атомов в кристаллической решетке.
Типы кристаллических решеток металлов
Среди металлов чаще всего встречаются три типа решеток, к первым из них относятся кубические объемноцентрированные. Они характерны тем, что атомы в них находятся в вершинах и центре куба например у лития, хрома, ванадия и других металлов (рис. 5,а).

Рис.5. Типы кристаллических решеток металла:
а-кубическая объемноцентрированная;
б-кубическая гранецентрированная;
в-гексагональная (плотная упаковка).
Ко второму типу относят решетку кубическую гранецентрированную (рис. 5,6), атомы в (которой расположены в вершинах куба и его гранях (например, у алюминия, меди, свинца, никеля, золота, серебра и платины).
Третий тип - это гексагональные, или шестиугольные, плотно упакованные решетки (рис.5,в). Они встречаются у магния, цинка, кадмия и бериллия.
Как видно из схемы, приведенной на рисунке 6, наиболее плотные упаковки атомов имеют гранецентрированные и гексагональные решетки.

Рис.6. Схема строения металла.
В узлах решетки положительно заряженные ионы. В промежутка находятся свободные электроны.
Интересно отметить, что некоторые металлы, в частности железо, цинк и никель, могут существовать в нескольких кристаллических формах, переходя из одной в другую. Этот переход совершается при различных температурах. Такие видоизменения, когда одно и то вещество может находиться в различных кристаллических формах, называются аллотропическими, а сами вещества аллотропными. Название «аллотропия» происходит от греческих слов «аллос»-другой, «тропос»-свойство.
Углерод может встречаться в природе в виде графита и алмаза, причем, как вы помните, графит является мягким веществом, оставляющим след на бумаге, в то время как алмаз один из наиболее твердых природных веществ. Температуры плавления алмаза и графита различны.
Известно аллотропическое видоизменение серы (ромбическая и призматическая). Ромбическая сера образуется при температуре ниже 96° С, выше этой температуры она переходит в призматическую. В зависимости от изменения кристаллического строения изменяются и свойства вещества.
Такие же аллотропические изменения наблюдают и у железа. Оно имеет решетку центрированного куба то температуры 910° С, а в интервале температур 910-1390° С совершается переход в гранецентрированную.
Аллотропические превращения металла легко наблюдать на примере олова. Обычное серебристо-белое олово имеет сложную кристаллическую решетку, которая устойчива при температуре выше 18° С, при более низкой температуре атомы олова в кристаллах начинают перестраиваться. Упаковка их (атомов) становится менее прочной, блестящее олово теряет блеск, ковкость и превращается в хрупкое серое олово, имеющее другую кристаллическую решетку.
Это явление было давно замечено и получило название «оловянной чумы», так как оловянные изделия - тарелки из олова, кубки, органы в церкви - иногда вдруг начинали разрушаться. «Оловянная чума» была большим бедствием. Как бороться с ней, не знали, потому что не знали причины ее происхождения. Сейчас нам ясно, что если нагревать изделие из олова, «заболевшее оловянной чумой», то кристаллы серого олова будут перестраиваться в кристаллы белого олова, и оно вновь приобретает ковкость и белый цвет.
Строение металлов
На схемах кристаллов (рис. 5) условно в кристаллической решетке проведены линии, соединяющие один атом металла с другим. В действительности никаких линий, соединяющих атомы, в узлах решетки нет. Они уложены плотно, соприкасаясь друг с другом. В узлах решетки находятся положительно заряженные ионы, окруженные электронами. Валентные электроны атомов металлов так же, как и сами атомы, находятся в беспрерывном колебании. Но внешне электроны (валентные) могут легче покинуть свой атом и перейти к соседнему. Следовательно, в кристаллической решетке имеются так называемые свободные электроны, или свободный электронный «газ», присущий всему комплексу атомов. Таким образом, возникает взаимодействие электронов внешних оболочек атомов металла. Благодаря этому внешнему взаимодействию электронов создается связь между атомами металла, возникают силы сцепления, прочно удерживающие атомы металла в кристаллической решетке (рис. 6). Ионы атомов металлов в кристаллической решетке, окруженные подвижными (незакрепленными) электронами, получили название ион-атомов, в отличие от обычных ионов.
То, что мы говорили о кристаллической решетке металлов, относится к чистым металлам, но мы знаем, что в практике применяют преимущественно сплавы.