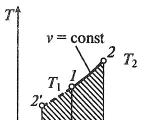
ตารางกระบวนการไอโซเทอร์มอล กฎของก๊าซในอุดมคติ
กระบวนการหลักในอุณหพลศาสตร์คือ:
- ไอโซคอริก, ไหลในปริมาณคงที่;
- ไอโซบาริกไหลด้วยแรงดันคงที่
- ไอโซเทอร์มอล, เกิดขึ้นที่อุณหภูมิคงที่;
- อะเดียแบติกซึ่งไม่มีการแลกเปลี่ยนความร้อนกับสิ่งแวดล้อม
- โพลีโทรปิก, สมการสมการ พีวีเอ็น= คงที่
กระบวนการไอโซคอริก ไอโซบาริก ไอโซเทอร์มอล และอะเดียแบติกเป็นกรณีพิเศษของกระบวนการโพลิโทรปิก
ในการศึกษากระบวนการทางอุณหพลศาสตร์กำหนด:
- ประมวลผลสมการใน หน้า— โวลต์ และ ต— สพิกัด;
- ความสัมพันธ์ระหว่างพารามิเตอร์ของสถานะก๊าซ
- การเปลี่ยนแปลงของพลังงานภายใน
- ปริมาณงานภายนอก
- ปริมาณความร้อนที่จ่ายให้กับกระบวนการหรือปริมาณความร้อนที่ถูกกำจัดออกไป
กระบวนการไอโซโคริก


กระบวนการไอโซโคริกในหน้า, โวลต์— , ต, ส- และฉัน, ส-พิกัด (ไดอะแกรม)
ในกระบวนการ isochoric เงื่อนไข โวลต์= คงที่
จากสมการสถานะของก๊าซในอุดมคติ ( พีวี = RT) ดังนี้:
พี/ที = อาร์/วี= คงที่,
นั่นคือ ความดันของก๊าซแปรผันโดยตรงกับอุณหภูมิสัมบูรณ์:
พี2/พี1 = ที2 /T1.
งานขยายตัวในกระบวนการ isochoric เป็นศูนย์ ( ล= 0) เนื่องจากปริมาตรของของไหลทำงานไม่เปลี่ยนแปลง (Δ โวลต์= คอสต์).
ปริมาณความร้อนที่จ่ายให้กับสารทำงานในกระบวนการ 1-2 ที่ ประวัติย่อ
ถาม= ประวัติย่อ(ต 2 — ต 1 ).
ต. ถึง ล= 0 ตามกฎข้อที่หนึ่งของอุณหพลศาสตร์ Δ ยู = ถามซึ่งหมายความว่าการเปลี่ยนแปลงของพลังงานภายในสามารถกำหนดได้โดยสูตร:
Δ ยู = cv (ท 2 - ท 1).
การเปลี่ยนแปลงของเอนโทรปีในกระบวนการ isochoric ถูกกำหนดโดยสูตร:
s2–s1= Δ ส = ประวัติย่อ ln( พี2/พี1) = ประวัติย่อ ln( ที2 /T1).
กระบวนการไอโซบาริก



กระบวนการไอโซบาริกในหน้า, โวลต์— , ต, ส- และฉัน, ส-พิกัด (ไดอะแกรม)
กระบวนการไอโซบาริกเป็นกระบวนการที่เกิดขึ้นที่ความดันคงที่ หน้า= คงที่ จากสมการสถานะของก๊าซในอุดมคติ จะได้ดังนี้
วี/ที = R/p= คงที่
v2/v1 = ที 2 /ที 1 ,
กล่าวคือ ในกระบวนการไอโซบาริก ปริมาตรของก๊าซจะแปรผันตรงกับอุณหภูมิสัมบูรณ์
งานจะเป็น:
ล = หน้า(โวลต์ 2 – โวลต์ 1 ).
ต. ถึง พีวี 1 = RT 1 และ พีวี 2 = RT 2 , ที่
ล = ร(ทีทู-ที1).
ปริมาณความร้อนที่ ซีพี= const ถูกกำหนดโดยสูตร:
ถาม = ซีพี(ทีทู-ที1).
การเปลี่ยนแปลงของเอนโทรปีจะเป็น:
s2–s1= Δ ส = ซีพี ln( ที2 /T1).
กระบวนการไอโซเทอร์มอล



กระบวนการไอโซเทอร์มอลในหน้า, โวลต์— , ต, ส- และฉัน, ส-พิกัด (ไดอะแกรม)
ในกระบวนการไอโซเทอร์มอล อุณหภูมิของของไหลทำงานจะคงที่ ต= const ดังนั้น:
พีวี = RT= คงที่
พี2/พี1 = v1/v2,
กล่าวคือ ความดันและปริมาตรแปรผกผันซึ่งกันและกัน ดังนั้นระหว่างการบีบอัดแบบอุณหภูมิความร้อน ความดันก๊าซจะเพิ่มขึ้น และระหว่างการขยายตัวจะลดลง
งานของกระบวนการจะเท่ากับ:
ล = RT ln( v2 – v1) = RT ln( พี 1 – พี 2).
เนื่องจากอุณหภูมิยังคงไม่เปลี่ยนแปลง พลังงานภายในของก๊าซในอุดมคติในกระบวนการไอโซเทอร์มอลจึงคงที่ (Δ ยู= 0) และความร้อนทั้งหมดที่จ่ายให้กับสารทำงานจะถูกแปลงเป็นงานของการขยายตัวอย่างสมบูรณ์:
ถาม = ล.
ในระหว่างการบีบอัดด้วยอุณหภูมิความร้อน ความร้อนจะถูกกำจัดออกจากของไหลทำงานในปริมาณที่เท่ากับงานที่ใช้ในการบีบอัด
การเปลี่ยนแปลงของเอนโทรปีคือ:
s2–s1= Δ ส = ร ln( พี1/พี2) = ร ln( v2/v1).
กระบวนการอะเดียแบติก



กระบวนการอะเดียแบติกในหน้า, โวลต์— , ต, ส- และฉัน, ส-พิกัด (ไดอะแกรม)
กระบวนการอะเดียแบติกคือการเปลี่ยนแปลงสถานะของก๊าซที่เกิดขึ้นโดยไม่มีการแลกเปลี่ยนความร้อนกับสิ่งแวดล้อม ตั้งแต่ง ถาม= 0 สมการของกฎข้อที่หนึ่งของอุณหพลศาสตร์สำหรับกระบวนการอะเดียแบติกจะมีรูปแบบ:
ง ยู + หน้าง โวลต์ = 0
Δ ยู+ ล = 0,
เพราะฉะนั้น
Δ ยู= —ล.
ในกระบวนการอะเดียแบติก การขยายตัวจะดำเนินการเนื่องจากการใช้พลังงานภายในของก๊าซเท่านั้น และในระหว่างการบีบอัดซึ่งเกิดขึ้นเนื่องจากการกระทำของแรงภายนอก งานทั้งหมดที่พวกเขาทำจะเพิ่มพลังงานภายใน ของแก๊ส
ให้เราแสดงความจุความร้อนในกระบวนการอะเดียแบติกผ่าน คนรกและเงื่อนไขง ถาม= 0 แสดงได้ดังนี้:
ง ถาม = คนรก d ต = 0.
เงื่อนไขนี้บอกว่าความจุความร้อนในกระบวนการอะเดียแบติกเป็นศูนย์ ( คนรก = 0)
เป็นที่รู้จักกันว่า
กับหน้า/ประวัติย่อ= เค
และสมการของเส้นโค้งกระบวนการอะเดียแบติก (อะเดียแบติก) ใน หน้า, โวลต์-แผนภาพดูเหมือนว่า:
พี.วี.เค= คงที่
ในสำนวนนี้ เคถูกเรียก เลขชี้กำลังอะเดียแบติก(เรียกอีกอย่างว่าอัตราส่วนของปัวซอง)
ค่าของเลขชี้กำลังอะเดียแบติกเคสำหรับก๊าซบางชนิด:
เคอากาศ = 1.4
เคไอน้ำร้อนยวดยิ่ง = 1.3
เคไอเสีย ICE = 1.33
เคไอเปียกอิ่มตัว = 1.135
จากสูตรก่อนหน้านี้ดังนี้:
ล= — Δ ยู = ประวัติย่อ(ต 1 – ต 2 );
ฉัน 1 – ฉัน 2 = ซีพี(ต 1 – ต 2 ).
งานด้านเทคนิคของกระบวนการอะเดียแบติก ( ลเทค) เท่ากับความแตกต่างระหว่างเอนทาลปีของจุดเริ่มต้นและจุดสิ้นสุดของกระบวนการ ( ฉัน 1 – ฉัน 2 ).
เรียกว่ากระบวนการอะเดียแบติกที่เกิดขึ้นโดยไม่มีแรงเสียดทานภายในของไหลทำงาน ไอเซนโทรปิก. ใน ต, สในแผนภาพจะแสดงด้วยเส้นแนวตั้ง
โดยปกติแล้ว กระบวนการอะเดียแบติกจริงจะดำเนินการในที่ที่มีแรงเสียดทานภายในของไหลทำงาน ซึ่งเป็นผลมาจากการที่ความร้อนถูกปล่อยออกมาเสมอ ซึ่งจะถูกส่งไปยังของไหลทำงานเอง ในกรณีนี้ ง ส> 0 และเรียกกระบวนการนี้ว่า กระบวนการอะเดียแบติกจริง.
กระบวนการโพลีโทรปิก
กระบวนการนี้เรียกว่า โพลิโทรปิก ซึ่งอธิบายโดยสมการ:
พีวีเอ็น= คงที่
ดัชนีโพลีโทรปิก นสามารถรับค่าใดๆ จาก -∞ ถึง +∞ ได้ แต่สำหรับกระบวนการนี้ จะเป็นค่าคงที่
จากสมการกระบวนการโพลิโทรปิกและสมการไคลเปอรอน เราสามารถรับนิพจน์ที่สร้างความสัมพันธ์ระหว่าง หน้า, โวลต์และ ตที่จุดสองจุดบน polytrope:
พี2/พี1 = (v1/v2)n; ที2 /T1 = (v1/v2) น-1 ; ที2 /T1 = (พี2/พี1) (n-1)/n .
การทำงานของการขยายตัวของก๊าซในกระบวนการโพลีโทรปิกคือ:

ในกรณีของแก๊สอุดมคติ สูตรนี้สามารถเปลี่ยนได้:

ปริมาณความร้อนที่จ่ายหรือนำออกในกระบวนการถูกกำหนดโดยใช้กฎข้อที่หนึ่งของอุณหพลศาสตร์:
ถาม = (คุณ 2 – คุณ 1) + ล.
เพราะว่า

คือความจุความร้อนของก๊าซอุดมคติในกระบวนการโพลีทรอปิก
ที่ ประวัติย่อ, เคและ น= คงที่ ค เอ็น= const ดังนั้นบางครั้งกระบวนการโพลีโทรปิกจึงถูกกำหนดให้เป็นกระบวนการที่มีความจุความร้อนคงที่
กระบวนการโพลีโทรปิกมีความหมายกว้างๆ เนื่องจากครอบคลุมกระบวนการทางอุณหพลศาสตร์พื้นฐานทั้งชุด
การแสดงกราฟิกของโพลีโทรปใน หน้า, โวลต์พิกัดขึ้นอยู่กับดัชนี polytrope น.

พีวี 0= คงที่ ( น= 0) คือไอโซบาร์
พีวี= คงที่ ( น= 1) คือไอโซเทอร์ม
พี 0 โวลต์= คงที่, หน้า 1/∞v= คงที่, pv∞= const - ไอโซชอร์;
พี.วี.เค= คงที่ ( น = เค) เป็นอะเดียบัต
น > 0 – เส้นโค้งไฮเปอร์โบลิก
น < 0 คือพาราโบลา
อ้างอิงจากเอกสารประกอบการบรรยายเกี่ยวกับอุณหพลศาสตร์และหนังสือเรียน "ความรู้พื้นฐานด้านพลังงาน" ผู้แต่ง G. F. Bystritsky แก้ไขครั้งที่ 2 รายได้ และเพิ่มเติม - ม.: KNORUS, 2554. - 352 น.
กระบวนการไอโซบาริกคืออะไร
คำนิยาม
กระบวนการไอโซบาริก (หรือไอโซบาริก) เป็นกระบวนการที่เกิดขึ้นในมวลคงที่ของก๊าซที่ความดันคงที่
ให้เราเขียนสมการของก๊าซในอุดมคติสองสถานะ:
\ \
เราหารสมการ (2) ด้วยสมการ (1) เราได้สมการของกระบวนการไอโซบาริก:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \left(4\right).\]
สมการ (4) เรียกว่ากฎของเกย์-ลูสแซก
พลังงานภายในและปริมาณความร้อนของกระบวนการไอโซบาริก
กระบวนการนี้เกิดขึ้นกับการป้อนความร้อนหากปริมาตรเพิ่มขึ้นหรือการกำจัดความร้อนเพื่อลดปริมาตร มาเขียนกฎข้อที่หนึ่งของอุณหพลศาสตร์กัน เราจะได้นิพจน์สำหรับงาน พลังงานภายใน และปริมาณความร้อนของกระบวนการไอโซบาริกอย่างต่อเนื่อง:
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \left(5\right).\] \[\triangle Q=\int\limits^(T_2)_ (T_1)(dU)+\int\จำกัด^(V_2)_(V_1)(dA)(6)\]
โดยที่ $\delta Q\ $ คือความร้อนเบื้องต้นที่จ่ายให้กับระบบ $dU$ คือการเปลี่ยนแปลงของพลังงานภายในของแก๊สในกระบวนการที่กำลังดำเนินอยู่ $dA$ คืองานเบื้องต้นที่ทำโดยแก๊สในกระบวนการ i คือจำนวนองศาอิสระของโมเลกุลของแก๊ส R คือค่าคงที่ของแก๊สสากล d คือจำนวนโมลของแก๊ส
การเปลี่ยนแปลงพลังงานภายในของก๊าซ:
\[\triangle U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
สมการ (8) กำหนดงานสำหรับกระบวนการ isobaric เราลบสมการ (1) จาก (2) เราได้สมการเพิ่มเติมสำหรับการทำงานของแก๊สในกระบวนการไอโซบาริก:
\ \[\triangle Q=\frac(i)(2)нR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \triangle T\ ( 10),\]
โดยที่ $c_(\mu p)$ คือความจุความร้อนโมลาร์ของก๊าซในกระบวนการไอโซบาริก สมการ (10) กำหนดปริมาณความร้อนที่จ่ายให้กับก๊าซมวล m ในกระบวนการไอโซบาริกโดยมีอุณหภูมิเพิ่มขึ้น $\triangle T.$
กระบวนการไอโซโพรเซสมักจะแสดงไว้ในแผนภาพอุณหพลศาสตร์ ดังนั้น เส้นที่แสดงกระบวนการไอโซบาริกบนไดอะแกรมดังกล่าวจึงเรียกว่าไอโซบาร์ (รูปที่ 1)
ตัวอย่างที่ 1
งาน: พิจารณาว่าแรงกดดัน $p_1$ และ $p_2$ เกี่ยวข้องกันอย่างไรในไดอะแกรม V(T) ในรูปที่ 1c
วาดไอโซเทอร์ม $T_1$

ที่จุด A และ B อุณหภูมิจะเท่ากัน ดังนั้น ก๊าซจึงเป็นไปตามกฎของ Boyle-Mariotte:
\ \
ลองแปลงปริมาณเหล่านี้เป็น SI: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
มาคำนวณกัน:
คำตอบ: การทำงานของแก๊สในกระบวนการไอโซบาริกคือ 600 J
ตัวอย่างที่ 3
งาน: เปรียบเทียบงานแก๊สในกระบวนการ ABC และงานแก๊สในกระบวนการ CDA รูปที่ 3

เราใช้สูตรที่กำหนดการทำงานของแก๊สเป็นพื้นฐานในการแก้ปัญหา:
จากความหมายทางเรขาคณิตของอินทิกรัลที่แน่นอน เป็นที่ทราบกันดีว่างานคือพื้นที่ของรูปซึ่งถูกจำกัดโดยฟังก์ชันของอินทิกรันด์ แกน abscissa และ isochores ที่จุด $V_1\ และ\ V_2$ (แกน p(V)). เราแปลกราฟกระบวนการเป็นแกน p(V)
พิจารณาแต่ละส่วนของกราฟของกระบวนการที่แสดงในรูปที่ (3)
AB: กระบวนการ Isochoric (p=const), $V\uparrow \left(\ Volume\ Grows\right),\ T\uparrow $;
VS: กระบวนการไอโซคอริก (V =const), $T\uparrow $ (จากกราฟ), p$\uparrow $, จากกฎหมายสำหรับกระบวนการไอโซคอริก ($\frac(p)(T)=const$);
ซีดี: (p=const), $V\downarrow ,\ T\downarrow ;$
DA: (V =const), $T\downarrow ,\ p\downarrow .$
อธิบายกราฟของกระบวนการในแกน p(V) (รูปที่ 4):

งานแก๊ส $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- พื้นที่สี่เหลี่ยมผืนผ้า ABFE) (รูปที่ 3) ทำงานกับแก๊ส $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -area\ ofสี่เหลี่ยมผืนผ้า\ $EFCD แน่นอน $A_(CDA)>A_(ABC).$
, กระบวนการทางอุณหพลศาสตร์คือการเปลี่ยนแปลงสถานะของระบบซึ่งเป็นผลมาจากพารามิเตอร์อย่างน้อยหนึ่งตัว (อุณหภูมิ ปริมาตร หรือความดัน) เปลี่ยนค่าของมัน อย่างไรก็ตาม หากเราพิจารณาว่าพารามิเตอร์ทั้งหมดของระบบอุณหพลศาสตร์มีการเชื่อมโยงความสัมพันธุ์ไม่ได้ การเปลี่ยนแปลงในพารามิเตอร์ใดพารามิเตอร์หนึ่งย่อมทำให้เกิดการเปลี่ยนแปลงในพารามิเตอร์อย่างน้อยหนึ่งตัว (ตามอุดมคติ) หรือหลายพารามิเตอร์ (ในความเป็นจริง) อย่างหลีกเลี่ยงไม่ได้ ในกรณีทั่วไป เราสามารถพูดได้ว่ากระบวนการทางอุณหพลศาสตร์เกี่ยวข้องกับการละเมิดสมดุลของระบบ และหากระบบอยู่ในสภาวะสมดุล กระบวนการทางอุณหพลศาสตร์จะไม่สามารถเกิดขึ้นได้
สภาวะสมดุลของระบบเป็นแนวคิดเชิงนามธรรม เนื่องจากเป็นไปไม่ได้ที่จะแยกวัตถุใดๆ ออกจากโลกโดยรอบ ดังนั้นกระบวนการทางอุณหพลศาสตร์ต่างๆ จึงเกิดขึ้นในระบบจริงอย่างหลีกเลี่ยงไม่ได้ ในเวลาเดียวกัน ในบางระบบ การเปลี่ยนแปลงที่ช้าจนแทบมองไม่เห็นสามารถเกิดขึ้นได้ โดยกระบวนการที่เกี่ยวข้องสามารถพิจารณาตามเงื่อนไขว่าประกอบด้วยลำดับของสถานะสมดุลของระบบ กระบวนการดังกล่าวเรียกว่าดุลยภาพหรือ กึ่งสถิต.
อีกสถานการณ์หนึ่งที่เป็นไปได้ของการเปลี่ยนแปลงที่ต่อเนื่องกันในระบบ ซึ่งหลังจากนั้นจะกลับสู่สถานะเดิม เรียกว่า กระบวนการแบบวงกลมหรือวงจร แนวคิดเกี่ยวกับความสมดุลและกระบวนการแบบวงกลมนั้นอยู่ภายใต้ข้อสรุปทางทฤษฎีมากมายและวิธีการประยุกต์ทางอุณหพลศาสตร์
การศึกษากระบวนการทางอุณหพลศาสตร์ประกอบด้วยการพิจารณางานที่ทำในกระบวนการนี้ การเปลี่ยนแปลงของพลังงานภายใน ปริมาณความร้อน และการสร้างความสัมพันธ์ระหว่างปริมาณแต่ละปริมาณที่แสดงลักษณะสถานะของก๊าซ
ในบรรดากระบวนการทางอุณหพลศาสตร์ที่เป็นไปได้ทั้งหมด กระบวนการไอโซคอริก ไอโซบาริก ไอโซเทอร์มอล อะเดียแบติก และโพลิโทรปิกเป็นสิ่งที่น่าสนใจที่สุด
กระบวนการไอโซโคริก
กระบวนการไอโซโคริกเป็นกระบวนการทางอุณหพลศาสตร์ที่เกิดขึ้นที่ปริมาตรคงที่ กระบวนการดังกล่าวสามารถทำได้โดยการให้ความร้อนแก่ก๊าซที่อยู่ในภาชนะปิด ก๊าซร้อนขึ้นจากการจ่ายความร้อนและความดันเพิ่มขึ้น
การเปลี่ยนแปลงพารามิเตอร์ของก๊าซในกระบวนการไอโซโคริกอธิบายถึงกฎของชาร์ลส์: p 1 /T 1 \u003d p 2 /T 2 หรือในกรณีทั่วไป:
p/T = ต้นทุน
ความดันของแก๊สที่ผนังภาชนะแปรผันโดยตรงกับอุณหภูมิสัมบูรณ์ของแก๊ส
เนื่องจากในกระบวนการ isochoric การเปลี่ยนแปลงปริมาตร dV เท่ากับศูนย์ เราสามารถสรุปได้ว่าความร้อนทั้งหมดที่จ่ายให้กับก๊าซนั้นถูกใช้ไปกับการเปลี่ยนพลังงานภายในของก๊าซ (ไม่มีงานทำ).
กระบวนการไอโซบาริก
กระบวนการไอโซบาริกเป็นกระบวนการทางอุณหพลศาสตร์ที่เกิดขึ้นที่ความดันคงที่ กระบวนการดังกล่าวสามารถดำเนินการได้โดยการวางก๊าซในกระบอกสูบที่มีความหนาแน่นซึ่งมีลูกสูบที่เคลื่อนที่ได้ ซึ่งถูกกระทำโดยแรงภายนอกที่คงที่ระหว่างการกำจัดและการจ่ายความร้อน
เมื่ออุณหภูมิของก๊าซเปลี่ยนแปลง ลูกสูบจะเคลื่อนที่ไปในทิศทางใดทิศทางหนึ่ง ในขณะที่ปริมาตรของก๊าซเปลี่ยนไปตามกฎของเกย์-ลูสแซก:
V/T = คงที่
ซึ่งหมายความว่าในกระบวนการไอโซบาริก ปริมาตรของก๊าซจะแปรผันโดยตรงกับอุณหภูมิ
สรุปได้ว่าการเปลี่ยนแปลงของอุณหภูมิในกระบวนการนี้จะนำไปสู่การเปลี่ยนแปลงของพลังงานภายในของก๊าซอย่างหลีกเลี่ยงไม่ได้ และการเปลี่ยนแปลงของปริมาตรนั้นสัมพันธ์กับประสิทธิภาพการทำงาน เช่น ในกระบวนการไอโซบาริก ส่วนหนึ่งของความร้อน พลังงานถูกใช้ไปกับการเปลี่ยนแปลงพลังงานภายในของแก๊ส และอีกส่วนถูกใช้ไปกับการทำงานของแก๊สเพื่อเอาชนะการกระทำของแรงภายนอก ในกรณีนี้ อัตราส่วนระหว่างค่าความร้อนสำหรับการเพิ่มพลังงานภายในและสำหรับการทำงานขึ้นอยู่กับความจุความร้อนของก๊าซ
กระบวนการไอโซเทอร์มอล
กระบวนการไอโซเทอร์มอลเป็นกระบวนการทางอุณหพลศาสตร์ที่เกิดขึ้นที่อุณหภูมิคงที่
ในทางปฏิบัติเป็นเรื่องยากมากที่จะดำเนินการตามกระบวนการไอโซเทอร์มอลด้วยก๊าซ ท้ายที่สุดจำเป็นต้องปฏิบัติตามเงื่อนไขที่ว่าในกระบวนการบีบอัดหรือขยายตัวก๊าซจะมีเวลาในการแลกเปลี่ยนอุณหภูมิกับสิ่งแวดล้อมโดยรักษาอุณหภูมิให้คงที่
กฎของ Boyle-Mariotte อธิบายกระบวนการไอโซเทอร์มอล: pV \u003d const, เช่น ที่อุณหภูมิคงที่ ความดันก๊าซจะแปรผกผันกับปริมาตร
เห็นได้ชัดว่าในกระบวนการไอโซเทอร์มอล พลังงานภายในของก๊าซจะไม่เปลี่ยนแปลง เนื่องจากอุณหภูมิของมันคงที่
เพื่อให้บรรลุสภาวะคงที่ของอุณหภูมิก๊าซ จำเป็นต้องขจัดความร้อนออกจากมัน ซึ่งเทียบเท่ากับงานที่ใช้ในการบีบอัด:
dq = dA = pdv
การใช้สมการสถานะของก๊าซ หลังจากทำการเปลี่ยนแปลงและการแทนที่จำนวนมาก เราสามารถสรุปได้ว่าการทำงานของก๊าซในกระบวนการไอโซเทอร์มอลถูกกำหนดโดยนิพจน์:
A = RT ln(หน้า 1 /หน้า 2).
กระบวนการอะเดียแบติก
กระบวนการอะเดียแบติกเป็นกระบวนการทางอุณหพลศาสตร์ที่ดำเนินไปโดยไม่มีการแลกเปลี่ยนความร้อนระหว่างของไหลทำงานกับสิ่งแวดล้อม เช่นเดียวกับกระบวนการไอโซเทอร์มอล การนำกระบวนการอะเดียแบติกไปใช้ในทางปฏิบัติเป็นเรื่องยากมาก กระบวนการดังกล่าวสามารถดำเนินการกับสื่อการทำงานที่วางอยู่ในภาชนะ เช่น กระบอกสูบที่มีลูกสูบ ซึ่งล้อมรอบด้วยวัสดุฉนวนความร้อนคุณภาพสูง
แต่ไม่ว่าเราจะใช้ฉนวนความร้อนคุณภาพสูงแบบใดในกรณีนี้ ปริมาณความร้อนบางส่วนจะถูกแลกเปลี่ยนระหว่างสารทำงานและสิ่งแวดล้อมอย่างหลีกเลี่ยงไม่ได้
ดังนั้นในทางปฏิบัติจึงเป็นไปได้ที่จะสร้างแบบจำลองโดยประมาณของกระบวนการอะเดียแบติกเท่านั้น อย่างไรก็ตาม กระบวนการทางอุณหพลศาสตร์จำนวนมากที่ดำเนินการในวิศวกรรมความร้อนดำเนินไปอย่างรวดเร็วจนของเหลวทำงานและตัวกลางไม่มีเวลาแลกเปลี่ยนความร้อน ดังนั้นด้วยข้อผิดพลาดระดับหนึ่ง กระบวนการดังกล่าวจึงถือเป็นอะเดียแบติก
เพื่อให้ได้สมการเกี่ยวกับความดันและปริมาตร 1 กกก๊าซในกระบวนการอะเดียแบติก เราเขียนสมการของกฎข้อที่หนึ่งของอุณหพลศาสตร์:
dq = ดู่ + pdv
เนื่องจากสำหรับกระบวนการอะเดียแบติก การถ่ายเทความร้อน dq มีค่าเท่ากับศูนย์ และการเปลี่ยนแปลงของพลังงานภายในเป็นฟังก์ชันของการนำความร้อนของอุณหภูมิ: du = c v dT จากนั้นเราสามารถเขียน:
c v dT + pdv = 0 (3) .
แยกความแตกต่างของสมการ Clapeyron pv = RT เราได้รับ:
pdv + vdp = ถ.
ให้เราแสดง dT จากตรงนี้แล้วแทนลงในสมการ (3) หลังจากการจัดเรียงใหม่และการเปลี่ยนแปลง เราได้รับ:
pdvc v /(R + 1) + c v vdp/R = 0.
เมื่อคำนึงถึงสมการเมเยอร์ R = c p – c v นิพจน์สุดท้ายสามารถเขียนใหม่เป็น:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
หารนิพจน์ผลลัพธ์ด้วย c v และแสดงอัตราส่วน c p / c v ด้วยตัวอักษร k หลังจากรวมสมการแล้ว (4) เราได้รับ (ที่ k = คงที่):
ln vk + ln p = const หรือ ln pvk = const หรือ pvk = const
สมการที่ได้คือสมการของกระบวนการอะเดียแบติก โดยที่ k เป็นเลขชี้กำลังของอะเดียแบติก
หากเราถือว่าความจุความร้อนเชิงปริมาตร c v เป็นค่าคงที่ เช่น c v \u003d const ดังนั้นงานของกระบวนการอะเดียแบติกสามารถแสดงเป็นสูตรได้ (ให้โดยไม่มีการส่งออก):
ล. \u003d c v (T 1 - T 2) หรือ ล. \u003d (หน้า 1 โวลต์ 1 - พี 2 โวลต์ 2) / (k-1).
กระบวนการโพลีโทรปิก
ซึ่งแตกต่างจากกระบวนการทางอุณหพลศาสตร์ที่พิจารณาข้างต้น เมื่อพารามิเตอร์ของก๊าซใดๆ ยังคงไม่เปลี่ยนแปลง กระบวนการแบบโพลิโทรปิกนั้นมีความเป็นไปได้ที่จะเปลี่ยนแปลงพารามิเตอร์ของก๊าซหลักใดๆ กระบวนการทางอุณหพลศาสตร์ทั้งหมดข้างต้นเป็นกรณีพิเศษของกระบวนการโพลีโทรปิก
สมการทั่วไปของกระบวนการ polytropic มีรูปแบบ pv n = const โดยที่ n คือดัชนี polytropic ซึ่งเป็นค่าคงที่สำหรับกระบวนการนี้ซึ่งสามารถรับค่าจาก - ∞ ถึง + ∞ .
เห็นได้ชัดว่าการให้ค่าบางอย่างกับดัชนี polytropic สามารถรับกระบวนการทางอุณหพลศาสตร์อย่างใดอย่างหนึ่ง - isochoric, isobaric, isothermal หรือ adiabatic
ดังนั้น ถ้าเราใช้ n = 0 เราจะได้ p = const - กระบวนการไอโซบาริก ถ้าเราใช้ n = 1 เราจะได้กระบวนการไอโซเทอร์มอลที่อธิบายโดยการพึ่งพา pv = const ; สำหรับ n = k กระบวนการเป็นแบบอะเดียแบติก และสำหรับ n เท่ากับ - ∞ หรือ + ∞ เราได้กระบวนการไอโซโคริก
หัวข้อของตัวแปลงสัญญาณ USE: isoprocesses - กระบวนการ isothermal, isochoric, isobaric
ตลอดเอกสารฉบับนี้ เราจะปฏิบัติตามข้อสันนิษฐานต่อไปนี้: มวลและองค์ประกอบทางเคมีของก๊าซยังคงไม่เปลี่ยนแปลง. กล่าวอีกนัยหนึ่ง เราเชื่อว่า:
นั่นคือไม่มีการรั่วไหลของก๊าซจากเรือหรือในทางกลับกันก๊าซไหลเข้าสู่เรือ
นั่นคือ อนุภาคของแก๊สจะไม่มีการเปลี่ยนแปลงใดๆ (กล่าวคือ ไม่มีการแตกตัว - การสลายตัวของโมเลกุลเป็นอะตอม)
เงื่อนไขทั้งสองนี้เป็นไปตามสถานการณ์ที่น่าสนใจทางกายภาพมากมาย (เช่น ในเครื่องยนต์ความร้อนรุ่นธรรมดา) ดังนั้นจึงสมควรได้รับการพิจารณาแยกต่างหาก
ถ้ามวลของแก๊สและมวลโมลาร์คงที่ สถานะของแก๊สจะถูกกำหนดโดย สามพารามิเตอร์มหภาค: ความดันปริมาตรและ อุณหภูมิ. พารามิเตอร์เหล่านี้สัมพันธ์กันโดยสมการสถานะ (สมการ Mendeleev-Clapeyron)
กระบวนการทางอุณหพลศาสตร์(หรือเรียกง่ายๆว่า กระบวนการ) คือการเปลี่ยนแปลงสถานะของก๊าซเมื่อเวลาผ่านไป ในระหว่างกระบวนการทางอุณหพลศาสตร์ ค่าของพารามิเตอร์ระดับมหภาคจะเปลี่ยนไป - ความดัน ปริมาตร และอุณหภูมิ
ที่น่าสนใจเป็นพิเศษคือ ไอโซโพรเซส- กระบวนการทางอุณหพลศาสตร์ซึ่งค่าของพารามิเตอร์มหภาคตัวใดตัวหนึ่งยังคงไม่เปลี่ยนแปลง การแก้ไขพารามิเตอร์แต่ละตัวในสามพารามิเตอร์ทำให้เราได้รับไอโซโพรเซสสามประเภท
1. กระบวนการไอโซเทอร์มอลไปที่อุณหภูมิก๊าซคงที่: .
2. กระบวนการไอโซบาริกทำงานที่แรงดันแก๊สคงที่: .
3. กระบวนการไอโซโคริกไปที่ปริมาตรคงที่ของก๊าซ: .
กระบวนการไอโซโพรเซสอธิบายโดยกฎง่ายๆ ของ Boyle - Mariotte, Gay-Lussac และ Charles เรามาศึกษากันต่อ
กระบวนการไอโซเทอร์มอล
ให้ก๊าซในอุดมคติดำเนินกระบวนการแบบไอโซเทอร์มอลที่อุณหภูมิ . ในระหว่างกระบวนการ ความดันของก๊าซและปริมาตรเท่านั้นที่เปลี่ยนไป
พิจารณาสถานะของก๊าซโดยพลการสองสถานะ: ในหนึ่งในนั้น ค่าของพารามิเตอร์มหภาคคือ และในสถานะที่สองคือ . ค่าเหล่านี้เกี่ยวข้องกับสมการ Mendeleev-Clapeyron:
ดังที่เรากล่าวไว้ตั้งแต่ต้น มวลและมวลโมลาร์จะถือว่าคงที่
ดังนั้นส่วนที่ถูกต้องของสมการที่เขียนจึงเท่ากัน ดังนั้นด้านซ้ายจึงเท่ากัน:
(1)
เนื่องจากทั้งสองสถานะของก๊าซถูกเลือกโดยพลการ เราจึงสรุปได้ว่า ในระหว่างกระบวนการอุณหภูมิคงที่ ผลคูณของความดันและปริมาตรของก๊าซจะคงที่:
(2)
คำสั่งนี้เรียกว่า กฎของบอยล์ - Mariotte.
มีการเขียนกฎหมาย Boyle-Mariotte ในรูปแบบ
(3)
เราสามารถกำหนดได้ดังนี้: ในกระบวนการไอโซเทอร์มอล ความดันของก๊าซจะแปรผกผันกับปริมาตรของมัน. ตัวอย่างเช่น ถ้าในระหว่างการขยายตัวของก๊าซที่อุณหภูมิความร้อน ปริมาตรของก๊าซจะเพิ่มขึ้น 3 เท่า ความดันของก๊าซจะลดลง 3 เท่า
จะอธิบายความสัมพันธ์ผกผันระหว่างความดันและปริมาตรจากมุมมองทางกายภาพได้อย่างไร ที่อุณหภูมิคงที่ พลังงานจลน์เฉลี่ยของโมเลกุลของก๊าซจะไม่เปลี่ยนแปลง กล่าวคือ แรงกระแทกของโมเลกุลบนผนังของภาชนะจะไม่เปลี่ยนแปลง เมื่อปริมาตรเพิ่มขึ้นความเข้มข้นของโมเลกุลจะลดลงและจำนวนผลกระทบของโมเลกุลต่อหน่วยเวลาต่อหน่วยพื้นที่ของผนังจะลดลง - ความดันก๊าซจะลดลง ในทางตรงกันข้าม เมื่อปริมาตรลดลง ความเข้มข้นของโมเลกุลจะเพิ่มขึ้น การกระแทกของโมเลกุลจะบ่อยขึ้น และความดันของก๊าซจะเพิ่มขึ้น
กราฟกระบวนการไอโซเทอร์มอล
โดยทั่วไป เป็นเรื่องปกติที่จะแสดงกราฟของกระบวนการทางอุณหพลศาสตร์ในระบบพิกัดต่อไปนี้:
-แผนภาพ: แกน abscissa, แกนกำหนด;
-แผนภาพ: แกน abscissa, แกนกำหนด
กราฟของกระบวนการไอโซเทอร์มอลเรียกว่า ไอโซเทอร์ม.
ไอโซเทอร์มบนแผนภูมิเป็นแผนภาพแบบสัดส่วนผกผัน
กราฟดังกล่าวคือไฮเปอร์โบลา (จำพีชคณิต - กราฟฟังก์ชัน) Isotherm-hyperbola แสดงในรูป 1 .

ข้าว. 1. ไอโซเทอร์มบนไดอะแกรม
แต่ละไอโซเทอร์มสอดคล้องกับค่าอุณหภูมิคงที่ ปรากฎว่า ยิ่งอุณหภูมิสูงขึ้นเท่าใด ไอโซเทอร์มที่เกี่ยวข้องก็จะยิ่งสูงขึ้นเท่านั้น -แผนภาพ.
อันที่จริง ให้เราพิจารณากระบวนการความร้อนใต้ความร้อนสองกระบวนการที่ดำเนินการโดยก๊าซชนิดเดียวกัน (รูปที่ 2) กระบวนการแรกเกิดขึ้นที่อุณหภูมิ กระบวนการที่สองเกิดขึ้นที่อุณหภูมิ

ข้าว. 2. อุณหภูมิยิ่งสูง ไอโซเทอร์มยิ่งสูง
เราแก้ไขค่าบางอย่างของปริมาณ . ในไอโซเทอร์มแรกจะสอดคล้องกับความดัน ในวินาที - class="tex" alt="p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
ในระบบพิกัดที่เหลืออีกสองระบบ ไอโซเทอร์มดูเรียบง่ายมาก: เป็นเส้นตรงที่ตั้งฉากกับแกน ( รูปที่ 3):

ข้าว. 3. ไอโซเทอร์มบน และ -ไดอะแกรม
กระบวนการไอโซบาริก
จำอีกครั้งว่ากระบวนการ isobaric เป็นกระบวนการที่เกิดขึ้นที่ความดันคงที่ ในระหว่างกระบวนการไอโซบาริก ปริมาตรของก๊าซและอุณหภูมิเท่านั้นที่เปลี่ยนไป
ตัวอย่างทั่วไปของกระบวนการไอโซบาริก: ก๊าซอยู่ภายใต้ลูกสูบขนาดใหญ่ที่สามารถเคลื่อนที่ได้อย่างอิสระ ถ้ามวลของลูกสูบและหน้าตัดของลูกสูบ ความดันก๊าซจะคงที่และเท่ากับ
ความกดอากาศอยู่ที่ไหน
ให้ก๊าซในอุดมคติดำเนินกระบวนการไอโซบาริกที่ความดัน พิจารณาอีกครั้งสองสถานะโดยพลการของก๊าซ เวลานี้ค่าของพารามิเตอร์ระดับมหภาคจะเท่ากับ และ .
ให้เราเขียนสมการของรัฐ:
เมื่อนำมาหารกัน เราจะได้รับ:
โดยหลักการแล้วอาจเพียงพอแล้ว แต่เราจะดำเนินการต่อไปอีกเล็กน้อย ให้เราเขียนความสัมพันธ์ที่เป็นผลลัพธ์ใหม่เพื่อให้เฉพาะพารามิเตอร์ของสถานะแรกปรากฏในส่วนหนึ่ง และเฉพาะพารามิเตอร์ของสถานะที่สองเท่านั้นที่ปรากฏในอีกส่วนหนึ่ง (กล่าวคือ เรา "แยกดัชนี" ออกเป็นส่วนต่างๆ):
(4)
และจากที่นี่ - ในมุมมองของความเด็ดขาดของการเลือกรัฐ! - เราได้รับ กฎของเกย์-ลูสแซก:
(5)
กล่าวอีกนัยหนึ่ง ที่ความดันคงที่ ปริมาตรของก๊าซจะแปรผันโดยตรงกับอุณหภูมิของก๊าซนั้น:
(6)
ทำไมปริมาตรเพิ่มขึ้นตามอุณหภูมิ? เมื่ออุณหภูมิสูงขึ้น โมเลกุลจะเริ่มกระแทกแรงขึ้นและยกลูกสูบขึ้น ในเวลาเดียวกัน ความเข้มข้นของโมเลกุลจะลดลง การกระทบกันจะน้อยลง ดังนั้นในที่สุดความดันจะยังคงเท่าเดิม
แผนผังของกระบวนการไอโซบาริก
กราฟของกระบวนการไอโซบาริกเรียกว่า ไอโซบาร์. บนไดอะแกรม isobar เป็นเส้นตรง (รูปที่ 4):

ข้าว. 4. Isobar บน -แผนภาพ
ส่วนที่เป็นเส้นประของกราฟหมายความว่าในกรณีของก๊าซจริงที่อุณหภูมิต่ำเพียงพอ แบบจำลองก๊าซในอุดมคติ (และด้วยกฎของเกย์-ลูสแซก) จะหยุดทำงาน เมื่ออุณหภูมิลดลง อนุภาคของแก๊สจะเคลื่อนที่ช้าลงเรื่อยๆ และแรงของอันตรกิริยาระหว่างโมเลกุลมีอิทธิพลอย่างมากต่อการเคลื่อนที่ของพวกมัน (การเปรียบเทียบ: ลูกบอลที่ช้าจะจับได้ง่ายกว่าลูกบอลที่เร็ว) ที่อุณหภูมิต่ำมาก ก๊าซจะกลายเป็นของเหลว
ทีนี้มาดูกันว่าตำแหน่งของไอโซบาร์เปลี่ยนไปอย่างไรเมื่อความดันเปลี่ยนแปลง ปรากฎว่า ยิ่งความดันสูง isobar ก็จะยิ่งต่ำลง -แผนภาพ.
ในการตรวจสอบสิ่งนี้ ให้พิจารณาไอโซบาร์สองตัวที่มีแรงดันและ (รูปที่ 5):

ข้าว. 5. ไอโซบาร์ยิ่งต่ำ แรงดันยิ่งมากขึ้น
ให้เรากำหนดค่าบางอย่างของอุณหภูมิ เราเห็นว่า. แต่ที่อุณหภูมิคงที่ ปริมาตรยิ่งเล็ก ความดันยิ่งมากขึ้น (กฎของบอยล์ - Mariotte!)
ดังนั้น class="tex" alt="p_2 > p_1"> .!}
ในระบบพิกัดที่เหลืออีกสองระบบ isobar เป็นเส้นตรงที่ตั้งฉากกับแกน (รูปที่ 6):

ข้าว. 6. ไอโซบาร์บนและ -ไดอะแกรม
กระบวนการไอโซโคริก
เราจำได้ว่ากระบวนการ isochoric เป็นกระบวนการที่เกิดขึ้นที่ปริมาตรคงที่ ในกระบวนการไอโซโคริก ความดันของก๊าซและอุณหภูมิเท่านั้นที่เปลี่ยนไป
กระบวนการ isochoric นั้นง่ายมากที่จะจินตนาการ: เป็นกระบวนการที่เกิดขึ้นในภาชนะแข็งที่มีปริมาตรคงที่ (หรือในกระบอกสูบใต้ลูกสูบเมื่อลูกสูบถูกตรึง)
ให้ก๊าซในอุดมคติดำเนินกระบวนการไอโซโคริกในภาชนะที่มีปริมาตร อีกครั้ง ให้พิจารณาสถานะก๊าซสองสถานะโดยพลการด้วยพารามิเตอร์และ เรามี:
เราแบ่งสมการเหล่านี้เข้าด้วยกัน:
เช่นเดียวกับที่มาของกฎหมายเกย์-ลูสแซก เรา "แบ่ง" ดัชนีออกเป็นส่วนต่างๆ:
(7)
ในมุมมองของความเด็ดขาดของการเลือกรัฐ เรามาถึง กฎของชาร์ลส์:
(8)
กล่าวอีกนัยหนึ่ง ที่ปริมาตรคงที่ของก๊าซ ความดันจะแปรผันโดยตรงกับอุณหภูมิ:
(9)
การเพิ่มความดันของก๊าซที่มีปริมาตรคงที่เมื่อได้รับความร้อนเป็นสิ่งที่เห็นได้ชัดจากมุมมองทางกายภาพ คุณสามารถอธิบายได้ง่ายๆด้วยตัวคุณเอง
แผนภาพกระบวนการไอโซโคริก
กราฟของกระบวนการ isochoric เรียกว่า ไอโซชอร์. บนไดอะแกรม isochore เป็นเส้นตรง ( รูปที่ 7):

ข้าว. 7. Isochore บน -แผนภาพ
ความหมายของพื้นที่ประเหมือนกัน: ความไม่เพียงพอของแบบจำลองก๊าซในอุดมคติที่อุณหภูมิต่ำ

ข้าว. 8. ไอโซชอร์ยิ่งต่ำ ปริมาณยิ่งมาก
หลักฐานคล้ายกับก่อนหน้านี้ เราแก้ไขอุณหภูมิ และดูว่า แต่ที่อุณหภูมิคงที่ ความดันจะยิ่งน้อยลง ปริมาตรก็จะยิ่งมากขึ้น (กฎ Boyle-Mariotte อีกครั้ง) ดังนั้น class="tex" alt="V_2 > V_1"> .!}
ในระบบพิกัดที่เหลืออีกสองระบบ ไอโซชอร์เป็นเส้นตรงที่ตั้งฉากกับแกน (รูปที่ 9):

ข้าว. 9. Isochores บนและ -แผนภาพ
กฎของ Boyle - Mariotte, Gay-Lussac และ Charles เรียกอีกอย่างว่า กฎของแก๊ส.
เราได้กฎของแก๊สจากสมการ Mendeleev-Clapeyron แต่ในอดีตนั้นตรงกันข้าม: กฎของก๊าซถูกสร้างขึ้นโดยการทดลองและก่อนหน้านี้มาก สมการของรัฐปรากฏในภายหลังเป็นลักษณะทั่วไป
กระบวนการไอโซบาริก
แปลงไอโซโพรเซสในระบบพิกัดต่างๆ
กระบวนการไอโซบาริก(ภาษากรีกอื่น ๆ ισος, isos - "เหมือนกัน" + βαρος, baros - "น้ำหนัก") - กระบวนการเปลี่ยนสถานะของระบบอุณหพลศาสตร์ที่ความดันคงที่ ()
โจเซฟ หลุยส์ เกย์-ลูสแซค ศึกษาการพึ่งพาปริมาตรของก๊าซกับอุณหภูมิที่ความดันคงที่ในปี ค.ศ. 1802 กฎของเกย์-ลูสแซก: ที่ความดันคงที่และค่าคงที่ของมวลของก๊าซและมวลโมลาร์ของก๊าซ อัตราส่วนของปริมาตรของก๊าซต่ออุณหภูมิสัมบูรณ์จะคงที่: V / T = const
กระบวนการไอโซโคริก
กระบวนการไอโซโคริก(จากนักร้องกรีก - สถานที่ว่าง) - กระบวนการเปลี่ยนสถานะของระบบอุณหพลศาสตร์ที่ปริมาตรคงที่ () สำหรับก๊าซในอุดมคติ กฎของชาร์ลส์อธิบายกระบวนการไอโซโคริก: สำหรับมวลของก๊าซที่กำหนดที่ปริมาตรคงที่ ความดันจะแปรผันโดยตรงกับอุณหภูมิ:
เส้นที่แสดงกระบวนการไอโซคอริกในไดอะแกรมเรียกว่าไอโซชอร์
นอกจากนี้ยังควรชี้ให้เห็นว่าพลังงานที่จ่ายให้กับก๊าซนั้นใช้ไปกับการเปลี่ยนแปลงพลังงานภายใน นั่นคือ Q = 3* ν*R*T/2=3*V*ΔP โดยที่ R คือค่าคงที่ของก๊าซสากล ν คือจำนวนโมลในแก๊ส, T คืออุณหภูมิในหน่วยเคลวิน, V คือปริมาตรของแก๊ส, ΔP คือการเปลี่ยนแปลงความดันที่เพิ่มขึ้น และเส้นที่แสดงกระบวนการไอโซคอริกในแผนภาพในแกน P(T) ควรขยายและเชื่อมต่อกับจุดกำเนิดด้วยเส้นประ เนื่องจากอาจเกิดความเข้าใจผิดได้
กระบวนการไอโซเทอร์มอล
กระบวนการไอโซเทอร์มอล(จากภาษากรีก "กระติกน้ำร้อน" - อุ่นร้อน) - กระบวนการเปลี่ยนสถานะของระบบอุณหพลศาสตร์ที่อุณหภูมิคงที่ () () กระบวนการไอโซเทอร์มอลอธิบายไว้ในกฎของ Boyle - Mariotte:
ที่อุณหภูมิคงที่และค่าคงที่ของมวลก๊าซและมวลโมลาร์ ผลคูณของปริมาตรก๊าซและความดันจะคงที่: PV = const
กระบวนการไอเซนโทรปิก
กระบวนการไอเซนโทรปิก- กระบวนการเปลี่ยนสถานะของระบบอุณหพลศาสตร์ที่เอนโทรปีคงที่ () ตัวอย่างเช่น กระบวนการอะเดียแบติกที่ผันกลับได้คือไอเซนโทรปิก: ในกระบวนการดังกล่าวไม่มีการแลกเปลี่ยนความร้อนกับสิ่งแวดล้อม ก๊าซอุดมคติในกระบวนการดังกล่าวอธิบายโดยสมการต่อไปนี้:
เลขชี้กำลังอะเดียแบติกอยู่ที่ไหน กำหนดโดยประเภทของก๊าซ
มูลนิธิวิกิมีเดีย 2553 .
ดูว่า "กระบวนการไอโซโพรเซส" คืออะไรในพจนานุกรมอื่นๆ:
กระบวนการไอโซโพรเซสเป็นกระบวนการทางอุณหพลศาสตร์ที่มวลและปริมาณทางกายภาพของพารามิเตอร์สถานะ: ความดัน ปริมาตร หรืออุณหภูมิยังคงไม่เปลี่ยนแปลง ดังนั้น กระบวนการไอโซบาริกจึงสอดคล้องกับความดันคงที่ ปริมาตรไอโซโคริก ... Wikipedia
ทฤษฎีจลนพลศาสตร์ของโมเลกุล (เรียกโดยย่อว่า MKT) เป็นทฤษฎีที่พิจารณาโครงสร้างของสสารจากมุมมองขององค์ประกอบหลักสามประการที่ถูกต้องโดยประมาณ: ร่างกายทั้งหมดประกอบด้วยอนุภาคซึ่งมีขนาดที่ละเลยได้: อะตอม โมเลกุล และไอออน; อนุภาค ... ... วิกิพีเดีย
- (เรียกโดยย่อว่า MKT) ทฤษฎีที่พิจารณาโครงสร้างของสสารจากมุมมองของบทบัญญัติหลักสามประการที่ถูกต้องโดยประมาณ: ร่างกายทั้งหมดประกอบด้วยอนุภาคที่มีขนาดที่สามารถละเลยได้: อะตอม โมเลกุล และไอออน; อนุภาคต่อเนื่องกัน ... ... Wikipedia
หนังสือ
- การทำนายทางสถิติของลักษณะความแข็งแรงของการเสียรูปของวัสดุโครงสร้าง , G. Pluvinazh , VT Sapunov , หนังสือเล่มนี้นำเสนอวิธีการใหม่ที่เสนอวิธีการทั่วไปในการทำนายลักษณะของกระบวนการจลน์ศาสตร์ทั่วไปสำหรับวัสดุโลหะและพอลิเมอร์ วิธี… หมวดหมู่:ตำราเรียนสำหรับมหาวิทยาลัยสำนักพิมพ์: