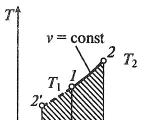
इज़ोटेर्मल प्रक्रियाओं की तालिका। आदर्श गैसों के नियम
ऊष्मागतिकी में मुख्य प्रक्रियाएँ हैं:
- समद्विबाहु, स्थिर मात्रा में बह रहा है;
- समदाब रेखीयनिरंतर दबाव पर बहना;
- इज़ोटेर्माल, स्थिर तापमान पर घटित होना;
- स्थिरोष्म, जिस पर पर्यावरण के साथ कोई ताप विनिमय नहीं होता है;
- बहुउष्णकटिबंधीय, समीकरण को संतुष्ट करना पी.वी.एन= स्थिरांक.
आइसोकोरिक, आइसोबैरिक, इज़ोटेर्मल और एडियाबेटिक प्रक्रियाएं पॉलीट्रोपिक प्रक्रिया के विशेष मामले हैं।
थर्मोडायनामिक प्रक्रियाओं के अध्ययन में निर्धारित करें:
- प्रक्रिया समीकरण में पी— वी और टी— एसनिर्देशांक;
- गैस अवस्था मापदंडों के बीच संबंध;
- आंतरिक ऊर्जा में परिवर्तन;
- बाहरी कार्य की मात्रा;
- प्रक्रिया में आपूर्ति की गई ऊष्मा की मात्रा या निकाली गई ऊष्मा की मात्रा।
आइसोकोरिक प्रक्रिया


आइसोकोरिक प्रक्रिया मेंपी, वी— , टी, एस- औरमैं, एस-निर्देशांक (आरेख)
एक समद्विबाहु प्रक्रिया में, स्थिति वी= स्थिरांक.
अवस्था के आदर्श गैस समीकरण से ( पीवी = आर टी) इस प्रकार है:
पी/टी = आर/वी= स्थिरांक,
यानी, गैस का दबाव सीधे उसके पूर्ण तापमान के समानुपाती होता है:
पी2/पी1 = टी2/टी1.
समद्विबाहु प्रक्रिया में विस्तार कार्य शून्य होता है ( एल= 0), चूँकि कार्यशील द्रव का आयतन नहीं बदलता (Δ वी= स्थिरांक).
प्रक्रिया 1-2 में कार्यशील द्रव को आपूर्ति की गई ऊष्मा की मात्रा सीवी
क्यू= सीवी(टी 2 — टी 1 ).
टी. से. एल= 0, तो थर्मोडायनामिक्स के पहले नियम के आधार पर Δ यू = क्यू, जिसका अर्थ है कि आंतरिक ऊर्जा में परिवर्तन सूत्र द्वारा निर्धारित किया जा सकता है:
Δ यू = सी वी (टी 2 - टी 1).
आइसोकोरिक प्रक्रिया में एन्ट्रापी में परिवर्तन सूत्र द्वारा निर्धारित किया जाता है:
s2-s1= Δ एस = सीवीएलएन( पी2/पी1) = सीवीएलएन( टी2/टी1).
समदाब रेखीय प्रक्रिया



आइसोबैरिक प्रक्रिया मेंपी, वी— , टी, एस- औरमैं, एस-निर्देशांक (आरेख)
एक समदाब रेखीय प्रक्रिया वह प्रक्रिया है जो निरंतर दबाव पर होती है। पी= स्थिरांक. एक आदर्श गैस की अवस्था के समीकरण से यह निम्नानुसार है:
वी/टी = आर/पी= स्थिरांक
v2/v1 = टी 2 /टी 1 ,
यानी, एक आइसोबैरिक प्रक्रिया में, गैस का आयतन उसके निरपेक्ष तापमान के समानुपाती होता है।
कार्य होगा:
एल = पी(वी 2 – वी 1 ).
टी. से. पीवी 1 = आर टी 1 और पीवी 2 = आर टी 2 , वह
एल = आर(टी 2-T1).
ऊष्मा की मात्रा सीपी= स्थिरांक सूत्र द्वारा निर्धारित किया जाता है:
क्यू = सीपी(टी 2-T1).
एन्ट्रापी में परिवर्तन होगा:
s2-s1= Δ एस = सीपीएलएन( टी2/टी1).
इज़ोटेर्मल प्रक्रिया



इज़ोटेर्माल प्रक्रिया मेंपी, वी— , टी, एस- औरमैं, एस-निर्देशांक (आरेख)
इज़ोटेर्माल प्रक्रिया में, कार्यशील द्रव का तापमान स्थिर रहता है टी= स्थिरांक, तो:
पीवी = आर टी= स्थिरांक
पी2/पी1 = v1/v2,
यानी, दबाव और आयतन एक दूसरे के व्युत्क्रमानुपाती होते हैं, जिससे इज़ोटेर्मल संपीड़न के दौरान गैस का दबाव बढ़ता है, और विस्तार के दौरान यह घट जाता है।
प्रक्रिया का कार्य इसके बराबर होगा:
एल = आर टीएलएन( v2 – v1) = आर टीएलएन( पी1 – पी2).
चूँकि तापमान अपरिवर्तित रहता है, एक इज़ोटेर्मल प्रक्रिया में एक आदर्श गैस की आंतरिक ऊर्जा स्थिर रहती है (Δ यू= 0) और कार्यशील द्रव को आपूर्ति की गई सारी ऊष्मा पूरी तरह से विस्तार के कार्य में परिवर्तित हो जाती है:
क्यू = एल.
इज़ोटेर्मल संपीड़न के दौरान, संपीड़न पर खर्च किए गए कार्य के बराबर मात्रा में कार्यशील तरल पदार्थ से गर्मी हटा दी जाती है।
एन्ट्रापी में परिवर्तन है:
s2-s1= Δ एस = आरएलएन( पी1/पी2) = आरएलएन( v2/v1).
रुद्धोष्म प्रक्रिया



रुद्धोष्म प्रक्रिया मेंपी, वी— , टी, एस- औरमैं, एस-निर्देशांक (आरेख)
रुद्धोष्म प्रक्रिया गैस की अवस्था में परिवर्तन है जो पर्यावरण के साथ ताप विनिमय के बिना होता है। चूंकि डी क्यू= 0, तो रुद्धोष्म प्रक्रिया के लिए ऊष्मागतिकी के प्रथम नियम का समीकरण इस प्रकार होगा:
डी यू + पीडी वी = 0
Δ यू+ एल = 0,
इस तरह
Δ यू= —एल.
रुद्धोष्म प्रक्रिया में विस्तार का कार्य गैस की आंतरिक ऊर्जा के व्यय के कारण ही होता है और संपीड़न के दौरान, जो बाह्य बलों की क्रिया के कारण होता है, उनके द्वारा किया गया सारा कार्य आंतरिक ऊर्जा को बढ़ाने में चला जाता है गैस का.
आइए हम रुद्धोष्म प्रक्रिया में ताप क्षमता को निरूपित करें सीनरक, और हालत डी क्यू= 0 को इस प्रकार व्यक्त किया गया है:
डी क्यू = सीनरक डी टी = 0.
यह स्थिति कहती है कि रुद्धोष्म प्रक्रिया में ताप क्षमता शून्य है ( सीनरक = 0).
ह ज्ञात है कि
साथपी/सीवी= क
और एडियाबेटिक प्रक्रिया वक्र (एडियाबेटिक) का समीकरण पी, वी-आरेख इस प्रकार दिखता है:
पी.वी.के= स्थिरांक.
इस अभिव्यक्ति में ककहा जाता है रुद्धोष्म प्रतिपादक(जिसे पॉइसन अनुपात भी कहा जाता है)।
रुद्धोष्म घातांक का मानककुछ गैसों के लिए:
कवायु = 1.4
कअत्यधिक गरम भाप = 1.3
कआईसीई निकास = 1.33
कसंतृप्त गीली भाप = 1.135
पिछले सूत्रों से इस प्रकार है:
एल= — Δ यू = सीवी(टी 1 – टी 2 );
मैं 1 – मैं 2 = सीपी(टी 1 – टी 2 ).
रुद्धोष्म प्रक्रिया का तकनीकी कार्य ( एल tech) प्रक्रिया की शुरुआत और अंत की एन्थैल्पी के बीच के अंतर के बराबर है ( मैं 1 – मैं 2 ).
रुद्धोष्म प्रक्रिया जो कार्यशील द्रव में आंतरिक घर्षण के बिना होती है, कहलाती है आइसेंट्रोपिक. में टी, एसआरेख में, इसे एक ऊर्ध्वाधर रेखा द्वारा दर्शाया गया है।
आमतौर पर, वास्तविक रुद्धोष्म प्रक्रियाएं कार्यशील द्रव में आंतरिक घर्षण की उपस्थिति में आगे बढ़ती हैं, जिसके परिणामस्वरूप हमेशा गर्मी निकलती है, जो कार्यशील द्रव को ही प्रदान की जाती है। इस मामले में डी एस> 0 और प्रक्रिया कहलाती है वास्तविक रुद्धोष्म प्रक्रिया.
बहुउष्णकटिबंधीय प्रक्रिया
एक प्रक्रिया को पॉलीट्रोपिक कहा जाता है, जिसे समीकरण द्वारा वर्णित किया गया है:
पी.वी.एन= स्थिरांक.
पॉलीट्रोपिक सूचकांक एन-∞ से +∞ तक कोई भी मान ले सकता है, लेकिन इस प्रक्रिया के लिए यह एक स्थिर मान है।
पॉलीट्रोपिक प्रक्रिया समीकरण और क्लेपेरॉन समीकरण से, कोई एक अभिव्यक्ति प्राप्त कर सकता है जो बीच संबंध स्थापित करता है पी, वीऔर टीपॉलीट्रोप पर किन्हीं दो बिंदुओं पर:
पी2/पी1 = (v1/v2)एन; टी2/टी1 = (v1/v2) एन-1 ; टी2/टी1 = (पी2/पी1) (एन-1)/एन।
बहुउद्देशीय प्रक्रिया में गैस विस्तार का कार्य है:

आदर्श गैस के मामले में, इस सूत्र को रूपांतरित किया जा सकता है:

प्रक्रिया में आपूर्ति की गई या निकाली गई गर्मी की मात्रा थर्मोडायनामिक्स के पहले नियम का उपयोग करके निर्धारित की जाती है:
क्यू = (तुम 2 – तुम 1) + एल.
क्योंकि

एक बहुउद्देशीय प्रक्रिया में एक आदर्श गैस की ताप क्षमता है।
पर सीवी, कऔर एन= स्थिरांक सी एन= स्थिरांक, इसलिए एक पॉलीट्रोपिक प्रक्रिया को कभी-कभी निरंतर ताप क्षमता वाली प्रक्रिया के रूप में परिभाषित किया जाता है।
पॉलीट्रोपिक प्रक्रिया का एक सामान्यीकरण अर्थ है, क्योंकि इसमें बुनियादी थर्मोडायनामिक प्रक्रियाओं के पूरे सेट को शामिल किया गया है।
में एक पॉलीट्रोप का चित्रमय प्रतिनिधित्व पी, वीपॉलीट्रोप इंडेक्स के आधार पर निर्देशांक एन.

प0 0= स्थिरांक ( एन= 0) समदाब रेखा है;
पीवी= स्थिरांक ( एन= 1) इज़ोटेर्म है;
प0 वि= स्थिरांक, पी 1/∞वी= स्थिरांक, pv∞= स्थिरांक - आइसोकोर;
पी.वी.के= स्थिरांक ( एन = क) एक रुद्धोष्म है।
एन > 0 - अतिशयोक्तिपूर्ण वक्र,
एन < 0 परवलय हैं.
थर्मोडायनामिक्स पर मेरे व्याख्यान नोट्स और पाठ्यपुस्तक "ऊर्जा के बुनियादी सिद्धांत" की सामग्री के आधार पर। लेखक जी. एफ. बिस्ट्रिट्स्की। दूसरा संस्करण, रेव. और अतिरिक्त - एम.: नोरस, 2011. - 352 पी।
समदाब रेखीय प्रक्रिया क्या है
परिभाषा
एक आइसोबैरिक (या आइसोबैरिक) प्रक्रिया एक ऐसी प्रक्रिया है जो स्थिर दबाव पर गैस के निरंतर द्रव्यमान में होती है।
आइए एक आदर्श गैस की दो अवस्थाओं के लिए समीकरण लिखें:
\ \
हम समीकरण (2) को समीकरण (1) से विभाजित करते हैं, हमें समदाब रेखीय प्रक्रिया का समीकरण प्राप्त होता है:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \left(4\right).\]
समीकरण (4) को गे-लुसाक नियम कहा जाता है।
आंतरिक ऊर्जा और आइसोबैरिक प्रक्रिया की ऊष्मा की मात्रा
यदि वॉल्यूम बढ़ रहा है या वॉल्यूम कम करने के लिए हीट हटाने से यह प्रक्रिया होती है। आइए थर्मोडायनामिक्स के पहले नियम को लिखें, हम क्रमिक रूप से कार्य, आंतरिक ऊर्जा और आइसोबैरिक प्रक्रिया की गर्मी की मात्रा के लिए अभिव्यक्ति प्राप्त करेंगे:
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \left(5\right).\] \[\triकोण Q=\int\limits^(T_2)_ (T_1)(dU)+\int\limits^(V_2)_(V_1)(dA)(6)\]
जहां $\delta Q\ $ सिस्टम को आपूर्ति की जाने वाली प्रारंभिक गर्मी है, $dU$ चालू प्रक्रिया में गैस की आंतरिक ऊर्जा में परिवर्तन है, $dA$ प्रक्रिया में गैस द्वारा किया गया प्राथमिक कार्य है, i गैस अणु की स्वतंत्रता की डिग्री की संख्या है, आर सार्वभौमिक गैस स्थिरांक है, डी गैस के मोल की संख्या है।
गैस की आंतरिक ऊर्जा में परिवर्तन:
\[\triangle U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
समीकरण (8) एक आइसोबैरिक प्रक्रिया के लिए कार्य को परिभाषित करता है। हम समीकरण (1) को (2) से घटाते हैं, हमें आइसोबैरिक प्रक्रिया में गैस के कार्य के लिए एक और समीकरण प्राप्त होता है:
\ \[\triangle Q=\frac(i)(2)нR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \triangle T\ ( 10),\]
जहां $c_(\mu p)$ एक आइसोबैरिक प्रक्रिया में गैस की दाढ़ ताप क्षमता है। समीकरण (10) $\त्रिभुज T द्वारा तापमान में वृद्धि के साथ एक आइसोबैरिक प्रक्रिया में द्रव्यमान m की गैस को दी गई गर्मी की मात्रा निर्धारित करता है।
आइसोप्रोसेस को अक्सर थर्मोडायनामिक आरेखों में दर्शाया जाता है। तो, ऐसे आरेख पर एक समदाब रेखीय प्रक्रिया को दर्शाने वाली रेखा को समदाब रेखा (चित्र 1) कहा जाता है।
उदाहरण 1
कार्य: निर्धारित करें कि चित्र 1c में V(T) आरेख पर दबाव $p_1$ और $p_2$ कैसे संबंधित हैं।
समताप रेखा $T_1$ खींचिए

बिंदु A और B पर तापमान समान है, इसलिए, गैस बॉयल-मैरियट नियम का पालन करती है:
\ \
आइए इन संस्करणों को SI में बदलें: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
आइए गणना करें:
उत्तर: समदाब रेखीय प्रक्रिया में गैस का कार्य 600 J होता है।
उदाहरण 3
कार्य: एबीसी प्रक्रिया में गैस कार्य और सीडीए प्रक्रिया में गैस कार्य की तुलना करें चित्र 3।

समाधान के आधार के रूप में, हम वह सूत्र लेते हैं जो गैस का कार्य निर्धारित करता है:
निश्चित अभिन्न के ज्यामितीय अर्थ से यह ज्ञात होता है कि कार्य आकृति का क्षेत्र है, जो बिंदु $V_1\ और\ V_2$ पर समाकलन, भुज अक्ष और आइसोकोर्स के कार्य द्वारा सीमित है। (अक्ष p(V)). हम प्रक्रिया ग्राफ़ को p(V) अक्षों में अनुवादित करते हैं।
चित्र (3) में दर्शाई गई प्रक्रियाओं के ग्राफ़ के प्रत्येक खंड पर विचार करें।
एबी: आइसोकोरिक प्रक्रिया (पी=कॉन्स्ट), $V\अपरो \बाएं(\ वॉल्यूम\ बढ़ता है\दाएं),\ टी\अपरो $;
वीएस: आइसोकोरिक प्रक्रिया (V =const), $T\uparrow $ (ग्राफ़ से), p$\uparrow $, आइसोकोरिक प्रक्रिया के नियम से ($\frac(p)(T)=const$);
सीडी: (पी=कॉन्स्ट), $वी\डाउनएरो ,\ टी\डाउनएरो ;$
डीए: (वी = स्थिरांक), $टी\डाउनएरो ,\ पी\डाउनएरो .$
आइए पी(वी) अक्षों में प्रक्रियाओं के ग्राफ़ को चित्रित करें (चित्र 4):

गैस कार्य $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- आयत ABFE का क्षेत्रफल) (चित्र 3)। गैस पर कार्य $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -आयत का क्षेत्रफल\ $EFCD.जाहिर तौर पर $A_(CDA)>A_(ABC).$
, थर्मोडायनामिक प्रक्रिया एक प्रणाली की स्थिति में परिवर्तन है, जिसके परिणामस्वरूप इसका कम से कम एक पैरामीटर (तापमान, आयतन या दबाव) इसका मान बदल देता है। हालाँकि, अगर हम इस बात को ध्यान में रखते हैं कि थर्मोडायनामिक प्रणाली के सभी पैरामीटर अविभाज्य रूप से जुड़े हुए हैं, तो उनमें से किसी में भी परिवर्तन अनिवार्य रूप से कम से कम एक (आदर्श रूप से) या कई (वास्तव में) मापदंडों में बदलाव की आवश्यकता होती है। सामान्य स्थिति में, हम कह सकते हैं कि थर्मोडायनामिक प्रक्रिया सिस्टम के संतुलन के उल्लंघन से जुड़ी है, और यदि सिस्टम संतुलन की स्थिति में है, तो इसमें कोई थर्मोडायनामिक प्रक्रिया नहीं हो सकती है।
एक प्रणाली की संतुलन स्थिति एक अमूर्त अवधारणा है, क्योंकि आसपास की दुनिया से किसी भी सामग्री को अलग करना असंभव है, इसलिए किसी भी वास्तविक प्रणाली में विभिन्न थर्मोडायनामिक प्रक्रियाएं अनिवार्य रूप से होती हैं। साथ ही, कुछ प्रणालियों में इतने धीमे, लगभग अगोचर परिवर्तन हो सकते हैं कि उनसे जुड़ी प्रक्रियाओं को सशर्त रूप से सिस्टम की संतुलन स्थितियों के अनुक्रम से युक्त माना जा सकता है। ऐसी प्रक्रियाओं को संतुलन या कहा जाता है अर्ध स्टेटिक.
सिस्टम में क्रमिक परिवर्तनों का एक और संभावित परिदृश्य, जिसके बाद यह अपनी मूल स्थिति में लौट आता है, कहलाता है वृत्ताकार प्रक्रियाया एक चक्र. संतुलन और वृत्ताकार प्रक्रियाओं की अवधारणाएँ थर्मोडायनामिक्स के कई सैद्धांतिक निष्कर्षों और व्यावहारिक तरीकों का आधार हैं।
थर्मोडायनामिक प्रक्रिया के अध्ययन में इस प्रक्रिया में किए गए कार्य, आंतरिक ऊर्जा में परिवर्तन, गर्मी की मात्रा और गैस की स्थिति को दर्शाने वाली व्यक्तिगत मात्राओं के बीच संबंध स्थापित करना शामिल है।
सभी संभावित थर्मोडायनामिक प्रक्रियाओं में से, आइसोकोरिक, आइसोबैरिक, इज़ोटेर्मल, एडियाबेटिक और पॉलीट्रोपिक प्रक्रियाएं सबसे अधिक रुचि रखती हैं।
आइसोकोरिक प्रक्रिया
एक आइसोकोरिक प्रक्रिया एक थर्मोडायनामिक प्रक्रिया है जो स्थिर मात्रा में होती है। ऐसी प्रक्रिया किसी बंद बर्तन में रखी गैस को गर्म करके की जा सकती है। ऊष्मा की आपूर्ति के परिणामस्वरूप गैस गर्म हो जाती है और इसका दबाव बढ़ जाता है।
आइसोकोरिक प्रक्रिया में गैस मापदंडों में परिवर्तन चार्ल्स के नियम का वर्णन करता है: पी 1 /टी 1 = पी 2 /टी 2, या सामान्य मामले में:
पी/टी = स्थिरांक।
किसी बर्तन की दीवारों पर गैस का दबाव सीधे गैस के पूर्ण तापमान के समानुपाती होता है।
चूँकि एक आइसोकोरिक प्रक्रिया में आयतन dV में परिवर्तन शून्य के बराबर होता है, हम यह निष्कर्ष निकाल सकते हैं कि गैस को आपूर्ति की गई सारी ऊष्मा गैस की आंतरिक ऊर्जा को बदलने में खर्च होती है (कोई काम नहीं हुआ).
समदाब रेखीय प्रक्रिया
आइसोबैरिक प्रक्रिया एक थर्मोडायनामिक प्रक्रिया है जो निरंतर दबाव पर होती है। ऐसी प्रक्रिया को एक गतिशील पिस्टन के साथ घने सिलेंडर में गैस रखकर किया जा सकता है, जिस पर गर्मी को हटाने और आपूर्ति के दौरान एक निरंतर बाहरी बल द्वारा कार्य किया जाता है।
जब गैस का तापमान बदलता है, तो पिस्टन एक दिशा या दूसरी दिशा में चलता है; जबकि गैस की मात्रा गे-लुसाक के नियम के अनुसार बदलती है:
वी/टी = स्थिरांक।
इसका मतलब यह है कि एक समदाब रेखीय प्रक्रिया में गैस द्वारा ग्रहण किया गया आयतन सीधे तापमान के समानुपाती होता है।
यह निष्कर्ष निकाला जा सकता है कि इस प्रक्रिया में तापमान में बदलाव से अनिवार्य रूप से गैस की आंतरिक ऊर्जा में बदलाव आएगा, और मात्रा में बदलाव काम के प्रदर्शन से जुड़ा हुआ है, यानी, एक आइसोबैरिक प्रक्रिया में, थर्मल का हिस्सा ऊर्जा गैस की आंतरिक ऊर्जा को बदलने पर खर्च की जाती है, और दूसरा हिस्सा बाहरी ताकतों की कार्रवाई पर काबू पाने के लिए गैस कार्य के प्रदर्शन पर खर्च किया जाता है। इस मामले में, आंतरिक ऊर्जा बढ़ाने और कार्य करने के लिए ताप लागत के बीच का अनुपात गैस की ताप क्षमता पर निर्भर करता है।
इज़ोटेर्मल प्रक्रिया
इज़ोटेर्माल प्रक्रिया एक थर्मोडायनामिक प्रक्रिया है जो स्थिर तापमान पर होती है।
व्यवहार में गैस के साथ इज़ोटेर्माल प्रक्रिया को अंजाम देना बहुत कठिन है। आखिरकार, इस शर्त का पालन करना आवश्यक है कि संपीड़न या विस्तार की प्रक्रिया में, गैस के पास पर्यावरण के साथ तापमान का आदान-प्रदान करने का समय हो, जिससे उसका अपना तापमान स्थिर बना रहे।
इज़ोटेर्मल प्रक्रिया को बॉयल-मैरियट कानून द्वारा वर्णित किया गया है: पीवी \u003d स्थिरांक, यानी एक स्थिर तापमान पर, गैस का दबाव इसकी मात्रा के व्युत्क्रमानुपाती होता है।
जाहिर है, इज़ोटेर्मल प्रक्रिया में, गैस की आंतरिक ऊर्जा नहीं बदलती है, क्योंकि इसका तापमान स्थिर रहता है।
गैस के तापमान की स्थिरता की स्थिति को पूरा करने के लिए, इसमें से गर्मी को निकालना आवश्यक है, जो संपीड़न पर खर्च किए गए कार्य के बराबर है:
डीक्यू = डीए = पीडीवी।
गैस की अवस्था के समीकरण का उपयोग करते हुए, कई परिवर्तन और प्रतिस्थापन करने के बाद, हम यह निष्कर्ष निकाल सकते हैं कि इज़ोटेर्माल प्रक्रिया में गैस का कार्य अभिव्यक्ति द्वारा निर्धारित होता है:
ए = आरटी एलएन(पी 1 /पी 2).
रुद्धोष्म प्रक्रिया
रुद्धोष्म प्रक्रिया एक थर्मोडायनामिक प्रक्रिया है जो कार्यशील तरल पदार्थ और पर्यावरण के बीच ताप विनिमय के बिना आगे बढ़ती है। एक इज़ोटेर्मल प्रक्रिया की तरह, रुद्धोष्म प्रक्रिया को व्यवहार में लागू करना बहुत कठिन है। ऐसी प्रक्रिया एक बर्तन में रखे गए कामकाजी माध्यम के साथ आगे बढ़ सकती है, उदाहरण के लिए, पिस्टन वाला एक सिलेंडर, जो उच्च गुणवत्ता वाली गर्मी-इन्सुलेट सामग्री से घिरा हुआ है।
लेकिन इससे कोई फर्क नहीं पड़ता कि इस मामले में हम किस उच्च-गुणवत्ता वाले ताप इन्सुलेटर का उपयोग करते हैं, कुछ, भले ही नगण्य, गर्मी की मात्रा अनिवार्य रूप से काम कर रहे तरल पदार्थ और पर्यावरण के बीच आदान-प्रदान की जाएगी।
इसलिए, व्यवहार में, रुद्धोष्म प्रक्रिया का केवल एक अनुमानित मॉडल बनाना संभव है। फिर भी, हीट इंजीनियरिंग में की जाने वाली कई थर्मोडायनामिक प्रक्रियाएं इतनी तेजी से आगे बढ़ती हैं कि काम करने वाले तरल पदार्थ और माध्यम के पास गर्मी का आदान-प्रदान करने का समय नहीं होता है, इसलिए, कुछ हद तक त्रुटि के साथ, ऐसी प्रक्रियाओं को रुद्धोष्म माना जा सकता है।
दबाव और आयतन से संबंधित एक समीकरण प्राप्त करना 1 किलोग्रामरुद्धोष्म प्रक्रिया में गैस, हम ऊष्मागतिकी के पहले नियम का समीकरण लिखते हैं:
डीक्यू = डु + पीडीवी।
चूँकि रुद्धोष्म प्रक्रिया के लिए ऊष्मा स्थानांतरण dq शून्य के बराबर है, और आंतरिक ऊर्जा में परिवर्तन तापमान की तापीय चालकता का एक कार्य है: du = c v dT, तो हम लिख सकते हैं:
सी वी डीटी + पीडीवी = 0 (3) .
क्लैपेरॉन समीकरण pv = RT को विभेदित करने पर, हम पाते हैं:
पीडीवी + वीडीपी = आरडीटी।
आइए हम यहां से dT को व्यक्त करें और इसे समीकरण (3) में प्रतिस्थापित करें। पुनर्व्यवस्था और परिवर्तन के बाद, हमें मिलता है:
पीडीवीसी वी /(आर + 1) + सी वी वीडीपी/आर = 0.
मेयर समीकरण आर = सी पी - सी वी को ध्यान में रखते हुए, अंतिम अभिव्यक्ति को इस प्रकार फिर से लिखा जा सकता है:
पीडीवी(सी वी + सी पी - सी वी)/(सी पी - सी वी) + सी वी वीडीपी/(सी पी - सी वी) = 0,
सी पी पीडीवी + सी वी वीडीपी = 0 (4) .
परिणामी अभिव्यक्ति को c v से विभाजित करना और समीकरण को एकीकृत करने के बाद अनुपात c p / c v को अक्षर k से निरूपित करना (4) हमें (पर) मिलता है के = स्थिरांक):
एलएन वीके + एलएन पी = कॉन्स्ट या एलएन पीवीके = कॉन्स्ट या पीवीके = कॉन्स्ट।
परिणामी समीकरण रुद्धोष्म प्रक्रिया का समीकरण है, जिसमें k रुद्धोष्म घातांक है।
यदि हम मानते हैं कि वॉल्यूमेट्रिक ताप क्षमता c v एक स्थिर मान है, अर्थात c v \u003d const, तो रुद्धोष्म प्रक्रिया के कार्य को सूत्र के रूप में दर्शाया जा सकता है (आउटपुट के बिना दिया गया):
एल = सी वी (टी 1 - टी 2) या एल = (पी 1 वी 1 - पी 2 वी 2) / (के-1).
बहुउष्णकटिबंधीय प्रक्रिया
ऊपर मानी गई थर्मोडायनामिक प्रक्रियाओं के विपरीत, जब कोई भी गैस पैरामीटर अपरिवर्तित रहता है, तो पॉलीट्रोपिक प्रक्रिया को किसी भी मुख्य गैस पैरामीटर को बदलने की संभावना की विशेषता होती है। उपरोक्त सभी थर्मोडायनामिक प्रक्रियाएं पॉलीट्रोपिक प्रक्रियाओं के विशेष मामले हैं।
पॉलीट्रोपिक प्रक्रिया के सामान्य समीकरण का रूप pv n = const है, जहां n पॉलीट्रोपिक इंडेक्स है - इस प्रक्रिया के लिए एक स्थिर मान, जो - ∞ से + ∞ तक मान ले सकता है।
यह स्पष्ट है कि पॉलीट्रोपिक इंडेक्स को कुछ मान देकर, एक या दूसरी थर्मोडायनामिक प्रक्रिया प्राप्त की जा सकती है - आइसोकोरिक, आइसोबैरिक, इज़ोटेर्मल या एडियाबेटिक।
इसलिए, यदि हम n = 0 लेते हैं, तो हमें p = const - एक आइसोबैरिक प्रक्रिया मिलती है, यदि हम n = 1 लेते हैं, तो हमें निर्भरता pv = const द्वारा वर्णित एक आइसोथर्मल प्रक्रिया मिलती है; n = k के लिए प्रक्रिया रुद्धोष्म है, और n के लिए - ∞ या + ∞ के बराबर है। हमें एक समद्विबाहु प्रक्रिया प्राप्त होती है।
यूएसई कोडिफायर के विषय: आइसोप्रोसेस - इज़ोटेर्मल, आइसोकोरिक, आइसोबैरिक प्रक्रियाएं।
इस पूरे पत्रक में, हम निम्नलिखित धारणा का पालन करेंगे: गैस का द्रव्यमान और रासायनिक संरचना अपरिवर्तित रहती है. दूसरे शब्दों में, हम मानते हैं कि:
अर्थात्, पात्र से कोई गैस रिसाव नहीं है या, इसके विपरीत, पात्र में गैस का प्रवाह नहीं है;
अर्थात्, गैस के कणों में कोई परिवर्तन नहीं होता है (कहते हैं, कोई पृथक्करण नहीं होता है - अणुओं का परमाणुओं में क्षय)।
ये दो शर्तें बहुत सी शारीरिक रूप से दिलचस्प स्थितियों में संतुष्ट होती हैं (उदाहरण के लिए, ताप इंजन के सरल मॉडल में) और इसलिए एक अलग विचार के लायक हैं।
यदि गैस का द्रव्यमान और उसका दाढ़ द्रव्यमान निश्चित हो, तो गैस की अवस्था निर्धारित होती है तीनस्थूल पैरामीटर: दबाव, आयतनऔर तापमान. ये पैरामीटर राज्य के समीकरण (मेंडेलीव-क्लैपेरॉन समीकरण) द्वारा एक दूसरे से संबंधित हैं।
थर्मोडायनामिक प्रक्रिया(या केवल प्रक्रिया) समय के साथ गैस की अवस्था में परिवर्तन है। थर्मोडायनामिक प्रक्रिया के दौरान, मैक्रोस्कोपिक मापदंडों - दबाव, आयतन और तापमान - के मान बदल जाते हैं।
विशेष रुचि के हैं आइसोप्रोसेस- थर्मोडायनामिक प्रक्रियाएं जिनमें मैक्रोस्कोपिक मापदंडों में से एक का मान अपरिवर्तित रहता है। तीनों मापदंडों में से प्रत्येक को बारी-बारी से ठीक करने पर, हमें तीन प्रकार की आइसोप्रोसेस मिलती हैं।
1. इज़ोटेर्माल प्रक्रियास्थिर गैस तापमान पर जाता है: .
2. समदाब रेखीय प्रक्रियास्थिर गैस दबाव पर चलता है: .
3. आइसोकोरिक प्रक्रियागैस की एक स्थिर मात्रा पर चला जाता है: .
आइसोप्रोसेस का वर्णन बॉयल - मैरियट, गे-लुसाक और चार्ल्स के बहुत ही सरल नियमों द्वारा किया जाता है। आइए उनका अध्ययन करने के लिए आगे बढ़ें।
इज़ोटेर्मल प्रक्रिया
मान लीजिए कि एक आदर्श गैस एक तापमान पर इज़ोटेर्माल प्रक्रिया करती है। प्रक्रिया के दौरान, केवल गैस का दबाव और उसका आयतन बदलता है।
गैस की दो मनमानी अवस्थाओं पर विचार करें: उनमें से एक में, मैक्रोस्कोपिक मापदंडों के मान हैं, और दूसरे में, वे हैं। ये मान मेंडेलीव-क्लैपेरॉन समीकरण से संबंधित हैं:
जैसा कि हमने शुरू से कहा, द्रव्यमान और दाढ़ द्रव्यमान को स्थिर माना जाता है।
इसलिए, लिखित समीकरण के सही भाग बराबर हैं। इसलिए, बाएँ हाथ की भुजाएँ भी बराबर हैं:
(1)
चूँकि गैस की दो अवस्थाएँ मनमाने ढंग से चुनी गईं, इसलिए हम यह निष्कर्ष निकाल सकते हैं इज़ोटेर्मल प्रक्रिया के दौरान, गैस के दबाव और आयतन का उत्पाद स्थिर रहता है:
(2)
इस कथन को कहा जाता है बॉयल का नियम - मैरियट.
फॉर्म में बॉयल-मैरियट कानून लिखकर
(3)
इसे इस प्रकार भी तैयार किया जा सकता है: इज़ोटेर्माल प्रक्रिया में, गैस का दबाव उसके आयतन के व्युत्क्रमानुपाती होता है।. यदि, उदाहरण के लिए, किसी गैस के इज़ोटेर्मल विस्तार के दौरान, इसकी मात्रा तीन गुना बढ़ जाती है, तो गैस का दबाव तीन गुना कम हो जाता है।
भौतिक दृष्टिकोण से दबाव और आयतन के बीच व्युत्क्रम संबंध की व्याख्या कैसे करें? स्थिर तापमान पर, गैस अणुओं की औसत गतिज ऊर्जा अपरिवर्तित रहती है, यानी सीधे शब्दों में कहें तो बर्तन की दीवारों पर अणुओं के प्रभाव का बल नहीं बदलता है। आयतन में वृद्धि के साथ, अणुओं की सांद्रता कम हो जाती है, और, तदनुसार, दीवार के प्रति इकाई क्षेत्र में प्रति इकाई समय में आणविक प्रभावों की संख्या कम हो जाती है - गैस का दबाव कम हो जाता है। इसके विपरीत, आयतन में कमी के साथ, अणुओं की सांद्रता बढ़ जाती है, उनके प्रभाव अधिक बार होते हैं, और गैस का दबाव बढ़ जाता है।
इज़ोटेर्मल प्रक्रिया ग्राफ़
सामान्य तौर पर, निम्नलिखित समन्वय प्रणालियों में थर्मोडायनामिक प्रक्रियाओं के ग्राफ़ को चित्रित करने की प्रथा है:
-आरेख: भुज अक्ष, कोटि अक्ष;
-आरेख: भुज अक्ष, कोटि अक्ष।
इज़ोटेर्माल प्रक्रिया का ग्राफ कहलाता है इज़ोटेर्म.
-चार्ट पर एक इज़ोटेर्म एक व्युत्क्रमानुपाती प्लॉट है।
ऐसा ग्राफ़ एक हाइपरबोला है (बीजगणित - फ़ंक्शन ग्राफ़ याद रखें)। इज़ोटेर्म-हाइपरबोला को अंजीर में दिखाया गया है। 1 .

चावल। 1. इज़ोटेर्म ऑन-आरेख
प्रत्येक इज़ोटेर्म एक निश्चित निश्चित तापमान मान से मेल खाता है। यह पता चला है कि तापमान जितना अधिक होगा, संगत आइसोथर्म उतना ही अधिक होगा -आरेख.
दरअसल, आइए हम एक ही गैस द्वारा निष्पादित दो इज़ोटेर्मल प्रक्रियाओं पर विचार करें (चित्र 2)। पहली प्रक्रिया एक तापमान पर होती है, दूसरी - एक तापमान पर।

चावल। 2. तापमान जितना अधिक होगा, इज़ोटेर्म उतना ही अधिक होगा
हम वॉल्यूम का कुछ मान तय करते हैं। पहले इज़ोटेर्म पर यह दबाव से मेल खाता है, दूसरे पर - class='tex' alt='p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
शेष दो समन्वय प्रणालियों में, इज़ोटेर्म बहुत सरल दिखता है: यह अक्ष के लंबवत एक सीधी रेखा है (चित्र 3):

चावल। 3. इज़ोटेर्म ऑन और -आरेख
समदाब रेखीय प्रक्रिया
एक बार फिर याद करें कि आइसोबैरिक प्रक्रिया एक ऐसी प्रक्रिया है जो निरंतर दबाव में होती है। आइसोबैरिक प्रक्रिया के दौरान, केवल गैस का आयतन और उसका तापमान बदलता है।
आइसोबैरिक प्रक्रिया का एक विशिष्ट उदाहरण: गैस एक विशाल पिस्टन के नीचे होती है जो स्वतंत्र रूप से घूम सकती है। यदि पिस्टन का द्रव्यमान और पिस्टन का क्रॉस सेक्शन है, तो गैस का दबाव स्थिर और बराबर है
वायुमंडलीय दबाव कहाँ है.
मान लीजिए कि एक आदर्श गैस दबाव पर एक आइसोबैरिक प्रक्रिया करती है। गैस की दो मनमानी अवस्थाओं पर फिर से विचार करें; इस बार मैक्रोस्कोपिक मापदंडों का मान और के बराबर होगा।
आइए राज्य के समीकरण लिखें:
उन्हें एक दूसरे से विभाजित करने पर, हमें प्राप्त होता है:
सिद्धांत रूप में, यह पहले से ही पर्याप्त हो सकता है, लेकिन हम थोड़ा और आगे बढ़ेंगे। आइए परिणामी संबंध को फिर से लिखें ताकि केवल पहले राज्य के पैरामीटर एक भाग में दिखाई दें, और केवल दूसरे राज्य के पैरामीटर दूसरे भाग में दिखाई दें (दूसरे शब्दों में, हम "सूचकांकों को विभिन्न भागों में विभाजित करते हैं"):
(4)
और अब यहाँ से - राज्यों की पसंद की मनमानी को देखते हुए! - हम पाते हैं गे-लुसाक का नियम:
(5)
दूसरे शब्दों में, स्थिर दबाव पर, गैस का आयतन उसके तापमान के सीधे आनुपातिक होता है।:
(6)
तापमान के साथ आयतन क्यों बढ़ता है? जैसे-जैसे तापमान बढ़ता है, अणु जोर से टकराने लगते हैं और पिस्टन को ऊपर उठाते हैं। इसी समय, अणुओं की सांद्रता कम हो जाती है, प्रभाव कम हो जाते हैं, जिससे अंत में दबाव समान रहता है।
आइसोबैरिक प्रक्रिया के प्लॉट
आइसोबैरिक प्रक्रिया का ग्राफ कहलाता है समताप-रेखा. -आरेख पर, समदाब रेखा एक सीधी रेखा है (चित्र 4):

चावल। 4. समदाब रेखा पर -आरेख
ग्राफ़ के बिंदीदार खंड का मतलब है कि पर्याप्त कम तापमान पर वास्तविक गैस के मामले में, आदर्श गैस मॉडल (और इसके साथ गे-लुसाक कानून) काम करना बंद कर देता है। दरअसल, जैसे-जैसे तापमान घटता है, गैस के कण अधिक से अधिक धीमी गति से चलते हैं, और अंतर-आणविक संपर्क की ताकतों का उनके आंदोलन पर तेजी से महत्वपूर्ण प्रभाव पड़ता है (एक सादृश्य: तेज गेंद की तुलना में धीमी गेंद को पकड़ना आसान होता है)। खैर, बहुत कम तापमान पर गैसें तरल पदार्थ में बदल जाती हैं।
अब आइए जानें कि दबाव में परिवर्तन के साथ आइसोबार की स्थिति कैसे बदलती है। यह पता चला है कि दबाव जितना अधिक होगा, आइसोबार उतना ही नीचे चला जाएगा। -आरेख.
इसे सत्यापित करने के लिए, दबाव वाले दो आइसोबार पर विचार करें और (चित्र 5):

चावल। 5. समदाब रेखा जितनी नीचे होगी, दबाव उतना ही अधिक होगा
आइए हम तापमान का कुछ मान निश्चित करें। हमने देखा कि । लेकिन एक निश्चित तापमान पर, आयतन जितना छोटा होगा, दबाव उतना ही अधिक होगा (बॉयल का नियम - मैरियट!)।
तो class='tex' alt='p_2 > p_1"> .!}
शेष दो समन्वय प्रणालियों में, आइसोबार अक्ष के लंबवत एक सीधी रेखा है (चित्र 6):

चावल। 6. आइसोबार ऑन और -आरेख
आइसोकोरिक प्रक्रिया
एक समद्विबाहु प्रक्रिया, हम याद करते हैं, एक ऐसी प्रक्रिया है जो स्थिर मात्रा में होती है। आइसोकोरिक प्रक्रिया में, केवल गैस का दबाव और उसका तापमान बदलता है।
एक आइसोकोरिक प्रक्रिया की कल्पना करना बहुत सरल है: यह एक ऐसी प्रक्रिया है जो एक निश्चित आयतन के कठोर बर्तन में (या पिस्टन के स्थिर होने पर पिस्टन के नीचे एक सिलेंडर में) होती है।
मान लीजिए कि एक आदर्श गैस आयतन के एक बर्तन में एक आइसोकोरिक प्रक्रिया करती है। फिर से, मापदंडों के साथ दो मनमानी गैस अवस्थाओं पर विचार करें। अपने पास:
हम इन समीकरणों को एक दूसरे में विभाजित करते हैं:
गे-लुसाक कानून की व्युत्पत्ति के अनुसार, हम सूचकांकों को विभिन्न भागों में "विभाजित" करते हैं:
(7)
राज्यों की पसंद की मनमानी को देखते हुए, हम पहुंचते हैं चार्ल्स कानून:
(8)
दूसरे शब्दों में, किसी गैस के स्थिर आयतन पर, उसका दबाव उसके तापमान के सीधे आनुपातिक होता है।:
(9)
किसी निश्चित आयतन की गैस को गर्म करने पर उसके दबाव में वृद्धि भौतिक दृष्टिकोण से बिल्कुल स्पष्ट बात है। आप इसे स्वयं आसानी से समझा सकते हैं।
आइसोकोरिक प्रक्रिया प्लॉट
समद्विबाहु प्रक्रिया का ग्राफ कहलाता है आइसोचोर. -आरेख पर, आइसोकोर एक सीधी रेखा है (चित्र 7):

चावल। 7. आइसोकोर ऑन-आरेख
बिंदीदार क्षेत्र का अर्थ एक ही है: कम तापमान पर आदर्श गैस मॉडल की अपर्याप्तता।

चावल। 8. आइसोकोर जितना कम होगा, आयतन उतना ही अधिक होगा
प्रमाण पिछले वाले के समान है। हम तापमान ठीक करते हैं और देखते हैं। लेकिन एक निश्चित तापमान पर, दबाव जितना छोटा होता है, आयतन उतना ही बड़ा होता है (फिर से, बॉयल-मैरियट नियम)। तो class='tex' alt='V_2 > V_1"> .!}
शेष दो समन्वय प्रणालियों में, आइसोकोर अक्ष के लंबवत एक सीधी रेखा है (चित्र 9):

चावल। 9. आइसोकोर्स ऑन और -आरेख
बॉयल के नियम - मैरियट, गे-लुसाक और चार्ल्स को भी कहा जाता है गैस कानून.
हमने मेंडेलीव-क्लैपेरॉन समीकरण से गैस नियम प्राप्त किए। लेकिन ऐतिहासिक रूप से यह विपरीत था: गैस कानून प्रयोगात्मक रूप से और बहुत पहले स्थापित किए गए थे। राज्य का समीकरण बाद में उनके सामान्यीकरण के रूप में सामने आया।
समदाब रेखीय प्रक्रिया
विभिन्न समन्वय प्रणालियों में आइसोप्रोसेस के प्लॉट
समदाब रेखीय प्रक्रिया(अन्य ग्रीक ισος, आइसोस - "समान" + βαρος, बारोस - "वजन") - निरंतर दबाव पर थर्मोडायनामिक प्रणाली की स्थिति को बदलने की प्रक्रिया ()
निरंतर दबाव पर तापमान पर गैस की मात्रा की निर्भरता की प्रयोगात्मक जांच 1802 में जोसेफ लुईस गे-लुसाक द्वारा की गई थी। गे-लुसाक का नियम: स्थिर दबाव और गैस के द्रव्यमान और उसके दाढ़ द्रव्यमान के स्थिर मूल्यों पर, गैस के आयतन और उसके पूर्ण तापमान का अनुपात स्थिर रहता है: V / T = स्थिरांक।
आइसोकोरिक प्रक्रिया
आइसोकोरिक प्रक्रिया(ग्रीक कोरस से - व्याप्त स्थान) - एक स्थिर आयतन () पर थर्मोडायनामिक प्रणाली की स्थिति को बदलने की प्रक्रिया। आदर्श गैसों के लिए, आइसोकोरिक प्रक्रिया को चार्ल्स के नियम द्वारा वर्णित किया गया है: एक स्थिर आयतन पर गैस के दिए गए द्रव्यमान के लिए, दबाव सीधे तापमान के समानुपाती होता है:
आरेख में एक आइसोकोरिक प्रक्रिया को दर्शाने वाली रेखा को आइसोकोर कहा जाता है।
यह भी इंगित करने योग्य है कि गैस को आपूर्ति की गई ऊर्जा आंतरिक ऊर्जा को बदलने पर खर्च की जाती है, अर्थात, Q = 3* ν*R*T/2=3*V*ΔP, जहां R सार्वभौमिक गैस स्थिरांक है, ν गैस में मोल्स की संख्या है, T केल्विन में तापमान है, V गैस का आयतन है, ΔP दबाव परिवर्तन में वृद्धि है। और आरेख में पी(टी) अक्षों में आइसोकोरिक प्रक्रिया को दर्शाने वाली रेखा को विस्तारित किया जाना चाहिए और एक बिंदीदार रेखा के साथ मूल से जोड़ा जाना चाहिए, क्योंकि गलतफहमी पैदा हो सकती है।
इज़ोटेर्माल प्रक्रिया
इज़ोटेर्माल प्रक्रिया(ग्रीक "थर्मस" से - गर्म, गर्म) - एक स्थिर तापमान पर थर्मोडायनामिक प्रणाली की स्थिति को बदलने की प्रक्रिया () ()। इज़ोटेर्माल प्रक्रिया का वर्णन बॉयल-मैरियट नियम द्वारा किया गया है:
एक स्थिर तापमान और गैस द्रव्यमान और उसके दाढ़ द्रव्यमान के निरंतर मूल्यों पर, गैस की मात्रा और उसके दबाव का उत्पाद स्थिर रहता है: पीवी = स्थिरांक।
आइसेंट्रोपिक प्रक्रिया
आइसेंट्रोपिक प्रक्रिया- एक स्थिर एन्ट्रापी () पर थर्मोडायनामिक प्रणाली की स्थिति को बदलने की प्रक्रिया। उदाहरण के लिए, एक प्रतिवर्ती रुद्धोष्म प्रक्रिया आइसेंट्रोपिक है: ऐसी प्रक्रिया में पर्यावरण के साथ कोई ताप विनिमय नहीं होता है। ऐसी प्रक्रिया में एक आदर्श गैस का वर्णन निम्नलिखित समीकरण द्वारा किया जाता है:
रुद्धोष्म घातांक कहां है, यह गैस के प्रकार से निर्धारित होता है।
विकिमीडिया फ़ाउंडेशन. 2010 .
देखें अन्य शब्दकोशों में "आइसोप्रोसेस" क्या हैं:
आइसोप्रोसेस थर्मोडायनामिक प्रक्रियाएं हैं जिसके दौरान द्रव्यमान और राज्य मापदंडों की एक और भौतिक मात्रा: दबाव, आयतन या तापमान अपरिवर्तित रहते हैं। तो, एक आइसोबैरिक प्रक्रिया एक स्थिर दबाव, एक आइसोकोरिक वॉल्यूम से मेल खाती है ... विकिपीडिया
आणविक गतिज सिद्धांत (संक्षिप्त रूप में एमकेटी) एक सिद्धांत है जो तीन मुख्य लगभग सही प्रावधानों के दृष्टिकोण से पदार्थ की संरचना पर विचार करता है: सभी निकायों में कण होते हैं, जिनके आकार की उपेक्षा की जा सकती है: परमाणु, अणु और आयन; कण ... ... विकिपीडिया
- (एमकेटी के रूप में संक्षिप्त) एक सिद्धांत जो तीन मुख्य लगभग सही प्रावधानों के दृष्टिकोण से पदार्थ की संरचना पर विचार करता है: सभी निकायों में ऐसे कण होते हैं जिनके आकार की उपेक्षा की जा सकती है: परमाणु, अणु और आयन; कण निरंतर हैं ... ...विकिपीडिया
पुस्तकें
- संरचनात्मक सामग्रियों की विरूपण-शक्ति विशेषताओं की सांख्यिकीय भविष्यवाणी, जी. प्लुविनाज़, वीटी सैपुनोव, यह पुस्तक एक नई विधि प्रस्तुत करती है जो धातु और बहुलक सामग्रियों के लिए सामान्य गतिज प्रक्रियाओं की विशेषताओं की भविष्यवाणी करने के लिए एक सामान्य पद्धति का प्रस्ताव करती है। तरीका… श्रेणी: विश्वविद्यालयों के लिए पाठ्यपुस्तकेंप्रकाशक: