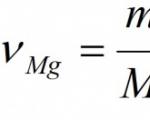रासायनिक समीकरणों का उपयोग करके गणना। रासायनिक समीकरणों का उपयोग करके गणनाएँ रासायनिक प्रतिक्रियाओं के समीकरणों का उपयोग करके 6 गणनाएँ करें
स्तुईचिओमेटरी- प्रतिक्रियाशील पदार्थों के बीच मात्रात्मक संबंध।
यदि अभिकर्मक कड़ाई से परिभाषित मात्रा में रासायनिक संपर्क में प्रवेश करते हैं, और प्रतिक्रिया के परिणामस्वरूप पदार्थ बनते हैं, जिनकी मात्रा की गणना की जा सकती है, तो ऐसी प्रतिक्रियाओं को कहा जाता है Stoiciometric.
स्टोइकोमेट्री के नियम:
रासायनिक यौगिकों के सूत्रों से पहले रासायनिक समीकरणों में गुणांक कहलाते हैं Stoiciometric.
रासायनिक समीकरणों का उपयोग करने वाली सभी गणनाएं स्टोइकोमेट्रिक गुणांक के उपयोग पर आधारित होती हैं और किसी पदार्थ की मात्रा (मोल्स की संख्या) खोजने से जुड़ी होती हैं।
प्रतिक्रिया समीकरण में पदार्थ की मात्रा (मोल्स की संख्या) = संबंधित अणु के सामने गुणांक।
एन ए=6.02×10 23 मोल -1.
η - उत्पाद के वास्तविक द्रव्यमान का अनुपात एमपीसैद्धांतिक रूप से संभव करने के लिए एमटी, एक इकाई के अंशों में या प्रतिशत के रूप में व्यक्त किया जाता है।
यदि स्थिति में प्रतिक्रिया उत्पादों की उपज इंगित नहीं की जाती है, तो गणना में इसे 100% (मात्रात्मक उपज) के बराबर लिया जाता है।
रासायनिक प्रतिक्रिया समीकरणों का उपयोग करके गणना योजना:
- किसी रासायनिक अभिक्रिया के लिए समीकरण लिखिए।
- पदार्थों के रासायनिक सूत्रों के ऊपर माप की इकाइयों के साथ ज्ञात और अज्ञात मात्राएँ लिखें।
- ज्ञात एवं अज्ञात पदार्थों के रासायनिक सूत्रों के अंतर्गत प्रतिक्रिया समीकरण से प्राप्त इन मात्राओं के संगत मान लिखिए।
- एक अनुपात बनाएं और हल करें.
उदाहरण। 24 ग्राम मैग्नीशियम के पूर्ण दहन के दौरान बनने वाले मैग्नीशियम ऑक्साइड के द्रव्यमान और मात्रा की गणना करें।
|
दिया गया: एम(एम.जी) = 24 ग्राम खोजो: ν (एम जी ओ) एम (एम जी ओ) |
समाधान: 1. आइए एक रासायनिक प्रतिक्रिया के लिए एक समीकरण बनाएं: 2एमजी + ओ 2 = 2एमजीओ। 2. पदार्थों के सूत्रों के तहत हम पदार्थ की मात्रा (मोल्स की संख्या) को इंगित करते हैं जो स्टोइकोमेट्रिक गुणांक से मेल खाती है: 2एमजी + ओ2 = 2एमजीओ 2 मोल 2 मोल 3. मैग्नीशियम का दाढ़ द्रव्यमान निर्धारित करें: मैग्नीशियम का सापेक्ष परमाणु द्रव्यमान एआर (एमजी) = 24. क्योंकि तब दाढ़ द्रव्यमान का मान सापेक्ष परमाणु या आणविक द्रव्यमान के बराबर होता है एम (एमजी)= 24 ग्राम/मोल. 4. स्थिति में निर्दिष्ट पदार्थ के द्रव्यमान का उपयोग करके, हम पदार्थ की मात्रा की गणना करते हैं:
5. मैग्नीशियम ऑक्साइड का रासायनिक सूत्र ऊपर एम जी ओ, जिसका द्रव्यमान अज्ञात है, हम निर्धारित करते हैं एक्सतिल, मैग्नीशियम सूत्र के ऊपर मिलीग्रामहम इसका दाढ़ द्रव्यमान लिखते हैं: 1 तिल एक्सतिल 2एमजी + ओ2 = 2एमजीओ 2 मोल 2 मोल
अनुपात हल करने के नियमों के अनुसार:
मैग्नीशियम ऑक्साइड की मात्रा (एमजीओ)= 1 मोल. 7. मैग्नीशियम ऑक्साइड के दाढ़ द्रव्यमान की गणना करें: एम (एमजी)=24 ग्राम/मोल, एम(ओ)=16 ग्राम/मोल. एम(एमजीओ)= 24 + 16 = 40 ग्राम/मोल। हम मैग्नीशियम ऑक्साइड के द्रव्यमान की गणना करते हैं: एम (एमजीओ) = ν (एमजीओ) × एम (एमजीओ) = 1 मोल × 40 ग्राम/मोल = 40 ग्राम। उत्तर: ν (एमजीओ) = 1 मोल; एम (एमजीओ) = 40 ग्राम. |
आप जो भी पढ़ेंगे, आप
आप अपने लिए अध्ययन करें.
पेट्रोनियास
पाठ मकसद:
- छात्रों को रासायनिक समीकरणों का उपयोग करके समस्याओं को हल करने के बुनियादी तरीकों से परिचित कराना:
- प्रारंभिक पदार्थों की मात्रा, द्रव्यमान या आयतन से प्रतिक्रिया उत्पादों की मात्रा, द्रव्यमान और आयतन ज्ञात करें,
- किसी समस्या के पाठ के साथ काम करने में कौशल विकसित करना जारी रखें, शैक्षिक समस्या को हल करने के लिए तर्कसंगत रूप से एक विधि चुनने की क्षमता और रासायनिक प्रतिक्रियाओं के समीकरण बनाने की क्षमता विकसित करना जारी रखें।
- विश्लेषण करने, तुलना करने, मुख्य बात पर प्रकाश डालने, कार्य योजना बनाने और निष्कर्ष निकालने की क्षमता विकसित करें।
- दूसरों के प्रति सहिष्णुता, निर्णय लेने में स्वतंत्रता और अपने काम के परिणामों का निष्पक्ष मूल्यांकन करने की क्षमता विकसित करें।
कार्य के रूप: ललाट, व्यक्तिगत, जोड़ी, समूह।
पाठ का प्रकार: आईसीटी के उपयोग के साथ संयुक्त
मैं संगठनात्मक क्षण.
हैलो दोस्तों। आज हम सीखेंगे कि रासायनिक प्रतिक्रियाओं के समीकरणों का उपयोग करके समस्याओं को कैसे हल किया जाए। स्लाइड 1 (प्रस्तुति देखें)।
पाठ उद्देश्य स्लाइड 2।
II.ज्ञान, कौशल और क्षमताओं को अद्यतन करना।
रसायन विज्ञान एक बहुत ही रोचक और साथ ही जटिल विज्ञान है। रसायन विज्ञान को जानने और समझने के लिए, आपको न केवल सामग्री को आत्मसात करना होगा, बल्कि अर्जित ज्ञान को लागू करने में भी सक्षम होना होगा। आपने सीखा कि कौन से संकेत रासायनिक प्रतिक्रियाओं के घटित होने का संकेत देते हैं, आपने सीखा कि रासायनिक प्रतिक्रियाओं के लिए समीकरण कैसे लिखें। मुझे आशा है कि आपको इन विषयों की अच्छी समझ होगी और आप बिना किसी कठिनाई के मेरे प्रश्नों का उत्तर दे सकेंगे।
कौन सी घटना रासायनिक परिवर्तनों का संकेत नहीं है:
क) तलछट की उपस्थिति; ग) आयतन में परिवर्तन;
बी) गैस रिलीज; घ) गंध का प्रकट होना। स्लाइड 3
कृपया संख्या में बताएं:
ए) यौगिक प्रतिक्रियाओं के समीकरण
बी) प्रतिस्थापन प्रतिक्रियाओं के समीकरण
ग) अपघटन प्रतिक्रियाओं के समीकरण स्लाइड 4
समस्याओं को हल करने का तरीका सीखने के लिए, क्रियाओं का एक एल्गोरिदम बनाना आवश्यक है, अर्थात। क्रियाओं का क्रम निर्धारित करें।
रासायनिक समीकरणों का उपयोग करके गणना के लिए एल्गोरिदम (प्रत्येक छात्र के डेस्क पर)
5. उत्तर लिखिए.
आइए एक एल्गोरिथम का उपयोग करके समस्याओं को हल करना शुरू करें
प्रतिक्रिया में भाग लेने वाले किसी अन्य पदार्थ के ज्ञात द्रव्यमान से किसी पदार्थ के द्रव्यमान की गणना करना
अपघटन के परिणामस्वरूप जारी ऑक्सीजन के द्रव्यमान की गणना करें
पानी के अंश जिनका वजन 9 ग्राम है।
आइए पानी और ऑक्सीजन का दाढ़ द्रव्यमान ज्ञात करें:
एम(एच 2 ओ) = 18 ग्राम/मोल
एम(ओ2) = 32 ग्राम/मोल स्लाइड 6
आइए रासायनिक प्रतिक्रिया का समीकरण लिखें:
2एच 2 ओ = 2एच 2 + ओ 2
प्रतिक्रिया समीकरण में सूत्र के ऊपर हम वही लिखते हैं जो हमने पाया
किसी पदार्थ की मात्रा का मान, तथा पदार्थों के सूत्रों के अंतर्गत -
स्टोइकोमेट्रिक अनुपात प्रदर्शित
रासायनिक समीकरण
0.5मोल x मोल
2एच 2 ओ = 2एच 2 + ओ 2
2मोल 1मोल
आइए उस पदार्थ की मात्रा की गणना करें जिसका द्रव्यमान हम ज्ञात करना चाहते हैं।
ऐसा करने के लिए, हम एक अनुपात बनाते हैं
0.5मोल = हॉपमोल
2मोल 1मोल
जहाँ x = 0.25 mol स्लाइड 7
इसलिए, n(O 2) = 0.25 मोल
उस पदार्थ का द्रव्यमान ज्ञात कीजिए जिसकी गणना करना आवश्यक है
एम(ओ 2)= एन(ओ 2)*एम(ओ 2)
एम(ओ 2) = 0.25 मोल 32 ग्राम/मोल = 8 ग्राम
चलिए उत्तर लिखते हैं
उत्तर: एम(ओ 2) = 8 ग्राम स्लाइड 8
प्रतिक्रिया में भाग लेने वाले किसी अन्य पदार्थ के ज्ञात द्रव्यमान से किसी पदार्थ के आयतन की गणना करना
9 ग्राम वजन वाले पानी के एक हिस्से के अपघटन के परिणामस्वरूप जारी ऑक्सीजन (संख्या) की मात्रा की गणना करें।

V(0 2)=?l(n.s.)
एम(एच 2 ओ) = 18 ग्राम/मोल
Vm=22.4l/mol स्लाइड 9
आइए प्रतिक्रिया समीकरण लिखें। आइए गुणांकों को व्यवस्थित करें
2एच 2 ओ = 2एच 2 + ओ 2
प्रतिक्रिया समीकरण में सूत्र के ऊपर हम पदार्थ की मात्रा का पाया गया मान लिखते हैं, और पदार्थों के सूत्रों के नीचे - रासायनिक समीकरण द्वारा प्रदर्शित स्टोइकोमेट्रिक अनुपात
0.5 मोल - x मोल
2एच 2 ओ = 2एच 2 + ओ 2 स्लाइड10
2मोल - 1मोल
आइए उस पदार्थ की मात्रा की गणना करें जिसका द्रव्यमान हम ज्ञात करना चाहते हैं। ऐसा करने के लिए, आइए एक अनुपात बनाएं
![]()
जहाँ x = 0.25 mol
आइए उस पदार्थ का आयतन ज्ञात करें जिसकी गणना करने की आवश्यकता है
वी(0 2)=एन(0 2) वीएम
V(O 2) = 0.25 mol 22.4 l/mol = 5.6 l (संख्या)
उत्तर: 5.6 ली स्लाइड 11
III. अध्ययन की गई सामग्री का समेकन।
स्वतंत्र समाधान के लिए कार्य:
1. कोयले के साथ ऑक्साइड Fe 2 O 3 और SnO 2 को कम करने पर 20 ग्राम Fe और Sn प्राप्त हुए। प्रत्येक ऑक्साइड के कितने ग्राम लिए गए?
2.किस स्थिति में अधिक पानी बनता है:
a) 10 ग्राम कॉपर (I) ऑक्साइड (Cu 2 O) को हाइड्रोजन के साथ कम करते समय या
बी) हाइड्रोजन के साथ 10 ग्राम कॉपर (II) ऑक्साइड (CuO) को कम करते समय? स्लाइड 12
आइए समस्या 1 का समाधान देखें

एम(Fe 2 O 3)=160 ग्राम/मोल
एम(Fe)=56 ग्राम/मोल, ![]()
एम(Fe 2 O 3)=, m(Fe 2 O 3)= 0.18*160=28.6g
उत्तर: 28.6 ग्राम
स्लाइड 13
आइए समस्या 2 का समाधान देखें

एम(CuO) = 80 ग्राम/मोल
4. ![]()
x मोल = 0.07 मोल,
n(H 2 O)=0.07 mol
एम(एच 2 ओ) = 0.07 मोल*18 ग्राम/मोल = 1.26 ग्राम
स्लाइड 14
CuO + H 2 = Cu + H 2 O
n(CuO) = एम/एम(CuO)
n(CuO) = 10 ग्राम/80 ग्राम/मोल = 0.125 मोल
0.125मोल हॉप्स
CuO + H 2 = Cu + H 2 O
1मोल 1मोल
![]()
x mol = 0.125 mol, n(H 2 O) = 0.125 mol
एम (एच 2 ओ) = एन * एम (एच 2 ओ);
m(H 2 O) = 0.125mol*18g/mol=2.25g
उत्तर: 2.25 ग्राम स्लाइड 15
गृहकार्य: पाठ्यपुस्तक सामग्री पी का अध्ययन करें। 45-47, समस्या का समाधान करें
कैल्शियम ऑक्साइड का द्रव्यमान क्या है और कार्बन डाइऑक्साइड (n.s.) का आयतन क्या है
250 ग्राम वजन वाले कैल्शियम कार्बोनेट को विघटित करके प्राप्त किया जा सकता है?
CaCO 3 = CaO + CO स्लाइड 16.
साहित्य
1. गेब्रियलियन ओ.एस. सामान्य शिक्षा संस्थानों में ग्रेड 8-11 के लिए रसायन विज्ञान पाठ्यक्रम कार्यक्रम। एम. बस्टर्ड 2006
2. गेब्रियलियन ओ.एस. रसायन विज्ञान। 8 वीं कक्षा। सामान्य शिक्षा संस्थानों के लिए पाठ्यपुस्तक। बस्टर्ड। एम. 2005
3. गोर्बुन्त्सोवा एस.वी. स्कूल पाठ्यक्रम के मुख्य अनुभागों पर परीक्षण। 8वीं - 9वीं कक्षा। वाको, मॉस्को, 2006।
4. गोर्कोवेंको एम.यू. रसायन विज्ञान में पाठ विकास। ओ.एस. गेब्रियलियन, एल.एस. गुज़े, वी.वी. सोरोकिन, आर.पी. सुरोवत्सेवा और जी.ई. रुडज़ाइटिस, एफ.जी. फेल्डमैन की पाठ्यपुस्तकों के लिए। 8वीं कक्षा। वाको, मॉस्को, 2004।
5. गेब्रियलियन ओ.एस. रसायन विज्ञान। ग्रेड 8: परीक्षण और परीक्षण। - एम.: बस्टर्ड, 2003।
6. रेडेत्स्की ए.एम., गोर्शकोवा वी.पी. ग्रेड 8-9 के लिए रसायन विज्ञान पर उपदेशात्मक सामग्री: शिक्षकों के लिए एक मैनुअल। - एम.: शिक्षा, 2000
आवेदन पत्र।
रासायनिक समीकरणों का उपयोग करके गणना
क्रियाओं का एल्गोरिदम.
रसायन विज्ञान में गणना समस्या को हल करने के लिए, आप निम्नलिखित एल्गोरिदम का उपयोग कर सकते हैं - पाँच कदम उठाएँ:
1. किसी रासायनिक प्रतिक्रिया के लिए एक समीकरण लिखें।
2. पदार्थों के सूत्रों के ऊपर, माप की संबंधित इकाइयों के साथ ज्ञात और अज्ञात मात्राएँ लिखें (केवल शुद्ध पदार्थों के लिए, अशुद्धियों के बिना)। यदि, समस्या की स्थितियों के अनुसार, अशुद्धियों वाले पदार्थ प्रतिक्रिया में प्रवेश करते हैं, तो सबसे पहले आपको शुद्ध पदार्थ की सामग्री निर्धारित करने की आवश्यकता है।
3. ज्ञात एवं अज्ञात पदार्थों के सूत्रों के अंतर्गत प्रतिक्रिया समीकरण से प्राप्त इन मात्राओं के संगत मान लिखिए।
4. एक अनुपात बनाएं और हल करें।
5. उत्तर लिखिए.
कुछ भौतिक एवं रासायनिक मात्राओं एवं उनकी इकाइयों के बीच संबंध
द्रव्यमान (एम) : जी; किलोग्राम; एमजी
पदार्थों की मात्रा (n): मोल; किमीोल; mmol
मोलर द्रव्यमान (एम): जी/मोल; किग्रा/किलोमीटर; मिलीग्राम/मिमीओल
आयतन (वी): एल; एम 3 /किमीओल; एमएल
मोलर आयतन (Vm): l/mol; एम 3 /किमीओल; एमएल/मिमीओल
कणों की संख्या (एन): 6 1023 (अवागाद्रो संख्या - एन ए); 6 1026 ; 6 1020
यह पाठ "रासायनिक प्रतिक्रिया के समीकरण" विषय के अध्ययन को जारी रखने के लिए समर्पित है। पाठ रासायनिक प्रतिक्रिया के समीकरण का उपयोग करके सबसे सरल गणनाओं पर चर्चा करता है, जो प्रतिक्रिया में भाग लेने वाले पदार्थों की मात्रा के अनुपात से संबंधित है।
विषय: प्रारंभिक रासायनिक विचार
पाठ: रासायनिक प्रतिक्रिया समीकरण
1. प्रतिक्रिया में भाग लेने वाले पदार्थों की मात्रा का अनुपात
प्रतिक्रिया समीकरण में गुणांक न केवल प्रत्येक पदार्थ के अणुओं की संख्या दर्शाते हैं, बल्कि प्रतिक्रिया में भाग लेने वाले पदार्थों की मात्रा का अनुपात भी दर्शाते हैं। इस प्रकार, प्रतिक्रिया समीकरण के अनुसार: 2H2 + O2 = 2H2O - यह तर्क दिया जा सकता है कि एक निश्चित मात्रा में पानी (उदाहरण के लिए, 2 मोल) बनाने के लिए, साधारण पदार्थ हाइड्रोजन (2 मोल) और आधे के समान मात्रा में मोल की आवश्यकता होती है। सरल पदार्थ ऑक्सीजन (1 मोल) के जितने मोल की आवश्यकता होती है। आइए हम ऐसी गणनाओं के उदाहरण दें।
2. कार्य 1
कार्य 1. आइए 4 मोल पानी के अपघटन के परिणामस्वरूप बनने वाले ऑक्सीजन पदार्थ की मात्रा निर्धारित करें।
समस्या को हल करने के लिए एल्गोरिदम:
1. प्रतिक्रिया समीकरण लिखिए
2. प्रतिक्रिया समीकरण के अनुसार और समस्या की स्थितियों के अनुसार पदार्थों की मात्रा निर्धारित करके एक अनुपात बनाएं (पदार्थ की अज्ञात मात्रा को x मोल के रूप में निर्दिष्ट करें)।
3. एक समीकरण बनाएं (अनुपात से)।
4. समीकरण हल करें, x ज्ञात करें।
चावल। 1. संक्षिप्त स्थिति का निरूपण एवं समस्या का समाधान 1
3. कार्य 2कार्य 2. तांबे के 3 मोल को पूरी तरह से जलाने के लिए कितनी मात्रा में ऑक्सीजन की आवश्यकता होती है?आइए रासायनिक प्रतिक्रिया के समीकरण का उपयोग करके समस्याओं को हल करने के लिए एक एल्गोरिदम का उपयोग करें।

चावल। 2. संक्षिप्त स्थिति का निरूपण एवं समस्या का समाधान 2.
एल्गोरिदम का ध्यानपूर्वक अध्ययन करें और उन्हें एक नोटबुक में लिखें, प्रस्तावित समस्याओं को स्वयं हल करें
मैं. एल्गोरिथम का उपयोग करके, निम्नलिखित समस्याओं को स्वयं हल करें:
1. पर्याप्त मात्रा में ऑक्सीजन के साथ 0.27 मोल पदार्थ की मात्रा के साथ एल्युमीनियम की परस्पर क्रिया के परिणामस्वरूप बनने वाले एल्युमीनियम ऑक्साइड पदार्थ की मात्रा की गणना करें (4एएल +3ओ 2 =2Al2 O3 ).
2. पर्याप्त मात्रा में ऑक्सीजन के साथ 2.3 मोल पदार्थ के साथ सोडियम की परस्पर क्रिया के परिणामस्वरूप बनने वाले सोडियम ऑक्साइड पदार्थ की मात्रा की गणना करें(4Na+O2 =2Na2 O).
एल्गोरिथम नंबर 1
किसी प्रतिक्रिया में शामिल पदार्थ की ज्ञात मात्रा से किसी पदार्थ की मात्रा की गणना करना।
उदाहरण। 6 मोल पदार्थ की मात्रा के साथ पानी के अपघटन के परिणामस्वरूप जारी ऑक्सीजन की मात्रा की गणना करें।



द्वितीय. एल्गोरिथम का उपयोग करके, निम्नलिखित समस्याओं को स्वयं हल करें:
1. 4 mol (S + O) पदार्थ की मात्रा के साथ सल्फर ऑक्साइड (IV) प्राप्त करने के लिए आवश्यक सल्फर के द्रव्यमान की गणना करें 2
=SO2).
2. 0.6 mol (2Li+Cl2 = 2LiCl) पदार्थ की मात्रा के साथ लिथियम क्लोराइड प्राप्त करने के लिए आवश्यक लिथियम के द्रव्यमान की गणना करें।
एल्गोरिथम संख्या 2
किसी प्रतिक्रिया में शामिल किसी अन्य पदार्थ की ज्ञात मात्रा से किसी पदार्थ के द्रव्यमान की गणना करना।
उदाहरण: 8 मोल पदार्थ की मात्रा के साथ एल्यूमीनियम ऑक्साइड प्राप्त करने के लिए आवश्यक एल्यूमीनियम के द्रव्यमान की गणना करें।



तृतीय. एल्गोरिथम का उपयोग करके, निम्नलिखित समस्याओं को स्वयं हल करें:
1. यदि 12.8 ग्राम (2Na+S=Na2S) वजन वाला सल्फर सोडियम के साथ प्रतिक्रिया करता है तो सोडियम सल्फाइड की मात्रा की गणना करें।
2. यदि 64 ग्राम वजनी कॉपर (II) ऑक्साइड हाइड्रोजन (CuO + H2 = Cu + H2 O) के साथ प्रतिक्रिया करता है तो बनने वाले कॉपर पदार्थ की मात्रा की गणना करें।
एल्गोरिथम का ध्यानपूर्वक अध्ययन करें और इसे अपनी नोटबुक में लिखें।
एल्गोरिथम संख्या 3
किसी प्रतिक्रिया में शामिल किसी अन्य पदार्थ के ज्ञात द्रव्यमान से किसी पदार्थ की मात्रा की गणना करना।
उदाहरण। यदि 19.2 ग्राम वजनी तांबा ऑक्सीजन के साथ प्रतिक्रिया करता है तो कॉपर (I) ऑक्साइड की मात्रा की गणना करें।



एल्गोरिथम का ध्यानपूर्वक अध्ययन करें और इसे अपनी नोटबुक में लिखें।
चतुर्थ. एल्गोरिथम का उपयोग करके, निम्नलिखित समस्याओं को स्वयं हल करें:
1. 112 ग्राम वजन वाले लोहे के साथ प्रतिक्रिया करने के लिए आवश्यक ऑक्सीजन के द्रव्यमान की गणना करें
(3Fe + 4O2 =Fe3 O4).
एल्गोरिथम संख्या 4
प्रतिक्रिया में भाग लेने वाले किसी अन्य पदार्थ के ज्ञात द्रव्यमान से किसी पदार्थ के द्रव्यमान की गणना करना
उदाहरण। फास्फोरस के दहन के लिए आवश्यक ऑक्सीजन के द्रव्यमान की गणना करें, जिसका वजन 0.31 ग्राम है।



स्वतंत्र समाधान के लिए कार्य
1. पर्याप्त मात्रा में ऑक्सीजन (4Al + 3O2 = 2Al2 O3) के साथ 0.27 mol पदार्थ की मात्रा के साथ एल्यूमीनियम की परस्पर क्रिया के परिणामस्वरूप बनने वाले एल्यूमीनियम ऑक्साइड पदार्थ की मात्रा की गणना करें।
2. पर्याप्त मात्रा में ऑक्सीजन (4Na + O2 = 2Na2 O) के साथ 2.3 mol मात्रा वाले पदार्थ के साथ सोडियम की परस्पर क्रिया के परिणामस्वरूप बनने वाले सोडियम ऑक्साइड पदार्थ की मात्रा की गणना करें।
3. 4 मोल (S+O2 =SO2) पदार्थ की मात्रा के साथ सल्फर ऑक्साइड (IV) प्राप्त करने के लिए आवश्यक सल्फर के द्रव्यमान की गणना करें।
4. 0.6 mol (2Li+Cl2 = 2LiCl) पदार्थ की मात्रा के साथ लिथियम क्लोराइड प्राप्त करने के लिए आवश्यक लिथियम के द्रव्यमान की गणना करें।
5. यदि 12.8 ग्राम (2Na+S=Na2S) वजन वाला सल्फर सोडियम के साथ प्रतिक्रिया करता है तो सोडियम सल्फाइड की मात्रा की गणना करें।
6. यदि 64 ग्राम वजनी कॉपर (II) ऑक्साइड हाइड्रोजन (CuO + H2 = Cu + H2 O) के साथ प्रतिक्रिया करता है तो बनने वाले कॉपर पदार्थ की मात्रा की गणना करें।
अभ्यास
सिम्युलेटर नंबर 1 - रासायनिक प्रतिक्रिया समीकरण का विश्लेषण
सिम्युलेटर नंबर 6 - स्टोइकोमेट्रिक गणना
पाठ सारांश "रासायनिक समीकरणों का उपयोग करके गणना"
1. होमवर्क की जाँच करना
होमवर्क के रूप में, आपको प्रतिक्रिया समीकरणों में गुणांक रखने के लिए कहा गया था।आप ब्रेक के दौरान किया गया काम देख सकते हैं. गलतियाँ तो होंगी ही।क्या सब कुछ ठीक हो गया, क्या किसी के पास कोई प्रश्न है?उन्हें अपने घरेलू अनुभव के बारे में बात करने दीजिए।
2. विषय की घोषणा एवं ज्ञान का अद्यतनीकरण
आज के पाठ का विषय रासायनिक समीकरणों का उपयोग करके गणना है। सबसे पहले, आइए वह सब कुछ याद रखें जो आज हमारे लिए उपयोगी हो सकता है। हम पहले ही प्रयोगशाला के काम में, होमवर्क में, और इससे भी पहले बाइनरी यौगिकों के विषय में रासायनिक समीकरणों का सामना कर चुके हैं। आइए रासायनिक प्रतिक्रिया के समीकरण की परिभाषा याद रखें।
(यह रासायनिक सूत्रों और गुणांकों का उपयोग करके रासायनिक प्रतिक्रिया का एक पारंपरिक संकेतन है।)
अद्भुत।
किसी भी यौगिक का उत्पादन करते समय, आपको यह जानना होगा कि प्रतिक्रिया उत्पाद का आवश्यक द्रव्यमान प्राप्त करने के लिए कितनी प्रारंभिक सामग्री लेनी है। ऐसा करने के लिए, चल रही रासायनिक प्रतिक्रिया के लिए और गणना करते समय एक समीकरण बनाएंद्रव्यमान दाढ़ द्रव्यमान को ध्यान में रखते हैं पदार्थ, और गणना करते समयगैसों की मात्रा मूल्य को ध्यान में रखेंदाढ़ की मात्रागैसों
सामान्य परिस्थितियों में गैसों के मोलर आयतन का मान कौन याद रखता है? (22.4 लीटर/मोल)
और ये सामान्य स्थितियाँ क्या हैं? (दबाव 101.3 केपीए और तापमान 0ओ सी)
अर्थात्, इन परिस्थितियों में, किसी भी गैस का 1 मोल 22.4 लीटर की मात्रा लेता है।
दरअसल, समस्याओं को हल करने के लिए हमें कई मात्राएँ याद रखनी होंगी:
दाढ़ द्रव्यमान - एम (जी/मोल)
पदार्थ की मात्रा - n (mol)
आयतन - वी (एल)
यह इस तरह से बेहतर है: आपको याद है कि दाढ़ द्रव्यमान संख्यात्मक रूप से किसी पदार्थ के सापेक्ष परमाणु द्रव्यमान या सापेक्ष आणविक द्रव्यमान के बराबर होता है। ऐसा करने के लिए, आपको आवर्त सारणी का उपयोग करने की आवश्यकता है, जहां प्रत्येक "सेल" के नीचे सापेक्ष परमाणु द्रव्यमान दर्शाया गया है। पूर्णांकन नियमों को न भूलकर, हम गणना में इस द्रव्यमान के संपूर्ण मान का उपयोग करते हैं।
रसायन विज्ञान एक बहुत ही स्पष्ट, तार्किक और सुसंगत विज्ञान है, इसलिए समस्याओं को हल करने के लिए पाठ्यपुस्तक में दिए गए एल्गोरिदम का उपयोग करना सुविधाजनक होगा। यह क्रियाओं का एक सार्वभौमिक क्रम है जिसका उपयोग इस प्रकार की किसी भी समस्या को हल करने के लिए किया जाता है।
कृपया पाठ्यपुस्तक खोलें और आइए हम सभी एल्गोरिथम से परिचित हों।
(यहां हम सभी एक साथ अपनी पाठ्यपुस्तकें खोलते हैं, एक व्यक्ति, शायद मैं, एल्गोरिदम पढ़ता है, बाकी लोग यह समझने के लिए अनुसरण करते हैं कि उन्हें अब क्या करना है)
यह व्यापक लगता है, लेकिन मुझे आशा है कि यह बहुत भ्रमित करने वाला नहीं है। आइए इसे एक उदाहरण से समझने का प्रयास करें।
कार्य 1। हाइड्रोजन का उत्पादन करने के लिए, एल्युमीनियम को सल्फ्यूरिक एसिड में घोला जाता है: 2Al + 3H 2 एसओ 4 → अल 2 (एसओ 4 ) 3 + 3 एच 2 (हमारे एल्गोरिदम का पहला बिंदु)। प्रतिक्रिया के लिए हमने 10.8 ग्राम एल्युमीनियम लिया। उपभोग किए गए सल्फ्यूरिक एसिड के द्रव्यमान की गणना करें।
दिया गया: एम(अल) = 10.8 ग्राम | समाधान: m=10.8 ग्राम m - ? 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 एम=27 ग्राम/मोल एम=98 ग्राम/मोल यहां हम यह उल्लेख कर सकते हैं कि वास्तव में, 2 एल्यूमीनियम परमाणु और 3 एसिड अणु प्रतिक्रिया में प्रवेश नहीं करते हैं, बल्कि एल्यूमीनियम परमाणुओं का एक हिस्सा और एसिड अणुओं का एक हिस्सा प्रतिक्रिया में प्रवेश करते हैं। रसायन विज्ञान में इस भाग को संक्षिप्त शब्द "मोल" कहा जाता है। n=2 मोल n=3 मोल एम = एम ∙ एन एम=54 ग्राम एम=294 ग्राम अनुपात द्वारा गणना: |
||||
एम (एच 2 एसओ 4 ) - ? |
|||||
10.8 ग्राम | |||||
54 ग्रा | 294 ग्राम | ||||
10.8 ग्राम ∙ 294 ग्राम | |||||
54 ग्रा | |||||
एक्स = 58.8 ग्राम उत्तर: एम (एच 2 एसओ 4) = 58.8 ग्राम |
|||||
बस यही समस्या का समाधान है. कोई सवाल? आइए समाधान के बारे में एक बार और बात करें:
एक समीकरण बनाया
पदार्थों के ऊपर हमने हस्ताक्षर किया है कि हम क्या जानते हैं और क्या खोजना चाहते हैं
सूत्रों के अंतर्गत हमने दाढ़ द्रव्यमान, पदार्थ की मात्रा और लिखा हैStoiciometricपदार्थ का द्रव्यमान ( "आवर्त सारणी के अनुसार द्रव्यमान" इंगित करना बेहतर है)
एक अनुपात बना लिया
अनुपात हल किया
उत्तर रिकार्ड किया
आइए इसी तरह की समस्या को हल करें, लेकिन गैसीय पदार्थों के साथ (यहां हम पदार्थ के दाढ़ द्रव्यमान का उपयोग नहीं करेंगे, लेकिन क्या?...दाढ़ की मात्रा)
समस्या 2. 25 ग्राम जिंक हाइड्रोक्लोरिक एसिड में घुल जाता है, रासायनिक प्रतिक्रिया के दौरान एक गैस निकलती है - हाइड्रोजन। जारी हाइड्रोजन की मात्रा की गणना करें।
दिया गया: एम(जेडएन) = 10.8 ग्राम | समाधान: एम=25 ग्राम वी - ? Zn + 2HCl → ZnCl 2 + H 2 एम=65 ग्राम/मोल वी एम=22.4 एल/मोल n=1 मोल n=1 मोल एम=65 ग्राम वी=22.4 लीटर अनुपात द्वारा गणना: |
||||
एम(एचसीएल) - ? |
|||||
25 ग्रा | |||||
65 ग्रा | 22.4 ली | ||||
25 ग्राम ∙ 22.4 ली | |||||
65 ग्रा | |||||
एक्स = 8.61 एल उत्तर: वी(एच 2 ) = 8.61 एल |
|||||
आइए देखें कि आपने सामग्री में कैसे महारत हासिल की है। समान एल्गोरिथम का उपयोग करके समस्या का समाधान करें:
यह सच नहीं है कि आप सफल होंगे:
के साथ प्रतिक्रिया करते समय कोयला ऑक्साइड Fe2O3 (पहला विकल्प) और SnO2 (दूसरा विकल्प) का उपयोग करके प्रत्येक को 20 ग्राम Fe और Sn प्राप्त हुआ। प्रत्येक ऑक्साइड के कितने ग्राम लिए गए?
कृपया ध्यान दें कि अब हम शुरुआती पदार्थों के द्रव्यमान की गणना कर रहे हैं, प्रतिक्रिया उत्पादों की नहीं)
(सभी को इसे एक नोटबुक में हल करने दें और चुनिंदा तरीके से उन्हें समाधान दिखाने के लिए कहें, हम सभी मिलकर समीकरण को बोर्ड पर लिखेंगे, और हर कोई इसे स्वयं हल करने का प्रयास करेगा)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28.5 ग्राम
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25.38 ग्राम
गृहकार्य: पाठ्यपुस्तक सामग्री पी का अध्ययन करें। 146-150, समस्या का समाधान करें
कैल्शियम ऑक्साइड का द्रव्यमान क्या है और कार्बन डाइऑक्साइड (n.s.) का आयतन क्या है
250 ग्राम वजन वाले कैल्शियम कार्बोनेट को विघटित करके प्राप्त किया जा सकता है?स्कूली बच्चों को दिया जाना चाहिएतैयार समीकरणइस कार्य को पूरा करने के लिए
पद्धतिगत पाठ विकास (2 घंटे)
रासायनिक समीकरणों का उपयोग करके गणना
खापुगिना पोलीना इवानोव्ना,
रसायन विज्ञान शिक्षक जीबीओयू माध्यमिक विद्यालय 277
सेंट पीटर्सबर्ग का किरोव्स्की जिला
पाठ मकसद: आठवीं कक्षा के विद्यार्थियों को रासायनिक समीकरणों का उपयोग करके गणना करना सिखाएं: प्रारंभिक पदार्थों की मात्रा, आयतन और द्रव्यमान से प्रतिक्रिया उत्पादों की मात्रा, द्रव्यमान और मात्रा का पता लगाएं।
कक्षाओं के दौरान:
किसी नए विषय का अध्ययन करने से पहले, हमें उन मात्राओं और सूत्रों को याद रखना होगा जो आप पहले से जानते हैं। रासायनिक प्रतिक्रियाओं के प्रकार याद रखें. और आप पहले से ही जानते हैं कि रासायनिक समीकरण कैसे बनाएं और उन्हें बराबर कैसे करें। आइए निम्नलिखित कार्य करके आपके ज्ञान का परीक्षण करें: मूल्यांकन परीक्षा।(परीक्षण की सामग्री मेरी निजी वेबसाइट पर फ़ाइलों और फ़ोटो फ़ोल्डर में देखी जा सकती है)
शिक्षक का स्पष्टीकरण:
1. रासायनिक समीकरणों का उपयोग करके गणना करना सीखने से पहले, आपको किसी पदार्थ की मात्रा, द्रव्यमान और आयतन ज्ञात करने के लिए उन सूत्रों को एक बार फिर से याद करना होगा जो हम पहले से जानते हैं; एक चरण में आप अपने द्वारा किए गए काम के बाद खुद को परख सकते हैं . ऐसा करने के लिए, आइए निम्नलिखित प्रस्तुति की ओर मुड़ें, जो हमारे ज्ञान को स्मृति में पुनर्स्थापित करने में मदद करेगी। प्रस्तुति संख्या 1.
जो सूत्र आप पहले से जानते हैं उन्हें अपनी नोटबुक में लिखें:
n- पदार्थ की मात्रा (मोल)
एम- पदार्थ का द्रव्यमान (जी)
एम - दाढ़ द्रव्यमान (जी/मोल)
वी - गैस की मात्रा (एल)
वी एम - मोलर आयतन = 22.4 एल/मोल
एन = एम/एम ; एम = एन.एम
एन = वी/वीएम; वी = एन.वी एम
2. अब, हमें यह समझना चाहिए कि एक रासायनिक समीकरण न केवल प्रक्रिया के गुणात्मक (पदार्थों का परिवर्तन) पक्ष को दर्शाता है, बल्कि मात्रात्मक पक्ष को भी दर्शाता है। ऐसा करने के लिए, आइए निम्नलिखित की ओर मुड़ें प्रस्तुतियाँ#2(प्रस्तुति मेरी निजी वेबसाइट पर फाइलों और फोटो फ़ोल्डर में देखी जा सकती है)
अपनी कॉपी मैं लिखो:
प्रतिक्रिया समीकरण में गुणांक कणों की संख्या को इंगित करता है, और कणों की संख्या बदले में मोल्स की संख्या निर्धारित करती है!
2 एच₂ + ओ₂ = 2H₂ के बारे में
कणों की संख्या 2 अणु 1 अणु 2 अणु
मात्रा ↓ ↓ ↓
पदार्थ,एन2 मोल 1 मोल 2 मोल
2 फ़े(ओह)3 = फ़े2 हे3 + 3 एच2 हे
↓ ↓ ↓
एन= 2मोल 1मोल 3मोल
3. अगला चरण जिसकी हमें जांच करनी चाहिए वह है प्रतिक्रिया समीकरण का उपयोग करके अनुपात बनाने की क्षमता, साथ ही इसे हल करना। ऐसा करने के लिए, आइए निम्नलिखित की ओर मुड़ें प्रस्तुतियाँ 3.(प्रस्तुति मेरी निजी वेबसाइट पर फाइलों और फोटो फ़ोल्डर में देखी जा सकती है)
अपनी कॉपी मैं लिखो:
स्थिति से ज्ञात: 2 mol X mol (अंशांक)
4पी+5ओ₂ = 2पी₂ हे₅
समीकरण द्वारा ज्ञात: 4 mol 5 mol 2 mol (हर)
आइए अनुपात बनाएं और हल करें:
2 मोल X मोल
_______ = _______
4 मोल 2 मोल
एक्स मोल = 2 मोल. 2 मोल= 1 मोल
4 मोल
एक्स =एन(पी₂ हे₅ )= 1 मोल
4. आइए रासायनिक प्रतिक्रियाओं के समीकरणों का उपयोग करके समस्याओं को हल करने के लिए आगे बढ़ें। रसायन विज्ञान में गणना समस्या को हल करने के लिए, आपको निम्नलिखित एल्गोरिदम का उपयोग करने की आवश्यकता है - पांच कदम उठाएं। प्रस्तुति 4. (प्रस्तुति मेरी निजी वेबसाइट पर फाइलों और फोटो फ़ोल्डर में देखी जा सकती है) पाठ्यपुस्तक पृष्ठ 101
अपनी कॉपी में:
छात्रों को अपनी नोटबुक में चिपकाने के लिए एक तैयार समाधान एल्गोरिदम दिया जाता है।
रासायनिक प्रतिक्रिया समीकरणों का उपयोग करके गणना समस्याओं को हल करने के लिए एल्गोरिदम:
1. रासायनिक प्रतिक्रिया के लिए एक समीकरण बनाएं (यानी, गुणांक निर्धारित करना सुनिश्चित करें!)
2. समीकरण में संबंधित सूत्रों के ऊपर, माप की इकाइयों के साथ पदार्थों के बारे में मात्रात्मक डेटा लिखें जो ज्ञात हैं या समस्या की स्थितियों के आधार पर गणना की जा सकती हैं, और वांछित मान X भी माप की इकाइयों के साथ लिखें।
3. इन सूत्रों के अंतर्गत, समीकरण द्वारा निर्दिष्ट संगत मात्रात्मक मात्राएँ, माप की इकाइयों के साथ भी लिखें।
4. एक अनुपात बनाएं और हल करें।
5. उत्तर को औपचारिक बनाएं.
5. आइए समस्या का समाधान करें.
गर्म करने पर सल्फ्यूरिक एसिड के साथ 0.5 मोल एल्यूमीनियम ऑक्साइड की परस्पर क्रिया के परिणामस्वरूप बनने वाले पानी के द्रव्यमान की गणना करें।
समस्या पढ़ें.
समस्या कथन लिखें. (दिया गया है, खोजें।)
अपनी कॉपी में: (छात्र शिक्षक के स्पष्टीकरण के अनुसार समाधान लिखते हैं प्रस्तुतियाँ 5 ) (प्रस्तुति मेरी निजी वेबसाइट पर फाइलों और फोटो फ़ोल्डर में देखी जा सकती है)
दिया गया:
n(Al₂O₃)=0.5 मोल
_________________
खोजो:
समाधान:
एन=0.5 मोल X मोल
अल₂ हे₃ +3 एच₂ इसलिए₄ = अल₂ (इसलिए₄ ) ₃ +3 एच₂ हे
एन= 1 मोल 3 मोल
एम = 102 ग्राम/मोल 18 ग्राम/मोल
आणविक भार की गणना:
Мr(Al₂O₃)= 2.27+3.16= 54+48=102
Мr(H₂O)= 2.1+16=18
एक अनुपात बनाएं और हल करें.
0.5 मोल = एक्स मोल
1 मोल 3 मोल
एक्स मोल =एन(एच₂ हे) = 0.5 मोल. 3 मोल= 1.5 मोल
1 तिल
आइए पानी का द्रव्यमान ज्ञात करें।
एम(एच₂ हे) = एन(एच₂ हे) . एम(एच₂ हे)
एम(एच₂ हे) = 1.5 मोल.18 ग्राम/मोल = 27 ग्राम
उत्तर:एम(एच₂ हे)=27 ग्राम
6. समस्याओं का समाधान स्वयं करें.
मूल्यांकन के लिए दो छात्रों को बोर्ड में बुलाया जाता है।
1. समीकरण के अनुसार 634 ग्राम एल्यूमीनियम क्लोराइड प्राप्त करने के लिए आवश्यक क्लोरीन (संख्या) की मात्रा निर्धारित करें: 2Al + 3Cl 2 = 2AlCl 3। उत्तर: 159.6 ली
2. समीकरण के अनुसार 128 ग्राम वजन वाली ऑक्सीजन के साथ प्रतिक्रिया के लिए आवश्यक पदार्थ की मात्रा और लिथियम के द्रव्यमान की गणना करें: 4Li + O 2 = 2Li 2 O उत्तर: 16 मोल, 112 ग्राम
7. गृहकार्य.
काम।
जिंक ऑक्साइड का द्रव्यमान ज्ञात करें, जो ऑक्सीजन के साथ 13 ग्राम जिंक की परस्पर क्रिया से बनता है।