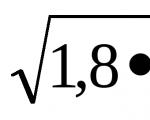आयन विनिमय अभिक्रियाएँ पूर्ण होने जा रही हैं। आयनिक प्रतिक्रिया समीकरण
समस्या 1. यदि HCN विलयन (C m = 10 -3 M) में हाइड्रोजन आयनों की सांद्रता की गणना करें = 4,2∙10 -3 .
समाधान: हाइड्रोसायनिक एसिड का पृथक्करण समीकरण HCN ↔ H + + CN के अनुसार होता है - ; और विलयन में आयनों की सांद्रता एक दूसरे के बराबर होती है (क्योंकि एच+: सी एन - = 1:1, कहां
- स्टोइकोमेट्रिक गुणांक) यानी। == सी एम, मोल/ली; तब = = 4.2∙10 -3 ∙ 10 -3 = 4.210 -7 mol/l.
समाधान : अमोनियम हाइड्रॉक्साइड इस प्रकार अलग हो जाता है:
NH 4 OH ↔ NH 4 + + OH -, पृथक्करण स्थिरांक का रूप होता है
के डी =;
अमोनियम और हाइड्रॉक्साइड आयनों की सांद्रता समान है ( (एनएच4+) : (ओएच -) = 1:1), हम उन्हें इस प्रकार निरूपित करते हैं एक्स:
= = एक्समोल/ली , तो K d के लिए व्यंजक रूप लेगा
1,810 -5 = एक्स 2 / 0,01-एक्स. ध्यान में रख कर एक्स<< С м, решаем уравнение
1.810 -5 =x 2 / 0.01, सापेक्ष एक्स:
एक्स=
 =4.2∙10 -4 मोल/ली; = 4.2∙10 -4 mol/l.
=4.2∙10 -4 मोल/ली; = 4.2∙10 -4 mol/l.
हाइड्रोजन और हाइड्रॉक्साइड आयनों की सांद्रता पानी के आयनिक उत्पाद K के माध्यम से संबंधित होती है डब्ल्यू= =10 -14, आइए हम हाइड्रोजन आयनों की सांद्रता = K व्यक्त करें डब्ल्यू/ और इसके मूल्य की गणना करें:
110 -14 /4.210 -4 = 2.310 -11 मोल/ली.
समस्या 3. एचसीएल समाधान का पीएच निर्धारित करें ( =1), यदि C m =2∙10 -3 M
समाधान: हाइड्रोक्लोरिक एसिड का पृथक्करण समीकरण के अनुसार होता है
एचसीएल एच + + सीएल - , हाइड्रोजन आयनों की सांद्रता = C m =1∙2∙10 -3 = =2∙10 -3 mol/l. हाइड्रोजन सूचक पीएच = - लॉग = - लॉग2∙10 -3 = 2.7।
समस्या 4. यदि pH=11 और Kd=1.8∙10 -5 हो तो अमोनियम हाइड्रॉक्साइड की मोलर सांद्रता निर्धारित करें।
समाधान: हाइड्रोजन आयनों की सांद्रता =10 - pH =10 -11 mol/l. पानी के आयनिक उत्पाद से हम सांद्रता = K निर्धारित करते हैं डब्ल्यू / = 10 -14 /10 -11 =10 -3 मोल/ली. अमोनियम हाइड्रॉक्साइड एक कमजोर आधार है और पृथक्करण प्रतिक्रिया समीकरण द्वारा विशेषता है
एनएच 4 ओएच ↔ एनएच 4 + + ओएच -। पृथक्करण स्थिरांक के लिए अभिव्यक्ति
के डी =. 
ओस्टवाल्ड के नियम से यह निष्कर्ष निकलता है कि == ∙सी एम, ए को डी = 2 C m. समीकरणों को संयोजित करने पर, हमें C m = 2 / K d = 10 -6 / 1.8∙10 -5 = 0.056 mol/l मिलता है
घुलनशीलता उत्पाद
पदार्थों की, उनकी प्रकृति के आधार पर, पानी में अलग-अलग घुलनशीलता होती है, जो एक मिलीग्राम के अंश से लेकर सैकड़ों ग्राम प्रति लीटर तक होती है। मुश्किल से घुलनशील इलेक्ट्रोलाइट्स बहुत कम सांद्रता के संतृप्त समाधान बनाते हैं, इसलिए हम मान सकते हैं कि उनके पृथक्करण की डिग्री एकता तक पहुंचती है। इस प्रकार, विरल रूप से घुलनशील इलेक्ट्रोलाइट का एक संतृप्त समाधान एक प्रणाली है जिसमें स्वयं समाधान शामिल होता है, जो विघटित पदार्थ के अवक्षेप के साथ संतुलन में होता है। निरंतर बाहरी परिस्थितियों में, अवक्षेप विघटन की दर क्रिस्टलीकरण प्रक्रिया की दर के बराबर होती है: K एनए एम ↔ एनके+ एम + एमए- एन (1)
अवक्षेपित घोल
इस विषम संतुलन प्रक्रिया का वर्णन करने के लिए, एक संतुलन स्थिरांक का उपयोग किया जाता है, जिसे घुलनशीलता उत्पाद पीआर = कहा जाता है एन एम, संतृप्त घोल (मोल/ली) में आयनों की सांद्रता कहां और कितनी है। उदाहरण के लिए:
AgCl= Ag + +Cl - , PR = ; यहाँ एन=एम=1.
पीबीआई 2 = पीबी 2+ +2आई - , पीआर = 2; यहाँ एन=1, एम=2.
पीआर विघटित पदार्थ की प्रकृति और तापमान पर निर्भर करता है। पीआर एक सारणीबद्ध मान है. पीआर को जानना , आप किसी पदार्थ के संतृप्त घोल की सांद्रता की गणना कर सकते हैं, और प्रति 100 मिलीलीटर पानी (मान) में इसकी घुलनशीलता का अनुमान भी लगा सकते हैं एस, संदर्भ साहित्य में दिया गया है) और पदार्थ के अवक्षेपण की संभावना निर्धारित करते हैं।
समीकरण (1) के लिए, मुश्किल से घुलनशील पदार्थ (C m, mol/l) के संतृप्त घोल की सांद्रता और PR मान के बीच संबंध निम्नलिखित समीकरण द्वारा निर्धारित किया जाता है: 
 ,
,
कहाँ एनऔर एम -स्टॉइचीओमेट्रिक गुणांक eq में। 1.
कार्य 5. संतृप्त घोल (C m)Mg(OH) 2 की सांद्रता 1.1 है 10 -4 मोल/ली. पीआर के लिए अभिव्यक्ति लिखिए और इसके मूल्य की गणना करें।
समाधान: Mg(OH) 2 के संतृप्त घोल में, अवक्षेप और घोल Mg(OH) 2 ↔Mg 2+ + 2OH - के बीच संतुलन स्थापित होता है, जिसके लिए PR अभिव्यक्ति का रूप PR होता है = 2 . आयनों की सांद्रता जानकर आप उसका संख्यात्मक मान ज्ञात कर सकते हैं। पूर्ण पृथक्करण को देखते हुए
Mg(OH) 2, इसकी सांद्रता संतृप्त घोल C m = = 1.110 -4 मोल/ली, ए = 2 = 2.210 -4 मोल/ली. इसलिए, पीआर=2 =1.1. 10 -4 (2.2 10 -4) 2 = 5.3. 10 -12.
कार्य 6. यदि 0.5 लीटर पानी में 0.011 ग्राम नमक घोला जाए तो संतृप्त घोल की सांद्रता और सिल्वर क्रोमेट के पीआर की गणना करें।
समाधान:
संतृप्त घोल Ag 2 CrO 4 की दाढ़ सांद्रता निर्धारित करने के लिए हम सूत्र C M = का उपयोग करते हैं
 ,
कहाँ एम- विलेय का द्रव्यमान (g), M - दाढ़ द्रव्यमान (g/mol), वी- समाधान की मात्रा (एल)। एम (एजी 2
सीआरओ 4
)
=332 ग्राम/मोल. सेमी =9.48. 10 -5 मोल/ली. सिल्वर (I) क्रोमेट का विघटन नमक के पूर्ण ( = 1) पृथक्करण के साथ होता है: Ag 2 CrO 4 ↔ 2Ag + +CrO 4 2-, PR = 2, जहां = C m = 9.48। 10 -5 mol/l, a = 2 =1.89610 -4.
,
कहाँ एम- विलेय का द्रव्यमान (g), M - दाढ़ द्रव्यमान (g/mol), वी- समाधान की मात्रा (एल)। एम (एजी 2
सीआरओ 4
)
=332 ग्राम/मोल. सेमी =9.48. 10 -5 मोल/ली. सिल्वर (I) क्रोमेट का विघटन नमक के पूर्ण ( = 1) पृथक्करण के साथ होता है: Ag 2 CrO 4 ↔ 2Ag + +CrO 4 2-, PR = 2, जहां = C m = 9.48। 10 -5 mol/l, a = 2 =1.89610 -4.
इस प्रकार पीआर = (1.89610 -4) 2 (9.4810 -5) = 3.410 -12।
समस्या 7. क्या CaCO 3 C 1 = 10 -2 M और C 2 = 10 -6 M की सांद्रता के साथ CaCO 3 नमक का घोल तैयार करना संभव है, यदि PR CaCO 3 = 3.810 -9।
समाधान: पीआर मान जानकर आप एकाग्रता की गणना कर सकते हैं
संतृप्त नमक समाधान और प्रस्तावित के साथ इसकी तुलना
सांद्रता, समाधान तैयार करने की संभावना या असंभवता के बारे में निष्कर्ष निकालें। कैल्शियम कार्बोनेट का विघटन इस समीकरण में CaCO 3 ↔Ca 2+ +CO 3 2- योजना के अनुसार होता है एन = एम = 1 तो
 =
=
 ≈ 6.2 10 -5 मोल/ली,
≈ 6.2 10 -5 मोल/ली,
सी 1 > सी एम - घोल तैयार नहीं किया जा सकता, क्योंकि अवक्षेप बनेगा;
सी 2< С м – раствор приготовить можно.
आयन विनिमय प्रतिक्रियाएँ
इलेक्ट्रोलाइट समाधान आयन विनिमय प्रतिक्रियाओं की विशेषता रखते हैं। ऐसी प्रतिक्रियाओं के लगभग पूरी तरह से घटित होने के लिए एक शर्त समाधान से कुछ आयनों को हटाना है:
1) तलछट का निर्माण
FeSO 4 + 2 NaOH Fe(OH) 2 + Na 2 SO 4 - आणविक समीकरण (MU)
Fe 2+ +SO 4 2- +2Na + +2OH - Fe(OH) 2 +2Na + +SO 4 2- आयन-आणविक समीकरण (IMU)।
Fe 2+ +2OH - Fe(OH) 2 (PR Fe (OH) 2 = 4.810 -16) - अवक्षेप के निर्माण के लिए एक संक्षिप्त आयन-आणविक समीकरण;
2) गैस निकलना
Na 2 CO 3 + 2H 2 SO 4 H 2 CO 3 + 2NaHSO 4 (MU)
2Na + +CO 3 2- + 2H + + 2HSO 4 - H 2 C0 3 + 2Na + + 2HSO 4 - (IMU)
2H + + CO 3 2- H 2 C0 3 H 2 O + C0 2 - आयन - आणविक स्तर
एक अस्थिर यौगिक का निर्माण.
3) कमजोर इलेक्ट्रोलाइट्स का निर्माण
ए) सरल पदार्थ:
2KCN + H 2 SO 4 2HCN + K 2 SO 4 (MU)
2K + + 2CN - + 2H + +SO 4 2- 2HCN + 2K + +SO 4 2- (IMU)
सीएन - +एच + एचसीएन (के डी एचसीएन = 7.8 · 10 -10) - कमजोर इलेक्ट्रोलाइट एचसीएन के गठन का आयन-आणविक स्तर।
बी) जटिल यौगिक:
ZnCl 2 + 4NH 3 Cl 2 (MU)
Zn 2+ + 2Cl - +4NH 3 2+ + 2Cl - -(IMU)
Zn 2+ +4NH 3 2+ - एक जटिल धनायन के निर्माण के लिए एक संक्षिप्त आयनिक-आणविक समीकरण।
ऐसी प्रक्रियाएं हैं जिनमें कमजोर इलेक्ट्रोलाइट्स या खराब घुलनशील यौगिक शुरुआती सामग्रियों और प्रतिक्रिया उत्पादों में से हैं। इस मामले में, संतुलन उन पदार्थों के निर्माण की ओर स्थानांतरित हो जाता है जिनका पृथक्करण स्थिरांक सबसे कम होता है या कम घुलनशील पदार्थ के निर्माण की ओर होता है:
ए) एनएच 4 ओएच + एचसीएल एनएच 4 सीएल + एच 2 ओ (एमयू)
एनएच 4 ओएच + एच + + सीएल - एनएच 4 + + सीएल - + एच 2 ओ
एनएच 4 ओएच + एच + एनएच 4 + + एच 2 ओ (आईएमयू)
के डी (एनएच 4 ओएच) =1.8 10 -5 > के डी (एच 2 ओ) =1.810 -16.
संतुलन पानी के अणुओं के निर्माण की ओर स्थानांतरित हो जाता है।
बी) AgCl + NaI AgI + NaCl (MU)
AgCl + Na + +I - AgI+ Na + +Cl -
AgCl + I - AgI + Cl - (IMU)
वगैरह AgCl =1.7810 -10 > वगैरहएजीआई =8.310 -17.
संतुलन AgI अवक्षेप के निर्माण की ओर स्थानांतरित हो जाता है।
सी) ऐसी प्रक्रियाएं हो सकती हैं जिनके समीकरणों में खराब घुलनशील यौगिक और कमजोर इलेक्ट्रोलाइट दोनों हों
एमएनएस + 2एचसीएल एमएनसीएल 2 + एच 2 एस (एमयू)
एमएनएस + 2एच + +2सीएल - एमएन 2+ + 2सीएल - + एच 2 एस
एमएनएस + 2 एच + एमएन 2+ + एच 2 एस (आईएमयू)
पीआर एमएनएस =2.510 -10 ; =  =1.58.10 -5 मोल/ली
=1.58.10 -5 मोल/ली
के डी एच 2 एस = के 1 के 2 = 610 -22; =  =5.4.10 -8 मोल/ली
=5.4.10 -8 मोल/ली
S 2- आयनों का H 2 S अणुओं में बंधन MnS की तुलना में अधिक पूर्ण रूप से होता है, इसलिए प्रतिक्रिया H 2 S के निर्माण की ओर आगे की दिशा में आगे बढ़ती है।
लवणों का जल अपघटन
हाइड्रोलिसिस उनके हाइड्रेशन शेल के साथ नमक आयनों के ध्रुवीकरण संपर्क का परिणाम है। हाइड्रोलिसिस पानी के अणुओं और नमक आयनों के बीच समाधान में एक विनिमय प्रतिक्रिया है। हाइड्रोलिसिस के परिणामस्वरूप, एक कमजोर इलेक्ट्रोलाइट (कमजोर एसिड या कमजोर आधार) के गठन के कारण, आयनिक संतुलन H 2 O⇄H + + OH - H + या OH के बंधन के कारण बदल जाता है - और pH वातावरण बदल जाता है . जिन लवणों में कमजोर अम्ल या कमजोर क्षार आयन होते हैं, वे जल-अपघटन से गुजरते हैं। प्रबल अम्ल और प्रबल क्षार के आयनों से बनने वाले लवण जल अपघटन (NaCl, Na 2 SO 4) से नहीं गुजरते। हाइड्रोलिसिस के उत्पाद कमजोर इलेक्ट्रोलाइट्स, खराब रूप से अलग करने वाले, कम घुलनशील और अस्थिर पदार्थ हो सकते हैं। हाइड्रोलिसिस एक चरणबद्ध प्रतिक्रिया है; एक बहुआवेशित आयन के मामले में, चरणों की संख्या उसके आवेश के बराबर होती है। हाइड्रोलिसिस द्वारा कटियनमजबूत अम्ल आयनों और कमजोर आधार धनायनों द्वारा निर्मित लवण प्रभावित होते हैं। उदाहरण के लिए, कमजोर आधारों में हाइड्रॉक्साइड शामिल हैं पी- और डी-धातुएँ (K d 10 -4), साथ ही अमोनियम हाइड्रॉक्साइड।
जिंक क्लोराइड एक नमक है जो कमजोर आधार Zn(OH) 2 और मजबूत एसिड HCl से बनता है। जिंक धनायन का चार्ज 2+ है, इसलिए हाइड्रोलिसिस दो चरणों में होगा:
Zn 2+ + HOH ↔ ZnOH + + H + I चरण
ZnOH + +HOH↔ Zn(OH) 2 +H + II चरण
इस अंतःक्रिया के परिणामस्वरूप, H + आयनों की अधिकता प्रकट होती है ([H + ] [OH - ]), घोल अम्लीकृत होता है (pH<7).
हाइड्रोलिसिस द्वारा ऋणायन. इस प्रकार की हाइड्रोलिसिस एक कमजोर एसिड (K d 10 -3) के आयनों और एक मजबूत आधार (K d >10 -3) के धनायनों द्वारा निर्मित लवणों की विशेषता है। आइए पोटेशियम कार्बोनेट के हाइड्रोलिसिस पर विचार करें - कमजोर कार्बोनिक एसिड एच 2 सीओ 3 (के डी आई) द्वारा गठित नमक = 4.5. 10 -7) और मजबूत आधार KOH, कार्बोक्सो आयन का चार्ज (2-) होता है। हाइड्रोलिसिस दो चरणों में होता है:
CO 3 2- +H 2 O↔HCO 3 - +OH - चरण I
HCO 3 - +H 2 O↔H 2 CO 3 +OH - II चरण
इस स्थिति में, OH - आयन निकलते हैं ([H + ] [OH - ]) - घोल क्षारीय हो जाता है (pH > 7)।
अपरिवर्तनीय हाइड्रोलिसिस. कमजोर आधार और कमजोर अम्ल से बने लवण धनायन और ऋणायन पर जल-अपघटित हो जाते हैं। हाइड्रोलिसिस का परिणाम मूल्य पर निर्भर करेगा क्षार और अम्ल को डी करने के लिए. आइए अमोनियम फ्लोराइड के हाइड्रोलिसिस पर विचार करें, जो कमजोर से बनने वाला नमक है
आधार NH 4 OH (K d = 1.8 . 10 -5) और कमजोर अम्ल HF (K d = 6.8 . 10 -4):
एनएच 4 एफ + एचओएच एनएच 4 ओएच + एचएफ
इस मामले में के डी (एनएच 4 ओएच) के डी (एचएफ), इसलिए, हाइड्रोलिसिस (मुख्य रूप से) धनायन के साथ आगे बढ़ेगा और माध्यम की प्रतिक्रिया थोड़ी अम्लीय होगी।
इलेक्ट्रोलाइट समाधानों के बीच प्रतिक्रियाओं का आदान-प्रदान
अभिक्रियाएँ जिससे अवक्षेप का निर्माण होता है। एक परखनली में 3-4 मिलीलीटर कॉपर (आई) सल्फेट घोल डालें, दूसरे में उतनी ही मात्रा में कैल्शियम क्लोराइड घोल और तीसरे में एल्यूमीनियम सल्फेट डालें। पहली टेस्ट ट्यूब में थोड़ा सा सोडियम हाइड्रॉक्साइड घोल, दूसरे में सोडियम ऑर्थोफोस्फेट घोल और तीसरे में बेरियम नाइट्रेट घोल मिलाएं। सभी परखनलियों में अवक्षेप बनता है।
व्यायाम। प्रतिक्रिया समीकरण आणविक, आयनिक और संक्षिप्त आयनिक रूप में लिखें। बताएं कि वर्षा क्यों हुई। किन अन्य पदार्थों के घोल को टेस्ट ट्यूब में डाला जा सकता है जिससे अवक्षेपण हो सके? इन प्रतिक्रियाओं के लिए आणविक, आयनिक और संक्षिप्त आयनिक रूप में समीकरण लिखें।
ऐसी प्रतिक्रियाएँ जिनमें गैस का निकलना शामिल है। एक परखनली में 3-4 मिली सोडियम सल्फाइट घोल और दूसरी में उतनी ही मात्रा में सोडियम कार्बोनेट घोल डालें। उनमें से प्रत्येक में समान मात्रा में सल्फ्यूरिक एसिड मिलाएं। पहली टेस्ट ट्यूब तीखी गंध वाली गैस छोड़ती है, दूसरी टेस्ट ट्यूब गंधहीन गैस छोड़ती है।
व्यायाम। आणविक, आयनिक और संक्षिप्त आयनिक रूप में होने वाली प्रतिक्रियाओं के लिए समीकरण लिखें। इस बारे में सोचें कि समान परिणाम प्राप्त करने के लिए इन समाधानों में कौन से अन्य एसिड लागू किए जा सकते हैं। इन प्रतिक्रियाओं के लिए आणविक, आयनिक और संक्षिप्त आयनिक रूप में समीकरण लिखें।
प्रतिक्रियाएँ जो कि थोड़ा अलग करने वाले पदार्थ के निर्माण के साथ होती हैं। एक परखनली में 3-4 मिलीलीटर सोडियम हाइड्रॉक्साइड घोल डालें और फिनोलफथेलिन की दो या तीन बूंदें डालें। घोल का रंग गहरा लाल हो जाता है। फिर हाइड्रोक्लोरिक या सल्फ्यूरिक एसिड मिलाएं जब तक कि रंग फीका न हो जाए।
एक अन्य परखनली में लगभग 10 मिलीलीटर कॉपर (II) सल्फेट डालें और कुछ सोडियम हाइड्रॉक्साइड घोल डालें। कॉपर (II) हाइड्रॉक्साइड का नीला अवक्षेप बनता है। अवक्षेप के घुलने तक सल्फ्यूरिक एसिड को परखनली में डालें।
व्यायाम। आणविक, आयनिक और संक्षिप्त आयनिक रूप में होने वाली प्रतिक्रियाओं के लिए समीकरण लिखें। स्पष्ट करें कि पहली परखनली में मलिनकिरण क्यों हुआ, और दूसरी में अवक्षेप का विघटन क्यों हुआ। घुलनशील और अघुलनशील क्षारों में कौन से सामान्य गुण होते हैं?
क्लोराइड आयन के लिए गुणात्मक प्रतिक्रिया। एक परखनली में 1-2 मिलीलीटर पतला हाइड्रोक्लोरिक एसिड, दूसरी में उतनी ही मात्रा में सोडियम क्लोराइड घोल और तीसरी में कैल्शियम क्लोराइड घोल डालें। सभी परखनलियों में सिल्वर(I) नाइट्रेट घोल AgNO3 की कुछ बूंदें डालें। जाँच करें कि अवक्षेप सांद्र नाइट्रिक एसिड में घुल गया है या नहीं।
व्यायाम। आणविक, आयनिक और संक्षिप्त आयनिक रूप में संबंधित रासायनिक प्रतिक्रियाओं के समीकरण लिखें। इस बारे में सोचें कि आप कैसे अंतर कर सकते हैं: ए) अन्य एसिड से हाइड्रोक्लोरिक एसिड; बी) अन्य लवणों से क्लोराइड; ग) हाइड्रोक्लोरिक एसिड से क्लोराइड का समाधान। आप सिल्वर(I) नाइट्रेट घोल के बजाय लेड(II) नाइट्रेट घोल का उपयोग क्यों कर सकते हैं?
पाठ आयन विनिमय प्रतिक्रियाओं को पूरा करने के लिए आगे बढ़ने की स्थितियों की जांच करेगा। बेहतर ढंग से समझने के लिए कि आयन एक्सचेंज प्रतिक्रियाओं को पूरा करने के लिए किन स्थितियों का पालन किया जाना चाहिए, हम समीक्षा करेंगे कि ये प्रतिक्रियाएं क्या हैं और उनका सार क्या है। इन अवधारणाओं को सुदृढ़ करने के लिए उदाहरण दिए गए हैं।
विषय: रासायनिक बंधन. इलेक्ट्रोलाइटिक पृथक्करण
पाठ: प्रवाह की स्थितियाँपूरा होने तक आयन विनिमय प्रतिक्रियाएँ
यदि आप सोडियम हाइड्रॉक्साइड को पोटेशियम क्लोराइड के साथ प्रतिक्रिया करने का प्रयास करते हैं, तो प्रतिक्रिया नहीं होगी। किसी प्रतिक्रिया में, आयनों का आदान-प्रदान होता है, लेकिन कोई उत्पाद नहीं बनता है। आइये इसके कारणों पर नजर डालते हैं। परस्पर आकर्षण के परिणामस्वरूप बने पदार्थ विघटित हो सकते हैं।
1. आयन विनिमय प्रतिक्रियाओं से अवक्षेप का निर्माण होता है।
पहले, प्रतिक्रिया समीकरणों पर विचार किया जाता था जिसके परिणामस्वरूप अवक्षेप का निर्माण होता था।
ये सभी प्रतिक्रियाएँ आयन विनिमय प्रतिक्रियाओं से संबंधित थीं। यह निष्कर्ष निकाला जा सकता है कि आयन विनिमय प्रतिक्रिया के पूरा होने की शर्तों में से एक अवक्षेप का निर्माण है।
BaCl 2 + Na 2 CO 3 → BaCO 3 ↓ + 2NaCl।
Ba 2+ +2Cl - + 2Na + + CO 3 2- →BaCO 3 ↓ + 2Na + +2Cl - पूर्ण आयनिक समीकरण
Ba 2+ + CO 3 2- → BaCO 3 ↓ संक्षिप्त आयनिक समीकरण।
आइए अवक्षेप के निर्माण के लिए एक अन्य प्रतिक्रिया समीकरण लिखें।
CuSO 4 + 2NaOH → Cu(OH) 2 ↓ + Na 2 SO 4
Cu 2+ + SO 4 2- +2Na + + 2OH - → Cu(OH) 2 ↓ + 2Na + + SO 4 2- पूर्ण आयनिक समीकरण
Cu 2+ + 2OH - → Cu(OH) 2 ↓ संक्षिप्त आयनिक समीकरण।
निष्कर्ष:यदि परिणाम अवक्षेप हो तो आयन विनिमय प्रतिक्रियाएं पूरी होने लगती हैं।
चावल। 1. उदासीनीकरण प्रतिक्रिया ()
हाइड्रोक्लोरिक एसिड के साथ सोडियम हाइड्रॉक्साइड के उदासीनीकरण की प्रतिक्रिया पर विचार करें।
NaOH + HCl → NaCl+ H 2 O
Na + + OH - + H + + Cl - →Na + + Cl - + H 2 O पूर्ण आयनिक समीकरण
OH - + H + → H 2 O कम आयनिक समीकरण
यह प्रतिक्रिया पूर्णता की ओर बढ़ती है, क्योंकि परिणाम थोड़ा अलग करने वाला पदार्थ है - पानी।
निष्कर्ष:यदि परिणाम थोड़ा अलग करने वाला पदार्थ हो तो आयन विनिमय प्रतिक्रियाएं पूरी होने लगती हैं।
आप जानते हैं कि कैल्शियम कार्बोनेट हाइड्रोक्लोरिक अम्ल के साथ अच्छी तरह प्रतिक्रिया करता है।
CaCO 3 +2HCl → CaCl 2 + H 2 O + CO 2
CaCO 3 +2H + + 2Cl - → Ca 2+ +2Cl - + H 2 O + CO 2 पूर्ण आयनिक समीकरण
2H + + CaCO 3 → Ca 2+ + H 2 O + CO 2 संक्षिप्त आयनिक समीकरण।
इस प्रतिक्रिया के परिणामस्वरूप, कार्बन डाइऑक्साइड उत्पन्न होता है, जो कमजोर कार्बोनिक एसिड के अपघटन के दौरान बनता है। कृपया ध्यान दें कि कैल्शियम कार्बोनेट एक अघुलनशील पदार्थ है और आयनों में टूटता नहीं है। संपूर्ण आयनिक समीकरण में हम केवल हाइड्रोजन क्लोराइड और कैल्शियम क्लोराइड को आयन के रूप में लिखते हैं। शेष सूत्र अपरिवर्तित रहते हैं, क्योंकि ये पदार्थ उजागर नहीं होते हैं।
निष्कर्ष:यदि उनके परिणामस्वरूप गैस बनती है तो आयन विनिमय प्रतिक्रियाएं पूरी हो जाती हैं।
इस पाठ में, आपने आयन विनिमय प्रतिक्रियाओं को पूरा करने के लिए शर्तों की जांच की। यदि परिणाम एक अवक्षेप, थोड़ा अलग करने वाला पदार्थ या गैस है तो आयन विनिमय प्रतिक्रियाएं पूरी हो जाती हैं।
1. रुडज़ाइटिस जी.ई. अकार्बनिक और कार्बनिक रसायन विज्ञान. 9वीं कक्षा: सामान्य शिक्षा संस्थानों के लिए पाठ्यपुस्तक: बुनियादी स्तर / जी.ई. रुडज़ाइटिस, एफ.जी. फेल्डमैन. एम.: आत्मज्ञान। 2009 119 पी.: बीमार।
2. पोपेल पी.पी. रसायन विज्ञान: 8वीं कक्षा: सामान्य शिक्षा संस्थानों के लिए पाठ्यपुस्तक / पी.पी. पोपेल, एल.एस. क्रिवल्या। -के.: आईसी "अकादमी", 2008.-240 पी.: बीमार।
3. गेब्रियलियन ओ.एस. रसायन विज्ञान। 9 वां दर्जा। पाठ्यपुस्तक। प्रकाशक: बस्टर्ड: 2001. 224s.
1. क्रमांक 3,4,5 (पृ.22) रुडजाइटिस जी.ई. अकार्बनिक और कार्बनिक रसायन विज्ञान. 9वीं कक्षा: सामान्य शिक्षा संस्थानों के लिए पाठ्यपुस्तक: बुनियादी स्तर / जी.ई. रुडज़ाइटिस, एफ.जी. फेल्डमैन. एम.: आत्मज्ञान। 2009 119 पी.: बीमार।
2. आटा बनाते समय जब आप सोडा में सिरका मिलाते हैं तो आप क्या देखते हैं? प्रतिक्रिया समीकरण लिखें.
3. केतली में स्केल क्यों बनता है? इसे कैसे दूर करें? प्रतिक्रिया समीकरण लिखें.
लक्ष्य:
- छात्रों को आयन विनिमय प्रतिक्रियाओं और उनके घटित होने की स्थितियों के बारे में ज्ञान प्राप्त करना चाहिए।
- पदार्थों के पृथक्करण के समीकरण लिखने का कौशल विकसित करना जारी रखें;
- घुलनशीलता तालिका के साथ काम करें;
- इलेक्ट्रोलाइट्स और गैर-इलेक्ट्रोलाइट्स को पहचानते समय, तुलना, अवलोकन करते समय तार्किक सोच विकसित करना; व्यावहारिक कौशल और क्षमताएं विकसित करना, निष्कर्ष निकालना;
- आणविक, पूर्ण आयनिक और कम आयनिक रूपों में प्रतिक्रिया समीकरण लिखें।
तरीके और कार्यप्रणाली तकनीक:मौखिक-दृश्य, अनुमानी, समूह ललाट प्रयोगशाला कार्य।
उपकरण:
- छात्रों के डेस्क पर: H 2 SO 4, BaCl 2, Na 2 CO 3, फिनोलफथेलिन, NaOH, 4 सीरिंज, टैबलेट, घुलनशीलता तालिका, भरने के लिए तालिका।
- शिक्षक को: H 2 SO 4, BaCl 2, Na 2 CO 3, फिनोलफथेलिन, NaOH, 3 टेस्ट ट्यूब, 2 कंटेनरों में: सोडा और नमक, पानी, एसिटिक एसिड।
कक्षाओं के दौरान
1. संगठनात्मक क्षण.
2. लक्ष्य निर्धारण.
अध्यापक. दोस्तों, कल्पना कीजिए कि आपकी रसोई में बिना लेबल वाले 2 समान जार में नमक और सोडा है। आप इन दोनों पदार्थों को बिना चखे कैसे पहचान सकते हैं?
अध्यापक। इसका पता लगाने के लिए, हमें आयन विनिमय प्रतिक्रियाओं से परिचित होना होगा, उनकी घटना के लिए शर्तों को निर्धारित करना होगा, और पूर्ण, संक्षिप्त आयनिक समीकरण लिखना सीखना होगा। आयन विनिमय प्रतिक्रियाओं के तंत्र को बेहतर ढंग से समझने के लिए, आइए याद रखें कि किन पदार्थों को इलेक्ट्रोलाइट्स कहा जाता है।
विद्यार्थी। इलेक्ट्रोलाइट्स ऐसे पदार्थ हैं जो पिघले और घोल में विद्युत प्रवाह का संचालन करते हैं।
अध्यापक। विलयनों और पिघलों में इलेक्ट्रोलाइट्स विद्युत धारा का संचालन क्यों करते हैं?
विद्यार्थी। इलेक्ट्रोलाइट्स बिजली का संचालन करते हैं क्योंकि आयन विलयन में बनते हैं और पिघलते हैं।
अध्यापक। इलेक्ट्रोलाइटिक पृथक्करण क्या है?
विद्यार्थी। इलेक्ट्रोलाइट के आयनों में टूटने की प्रक्रिया को इलेक्ट्रोलाइटिक पृथक्करण कहा जाता है।
अध्यापक। आइए विभिन्न पदार्थों के लिए पृथक्करण समीकरण लिखें। (3 छात्र बोर्ड पर कार्ड पर काम करते हैं):
- कार्ड नंबर 1. पदार्थों के लिए सारांश पृथक्करण समीकरण लिखें: एच 2 एसओ 4, एचसीएल।
- कार्ड नंबर 2. पदार्थों के लिए समग्र पृथक्करण समीकरण लिखें: Na 2 CO 3, BaCl 2।
- कार्ड संख्या 3. पदार्थों के लिए कुल पृथक्करण समीकरण लिखें: NaOH, Ba(OH) 2
अध्यापक। कक्षा असाइनमेंट: पदार्थों की इस सूची से इलेक्ट्रोलाइट्स और गैर-इलेक्ट्रोलाइट्स का चयन करें।
KCl, CuO, CuSO 4, Cu(OH) 2, BaSO 4, K 2 SO 4। (एक शीट से).
इलेक्ट्रोलाइट्स के लिए, सारांश पृथक्करण समीकरण लिखें। (ब्लैकबोर्ड पर).
अध्यापक। आइए बोर्ड पर नोट्स की जाँच करें।
अध्यापक। दोस्तों, नाम बताएं कि अघुलनशील पदार्थ BaSO4 किन आयनों से बनता है?
विद्यार्थी. बेरियम सल्फेट बेरियम आयनों और सल्फेट आयनों से बनता है।
अध्यापक। घुलनशीलता तालिका का उपयोग करके उन पदार्थों के नाम बताएं, जिनके घोल में Ba 2+ आयन और SO 4 2- होते हैं?
विद्यार्थी। उदाहरण के लिए, बेरियम क्लोराइड और सल्फ्यूरिक एसिड।
अध्यापक। आइए H 2 SO 4 और BaCl 2 (ब्लैकबोर्ड पर छात्र) के बीच प्रतिक्रिया के लिए समीकरण लिखें।
BaCl2 + H2SO4 = BaSO4 + 2HCl
अध्यापक। इलेक्ट्रोलाइट विलयनों में होने वाली प्रतिक्रियाओं को आयन विनिमय प्रतिक्रियाएँ कहा जाता है। यह पता लगाने के लिए कि आयन विनिमय प्रतिक्रियाएँ किन परिस्थितियों में होती हैं, आइए प्रयोगशाला कार्य करें:
उद्देश्य: ऐसी प्रतिक्रियाओं की स्थितियों से परिचित होना। (नोटबुक में लिखें)
अनुभव क्रमांक 1. BaSO 4 प्राप्त करना। (अनुभव के बजाय, आप "वर्चुअल स्कूल ऑफ़ सिरिल एंड मेथोडियस" 9वीं कक्षा के पाठ संख्या 6 से एक पाठ के टुकड़े का उपयोग कर सकते हैं)
शिक्षक ब्लैकबोर्ड पर भी ऐसा ही करता है।
शिक्षक टिप्पणी करते हैं: BaCl2 समाधान में H2SO4 का एक समाधान जोड़ें। हम क्या देखते हैं?
विद्यार्थी: एक सफेद अवक्षेप गिरा।
शिक्षक: आइए पूरा आयनिक समीकरण लिखें; इसके लिए हम लिखते हैं कि लिए गए पदार्थों के घोल में कौन से आयन थे और कौन से पदार्थ बने।
2H 1+ + SO 4 2- + Ba 2+ +2Cl 1- - > BaSO 4v + 2H 1+ +2Cl 1-
यह संपूर्ण आयनिक समीकरण है.
यदि हम समीकरण के दाएं और बाएं पक्षों को समान आयनों से कम करते हैं, तो हमें संक्षिप्त आयनिक समीकरण मिलता है।
SO 4 2- + Ba 2+ -> BaSO 4v
बहस:
कक्षा के लिए प्रश्न:
- प्रतिक्रिया से पहले घोल में कौन से आयन मौजूद थे?
- प्रतिक्रिया के बाद घोल में कौन से आयन बचे रहे?
- इन प्रतिक्रियाओं का सार क्या है?
कक्षा के साथ बातचीत: हम चर्चा करते हैं कि प्रतिक्रिया का सार यह है कि बा 2+ और एसओ 4 2- आयनों का बंधन हुआ।
यह समीकरण इस प्रतिक्रिया का सार दर्शाता है.
अनुभव क्रमांक 2.कार्बन डाइऑक्साइड प्राप्त करना।
शिक्षक टिप्पणी करते हैं: Na 2 CO 3 घोल में H 2 SO 4 का घोल मिलाएं। (1 छात्र बोर्ड पर प्रतिक्रिया लिखता है)
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + H 2 O + CO 2
हम क्या देख रहे हैं?
विद्यार्थी: गैस के बुलबुले निकलना।
शिक्षक पूर्ण आयनिक समीकरण और संक्षिप्त आयनिक समीकरण लिखता है।
2Na 1+ +CO 3 2- +2H 1+ +SO 4 2- - >2Na 1+ + SO 4 2- + H 2 O+ CO 2
CO 3 2- +2H 1+ ->H 2 O+ CO 2
अनुभव क्रमांक 3.एच 2 ओ (कम विघटित पदार्थ) का निर्माण।
शिक्षक टिप्पणी करते हैं: NaOH समाधान में फ़ेथलीन फिनोल की 1-2 बूँदें जोड़ें, समाधान लाल रंग का हो जाता है, H 2 SO 4 जोड़ें। (1 छात्र बोर्ड पर प्रतिक्रिया लिखता है)
2 NaOH + H 2 SO 4 = Na 2 SO 4 + 2 H 2 O
हम क्या देख रहे हैं?
विद्यार्थी। घोल रंगहीन हो गया.
अध्यापक। आइए पूर्ण आयनिक समीकरण और संक्षिप्त आयनिक समीकरण को बोर्ड (1 छात्र) पर लिखें।
2Na 1+ +2OH 1- +2H 1+ + SO 4 2- ->2Na 1+ + SO 4 2- + 2H 2 O
2OH 1- +2H 1+ ->2H 2 O
| प्रतिक्रिया की स्थितियाँ इलेक्ट्रोलाइट समाधानों के बीच (छात्र द्वारा पूरा किया जाना है)। |
आयन विनिमय प्रतिक्रियाओं के उदाहरण. |
| 1. | Na 2 CO 3 +CaCl 2 =CaCO 3 +2NaCl 2Na + + CO 3 2- +Ca 2+ + 2Cl - = CaCO 3 +2Na + + 2Cl - Ca 2+ + CO 3 2- = CaCO 3 |
| 2. | K 2 CO 3 +2HCl =2KCl+H 2 O+CO 2 2K + + CO 3 2- +2H + +2Cl - =2K + +2Cl - +H 2 O+CO 2 CO 3 2- +2H + = CO 2 ^+H 2 O |
| 3. | NaOH+HNO 3 = NaNO 3 +H 2 O Na + +OH - +H + +NO 3 =Na + +NO 3 - + H 2 O एच + + ओएच - =एच 2 ओ |
शिक्षक: दोस्तों, हमने आयन विनिमय अभिक्रियाएँ कीं। आइए निष्कर्ष निकालें: आयन विनिमय प्रतिक्रियाएं किन परिस्थितियों में पूरी होती हैं? (दी गई तालिकाएँ भरें)
विद्यार्थी:आयन विनिमय प्रतिक्रियाएं पूरी होने की ओर अग्रसर होती हैं यदि, परिणामस्वरूप, एक अवक्षेप बनता है, एक गैस निकलती है, और एक खराब रूप से विघटित होने वाला पदार्थ, जैसे कि पानी, बनता है।
शिक्षक: चलिए अपनी समस्या पर वापस आते हैं। नमक (NaCl) और सोडा (Na 2 CO 3) को पहचानने की एक विधि सुझाएँ।
छात्र: आपको इन पदार्थों में एसिड मिलाना होगा। जिस पात्र में गैस का विकास देखा जाएगा, वहां सोडा होगा।
सामग्री को ठीक करना:
बोर्ड में कार्य: 1 इस सूची में से उन प्रतिक्रियाओं का चयन करें जो अंत तक जाती हैं (एक छात्र)
NaOH+ NaCl -> NaCl+ H 2 O
AgNO 3 + NaCl ->NaNO 3 + AgCl
CuCl 2 +2NaOH ->Cu(OH) 2 +2NaCl
KNO 3 +LiCl ->KCl+LiNO 3
दिया गया:
पूर्ण आयनिक समीकरण.
Fe 3+ +3Cl - +3Na + +3OH - = Fe(OH) 3 +3Na + +3Cl -
तदनुसार आणविक एवं संक्षिप्त आयनिक समीकरण लिखिए।
अध्यापक।आइए अपने पाठ का सारांश प्रस्तुत करें: पाठ में हम किन प्रतिक्रियाओं से परिचित हुए?
विद्यार्थी।हमने आयन एक्सचेंज प्रतिक्रियाओं के बारे में सीखा।
अध्यापक. किन परिस्थितियों में इन प्रतिक्रियाओं का पूरा होना संभव है?
विद्यार्थी। यदि एक अवक्षेप बनता है, एक गैस निकलती है, और थोड़ा अलग करने वाला पदार्थ बनता है तो आयन विनिमय प्रतिक्रियाएं पूरी होने लगती हैं।
अध्यापक। गृहकार्य: §37 व्यायाम। 4, 5.
साहित्य।
- गेब्रियलियन ओ.एस. रसायन विज्ञान। 8वीं कक्षा: बस्टर्ड, 1999।
- "वर्चुअल स्कूल ऑफ़ सिरिल एंड मेथोडियस" रसायन विज्ञान पाठ 8-9 ग्रेड, 2004।
प्रस्तावित सामग्री 9वीं कक्षा के लिए व्यावहारिक कार्य के पद्धतिगत विकास प्रस्तुत करती है: "नाइट्रोजन और फास्फोरस", "खनिज उर्वरकों का निर्धारण" विषय पर प्रयोगात्मक समस्याओं का समाधान, साथ ही "इलेक्ट्रोलाइट समाधानों के बीच विनिमय प्रतिक्रियाओं" विषय पर प्रयोगशाला प्रयोग।
इलेक्ट्रोलाइट समाधानों के बीच प्रतिक्रियाओं का आदान-प्रदान
पद्धतिगत विकास में तीन भाग होते हैं: सिद्धांत, कार्यशाला, नियंत्रण। सैद्धांतिक भाग रासायनिक प्रतिक्रियाओं के आणविक, पूर्ण और संक्षिप्त आयनिक समीकरणों के कुछ उदाहरण प्रदान करता है जो एक अवक्षेप के गठन, थोड़ा अलग करने वाले पदार्थ और गैस की रिहाई के साथ होते हैं। व्यावहारिक भाग में प्रयोगशाला प्रयोगों को करने के तरीके पर छात्रों के लिए कार्य और सिफारिशें शामिल हैं। नियंत्रण में सही उत्तर के चयन के साथ परीक्षण कार्य शामिल हैं।
लिखित
1. अभिक्रियाएँ जिससे अवक्षेप का निर्माण होता है।
ए) जब कॉपर (II) सल्फेट सोडियम हाइड्रॉक्साइड के साथ प्रतिक्रिया करता है, तो कॉपर (II) हाइड्रॉक्साइड का एक नीला अवक्षेप बनता है।
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4।
Cu 2+ + + 2Na + + 2OH - = Cu(OH) 2 + 2Na + +,
Cu 2+ + 2OH - = Cu(OH) 2.
बी) जब बेरियम क्लोराइड सोडियम सल्फेट के साथ प्रतिक्रिया करता है, तो बेरियम सल्फेट का एक सफेद दूधिया अवक्षेप बनता है।
रासायनिक प्रतिक्रिया का आणविक समीकरण:
BaCl 2 + Na 2 SO 4 = 2NaCl + BaSO 4.
पूर्ण और संक्षिप्त आयनिक प्रतिक्रिया समीकरण:
बा 2+ + 2Cl – + 2Na + + = 2Na + + 2Cl – + BaSO 4,
बा 2+ + = बासो 4।
2.
जब सोडियम कार्बोनेट या बाइकार्बोनेट (बेकिंग सोडा) हाइड्रोक्लोरिक या अन्य घुलनशील एसिड के साथ परस्पर क्रिया करता है, तो उबलने या गैस के बुलबुले निकलने की तीव्रता देखी जाती है। इससे कार्बन डाइऑक्साइड CO2 निकलती है, जिससे चूने के पानी (कैल्शियम हाइड्रॉक्साइड) के स्पष्ट घोल में बादल छा जाते हैं। चूने का पानी गंदला हो जाता है क्योंकि... अघुलनशील कैल्शियम कार्बोनेट बनता है।
ए) Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2;
बी) NaHCO 3 + HCl = NaCl + CO 2 + H 2 O;
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O.
ए) 2Na + + + 2H + + 2Cl - = 2Na + + 2Cl - + CO 2 + H 2 O,
2एच + = सीओ 2 + एच 2 ओ;
बी) ना + + + एच + + सीएल - = ना + + सीएल - + सीओ 2 + एच 2 ओ,
एच + = सीओ 2 + एच 2 ओ.
3. प्रतिक्रियाएँ जो कि थोड़ा अलग करने वाले पदार्थ के निर्माण के साथ होती हैं।
जब सोडियम या पोटेशियम हाइड्रॉक्साइड फिनोलफथेलिन संकेतक की उपस्थिति में हाइड्रोक्लोरिक एसिड या अन्य घुलनशील एसिड के साथ प्रतिक्रिया करता है, तो क्षार समाधान रंगहीन हो जाता है, और तटस्थता प्रतिक्रिया के परिणामस्वरूप, एक कम-विघटित पदार्थ एच 2 ओ बनता है।
रासायनिक प्रतिक्रियाओं के आणविक समीकरण:
ए) NaOH + HCl = NaCl + H 2 O;
ग) 3KOH + H 3 PO 4 = K 3 PO 4 + 3H 2 O.
पूर्ण और संक्षिप्त आयनिक प्रतिक्रिया समीकरण:
ए) ना + + ओएच - + एच + + सीएल - = ना + + सीएल - + एच 2 ओ,
ओह - + एच + = एच 2 ओ;
बी) 2Na + + 2OH - + 2H + + = 2Na + + + 2H 2 O,
2OH - + 2H + = 2H 2 O;
ग) 3K + + 3OH - +3H + + = 3K + + + 3H 2 O,
3OH - + 3H + = 3H 2 O.
कार्यशाला
1. इलेक्ट्रोलाइट समाधानों के बीच प्रतिक्रियाओं के आदान-प्रदान से अवक्षेप का निर्माण होता है।
ए) कॉपर (II) सल्फेट और सोडियम हाइड्रॉक्साइड के घोल के बीच प्रतिक्रिया करें। रासायनिक प्रतिक्रियाओं के आणविक, पूर्ण और संक्षिप्त आयनिक समीकरण लिखें, रासायनिक प्रतिक्रिया के संकेतों पर ध्यान दें।
बी) बेरियम क्लोराइड और सोडियम सल्फेट के घोल के बीच प्रतिक्रिया करें। रासायनिक प्रतिक्रियाओं के आणविक, पूर्ण और संक्षिप्त आयनिक समीकरण लिखें, रासायनिक प्रतिक्रिया के संकेतों पर ध्यान दें।
2. ऐसी प्रतिक्रियाएँ जिनमें गैस का निकलना शामिल है।
हाइड्रोक्लोरिक या अन्य घुलनशील एसिड के साथ सोडियम कार्बोनेट या सोडियम बाइकार्बोनेट (बेकिंग सोडा) के घोल के बीच प्रतिक्रिया करना। छोड़ी गई गैस को (गैस आउटलेट ट्यूब का उपयोग करके) एक अन्य टेस्ट ट्यूब में डाले गए साफ चूने के पानी के माध्यम से तब तक गुजारें जब तक कि वह बादल न बन जाए। रासायनिक प्रतिक्रियाओं के आणविक, पूर्ण और संक्षिप्त आयनिक समीकरण लिखें, इन प्रतिक्रियाओं के संकेतों पर ध्यान दें।
3. प्रतिक्रियाएँ जो कि थोड़ा अलग करने वाले पदार्थ के निर्माण के साथ होती हैं।
क्षार घोल में फिनोलफथेलिन डालने के बाद, क्षार (NaOH या KOH) और अम्ल (HCl, HNO 3 या H 2 SO 4) के बीच उदासीनीकरण प्रतिक्रियाएँ करें। अवलोकनों को नोट करें और रासायनिक प्रतिक्रियाओं के लिए आणविक, पूर्ण और संक्षिप्त आयनिक समीकरण लिखें।
लक्षण, इन प्रतिक्रियाओं के साथ, निम्नलिखित सूची से चुना जा सकता है:
1) गैस के बुलबुले निकलना; 2) अवसादन; 3) गंध की उपस्थिति; 4) तलछट का विघटन; 5) गर्मी रिलीज; 6) घोल का रंग बदलना.
नियंत्रण (परीक्षण)
1. नीला अवक्षेप उत्पन्न करने वाली प्रतिक्रिया के लिए आयनिक समीकरण है:
ए) Cu 2+ + 2OH - = Cu(OH) 2;
ग) Fe 3+ + 3OH - = Fe(OH) 3;
डी) अल 3+ + 3ओएच - = अल(ओएच) 3।
2. जिस प्रतिक्रिया में कार्बन डाइऑक्साइड निकलता है उसका आयनिक समीकरण है:
ए) सीएसीओ 3 + सीओ 2 + एच 2 ओ = सीए 2+ +;
बी) 2एच + + एसओ 2- 3 = एच 2 ओ + एसओ 2;
ग) सीओ 2- 3 + 2एच + = सीओ 2 + एच 2 ओ;
घ) 2H + + 2OH - = 2H 2 O.
3. उस प्रतिक्रिया के लिए आयनिक समीकरण जिसमें कम-विघटनकारी पदार्थ बनता है:
ए) एजी + + सीएल - = एजीसीएल;
बी) ओएच - + एच + = एच 2 ओ;
ग) Zn + 2H + = Zn 2+ + H 2;
घ) Fe 3+ + 3OH - = Fe(OH) 3.
4. सफेद अवक्षेप उत्पन्न करने वाली प्रतिक्रिया के लिए आयनिक समीकरण है:
ए) Cu 2+ + 2OH - = Cu(OH) 2;
बी) CuO + 2H + = Cu 2+ + H 2 O;
ग) Fe 3+ + 3OH - = Fe(OH) 3;
घ) बीए 2+ + एसओ 2- 4 = बीएएसओ 4।
5. आणविक समीकरण जो प्रतिक्रिया 3OH - + 3H + = 3H 2 O के लिए संक्षिप्त आयनिक समीकरण से मेल खाता है:
ए) NaOH + HCl = NaCl + H 2 O;
बी) 2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O;
ग) 3KOH + H 3 PO 4 = K 3 PO 4 + 3H 2 O;
डी) बा(ओएच) 2 + 2एचसीएल = बीएसीएल 2 + एच 2 ओ।
6. आणविक समीकरण जो संक्षिप्त आयनिक प्रतिक्रिया समीकरण से मेल खाता है
एच + + = एच 2 ओ + सीओ 2 , -
ए) एमजीसीओ 3 + 2 एचसीएल = एमजीसीएल 2 + सीओ 2 + एच 2 ओ;
बी) Na 2 CO 3 + 2HCl = 2NaCl + CO 2 + H 2 O;
ग) NaHCO 3 + HCl = NaCl + CO 2 + H 2 O;
डी) सीए(ओएच) 2 + सीओ 2 = सीएसीओ 3 + एच 2 ओ।
| उत्तर. 1 -ए; 2 -वी; 3 -बी; 4 -जी; 5 -वी; 6 -वी. |
"नाइट्रोजन और फास्फोरस" विषय पर प्रयोगात्मक समस्याओं का समाधान
"नाइट्रोजन और फास्फोरस" विषय पर नई सामग्री का अध्ययन करते समय, छात्र अमोनिया के उत्पादन, नाइट्रेट, फॉस्फेट और अमोनियम लवण के निर्धारण से संबंधित प्रयोगों की एक श्रृंखला करते हैं, और कुछ कौशल और क्षमताएं हासिल करते हैं। इस पद्धतिगत विकास में छह कार्य शामिल हैं। व्यावहारिक कार्य को पूरा करने के लिए, तीन कार्य पर्याप्त हैं: एक पदार्थ प्राप्त करने पर, दो पदार्थ को पहचानने पर। व्यावहारिक कार्य करते समय, छात्रों को ऐसे रूप में कार्यों की पेशकश की जा सकती है जिससे उनके लिए रिपोर्ट तैयार करना आसान हो जाएगा (कार्य 1, 2 देखें)। (उत्तर शिक्षक के लिए दिए गए हैं।)
अभ्यास 1
अमोनिया प्राप्त करें और प्रयोगात्मक रूप से इसकी उपस्थिति सिद्ध करें।
ए) अमोनिया का उत्पादन।
गैस आउटलेट ट्यूब के साथ एक टेस्ट ट्यूब में ठोस अमोनियम क्लोराइड और कैल्शियम हाइड्रॉक्साइड पाउडर के बराबर मात्रा वाले मिश्रण को गर्म करें। इस मामले में, अमोनिया जारी किया जाएगा, जिसे एक छेद के साथ स्थित एक अन्य सूखी टेस्ट ट्यूब में एकत्र किया जाना चाहिए ............ ( क्यों?).
अमोनिया के उत्पादन के लिए प्रतिक्रिया समीकरण लिखें।
…………………………………………………..
बी) अमोनिया का निर्धारण.
गंध से पहचाना जा सकता है………… (पदार्थ का नाम), साथ ही लिटमस या फिनोलफथेलिन के रंग में परिवर्तन से। जब अमोनिया को पानी में घोला जाता है, तो ...... बनता है। (आधार का नाम), तो लिटमस टेस्ट...... (रंग निर्दिष्ट करें), और रंगहीन फिनोलफ्थेलिन ………… बन जाता है। (रंग निर्दिष्ट करें).
बिन्दुओं के स्थान पर उनके अर्थ के अनुसार शब्द डालें। प्रतिक्रिया समीकरण लिखें.
…………………………………………………..


* अमोनिया, अमोनिया का एक जलीय घोल, अमोनिया जैसी गंध देता है। – टिप्पणी ईडी।
कार्य 2
कॉपर नाइट्रेट को दो अलग-अलग तरीकों से तैयार करें, जिसमें निम्नलिखित पदार्थ उपलब्ध हों: सांद्र नाइट्रिक एसिड, कॉपर बुरादा, कॉपर (II) सल्फेट, सोडियम हाइड्रॉक्साइड। आणविक रूप में रासायनिक प्रतिक्रियाओं के समीकरण लिखें और परिवर्तनों को नोट करें। विधि 1 में, रेडॉक्स प्रतिक्रिया के लिए, इलेक्ट्रॉन संतुलन समीकरण लिखें, ऑक्सीकरण एजेंट और कम करने वाले एजेंट का निर्धारण करें। विधि 2 में, संक्षिप्त आयनिक प्रतिक्रिया समीकरण लिखें।
पहला एस पी ओ एस ओ बी. कॉपर + नाइट्रिक एसिड. टेस्ट ट्यूब की सामग्री को हल्का गर्म करें। रंगहीन घोल बन जाता है... (रंग निर्दिष्ट करें), क्योंकि बन गया है….. (पदार्थ का नाम); गैस निकलती है……..एक अप्रिय गंध के साथ रंग, यह है……. (पदार्थ का नाम).
दूसरा एस पी ओ एस ओ बी. जब कॉपर (II) सल्फेट सोडियम हाइड्रॉक्साइड के साथ प्रतिक्रिया करता है, तो ...... रंग का एक अवक्षेप प्राप्त होता है, यह ...... है (पदार्थ का नाम). इसमें नाइट्रिक एसिड मिलाएं जब तक कि अवक्षेप पूरी तरह से घुल न जाए... (तलछट का नाम). एक स्पष्ट नीला घोल बनता है...... (नमक का नाम).


कार्य 3
प्रयोगात्मक रूप से सिद्ध करें कि अमोनियम सल्फेट में NH 4 + और SO 2- 4 आयन होते हैं। प्रेक्षणों को नोट करें और प्रतिक्रियाओं के लिए आणविक और संक्षिप्त आयनिक समीकरण लिखें।


कार्य 4
टेस्ट ट्यूब नंबर 1, नंबर 2, नंबर 3 में सोडियम ऑर्थोफोस्फेट, सोडियम क्लोराइड, सोडियम नाइट्रेट के घोल की उपस्थिति का प्रायोगिक निर्धारण कैसे करें? प्रेक्षणों को नोट करें और प्रतिक्रियाओं के लिए आणविक और संक्षिप्त आयनिक समीकरण लिखें।

कार्य 5
निम्नलिखित पदार्थ होने पर: नाइट्रिक एसिड, तांबे की छीलन या तार, यूनिवर्सल इंडिकेटर पेपर या मिथाइल ऑरेंज, प्रयोगात्मक रूप से नाइट्रिक एसिड की संरचना साबित करें। नाइट्रिक एसिड के पृथक्करण के लिए समीकरण लिखें; सांद्र नाइट्रिक एसिड और इलेक्ट्रॉन संतुलन समीकरण के साथ तांबे की प्रतिक्रिया के लिए आणविक समीकरण, ऑक्सीकरण एजेंट और कम करने वाले एजेंट की पहचान करें।

कार्य 6
इन पदार्थों का उपयोग करके विभिन्न तरीकों से कॉपर नाइट्रेट का घोल तैयार करें: नाइट्रिक एसिड, कॉपर ऑक्साइड, बेसिक कॉपर कार्बोनेट या हाइड्रोक्सीकॉपर (II) कार्बोनेट। रासायनिक प्रतिक्रियाओं के लिए आणविक, पूर्ण और संक्षिप्त आयनिक समीकरण लिखें। रासायनिक प्रतिक्रियाओं के संकेतों पर ध्यान दें।


बेंचमार्क परीक्षण
1. प्रतिक्रिया समीकरण दीजिए जहां पीला अवक्षेप बनता है।

2. जिस प्रतिक्रिया में सफेद चीज़ जैसा अवक्षेप बनता है उसका आयनिक समीकरण है:

3. नाइट्रेट में नाइट्रेट आयन की उपस्थिति सिद्ध करने के लिए, आपको यह लेना होगा:
ए) हाइड्रोक्लोरिक एसिड और जिंक;
बी) सल्फ्यूरिक एसिड और सोडियम क्लोराइड;
ग) सल्फ्यूरिक एसिड और तांबा।
4. क्लोराइड आयन के लिए अभिकर्मक है:
क) तांबा और सल्फ्यूरिक एसिड;
बी) सिल्वर नाइट्रेट;
ग) बेरियम क्लोराइड।
5. प्रतिक्रिया समीकरण में, जिसका आरेख
HNO 3 + Cu -> Cu(NO 3) 2 + NO 2 + H 2 O,
ऑक्सीकरण एजेंट से पहले आपको गुणांक डालना होगा:
ए) 2; बी 4; 6 पर।
6. क्षारीय और अम्लीय लवण जोड़े के अनुरूप हैं:
ए) Cu(OH) 2, Mg(HCO 3) 2;
बी) Cu(NO 3) 2, HNO 3;
सी) 2 सीओ 3, सीए (एचसीओ 3) 2।
|
उत्तर. 1 -ए; 2 -बी; 3 -वी; 4 -बी; 5 -बी; 6 -वी. |
खनिज उर्वरकों का निर्धारण
इस व्यावहारिक कार्य के पद्धतिगत विकास में तीन भाग होते हैं: सिद्धांत, कार्यशाला, नियंत्रण। सैद्धांतिक भाग खनिज उर्वरकों में शामिल धनायनों और ऋणायनों के गुणात्मक निर्धारण पर सामान्य जानकारी प्रदान करता है। कार्यशाला सात खनिज उर्वरकों के उदाहरण उनकी विशिष्ट विशेषताओं के विवरण के साथ प्रदान करती है, और गुणात्मक प्रतिक्रियाओं के लिए समीकरण भी देती है। पाठ में, बिंदुओं और प्रश्न चिह्नों के बजाय, आपको ऐसे उत्तर डालने होंगे जो अर्थ में उपयुक्त हों। शिक्षक के विवेक पर व्यावहारिक कार्य पूरा करने के लिए चार उर्वरक लेना पर्याप्त है। छात्रों के ज्ञान के परीक्षण में उर्वरक सूत्र निर्धारित करने के लिए परीक्षण कार्य शामिल हैं, जो इस व्यावहारिक कार्य में दिए गए हैं।
लिखित
1. क्लोराइड आयन का अभिकर्मक सिल्वर नाइट्रेट है। प्रतिक्रिया एक सफेद पनीर अवक्षेप के निर्माण के साथ आगे बढ़ती है:
एजी + + सीएल - = एजीसीएल।
2. क्षार का उपयोग करके अमोनियम आयन का पता लगाया जा सकता है। जब अमोनियम नमक के घोल को क्षार घोल के साथ गर्म किया जाता है, तो अमोनिया निकलता है, जिसमें एक तीखी विशिष्ट गंध होती है:
NH + 4 + OH - = NH 3 + H 2 O.
आप अमोनियम आयन को निर्धारित करने के लिए पानी से सिक्त लाल लिटमस पेपर, एक सार्वभौमिक संकेतक या कागज की फिनोलफथेलिन पट्टी का भी उपयोग कर सकते हैं। कागज के टुकड़े को परखनली से निकलने वाले वाष्प के ऊपर रखना चाहिए। लाल लिटमस नीला हो जाता है, सार्वभौमिक संकेतक बैंगनी हो जाता है, और फिनोलफथेलिन लाल रंग का हो जाता है।
3. नाइट्रेट आयनों को निर्धारित करने के लिए, तांबे की छीलन या टुकड़ों को नमक के घोल में मिलाया जाता है, फिर सांद्र सल्फ्यूरिक एसिड मिलाया जाता है और गर्म किया जाता है। कुछ समय बाद, एक अप्रिय गंध वाली भूरे रंग की गैस निकलने लगती है। भूरी NO2 गैस का निकलना आयनों की उपस्थिति को इंगित करता है।
उदाहरण के लिए:
NaNO 3 + H 2 SO 4 NaHSO 4 + HNO 3,
4HNO 3 + Cu = Cu(NO 3) 2 + 2NO 2 + 2H 2 O.
4. फॉस्फेट आयन का अभिकर्मक सिल्वर नाइट्रेट है। जब इसे फॉस्फेट के घोल में मिलाया जाता है, तो सिल्वर फॉस्फेट का एक पीला अवक्षेप अवक्षेपित हो जाता है:
3एजी + + पीओ 3- 4 = एजी 3 पीओ 4.
5. सल्फेट आयन का अभिकर्मक बेरियम क्लोराइड है। बेरियम सल्फेट का एक सफेद दूधिया अवक्षेप, एसिटिक एसिड में अघुलनशील, अवक्षेपित होता है:
बीए 2+ + एसओ 2- 4 = बीएएसओ 4।
कार्यशाला
1. सिल्विनाइट (NaCl KCl), गुलाबी क्रिस्टल, पानी में अच्छी घुलनशीलता। लौ पीली हो जाती है. नीले कांच के माध्यम से लौ को देखने पर बैंगनी रंग ध्यान देने योग्य है। साथ …….. (अभिकर्मक का नाम)एक सफेद अवक्षेप देता है...... (नमक का नाम).
केसीएल + ? -> KNO 3 + AgCl.
2. अमोनियम नाइट्रेट NH 4 NO 3, या…….. (उर्वरक का नाम), सफेद क्रिस्टल, पानी में अत्यधिक घुलनशील। ब्राउन गैस सल्फ्यूरिक एसिड और तांबे के साथ निकलती है... (पदार्थ का नाम). समाधान के साथ...... (अभिकर्मक का नाम)गर्म करने पर अमोनिया की गंध आती है, इसकी वाष्प लाल लिटमस में बदल जाती है... रंग।
एनएच 4 नंबर 3 + एच 2 एसओ 4 एनएच 4 एचएसओ 4 + एचएनओ 3,
HNO 3 + Cu -> Cu(NO 3) 2 + ? + ? .
NH 4 NO 3 + ? -> NH 3 + H 2 O + NaNO 3.
3. पोटेशियम नाइट्रेट (KNO3), या…… (उर्वरक का नाम), एच 2 एसओ 4 और ……… के साथ (पदार्थ का नाम)ब्राउन गैस पैदा करता है. लौ बैंगनी हो जाती है.
KNO 3 + H 2 SO 4 KHSO 4 + HNO 3,
4HNO 3 + ? -> Cu(NO 3) 2 + ? + 2H 2 O.
4. अमोनियम क्लोराइड एनएच 4 सीएल घोल के साथ……. (अभिकर्मक का नाम)गर्म करने पर यह अमोनिया बनाता है, इसके वाष्प लाल लिटमस को नीला कर देते हैं। साथ …… (अभिकर्मक आयन का नाम)चाँदी एक सफ़ेद चीज़ जैसा अवक्षेप देती है...... (तलछट का नाम).
एनएच 4 सीएल + ? = NH 4 NO 3 + AgCl,
एनएच 4 सीएल + ? = NH 3 + H 2 O + NaCl।
5. गर्म करने पर अमोनियम सल्फेट (एनएच 4) 2 एसओ 4 क्षार घोल के साथ अमोनिया बनाता है, इसका वाष्प लाल लिटमस को नीला कर देता है। साथ …….. (अभिकर्मक का नाम)सफ़ेद दूधिया तलछट देता है......... (तलछट का नाम).
(एनएच 4) 2 एसओ 4 + 2एनएओएच = 2एनएच 3 + 2एच 2 ओ + ? ,
(एनएच 4) 2 एसओ 4 + ? -> एनएच 4 सीएल + ? .
6. सोडियम नाइट्रेट NaNO3, या…… (उर्वरक का नाम), सफेद क्रिस्टल, पानी में अच्छी घुलनशीलता, H 2 SO 4 और Cu के साथ एक भूरे रंग की गैस पैदा करता है। लौ पीली हो जाती है.
NaNO 3 + H 2 SO 4 NaHSO 4 + ? ,
Cu -> Cu(NO 3) 2 + ? + 2H 2 O.
7. कैल्शियम डाइहाइड्रोजन फॉस्फेट Ca(H 2 PO 4) 2, या…… (उर्वरक का नाम), धूसर महीन दाने वाला पाउडर या कण, पानी में खराब घुलनशील, ...... के साथ (अभिकर्मक का नाम)देता है …….. (रंग निर्दिष्ट करें) अवक्षेप ……… (पदार्थ का नाम)एजीएच 2 पीओ 4.
Ca(H 2 PO 4) 2 + ? -> 2AgH 2 PO 4 + Ca(NO 3) 2.

नियंत्रण (परीक्षण)
1. गुलाबी क्रिस्टल, पानी में अत्यधिक घुलनशील, लौ को पीला रंग देते हैं; AgNO3 के साथ परस्पर क्रिया करने पर एक सफेद अवक्षेप बनता है - यह है:
ए) सीए(एच 2 पीओ 4) 2; बी) NaCl KCl;
ग) केएनओ 3; डी) एनएच 4 सीएल।
2. क्रिस्टल पानी में अत्यधिक घुलनशील होते हैं; एच 2 एसओ 4 और तांबे के साथ प्रतिक्रिया में, एक भूरे रंग की गैस निकलती है; क्षार समाधान के साथ, गर्म होने पर, यह अमोनिया पैदा करती है, जिसके वाष्प लाल लिटमस को नीला कर देते हैं - यह है:
ए) नैनो 3; बी) (एनएच 4) 2 एसओ 4;
ग) एनएच 4 नंबर 3; घ) KNO 3.
3. हल्के क्रिस्टल, पानी में अत्यधिक घुलनशील; H 2 SO 4 और Cu के साथ परस्पर क्रिया करने पर भूरी गैस निकलती है; लौ बैंगनी हो जाती है - यह है:
ए) केएनओ 3; बी) एनएच 4 एच 2 पीओ 4;
ग) Ca(H 2 PO 4) 2 CaSO 4; डी) एनएच 4 नंबर 3।
4. क्रिस्टल पानी में अत्यधिक घुलनशील होते हैं; सिल्वर नाइट्रेट के साथ यह एक सफेद अवक्षेप देता है, क्षार के साथ गर्म करने पर यह अमोनिया देता है, जिसके वाष्प लाल लिटमस को नीला कर देते हैं - यह है:
ए) (एनएच 4) 2 एसओ 4; बी) एनएच 4 एच 2 पीओ 4;
ग) NaCl KCl; डी) एनएच 4 सीएल।
5. हल्के क्रिस्टल, पानी में अत्यधिक घुलनशील; BaCl2 के साथ यह एक सफेद दूधिया अवक्षेप देता है, क्षार के साथ यह अमोनिया देता है, जिसके वाष्प लाल लिटमस को नीला कर देते हैं - यह है:
ग) एनएच 4 सीएल; डी) एनएच 4 एच 2 पीओ 4।
6. हल्के क्रिस्टल, पानी में अत्यधिक घुलनशील; एच 2 एसओ 4 और सीयू के साथ बातचीत करते समय, यह भूरे रंग की गैस पैदा करता है, लौ पीली हो जाती है - यह है:
ए) एनएच 4 नंबर 3; बी) (एनएच 4) 2 एसओ 4;
ग) केएनओ 3; घ) NaNO 3.
7. धूसर महीन दाने वाला पाउडर या कण, पानी में घुलनशीलता खराब है, सिल्वर नाइट्रेट के घोल से यह एक पीला अवक्षेप देता है - यह है:
ए) (एनएच 4) 2 एसओ 4; बी) NaCl KCl;
सी) सीए (एच 2 पीओ 4) 2; घ) KNO 3.
| उत्तर. 1 -बी; 2 -वी; 3 -ए; 4 -जी; 5 -बी; 6 -जी; 7 -वी. |