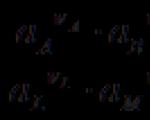Elektrokemija. Galvanski članak Elektrokemijski članak
Elektrokemijski elementi. Elektromotorna sila. Termodinamika galvanskog članka. EMF mjerenje.
Dvostruki električni sloj, mehanizam nastanka i struktura.
GALVANSKI ELEMENTI. EMF.
Kada električna struja prolazi kroz elektrolit, na površini elektroda dolazi do elektrokemijskih reakcija. Pojava elektrokemijskih reakcija može biti generirana vanjskim izvorom struje. Moguća je i suprotna pojava: elektrokemijske reakcije koje se odvijaju na dvije elektrode uronjene u elektrolit stvaraju električnu struju, a reakcije se odvijaju samo u zatvorenom krugu (kada struja prolazi).
Elektrokemijski (ili galvanski) članak je uređaj za proizvodnju električne struje putem elektrokemijskih reakcija. Najjednostavniji elektrokemijski element sastoji se od dvije metalne elektrode (vodiči prve vrste), spuštene u elektrolit (vodič druge vrste) i međusobno spojene metalnim kontaktom. Nekoliko serijski spojenih elektrokemijskih elemenata elektrokemijski krug .
Najvažnija kvantitativna karakteristika elektrokemijskog elementa je elektromotorna sila(EMF, E), koji je jednak razlici potencijala pravilno otvoren element (kod kojeg su vodiči prve vrste od istog materijala spojeni na krajnje elektrode elementa).
Ako se pri prolasku električne struje u različitim smjerovima dogodi ista reakcija na površini elektrode, ali u suprotnim smjerovima, tada se takve elektrode, kao i element ili strujni krug koji se od njih sastoji, nazivaju reverzibilan . EMF reverzibilnih elemenata je njihovo termodinamičko svojstvo, tj. ovisi samo o T, P, prirodi tvari koje čine elektrode i otopine i koncentraciji tih otopina. Primjer reverzibilnog elementa je Daniel-Jacobi element :
(-) Cu çZn çZnSO 4 ççCuSO 4 çCu (+)
kod kojih je svaka elektroda reverzibilna. Kada element radi, odvijaju se sljedeće reakcije: Zn ® Zn 2+ + 2 e, Cu 2+ + 2 e® Cu. Kada se iz vanjskog izvora propusti struja infinitezimalne jakosti, na elektrodama se javljaju obrnute reakcije.
Primjer ireverzibilnog elementa je Volta element :
(-) Zn ç H 2 SO 4 ç Cu (+)
Kada element radi, odvijaju se sljedeće reakcije: Zn ® Zn 2+ + 2 e, 2H + + 2 e® H 2 . Pri prolasku struje iz vanjskog izvora, reakcije elektroda će biti: 2H + + 2 e® H 2 , Cu ® Cu 2+ + 2 e .
EMF elektrokemijskog elementa je pozitivna vrijednost, jer odgovara određenom spontanom procesu koji proizvodi pozitivan rad. Obrnuti proces, koji se ne može dogoditi samostalno, odgovarao bi negativnom EMF-u. Pri sastavljanju lanca elektrokemijskih elemenata proces u jednom od elemenata može se usmjeriti tako da ga prati utrošak rada izvana (nespontani proces), koristeći za to rad drugog elementa lanca u pri čemu dolazi do spontanog procesa. Ukupna emf bilo kojeg strujnog kruga jednaka je algebarskom zbroju pozitivnih i negativnih veličina. Stoga je vrlo važno pri pisanju dijagrama kruga uzeti u obzir znakove EMF-a, koristeći prihvaćena pravila.
EMF elektrokemijskog kruga smatra se pozitivnim, ako je pri pisanju strujnog kruga desna elektroda pozitivno nabijena u odnosu na lijevu (tijekom rada strujnog kruga kationi prelaze u otopini od elektrode napisane lijevo prema elektrodi napisanoj desno, a elektroni se kreću u isti smjer u vanjskom strujnom krugu). Primjer.
TERMODINAMIKA GALVANSKOG ĆELENA .
Neka reakcija teče reverzibilno i izotermno u elektrokemijskom sustavu:
n A A + n B B + ... ± nF Û n L L + n M M + ... ±
Električna energija koju stvara element jednaka je korisnom radu A¢ ukupnog procesa. Korisni rad A¢ reverzibilnog procesa je maksimalan i pri P, T = const jednak je smanjenju izobarnog potencijala sustava:
DG P, T = nFE P, T
E P , T - reverzibilni EMF sustava.
E P,T = -DG P,T / nF, E V,T = -DF V,T / nF
Dakle, mjerenjem EMF elementa i njegovog temperaturnog koeficijenta, moguće je pronaći vrijednosti DG i DS za ukupni proces koji se odvija u galvanskoj ćeliji. Ovaj proces je spontan, stoga DG< 0.
Pomoću Gibbs-Helmholtzove jednadžbe možemo izračunati promjenu entalpije procesa:
DH = DG - T = -nFE P + TnF
nFE P = -DH + nFT = + nFT
nFE V = -DU + nFT = + nFT
Iz jednadžbi slijedi da odnos između električne energije reverzibilno generirane ili apsorbirane u elektrokemijskom sustavu i toplinskog učinka reakcije koja se u njemu odvija ovisi o predznaku i veličini temperaturnog koeficijenta emf. dE/ dT :
1. AkodE / dT > 0 , tada nFE > (DG > DH) i sustav će pretvoriti u električnu energiju ne samo količinu topline koja odgovara toplinskom učinku reakcije, već i dodatnu toplinu - Peletierova toplina Q P = nFT dE/ dT posuđeno iz okoline. U adijabatskim uvjetima (u uvjetima toplinske izolacije, kada je izmjena s okolinom nemoguća) T sustava opada. Hlađenje sustava je posebno vidljivo ako dE/ dT > 0 < 0 (реакция эндотермична).
2. AkodE / dT < 0 , zatim nFE< (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. AkodE / dT = 0 , tada DG = DH i nFE = - električna energija koju sustav reverzibilno proizvodi ekvivalentna je toplinskom učinku kemijske reakcije. Ovaj odnos je poznat kao Thomsonov princip (pravilo) .
Za izračun EMF-a, jednadžbe se mogu prepisati kao:
Kada koristite jednadžbe, morate imati na umu da one vrijedi samo za reverzibilne elektrokemijske sustave, stoga je pri proučavanju ovisnosti EMF o T potrebno izbjegavati upotrebu elektrokemijskih sustava s tekućim granicama, jer difuzijski potencijali koji nastaju na njima nisu ravnotežni.
Povežimo EMF elementa s konstantom ravnoteže reakcije koja se odvija u elementu. Jednadžba izoterme kemijske reakcije:
DG = RT ul K a - RT
E = - = ul K a -
Prvi član na desnoj strani jednadžbe za dani P, T je konstantna vrijednost; može se označiti s E o. E o - standardni EMF elementa (elektrokemijskog sustava) , tj. EMF uopće a ja = 0.
E = E o + ul
 = E o + 2,303 lg
= E o + 2,303 lg 
Dakle, EMF elektrokemijskog sustava je funkcija aktivnosti sudionika u elektrokemijskoj reakciji. Gornje jednadžbe omogućuju izračunavanje vrijednosti DG i K A na temelju eksperimentalnih vrijednosti E i, obrnuto, izračunati E, znajući termodinamičke karakteristike kemijske reakcije.
MJERENJE EMF-a .
Za mjerenje ravnotežne (reverzibilne) vrijednosti EMF nekog elektrokemijskog elementa potrebno je da se proces odvija beskonačno sporo, tj. tako da element radi na infinitezimalnoj struji. Ovaj uvjet je zadovoljen u metodi kompenzacije, koja se temelji na činjenici da je element spojen u seriju protiv vanjske razlike potencijala, a potonji je odabran tako da nema struje u krugu. Tada je vanjska razlika potencijala jednaka EMF kruga.
Pomoću metode kompenzacije možete izravno izmjeriti vrijednost EMF-a, ali to je prilično komplicirana operacija, stoga u laboratorijskoj praksi radije uspoređuju EMF elementa koji se proučava s EMF-om takozvanog standarda (normalnog) elemenata, koji se pažljivo mjeri pri različitim T. Ova komparativna metoda je također kompenzacija.
Osnovni normalni element je zasićeni Westonov element .
(krug za mjerenje EMF - samostalno).
STRUKTURA GRANICE ELEKTRODE - RIJEŠENJE. DVOSTRUKI ELEKTRIČNI SLOJ .
Kada vodič prve vrste dođe u kontakt s elektrolitom, a električni dvostruki sloj . Kao primjer, razmotrite bakrenu elektrodu uronjenu u otopinu CuSO 4 . Kemijski potencijal bakrenih iona u metalu pri danoj T može se smatrati konstantnim, dok kemijski potencijal bakrenih iona u otopini ovisi o koncentraciji soli; općenito, ti kemijski potencijali nisu isti.
Neka koncentracija CuSO 4 bude takva da > . Zatim, kada se metal uroni u otopinu, dio iona Cu 2+ iz otopine dehidrira i prenese se na metal, stvarajući na njemu pozitivan naboj. Ovaj naboj će spriječiti daljnji prijenos Cu 2+ iona iz otopine u metal i dovesti do stvaranja sloja SO 4 2- aniona privučenih u blizini elektrode. Takozvani elektrokemijska ravnoteža , pri čemu će se kemijski potencijali iona u metalu i u otopini razlikovati za veličinu razlike potencijala rezultirajućeg dvostrukog električnog sloja (DEL):
Razlika električnog potencijala i razlika kemijskog potencijala kompenziraju se u elektrokemijskoj ravnoteži.
Neka koncentracija CuSO 4 bude toliko mala da< . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
Možete odabrati koncentraciju elektrolita pri kojoj su kemijski potencijali iona u metalu i otopini isti. Otopine te koncentracije nazivaju se nulta rješenja . Kada je metal uronjen u svoju nultu otopinu, na površini elektrode se ne pojavljuje EDL; međutim, čak ni u tom slučaju razlika potencijala između metala i otopine nije nula.
Prema Nernstu, jedini izvor EMF elektrokemijske ćelije je EMF na površini elektroda. Nernst je definirao potencijal metala u nultoj otopini kao apsolutni nulti potencijal. U radovima A. N. Frumkina pokazalo se da su Nernstove ideje netočne. Eksperimentalno je utvrđeno da se EMF elementa koji se sastoji od dvije različite elektrode uronjene u njihove nulte otopine vrlo značajno razlikuje od nule (možda više od 1 V). Potencijal metala u nultoj otopini, tzv nulti potencijal naboja , ne može se smatrati apsolutnim nultim potencijalom.
TEORIJA KONDENZIRANOG HELMHOLTZOVOG DVOSTRUKOG SLOJA. Prvu kvantitativnu teoriju strukture DEL na granici metal-otopina stvorio je Helmholtz (1853). Prema Helmholtzu, EDL se može usporediti s ravnim kondenzatorom, čija se jedna ploča podudara s ravninom koja prolazi kroz površinske naboje u metalu, druga s ravninom koja povezuje središta naboja iona u otopini, privučeni na površinu metala elektrostatskim silama. Dvostruka debljina sloja l jednak radijusu iona r. Prema uvjetu električne neutralnosti, broj iona privučenih na površinu metala mora biti takav da njihovi naboji kompenziraju površinske naboje metala, tj.
Teorija kondenziranog dvostrukog sloja omogućuje dobivanje vrijednosti EDL kapacitivnosti koje su u skladu s eksperimentom i fizički prihvatljivom debljinom EDL-a. Međutim, ne može protumačiti mnoge eksperimentalne zakonitosti: eksperimentalno utvrđene vrijednosti elektrokinetičkog potencijala (x-potencijala) i njihovu ovisnost o koncentraciji elektrolita, promjenu predznaka naboja na metalnoj površini u prisutnosti površinski aktivne tvari. .
TEORIJA DIFUZNOG DVOSLOJNOG GUI- TORBAR. Helmholtzova teorija ne uzima u obzir da se svojstva DES-a mijenjaju s koncentracijom elektrolita te su T. Gouy (1910.) i Chapman (1913.) pokušali povezati gustoću naboja u DES-u sa sastavom otopine. Uzeli su u obzir da osim elektrostatskih sila koje nastaju između metala i iona, na ione djeluju i sile toplinskog gibanja molekula. Kada se primijene ove dvije sile, ioni u otopini trebaju biti difuzno raspoređeni u odnosu na metalnu površinu - s volumetrijskom gustoćom naboja koja se smanjuje s udaljenošću od nje.
Gouy i Chapman smatrali su da se ioni mogu smatrati materijalnim točkama koje nemaju vlastiti volumen, ali imaju naboj, te da je njihova raspodjela u polju naboja elektrode pokorna Boltzmannovoj raspodjeli.
Gouy-Chapmanova teorija slaže se bolje od Helmholtzove teorije sa zakonima elektrokinetičkih pojava. Ako pretpostavimo da polazeći s određene udaljenosti l 1 ioni više nisu čvrsto vezani za površinu elektrode s relativnim kretanjem krute i tekuće faze, tada se potencijal koji odgovara ovoj udaljenosti može smatrati x-potencijalom (x< j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
Dakle, Gouy-Chapmanova teorija je najbolje opravdana tamo gdje se Helmholtzova teorija pokaže neprimjenjivom, i obrnuto, potonja daje bolju konvergenciju s eksperimentom u slučajevima kada prva daje netočne rezultate. Posljedično, struktura DES-a mora odgovarati nekoj kombinaciji modela koje su predložili Helmholtz i Gouy-Chapman. Ovu pretpostavku iznio je Stern (1924.) u svojoj adsorpcijskoj teoriji DEL.
STERNOVA ADSORPCIJSKA TEORIJA. Stern je vjerovao da se određeni dio iona zadržava u blizini sučelja metal-elektrolit, tvoreći Helmholtzovu ili kondenziranu dvoslojnu ploču debljine koja odgovara prosječnom radijusu iona elektrolita. Preostali ioni uključeni u EDL distribuiraju se difuzno uz postupno smanjenje gustoće naboja. Za difuzni dio EDL-a, Stern je, kao i Gouy, zanemario intrinzične veličine iona. Osim toga, Stern je sugerirao da se u gustom dijelu EDL-a ioni zadržavaju ne samo zbog elektrostatskih sila, već i specifičnih adsorpcijskih sila, tj. sile nekoulonovskog porijekla. Stoga, u otopinama koje sadrže površinski aktivne ione, njihov broj u gustom dijelu EDL može premašiti naboj metalne površine za određeni iznos, ovisno o svojstvima iona i naboju metala. Stoga, prema Sternu, treba razlikovati dva modela DES-a, od kojih se jedan odnosi na otopine površinski neaktivnih elektrolita, a drugi na otopine koje sadrže specifično adsorbirane ione.
U teoriji adsorpcije također je očuvana jednakost:
Q M = q L = q 1 + q 2
Gustoća naboja na strani otopine q L sastoji se od dva dijela: gustoće naboja u Helmholtzovu sloju q 1 i gustoće naboja u difuznom sloju q 2 .
Sternova teorija omogućuje nam definiranje x-potencijala kao pada potencijala u difuznom dijelu EDL-a, gdje je jaka veza između metala i iona već izgubljena. Uz ovu definiciju, x-potencijal se ne bi trebao podudarati s Nerstovim potencijalom, kao što se eksperimentalno uočava. Sternova teorija uspjela je objasniti ponovno punjenje površine čvrstog tijela.
Pri infinitezimalnoj koncentraciji svi naboji u otopini raspoređeni su difuzno, a struktura EDL-a opisana je Gouy-Chapmanovom teorijom. Naprotiv, u koncentriranim otopinama struktura DES-a približava se modelu koji je predložio Helmholtz. U području prosječnih koncentracija, gdje je x usporediv po veličini s RT/F, njegova ovisnost o koncentraciji može se izraziti približnim jednadžbama:
za pozitivne vrijednosti x: x = B - ul S
za negativne vrijednosti x: x = B¢ + ul S
Sternova teorija daje kvalitativno ispravnu sliku DEL-a. Određivanje kapacitivnosti pomoću Sternovog modela u skladu je s iskustvom kako u pogledu vrijednosti kapacitivnosti tako i u prirodi njegove ovisnosti o potencijalu elektrode i koncentraciji otopine. Ali Sternova teorija nije lišena nedostataka. To uključuje nemogućnost kvantitativnog opisa krivulja kapacitivnosti, posebno kada se odmakne od potencijala nultog naboja.
DALJNJI RAZVOJ TEORIJE DES STANJA. Učinjeni su mnogi pokušaji da se razvije teorija DES-a koja je kvantitativno konzistentna s eksperimentalnim podacima (Rice, Frumkin et al., Bockris, Devanathan, Esin, Muller, Parsons, Ershler, itd.). Najšire prihvaćen model je Graham (1947). Prema Grahamu, DES premaz u otopini sastoji se ne od dva, već od tri dijela. Prva, računajući od površine metala, naziva se unutarnja Helmholtzova ravnina; sadrži samo površinski aktivne ione (naboj ravnine je q 1) ili, ako ih nema u otopini, molekule otapala (q 1 = 0); njegov potencijal vezan uz rješenje označen je s y 1. Sljedeća ravnina, uklonjena s površine metala na udaljenost kojoj ioni (njihovi centri naboja) mogu pristupiti, naziva se vanjska Helmholtzova ravnina; njen ukupni naboj je q 2, a potencijal ravnine je y 2. Iza vanjske Helmholtzove ravnine nalazi se difuzni sloj s potencijalom koji varira od y 2 do nule i s gustoćom naboja koja se podudara s q 2 .
Grahamov model odražava glavne značajke i karakteristike DES strukture metal-elektrolit. Omogućuje vam izračunavanje krivulja diferencijalnog kapaciteta za bilo koju koncentraciju danog elektrolita ako postoji eksperimentalna krivulja za barem jednu od njegovih otopina. Međutim, ovaj model ne pokriva sve aspekte problema.
Kada električna struja prolazi kroz otopinu, struje teku na površini elektroda. elektrokemijske reakcije, koji su popraćeni protokom elektrona prema ili od elektrode. U obrnutim procesima, elektrokemijske reakcije koje se odvijaju na sučeljima između vodiča prve i druge vrste dovode do stvaranja električne struje.
Elektrokemijski procesi razlikuju se od konvencionalnih kemijskih reakcija u nizu značajki.
Kemijska reakcija moguća je samo kada se čestice koje reagiraju sudare. Kada dođu u kontakt, elektronima postaje moguće prijeći s jedne čestice na drugu. Hoće li se takav prijelaz stvarno dogoditi ovisi o energiji čestica i njihovoj međusobnoj orijentaciji. Energija aktivacije ovisi o prirodi kemijske reakcije, a za ionske reakcije obično je niska. Put prijelaza elektrona je vrlo kratak, što je također karakteristika kemijske reakcije. Do sudara čestica može doći u bilo kojoj točki reakcijskog prostora na različitim međusobnim položajima, pa se elektronski prijelazi mogu događati u proizvoljnim smjerovima, tj. Značajke kemijskog procesa su slučajnost sudara i nedostatak usmjerenosti elektronskih prijelaza. Kao rezultat toga, energetski učinci kemijskih reakcija pojavljuju se prvenstveno u obliku topline (moguć je i manji rad širenja).
Da bi se energetske promjene koje odgovaraju kemijskoj transformaciji manifestirale u obliku električne energije, tj. Da bi se elektrokemijski proces odvijao, potrebno je promijeniti uvjete reakcije.
Električna energija uvijek je povezana s prolaskom električne struje, tj. protok elektrona u određenom smjeru. Stoga se reakcija mora odvijati na način da elektronički prijelazi ne budu slučajni, već da se odvijaju u jednom smjeru, a njihov put mora biti znatno veći od veličine atoma. Stoga se u elektrokemijskim procesima prijelaz elektrona s jednog sudionika na drugi mora dogoditi na znatnoj udaljenosti, za što je potrebno prostorno razdvajanje sudionika reakcije. Međutim, samo prostorno odvajanje nije dovoljno, jer će jednostavno uzrokovati prestanak reakcije.
Za izvođenje elektrokemijskog procesa potrebni su dodatni uvjeti: elektroni se moraju otrgnuti od nekih čestica i prenijeti na druge na jedan uobičajeni način. To se može postići zamjenom izravnog kontakta između sudionika u reakciji njihovim kontaktom s dva metala koja su međusobno povezana metalnim vodičem. Da bi tok elektrona bio kontinuiran, potrebno je osigurati i prolaz električne struje kroz reakcijski prostor, što obično provode sami sudionici elektrokemijske reakcije (ako su u ioniziranom stanju) odn. posebnim spojevima visoke ionske vodljivosti.
Naziva se uređaj za proizvodnju električne energije putem elektrokemijskih reakcija elektrokemijski(ili galvanski)element. Najjednostavniji elektrokemijski element sastoji se od dvije metalne elektrode (vodiči prve vrste) uronjene u otopinu elektrolita (vodiči druge vrste).
Ako se pri prolasku električne struje u različitim smjerovima dogodi ista reakcija na površini elektrode, ali u suprotnim smjerovima, tada se takve elektrode, kao i od njih sastavljeni elektrokemijski elementi, nazivaju reverzibilan. Primjer reverzibilnog elementa je Daniel-Jacobijev element
(–) Zn | ZnSO 4, otopina || CuSO 4, otopina | Cu(+)
Kada takav element radi, na elektrodama se javljaju elektrokemijske reakcije:
Zn Zn 2 + + 2e
Cu 2 + + 2eCu
Ukupna jednadžba reakcije u elementu može se prikazati kao
Zn + Cu 2 + Zn 2 + + Cu
Kada infinitezimalna struja iz vanjskog izvora prolazi kroz element, te se reakcije odvijaju u suprotnom smjeru.
Primjer nepovratan element je Volta element
(–) Zn | H2SO4 | Cu(+)
Kada takav element radi, na elektrodama se javljaju sljedeće reakcije:
Zn Zn 2 + + 2e
2H + + 2eH 2 ,
a reakcija u elementu prikazana je jednadžbom
Zn + 2H + Zn 2+ + H 2
Kada struja prolazi iz vanjskog izvora, na elektrodama se javljaju druge reakcije:
Cu Cu 2 + + 2e,
oni. u elektrokemijskoj ćeliji bakar se otapa u sumpornoj kiselini uz oslobađanje vodika:
Cu + 2H + Cu 2 + + H 2
Najvažnija karakteristika elektrokemijskog članka je njegova elektromotorna sila(EMF) E– razlika potencijala pravilno otvorenog elementa, tj. razlika potencijala između krajeva vodiča prve vrste od istog materijala spojenih na elektrode galvanskog članka. Drugim riječima, EMF je razlika potencijala u uvjetima ravnoteže kada strujni krug ne teče. Ako zatvorite elektrode, tada će u krugu teći električna struja, a razlika potencijala predstavlja napon elektrokemijski element koji se razlikuje od EMF-a količinom pada napona na unutarnjem otporu elementa.
Svrha elektrokemijskih elemenata je promicanje kretanja elektrona u vanjskom krugu u koji je uključen korisni element
opterećenje. Stoga, da bi izvršila svoju zadaću, goriva ćelija mora sadržavati izvor i ponor elektrona (Sl. 7.1).
Reakcije koje se odvijaju u elektrokemijskoj ćeliji nazivaju se redukcijske reakcije, jer pojam "oksidacija" odgovara procesu otpuštanja elektrona, a pojam "redukcija" odgovara procesu otpuštanja elektrona.
Značenje brojnih zastarjelih znanstvenih pojmova često nije jasno iz njihovih naziva, a pojmovi "oksidacija" i "redukcija" zahtijevaju objašnjenje. Na jugoistoku, kisik (kisik) dolazi od latinskog korijena oxus (kiseo ili ljut, oštar) i znači "proizvođač kiseline". Ovaj naziv je prvi put korišten u djelu Morveaua i Lavoisiera “Nomenclature Chimique”, objavljenom 1787. godine. U to vrijeme kemičari su se pridržavali pogrešnog uvjerenja. da je kisik glavni element uključen u kiseline; kada se kiselina otopi u vodi, dio vodikovih atoma koji ulaze u njen sastav gubi svoj elektron - voda postaje kisela, a vodik oksidira. Analitički, svaka reakcija povezana s procesom gubitka elektrona naziva se oksidacija. Obrnuta reakcija - reakcija hvatanja elektrona - naziva se ■postajanje.
Teći
J elektrona
Izvor elektrona >
(oksidacija)
Pozitivan< -
smjer električne struje Sl. 7.1. Elektrokemijska ćelija mora sadržavati izvor i ponor elektrona
U elektrokemijskoj ćeliji, cjelokupna reakcija je podijeljena u dvije međureakcije koje se odvijaju u odvojenim područjima uređaja. Ta su područja spojena elektrolitom, koji je vodič iona, ali provodi elektrone oslobođene u reakciji međuoksidacije, elektroni mogu ući u područje gdje se odvija reakcija redukcije, ali kroz vanjski krug. Dakle, električna struja nastaje u vanjskom krugu, a elektrokemijska ćelija je njen izvor - to je njena svrha. Dogovoreno je da je pozitivni smjer električnog a u vanjskom krugu smjer od reducirajućeg oksidacijskog područja elementa - električna struja napušta element redukcijskog područja, koje je stoga katoda goriva - o elementa, i ulazi u područje oksidacije, koje je anoda. Kao u svakom drugom električnom izvoru, katoda je pozitivno nabijena
aktivna elektroda, a anoda je negativno nabijena elektroda. Kada su u pitanju potrošači električne energije (opterećenje), nazivi se mijenjaju u suprotne. U uvodu Ch. 6 Pojmovi "anoda" i "katoda" razmatraju se detaljnije.
Kao primjer elektrokemijske ćelije razmotrimo membranu koja ima ulogu elektrolita. Neka jedna od bočnih površina membrane bude u kontaktu s vodikom. Pod normalnim uvjetima plin će se pretežno sastojati od molekularnog vodika, ali mali broj molekula može disocirati na atome
a neki od atoma će oksidirati (ionizirati), tj. izgubiti svoj elektron
N -> Nt + e~.
Budući da je membrana nepropusna za elektrone, oni će svi ostati s jedne strane, dok će formirani ioni kroz diff; kroz opnu će se naći s druge strane. U tom slučaju ioni nose pozitivan naboj, pa će površina membrane na kojoj se nalazi vodik postati negativno nabijena zbog viška elektrona koji su se na njoj nakupili, a suprotna površina će postati pozitivno nabijena zbog pozitivnog iona koji su se na njemu pojavili zbog difuzije. Električno polje uzrokuje kretanje nekih iona u suprotnom smjeru od "vodikove" površine membrane. Dinamička ravnoteža u sustavu koji se razmatra uspostavlja se kada je difuzijski tok iona st. i jednak je povratnoj struji.
Nanesite sada elektrovodljivi prah na obje površine membrane. To će rezultirati u dva porozna elektrovodljiva sloja koji će djelovati kao elektrode. Spojimo vanjski grijač1 na elektrode, osiguravajući električni spoj elektroda. Otpor opterećenja na značajan Rl. Ioni se ne mogu kretati u vanjskom krugu, a elektroni se počinju kretati iz "vodikovog" dijela, gdje ih ima u višku, na suprotnu stranu membrane, stvarajući električnu struju u vanjskom krugu, kao na sl. 7.2. Reakcija koja nas zanima događa se na "vodenoj" elektrodi i opisuje se jednadžbom
2H2 -> 4H+ + 4e (anodna reakcija)
Opisana shema rada elementa ima jedan značajan nedostatak: proturječi prvom zakonu termodinamike. Doista, kada električna struja teče kroz vanjsko opterećenje, njezina količina se oslobađa, što je određeno umnoškom I2RL. U isto vrijeme, električni
idući u katodnu regiju, kombiniraju se s H+ ionima, koji difundiraju kroz membranu, tvoreći atome vodika, u konačnici generirajući molekule plina H2 koji se koristi kao "gorivo". Kada bi se proces odvijao prema zadanoj shemi, dobili bismo toplinu bez ikakve potrošnje goriva.
Vanjski krug samo tvori put za kretanje elektrona, ali sam po sebi ne može biti uzrok nastanka električne struje. Baš kao ako spustite jedan kraj cijevi u jezero, voda sama neće teći u cijev. Da bi voda tekla, drugi kraj mora biti ispod površine vode. Slično, da bi se u vanjski krug uvela električna struja, potrebno je smanjiti remodinamički potencijal u katodnom području. Najlakši način za to je dodavanje kisika, čije se molekule spajaju s elektronima i ionima, što rezultira stvaranjem vode:
4e“ + 4N+ + 02 -» 2N20 (katodna reakcija). (4)
Reakcija je egzotermna, tj. odvija se uz oslobađanje pretežno električne energije, a ne toplinske, kao što se događa pri izgaranju vodika. Očito je da ta energija pokreće gorivi element.
Opisani dijagram elektrokemijske ćelije prikazan je na sl. 7.2.
Pod normalnim uvjetima, udio raspršenih molekula vodika * u punom području je mali. Može se malo povećati promjenom fizičkih parametara
metara u skladu s Le Chatelierovim načelom. na primjer, povećanjem temperature sustava. Stupanj disocijacije molekula vodika također se može povećati1 djelovanjem katalizatora.
Kompletna reakcija koja se odvija u elektrokemijskoj ćeliji opisana je jednadžbom:
2H2 + O2 -> 2H20.
Elektrokemijska ćelija, koju je izumio Alessandro Volta (1745.-1. 1800.), bila je prvi uređaj za generiranje električne struje u kontinuiranom načinu rada. Sastojala se od cinkove i srebrne (ili bakrene) baze odvojene listovima papira natopljenim u otopini soli Galvanska baterija nastala je spajanjem elemenata u seriju, elektroda jednog elementa spojena je izravno na CINK elektrodu drugog elementa.
Elektrokemijska Volta ćelija može se izraditi uranjanjem zavarenih i bakrenih elektroda u razrijeđenu (npr. 10%) otopinu te kiseline. Cink će oksidirati:
Zn -> Zr,++ + 2e >
Kao rezultat toga nastaju slobodni elektroni. Otopiti ione cinka u vodi. Sumporna kiselina, kao jaka kiselina1), disocira na ione:
H2S04 - "2N+ + SOf"
Ioni cinka spajaju se sa ionima sulfata i formiraju cink sulfat. Ponovi u obliku hidronijevog iona H" (H20)x kretat će se kroz elektrolit do elektrode, na kojoj će se osloboditi u obliku plinskih mjehurića (kada hidronijev ion uhvati elektrone koji dolaze na elektrodu izvana II Ova vrsta elektrokemijske ćelije u praksi je gotovo beskorisna, jer će se bakrena elektroda vrlo brzo prekriti mjehurićima vodika koji se lijepe na njenu površinu, što će značajno smanjiti protok iona koji ulaze u elektrodu. Takozvane "suhe ćelije" koriste neku metodu za sprječavanje stvaranja izolacijskog sloja plina na površini. Kemijski reagens koji se koristi za apsorpciju vodika naziva se depolarizator. Jedan od utrošenih reagensa obično je
"> Jakost kiseline određena je stupnjem disocijacije njezinih molekula u vodenoj otopini. C kiselina potpuno disocira na H+ i C1_ ione - to je jaka kiselina. Sumporna kiselina je nešto slabija, ali također spada u jake kiseline Iznenađujuće, fluorovodična kiselina, unatoč visokoj korozivnoj aktivnosti, slaba je kiselina - n t otopina na sobnoj temperaturi, udio H+ iona u ukupnoj koncentraciji neutralnih HF molekula manji je od 3%.
žuč, lako podložna oksidaciji; Najčešće se koristi cink. Imajte na umu da bakrena elektroda u Volta elementu ne ulazi u kemijske reakcije, pa se bakar ne troši.
Donedavno su jeftine galvanske baterije koristile Leclanchetove ćelije, kod kojih je anoda izrađena od cinka, a katoda od grafitne šipke presvučene slojem praškastog mangan dioksida s dodatkom grafita (radi povećanja električne vodljivosti). Mangan dioksid apsorbira oslobođeni vodik, čime se sprječava stvaranje plinovitog sloja na površini katode. Kao elektrolit se koristi amonijev klorid. Moderne (alkalne) baterije koriste alkalni elektrolit.
Kada bi cink koji se koristi za materijal anode bio apsolutno čist, trošio bi se samo kada električna struja teče kroz element. Prisutnost nečistoća uzrokuje koroziju elektrode čak i kada se element ne koristi (nečistoće tvore brojne mikroskopske elektrokemijske ćelije unutar materijala elektrode). Kako bi se osigurao dug vijek trajanja takvih baterija, anoda je izrađena od legure cinka i žive (amalgamirane). Trenutačno su Leclanche ćelije gotovo potpuno zamijenjene alkalnim baterijama.
Mnoge kemijske reakcije odvijaju se samo kada se energija dovodi izvana. Često se provode u elektrolitičkim ćelijama (elektrolizerima) na elektrodama spojenim na vanjski izvor struje. Proučavanje ovih reakcija daje informacije o prirodi i svojstvima različitih tvari, a također omogućuje dobivanje novih kemijskih spojeva pomoću elektrosinteze. Elektrokemijski procesi imaju široku primjenu u industriji. Primjeri uključuju proizvodnju klora i aluminija, galvanizaciju i električnu ekstrakciju. Galvanski članci, koji pretvaraju kemijsku energiju u električnu, čine osnovu izvora struje - baterija i akumulatora, kao i gorivih članaka. Elektrokemija proučava i druge električne pojave: ponašanje iona u otopinama elektrolita i prolazak struje kroz takve otopine; odvajanje iona u električnom polju (elektroforeza); korozija i pasivizacija metala; električni učinci u biološkim sustavima (bioelektrokemija); fotoelektrokemijski procesi (učinak svjetlosti na elektrokemijske reakcije u stanicama).
Povijesna referenca.
Provođenje sustavnih elektrokemijskih istraživanja postalo je moguće tek nakon stvaranja stalnog, dovoljno snažnog izvora električne struje. Takav izvor pojavio se na prijelazu iz 18. u 19. stoljeće. kao rezultat rada L. Galvanija i A. Volte. Dok je proučavao fiziološke funkcije žabe, Galvani je slučajno stvorio elektrokemijski krug koji se sastoji od dva različita metala i mišića rasječenog žabljeg bata. Kad se šapa, pričvršćena bakrenim držačem, dotakne željeznom žicom, također spojenom na držač, mišić se kontrahirao. Slične kontrakcije dogodile su se pod utjecajem električnog pražnjenja. Galvani je ovaj fenomen objasnio postojanjem "životinjskog elektriciteta". Drugačije tumačenje ovih pokusa dao je Volta, koji je smatrao da elektricitet nastaje na mjestu dodira dvaju metala, a kontrakcija mišića žabe rezultat je prolaska električne struje kroz njega. Struja se također javljala kada bi se spužvasti materijal (tkanina ili papir) namočen u slanu vodu stavio između dva metalna diska, na primjer cinka i bakra, i zatvorio krug. Povezivanjem 15-20 ovih "elemenata" u seriju, Volta je 1800. stvorio prvi kemijski izvor struje - "voltin stup".
Utjecaj električne energije na kemijske sustave odmah je zainteresirao mnoge znanstvenike. Već 1800. godine W. Nicholson i A. Carlyle objavili su da se voda raspada na vodik i kisik kada kroz nju prođe električna struja pomoću platinastih i zlatnih žica spojenih na “naponski stup”. Najvažnije od ranih elektrokemijskih studija bio je rad engleskog kemičara H. Davyja. Godine 1807. izolirao je element kalij propuštanjem struje kroz blago navlaženu krutu kalijevu lužinu. Izvor napona bila je baterija od 100 galvanskih članaka. Metalni natrij dobiven je na sličan način. Davy je kasnije izolirao magnezij, kalcij, stroncij i barij elektrolizom pomoću živine elektrode.
Davyjev pomoćnik M. Faraday istraživao je odnos između količine elektriciteta (trenutno vrijeme vrijeme) koji teče kroz sučelje elektroda/otopina i kemijskih promjena koje je uzrokovao. Instrument (sada poznat kao plinski kulometar) stvoren je za mjerenje količine elektriciteta iz volumena vodika i kisika koji se oslobađaju u elektrolitičkoj ćeliji, a pokazano je (1833.) da je količina elektriciteta potrebna za dobivanje određene količine tvari ne ovisi o veličini elektroda, udaljenosti između njih i broju ploča u bateriji koja hrani ćeliju. Osim toga, Faraday je otkrio da je količina tvari koja se oslobađa tijekom elektrolize izravno proporcionalna njezinom kemijskom ekvivalentu i količini električne energije koja prolazi kroz elektrolit. (Kemijski ekvivalent je broj grama elementa ili spoja koji reagira ili zamjenjuje jedan mol atoma (1,0078 g) vodika u spojevima; cm. EKVIVALENTNA MASA). Ove dvije temeljne odredbe nazivaju se Faradayevi zakoni. Zajedno sa svojim prijateljem W. Whewellom, specijalistom za klasičnu filologiju, Faraday je razvio i novu terminologiju u elektrokemiji. Vodiče uronjene u otopinu nazvao je elektrodama (prije su se zvali stupovi); uveo pojmove "elektroliza" (kemijske promjene povezane s prolaskom struje), "elektrolit" (vodljiva tekućina u elektrokemijskim ćelijama), "anoda" (elektroda na kojoj se odvija reakcija oksidacije) i "katoda" (elektroda na kojoj se dolazi do reakcije redukcije). Nositelje naboja u tekućinama nazvao je ionima (od grčkog "lutalica", "lutalica"), a ione koji se kreću prema anodi (pozitivnoj elektrodi) nazivaju "anionima", a one koji se kreću prema katodi - "kationima". Faradayeva istraživanja elektromagnetske indukcije dovela su do stvaranja električnih generatora, koji su omogućili izvođenje elektrokemijskih procesa u industrijskim razmjerima.
Faraday je sposobnost otopina da propuštaju električnu struju objasnio prisutnošću iona u njima, ali on sam i drugi znanstvenici, poput I. Hittorfa i F. Kohlrauscha, vjerovali su da ioni nastaju pod utjecajem struje. Godine 1884. S. Arrhenius je predložio da zapravo ioni nastaju jednostavno kada se sol otopi u vodi. Radovi S. Arrheniusa, J. van't Hoffa i W. Ostwalda bili su važna prekretnica u razvoju teorije elektrolita i ideja o fizikalno-kemijskim svojstvima otopina i njihovoj termodinamici. Podudarnost između teorije i eksperimentalnih podataka o ionskoj vodljivosti i ravnotežama u otopini postala je potpunija nakon što su P. Debye i E. Hückel 1923. godine uzeli u obzir dugodometne elektrostatske interakcije između iona.
Veliki doprinos elektrokemijskoj termodinamici, a posebno razjašnjavanju prirode električnog potencijala (napona) u elektrokemijskoj ćeliji i ravnoteže između električne, kemijske i toplinske energije dali su J. Gibbs i W. Nernst. Elektrokemijski potencijal određen je kemijskom energijom procesa koji se odvijaju u stanici, ali ovisi i o njihovoj brzini (kinetici). Modeliranjem kinetičkih procesa na elektrodama bavili su se Y. Tafel (1905), J. Butler (1924), M. Volmer (1930), A. N. Frumkin (1930–1933).
Elektrokemijske ćelije.
Elektrokemijska ćelija obično se sastoji od dvije polućelije, od kojih je svaka elektroda uronjena u svoj elektrolit. Elektrode su izrađene od elektrovodljivog materijala (metala ili ugljika), rjeđe od poluvodiča. Nositelji naboja u elektrodama su elektroni, a nositelji naboja u elektrolitu su ioni. Vodena otopina kuhinjske soli (natrijev klorid NaCl), koja je elektrolit, sadrži nabijene čestice: natrijeve katione Na + i klorove anione Cl –. Ako takvu otopinu stavite u električno polje, ioni Na + će se pomaknuti na negativni pol, a ioni Cl – na pozitivni pol. Otopljene soli, poput NaCl, također su elektroliti. Elektroliti također mogu biti krute tvari, na primjer b- aluminijev oksid (natrijev polialuminat) koji sadrži pokretne natrijeve ione ili polimere ionske izmjene.
Polućelije su odvojene pregradom, koja ne ometa kretanje iona, ali sprječava miješanje elektrolita. Ulogu takve pregrade može imati solni most, cijev s vodenom otopinom zatvorena s oba kraja staklenom vunom, membrana za ionsku izmjenu ili porozna staklena ploča. Obje elektrode elektrolitičke ćelije mogu se uroniti u isti elektrolit.
Postoje dvije vrste elektrokemijskih ćelija: galvanske ćelije i elektrolitičke ćelije (elektrolizeri). U galvanskom članku kemijske reakcije odvijaju se spontano na granici elektroda/elektrolit, a elektrode su međusobno povezane vodičem. Više galvanskih članaka spojenih u seriju čine bateriju – kemijski izvor struje. U elektrolitičkoj ćeliji, reakcije na sučelju elektroda/elektrolit događaju se zbog vanjskog izvora električne energije; potonja se pretvara u kemijsku energiju produkata reakcije koji nastaju na elektrodama. Struktura galvanskog članka prikazana je na sl. 1, a elektrolizer - na sl. 2. Imajte na umu da se ista ćelija, ovisno o načinu rada, može ponašati ili kao galvanska ćelija ili kao elektrolizator. Dakle, olovni akumulator automobila djeluje kao galvanski članak kada se koristi za pokretanje motora (dok ga prazni), i kao elektrolizator kada se puni iz automobilskog generatora ili punjača.
Jednostavna galvanska ćelija, koju je 1836. stvorio J. Daniel (slika 1), sastoji se od dvije elektrode: cinkove, uronjene u vodenu otopinu cinkovog sulfata, i bakrene, uronjene u vodenu otopinu bakrovog (II) sulfata. Takav je element sličan parovima bakar-cink u voltovom stupcu. Kada je vanjski krug zatvoren, atomi cinka na površini cinčane elektrode oksidiraju se u ione uz oslobađanje elektrona: Zn ® Zn 2+ + 2e – . Ti se elektroni kreću duž vanjskog kruga do bakrene elektrode i reduciraju ione bakra u atome: Cu 2+ + 2e – ® Cu. Protok elektrona u vanjskom krugu je struja koju stvara element. Ukupna reakcija koja vodi do kemijske transformacije i stvaranja električne energije ima oblik
Potpuno ista reakcija događa se kada se metalni cink doda otopini bakrenog sulfata, ali u ovom slučaju se kemijska energija pretvara u toplinsku energiju.
Elektrokemijske ćelije često se shematski prikazuju označavanjem granice između elektrode i elektrolita okomitom ili kosom crtom (| ili /), a slani most s dvije kose crte (//). Dakle, galvanski članak na Sl. 1 unos odgovora
gdje je M molarna koncentracija otopine.
U elektrolitičkoj ćeliji prikazanoj na Sl. 2, odvijaju se iste reakcije kao u industrijskim elektrolizerima za proizvodnju klora i lužina: pretvaranje slane vode (koncentrirane vodene otopine natrijevog klorida) u klor i natrijev hidroksid NaOH:
Kloridni ioni na grafitnoj elektrodi oksidiraju se u plinoviti klor, a voda na željeznoj elektrodi reducira se u ione vodika i hidroksida. Elektroliti ostaju električki neutralni zahvaljujući kretanju natrijevih iona kroz pregradu - membranu za ionsku izmjenu. Elektroda na kojoj se odvija oksidacija (cink na sl. 1 i grafit na sl. 2) naziva se anoda, a elektroda na kojoj dolazi do redukcije katoda.
Potencijal elektrode.
Glavni električni parametri elektrokemijskih ćelija su struja (mjerena u amperima, A) i potencijal (mjerena u voltima, V). Jakost struje određena je brzinom reakcija elektroda, a potencijal je određen kemijskom energijom procesa koji se odvijaju u ćeliji. Jednaka je energiji (mjerenoj u džulima, J) podijeljenoj s količinom elektriciteta (mjerenoj u kulonima, C), tj. 1 V = 1 J / Cl. Stoga je potencijal elementa (elektromotorna sila, emf) mjera energije koja se stvara tijekom reakcija koje se u njemu odvijaju. Ako je vanjski krug otvoren, ne dolazi do reakcije elektrode.
Potencijal galvanskog članka s otvorenim vanjskim krugom pruža informacije o termodinamici njegovih reakcija. Potencijal elementa prikazanog na sl. 1, pri koncentraciji otopine od 1 M i temperaturi od 25 ° C - njegov standardni potencijal E° – jednako 1,10 V. Odgovarajuća energija, Gibbsov termodinamički potencijal, D G°, dano je pomoću
Gdje n– broj elektrona prenesenih tijekom reakcije (u ovom slučaju 2), F– Faradayev broj (96 485 C / madež). Potencijal galvanskog članka jednak je razlici potencijala između njegova dva poluelementa, tj. razlika u njegovim elektrodnim potencijalima. Potencijali elektroda mjere se u odnosu na potencijal referentne elektrode, za koji se konvencionalno uzima da je nula ( cm. stol). Dogovorom je kao standardna elektroda odabrana normalna vodikova elektroda (N.H.E.); to je ploča od platine, koja je obložena platinastom crnilom, zasićena vodikovim plinom pri tlaku od 1,01H 10 5 Pa (1 atm.) i uronjena u otopinu koja sadrži H + ione s termodinamičkom aktivnošću a= 1. Shematski se ova elektroda može prikazati kao Pt/H 2 (1,01H 10 5 Pa)/H + ( a= 1). Na njemu se odvija reakcija 2H + + 2e – ® H 2 . Za određivanje standardnog potencijala Cu/Cu 2+ bakrene elektrode sastavite sljedeći galvanski član:
a za polureakciju Cu 2+ + 2e – ® Cu mjerenje daje
Slično, za polućeliju Zn/Zn 2+, u kojoj se odvija reakcija Zn 2+ + 2e – ® Zn, dobivamo
Razlika između ova dva standardna elektrodna potencijala jednaka je standardnom potencijalu elementa Zn–Cu.
Naime, vodikova elektroda se rijetko koristi u potenciometrijskim mjerenjima, budući da predstavlja idealan sustav koji je teško implementirati u praksi. Mnogo češće se koriste praktičnije i kompaktnije elektrode za usporedbu različitih vrsta, koje imaju specifičnu, pažljivo izmjerenu vrijednost potencijala u odnosu na struju. Obično se koristi kalomel elektroda (CE), koja se sastoji od metalne žive, živinog klorida (kalomel) i otopine kalijevog klorida: Hg /Hg 2 Cl 2 /KCl. Na elektrodi se događa sljedeća reakcija:
Potencijalni k.e. ovisi o koncentraciji živinih iona, a potonja ovisi o koncentraciji otopine KCl. Za zasićenu otopinu KCl E° (k.e.) av = 0,2412 V (n.e.) na 25 °C.
|
STANDARDNI POTENCIJALI ELEKTRODA |
|
| Reakcija elektrode |
E o, V |
| Li + + e – ® Li | |
| Mg 2+ + 2e – ® Mg | |
| Al 3+ + 3e – ® Al | |
| Zn 2+ + 2e – ® Zn | |
| Cr 3+ + e – ® Cr 2+ | |
| 2H + + 2e – ® H 2 | |
| Cu 2+ + 2e – ® Cu | |
| Fe 3+ + e – ® Fe 2+ | |
| O 2 + 4H + + 4e – ® 2H 2 O | |
| Cl 2 + 2e – ® 2Cl – | |
| F 2 + 2e – ® 2F – | |
Imajte na umu da tvar nekih elektroda nije uključena u jednadžbu odgovarajuće reakcije. Da, reakcija
zapravo se događa na platinskoj elektrodi u Pt/Fe 3+, Fe 2+ ćeliji. Platinasta elektroda je inertna i omogućuje kontakt samo s elektrolitom koji sadrži oksidirane i reducirane oblike elementa (u ovom slučaju ione dvovalentnog i trovalentnog željeza). Platinasta elektroda ima istu ulogu u N.V.E.
Tablice elektrodnih potencijala omogućuju vam izračunavanje EMF galvanskog članka na temelju njegovih elektrodnih potencijala. Također se mogu koristiti za predviđanje hoće li se dogoditi određena redoks reakcija. O standardnom potencijalu elektrode možemo govoriti samo kada je aktivnost komponenti koje sudjeluju u reakciji jednaka 1, tj. njihova koncentracija u otopini je blizu 1M. Potencijal elektrode E ovisi o koncentraciji oksidiranih i reduciranih oblika u otopini i povezan je s njima i standardnim potencijalom E° Nernstova jednadžba. Za generaliziranu reakciju
vol + n e – = crveno
ova jednadžba ima oblik
Gdje R– univerzalna plinska konstanta, T– apsolutna temperatura i – aktivnosti oksidiranih i reduciranih oblika. Aktivnosti čistih krutina i tekućina smatraju se 1. Na 25°C RT/F= 0,025 V. Mjerenjem potencijala elektrode u odnosu na potencijal referentne elektrode moguće je pomoću jednadžbe (10) odrediti koncentracije tvari u otopini; ova metoda se naziva potenciometrija.
Elektrodne reakcije.
Potenciometrijska mjerenja provode se u uvjetima kada u elektrokemijskoj ćeliji nema struje. To znači da se u njemu ne događaju sveukupne kemijske promjene, a izmjereni potencijal (ravnoteža) određen je termodinamikom reakcija. U tim uvjetima čimbenici poput veličine i oblika elektroda ili intenziteta miješanja otopine ne utječu na izmjereni potencijal. Ako struja teče kroz elektrokemijsku ćeliju, tada brzina elektrodnih reakcija ne ovisi samo o termodinamičkim parametrima, već io jakosti struje u skladu s jednadžbom
Gdje n– broj elektrona koji sudjeluju u danoj elektrodnoj reakciji, F– Faradayev broj. U ovom slučaju potencijal elektrokemijske ćelije ovisi o kinetičkim čimbenicima, kao io materijalu od kojeg je elektroda izrađena, veličini i obliku elektrode, intenzitetu miješanja otopine i mnogim drugim čimbenicima. Unutarnji otpor ćelije ne može se zanemariti. Uz razliku potencijala na obje granice elektroda/elektrolit, dolazi do pada napona u samoj otopini, zbog njezinog otpora. Ovaj pad napona otežava proučavanje učinaka povezanih s reakcijama koje se odvijaju na obje elektrode. Obično se reakcija proučava na jednoj elektrodi, koja se naziva radna ili indikatorska elektroda, pomoću ćelije s tri elektrode (slika 3): treća elektroda (na primjer, zasićeni kalomel) postavlja se u isti odjeljak kao i radna elektroda. jedan, što bliže njemu kako bi se smanjio učinak ohmičkog pada napona. Mjerenjem struje kroz radnu elektrodu u ovisnosti o potencijalu ove elektrode u odnosu na referentnu elektrodu dobiva se tzv. polarizacijska krivulja.
Prolaskom vanjske struje potencijal elektrode se razlikuje od ravnotežnog. To odstupanje naziva se polarizacija, a njegova veličina prenapon. Prenapon ovisi o nekoliko čimbenika koji ograničavaju brzinu reakcija elektrode. Brze elektrodne reakcije pri određenoj gustoći struje (jačina struje po jedinici površine elektrode) događaju se pri potencijalima bliskim termodinamičkim, a time i pri niskom prenaponu. Spore reakcije karakteriziraju visoki prenapon. Brzine elektrodnih reakcija, a time i prenapona, ovise o koncentraciji reagensa, temperaturi, otapalu, materijalu elektrode, načinu i brzini prijenosa mase i gustoći struje. Ukupni prenapon može se rastaviti na nekoliko komponenti: koncentracija, aktivacija i reakcija.
Prenapon koncentracije uzrokovan je činjenicom da se pri prolasku struje mijenja koncentracija iona koji reagira na površini elektrode, budući da se u tom području troše elektroaktivne tvari i nastaju produkti reakcije. Razmotrimo redukciju Cu 2+ na bakrenoj elektrodi. U početku je koncentracija Cu 2+ u otopini 1M. U nedostatku struje u krugu, potencijal bakrene elektrode je blizu standardnog potencijala para Cu/Cu 2+, tj. 0,34 V u odnosu na N.E. [ cm. jednadžba (6)]. Prolaskom katodne struje koncentracija Cu 2+ iona na površini elektrode opada, a katodni potencijal, u skladu s Nernstovom jednadžbom (10), postaje sve negativniji. Svježi dijelovi reagensa dolaze iz otopine na elektrodu na različite načine: kao rezultat difuzije, konvekcije i migracije. Što je veća brzina tih procesa (npr. što je miješanje intenzivnije), koncentracijski je prenapon manji. Ova se komponenta ukupnog prenapona često može izračunati. Ako koncentracijska polarizacija daje glavni doprinos ukupnom prenaponu (to znači da je brzina preostalih stupnjeva elektrodne reakcije visoka), tada se reakcija naziva reverzibilnom ili Nernstianom.
Aktivacijski prenapon nastaje kao rezultat činjenice da se prijenos elektrona na površini elektrode ne događa trenutno, već konačnom brzinom. Razmotrimo generaliziranu elektrodnu reakciju ox + n e – = crveno. Da bi se elektroni prenijeli na oksidirane spojeve zadanom brzinom (tj. zadanom gustoćom struje), potrebno je prevladati energetsku barijeru koja se naziva energija aktivacije elektrodne reakcije. Ova energija se dobiva primijenjenim potencijalom. Odnos između gustoće struje i aktivacijskog prenapona opisan je Butler–Volmerovim i Tafelovim jednadžbama, koje se mogu koristiti za određivanje kinetičkih parametara elektrodnih reakcija. Mnoge elektrodne reakcije, poput redukcije vode u vodik i njezine oksidacije u kisik, odvijaju se sporo. Brzina reakcije elektrode može uvelike ovisiti o materijalu od kojeg je elektroda izrađena i svojstvima njezine površine. Na primjer, na živinoj elektrodi, redukcija vode u vodik je znatno teška: karakterizirana je visokim vodikovim prenaponom. Ova reakcija se odvija puno brže i s manjim prenaponom na platini; Zbog toga se platina koristi u vodikovoj referentnoj elektrodi. Brzina reakcija također ovisi o tvarima koje su adsorbirane ili vezane na površinu elektrode; Stoga cijanidni ion i brojni organski spojevi smanjuju brzinu razvijanja vodika na površini platinske elektrode. Istodobno, neki surfaktanti mogu značajno povećati brzinu reakcije elektrode - nazivaju se elektrokatalizatori.
Reakcijski prenapon nastaje kada je prijenos elektrona na elektrodi povezan s kemijskom reakcijom u otopini. Takva reakcija može poslužiti kao izvor čestica uključenih u prijenos elektrona, au isto vrijeme ograničiti brzinu cjelokupnog elektrodnog procesa. Zbog toga je toliko važno znati pojedinosti mehanizma (tj. stadija i međustanja) elektrodnih reakcija. U mnogim slučajevima početni materijal prolazi nekoliko transformacija prije nego što postane konačni proizvod na elektrodi, kao u slučaju redukcije kisika u vodu, procesa od velike praktične važnosti. Ukupna reakcija ima oblik
i sastoji se od nekoliko faza, u jednoj od njih dolazi do prekida veze kisik-kisik. Zbog ove višestupanjske reakcije, reakcija na većini elektroda je spora, au industrijskoj mjeri se odvija u prisutnosti elektrokatalizatora. Mehanizam elektrodnih reakcija proučava se pomoću elektroanalitičkih metoda opisanih u nastavku. Često se tijek reakcije mijenja kada se promijeni sastav otopine i priroda otapala. Na primjer, redukcija kisika u acetonitrilu, gdje postoji manjak protona, odvija se u skladu s jednostavnim mehanizmom jednog elektrona:
Elektrokemijske metode analize.
Za kvalitativnu i kvantitativnu analizu kemijskih tvari razvijene su različite elektrokemijske metode, koje su često korisne i za određivanje termodinamičkih i kinetičkih parametara elektrodnih reakcija i proučavanje njihovih mehanizama.
Konduktometrija
temelji se na mjerenju električne vodljivosti otopine i koristi se za određivanje koncentracije soli, kiselina, baza itd. U konduktometrijskim određivanjima obično se koriste elektrode izrađene od identičnih materijala, a uvjeti za njihovo provođenje odabrani su na takav način da minimiziraju doprinos skokova potencijala na oba sučelja elektroda/elektrolit (na primjer, koristi se visokofrekventna izmjenična struja ). U ovom slučaju, glavni doprinos izmjerenom potencijalu ćelije daje omski pad napona IR, Gdje R– otpor otopine. Električna vodljivost jednokomponentne otopine može se povezati s njezinom koncentracijom, a mjerenje električne vodljivosti elektrolita složenog sastava omogućuje procjenu ukupnog sadržaja iona u otopini i koristi se, na primjer, u praćenju kvalitete destilirane ili deionizirane vode. U drugoj vrsti konduktometrije – konduktometrijskoj titraciji – analiziranoj otopini se u obrocima dodaje poznati reagens i prati se promjena električne vodljivosti. Točka ekvivalencije, na kojoj se bilježi oštra promjena električne vodljivosti, određuje se iz grafikona ovisnosti ove vrijednosti o volumenu dodanog reagensa.
Potenciometrija
koristi se za određivanje različitih fizikalno-kemijskih parametara na temelju podataka o potencijalu galvanskog članka. Potencijal elektrode u odsutnosti struje u elektrokemijskom krugu, mjeren u odnosu na referentnu elektrodu, povezan je s koncentracijom otopine Nernstovom jednadžbom. U potenciometrijskim mjerenjima široko se koriste ion-selektivne elektrode koje su osjetljive prvenstveno na jedan ion u otopini: staklena elektroda za mjerenje pH i elektrode za selektivno određivanje iona natrija, amonija, fluora, kalcija, magnezija itd. Površina sloj ion-selektivne elektrode može uključivati enzime, a rezultat je sustav koji je osjetljiv na odgovarajuću podlogu. Imajte na umu da potencijal ion-selektivne elektrode nije određen prijenosom elektrona, kao u slučaju tvari s elektronskom vodljivošću, već uglavnom prijenosom ili izmjenom iona. Međutim, Nernstova jednadžba, koja povezuje potencijal elektrode s logaritmom koncentracije (ili aktivnosti) tvari u otopini, također je primjenjiva na takvu elektrodu. Kod potenciometrijske titracije, reagens se dodaje otopini koja se analizira u obrocima i prati se promjena potencijala. Krivulje u obliku slova S karakteristične za ovu vrstu titracije omogućuju određivanje točke ekvivalencije i pronalaženje termodinamičkih parametara kao što su konstanta ravnoteže i standardni potencijal.
Voltametrija.
Sve vrste voltametrijskih metoda koriste radnu mikroelektrodu s površinom od 10–7–10–1 cm2. Pomoću njega dobivene strujno-naponske krivulje omogućuju identifikaciju otopljenih tvari, određivanje njihove koncentracije, a često i termodinamičkih i kinetičkih parametara. Prvu voltametrijsku metodu - polarografiju - predložio je 1922. godine češki kemičar J. Heyrovsky. Radna elektroda u njegovoj postavi bila je kapajuća živina elektroda. Živa ima visok prenapon vodika, tako da je živina elektroda prikladna za proučavanje procesa koji se odvijaju pri negativnim potencijalima. Površina elektrode se tijekom procesa mjerenja stalno obnavlja, čime se eliminira onečišćenje elektrode. Voltametrijske studije također se provode pomoću čvrstih elektroda, kao što su platina i ugljik, i koriste procese koji se odvijaju na pozitivnim potencijalima. U linearnoj voltametriji (kronoamperometriji), potencijal se mijenja linearno s vremenom i otopina se ne miješa, tako da se prijenos mase događa isključivo zbog difuzije. U cikličkoj voltametriji, ponovljeni trokutasti naponski impulsi primjenjuju se na elektrodu. Tvari nastale u uzlaznom dijelu ciklusa proučavaju se u njegovom silaznom dijelu. Ova metoda je posebno učinkovita za proučavanje mehanizma elektrodnih reakcija analizom polarizacijskih krivulja pri različitim brzinama pomicanja potencijala i različitim koncentracijama otopine. Postoje i druge vrste voltametrije - diferencijalni puls i kvadratni val - u kojima se naponski impulsi različitih oblika superponiraju na linearno rastući potencijal. Ove metode se široko koriste za određivanje malih koncentracija tvari u otopini. Ako se tijekom voltametrijskog mjerenja otopina miješa, što znači da se prijenos mase odvija istovremeno konvekcijom i difuzijom, tada govorimo o hidrodinamičkoj voltametriji. U ovom slučaju, prikladno je koristiti rotirajuću disk elektrodu, budući da se eksperimentalne krivulje struje i napona mogu izravno usporediti s teorijskim.
Amperometrija.
Metoda se temelji na mjerenju granične difuzijske struje koja prolazi kroz otopinu pri fiksnom naponu između indikatorske elektrode i referentne elektrode. Kod amperometrijske titracije točka ekvivalencije određena je lomom krivulje struje – volumen dodane radne otopine. Kronoamperometrijske metode temelje se na mjerenju ovisnosti struje o vremenu i uglavnom se koriste za određivanje koeficijenata difuzije i konstanti brzine. Minijaturne elektrokemijske ćelije koje služe kao senzori na izlazu kolona tekućinskog kromatografa rade na principu amperometrije (kao i voltametrije). Galvanostatske metode slične su amperometrijskim, ali mjere potencijal kada određena količina struje prolazi kroz ćeliju. Dakle, u kronopotenciometriji se kontrolira promjena potencijala tijekom vremena. Ove se metode uglavnom koriste za proučavanje kinetike elektrodnih reakcija.
Kulometrija.
U kulometriji, pri kontroliranom potencijalu, potpuna elektroliza otopine provodi se intenzivnim miješanjem u elektrolizeru s relativno velikom radnom elektrodom (donja živina ili platinska mreža). Ukupna količina električne energije ( Q, C) potrebna za elektrolizu povezana je s količinom tvari koja tvori ( A, d) Faradayev zakon:
Gdje M- oni kažu masa (g/mol), F- Faradayev broj. Kulometrijska titracija uključuje korištenje konstantne struje za elektrolitičko stvaranje reagensa koji reagira s tvari koja se određuje. Napredak titracije kontrolira se potenciometrijski ili amperometrijski. Kulometrijske metode su prikladne jer su apsolutne prirode (tj. omogućuju vam izračunavanje količine analita bez pribjegavanja kalibracijskim krivuljama) i neosjetljive su na promjene u uvjetima elektrolize i parametrima elektrolizatora (površina elektrode ili intenzitet miješanja). U kulogravimetriji se količina tvari koja je podvrgnuta elektrolizi određuje vaganjem elektrode prije i poslije elektrolize.
Postoje i druge elektroanalitičke metode. U polarografiji izmjenične struje, sinusoidni napon male amplitude primjenjuje se na linearno promjenjiv potencijal u širokom frekvencijskom rasponu i određuje se ili amplituda i fazni pomak rezultirajuće izmjenične struje ili impedancija. Iz tih podataka dobivaju se informacije o prirodi tvari u otopini te o mehanizmu i kinetici elektrodnih reakcija. Tankoslojne metode koriste elektrokemijske ćelije sa slojem elektrolita debljine 10-100 µm. U takvim ćelijama elektroliza se odvija brže nego u konvencionalnim elektrolizerima. Za proučavanje elektrodnih procesa koriste se spektrokemijske metode sa spektrofotometrijskom registracijom. Za analizu tvari formiranih na površini elektrode, mjeri se njihova apsorpcija svjetlosti u vidljivom, UV i IR području. Promjene svojstava površine elektrode i medija prate se metodama električne refleksije i elipsometrije, koje se temelje na mjerenju refleksije zračenja od površine elektrode. To uključuje metode zrcalne refleksije i Ramanovog raspršenja svjetlosti (Ramanova spektroskopija), spektroskopiju drugog harmonika (Fourierovu spektroskopiju).
Ostali elektrokemijski fenomeni i metode.
Relativnim kretanjem elektrolita i nabijenih čestica ili površina dolazi do elektrokinetičkih učinaka. Važan primjer ove vrste je elektroforeza, u kojoj dolazi do odvajanja nabijenih čestica (na primjer, proteinskih molekula ili koloidnih čestica) koje se kreću u električnom polju. Elektroforetske metode naširoko se koriste za odvajanje proteina ili deoksiribonukleinskih kiselina (DNK) u gelovima. Električni fenomeni imaju veliku ulogu u funkcioniranju živih organizama: oni su odgovorni za stvaranje i širenje živčanih impulsa, pojavu transmembranskih potencijala itd. Za proučavanje bioloških sustava i njihovih komponenti koriste se različite elektrokemijske metode. Također je zanimljivo proučavati utjecaj svjetlosti na elektrokemijske procese. Dakle, predmet fotoelektrokemijskih istraživanja je stvaranje električne energije i pokretanje kemijskih reakcija pod utjecajem svjetlosti, što je vrlo važno za povećanje učinkovitosti pretvaranja sunčeve energije u električnu. Ovdje se obično koriste poluvodičke elektrode od titanijevog dioksida, kadmijeva sulfida, galijevog arsenida i silicija. Još jedna zanimljiva pojava je elektrokemiluminiscencija, tj. stvaranje svjetlosti u elektrokemijskoj ćeliji. Uočava se kada se na elektrodama stvaraju produkti visoke energije. Često se postupak provodi na ciklički način kako bi se dobili i oksidirani i reducirani oblici danog spoja. Njihova međusobna interakcija dovodi do stvaranja pobuđenih molekula, koje emisijom svjetlosti prelaze u osnovno stanje.
Primijenjena elektrokemija.
Elektrokemija ima mnoge praktične primjene. Uz pomoć primarnih galvanskih članaka (jednokratnih elemenata) spojenih na baterije, kemijska se energija pretvara u električnu. Sekundarni izvori struje – baterije – skladište električnu energiju. Gorive ćelije primarni su izvori energije koji stvaraju električnu energiju kontinuiranom opskrbom reaktantima (kao što su vodik i kisik). Ovi principi leže u osnovi prijenosnih izvora energije i baterija koje se koriste na svemirskim postajama, električnim vozilima i elektroničkim uređajima.
Velika proizvodnja mnogih tvari temelji se na elektrokemijskoj sintezi. Elektrolizom slane vode u klor-alkalnom procesu nastaju klor i lužine, koji se zatim koriste za proizvodnju organskih spojeva i polimera, kao i u industriji celuloze i papira. Produkti elektrolize su spojevi kao što su natrijev klorat, persulfat, natrijev permanganat; Elektroekstrakcijom se dobivaju industrijski važni metali: aluminij, magnezij, litij, natrij i titan. Bolje je koristiti rastaljene soli kao elektrolite, jer u ovom slučaju, za razliku od vodenih otopina, redukcija metala nije komplicirana oslobađanjem vodika. Fluor se proizvodi elektrolizom u rastaljenoj soli. Elektrokemijski procesi služe kao osnova za sintezu nekih organskih spojeva; npr. hidrodimerizacijom akrilonitrila dobiva se adiponitril (intermedijer u sintezi najlona).
Galvanska obrada srebra, zlata, kroma, mesinga, bronce i drugih metala i legura naširoko se prakticira na raznim predmetima u svrhu zaštite čeličnih proizvoda od korozije, u dekorativne svrhe, za izradu električnih konektora i tiskanih pločica u elektroničkoj industriji. Elektrokemijske metode koriste se za visokopreciznu dimenzionalnu obradu izradaka od metala i legura, posebno onih koji se ne mogu obraditi konvencionalnim mehaničkim metodama, kao i za izradu dijelova složenih profila. Kada je površina metala kao što su aluminij i titan anodizirana, stvaraju se zaštitni oksidni filmovi. Takvi se filmovi stvaraju na površini obradaka od aluminija, tantala i niobija u proizvodnji elektrolitskih kondenzatora, a ponekad i u dekorativne svrhe.
Elektrokemijske metode često se koriste kao temelj istraživanja procesa korozije i odabira materijala koji usporavaju te procese. Korozija metalnih konstrukcija može se spriječiti katodnom zaštitom, za koju se vanjski izvor spaja na konstrukciju koja se štiti, a anoda i konstrukcija se održavaju na takvom potencijalu da je isključena njezina oksidacija. Istražuju se mogućnosti praktične primjene drugih elektrokemijskih procesa. Dakle, elektroliza se može koristiti za pročišćavanje vode. Vrlo obećavajući smjer je pretvorba sunčeve energije pomoću fotokemijskih metoda. Razvijaju se elektrokemijski monitori čiji se princip rada temelji na elektrokemiluminiscenciji. Spomenimo i proučavanje reverzibilnih promjena boje površine elektrode kao rezultat elektrodnih reakcija.
Književnost:
Agladze R.I. Primijenjena elektrokemija. M. – L., 1975
Izmailov N.A. Elektrokemija otopina. M., 1976
Mjerne metode u elektrokemiji, sv. 1–2. M., 1977
Koryta I. Ioni, elektrode, membrane. M., 1983
Bagotsky V.S. Osnove elektrokemije. M., 1988