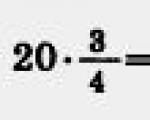Tabel proses isotermal. Hukum gas ideal
Proses utama dalam termodinamika adalah:
- isokorik, mengalir pada volume konstan;
- isobarik mengalir pada tekanan konstan;
- isotermal, terjadi pada suhu konstan;
- adiabatik, di mana tidak ada pertukaran panas dengan lingkungan;
- politropik, memenuhi persamaan pvn= konstanta
Proses isokorik, isobarik, isotermal, dan adiabatik adalah kasus khusus dari proses politropik.
Dalam studi proses termodinamika menentukan:
- persamaan proses di P— ay Dan T— S koordinat;
- hubungan antara parameter keadaan gas;
- perubahan energi internal;
- jumlah pekerjaan eksternal;
- jumlah panas yang disuplai ke proses atau jumlah panas yang dipindahkan.
Proses isokorik


Proses isokorik diP, ay— , T, S- DanSaya, S-koordinat (diagram)
Dalam proses isokorik, kondisinya ay= konstanta
Dari persamaan keadaan gas ideal ( pv = RT) berikut:
p/T = R/V= konstanta,
yaitu, tekanan gas berbanding lurus dengan suhu absolutnya:
p2/p1 = T2 /T1.
Pekerjaan ekspansi dalam proses isokorik adalah nol ( l= 0), karena volume fluida kerja tidak berubah (Δ ay= konstanta).
Jumlah panas yang dipasok ke fluida kerja dalam proses 1-2 di CV
Q= CV(T 2 — T 1 ).
T. ke. l= 0, maka berdasarkan hukum pertama termodinamika Δ kamu = Q, artinya perubahan energi dalam dapat ditentukan dengan rumus:
Δ kamu = c v (T 2 - T 1).
Perubahan entropi dalam proses isokorik ditentukan oleh rumus:
s2–s1= Δ S = CV dalam( p2/p1) = CV dalam( T2 /T1).
proses isobarik



proses isobarik diP, ay— , T, S- DanSaya, S-koordinat (diagram)
Proses isobarik adalah salah satu yang berlangsung pada tekanan konstan. P= konstanta Dari persamaan keadaan untuk gas ideal berikut ini:
v/T = R/p= konstanta
v2/v1 = T2/T1 ,
yaitu, dalam proses isobarik, volume gas sebanding dengan suhu absolutnya.
Pekerjaan akan menjadi:
l = P(ay 2 – ay 1 ).
T. ke. pv 1 = RT 1 Dan pv 2 = RT 2 , Itu
l = R(T2-T1).
Jumlah panas di cp= const ditentukan dengan rumus:
Q = cp(T2-T1).
Perubahan entropi akan menjadi:
s2–s1= Δ S = cp dalam( T2 /T1).
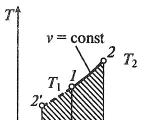
Proses isotermal



Proses isotermal diP, ay— , T, S- DanSaya, S-koordinat (diagram)
Dalam proses isotermal, suhu fluida kerja tetap konstan T= konstanta, jadi:
pv = RT= konstanta
p2/p1 = v1/v2,
yaitu, tekanan dan volume berbanding terbalik satu sama lain, sehingga selama kompresi isotermal tekanan gas meningkat, dan selama ekspansi menurun.
Pekerjaan proses akan sama dengan:
l = RT dalam ( v2 – v1) = RT dalam ( p1 – p2).
Karena suhu tetap tidak berubah, energi dalam gas ideal dalam proses isotermal tetap konstan (Δ kamu= 0) dan semua panas yang disuplai ke fluida kerja sepenuhnya diubah menjadi kerja ekspansi:
Q = l.
Selama kompresi isotermal, panas dihilangkan dari fluida kerja dalam jumlah yang sama dengan kerja yang dikeluarkan untuk kompresi.
Perubahan entropi adalah:
s2–s1= Δ S = R dalam( p1/p2) = R dalam( v2/v1).
proses adiabatik



proses adiabatik diP, ay— , T, S- DanSaya, S-koordinat (diagram)
Proses adiabatik adalah perubahan keadaan gas yang terjadi tanpa pertukaran panas dengan lingkungan. Sejak d Q= 0, maka persamaan hukum pertama termodinamika untuk proses adiabatik akan berbentuk:
D kamu + P D ay = 0
Δ kamu+ l = 0,
karena itu
Δ kamu= —l.
Dalam proses adiabatik, pekerjaan ekspansi dilakukan hanya karena pengeluaran energi internal gas, dan selama kompresi, yang terjadi karena aksi gaya eksternal, semua pekerjaan yang dilakukan oleh mereka digunakan untuk meningkatkan energi internal. dari gas.
Mari kita tunjukkan kapasitas panas dalam proses adiabatik melalui C neraka, dan kondisi d Q= 0 dinyatakan sebagai berikut:
D Q = C neraka d T = 0.
Kondisi ini menyatakan bahwa kapasitas kalor pada proses adiabatik adalah nol ( C neraka = 0).
Diketahui bahwa
DenganP/CV= k
dan persamaan kurva proses adiabatik (adiabatik) pada P, ay-diagram terlihat seperti:
p.v.k= konstanta
Dalam ungkapan ini k disebut eksponen adiabatik(juga disebut rasio Poisson).
Nilai eksponen adiabatikkuntuk beberapa gas:
k udara = 1,4
k uap super panas = 1,3
k Knalpot ICE = 1,33
k uap basah jenuh = 1,135
Dari rumus sebelumnya berikut ini:
l= — Δ kamu = CV(T 1 – T 2 );
Saya 1 – Saya 2 = cp(T 1 – T 2 ).
Pekerjaan teknis dari proses adiabatik ( l tech) sama dengan perbedaan antara entalpi awal dan akhir proses ( Saya 1 – Saya 2 ).
Proses adiabatik yang terjadi tanpa gesekan internal dalam fluida kerja disebut isentropik. DI DALAM T, S dalam diagram, itu diwakili oleh garis vertikal.
Biasanya, proses adiabatik nyata berlangsung dengan adanya gesekan internal pada fluida kerja, akibatnya panas selalu dilepaskan, yang disalurkan ke fluida kerja itu sendiri. Dalam hal ini d S> 0 dan prosesnya dipanggil proses adiabatik nyata.
Proses politropik
Suatu proses disebut politropik, yang dijelaskan oleh persamaan:
pvn= konstanta
indeks politropik N dapat mengambil nilai apapun dari -∞ sampai +∞, tetapi untuk proses ini adalah nilai konstan.
Dari persamaan proses politropik dan persamaan Claiperon, dapat diperoleh ekspresi yang membentuk hubungan antara P, ay Dan T pada setiap dua titik pada politrop:
p2/p1 = (v1/v2)N; T2 /T1 = (v1/v2) n-1 ; T2 /T1 = (p2/p1) (n-1)/n .
Kerja ekspansi gas dalam proses politropik adalah:

Dalam kasus gas ideal, rumus ini dapat diubah menjadi:

Jumlah panas yang diberikan atau dihilangkan dalam proses ditentukan dengan menggunakan hukum pertama termodinamika:
Q = (kamu 2 – kamu 1) + l.
Karena

adalah kapasitas panas gas ideal dalam proses politropik.
Pada CV, k Dan N= konstanta c n= const, jadi proses politropik terkadang didefinisikan sebagai proses dengan kapasitas panas konstan.
Proses politropik memiliki arti umum, karena mencakup seluruh rangkaian proses termodinamika dasar.
Representasi grafis dari politrop di P, ay koordinat tergantung pada indeks politrop N.

pv 0= konstan( N= 0) adalah isobar;
pv= konstan( N= 1) adalah isoterm;
p 0 v= konstanta, p 1/∞v= konstanta, pv∞= const - isochore;
p.v.k= konstan( N = k) adalah adiabat.
N > 0 – kurva hiperbolik,
N < 0 adalah parabola.
Berdasarkan materi catatan kuliah saya tentang termodinamika dan buku teks "Fundamentals of Energy". Penulis G. F. Bystritsky. edisi ke-2, rev. dan tambahan - M.: KNORUS, 2011. - 352 hal.
Apa yang dimaksud dengan proses isobarik
Definisi
Proses isobarik (atau isobarik) adalah proses yang terjadi dalam massa gas konstan pada tekanan konstan.
Mari kita tulis persamaan untuk dua keadaan gas ideal:
\ \
Kami membagi persamaan (2) dengan persamaan (1), kami memperoleh persamaan proses isobarik:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \kiri(4\kanan).\]
Persamaan (4) disebut hukum Gay-Lussac.
Energi internal dan jumlah panas dari proses isobarik
Proses ini terjadi dengan masukan kalor jika volumenya diperbesar atau penghilangan kalor untuk mengecilkan volumenya. Mari kita tuliskan hukum pertama termodinamika, kita akan mendapatkan ekspresi kerja, energi internal, dan jumlah panas dari proses isobarik secara berturut-turut:
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \left(5\right).\] \[\triangle Q=\int\limits^(T_2)_ (T_1)(dU)+\int\batas^(V_2)_(V_1)(dA)(6)\]
di mana $\delta Q\ $ adalah panas elementer yang disuplai ke sistem, $dU$ adalah perubahan energi dalam gas dalam proses yang berlangsung, $dA$ adalah kerja elementer yang dilakukan oleh gas dalam proses, i adalah jumlah derajat kebebasan molekul gas, R adalah konstanta gas universal, d adalah jumlah mol gas.
Perubahan energi dalam gas :
\[\segitiga U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
Persamaan (8) mendefinisikan usaha untuk proses isobarik. Kami mengurangi persamaan (1) dari (2), kami memperoleh satu persamaan lagi untuk operasi gas dalam proses isobarik:
\ \[\segitiga Q=\frac(i)(2)нR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \segitiga T\ ( 10),\]
di mana $c_(\mu p)$ adalah kapasitas panas molar gas dalam proses isobarik. Persamaan (10) menentukan jumlah kalor yang diberikan pada gas bermassa m dalam proses isobarik dengan kenaikan suhu sebesar $\triangle T.$
Isoproses sering digambarkan dalam diagram termodinamika. Jadi, garis yang menggambarkan proses isobarik pada diagram seperti itu disebut isobar (Gbr. 1).
Contoh 1
Tugas: Tentukan bagaimana tekanan $p_1$ dan $p_2$ terkait pada diagram V(T) pada Gambar 1c.
Gambarkan isoterm $T_1$

Pada titik A dan B, suhunya sama, oleh karena itu gas mematuhi hukum Boyle-Mariotte:
\ \
Mari kita ubah volume ini menjadi SI: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
Mari kita lakukan perhitungan:
Jawab: Usaha gas dalam proses isobarik adalah 600 J.
Contoh 3
Tugas: Bandingkan kerja gas pada proses ABC dan kerja gas pada proses CDA Gambar 3.

Sebagai dasar solusinya, kami mengambil rumus yang menentukan kerja gas:
Dari pengertian geometri integral tertentu diketahui bahwa usaha adalah luas bangun yang dibatasi oleh fungsi integral, sumbu absis, dan isokor pada titik $V_1\ dan\ V_2$ (sumbu p(V)). Kami menerjemahkan grafik proses ke dalam sumbu p(V).
Pertimbangkan setiap segmen grafik dari proses yang ditunjukkan pada Gambar (3).
AB: Proses isokorik (p=const), $V\uparrow \left(\ Volume\ grow\right),\ T\uparrow $;
VS: Proses isokorik (V = const), $T\uparrow $ (dari grafik), p$\uparrow $, dari hukum untuk proses isokorik ($\frac(p)(T)=const$);
CD: (p=const), $V\downarrow ,\T\downarrow ;$
DA: (V =const), $T\downarrow ,\ p\downarrow .$
Mari gambarkan grafik proses dalam sumbu p(V) (Gbr. 4):

Pekerjaan gas $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- luas persegi panjang ABFE) (Gbr. 3). Kerjakan gas $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -area\ persegi panjang\ $EFCD.Jelas $A_(CDA)>A_(ABC).$
, proses termodinamika adalah perubahan keadaan suatu sistem, akibatnya setidaknya salah satu parameternya (suhu, volume atau tekanan) mengubah nilainya. Namun, jika kita memperhitungkan bahwa semua parameter sistem termodinamika terkait erat, maka perubahan salah satunya pasti memerlukan perubahan setidaknya satu (idealnya) atau beberapa parameter (dalam kenyataan). Dalam kasus umum, kita dapat mengatakan bahwa proses termodinamika dikaitkan dengan pelanggaran kesetimbangan sistem, dan jika sistem berada dalam keadaan setimbang, maka tidak ada proses termodinamika yang dapat terjadi di dalamnya.
Keadaan kesetimbangan suatu sistem adalah konsep abstrak, karena tidak mungkin mengisolasi materi apa pun dari dunia sekitarnya, oleh karena itu berbagai proses termodinamika pasti terjadi dalam sistem nyata mana pun. Pada saat yang sama, dalam beberapa sistem, perubahan yang begitu lambat dan hampir tidak terlihat dapat terjadi sehingga proses yang terkait dengannya dapat dianggap secara kondisional terdiri dari urutan keadaan keseimbangan sistem. Proses semacam itu disebut kesetimbangan atau semi-statis.
Skenario lain yang mungkin dari perubahan berturut-turut dalam sistem, setelah itu kembali ke keadaan semula, disebut proses melingkar atau sebuah siklus. Konsep kesetimbangan dan proses sirkular mendasari banyak kesimpulan teoretis dan metode terapan termodinamika.
Studi tentang proses termodinamika terdiri dari menentukan pekerjaan yang dilakukan dalam proses ini, perubahan energi internal, jumlah panas, dan juga dalam membangun hubungan antara kuantitas individu yang mencirikan keadaan gas.
Dari semua kemungkinan proses termodinamika, proses isokorik, isobarik, isotermal, adiabatik, dan politropik adalah yang paling menarik.
Proses isokorik
Proses isokorik adalah proses termodinamika yang terjadi pada volume konstan. Proses semacam itu dapat dilakukan dengan memanaskan gas yang ditempatkan di bejana tertutup. Gas memanas akibat suplai panas, dan tekanannya meningkat.
Perubahan parameter gas dalam proses isokorik menjelaskan hukum Charles: p 1 /T 1 \u003d p 2 /T 2, atau dalam kasus umum:
p/T = konstanta .
Tekanan gas pada dinding bejana berbanding lurus dengan suhu absolut gas.
Karena dalam proses isokorik perubahan volume dV sama dengan nol, kita dapat menyimpulkan bahwa semua kalor yang disuplai ke gas dihabiskan untuk mengubah energi dalam gas. (tidak ada pekerjaan yang dilakukan).
proses isobarik
Proses isobarik adalah proses termodinamika yang terjadi pada tekanan konstan. Proses semacam itu dapat dilakukan dengan menempatkan gas dalam silinder padat dengan piston yang dapat digerakkan, yang ditindaklanjuti dengan gaya eksternal konstan selama pemindahan dan suplai panas.
Saat suhu gas berubah, piston bergerak ke satu arah atau lainnya; sedangkan volume gas berubah sesuai dengan hukum Gay-Lussac:
V/T = konstanta.
Ini berarti bahwa dalam proses isobarik volume yang ditempati gas berbanding lurus dengan suhu.
Dapat disimpulkan bahwa perubahan suhu dalam proses ini pasti akan menyebabkan perubahan energi dalam gas, dan perubahan volume dikaitkan dengan kinerja kerja, yaitu dalam proses isobarik, bagian dari panas. energi dihabiskan untuk mengubah energi internal gas, dan sebagian lainnya dihabiskan untuk kinerja pekerjaan gas untuk mengatasi aksi gaya eksternal. Dalam hal ini, rasio antara biaya panas untuk meningkatkan energi internal dan untuk melakukan pekerjaan bergantung pada kapasitas panas gas.
Proses isotermal
Proses isotermal adalah proses termodinamika yang terjadi pada suhu konstan.
Sangat sulit untuk melakukan proses isotermal dengan gas dalam praktiknya. Bagaimanapun, kondisi harus diperhatikan bahwa dalam proses kompresi atau ekspansi, gas memiliki waktu untuk bertukar suhu dengan lingkungan, menjaga suhunya tetap konstan.
Proses isotermal dijelaskan oleh hukum Boyle-Mariotte: pV \u003d const, yaitu pada suhu konstan, tekanan gas berbanding terbalik dengan volumenya.
Jelas, dalam proses isotermal, energi dalam gas tidak berubah, karena suhunya konstan.
Untuk memenuhi kondisi keteguhan suhu gas, perlu untuk menghilangkan panas darinya, setara dengan kerja yang dikeluarkan untuk kompresi:
dq = dA = pdv .
Dengan menggunakan persamaan keadaan gas, setelah melakukan sejumlah transformasi dan substitusi, kita dapat menyimpulkan bahwa kerja gas dalam proses isotermal ditentukan oleh persamaan:
A = RT ln(p 1 /p 2).
proses adiabatik
Proses adiabatik adalah proses termodinamika yang berlangsung tanpa pertukaran panas antara fluida kerja dan lingkungan. Seperti proses isotermal, sangat sulit untuk menerapkan proses adiabatik dalam praktiknya. Proses semacam itu dapat dilanjutkan dengan media kerja yang ditempatkan di dalam bejana, misalnya silinder dengan piston, dikelilingi oleh bahan insulasi panas berkualitas tinggi.
Tetapi apa pun insulator panas berkualitas tinggi yang kami gunakan dalam kasus ini, beberapa, meskipun dapat diabaikan, sejumlah panas pasti akan dipertukarkan antara fluida kerja dan lingkungan.
Oleh karena itu, dalam praktiknya, hanya dimungkinkan untuk membuat model perkiraan dari proses adiabatik. Namun demikian, banyak proses termodinamika yang dilakukan dalam rekayasa panas berjalan sangat cepat sehingga fluida kerja dan medium tidak memiliki waktu untuk bertukar panas, oleh karena itu, dengan tingkat kesalahan tertentu, proses tersebut dapat dianggap adiabatik.
Untuk mendapatkan persamaan yang menghubungkan tekanan dan volume 1 kg gas dalam proses adiabatik, kami menulis persamaan hukum pertama termodinamika:
dq = du + pdv .
Karena untuk proses adiabatik perpindahan panas dq sama dengan nol, dan perubahan energi dalam merupakan fungsi dari konduktivitas termal suhu: du = c v dT , maka kita dapat menulis:
cvdT + pdv = 0 (3) .
Diferensialkan persamaan Clapeyron pv = RT , kita dapatkan:
pdv + vdp = RdT .
Mari kita nyatakan dT dari sini dan substitusikan ke persamaan (3) . Setelah penataan ulang dan transformasi, kita mendapatkan:
pdvc v /(R + 1) + c v vdp/R = 0.
Dengan mempertimbangkan persamaan Mayer R = c p – c v, ekspresi terakhir dapat ditulis ulang sebagai:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
Membagi ekspresi yang dihasilkan dengan c v dan menunjukkan rasio c p / c v dengan huruf k , setelah mengintegrasikan persamaan (4) kita dapatkan (di k = konstanta):
ln vk + ln p = const atau ln pvk = const atau pvk = const .
Persamaan yang dihasilkan adalah persamaan proses adiabatik, di mana k adalah eksponen adiabatik.
Jika kita mengasumsikan bahwa kapasitas panas volumetrik c v adalah nilai konstan, yaitu c v \u003d const, maka kerja proses adiabatik dapat direpresentasikan sebagai rumus (diberikan tanpa keluaran):
l \u003d c v (T 1 - T 2) atau l \u003d (p 1 v 1 - p 2 v 2) / (k-1).
Proses politropik
Berbeda dengan proses termodinamika yang dipertimbangkan di atas, ketika salah satu parameter gas tetap tidak berubah, proses politropik dicirikan oleh kemungkinan mengubah salah satu parameter gas utama. Semua proses termodinamika di atas adalah kasus khusus dari proses politropik.
Persamaan umum dari proses politropik memiliki bentuk pv n = const , di mana n adalah indeks politropik - nilai konstan untuk proses ini, yang dapat mengambil nilai dari - ∞ hingga + ∞ .
Jelas bahwa dengan memberikan nilai tertentu pada indeks politropik, satu atau beberapa proses termodinamika dapat diperoleh - isokorik, isobarik, isotermal, atau adiabatik.
Jadi, jika kita mengambil n = 0 , kita mendapatkan p = const - proses isobarik, jika kita mengambil n = 1 , kita mendapatkan proses isotermal yang dijelaskan dengan ketergantungan pv = const ; untuk n = k prosesnya adiabatik, dan untuk n sama dengan - ∞ atau + ∞ . kita mendapatkan proses isokorik.
Topik pembuat kode USE: isoproses - proses isotermal, isokorik, isobarik.
Sepanjang selebaran ini, kami akan mematuhi asumsi berikut: massa dan komposisi kimia gas tetap tidak berubah. Dengan kata lain, kami percaya bahwa:
Artinya, tidak ada kebocoran gas dari bejana atau, sebaliknya, aliran gas ke dalam bejana;
Artinya, partikel gas tidak mengalami perubahan apa pun (katakanlah, tidak ada disosiasi - peluruhan molekul menjadi atom).
Kedua kondisi ini dipenuhi dalam banyak situasi yang menarik secara fisik (misalnya, dalam model mesin panas sederhana) dan oleh karena itu perlu dipertimbangkan secara terpisah.
Jika massa gas dan massa molarnya tetap, maka keadaan gas ditentukan oleh tiga parameter makroskopis: tekanan, volume Dan suhu. Parameter ini terkait satu sama lain dengan persamaan keadaan (persamaan Mendeleev-Clapeyron).
Proses termodinamika(atau sederhana proses) adalah perubahan keadaan gas dari waktu ke waktu. Selama proses termodinamika, nilai parameter makroskopis - tekanan, volume dan suhu - berubah.
Yang menarik adalah isoproses- proses termodinamika di mana nilai salah satu parameter makroskopis tetap tidak berubah. Memperbaiki masing-masing dari tiga parameter secara bergantian, kami mendapatkan tiga jenis proses iso.
1. Proses isotermal berjalan pada suhu gas konstan: .
2. proses isobarik berjalan pada tekanan gas konstan: .
3. Proses isokorik pergi pada volume konstan gas: .
Isoproses dijelaskan oleh hukum Boyle - Mariotte, Gay-Lussac dan Charles yang sangat sederhana. Mari kita lanjutkan untuk mempelajarinya.
Proses isotermal
Biarkan gas ideal melakukan proses isotermal pada suhu . Selama proses tersebut, hanya tekanan gas dan volumenya yang berubah.
Pertimbangkan dua keadaan gas yang berubah-ubah: di salah satunya, nilai parameter makroskopiknya adalah , dan yang kedua, adalah . Nilai-nilai ini terkait dengan persamaan Mendeleev-Clapeyron:
Seperti yang kami katakan sejak awal, massa dan massa molar diasumsikan konstan.
Oleh karena itu, bagian kanan dari persamaan tertulis adalah sama. Oleh karena itu, ruas kiri juga sama:
(1)
Karena dua keadaan gas dipilih secara sewenang-wenang, kita dapat menyimpulkannya selama proses isotermal, hasil kali tekanan dan volume gas tetap konstan:
(2)
Pernyataan ini disebut Hukum Boyle - Mariotte.
Setelah menulis hukum Boyle-Mariotte dalam formulir
(3)
seseorang juga dapat merumuskannya seperti ini: Dalam proses isotermal, tekanan gas berbanding terbalik dengan volumenya.. Jika, misalnya, selama pemuaian isotermal suatu gas, volumenya meningkat tiga kali lipat, maka tekanan gas berkurang tiga kali lipat.
Bagaimana menjelaskan hubungan terbalik antara tekanan dan volume dari sudut pandang fisik? Pada suhu konstan, energi kinetik rata-rata molekul gas tetap tidak berubah, artinya, gaya tumbukan molekul pada dinding bejana tidak berubah. Dengan peningkatan volume, konsentrasi molekul berkurang, dan karenanya, jumlah benturan molekuler per satuan waktu per satuan luas dinding berkurang - tekanan gas turun. Sebaliknya, dengan penurunan volume, konsentrasi molekul meningkat, dampaknya lebih sering, dan tekanan gas meningkat.
Grafik Proses Isotermal
Secara umum, menggambarkan grafik proses termodinamika dalam sistem koordinat berikut:
-diagram: sumbu absis, sumbu ordinat;
-diagram: sumbu absis, sumbu ordinat.
Grafik proses isotermal disebut isoterm.
Sebuah isoterm pada -chart adalah plot berbanding terbalik.
Grafik seperti itu adalah hiperbola (ingat aljabar - grafik fungsi). Isoterm-hiperbola ditunjukkan pada gambar. 1 .

Beras. 1. Isoterm pada -diagram
Setiap isoterm sesuai dengan nilai suhu tetap tertentu. Ternyata itu semakin tinggi suhu, semakin tinggi isoterm yang sesuai -diagram.
Memang, mari kita pertimbangkan dua proses isotermal yang dilakukan oleh gas yang sama (Gbr. 2). Proses pertama berlangsung pada suhu, yang kedua - pada suhu.

Beras. 2. Semakin tinggi suhunya, semakin tinggi isotermnya
Kami memperbaiki beberapa nilai volume . Pada isoterm pertama sesuai dengan tekanan , pada isoterm kedua - class="tex" alt="p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
Dalam dua sistem koordinat yang tersisa, isoterm terlihat sangat sederhana: berupa garis lurus yang tegak lurus terhadap sumbu ( gbr. 3):

Beras. 3. Isoterm dan -diagram
proses isobarik
Ingat sekali lagi bahwa proses isobarik adalah proses yang berlangsung pada tekanan konstan. Selama proses isobarik, hanya volume gas dan suhunya yang berubah.
Contoh khas dari proses isobarik: gas berada di bawah piston masif yang dapat bergerak bebas. Jika massa piston dan penampang piston , maka tekanan gasnya konstan dan sama dengan
dimana adalah tekanan atmosfer.
Biarkan gas ideal melakukan proses isobarik pada tekanan . Pertimbangkan lagi dua keadaan gas yang berubah-ubah; kali ini nilai parameter makroskopik akan sama dengan dan .
Mari kita tuliskan persamaan keadaan:
Membagi mereka satu sama lain, kita mendapatkan:
Pada prinsipnya, ini sudah cukup, tetapi kita akan melangkah lebih jauh. Mari kita tulis ulang relasi yang dihasilkan sehingga hanya parameter keadaan pertama yang muncul di satu bagian, dan hanya parameter keadaan kedua yang muncul di bagian lain (dengan kata lain, kita "membagi indeks" menjadi bagian yang berbeda):
(4)
Dan sekarang dari sini - mengingat kesewenang-wenangan pilihan negara! - kita mendapatkan hukum Gay-Lussac:
(5)
Dengan kata lain, Pada tekanan konstan, volume gas berbanding lurus dengan suhunya.:
(6)
Mengapa volume meningkat dengan suhu? Saat suhu naik, molekul mulai memukul lebih keras dan menaikkan piston. Pada saat yang sama, konsentrasi molekul berkurang, tumbukan menjadi lebih jarang, sehingga pada akhirnya tekanannya tetap sama.
Plot dari proses isobarik
Grafik proses isobarik disebut isobar. Pada -diagram, isobar berupa garis lurus (Gbr. 4):

Beras. 4. Isobar pada -diagram
Bagian grafik bertitik berarti bahwa dalam kasus gas nyata pada suhu yang cukup rendah, model gas ideal (dan dengan itu hukum Gay-Lussac) berhenti bekerja. Memang, dengan penurunan suhu, partikel gas bergerak semakin lambat, dan gaya interaksi antarmolekul memiliki pengaruh yang semakin signifikan terhadap pergerakannya (analoginya: bola lambat lebih mudah ditangkap daripada bola cepat). Nah, pada suhu yang sangat rendah, gas berubah menjadi cairan.
Sekarang mari kita cari tahu bagaimana posisi isobar berubah dengan perubahan tekanan. Ternyata itu Semakin tinggi tekanan, semakin rendah isobar. -diagram.
Untuk memverifikasi ini, pertimbangkan dua isobar dengan tekanan dan (Gbr. 5):

Beras. 5. Semakin rendah isobar, semakin besar tekanannya
Mari kita perbaiki beberapa nilai suhu. Kami melihat itu. Tetapi pada suhu tetap, volumenya semakin kecil, semakin besar tekanannya (hukum Boyle - Mariotte!).
Jadi class="tex" alt="p_2 > p_1"> .!}
Dalam dua sistem koordinat yang tersisa, isobar adalah garis lurus tegak lurus terhadap sumbu (Gbr. 6):

Beras. 6. Isobar dan -diagram
Proses isokorik
Proses isokorik, kita ingat, adalah proses yang berlangsung pada volume konstan. Dalam proses isokorik, hanya tekanan gas dan suhunya yang berubah.
Proses isokorik sangat sederhana untuk dibayangkan: ini adalah proses yang terjadi di bejana kaku dengan volume tetap (atau di dalam silinder di bawah piston saat piston dipasang).
Biarkan gas ideal melakukan proses isokorik dalam bejana volume . Sekali lagi, pertimbangkan dua kondisi gas arbitrer dengan parameter dan . Kita punya:
Kami membagi persamaan ini satu sama lain:
Seperti dalam penurunan hukum Gay-Lussac, kami “membagi” indeks menjadi beberapa bagian:
(7)
Mengingat kesewenang-wenangan pilihan negara, kami sampai pada hukum Charles:
(8)
Dengan kata lain, Pada volume konstan gas, tekanannya berbanding lurus dengan suhunya.:
(9)
Peningkatan tekanan gas dengan volume tetap saat dipanaskan adalah hal yang sangat jelas dari sudut pandang fisik. Anda dapat dengan mudah menjelaskannya sendiri.
Plot Proses Isochoric
Grafik proses isokorik disebut isochore. Pada -diagram, isochore berupa garis lurus ( gbr. 7):

Beras. 7. Isochore on -diagram
Arti dari area bertitik sama: ketidakcukupan model gas ideal pada suhu rendah.

Beras. 8. Semakin rendah isochore, semakin besar volumenya
Buktinya mirip dengan yang sebelumnya. Kami memperbaiki suhu dan melihatnya. Tetapi pada suhu tetap, tekanannya semakin kecil, semakin besar volumenya (sekali lagi, hukum Boyle-Mariotte). Jadi class="tex" alt="V_2 > V_1"> .!}
Dalam dua sistem koordinat yang tersisa, isochore adalah garis lurus tegak lurus terhadap sumbu (Gbr. 9):

Beras. 9. Isochores dan -diagram
Hukum Boyle - Mariotte, Gay-Lussac dan Charles juga disebut hukum gas.
Kami menurunkan hukum gas dari persamaan Mendeleev-Clapeyron. Tetapi secara historis justru sebaliknya: hukum gas ditetapkan secara eksperimental, dan jauh lebih awal. Persamaan keadaan muncul kemudian sebagai generalisasi mereka.
proses isobarik
Plot isoproses dalam sistem koordinat yang berbeda
proses isobarik(Yunani lainnya ισος, isos - "sama" + βαρος, baros - "berat") - proses mengubah keadaan sistem termodinamika pada tekanan konstan ()
Ketergantungan volume gas pada suhu pada tekanan konstan diselidiki secara eksperimental pada tahun 1802 oleh Joseph Louis Gay-Lussac. Hukum Gay-Lussac: Pada tekanan konstan dan nilai konstan massa gas dan massa molarnya, rasio volume gas terhadap suhu absolutnya tetap konstan: V / T = konstanta.
Proses isokorik
Proses isokorik(dari paduan suara Yunani - tempat yang ditempati) - proses mengubah keadaan sistem termodinamika pada volume konstan (). Untuk gas ideal, proses isokorik dijelaskan oleh hukum Charles: untuk massa gas tertentu pada volume konstan, tekanan berbanding lurus dengan suhu:
Garis yang menggambarkan proses isochoric dalam diagram disebut isochore.
Perlu juga ditunjukkan bahwa energi yang dipasok ke gas dihabiskan untuk mengubah energi dalam, yaitu, Q = 3* ν*R*T/2=3*V*ΔP, di mana R adalah konstanta gas universal, ν adalah jumlah mol dalam gas, T adalah temperatur dalam Kelvin , V adalah volume gas, ΔP adalah kenaikan perubahan tekanan. dan garis yang menggambarkan proses isokorik pada diagram, pada sumbu P(T), harus diperpanjang dan dihubungkan dengan garis putus-putus ke titik asal, karena dapat menimbulkan kesalahpahaman.
Proses isotermal
Proses isotermal(dari bahasa Yunani "termos" - hangat, panas) - proses mengubah keadaan sistem termodinamika pada suhu konstan () (). Proses isotermal dijelaskan oleh hukum Boyle - Mariotte:
Pada suhu konstan dan nilai konstan massa gas dan massa molarnya, hasil kali volume gas dan tekanannya tetap konstan: PV = konstanta.
Proses isentropik
Proses isentropik- proses mengubah keadaan sistem termodinamika pada entropi konstan (). Misalnya, proses adiabatik reversibel bersifat isentropik: dalam proses tersebut tidak ada pertukaran panas dengan lingkungan. Gas ideal dalam proses seperti itu dijelaskan oleh persamaan berikut:
dimana eksponen adiabatik, ditentukan oleh jenis gas.
Yayasan Wikimedia. 2010 .
Lihat apa itu "Isoproses" di kamus lain:
Isoproses adalah proses termodinamika di mana massa dan satu lagi kuantitas fisik dari parameter keadaan: tekanan, volume, atau suhu tetap tidak berubah. Jadi, proses isobarik sesuai dengan tekanan konstan, volume isokorik ... Wikipedia
Teori kinetik molekuler (disingkat MKT) adalah teori yang mempertimbangkan struktur materi dari sudut pandang tiga ketentuan utama yang kira-kira benar: semua benda terdiri dari partikel, yang ukurannya dapat diabaikan: atom, molekul, dan ion; partikel ... ... Wikipedia
- (disingkat MKT) teori yang mempertimbangkan struktur materi dari sudut pandang tiga ketentuan utama yang kira-kira benar: semua benda terdiri dari partikel yang ukurannya dapat diabaikan: atom, molekul, dan ion; partikel terus menerus ... ... Wikipedia
Buku
- Prediksi statistik karakteristik kekuatan deformasi bahan struktural , G. Pluvinazh , VT Sapunov , Buku ini menyajikan metode baru yang mengusulkan metodologi umum untuk memprediksi karakteristik proses kinetik, umum untuk bahan logam dan polimer. Metode… Kategori: Buku teks untuk universitas Penerbit: