알칸의 기본 화학적 성질. 알칸: 물리적, 화학적 특성, 응용
포화 탄화수소의 화학적 특성은 탄소와 수소 원자, 분자 내 $C-H$ 및 $C-C$ 결합의 존재에 의해 결정됩니다.
가장 단순한 알칸인 메탄 분자에서 화학 결합은 4개의 결합 분자 궤도에 위치한 8개의 원자가 전자(탄소 원자에서 4개, 수소 원자에서 4개)로 형성됩니다.
따라서 메탄 분자에서는 탄소 원자의 $sp3$-혼성 오비탈 4개와 수소 원자 4개의 s-오비탈로부터 4개의 $sp3-s(C-H)$ 공유 결합이 형성됩니다(그림 1).
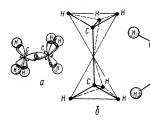
에탄 분자는 두 개의 탄소 사면체, 즉 하나의 $sp3-sp3(C-C)$ 공유 결합과 6개의 $sp3-s(C-H)$ 공유 결합으로 구성됩니다(그림 2).

그림 2. 에탄 분자의 구조: a - 분자 내 $\sigma $ 결합 배치; b - 분자의 사면체 모델; c - 분자의 볼-스틱 모델; d - Stewart - Briegleb에 따른 분자의 규모 모델
알칸의 화학 결합의 특징
고려된 공유 결합 유형에서 가장 큰 전자 밀도 영역은 원자핵을 연결하는 선에 위치합니다. 이러한 공유 결합은 국부적인 $\sigma $-$(\rm M)$$(\rm O)$에 의해 형성되며 $\sigma $ 결합이라고 합니다. 이러한 결합의 중요한 특징은 전자 밀도가 원자핵을 통과하는 축(전자 밀도의 원통형 대칭)을 기준으로 대칭으로 분포된다는 것입니다. 덕분에 이 결합으로 연결된 원자나 원자단은 결합의 변형을 일으키지 않고 자유롭게 회전할 수 있습니다. 알칸 분자의 탄소 원자의 원자가 방향 사이의 각도는 $109^\circ 28"$입니다. 따라서 이러한 물질의 분자에서는 직선 탄소 사슬이 있더라도 탄소 원자가 실제로 직선으로 위치하지 않습니다. 이 사슬은 지그재그 모양을 가지고 있으며 이는 탄소 원자의 간격 각도 보존과 관련이 있습니다 (그림 3).

그림 3. 일반 알칸의 탄소 사슬 구조 구조
충분히 긴 탄소 사슬을 가진 알칸 분자에서는 서로 원자가 결합되지 않은 탄소 원자의 반발로 인해 이 각도가 $2^\circ$만큼 증가합니다.
참고 1
각 화학 결합은 특정 에너지를 특징으로 합니다. 메탄 분자의 $C-H$ 결합 에너지는 422.9 kJ/mol, 에탄은 401.9 kJ/mol, 기타 알칸은 약 419 kJ/mol이라는 것이 실험적으로 확립되었습니다. $C-C$ 결합 에너지는 350kJ/mol입니다.
알칸의 구조와 반응성 사이의 관계
$C-C$ 및 $C-H$ 결합의 높은 에너지는 실온에서 포화 탄화수소의 낮은 반응성을 결정합니다. 따라서 알칸은 브롬수, 과망간산칼륨 용액을 변색시키지 않으며 이온 시약(산, 알칼리)과 상호작용하지 않으며 산화제 또는 활성 금속과 반응하지 않습니다. 따라서 예를 들어 나트륨 금속은 포화 탄화수소의 혼합물인 등유에 저장될 수 있습니다. 많은 유기 물질을 탄화시키는 진한 황산도 실온에서는 알칸에 영향을 미치지 않습니다. 포화 탄화수소의 반응성이 상대적으로 낮기 때문에 한때 파라핀이라고 불렸습니다. 알칸에는 수소, 할로겐 및 기타 시약을 첨가하는 능력이 없습니다. 따라서 이러한 종류의 유기 물질을 포화 탄화수소라고 불렀습니다.
포화 탄화수소의 화학 반응은 $C-C$ 또는 $C-H$ 결합의 절단으로 인해 발생할 수 있습니다. $C-H$ 결합의 파열은 불포화 화합물의 형성으로 인한 수소 원자의 제거 또는 후속적으로 수소 원자의 제거가 다른 원자 또는 원자단으로 대체되는 것을 동반합니다.
알칸의 구조와 포화 탄화수소 분자의 반응 조건에 따라 $C-H$ 결합은 균일하게 끊어질 수 있습니다.

그림 4. 알칸의 화학적 성질
그리고 음이온과 양이온의 형성으로 이종분해됩니다:
그림 5. 알칸의 화학적 성질
이 경우, 짝을 이루지 않은 전자를 갖지만 전하를 갖지 않는 자유 라디칼, 또는 상응하는 전하를 갖는 탄소 양이온 또는 탄소 음이온이 형성될 수 있습니다. 자유 라디칼은 라디칼 메커니즘의 반응에서 중간 입자로 형성되고, 이온 메커니즘의 반응에서는 탄수화물 양이온과 탄소 음이온이 형성됩니다.
$C-C$ 결합은 비극성이고 $C-H$ 결합은 저극성이며 이러한 $\sigma $-결합은 낮은 분극성을 갖기 때문에 알칸 분자에서 $\sigma $-결합의 이종분해 절단은 다음과 같은 형성과 함께 발생합니다. 이온에는 많은 에너지가 필요합니다. 이러한 결합의 용혈성 절단에는 더 적은 에너지가 필요합니다. 따라서 포화 탄화수소의 경우 라디칼 메커니즘에 의해 진행되는 반응이 더 일반적입니다. $\sigma $-bond $C-C$의 분할에는 $C-H$ 채권의 분할보다 에너지가 덜 필요합니다. 왜냐하면 $C-C$ 채권의 에너지가 $C-H$ 채권의 에너지보다 작기 때문입니다. 그러나 화학 반응은 시약에 더 쉽게 접근할 수 있기 때문에 $C-H$ 결합의 절단을 더 자주 포함합니다.
알칸의 분지화 및 크기가 반응성에 미치는 영향
$C-H$ 결합의 반응성은 선형 구조의 알칸에서 분지형 구조의 알칸으로 전환될 때 변경됩니다. 예를 들어, 자유 라디칼이 형성되는 동안 $C-H$ 결합의 해리 에너지(kJ/mol)는 다음과 같이 변합니다.

그림 6. 알칸의 화학적 성질
또한, 알칸의 이온화 에너지(IE) 값은 $\sigma $-결합의 총 수가 증가하면 공여체 특성이 증가하고 예를 들어 더 높은 분자량을 가진 화합물의 경우 전자를 제거하기가 더 쉬워진다는 것을 보여줍니다. :
그림 7. 알칸의 화학적 성질
따라서 자유 라디칼 과정에서 반응은 주로 3차 탄소 원자에서 일어나고, 그 다음에는 2차 탄소 원자, 마지막으로 1차 탄소 원자에서 발생하며, 이는 자유 라디칼의 안정성 계열과 일치합니다. 그러나 온도가 증가함에 따라 관찰된 경향은 감소하거나 완전히 평준화됩니다.
따라서 알칸은 두 가지 유형의 화학 반응이 특징입니다.
- 주로 라디칼 메커니즘에 의한 수소 치환 및
- $C-C$ 또는 $C-H$ 결합 뒤에 있는 분자가 절단됩니다.
알칸 :
알칸은 모든 원자가 단일 결합으로 연결된 분자의 포화 탄화수소입니다. 공식 -
물리적 특성 :
- 탄소 골격의 분자량과 길이에 따라 녹는점과 끓는점이 증가합니다.
- 정상적인 조건에서 CH 4 에서 C 4 H 10 까지의 분지되지 않은 알칸은 가스입니다. C 5 H 12 ~ C 13 H 28 - 액체; C 14 H 30 이후 - 고체.
- 녹는점과 끓는점은 가지가 적은 곳에서 가지가 많은 곳으로 감소합니다. 예를 들어, 20°C에서 n-펜탄은 액체이고 네오펜탄은 기체입니다.
화학적 특성:
· 할로겐화
치환반응 중 하나입니다. 수소화된 탄소 원자가 가장 먼저 할로겐화됩니다(3차 원자, 그 다음 2차, 1차 원자가 마지막으로 할로겐화됩니다). 알칸의 할로겐화는 단계적으로 발생합니다. 한 단계에서 하나 이상의 수소 원자가 대체되지 않습니다.
- CH 4 + Cl 2 → CH 3 Cl + HCl(클로로메탄)
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl(디클로로메탄)
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl(트리클로로메탄)
- CHCl 3 + Cl 2 → CCl 4 + HCl(사염화탄소).
빛의 영향으로 염소 분자가 라디칼로 분해 된 다음 알칸 분자를 공격하여 수소 원자를 빼앗아 결과적으로 메틸 라디칼 CH 3이 형성되어 염소 분자와 충돌하여 파괴되고 형성됩니다. 새로운 급진파.
· 연소
연료로서의 용도를 결정하는 포화 탄화수소의 주요 화학적 특성은 연소 반응입니다. 예:
CH 4 + 2O 2 → CO 2 + 2H 2 O + 큐
산소가 부족할 경우 이산화탄소 대신 일산화탄소나 석탄이 생성됩니다(산소 농도에 따라 다름).
일반적으로 알칸의 연소 반응은 다음과 같이 쓸 수 있습니다.
와 함께 N H 2 N +2 +(1,5N+0.5)O 2 = N CO 2 + ( N+1)H2O
· 분해
분해 반응은 고온의 영향 하에서만 발생합니다. 온도가 상승하면 탄소 결합이 끊어지고 자유 라디칼이 형성됩니다.
예:
CH4 → C + 2H2 (t > 1000°C)
C2H6 → 2C + 3H2
알켄 :
알켄은 분자 내에 단일 결합 외에 하나의 탄소-탄소 이중 결합을 포함하는 불포화 탄화수소입니다. 공식 - C n H 2n
탄화수소가 알켄 계열에 속한다는 것은 이름에 일반 접미사 –ene이 표시되어 있음을 나타냅니다.
물리적 특성 :
- 알켄의 녹는점과 끓는점(단순화)은 탄소 골격의 분자량과 길이에 따라 증가합니다.
- 정상적인 조건에서 C 2 H 4 ~ C 4 H 8의 알켄은 가스입니다. C 5 H 10에서 C 17 H 34까지 - 액체, C 18 H 36 이후 - 고체. 알켄은 물에는 녹지 않지만 유기용매에는 녹는다.
화학적 특성 :
· 탈수유기 화합물 분자에서 물 분자를 분리하는 과정입니다.
· 중합저분자량 물질의 많은 초기 분자를 큰 중합체 분자로 결합하는 화학 공정입니다.
고분자분자가 많은 동일한 구조 단위로 구성된 고분자 화합물입니다.
알카디엔 :
알카디엔은 분자 내에 단일 결합 외에 이중 탄소-탄소 결합을 포함하는 불포화 탄화수소입니다.
. 디엔은 알킨의 구조 이성질체입니다.물리적 특성 :
부타디엔은 기체(끓는점 -4.5°C)이고, 이소프렌은 34°C에서 끓는 액체이며, 디메틸부타디엔은 70°C에서 끓는 액체입니다. 이소프렌 및 기타 디엔 탄화수소는 고무로 중합될 수 있습니다. 정제된 상태의 천연 고무는 일반식(C5H8)n을 갖는 중합체이며 일부 열대 식물의 우유빛 수액에서 얻습니다.
고무는 벤젠, 가솔린, 이황화탄소에 잘 녹습니다. 낮은 온도에서는 가열하면 부서지기 쉽고 끈적해집니다. 고무의 기계적, 화학적 특성을 향상시키기 위해 가황을 통해 고무로 전환됩니다. 고무 제품을 얻으려면 먼저 고무와 유황의 혼합물과 그을음, 분필, 점토 및 가황을 촉진하는 일부 유기 화합물과 같은 충전재로 성형됩니다. 그런 다음 제품이 가열됩니다-뜨거운 가황. 가황 과정에서 황은 고무와 화학적으로 결합합니다. 또한, 가황고무에는 작은 입자 형태의 유리 상태의 황이 포함되어 있습니다.
디엔 탄화수소는 쉽게 중합됩니다. 디엔 탄화수소의 중합 반응은 고무 합성의 기초가 됩니다. 이들은 첨가 반응(수소화, 할로겐화, 할로겐화수소화)을 겪습니다.
H 2 C=CH-CH=CH 2 + H 2 -> H 3 C-CH=CH-CH 3
알킨 :
알킨은 분자에 단일 결합 외에 하나의 삼중 탄소-탄소 결합이 포함된 불포화 탄화수소입니다.
물리적 특성 :
알킨은 물리적 특성이 해당 알켄과 유사합니다. 낮은 (최대 C 4)은 알켄의 유사체보다 끓는점이 높은 무색 및 무취 가스입니다.
알킨은 물에는 잘 녹지 않지만 유기용매에는 더 잘 녹습니다.
화학적 특성 :
할로겐화 반응
알킨은 하나 또는 두 개의 할로겐 분자를 추가하여 해당 할로겐 유도체를 형성할 수 있습니다.
수분 공급
수은염이 있는 경우 알킨은 물을 첨가하여 아세트알데히드(아세틸렌의 경우) 또는 케톤(다른 알킨의 경우)을 형성합니다.

포화 탄화수소는 sp3 혼성화 상태의 탄소 원자로 구성된 분자인 화합물이다. 그들은 공유 시그마 결합에 의해서만 서로 연결됩니다. "포화" 또는 "포화" 탄화수소라는 이름은 이러한 화합물이 원자를 부착하는 능력이 없다는 사실에서 유래되었습니다. 그들은 극단적이고 완전히 포화 상태입니다. 예외는 시클로알칸입니다.
알칸이란 무엇입니까?
알칸은 포화 탄화수소이며 탄소 사슬은 열려 있고 단일 결합을 사용하여 서로 연결된 탄소 원자로 구성됩니다. 이는 다른 결합(즉, 알켄과 같은 이중 또는 알킬과 같은 삼중) 결합을 포함하지 않습니다. 알칸은 파라핀이라고도 합니다. 잘 알려진 파라핀은 특히 불활성인 포화 탄화수소 C 18 -C 35의 혼합물이기 때문에 이 이름을 얻었습니다.
알칸과 그 라디칼에 대한 일반 정보
공식 : C n P 2 n +2, 여기서 n은 1보다 크거나 같습니다. 몰 질량은 공식 M = 14n + 2를 사용하여 계산됩니다. 특징: 이름의 끝은 "-an"입니다. 수소 원자가 다른 원자로 대체되어 형성된 분자의 잔기를 지방족 라디칼 또는 알킬이라고합니다. 이들은 문자 R로 지정됩니다. 1가 지방족 라디칼의 일반 공식: C n P 2 n +1, 여기서 n은 1보다 크거나 같습니다. 지방족 라디칼의 몰 질량은 다음 공식으로 계산됩니다: M = 14n + 1. 지방족 라디칼의 특징: "-미사"라는 이름으로 끝납니다. 알칸 분자는 고유한 구조적 특징을 가지고 있습니다.
- C-C 결합은 길이가 0.154nm인 것이 특징입니다.
- C-H 결합의 길이는 0.109 nm입니다.
- 결합각(탄소-탄소 결합 사이의 각도)은 109도 28분입니다.

알칸은 메탄, 에탄, 프로판, 부탄 등의 동종 계열을 시작합니다.
알칸의 물리적 특성
알칸은 무색이며 물에 녹지 않는 물질입니다. 알칸이 녹기 시작하는 온도와 끓는 온도는 분자량과 탄화수소 사슬 길이의 증가에 따라 증가합니다. 가지가 적은 알칸에서 가지가 많은 알칸으로 갈수록 끓는점과 녹는점이 감소합니다. 기체 알칸은 연한 파란색 또는 무색 불꽃으로 연소할 수 있으며 상당한 열을 생성합니다. CH 4 -C 4 H 10은 냄새도 없는 가스입니다. C 5 H 12 -C 15 H 32는 특정 냄새가 나는 액체입니다. C 15 H 32 등도 냄새가 없는 고체입니다.
알칸의 화학적 성질
이들 화합물은 화학적으로 비활성이며, 이는 깨지기 어려운 시그마 결합(C-C 및 C-H)의 강도로 설명할 수 있습니다. C-C 결합은 비극성, C-H 결합은 저극성이라는 점도 고려해 볼 가치가 있습니다. 이들은 시그마 유형에 속하는 낮은 극성 유형의 결합이므로 동질 분해 메커니즘에 의해 파손될 가능성이 가장 높으며 그 결과 라디칼이 형성됩니다. 따라서 알칸의 화학적 성질은 주로 라디칼 치환 반응으로 제한됩니다.

질산화 반응
알칸은 온도 140°C의 기체 환경에서 10% 농도의 질산 또는 4가 산화질소와만 반응합니다. 알칸의 니트로화 반응을 Konovalov 반응이라고 합니다. 결과적으로 니트로 화합물과 물이 형성됩니다. CH 4 + 질산(희석) = CH 3 - NO 2(니트로메탄) + 물.
연소 반응
포화 탄화수소는 연료로 매우 자주 사용되며, 이는 연소 능력으로 정당화됩니다: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
산화 반응
알칸의 화학적 특성에는 산화 능력도 포함됩니다. 반응에 수반되는 조건과 조건이 어떻게 변화하는지에 따라 동일한 물질에서도 다른 최종 생성물을 얻을 수 있습니다. 반응을 촉진하는 촉매와 약 200°C의 온도에서 메탄을 산소로 가볍게 산화하면 다음과 같은 물질이 생성될 수 있습니다.
1) 2CH 4 (산소에 의한 산화) = 2CH 3 OH (알코올 - 메탄올).
2) CH 4 (산소에 의한 산화) = CH 2 O (알데히드 - 메탄알 또는 포름알데히드) + H 2 O.
3) 2CH 4 (산소에 의한 산화) = 2HCOOH (카르복실산 - 메탄 또는 포름산) + 2H 2 O.

또한 알칸의 산화는 공기와 함께 기체 또는 액체 매질에서 수행될 수 있습니다. 이러한 반응으로 인해 고급 지방 알코올과 이에 상응하는 산이 형성됩니다.
열과의 관계
+150-250°C를 초과하지 않는 온도에서는 항상 촉매가 있는 상태에서 원자 연결 순서의 변화로 구성된 유기 물질의 구조적 재배열이 발생합니다. 이 과정을 이성질체화라고 하며, 반응에서 생성된 물질을 이성질체라고 합니다. 따라서 노말 부탄으로부터 이성질체인 이소부탄이 얻어집니다. 300-600°C의 온도와 촉매가 존재하면 C-H 결합이 끊어져 수소 분자(탈수소화 반응)가 형성되고, 수소 분자는 탄소 사슬이 순환(알칸의 고리화 또는 방향족화 반응)으로 닫힙니다. :
1) 2CH4 = C2H4(에텐) + 2H2.
2) 2CH4 = C2H2(에틴) + 3H2.
3) C 7 H 16 (노르말 헵탄) = C 6 H 5 - CH 3 (톨루엔) + 4 H 2.

할로겐화 반응
이러한 반응에는 유기 물질의 분자에 할로겐(원자)이 도입되어 C-할로겐 결합이 형성되는 과정이 포함됩니다. 알칸이 할로겐과 반응하면 할로겐 유도체가 형성됩니다. 이 반응에는 특정한 특징이 있습니다. 이는 라디칼 메커니즘에 따라 진행되며 이를 시작하려면 할로겐과 알칸의 혼합물을 자외선에 노출시키거나 단순히 가열해야 합니다. 알칸의 특성으로 인해 할로겐 원자로 완전히 대체될 때까지 할로겐화 반응이 진행됩니다. 즉, 메탄의 염소화는 한 단계로 끝나지 않고 염화메틸이 생성됩니다. 반응은 더 진행되어 클로로메탄으로 시작하여 사염화탄소로 끝나는 가능한 모든 대체 생성물이 형성됩니다. 이러한 조건에서 다른 알칸이 염소에 노출되면 다른 탄소 원자에서 수소가 치환되어 다양한 생성물이 형성됩니다. 반응이 일어나는 온도는 최종 생성물의 비율과 형성 속도를 결정합니다. 알칸의 탄화수소 사슬이 길수록 반응이 더 쉬워집니다. 할로겐화 과정에서 가장 적게 수소화된(3차) 탄소 원자가 먼저 교체됩니다. 기본 항목은 다른 모든 항목 이후에 반응합니다. 할로겐화 반응은 단계적으로 발생합니다. 첫 번째 단계에서는 수소 원자 하나만 교체됩니다. 알칸은 할로겐 용액(염소 및 브롬수)과 상호작용하지 않습니다.

황산염화 반응
알칸의 화학적 특성은 설포염소화 반응(Reed 반응이라고 함)에 의해 보완됩니다. 자외선에 노출되면 알칸은 염소와 이산화황의 혼합물과 반응할 수 있습니다. 결과적으로 염화수소와 이산화황을 첨가하는 알킬 라디칼이 형성됩니다. 그 결과 염소 원자의 포획과 다음 분자인 R-H + SO 2 + Cl 2 + 자외선 = R-SO 2 Cl + HCl의 파괴로 인해 안정해지는 복합 화합물이 탄생했습니다. 반응의 결과로 형성된 설포닐 클로라이드는 계면활성제 생산에 널리 사용됩니다.
알칸의 용도는 매우 다양합니다. 연료뿐만 아니라 기계, 의학 등에서도 사용됩니다. 현대인의 삶에서 이러한 화합물의 역할은 아무리 강조해도 지나치지 않습니다.
알칸 : 속성 및 간략한 설명
알칸은 탄소 원자가 단순 포화 결합으로 연결된 비고리형 탄소 화합물입니다. 이러한 물질은 특정 특성과 특성을 지닌 전체 범위를 나타냅니다. 다음과 같이:
여기서 N은 탄소 원자의 수를 나타낸다. 예를 들어 CH3, C2H6입니다.
알칸 계열의 처음 네 가지 대표 물질은 메탄, 에탄, 프로판 및 부탄과 같은 기체 물질입니다. 다음 화합물(C5~C17)은 액체입니다. 이 시리즈는 정상적인 조건에서 고체인 화합물에 대해 계속됩니다.
화학적 성질과 관련하여 알칸은 활성이 낮습니다. 실제로 알칼리 및 산과 상호 작용하지 않습니다. 그건 그렇고, 알칸의 사용을 결정하는 것은 화학적 특성입니다.
그러나 이러한 화합물은 수소 원자 교체 및 분자 분할 과정을 포함한 특정 반응이 특징입니다.
- 가장 특징적인 반응은 수소 원자가 할로겐으로 대체되는 할로겐화 반응입니다. 이들 화합물의 염소화 및 브롬화 반응은 매우 중요합니다.
- 니트로화는 희석된 물질(10% 농도)과 반응하는 동안 수소 원자를 니트로 그룹으로 대체하는 것입니다. 정상적인 조건에서 알칸은 산과 반응하지 않습니다. 이러한 반응을 수행하려면 140°C의 온도가 필요합니다.
- 산화 - 정상적인 조건에서 알칸은 산소의 영향을 받지 않습니다. 그러나 공기 중에서 점화된 후 이러한 물질은 최종 생성물인 물과 물에 들어갑니다.
- 크래킹 - 이 반응은 필요한 촉매가 있는 경우에만 발생합니다. 이 과정에는 탄소 원자 사이의 안정적인 상동 결합이 절단되는 과정이 포함됩니다. 예를 들어, 부탄이 분해되면 반응을 통해 에탄과 에틸렌이 생성될 수 있습니다.
- 이성질체화 - 특정 촉매의 작용으로 인해 알칸의 탄소 골격이 일부 재배열될 수 있습니다.
알칸의 응용
이러한 물질의 주요 천연 공급원은 천연 가스 및 석유와 같은 귀중한 제품입니다. 오늘날 알칸의 적용 분야는 매우 광범위하고 다양합니다.
예를 들어, 기체 물질 귀중한 연료원으로 사용됩니다. 천연가스를 구성하는 메탄과 프로판-부탄 혼합물이 그 예입니다.
알칸의 또 다른 공급원은 다음과 같습니다. 기름 , 현대 인류에게 그 중요성은 과대평가하기 어렵습니다. 석유 제품에는 다음이 포함됩니다.
- 가솔린 - 연료로 사용됩니다.
- 둥유;
- 디젤 연료 또는 경유;
- 윤활유로 사용되는 중질 경유;
- 잔해는 아스팔트를 만드는 데 사용됩니다.
석유 제품은 플라스틱, 합성 섬유, 고무 및 일부 세제를 생산하는 데에도 사용됩니다.
바셀린과 바셀린은 알칸의 혼합물로 구성된 제품입니다. 이는 의약품 및 화장품(주로 연고 및 크림 제조용) 및 향수 제조에 사용됩니다.
파라핀은 고체 알칸의 혼합물인 또 다른 잘 알려진 제품입니다. 이것은 가열 온도가 50-70 도인 고체 흰색 덩어리입니다. 현대 생산에서는 파라핀을 사용하여 양초를 만듭니다. 성냥에는 동일한 물질이 함침되어 있습니다. 의학에서는 파라핀을 사용하여 다양한 열치료를 시행합니다.
알칸의 개념 정의부터 시작하는 것이 유용할 것입니다. 이들은 포화되거나 포화되어 C 원자의 연결이 단순 결합을 통해 수행되는 탄소라고 말할 수도 있습니다. 일반식은 CnH²n+ 2입니다.
다른 클래스와 비교할 때 분자 내 H 및 C 원자 수의 비율이 최대로 알려져 있습니다. 모든 원자가가 C 또는 H로 채워져 있기 때문에 알칸의 화학적 성질은 명확하게 표현되지 않으므로 두 번째 이름은 포화 또는 포화 탄화수소라는 문구입니다.
상대적인 화학적 불활성을 가장 잘 반영하는 오래된 이름인 파라핀도 있는데, 이는 "친화력이 없음"을 의미합니다.
그래서 오늘 우리 대화의 주제는 "알칸: 상동 계열, 명명법, 구조, 이성질체"입니다. 물리적 특성에 관한 데이터도 제공됩니다.
알칸: 구조, 명명법
그 안에는 C 원자가 sp3 혼성화라는 상태에 있습니다. 이와 관련하여, 알칸 분자는 서로뿐만 아니라 H에도 연결된 일련의 사면체 C 구조로 입증될 수 있습니다.
C와 H 원자 사이에는 강력하고 매우 낮은 극성의 s-결합이 있습니다. 원자는 항상 단순 결합을 중심으로 회전하므로 알칸 분자는 다양한 모양을 취하고 결합 길이와 그 사이의 각도는 일정한 값입니다. σ 결합 주위의 분자 회전으로 인해 서로 변형되는 모양을 일반적으로 형태라고 합니다.

문제의 분자에서 H 원자를 추출하는 과정에서 탄화수소 라디칼이라고 불리는 1가 종이 형성됩니다. 이는 무기 화합물뿐만 아니라 무기 화합물의 결과로도 나타납니다. 포화 탄화수소 분자에서 수소 원자 2개를 빼면 2가 라디칼이 생성됩니다.
따라서 알칸의 명명법은 다음과 같습니다.
- 방사형(이전 버전);
- 대체(국제적, 체계적). IUPAC에서 제안한 것입니다.
방사형 명명법의 특징
첫 번째 경우 알칸의 명명법은 다음과 같은 특징이 있습니다.
- 1개 또는 여러 개의 H 원자가 라디칼로 대체되는 메탄의 유도체로서 탄화수소를 고려합니다.
- 그다지 복잡하지 않은 연결의 경우 높은 수준의 편의성을 제공합니다.
대체 명명법의 특징
알칸의 대체 명명법에는 다음과 같은 특징이 있습니다.
- 이름의 기본은 1개의 탄소 사슬이며 나머지 분자 조각은 치환기로 간주됩니다.
- 동일한 근수가 여러 개인 경우 이름 앞에 숫자를 표시하고(엄격히 단어로) 근수를 쉼표로 구분합니다.
화학: 알칸의 명명법
편의를 위해 정보를 표 형식으로 제공합니다.
물질명 | 이름의 기초(루트) | 분자식 | 탄소 치환기의 이름 | 탄소 치환 공식 |
위의 알칸 명명법에는 역사적으로 발전된 이름(포화 탄화수소 계열의 처음 4개 구성원)이 포함됩니다.
5개 이상의 C 원자를 갖는 팽창되지 않은 알칸의 이름은 주어진 C 원자 수를 나타내는 그리스 숫자에서 파생됩니다. 따라서 접미사 -an은 해당 물질이 일련의 포화 화합물에서 유래되었음을 나타냅니다.

펼쳐진 알칸의 이름을 구성할 때, 주쇄는 C 원자의 최대 수를 포함하는 것입니다. 치환기의 수가 가장 적도록 번호가 매겨져 있습니다. 동일한 길이의 두 개 이상의 사슬의 경우, 주 사슬은 가장 많은 수의 치환기를 포함하는 사슬이 됩니다.
알칸의 이성질체
해당 시리즈의 모 탄화수소는 메탄 CH₄입니다. 메탄 시리즈의 각 후속 대표자와 함께 메틸렌 그룹 - CH2에서 이전 제품과의 차이가 관찰됩니다. 이 패턴은 전체 알칸 계열에서 추적될 수 있습니다.
독일 과학자 Schiel은 이 계열을 상동성이라고 부르는 제안을 내놓았습니다. 그리스어로 번역하면 "비슷한, 유사한"을 의미합니다.
따라서 동종 계열은 동일한 구조와 유사한 화학적 특성을 갖는 관련 유기 화합물의 집합입니다. 동족체는 특정 시리즈의 구성원입니다. 상동차는 인접한 2개의 동족체가 다른 메틸렌 그룹입니다.
앞에서 언급했듯이 포화 탄화수소의 구성은 일반 공식 CnH²n + 2를 사용하여 표현될 수 있습니다. 따라서 메탄 다음으로 동족 계열의 구성원은 에탄 - C²H₆입니다. 메탄의 구조를 변환하려면 H 원자 1개를 CH₃로 대체해야 합니다(아래 그림).

각 후속 상동체의 구조는 동일한 방식으로 이전 상동체로부터 추론될 수 있습니다. 결과적으로 프로판은 에탄(C₃H₈)으로부터 형성됩니다.
이성질체란 무엇입니까?
이들은 질적, 양적 분자 구성(동일한 분자식)은 동일하지만 화학 구조가 다르며 화학적 특성도 다른 물질입니다.
위에서 논의한 탄화수소는 끓는점과 같은 매개변수가 다릅니다: -0.5° - 부탄, -10° - 이소부탄. 이러한 유형의 이성질체를 탄소 골격 이성질체라고 하며 구조 유형에 속합니다.
구조 이성질체의 수는 탄소 원자 수가 증가함에 따라 급격히 증가합니다. 따라서 C₁₀H2₂는 75개의 이성질체(공간적 이성질체 제외)에 해당하며, C₁₅H₃₂의 경우 4347개의 이성질체가 이미 알려져 있습니다(C2₀H₄₂ - 366,319).
따라서 알칸이 무엇인지, 동종 계열, 이성질체, 명명법이 무엇인지는 이미 분명해졌습니다. 이제 IUPAC에 따라 이름을 컴파일하는 규칙으로 넘어갈 가치가 있습니다.

IUPAC 명명법: 이름 형성 규칙
첫째, 탄화수소 구조에서 가장 길고 치환체 수를 최대로 포함하는 탄소 사슬을 찾는 것이 필요합니다. 그런 다음 치환기가 가장 가까운 끝부터 시작하여 사슬의 C 원자에 번호를 매겨야합니다.
둘째, 염기는 C 원자 수 측면에서 주쇄에 해당하는 분지되지 않은 포화 탄화수소의 이름입니다.
셋째, 염기 앞에 치환기가 위치한 위치의 수를 표시해야합니다. 치환기의 이름은 그 뒤에 하이픈으로 표시됩니다.
넷째, 서로 다른 C 원자에 동일한 치환기가 존재하는 경우 위치가 결합되고 이름 앞에 곱셈 접두사가 나타납니다. di - 두 개의 동일한 치환기의 경우, 3 - 3의 경우, tetra - 4, penta - 5의 경우 등. 숫자는 쉼표로 구분하고 단어와는 하이픈으로 구분해야 합니다.
동일한 C 원자가 한 번에 두 개의 치환기를 포함하는 경우 위치도 두 번 기록됩니다.
이 규칙에 따라 알칸의 국제 명명법이 형성됩니다.

뉴먼 예측
이 미국 과학자는 형태를 그래픽으로 보여주기 위한 특별한 투영 공식인 뉴먼 투영법을 제안했습니다. 이는 A와 B 형태에 해당하며 아래 그림에 나와 있습니다.

첫 번째 경우는 A-폐쇄 형태이고, 두 번째 경우는 B-억제 형태입니다. A 위치에서 H 원자는 서로 최소 거리에 위치합니다. 이 형태는 그들 사이의 반발력이 가장 크기 때문에 가장 높은 에너지 값에 해당합니다. 이는 에너지적으로 불리한 상태이며, 그 결과 분자가 이를 떠나 더 안정적인 위치 B로 이동하는 경향이 있습니다. 여기서 H 원자는 서로 가능한 한 멀리 떨어져 있습니다. 따라서 이들 위치 사이의 에너지 차이는 12 kJ/mol이며, 이로 인해 메틸 그룹을 연결하는 에탄 분자의 축 주위의 자유 회전이 고르지 않습니다. 에너지적으로 유리한 위치에 진입한 후 분자는 그곳에 머무르게 됩니다. 즉, "속도가 느려집니다." 이것이 억제라고 불리는 이유입니다. 그 결과 10,000개의 에탄 분자가 실온에서 억제된 형태로 존재하게 되었습니다. 단 하나만 다른 모양을 가지고 있습니다 - 가려져 있습니다.
포화 탄화수소 얻기
기사에서 이것이 알칸이라는 것이 이미 알려졌습니다 (그 구조와 명명법은 이전에 자세히 설명되었습니다). 그것을 얻을 수 있는 방법을 고려하는 것이 유용할 것입니다. 그들은 석유, 천연, 석탄과 같은 천연 자원에서 방출됩니다. 합성 방법도 사용됩니다. 예를 들어, H2 2H2:
- 수소화 공정 CnH2n(알켄)→ CnH2n+2(알칸)← CnH2n-2(알킨).
- C와 H 일산화물의 혼합물에서 - 합성 가스: nCO+(2n+1)H2→ CnH2n+2+nH2O.
- 카르복실산(그 염)에서: 양극, 음극에서 전기분해:
- 콜베 전기분해: 2RCOONa+2H2O→R-R+2CO2+H2+2NaOH;
- Dumas 반응(알칼리와의 합금): CH₃COONa+NaOH(t)→CH₄+Na2CO₃.
- 오일 크래킹: CnH²n+2(450-700°)→ CmH²m+2+ Cn-mH²(n-m).
- 연료(고체)의 가스화: C+2H²→CH₄.
- C 원자 수가 적은 복합 알칸(할로겐 유도체)의 합성: 2CH₃Cl(클로로메탄) +2Na →CH₃- CH₃(에탄) +2NaCl.
- 물에 의한 메탄화물(금속 탄화물)의 분해: Al₄C₃+12H2O→4Al(OH₃)↓+3CH₄.
포화 탄화수소의 물리적 특성
편의상 데이터를 테이블로 그룹화했습니다.
공식 | 알칸 | 녹는점(°C) | 끓는점(°C) | 밀도, g/ml |
t = -165°С에서 0.415 |
||||
t= -100°C에서 0.561 |
||||
t = -45°C에서 0.583 |
||||
t =0°C에서 0.579 |
||||
2-메틸프로판 | t = -25°C에서 0.557 |
|||
2,2-디메틸프로판 | ||||
2-메틸부탄 | ||||
2-메틸펜탄 | ||||
2,2,3,3-테트라메틸부탄 | ||||
2,2,4-트리메틸펜탄 | ||||
n-C₁₀H2₂ | ||||
n-C₁₁H₂₄ | n-운데케인 | |||
n-C₁₂H₂₆ | n-도데칸 | |||
n-C₁₃H₂₈ | n-트리데칸 | |||
n-C₁₄H₃₀ | n-테트라데칸 | |||
n-C₁₅H₃₂ | n-펜타데칸 | |||
n-C₁₆H₃₄ | n-헥사데칸 | |||
n-C₂₀H₄₂ | n-에이코산 | |||
n-C₃₀H₆₂ | n-트리아콘탄 | 1mmHg 성 | ||
n-C₄₀H₈₂ | n-테트라콘탄 | 3mmHg 미술. | ||
n-C₅₀H₁₀₂ | n-펜타콘탄 | 15mmHg 미술. | ||
n-C₆₀H₁₂₂ | n-헥사콘탄 | |||
n-C₇₀H₁₄₂ | n-헵타콘탄 | |||
n-C₁₀₀H₂₀₂ |
결론
이 기사에서는 알칸(구조, 명명법, 이성질체, 상동 계열 등)과 같은 개념을 조사했습니다. 방사형 및 대체 명명법의 특징에 대해 약간 언급되었습니다. 알칸을 얻는 방법이 설명되어 있습니다.
또한 이 기사에는 알칸의 전체 명명법이 자세히 나열되어 있습니다(테스트는 받은 정보를 동화하는 데 도움이 될 수 있습니다).