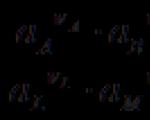전기화학. 갈바니 전지 전기화학 전지
전기 화학 요소. 기전력. 갈바니 전지의 열역학. EMF 측정.
전기이중층의 발생 메커니즘과 구조.
갈바닉 요소. EMF.
전해질에 전류가 흐르면 전극 표면에서 전기화학적 반응이 일어난다. 전기화학 반응의 발생은 외부 전류원에 의해 생성될 수 있습니다. 반대 현상도 가능합니다. 전해질에 담근 두 전극에서 일어나는 전기화학 반응은 전류를 발생시키며, 그 반응은 폐쇄 회로(전류가 흐를 때)에서만 일어납니다.
전기화학(또는 갈바니) 전지 전기화학반응을 통해 전류를 생산하는 장치이다. 가장 간단한 전기화학 소자는 두 개의 금속 전극(제1종 도체)으로 구성되며, 전해질(제2종 도체)로 내려가 금속 접점으로 서로 연결됩니다. 직렬 형태로 연결된 여러 전기화학 소자 전기화학 회로 .
전기화학소자의 가장 중요한 정량적 특성은 기전력이다.(EMF, E), 이는 전위차와 동일합니다. 올바르게 열린 요소 (동일한 재료로 만든 첫 번째 종류의 도체가 요소의 최종 전극에 연결되는 것).
전류가 서로 다른 방향으로 흐를 때 동일한 반응이 전극 표면에서 발생하지만 반대 방향으로 발생하는 경우 이러한 전극과 전극으로 구성된 요소 또는 회로를 호출합니다. 거꾸로 할 수 있는 . 가역 요소의 EMF는 열역학적 특성입니다. T, P, 전극과 용액을 구성하는 물질의 특성, 그리고 이러한 용액의 농도에만 의존합니다. 가역 요소의 예는 다음과 같습니다. 다니엘-야코비 요소 :
(-) Cu çZn çZnSO 4 ççCuSO 4 çCu (+)
각 전극은 가역적입니다. 요소가 작동하면 다음 반응이 발생합니다. Zn ® Zn 2+ + 2 이자형, 구리 2+ + 2 이자형® 구리. 극미량의 전류가 외부 소스로부터 흐르면 전극에서 역반응이 일어납니다.
되돌릴 수 없는 요소의 예는 다음과 같습니다. 볼타 요소 :
(-) Zn ç H 2 SO 4 ç Cu (+)
요소가 작동하면 다음 반응이 발생합니다. Zn ® Zn 2+ + 2 이자형, 2시간 + + 2 이자형® H 2 . 외부 소스에서 전류를 전달할 때 전극 반응은 다음과 같습니다. 2H + + 2 이자형® H 2 , Cu ® Cu 2+ + 2 이자형 .
전기화학소자의 EMF는 양의 값이다. 왜냐하면 그것은 긍정적인 일을 만들어내는 어떤 자발적인 과정에 해당합니다. 독립적으로 발생할 수 없는 역과정은 음의 EMF에 해당합니다. 전기화학 요소의 체인을 구성할 때, 요소 중 하나의 프로세스는 외부로부터의 작업 지출(비자발적 프로세스)을 수반하도록 지시될 수 있으며, 이를 위해 체인의 다른 요소의 작업을 사용합니다. 자발적인 과정이 일어나는 것입니다. 모든 회로의 총 EMF는 양수와 음수의 대수적 합과 같습니다. 따라서 회로도를 작성할 때 허용되는 규칙을 사용하여 EMF의 부호를 고려하는 것이 매우 중요합니다.
전기 화학 회로의 EMF는 양수로 간주됩니다., 회로를 작성할 때 오른쪽 전극이 왼쪽에 비해 양전하를 띠는 경우(회로 작동 중에 양이온이 용액에서 왼쪽에 쓰여진 전극에서 오른쪽에 쓰여진 전극을 향해 전달되고 전자가 안으로 이동합니다) 외부 회로에서는 같은 방향). 예.
갈바니 전지의 열역학 .
전기화학 시스템에서 반응이 가역적이고 등온적으로 진행되도록 합시다.
n A A + n B B + ... ± nF Û n L L + n M M + ... ±
요소에 의해 생성된 전기 에너지는 전체 공정의 유용한 작업 A¢와 같습니다. 가역 과정의 유용한 일 A¢는 최대이고 P에서 T = const는 시스템의 등압 전위 감소와 같습니다.
DG P, T = nFE P, T
E P , T - 시스템의 가역 EMF.
E P,T = -DG P,T / nF , E V,T = -DF V,T / nF
따라서 소자의 EMF와 온도 계수를 측정함으로써 갈바니 전지에서 발생하는 전체 공정에 대한 DG 및 DS 값을 찾는 것이 가능합니다. 이 과정은 자발적이므로 DG< 0.
Gibbs-Helmholtz 방정식을 사용하여 프로세스의 엔탈피 변화를 계산할 수 있습니다.
DH = DG - T = -nFE P + TnF
nFE P = -DH + nFT = + nFT
nFE V = -DU + nFT = + nFT
방정식으로부터 전기화학 시스템에서 가역적으로 생성되거나 흡수되는 전기 에너지와 그 시스템에서 발생하는 반응의 열 효과 사이의 관계는 EMF의 온도 계수의 부호와 크기에 따라 달라집니다. 드E/ dT :
1. 만약에드E / dT > 0 , 그러면 nFE > (DG > DH)이고 시스템은 반응의 열 효과에 해당하는 열량뿐만 아니라 추가 열도 전기 에너지로 변환합니다. 펠레티에의 온기 QP = nFT 드E/ dT환경에서 빌린 것입니다. 단열 조건(단열 조건, 환경과의 교환이 불가능한 경우)에서 시스템의 T는 감소합니다. 시스템 냉각은 다음과 같은 경우 특히 눈에 띕니다. 드E/ dT > 0 < 0 (реакция эндотермична).
2. 만약에드E / dT < 0 , nFE< (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. 만약에드E / dT = 0 이면 DG = DH 및 nFE = - 시스템에 의해 가역적으로 생성된 전기 에너지는 화학 반응의 열 효과와 동일합니다. 이 관계는 다음과 같이 알려져 있습니다. 톰슨의 원리(규칙) .
EMF를 계산하기 위해 방정식을 다음과 같이 다시 작성할 수 있습니다.
방정식을 사용할 때 다음 사항을 기억해야 합니다. 가역적 전기화학 시스템에만 유효따라서 T에 대한 EMF의 의존성을 연구할 때 액체 경계가 있는 전기화학 시스템의 사용을 피할 필요가 있습니다. 그들에서 발생하는 확산 잠재력은 평형이 아닙니다.
요소의 EMF를 요소에서 발생하는 반응의 평형 상수와 연관시켜 보겠습니다. 화학 반응 등온선 방정식:
DG = RT 에케이 ㅏ - RT
E = - = 에케이 ㅏ -
주어진 P, T에 대한 방정식 우변의 첫 번째 항은 상수 값이며 Eo로 표시할 수 있습니다. 에오 - 요소의 표준 EMF(전기화학 시스템) , 즉. EMF 전혀 나는 = 0.
이자 = 이자 오 + 에
 = EO + 2.303 LG
= EO + 2.303 LG 
따라서 전기화학 시스템의 EMF는 전기화학 반응 참가자의 활동에 따른 함수입니다. 위의 방정식을 통해 DG와 K의 값을 계산할 수 있습니다. ㅏ E의 실험값을 기반으로 하고, 반대로 E를 계산하여 화학 반응의 열역학적 특성을 알 수 있습니다.
EMF 측정 .
전기화학 요소 EMF의 평형(가역) 값을 측정하려면 프로세스가 무한히 느리게 발생해야 합니다. 그래서 요소는 무한한 전류에서 작동합니다. 이 조건은 보상 방법에서 충족되는데, 이는 요소가 외부 전위차에 대해 직렬로 연결되고 회로에 전류가 흐르지 않도록 후자가 선택된다는 사실을 기반으로 합니다. 그러면 외부 전위차는 회로의 EMF와 같습니다.
보상 방법을 사용하면 EMF 값을 직접 측정할 수 있지만 이는 다소 복잡한 작업이므로 실험실에서는 연구 중인 요소의 EMF를 소위 표준(일반)의 EMF와 비교하는 것을 선호합니다. 이는 서로 다른 T에서 신중하게 측정됩니다. 이 비교 방법은 또한 보상입니다.
기본 일반 요소는 다음과 같습니다. 포화 웨스턴 요소 .
(EMF 측정 회로 - 독립적으로).
전극 경계의 구조 - 해결책. 이중 전기 레이어 .
제1종 도체가 전해질과 접촉하면, 전기 이중층 . 예를 들어, CuSO4 용액에 담긴 구리 전극을 생각해 보십시오. 주어진 T에서 금속 내 구리 이온의 화학 전위는 일정한 것으로 간주될 수 있는 반면, 용액 내 구리 이온의 화학 전위는 염 농도에 따라 달라집니다. 일반적으로 이러한 화학적 전위는 동일하지 않습니다.
CuSO 4의 농도를 > 로 설정하십시오. 그런 다음 금속을 용액에 담그면 용액의 Cu 2+ 이온 중 일부가 탈수되어 금속으로 이동하여 양전하를 생성합니다. 이 전하는 Cu 2+ 이온이 용액에서 금속으로 더 이상 이동하는 것을 방지하고 전극 근처에 SO 4 2- 음이온 층이 형성되도록 합니다. 소위 전기화학적 평형 , 금속과 용액에 있는 이온의 화학 전위는 결과적인 이중 전기층(DEL)의 전위차 크기에 따라 달라집니다.
전기적 전위차와 화학적 전위차는 전기화학적 평형에서 보상됩니다.
CuSO4의 농도가 너무 낮아서< . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
금속 이온과 용액의 화학 전위가 동일한 전해질 농도를 선택할 수 있습니다. 이 농도의 용액을 제로 솔루션 . 금속을 제로 용액에 담그면 전극 표면에 EDL이 발생하지 않지만, 이 경우에도 금속과 용액 사이의 전위차는 0이 아닙니다.
Nernst에 따르면, 전기화학 전지의 유일한 EMF 소스는 전극 표면의 EMF입니다. Nernst는 영 용액에서 금속의 전위를 절대 영 전위로 정의했습니다. A.N. Frumkin의 연구에서 Nernst의 생각이 틀렸다는 것이 밝혀졌습니다. 영점 용액에 담긴 두 개의 서로 다른 전극으로 구성된 요소의 EMF가 영점(아마도 1V 이상)과 매우 크게 다르다는 것이 실험적으로 입증되었습니다. 제로 용액에서 금속의 전위를 호출합니다. 제로 충전 잠재력 , 절대 영전위로 간주될 수 없습니다.
응축된 헬름홀츠 이중층 이론. 금속-용액 경계면에서 DEL 구조에 대한 최초의 정량적 이론은 Helmholtz(1853)에 의해 만들어졌습니다. 헬름홀츠(Helmholtz)에 따르면 EDL은 평판 커패시터에 비유될 수 있는데, 그 중 하나는 금속의 표면 전하를 통과하는 평면과 일치하고 다른 하나는 용액의 이온 전하 중심을 연결하는 평면과 일치합니다. 정전기력에 의해 금속 표면에 끌어당겨집니다. 이중층 두께 엘이온 반경과 동일 아르 자형. 전기적 중성 조건에 따르면, 금속 표면에 끌어당겨지는 이온의 수는 이온의 전하가 금속 표면 전하를 보상할 수 있는 정도여야 합니다.
응축 이중층 이론을 통해 실험과 일치하는 EDL 커패시턴스 값과 물리적으로 그럴듯한 EDL 두께를 얻을 수 있습니다. 그러나 실험적으로 발견된 동전기 전위(x-전위) 값과 전해질 농도에 대한 의존성, 계면활성제 존재 시 금속 표면의 전하 부호 변화 등 많은 실험적 규칙성을 해석할 수는 없습니다. .
확산 이중층 GUI의 이론- 행상인. Helmholtz의 이론은 DES의 특성이 전해질의 농도에 따라 변한다는 점을 고려하지 않았으며 T. Gouy(1910)와 Chapman(1913)은 DES의 전하 밀도를 용액의 조성과 연관시키려고 했습니다. 그들은 금속과 이온 사이에서 발생하는 정전기력 외에도 이온이 열적 분자 운동의 힘에 의해 영향을 받는다는 점을 고려했습니다. 이 두 가지 힘이 가해지면 용액의 이온은 금속 표면에 대해 분산되어 있어야 하며, 금속 표면에서 멀어질수록 부피 전하 밀도가 감소합니다.
Gouy와 Chapman은 이온이 자체 부피는 없지만 전하를 갖는 물질 점으로 간주될 수 있으며 전극 전하장에서의 분포가 볼츠만 분포를 따른다고 믿었습니다.
Gouy-Chapman 이론은 Helmholtz 이론보다 동전기 현상의 법칙과 더 잘 일치합니다. 특정 거리에서 시작한다고 가정하면 엘 1 이온은 고체상과 액체상의 상대적인 이동으로 인해 더 이상 전극 표면에 단단히 결합되지 않으며, 이 거리에 해당하는 전위는 x-전위(x< j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
따라서 Gouy-Chapman 이론은 Helmholtz 이론이 적용 불가능한 것으로 판명되는 경우 가장 잘 정당화되며, 반대로 전자가 잘못된 결과를 제공하는 경우 후자는 실험과 더 나은 수렴을 제공합니다. 결과적으로 DES의 구조는 Helmholtz와 Gouy-Chapman이 제안한 모델의 일부 조합과 일치해야 합니다. 이 가정은 Stern(1924)의 DEL 흡착 이론에서 만들어졌습니다.
스턴 흡착 이론. Stern은 이온의 특정 부분이 금속-전해질 계면 근처에 유지되어 전해질 이온의 평균 반경에 해당하는 두께를 갖는 헬름홀츠 또는 응축된 이중층 판을 형성한다고 믿었습니다. EDL에 포함된 나머지 이온은 전하 밀도가 점차 감소하면서 분산되어 분포됩니다. EDL의 확산 부분에 대해 Stern은 Gouy와 마찬가지로 이온의 고유 크기를 무시했습니다. 또한 Stern은 EDL의 밀집된 부분에서 이온이 정전기적 힘뿐만 아니라 특정 흡착력으로 인해 유지된다고 제안했습니다. 쿨롱이 아닌 힘. 따라서 표면 활성 이온을 포함하는 용액에서 EDL의 조밀한 부분에 있는 이온의 수는 이온의 특성과 금속의 전하에 따라 금속 표면의 전하를 일정량 초과할 수 있습니다. 따라서 Stern에 따르면 DES의 두 가지 모델이 구별되어야 하는데, 그 중 하나는 표면 비활성 전해질 용액에 관한 것이고, 다른 하나는 특별히 흡착된 이온을 포함하는 용액에 관한 것입니다.
흡착 이론에서는 평등도 유지됩니다.
QM = qL = q1 + q2
용액 측의 전하 밀도 q L 은 헬름홀츠 층의 전하 밀도 q 1 과 확산층의 전하 밀도 q 2 의 두 부분으로 구성됩니다.
Stern의 이론을 사용하면 x-전위를 금속과 이온 사이의 강한 결합이 이미 손실된 EDL의 확산 부분의 전위 강하로 정의할 수 있습니다. 이 정의에 따르면 x 전위는 실험적으로 관찰되는 것처럼 Nerst 전위와 일치해서는 안 됩니다. 스턴의 이론은 고체 표면의 재충전을 설명할 수 있었습니다.
극미량 농도에서는 용액의 모든 전하가 분산되어 분포되며 EDL의 구조는 Gouy-Chapman 이론으로 설명됩니다. 반대로, 집중된 솔루션에서 DES의 구조는 Helmholtz가 제안한 모델에 접근합니다. x의 크기가 RT/F와 비슷한 평균 농도 영역에서 농도에 대한 의존성은 대략적인 방정식으로 표현될 수 있습니다.
양수 값의 경우 x: x = B - 에와 함께
x의 음수 값의 경우: x = B¢ + 에와 함께
Stern의 이론은 DEL에 대한 질적으로 정확한 그림을 제공합니다. Stern 모델을 사용한 커패시턴스 결정은 커패시턴스 값과 전극 전위 및 용액 농도에 대한 의존성 측면에서 경험과 일치합니다. 그러나 스턴의 이론은 단점에서 자유롭지 않다. 여기에는 특히 제로 전하 전위에서 멀어질 때 커패시턴스 곡선을 정량적으로 설명하는 것이 불가능하다는 점이 포함됩니다.
DES 스탠딩 이론의 추가 개발. 실험 데이터와 정량적으로 일치하는 DES 이론을 개발하려는 많은 시도가 있었습니다(Rice, Frumkin et al., Bockris, Devanathan, Esin, Muller, Parsons, Ershler 등). 가장 널리 받아들여지는 모델은 Graham(1947)이다. Graham에 따르면 용액의 DES 코팅은 두 부분이 아닌 세 부분으로 구성됩니다. 첫 번째는 금속 표면에서 세어 내부 헬름홀츠 평면이라고 합니다. 표면 활성 이온(평면의 전하는 q 1)만 포함하거나 용액에 없으면 용매 분자(q 1 = 0)만 포함합니다. 해와 관련된 잠재력은 y 1로 표시됩니다. 이온(전하 중심)이 접근할 수 있는 거리에서 금속 표면에서 제거된 다음 평면을 외부 헬름홀츠 평면이라고 합니다. 총 전하는 q2이고 비행기의 전위는 y2입니다. 외부 헬름홀츠 평면 뒤에는 전위가 y 2 에서 0까지 다양하고 전하 밀도가 q 2 와 일치하는 확산층이 있습니다.
Graham의 모델은 금속-전해질 DES 구조의 주요 특징과 특성을 반영합니다. 적어도 하나의 용액에 대한 실험 곡선이 있는 경우 특정 전해질의 농도에 대한 미분 정전용량 곡선을 계산할 수 있습니다. 그러나 이 모델은 문제의 모든 측면을 다루지는 않습니다.
용액에 전류가 흐르면 전극 표면에 전류가 흐릅니다. 전기화학 반응, 이는 전극으로 또는 전극으로부터 전자의 흐름을 동반합니다. 역과정에서는 제1종 도체와 제2종 도체 사이의 경계면에서 발생하는 전기화학 반응이 전류를 생성합니다.
전기화학 공정은 여러 가지 특징에서 기존 화학 반응과 다릅니다.
화학반응은 반응하는 입자들이 충돌할 때만 가능하다. 이들이 접촉하면 전자가 한 입자에서 다른 입자로 이동하는 것이 가능해집니다. 이러한 전이가 실제로 발생하는지 여부는 입자의 에너지와 상호 방향에 따라 달라집니다. 활성화 에너지는 화학 반응의 성격에 따라 달라지며 이온 반응의 경우 일반적으로 낮습니다. 전자 전이 경로가 매우 짧은 것은 화학 반응의 특징이기도 합니다. 입자의 충돌은 서로 다른 상호 위치의 반응 공간의 어느 지점에서나 발생할 수 있으므로 전자 전이는 임의의 방향으로 발생할 수 있습니다. 화학 공정의 특징은 충돌의 무작위성과 전자 전이의 방향성이 부족하다는 것입니다. 결과적으로, 화학 반응의 에너지 효과는 주로 열의 형태로 나타납니다(약간의 확장 작업도 가능함).
화학적 변환에 해당하는 에너지 변화가 전기 에너지의 형태로 나타나기 위해서는, 즉 전기화학적 과정이 진행되기 위해서는 반응조건의 변화가 필요하다.
전기 에너지는 항상 전류의 흐름과 관련이 있습니다. 특정 방향으로 전자의 흐름. 따라서 반응은 전자 전이가 무작위가 아닌 한 방향으로 발생하고 그 경로가 원자 크기보다 훨씬 커야 하는 방식으로 수행되어야 합니다. 따라서 전기화학 공정에서 한 참가자에서 다른 참가자로의 전자 전이는 상당한 거리에서 발생해야 하며, 이를 위해서는 반응 참가자의 공간적 분리가 필요합니다. 그러나 공간적 분리만으로는 반응이 멈추게 되므로 충분하지 않습니다.
전기화학 공정을 수행하려면 추가 조건이 필요합니다. 전자는 일부 입자에서 분리되어 하나의 일반적인 방식으로 다른 입자로 전달되어야 합니다. 이는 반응 참가자 간의 직접적인 접촉을 금속 도체로 서로 연결된 두 금속과의 접촉으로 대체함으로써 달성될 수 있습니다. 전자의 흐름이 연속적으로 이루어지기 위해서는 일반적으로 전기 화학 반응 참가자 자체 (이온화 된 상태 인 경우)가 수행하는 반응 공간을 통한 전류의 통과를 보장해야합니다. 이온 전도도가 높은 특수 화합물을 사용합니다.
전기화학반응을 통해 전기에너지를 생산하는 장치를 전기화학적 반응이라 한다. 전기화학(또는 갈바닉)요소. 가장 단순한 전기화학 소자는 전해질 용액(제2종 도체)에 담긴 두 개의 금속 전극(제1종 도체)으로 구성됩니다.
전류가 서로 다른 방향으로 흐를 때 동일한 반응이 전극 표면에서 발생하지만 반대 방향으로 발생하면 이러한 전극과 전극으로 구성된 전기 화학 요소를 호출합니다. 거꾸로 할 수 있는. 가역 요소의 예로는 Daniel-Jacobi 요소가 있습니다.
(–) 아연 | ZnSO 4, 솔루션 || CuSO 4, 솔루션 | 구리(+)
이러한 요소가 작동하면 전극에서 전기화학 반응이 발생합니다.
Zn Zn 2 + + 2e
Cu 2 + + 2eCu
요소의 전체 반응식은 다음과 같이 나타낼 수 있습니다.
Zn + Cu 2 + Zn 2 + + Cu
외부 소스로부터의 극소 전류가 소자를 통과할 때 이러한 반응은 반대 방향으로 진행됩니다.
예 뒤집을 수 없는요소는 볼타 요소입니다.
(–) 아연 | H2SO4 | 구리(+)
이러한 요소가 작동하면 전극에서 다음과 같은 반응이 발생합니다.
Zn Zn 2 + + 2e
2H + + 2eH 2 ,
요소의 반응은 방정식으로 표시됩니다.
아연 + 2H + Zn 2+ + H 2
전류가 외부 소스로부터 전달되면 전극에서 다른 반응이 발생합니다.
Cu Cu 2 + + 2e,
저것들. 전기화학 전지에서 구리는 수소를 방출하면서 황산에 용해됩니다.
Cu + 2H + Cu 2 + + H 2
전기화학전지의 가장 중요한 특징은 기전력(EMF) 이자형- 적절하게 열린 요소의 전위차, 즉 갈바니 전지의 전극에 연결된 동일한 물질로 된 첫 번째 종류의 도체 끝 사이의 전위차. 즉, EMF는 회로에 전류가 흐르지 않는 평형 조건에서의 전위차입니다. 전극을 닫으면 회로에 전류가 흐르고 전위차는 전압 EMF와 소자 내부 저항의 전압 강하량이 다른 전기화학 소자입니다.
전기화학소자의 목적은 유용한 원소가 포함된 외부회로에서 전자의 이동을 촉진시키는 것이다.
짐. 따라서, 그 임무를 수행하기 위해 연료전지는 전자의 공급원과 흡수원을 포함해야 합니다(그림 7.1).
전기화학 전지에서 일어나는 반응을 환원 반응이라고 합니다. "산화"라는 용어는 전자를 방출하는 과정에 해당하고 "환원"이라는 용어는 전자를 방출하는 과정에 해당하기 때문입니다.
수많은 시대에 뒤떨어진 과학 개념의 의미는 이름에서 명확하지 않은 경우가 많습니다. "산화"와 "환원"이라는 용어에는 설명이 필요합니다. 남동부에서 산소(oxygen)는 라틴어 어근 oxus(신맛, 뜨겁다, 날카롭다)에서 유래하며 '산 생산자'라는 뜻이다. 이 이름은 1787년에 출판된 Morveau와 Lavoisier의 "Nomenclature Chimique" 연구에서 처음 사용되었습니다. 당시 화학자들은 잘못된 믿음을 고수했습니다. 산에 포함된 주요 원소는 산소이고, 산이 물에 용해되면 그 구성에 포함된 수소 원자의 일부가 전자를 잃어 물이 산성이 되고 수소가 산화됩니다. 분석적으로 전자 손실 과정과 관련된 모든 반응을 산화라고 합니다. 역반응(전자 포획 반응)을 ■생성이라고 합니다.
흐름
J 전자
전자 소스 >
(산화)
긍정적인< -
전류의 방향 그림. 7.1. 전기화학 전지는 전자의 소스와 싱크를 포함해야 합니다.
전기화학 전지에서 전체 반응은 장치의 별도 영역에서 발생하는 두 개의 중간 반응으로 나뉩니다. 이러한 영역은 이온 전도체이지만 중간 산화 반응에서 방출된 전자를 전도하는 전해질에 의해 융합됩니다. 전자는 외부 회로를 통해 환원 반응이 일어나는 영역으로 들어갈 수 있습니다. 따라서 외부 회로에서 전류가 발생하고 전기 화학 전지가 그 소스입니다. 이것이 그 목적입니다. 외부 회로에서 전기 a의 양의 방향은 요소의 환원 산화 영역으로부터의 방향인 것으로 합의되었습니다. 즉, 전류는 환원 영역의 요소를 떠나며, 이는 연료의 음극이 됩니다. 양극인 산화 영역으로 들어갑니다. 다른 전원과 마찬가지로 음극도 양전하를 띠고 있습니다.
활성 전극, 양극은 음전하 전극입니다. 전기 에너지(부하) 소비자의 경우 이름이 반대로 변경됩니다. Ch. 소개에서. 6 "양극"과 "음극"이라는 용어에 대해 더 자세히 설명합니다.
전기화학전지의 예로 전해질 역할을 하는 막을 생각해보자. 멤브레인의 측면 중 하나가 수소와 접촉되도록 합니다. 정상적인 조건에서 가스는 주로 분자 수소로 구성되지만 소수의 분자가 원자로 해리될 수 있습니다.
일부 원자는 산화(이온화)됩니다. 즉, 전자를 잃습니다.
N -> Nt + e~ .
막은 전자가 통과하지 못하기 때문에 전자는 모두 한쪽에 남아 있는 반면 형성된 이온은 차이를 통해 생성됩니다. 막을 통해 그들은 반대편에 있는 자신을 발견할 것이다. 이 경우 이온은 양전하를 띠므로 수소가 위치한 막의 표면은 과잉 전자가 축적되어 음전하를 띠게 되고 반대쪽 표면은 양전하를 띠게 되어 양전하를 띠게 된다. 확산으로 인해 나타난 이온. 전기장은 일부 이온을 막의 "수소" 표면과 반대 방향으로 이동시킵니다. 고려 중인 시스템의 동적 평형은 이온의 확산 흐름이 st일 때 설정됩니다. i는 역전류와 같다.
이제 막의 양쪽 표면에 전기 전도성 분말을 바르면 전극 역할을 하는 두 개의 다공성 전기 전도성 층이 생성됩니다. 외부 히터1을 전극에 연결하여 전극의 전기적 연결을 보장해 보겠습니다. 상당한 Rl에 대한 부하 저항. 이온은 외부 회로에서 이동할 수 없으며 전자는 과잉이 있는 "수소" 부분에서 막의 반대쪽으로 이동하기 시작하여 그림 1과 같이 외부 회로에 전류를 형성합니다. 7.2. 관심 있는 반응은 "물" 전극에서 발생하며 다음 방정식으로 설명됩니다.
2H2 -> 4H+ + 4e (양극 반응)
설명된 요소 작동 방식에는 한 가지 중요한 단점이 있습니다. 이는 열역학 제1법칙과 모순됩니다. 실제로 전류가 외부 부하를 통해 흐를 때 그 양이 방출되며 그 양은 제품 I2RL에 의해 결정됩니다. 동시에 전기
음극 영역으로 이동하여 H+ 이온과 결합하여 막을 통해 확산되어 수소 원자를 형성하고 궁극적으로 "연료"로 사용되는 H2 가스 분자를 생성합니다. 주어진 계획에 따라 과정이 진행된다면, 우리는 연료를 소비하지 않고 열을 받을 것입니다.
외부 회로는 전자의 이동 경로를 형성할 뿐, 그 자체로는 전류 발생의 원인이 될 수 없습니다. 파이프의 한쪽 끝을 호수로 낮추면 물 자체가 파이프로 흘러 들어가지 않는 것과 같습니다. 물이 흐르려면 반대쪽 끝이 물 표면 아래에 있어야 합니다. 마찬가지로, 외부 회로에 전류를 도입하려면 음극 영역의 유역학적 전위를 낮추는 것이 필요합니다. 이를 수행하는 가장 쉬운 방법은 분자가 전자 및 이온과 결합하여 물을 형성하는 산소를 추가하는 것입니다.
4е“ + 4Н+ + 02 -» 2Н20 (음극 반응). (4)
반응은 발열 반응입니다. 즉, 수소를 연소할 때 발생하는 것처럼 열 에너지가 아닌 주로 전기 에너지의 방출로 진행됩니다. 분명히, 연료 요소에 동력을 공급하는 것은 바로 이 에너지입니다.
전기화학 셀의 설명된 다이어그램은 그림 1에 나와 있습니다. 7.2.
정상적인 조건에서 전체 영역에서 소산된 수소 분자 *의 비율은 작습니다. 물리적 매개변수를 변경하면 약간 증가할 수 있습니다.
Le Chatelier의 원리에 따른 미터. 예를 들어 시스템 온도를 높이는 것입니다. 촉매 작용을 사용하여 수소 분자의 해리 정도를 높일 수도 있습니다1.
전기화학 전지에서 발생하는 전체 반응은 다음 방정식으로 설명됩니다.
2H2 + 02 -> 2H?0.
알레산드로 볼타(1800년 1745-1)가 발명한 전기화학 전지는 연속 모드로 전류를 생성하는 최초의 장치로, 소금 용액에 담근 종이 시트로 분리된 아연과 은(또는 구리) 염기로 구성되었습니다. 갈바닉 전지는 소자들을 직렬로 연결하여 한 소자의 전극이 다른 소자의 ZINC 전극에 직접 연결되도록 구성하였다.
전기화학적 볼타 전지는 용접 전극과 구리 전극을 이 산의 묽은(예: 10%) 용액에 담가서 만들 수 있습니다. 아연은 다음과 같이 산화됩니다.
Zn -> Zr,++ + 2e >
결과적으로 자유 전자가 형성됩니다. 아연 이온을 물에 녹입니다. 강산1)인 황산은 이온으로 해리됩니다.
H2S04 - "2Н+ + SOf"
아연 이온은 황산염 이온과 결합하여 황산아연을 형성합니다. 하이드로늄 이온 H"(H20)x 형태의 폰은 전해질을 통해 전극으로 이동하며, 그곳에서 가스 버블 형태로 방출됩니다(하이드로늄 이온이 II 전극 외부에서 전극으로 들어오는 전자를 포착할 때). 회로).이 유형의 전기 화학 전지는 실제로 거의 쓸모가 없습니다. 구리 전극은 표면에 부착된 수소 기포로 매우 빨리 덮혀 전극으로 들어가는 이온의 흐름을 크게 감소시키기 때문입니다. 소위 "건전지"는 표면에 절연 가스층이 형성되는 것을 방지하기 위해 몇 가지 방법을 사용합니다. 수소를 흡수하는 데 사용되는 화학 시약을 탈분극제라고 합니다. 소비되는 시약 중 하나는 일반적으로 다음과 같습니다.
"> 산의 강도는 수용액에서 분자의 해리 정도에 따라 결정됩니다. C 산은 H+ 및 C1_ 이온으로 완전히 해리됩니다. 이는 강산입니다. 황산은 다소 약하지만 강산에도 속합니다. 놀랍게도, 불화수소산은 높은 부식 활성에도 불구하고 실온에서 약산 - n t 용액이며, 중성 HF 분자의 전체 농도에서 H+ 이온의 비율은 3% 미만입니다.
쓸개, 쉽게 산화되기 쉽다; 아연이 가장 자주 사용됩니다. 볼타 소자의 구리 전극은 화학 반응을 일으키지 않으므로 구리가 소비되지 않습니다.
최근까지 저렴한 갈바니 배터리는 Leclanchet 셀을 사용했는데, 양극은 아연으로 만들어지고 음극은 (전기 전도성을 높이기 위해) 흑연을 첨가한 분말 이산화망간 층으로 코팅된 흑연 막대로 만들어졌습니다. 이산화망간은 방출된 수소를 흡수하여 음극 표면에 가스층이 형성되는 것을 방지합니다. 염화암모늄이 전해질로 사용됩니다. 최신(알카라인) 배터리는 알칼리성 전해질을 사용합니다.
양극재에 사용된 아연이 절대적으로 순수한 경우에는 소자에 전류가 흐를 때만 소모됩니다. 불순물이 존재하면 소자를 사용하지 않더라도 전극이 부식됩니다(불순물은 전극 재료 내부에 수많은 미세한 전기화학 셀을 형성합니다). 이러한 배터리의 긴 수명을 보장하기 위해 양극은 아연과 수은의 합금(아말감화)으로 만들어집니다. 현재 Leclanche 셀은 거의 완전히 알카라인 배터리로 교체되었습니다.
많은 화학반응은 외부에서 에너지가 공급될 때만 발생합니다. 이는 종종 외부 전류원에 연결된 전극의 전해조(전해조)에서 수행됩니다. 이러한 반응에 대한 연구는 다양한 물질의 성질과 특성에 대한 정보를 제공하고 전기합성을 통해 새로운 화합물을 얻는 것도 가능하게 합니다. 전기화학 공정은 산업계에서 널리 사용됩니다. 예로는 염소 및 알루미늄 생산, 전기 도금 및 전기 추출이 있습니다. 화학 에너지를 전기 에너지로 변환하는 갈바니 전지는 배터리, 축전지, 연료 전지 등 전류원의 기초를 형성합니다. 전기화학은 또한 다른 전기적 현상, 즉 전해질 용액 내 이온의 거동과 그러한 용액을 통한 전류 흐름을 연구합니다. 전기장에서 이온 분리(전기 영동); 금속의 부식 및 패시베이션; 생물학적 시스템의 전기적 효과(생전기화학); 광전기화학 과정(세포의 전기화학 반응에 대한 빛의 영향).
역사적 참고자료.
일정하고 충분히 강력한 전류원이 생성된 후에만 체계적인 전기화학 연구를 수행하는 것이 가능해졌습니다. 그러한 자료는 18~19세기 초에 나타났습니다. L. Galvani와 A. Volta의 작업 결과. 개구리의 생리학적 기능을 연구하던 중 갈바니는 우연히 두 가지 다른 금속과 해부된 개구리 다리의 근육으로 구성된 전기화학 회로를 만들었습니다. 구리 홀더로 고정된 발을 홀더에 연결된 철선으로 만졌을 때 근육이 수축되었습니다. 방전의 영향으로 유사한 수축이 발생했습니다. 갈바니는 이 현상을 '동물 전기'의 존재로 설명했다. 이 실험에 대한 다른 해석은 두 금속의 접촉 지점에서 전기가 발생하고 개구리 근육의 수축은 전류가 통과 한 결과라고 믿었던 Volta에 의해 제공되었습니다. 소금물에 적신 해면질 물질(천이나 종이)을 아연과 구리 등의 두 금속 디스크 사이에 놓고 회로를 닫을 때도 전류가 발생했습니다. 이러한 "원소" 중 15~20개를 직렬로 연결함으로써 1800년에 볼타는 최초의 화학 전류원인 "볼타 기둥"을 만들었습니다.
화학 시스템에 대한 전기의 영향은 많은 과학자들에게 즉시 관심을 끌었습니다. 이미 1800년에 W. Nicholson과 A. Carlyle은 "볼타 기둥"에 연결된 백금 및 금 전선을 사용하여 전류가 물에 흐르면 물이 수소와 산소로 분해된다는 사실을 보고했습니다. 초기 전기화학 연구 중 가장 중요한 것은 영국의 화학자 H. Davy의 연구였습니다. 1807년에 그는 약간 축축한 고체 수산화칼륨에 전류를 흘려 칼륨 원소를 분리했습니다. 전압원은 100개의 갈바니 전지로 구성된 배터리였습니다. 유사한 방법으로 금속나트륨을 얻었다. Davy는 나중에 수은 전극을 사용하여 전기분해하여 마그네슘, 칼슘, 스트론튬 및 바륨을 분리했습니다.
Davy의 조수인 M. Faraday는 전극/용액 경계면을 통해 흐르는 전기량(현재 시간)과 이로 인한 화학적 변화 사이의 관계를 조사했습니다. 전해조에서 방출된 수소와 산소의 양으로부터 전기량을 측정하기 위해 기구(현재 가스 전기량계로 알려져 있음)가 만들어졌으며, 주어진 양의 전기분해를 얻는 데 필요한 전기량이 밝혀졌습니다(1833). 물질은 전극의 크기, 전극 사이의 거리, 셀에 전원을 공급하는 배터리의 플레이트 수에 의존하지 않습니다. 또한, 패러데이는 전기분해 중에 방출되는 물질의 양이 해당 물질의 화학적 당량과 전해질을 통과하는 전기량에 정비례한다는 사실을 발견했습니다. (화학당량은 화합물에서 수소 원자 1몰(1.0078g)과 반응하거나 이를 대체하는 원소 또는 화합물의 그램 수입니다. 센티미터. 동등한 질량). 이 두 가지 기본 조항을 패러데이의 법칙이라고 합니다. 패러데이는 고전 문헌학 전문가인 친구 W. 휴웰과 함께 전기화학 분야의 새로운 용어도 개발했습니다. 그는 용액에 담긴 도체를 전극(이전에는 극이라고 불렀음)이라고 불렀습니다. "전해"(전류 흐름과 관련된 화학적 변화), "전해질"(전기 화학 전지에서 액체 전도), "양극"(산화 반응이 일어나는 전극) 및 "음극"(산화 반응이 일어나는 전극)의 개념을 도입했습니다. 환원반응이 일어난다). 그는 액체 이온 (그리스어 "방랑자", "방랑자"에서 유래)의 전하 운반체를 불렀고 양극 (양극)으로 이동하는 이온을 "음이온", 음극으로 이동하는 이온을 "양이온"이라고 불렀습니다. 패러데이의 전자기 유도 연구는 전기 발전기의 탄생으로 이어졌고 이를 통해 산업적 규모의 전기화학적 공정을 수행할 수 있게 되었습니다.
패러데이는 이온이 존재하여 전류를 통과시키는 용액의 능력을 설명했지만 그 자신과 I. Hittorf 및 F. Kohlrausch와 같은 다른 과학자들은 이온이 전류의 영향을 받아 나타난다고 믿었습니다. 1884년에 S. Arrhenius는 실제로 소금이 물에 용해될 때 이온이 형성된다는 것을 제안했습니다. S. Arrhenius, J. van't Hoff 및 W. Ostwald의 연구는 전해질 이론의 발전과 용액의 물리화학적 특성 및 열역학에 대한 아이디어의 발전에 중요한 이정표였습니다. 이온 전도도와 용액 내 평형에 대한 이론과 실험 데이터 간의 일치성은 1923년 P. Debye와 E. Hückel이 이온 간의 장거리 정전기 상호 작용을 고려한 이후 더욱 완전해졌습니다.
J. Gibbs와 W. Nernst는 전기화학적 열역학, 특히 전기화학 전지의 전위(전압) 특성과 전기, 화학, 열 에너지 사이의 균형을 설명하는 데 크게 기여했습니다. 전기화학적 전위는 세포에서 일어나는 과정의 화학적 에너지에 의해 결정되지만, 과정의 속도(동역학)에도 영향을 받습니다. 전극의 운동 과정 모델링은 Y. Tafel(1905), J. Butler(1924), M. Volmer(1930), A. N. Frumkin(1930-1933)에 의해 수행되었습니다.
전기화학 전지.
전기화학 전지는 일반적으로 두 개의 반쪽 전지로 구성되며, 각 반쪽 전지는 자체 전해질에 담긴 전극입니다. 전극은 전기 전도성 물질(금속 또는 탄소)로 만들어지거나 덜 자주 반도체로 만들어집니다. 전극의 전하 캐리어는 전자이고, 전해질의 전하 캐리어는 이온입니다. 전해질인 식염(염화나트륨 NaCl) 수용액에는 하전 입자인 나트륨 양이온 Na + 및 염소 음이온 Cl –이 포함되어 있습니다. 이러한 용액을 전기장에 놓으면 Na + 이온은 음극으로 이동하고 Cl – 이온은 양극으로 이동합니다. NaCl과 같은 용융염도 전해질입니다. 전해질은 고체일 수도 있습니다. 예를 들어 비- 이동성 나트륨 이온 또는 이온 교환 폴리머를 함유한 알루미나(폴리알루미네이트 나트륨).
반쪽 전지는 이온의 이동을 방해하지 않지만 전해질의 혼합을 방지하는 칸막이로 분리되어 있습니다. 이러한 칸막이의 역할은 염다리, 유리솜으로 양쪽 끝이 막힌 수용액이 들어 있는 관, 이온교환막, 다공성 유리판 등에 의해 수행될 수 있다. 전해조의 두 전극을 동일한 전해질에 담글 수 있습니다.
전기화학 전지에는 갈바니 전지와 전해 전지(전해조)의 두 가지 유형이 있습니다. 갈바니 전지에서는 전극/전해질 계면에서 화학 반응이 자발적으로 일어나고, 전극은 도체에 의해 서로 연결됩니다. 직렬로 연결된 여러 갈바니 전지는 화학적 전류원인 배터리를 형성합니다. 전해조에서는 외부 전기 에너지원으로 인해 전극/전해질 계면에서의 반응이 발생합니다. 후자는 전극에서 발생하는 반응 생성물의 화학 에너지로 변환됩니다. 갈바니 전지의 구조는 그림 1에 나와 있습니다. 1 및 전해조 - 그림. 2. 동일한 셀은 작동 모드에 따라 갈바니 셀 또는 전해조로 작동할 수 있습니다. 따라서 납축 자동차 배터리는 엔진을 시동하는 데 사용될 때(방전하는 동안) 갈바니 전지로 작동하고, 자동차 발전기나 충전기에서 충전할 때 전해조로 작동합니다.
J. Daniel(그림 1)이 1836년에 만든 간단한 갈바니 전지는 두 개의 전극, 즉 황산아연 수용액에 담근 아연과 황산구리(II) 수용액에 담근 구리로 구성됩니다. 이러한 요소는 볼타 기둥의 구리-아연 쌍과 유사합니다. 외부 회로가 닫히면 아연 전극 표면의 아연 원자가 전자 방출과 함께 이온으로 산화됩니다. Zn ® Zn 2+ + 2e – . 이들 전자는 외부 회로를 따라 구리 전극으로 이동하고 구리 이온을 원자(Cu 2+ + 2e – ® Cu)로 환원합니다. 외부 회로에서 전자의 흐름은 소자에 의해 생성된 전류입니다. 화학적 변형과 전기 에너지 생성으로 이어지는 전반적인 반응은 다음과 같은 형태를 갖습니다.
황산동 용액에 금속 아연을 첨가하면 정확히 동일한 반응이 발생하지만 이 경우 화학 에너지가 열 에너지로 변환됩니다.
전기화학 전지는 전극과 전해질 사이의 경계를 수직 또는 슬래시(| 또는 /)로 표시하고 염다리를 두 개의 슬래시(//)로 표시하여 개략적으로 표시하는 경우가 많습니다. 따라서 그림의 갈바니 전지는 다음과 같습니다. 답변 항목 1개
여기서 M은 용액의 몰 농도입니다.
그림에 표시된 전해조에서 2, 염소 및 알칼리 생산을 위한 산업용 전해조에서와 동일한 반응이 발생합니다. 즉, 염수(농축된 염화나트륨 수용액)를 염소 및 수산화나트륨 NaOH로 전환합니다.
흑연 전극의 염화물 이온은 산화되어 염소 가스로 되고, 철 전극의 물은 수소와 수산화물 이온으로 환원됩니다. 전해질은 이온 교환막인 칸막이를 통한 나트륨 이온의 이동으로 인해 전기적으로 중성을 유지합니다. 산화가 일어나는 전극(그림 1의 아연, 그림 2의 흑연)을 양극, 환원이 일어나는 전극을 음극이라 한다.
전극 전위.
전기화학 전지의 주요 전기 매개변수는 전류(암페어, A로 측정)와 전위(볼트, V로 측정)입니다. 전류 세기는 전극 반응 속도에 따라 결정되고, 전위는 전지에서 일어나는 과정의 화학 에너지에 따라 결정됩니다. 이는 에너지(줄, J로 측정)를 전기량(쿨롱, C로 측정)으로 나눈 것과 같습니다. 1V = 1J / Cl. 따라서 요소의 전위(기전력, EMF)는 요소에서 발생하는 반응 중에 생성되는 에너지의 척도입니다. 외부 회로가 열려 있으면 전극 반응이 발생하지 않습니다.
개방형 외부 회로를 갖춘 갈바니 전지의 잠재력은 반응의 열역학에 대한 정보를 제공합니다. 그림에 표시된 요소의 잠재력. 1, 용액 농도 1M 및 온도 25°C - 표준 전위 이자형° – 1.10V와 동일. 해당 에너지, 깁스 열역학적 전위, D G°는 다음과 같이 주어진다.
어디 N– 반응 중에 전달된 전자의 수(이 경우 2), 에프– 패러데이 수 (96 485 C / 두더지). 갈바니 전지의 전위는 두 개의 반쪽 전지 사이의 전위차와 같습니다. 전극 전위의 차이. 전극 전위는 일반적으로 0으로 간주되는 기준 전극의 전위를 기준으로 측정됩니다( 센티미터. 테이블). 합의에 따라 일반 수소 전극(N.H.E.)이 표준 전극으로 선택되었습니다. 백금판을 백금블랙으로 코팅하고 1.01H105Pa(1atm.)의 압력에서 수소가스로 포화시킨 후 열역학적 활성을 갖는 H+이온이 함유된 용액에 담근 백금판입니다. ㅏ= 1. 개략적으로 이 전극은 Pt/H 2 (1.01H 10 5 Pa)/H + ( ㅏ= 1). 2H + + 2e – ® H 2 반응이 발생합니다. Cu/Cu 2+ 구리 전극의 표준 전위를 결정하려면 다음 갈바니 전지를 조립하십시오.
Cu 2+ + 2e – ® Cu의 반쪽 반응에 대한 측정 결과는 다음과 같습니다.
마찬가지로, Zn 2+ + 2e – ® Zn 반응이 일어나는 Zn/Zn 2+ 반쪽 전지에 대해 다음을 얻습니다.
이 두 표준 전극 전위의 차이는 Zn-Cu 원소의 표준 전위와 동일합니다.
실제로 수소 전극은 실제로 구현하기 어려운 이상적인 시스템을 나타내기 때문에 전위차 측정에 거의 사용되지 않습니다. 훨씬 더 자주, 전류에 대해 구체적이고 신중하게 측정된 전위 값을 갖는 다양한 유형의 보다 편리하고 컴팩트한 비교 전극이 사용됩니다. 일반적으로 금속 수은, 염화수은(칼로멜) 및 염화칼륨 용액(Hg /Hg 2 Cl 2 /KCl)으로 구성된 칼로멜 전극(CE)을 사용합니다. 전극에서는 다음과 같은 반응이 일어납니다.
잠재적인 k.e. 수은 이온의 농도에 따라 달라지며 후자는 KCl 용액의 농도에 따라 달라집니다. 포화 KCl 용액의 경우 이자형°(k.e.) av = 25°C에서 0.2412V(n.e.)
|
표준 전극 전위 |
|
| 전극반응 |
이자형오, 브이 |
| Li + + e – ® Li | |
| Mg 2+ + 2e – ® Mg | |
| Al 3+ + 3e – ® Al | |
| 아연 2+ + 2e – ® 아연 | |
| 크롬 3+ + e – ® 크롬 2+ | |
| 2H + + 2e – ® H 2 | |
| Cu 2+ + 2e – ® Cu | |
| Fe 3+ + e – ® Fe 2+ | |
| O 2 + 4H + + 4e – ® 2H 2 O | |
| Cl 2 + 2e – ® 2Cl – | |
| F 2 + 2e – ® 2F – | |
일부 전극의 물질은 해당 반응식에 포함되지 않습니다. 응, 반응
실제로 Pt/Fe 3+, Fe 2+ 셀의 백금 전극에서 발생합니다. 백금 전극은 불활성이며 산화된 형태와 환원된 형태의 원소(이 경우 2가 및 3가 철 이온)를 포함하는 전해질과만 접촉합니다. 백금 전극은 N.V.E에서도 동일한 역할을 합니다.
전극 전위 표를 사용하면 전극 전위를 기준으로 갈바니 전지의 EMF를 계산할 수 있습니다. 또한 특정 산화환원 반응이 일어날지 여부를 예측하는 데에도 사용할 수 있습니다. 반응에 참여하는 구성 요소의 활동도가 1인 경우에만 표준 전극 전위에 대해 이야기할 수 있습니다. 용액 내 농도는 1M에 가깝습니다. 전극 전위 이자형용액 내 산화 및 환원 형태의 농도에 따라 달라지며 표준 전위와 관련이 있습니다. 이자형° 네른스트 방정식. 일반화된 반응의 경우
황소 + N전자 – = 빨간색
이 방정식은 다음과 같은 형식을 갖습니다.
어디 아르 자형– 보편적인 기체 상수, 티– 절대 온도 – 산화 및 환원 형태의 활동 순수한 고체와 액체의 활동은 1로 간주됩니다. 25°C에서 RT/F= 0.025 V. 기준 전극의 전위에 대한 전극 전위를 측정함으로써 방정식 (10)을 사용하여 용액 내 물질의 농도를 결정할 수 있습니다. 이 방법을 전위차법이라고 합니다.
전극 반응.
전위차 측정은 전기화학 전지에 전류가 없는 조건에서 수행됩니다. 이는 전체적인 화학적 변화가 발생하지 않으며 측정된 전위(평형)가 반응의 열역학에 의해 결정된다는 것을 의미합니다. 이러한 조건에서는 전극의 크기와 모양, 용액의 교반 강도와 같은 요소가 측정된 전위에 영향을 미치지 않습니다. 전류가 전기화학 전지를 통해 흐를 경우, 전극 반응 속도는 열역학적 매개변수뿐만 아니라 다음 방정식에 따른 전류 세기에도 따라 달라집니다.
어디 N– 주어진 전극 반응에 참여하는 전자의 수, 에프– 패러데이 번호. 이 경우 전기화학 전지의 전위는 운동 요인뿐만 아니라 전극을 만드는 재료, 전극의 크기와 모양, 용액 교반 강도 및 기타 여러 요인에 따라 달라집니다. 셀의 내부 저항은 무시할 수 없습니다. 전극/전해질 경계의 전위차 외에도 용액 자체의 저항으로 인해 전압 강하가 발생합니다. 이러한 전압 강하는 두 전극에서 발생하는 반응과 관련된 효과를 연구하기 어렵게 만듭니다. 일반적으로 반응은 3개 전극 셀을 사용하여 작업 전극 또는 표시 전극이라고 하는 하나의 전극에서 연구됩니다(그림 3). 세 번째 전극(예: 포화 칼로멜)은 작업 전극과 동일한 구획에 배치됩니다. 하나는 저항 전압 강하의 영향을 최소화하기 위해 가능한 한 가깝게 배치하는 것입니다. 기준 전극에 대한 이 전극의 전위 함수로서 작동 전극을 통과하는 전류를 측정함으로써 소위 분극 곡선.
외부 전류가 흐르면 전극 전위는 평형 전위와 다릅니다. 이러한 편차를 분극이라고 하며 그 크기를 과전압이라고 합니다. 과전압은 전극 반응 속도를 제한하는 여러 요인에 따라 달라집니다. 주어진 전류 밀도(단위 전극 표면당 전류 강도)에서 빠른 전극 반응은 열역학에 가까운 전위에서 발생하므로 낮은 과전압에서 발생합니다. 느린 반응은 높은 과전압이 특징입니다. 전극 반응 속도, 즉 과전압은 시약의 농도, 온도, 용매, 전극 재료, 물질 이동 방법 및 속도, 전류 밀도에 따라 달라집니다. 총 과전압은 농도, 활성화, 반응 등 여러 구성요소로 분해될 수 있습니다.
농도 과전압은 전류가 흐르면 전극 표면의 반응 이온 농도가 변하기 때문에 발생합니다. 이는 이 영역에서 전기 활성 물질이 소비되고 반응 생성물이 형성되기 때문입니다. 구리 전극에서 Cu 2+의 환원을 고려해 보겠습니다. 처음에 용액의 Cu 2+ 농도는 1M입니다. 회로에 전류가 없으면 구리 전극의 전위는 Cu/Cu 2+ 쌍의 표준 전위에 가깝습니다. N.E에 비해 0.34V [ 센티미터. 식(6)]. 음극 전류가 흐르면서 전극 표면의 Cu 2+ 이온 농도는 감소하고 Nernst 식 (10)에 따라 음극 전위는 점점 음의 값을 갖게 됩니다. 시약의 새로운 부분은 확산, 대류 및 이동의 결과로 다양한 방식으로 용액에서 전극으로 도착합니다. 이러한 공정의 속도가 높을수록(예: 혼합 강도가 높을수록) 농도 과전압은 낮아집니다. 총 과전압의 이 구성요소는 종종 계산될 수 있습니다. 농도 분극이 전체 과전압에 주된 기여를 하는 경우(이는 전극 반응의 나머지 단계의 속도가 높다는 것을 의미함) 이 반응을 가역적 반응 또는 Nernstian 반응이라고 합니다.
활성화 과전압은 전극 표면의 전자 이동이 즉시 발생하지 않고 유한한 속도로 발생한다는 사실로 인해 발생합니다. 일반화된 전극 반응 ox + N e – = 빨간색. 주어진 속도(즉, 주어진 전류 밀도)로 산화된 화합물에 전자를 전달하려면 전극 반응의 활성화 에너지라고 하는 에너지 장벽을 극복해야 합니다. 이 에너지는 적용된 전위에 의해 공급됩니다. 전류 밀도와 활성화 과전압 사이의 관계는 전극 반응의 운동 매개변수를 결정하는 데 사용할 수 있는 Butler-Volmer 및 Tafel 방정식으로 설명됩니다. 물이 수소로 환원되거나 물이 산소로 산화되는 등 많은 전극 반응은 천천히 발생합니다. 전극 반응 속도는 전극을 만드는 재료와 표면 특성에 따라 크게 달라질 수 있습니다. 예를 들어, 수은 전극에서는 물을 수소로 환원시키는 것이 상당히 어렵습니다. 이는 높은 수소 과전압이 특징입니다. 이 반응은 백금에서 훨씬 더 빠르고 과전압도 덜 발생합니다. 수소 기준전극에 백금을 사용하는 것도 이 때문이다. 반응 속도는 전극 표면에 흡착되거나 결합된 물질에 따라 달라집니다. 따라서 시안화물 이온과 다수의 유기 화합물은 백금 전극 표면의 수소 발생 속도를 감소시킵니다. 동시에 일부 계면활성제는 전극 반응 속도를 크게 증가시킬 수 있습니다. 이를 전기촉매라고 합니다.
반응 과전압은 전극에서의 전자 이동이 용액 내 화학 반응과 결합될 때 발생합니다. 이러한 반응은 전자 이동과 관련된 입자의 소스 역할을 할 수 있으며 동시에 전체 전극 프로세스의 속도를 제한할 수 있습니다. 이것이 전극 반응의 메커니즘(즉, 단계 및 중간 상태)의 세부 사항을 아는 것이 매우 중요한 이유입니다. 많은 경우, 출발 물질은 산소가 물로 환원되는 경우와 같이 전극에서 최종 제품이 되기 전에 여러 가지 변형을 거치는데, 이는 실질적으로 매우 중요한 과정입니다. 전체 반응의 형태는 다음과 같습니다.
여러 단계로 구성되며 그 중 하나에서 산소-산소 결합이 끊어집니다. 이러한 다단계 반응으로 인해 대부분의 전극에서의 반응은 느리며, 산업 규모에서는 전기촉매가 있는 상태에서 반응이 수행됩니다. 전극 반응의 메커니즘은 아래에 설명된 전기 분석 방법을 사용하여 연구됩니다. 종종 용액의 조성과 용매의 성질이 변하면 반응 과정이 변합니다. 예를 들어, 양성자가 부족한 아세토니트릴의 산소 환원은 간단한 단일 전자 메커니즘에 따라 진행됩니다.
전기화학적 분석 방법.
화학 물질의 정성적 및 정량적 분석을 위해 다양한 전기화학적 방법이 개발되었으며, 이는 전극 반응의 열역학적 및 운동학적 매개변수를 결정하고 그 메커니즘을 연구하는 데에도 유용합니다.
전도도 측정
용액의 전기 전도도 측정을 기반으로 하며 염, 산, 염기 등의 농도를 결정하는 데 사용됩니다. 전도도 측정에서는 일반적으로 동일한 재료로 만들어진 전극이 사용되며 전극/전해질 계면 모두에서 전위 점프의 기여를 최소화하는 방식으로 전극의 전도 조건이 선택됩니다(예: 고주파 교류가 사용됨) ). 이 경우 측정된 셀 전위에 대한 주요 기여는 옴 전압 강하에 의해 이루어집니다. IR, 어디 아르 자형– 용액 저항. 단일 성분 용액의 전기 전도도는 농도와 관련될 수 있으며, 복합 조성의 전해질의 전기 전도도를 측정하면 용액의 총 이온 함량을 추정할 수 있으며, 예를 들어 증류수의 품질을 모니터링하는 데 사용됩니다. 또는 탈이온수. 또 다른 유형의 전도도 측정(전도도 측정 적정)에서는 알려진 시약을 분석된 용액에 일부 첨가하고 전기 전도도의 변화를 모니터링합니다. 전기 전도도의 급격한 변화가 나타나는 당량점은 첨가된 시약의 부피에 대한 이 값의 의존성의 그래프로부터 결정됩니다.
전위차법
갈바니 전지의 잠재력에 대한 데이터를 기반으로 다양한 물리화학적 매개변수를 결정하는 데 사용됩니다. 기준 전극을 기준으로 측정된 전기화학 회로에 전류가 없을 때의 전극 전위는 Nernst 방정식에 의해 용액의 농도와 관련됩니다. 전위차 측정에서는 pH를 측정하기 위한 유리 전극과 나트륨, 암모늄, 불소, 칼슘, 마그네슘 등의 이온을 선택적으로 측정하기 위한 전극과 같이 주로 용액 내 하나의 이온에 민감한 이온 선택성 전극이 널리 사용됩니다. 이온 선택성 전극의 층에는 효소가 포함될 수 있으며 그 결과 시스템은 적절한 기질에 민감합니다. 이온 선택성 전극의 전위는 전자 전도성을 갖는 물질의 경우처럼 전자의 전달에 의해 결정되는 것이 아니라 주로 이온의 전달 또는 교환에 의해 결정됩니다. 그러나 전극 전위를 용액 내 물질 농도(또는 활동도)의 로그와 관련시키는 Nernst 방정식은 이러한 전극에도 적용할 수 있습니다. 전위차 적정에서는 분석할 용액에 시약을 부분적으로 첨가하고 전위 변화를 모니터링합니다. 이러한 적정 유형의 특징인 S자형 곡선을 통해 당량점을 결정하고 평형 상수 및 표준 전위와 같은 열역학적 매개변수를 찾을 수 있습니다.
전압전류법.
모든 종류의 전압전류법은 표면적이 10–7–10–1 cm2인 작동하는 미세 전극을 사용합니다. 이를 통해 얻은 전류-전압 곡선을 통해 용해된 물질을 식별하고 농도를 결정하며 종종 열역학적 및 운동학적 매개변수를 확인할 수 있습니다. 최초의 전압전류법인 폴라로그래피는 체코의 화학자 J. Heyrovsky가 1922년에 제안했습니다. 그의 설정에 사용된 작업 전극은 물방울이 떨어지는 수은 전극이었습니다. 수은은 수소 과전압이 높으므로 수은 전극은 음전위에서 발생하는 과정을 연구하는 데 편리합니다. 전극 표면은 측정 과정에서 지속적으로 갱신되므로 전극의 오염이 제거됩니다. 전압전류법 연구는 백금이나 탄소와 같은 고체 전극을 사용하여 수행되며 양전위에서 발생하는 과정을 사용합니다. 선형 전위 스위프 전압전류법(시간 전류법)에서는 전위가 시간에 따라 선형적으로 변하고 용액은 교반되지 않으므로 확산으로 인해 질량 전달이 발생합니다. 순환 전압전류법에서는 반복되는 삼각 전압 펄스가 전극에 적용됩니다. 주기의 상승 부분에서 형성된 물질은 하강 부분에서 연구됩니다. 이 방법은 다양한 전위 스위프 속도와 다양한 용액 농도에서 분극 곡선을 분석하여 전극 반응의 메커니즘을 연구하는 데 특히 효과적입니다. 다른 유형의 전압전류법(차동 펄스 및 구형파)이 있는데, 여기서는 서로 다른 모양의 전압 펄스가 선형적으로 증가하는 전위에 중첩됩니다. 이러한 방법은 용액 내 작은 농도의 물질을 결정하는 데 널리 사용됩니다. 전압전류 측정 중에 용액이 혼합되어 대류와 확산을 사용하여 물질 전달이 동시에 발생하는 경우 유체역학적 전압전류법을 사용합니다. 이 경우 실험적인 전류-전압 곡선을 이론적인 곡선과 직접 비교할 수 있으므로 회전 디스크 전극을 사용하는 것이 편리합니다.
전류측정법.
이 방법은 표시 전극과 기준 전극 사이의 고정 전압에서 용액을 통과하는 제한 확산 전류를 측정하는 것을 기반으로 합니다. 전류량 적정에서 당량점은 전류 곡선의 중단, 즉 추가된 작업 용액의 부피에 의해 결정됩니다. 시간전류법은 시간에 따른 전류의 의존성을 측정하는 데 기반을 두고 있으며 주로 확산 계수와 속도 상수를 결정하는 데 사용됩니다. 액체 크로마토그래프 컬럼의 출력에서 센서 역할을 하는 소형 전기화학 셀은 전류법(및 전압전류법) 원리에 따라 작동합니다. 정전류 방식은 전류 측정 방식과 유사하지만 일정량의 전류가 셀을 통과할 때 전위를 측정합니다. 따라서 대시간전위차법에서는 시간에 따른 전위 변화가 제어됩니다. 이러한 방법은 주로 전극 반응의 동역학을 연구하는 데 사용됩니다.
전기량 측정.
전량법에서는 제어된 전위에서 상대적으로 큰 작업 전극(하단 수은 또는 백금 메쉬)이 있는 전해조에서 용액을 집중적으로 혼합하여 용액의 완전한 전기분해가 수행됩니다. 총 전력량 ( 큐, C) 전기 분해에 필요한 것은 형성 물질의 양과 관련이 있습니다 ( ㅏ, d) 패러데이의 법칙:
어디 중-그들이 말하길 질량(g/mol), 에프- 패러데이 번호. 전기량 적정은 정전류를 사용하여 측정되는 물질과 반응하는 시약을 전기분해적으로 생성하는 것을 포함합니다. 적정 진행은 전위차 또는 전류량 측정으로 제어됩니다. 전기량 측정 방법은 본질적으로 절대적이기 때문에 편리합니다(즉, 검량선에 의존하지 않고 분석물의 양을 계산할 수 있음). 전기분해 조건 및 전해조 매개변수(전극 표면적 또는 교반 강도)의 변화에 민감하지 않습니다. 전기량 측정에서는 전기분해 전과 후에 전극의 무게를 측정하여 전기분해된 물질의 양을 결정합니다.
다른 전기 분석 방법이 있습니다. 교류 폴라로그래피에서는 낮은 진폭의 정현파 전압이 넓은 주파수 범위에 걸쳐 선형적으로 변화하는 전위에 적용되며 결과 교류 전류의 진폭 및 위상 변이 또는 임피던스가 결정됩니다. 이러한 데이터로부터 용액 내 물질의 특성과 전극 반응의 메커니즘 및 동역학에 대한 정보를 얻습니다. 박층 방법은 두께가 10~100μm인 전해질 층을 갖춘 전기화학 전지를 사용합니다. 이러한 전지에서는 전기분해가 기존 전해조보다 빠르게 진행됩니다. 전극 공정을 연구하기 위해 분광 광도계 등록을 통한 분광 화학적 방법이 사용됩니다. 전극 표면에 형성된 물질을 분석하기 위해 가시광선, UV 및 IR 영역의 빛 흡수를 측정합니다. 전극 표면과 매질의 특성 변화는 전극 표면의 방사선 반사 측정을 기반으로 하는 전기 반사 및 엘립소메트리 방법을 사용하여 모니터링됩니다. 여기에는 정반사 및 빛의 라만 산란 방법(라만 분광법), 2차 고조파 분광법(푸리에 분광법)이 포함됩니다.
기타 전기화학적 현상 및 방법.
전해질과 하전 입자 또는 표면의 상대적인 움직임으로 동전기 효과가 발생합니다. 이러한 종류의 중요한 예는 전기장에서 움직이는 하전 입자(예: 단백질 분자 또는 콜로이드 입자)의 분리가 발생하는 전기 영동입니다. 전기영동 방법은 젤에서 단백질이나 디옥시리보핵산(DNA)을 분리하는 데 널리 사용됩니다. 전기 현상은 살아있는 유기체의 기능에 큰 역할을 합니다. 신경 자극의 생성 및 전파, 막횡단 전위의 발생 등을 담당합니다. 생물학적 시스템과 그 구성요소를 연구하기 위해 다양한 전기화학적 방법이 사용됩니다. 빛이 전기화학적 공정에 미치는 영향을 연구하는 것도 흥미롭습니다. 따라서 광전기화학 연구의 주제는 빛의 영향으로 전기에너지의 발생과 화학반응의 개시이며, 이는 태양에너지를 전기에너지로 변환하는 효율을 높이는 데 매우 중요하다. 이산화티타늄, 황화카드뮴, 갈륨비소 및 실리콘으로 만들어진 반도체 전극이 여기에 일반적으로 사용됩니다. 또 다른 흥미로운 현상은 전기화학발광입니다. 전기화학 전지에서 빛의 발생. 이는 전극에 고에너지 생성물이 형성될 때 관찰됩니다. 종종 이 공정은 주어진 화합물의 산화된 형태와 환원된 형태를 모두 얻기 위해 순환 방식으로 수행됩니다. 서로의 상호 작용은 빛의 방출과 함께 바닥 상태로 전달되는 여기된 분자의 형성으로 이어집니다.
응용 전기화학.
전기화학에는 많은 실용적인 응용이 있습니다. 배터리에 연결된 일차 갈바니 전지(일회용 요소)의 도움으로 화학 에너지가 전기 에너지로 변환됩니다. 2차 전류원 - 배터리 - 전기 에너지를 저장합니다. 연료전지는 수소, 산소 등의 반응물을 지속적으로 공급해 전기를 생산하는 1차 동력원이다. 이러한 원칙은 우주 정거장, 전기 자동차 및 전자 장치에 사용되는 휴대용 전원 및 배터리의 기초가 됩니다.
많은 물질의 대규모 생산은 전기화학적 합성을 기반으로 합니다. 염소-알칼리 공정에서 염수를 전기분해하면 염소와 알칼리가 생성되며, 이는 펄프 및 제지 산업뿐만 아니라 유기 화합물과 폴리머를 생산하는 데 사용됩니다. 전기분해 생성물은 염소산나트륨, 과황산염, 과망간산나트륨과 같은 화합물입니다. 알루미늄, 마그네슘, 리튬, 나트륨, 티타늄 등 산업적으로 중요한 금속은 전기추출을 통해 얻습니다. 용융 염을 전해질로 사용하는 것이 더 좋습니다. 이 경우 수용액과 달리 수소 방출로 인해 금속 환원이 복잡해지지 않기 때문입니다. 불소는 용융염에서 전기분해에 의해 생성됩니다. 전기화학 공정은 일부 유기 화합물 합성의 기초 역할을 합니다. 예를 들어, 아디포니트릴(나일론 합성의 중간체)은 아크릴로니트릴의 수소이량체화에 의해 얻어집니다.
은, 금, 크롬, 황동, 청동 및 기타 금속과 합금의 전기 도금은 철강 제품을 부식으로부터 보호하기 위해, 장식 목적으로, 전자 산업의 전기 커넥터 및 인쇄 회로 기판 제조를 위해 다양한 물체에 널리 실시됩니다. 전기화학적 방법은 금속 및 합금으로 만들어진 공작물의 고정밀 치수 가공, 특히 기존의 기계적 방법으로 가공할 수 없는 공작물의 고정밀 치수 가공과 복잡한 프로파일을 가진 부품의 제조에 사용됩니다. 알루미늄, 티타늄 등의 금속 표면을 양극산화 처리하면 보호산화막이 형성됩니다. 이러한 필름은 전해 콘덴서 제조 시 알루미늄, 탄탈륨 및 니오븀으로 만들어진 공작물의 표면에 생성되며 때로는 장식용으로 생성됩니다.
전기화학적 방법은 부식 과정과 이러한 과정을 늦추는 재료 선택에 대한 기초 연구에 종종 사용됩니다. 금속 구조의 부식은 외부 소스가 보호되는 구조에 연결되고 양극과 구조가 산화가 배제되는 전위로 유지되는 음극 보호를 사용하여 방지할 수 있습니다. 다른 전기화학 공정의 실제 적용 가능성이 탐구되고 있습니다. 그래서 전기분해를 이용하면 물을 정화할 수 있다. 매우 유망한 방향은 광화학 방법을 사용하여 태양 에너지를 변환하는 것입니다. 전기화학 발광을 기반으로 하는 작동 원리를 갖춘 전기화학 모니터가 개발되고 있습니다. 전극 반응의 결과로 전극 표면 색상의 가역적 변화에 대한 연구도 언급하겠습니다.
문학:
Agladze R.I. 응용 전기화학. M. – L., 1975
이즈마일로프 N.A. 솔루션의 전기화학.엠., 1976년
전기화학의 측정 방법, 권. 1-2. 엠., 1977
코리타 I. 이온, 전극, 막.엠., 1983
Bagotsky V.S. 전기화학의 기초.엠., 1988