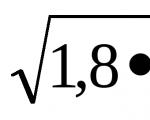Jonų mainų reakcijos baigsis. Joninių reakcijų lygtys
1 problema. Apskaičiuokite vandenilio jonų koncentraciją HCN tirpale (C m = 10 -3 M), jei = 4,2∙10 -3 .
Sprendimas: Ciano rūgšties disociacija vyksta pagal lygtį HCN ↔ H + + CN - ; jonų ir tirpalo koncentracijos yra lygios viena kitai (nes H+: C N - = 1:1, kur
- stechiometriniai koeficientai) t.y. = = C m, mol/l; Tada = = 4,2∙10 -3 ∙ 10 -3 = 4,210 -7 mol/l.
Sprendimas : Amonio hidroksidas disocijuoja taip:
NH 4 OH ↔ NH 4 + + OH -, disociacijos konstanta turi formą
K d =;
amonio ir hidroksido jonų koncentracijos yra vienodos ( (NH4+): (OH -) = 1:1), žymime juos kaip X:
= = x mol/l , tada K d išraiška įgis tokią formą
1,810 -5 = X 2 / 0,01-X. Atsižvelgiant į tai X<< С м, решаем уравнение
1,810 -5 =x 2 / 0,01, santykinis X:
X=
 =4,2∙10 -4 mol/l; = 4,2∙10 -4 mol/l.
=4,2∙10 -4 mol/l; = 4,2∙10 -4 mol/l.
Vandenilio ir hidroksido jonų koncentracijos yra susijusios su joniniu vandens produktu K w= =10 -14, išreikškime vandenilio jonų koncentraciją = K w/ ir apskaičiuokite jo vertę:
110 -14 /4,210 -4 = 2,310 -11 mol/l.
3 problema. Nustatykite HCl tirpalo pH ( =1), jei C m = 2∙10 -3 M
Sprendimas: Vandenilio chlorido rūgšties disociacija vyksta pagal lygtį
HCl H + + Cl - , vandenilio jonų koncentracija = C m =1∙2∙10 -3 = =2∙10 -3 mol/l. Vandenilio indikatorius pH = - log = - log2∙10 -3 = 2,7.
4 problema. Nustatykite amonio hidroksido molinę koncentraciją, jei pH=11 ir Kd=1,8∙10 -5.
Sprendimas: Vandenilio jonų koncentracija =10 - pH =10 -11 mol/l. Iš joninio vandens produkto nustatome koncentraciją = K w / = 10 -14 /10 -11 =10 -3 mol/l. Amonio hidroksidas yra silpna bazė ir jam būdinga disociacijos reakcijos lygtis
NH 4 OH ↔ NH 4 + + OH - . Disociacijos konstantos išraiška
K d =. 
Iš Ostvaldo dėsnio išplaukia, kad = = ∙C m, a KAM d = 2 C m. Sujungus lygtis, gauname C m = 2 / K d = 10 -6 / 1,8∙10 -5 = 0,056 mol/l
Tirpumo produktas
Medžiagos, priklausomai nuo jų pobūdžio, turi skirtingą tirpumą vandenyje, kuris svyruoja nuo miligramo frakcijų iki šimtų gramų litre. Sunkiai tirpūs elektrolitai sudaro labai mažos koncentracijos sočius tirpalus, todėl galime manyti, kad jų disociacijos laipsnis pasiekia vienybę. Taigi, prisotintas mažai tirpaus elektrolito tirpalas yra sistema, susidedanti iš paties tirpalo, kuris yra pusiausvyroje su ištirpusios medžiagos nuosėdomis. Esant pastovioms išorinėms sąlygoms, nuosėdų tirpimo greitis yra lygus kristalizacijos proceso greičiui: K n A m ↔ n K+ m + m A- n (1)
nuosėdų tirpalas
Šiam nevienalyčiam pusiausvyros procesui apibūdinti naudojama pusiausvyros konstanta, vadinama tirpumo sandauga PR = n m, kur ir yra jonų koncentracijos sočiame tirpale (mol/l). Pavyzdžiui:
AgCl= Ag + +Cl - , PR = ; Čia n=m=1.
PbI2 = Pb2+ +2I-, PR = 2; Čia n=1, m=2.
PR priklauso nuo ištirpusios medžiagos pobūdžio ir temperatūros. PR yra lentelės reikšmė. Žinant PR , galite apskaičiuoti medžiagos sočiojo tirpalo koncentraciją, taip pat įvertinti jo tirpumą g 100 ml vandens (vertė s, pateiktą informacinėje literatūroje) ir nustatyti medžiagos nusodinimo galimybę.
Pagal (1) lygtį ryšys tarp sunkiai tirpios medžiagos prisotinto tirpalo koncentracijos (C m, mol/l) ir PR vertės nustatomas pagal šią lygtį: 
 ,
,
Kur n Ir m –stechiometriniai koeficientai ekv. 1.
5 užduotis. Sočiojo tirpalo (C m)Mg(OH) 2 koncentracija yra 1,1 10 -4 mol/l. Užsirašykite PR išraišką ir apskaičiuokite jo vertę.
Sprendimas: Sočiame Mg(OH) 2 tirpale susidaro pusiausvyra tarp nuosėdų ir tirpalo Mg(OH) 2 ↔Mg 2+ + 2OH - , kurio PR išraiška turi formą PR = 2. Žinodami jonų koncentraciją, galite rasti jos skaitinę vertę. Atsižvelgiant į visišką atsiribojimą
Mg(OH) 2, jo koncentracija prisotintas tirpalas C m = = 1,110 -4 mol/l, a = 2 = 2,210 -4 mol/l. Todėl PR= 2 =1,1. 10 -4 (2,2 10 -4) 2 = 5,3. 10 -12.
6 užduotis. Apskaičiuokite sočiojo tirpalo koncentraciją ir sidabro chromato PR, jei 0,5 l vandens ištirpinama 0,011 g druskos.
Sprendimas:
Sočiųjų tirpalų Ag 2 CrO 4 molinei koncentracijai nustatyti naudojame formulę C M =
 ,
Kur m- ištirpusios medžiagos masė (g), M - molinė masė (g/mol), V- tirpalo tūris (l). M (Ag 2
CrO 4
)
=332 g/mol. cm =9,48. 10 -5 mol/l. Sidabro (I) chromato ištirpimą lydi visiška ( = 1) druskos disociacija: Ag 2 CrO 4 ↔ 2Ag + +CrO 4 2-, PR = 2, kur = C m = 9,48. 10 -5 mol/l, a = 2 =1,89610 -4.
,
Kur m- ištirpusios medžiagos masė (g), M - molinė masė (g/mol), V- tirpalo tūris (l). M (Ag 2
CrO 4
)
=332 g/mol. cm =9,48. 10 -5 mol/l. Sidabro (I) chromato ištirpimą lydi visiška ( = 1) druskos disociacija: Ag 2 CrO 4 ↔ 2Ag + +CrO 4 2-, PR = 2, kur = C m = 9,48. 10 -5 mol/l, a = 2 =1,89610 -4.
Taigi PR = (1,89610 -4) 2 (9,4810 -5) = 3,410 -12.
7 problema. Ar galima ruošti CaCO 3 druskos tirpalus su CaCO 3 C 1 = 10 -2 M ir C 2 = 10 -6 M koncentracijomis, jei PR CaCO 3 = 3,810 -9.
Sprendimas: Žinodami PR reikšmę, galite apskaičiuoti koncentraciją
prisotinto druskos tirpalo ir lyginant jį su siūlomu
koncentracijos, padaryti išvadą apie tirpalų paruošimo galimybę ar negalėjimą. Kalcio karbonato tirpimas vyksta pagal schemą CaCO 3 ↔Ca 2+ +CO 3 2- Šioje lygtyje n = m = 1 tada
 =
=
 ≈ 6,2 10 -5 mol/l,
≈ 6,2 10 -5 mol/l,
C 1 > C m – tirpalo paruošti negalima, nes susidarys nuosėdos;
C 2< С м – раствор приготовить можно.
Jonų mainų reakcijos
Elektrolitų tirpalams būdingos jonų mainų reakcijos. Būtina sąlyga, kad tokios reakcijos įvyktų beveik visiškai, yra tam tikrų jonų pašalinimas iš tirpalo dėl:
1) nuosėdų susidarymas
FeSO 4 + 2 NaOH Fe(OH) 2 + Na 2 SO 4 - molekulinė lygtis (MU)
Fe 2+ +SO 4 2- +2Na + +2OH - Fe(OH) 2 +2Na + +SO 4 2- jonų-molekulinė lygtis (IMU).
Fe 2+ +2OH - Fe(OH) 2 (PR Fe (OH) 2 = 4,810 -16) – trumpa jonų-molekulinė nuosėdų susidarymo lygtis;
2) dujų išleidimas
Na 2 CO 3 + 2H 2 SO 4 H 2 CO 3 + 2 NaHSO 4 (MU)
2Na + +CO 3 2- + 2H + + 2HSO 4 - H 2 C0 3 + 2Na + + 2HSO 4 - (IMU)
2H + + CO 3 2- H 2 C0 3 H 2 O + C0 2 - jonai - molekulinis lygis
lakiųjų junginių susidarymas.
3) silpnų elektrolitų susidarymas
a) paprastos medžiagos:
2KCN + H 2 SO 4 2 HCN + K 2 SO 4 (MU)
2K + + 2CN - + 2H + +SO 4 2- 2HCN + 2K + + SO 4 2- (IMU)
CN - +H + HCN (K d HCN = 7,8 10 -10) – silpno elektrolito HCN jonų molekulinis susidarymo lygis.
b) sudėtingi junginiai:
ZnCl 2 + 4NH 3 Cl 2 (MU)
Zn 2+ + 2Cl - +4NH3 2+ + 2Cl - -(IMU)
Zn 2+ +4NH 3 2+ - trumpa joninė-molekulinė lygtis sudėtingo katijono susidarymui.
Yra procesų, kuriuose silpni elektrolitai arba blogai tirpūs junginiai yra tarp pradinių medžiagų ir reakcijos produktų. Šiuo atveju pusiausvyra pasislenka į mažiausią disociacijos konstantą turinčių medžiagų susidarymą arba į mažiau tirpios medžiagos susidarymą:
A) NH 4 OH + HCl NH 4 Cl + H 2 O (MU)
NH 4 OH + H + + Cl - NH 4 + + Cl - + H 2 O
NH 4 OH + H + NH 4 + + H 2 O (IMU)
K d ( NH 4 OH) =1,8 10 -5 > K d ( H 2 O) =1,810 -16.
Pusiausvyra pasislenka vandens molekulių susidarymo link.
B) AgCl + NaI AgI + NaCl (MU)
AgCl + Na + +I - AgI+ Na + +Cl -
AgCl + I – AgI + Cl – (IMU)
KT AgCl =1,7810 -10 > KT AgI =8,310 -17.
Pusiausvyra pasislenka link AgI nuosėdų susidarymo.
C) Gali būti procesų, kurių lygtyse yra ir blogai tirpus junginys, ir silpnas elektrolitas
MnS + 2HCl MnCl2 + H 2S (MU)
MnS + 2H + +2Cl - Mn 2+ + 2Cl - + H 2 S
MnS + 2 H + Mn 2+ + H 2 S (IMU)
PR MnS =2,510 -10 ; =  =1,58,10 -5 mol/l
=1,58,10 -5 mol/l
K d H 2 S = K 1 K 2 = 610 -22; =  =5.4.10 -8 mol/l
=5.4.10 -8 mol/l
S 2- jonų prisijungimas prie H 2 S molekulių vyksta pilniau nei MnS, todėl reakcija vyksta į priekį, link H 2 S susidarymo.
Druskų hidrolizė
Hidrolizė yra druskos jonų poliarizacijos sąveikos su jų hidratacijos apvalkalu rezultatas. Hidrolizė yra vandens molekulių ir druskos jonų mainų reakcija tirpale. Dėl hidrolizės dėl silpno elektrolito (silpnos rūgšties arba silpnos bazės) susidarymo jonų pusiausvyra H 2 O⇄H + + OH - pakinta dėl H + arba OH jungimosi - ir pH aplinka. . Druskos, kuriose yra silpnų rūgščių arba silpnų bazių jonų, hidrolizuojamos. Druskos, sudarytos iš stiprios rūgšties ir stiprios bazės jonų, nehidrolizuojamos (NaCl, Na 2 SO 4). Hidrolizės produktais gali būti silpni elektrolitai, blogai disocijuojančios, mažai tirpios ir lakios medžiagos. Hidrolizė yra laipsniška reakcija; daugkartinio krūvio jonų atveju žingsnių skaičius yra lygus jo krūviui. Hidrolizė pagal katijonas paveikiamos druskos, susidarančios stiprių rūgščių anijonų ir silpnų bazinių katijonų. Pavyzdžiui, silpnos bazės apima hidroksidus p- Ir d-metalai (K d 10 -4), taip pat amonio hidroksidas.
Cinko chloridas yra druska, susidaranti iš silpnos bazės Zn(OH) 2 ir stiprios rūgšties HCl. Cinko katijono krūvis yra 2+, todėl hidrolizė vyks dviem etapais:
Zn 2+ + HOH ↔ ZnOH + + H + I pakopa
ZnOH + +HOH↔ Zn(OH) 2 +H + II pakopa
Dėl šios sąveikos atsiranda H + jonų perteklius ([H + ] [OH - ]), tirpalas parūgštinamas (pH<7).
Hidrolizė pagal anijonas. Šio tipo hidrolizė būdinga druskoms, kurias sudaro silpnos rūgšties anijonai (K d 10 -3) ir stiprios bazės katijonai (K d >10 -3). Panagrinėkime kalio karbonato – druskos, susidarančios silpnos anglies rūgšties H 2 CO 3 (K d I) hidrolizę. = 4,5. 10 -7) ir stiprios bazės KOH, karbokso anijonas turi krūvį (2-). Hidrolizė vyksta dviem etapais:
CO 3 2- +H 2 O↔HCO 3 - +OH - I etapas
HCO 3 - +H 2 O↔H 2 CO 3 +OH - II etapas
Tokiu atveju išsiskiria OH - jonai ([H + ] [OH - ]) - tirpalas tampa šarminis (pH > 7).
Negrįžtama hidrolizė. Silpnos bazės ir silpnos rūgšties susidarančios druskos hidrolizuojasi ties katijonu ir anijonu. Hidrolizės rezultatas priklausys nuo vertės Į d bazes ir rūgštis. Panagrinėkime amonio fluorido, druskos, susidarančios iš silpnos, hidrolizę
bazės NH4OH (K d = 1,8 . 10 -5) ir silpnos rūgšties HF (K d = 6,8 . 10 -4):
NH 4 F + HOH NH 4 OH + HF
Šiuo atveju K d ( NH 4 OH) K d ( HF), todėl hidrolizė (daugiausia) vyks palei katijoną ir terpės reakcija bus šiek tiek rūgšti.
Keitimosi reakcijos tarp elektrolitų tirpalų
Reakcijos, dėl kurių susidaro nuosėdos. Į vieną mėgintuvėlį supilkite 3-4 ml vario (I) sulfato tirpalo, į antrąjį – tiek pat kalcio chlorido tirpalo, į trečią – aliuminio sulfato. Į pirmąjį mėgintuvėlį įpilkite šiek tiek natrio hidroksido tirpalo, į antrąjį – natrio ortofosfato, o į trečiąjį – bario nitrato tirpalą. Visuose mėgintuvėliuose susidaro nuosėdos.
Pratimas. Parašykite reakcijų lygtis molekuline, jonine ir sutrumpintai jonine forma. Paaiškinkite, kodėl susidarė krituliai. Kokių dar medžiagų tirpalus galima pilti į mėgintuvėlius, kad susidarytų nuosėdos? Parašykite šių reakcijų lygtis molekuline, jonine ir sutrumpintai jonine forma.
Reakcijos, kurių metu išsiskiria dujos. Į vieną mėgintuvėlį supilkite 3-4 ml natrio sulfito tirpalo, o į antrąjį – tiek pat natrio karbonato tirpalo. Į kiekvieną iš jų įpilkite tiek pat sieros rūgšties. Pirmajame mėgintuvėlyje išskiriamos aštraus kvapo dujos, antrame mėgintuvėlyje – bekvapės dujos.
Pratimas. Parašykite lygtis reakcijų, vykstančių molekuline, jonine ir sutrumpintai jonine forma. Pagalvokite, kokias kitas rūgštis galima naudoti šiems tirpalams, kad gautumėte panašius rezultatus. Parašykite šių reakcijų lygtis molekuline, jonine ir sutrumpintai jonine forma.
Reakcijos, atsirandančios susidarant šiek tiek besiskiriančiai medžiagai. Į vieną mėgintuvėlį įpilkite 3-4 ml natrio hidroksido tirpalo ir įlašinkite du ar tris lašus fenolftaleino. Tirpalas įgauna tamsiai raudoną spalvą. Tada įpilkite druskos arba sieros rūgšties, kol spalva pasikeis.
Į kitą mėgintuvėlį įpilkite apie 10 ml vario(II) sulfato ir įpilkite šiek tiek natrio hidroksido tirpalo. Susidaro mėlynos vario(II) hidroksido nuosėdos. Į mėgintuvėlį įpilkite sieros rūgšties, kol nuosėdos ištirps.
Pratimas. Parašykite lygtis reakcijų, vykstančių molekuline, jonine ir sutrumpintai jonine forma. Paaiškinkite, kodėl pirmame mėgintuvėlyje pasikeitė spalva, o antrajame – nuosėdos ištirpo. Kokias bendras savybes turi tirpios ir netirpios bazės?
Kokybinė reakcija į chlorido joną. Į vieną mėgintuvėlį supilkite 1-2 ml praskiestos druskos rūgšties, į antrą – tiek pat natrio chlorido tirpalo, į trečią – kalcio chlorido tirpalo. Į visus mėgintuvėlius įlašinkite kelis lašus sidabro(I) nitrato tirpalo AgNO3. Patikrinkite, ar nuosėdos ištirpsta koncentruotoje azoto rūgštyje.
Pratimas. Parašykite atitinkamų cheminių reakcijų lygtis molekuline, jonine ir sutrumpintai jonine forma. Pagalvokite, kaip galite atskirti: a) druskos rūgštį nuo kitų rūgščių; b) kitų druskų chloridai; c) chloridų tirpalai iš druskos rūgšties. Kodėl taip pat galite naudoti švino (II) nitrato tirpalą, o ne sidabro (I) nitrato tirpalą?
Pamokoje bus nagrinėjamos jonų mainų reakcijų sąlygos. Siekdami geriau suprasti, kokių sąlygų reikia laikytis, kad jonų mainų reakcijos vyktų iki galo, apžvelgsime, kas yra šios reakcijos ir jų esmė. Pateikiami pavyzdžiai šioms sąvokoms sustiprinti.
Tema: Cheminis ryšys. Elektrolitinė disociacija
Pamoka: Srauto sąlygosjonų mainų reakcijos iki pabaigos
Jei bandysite sureaguoti natrio hidroksidą su kalio chloridu, reakcija neįvyks. Reakcijoje jonai keičiasi, tačiau produktai nesusidaro. Pažvelkime į to priežastis. Medžiagos, susidarančios dėl abipusio traukos, gali atsiskirti.
1. Jonų mainų reakcijos, dėl kurių susidaro nuosėdos.
Anksčiau buvo svarstomos reakcijos lygtys, dėl kurių susidarė nuosėdos.
Visos šios reakcijos priklausė jonų mainų reakcijoms. Galima daryti išvadą, kad viena iš sąlygų, kad jonų mainų reakcija vyktų iki galo, yra nuosėdų susidarymas.
BaCl 2 + Na 2 CO 3 → BaCO 3 ↓ + 2NaCl.
Ba 2+ +2Cl - + 2Na + + CO 3 2- →BaCO 3 ↓ + 2Na + +2Cl - visa joninė lygtis
Ba 2+ + CO 3 2- → BaCO 3 ↓ sutrumpinta joninė lygtis.
Parašykime kitą reakcijos lygtį, dėl kurios susidaro nuosėdos.
CuSO 4 + 2NaOH → Cu(OH) 2 ↓ + Na 2 SO 4
Cu 2+ + SO 4 2- +2Na + + 2OH - → Cu(OH) 2 ↓ + 2Na + + SO 4 2- pilna joninė lygtis
Cu 2+ + 2OH - → Cu(OH) 2 ↓ sutrumpinta joninė lygtis.
Išvada: Jonų mainų reakcijos baigiasi, jei susidaro nuosėdos.
Ryžiai. 1. Neutralizavimo reakcija ()
Apsvarstykite natrio hidroksido neutralizavimo reakciją su druskos rūgštimi.
NaOH + HCl → NaCl+ H 2 O
Na + + OH - + H + + Cl - →Na + + Cl - + H 2 O visa joninė lygtis
OH - + H + → H 2 O redukuota joninė lygtis
Ši reakcija vyksta iki galo, nes rezultatas yra šiek tiek disocijuojanti medžiaga - vanduo.
Išvada: Jonų mainų reakcijos baigiasi, jei susidaro šiek tiek disocijuojanti medžiaga.
Jūs žinote, kad kalcio karbonatas gerai reaguoja su druskos rūgštimi.
CaCO 3 +2HCl → CaCl 2 + H 2 O + CO 2
CaCO 3 +2H + + 2Cl - → Ca 2+ +2Cl - + H 2 O + CO 2 visa joninė lygtis
2H + + CaCO 3 → Ca 2+ + H 2 O + CO 2 sutrumpinta joninė lygtis.
Dėl šios reakcijos susidaro anglies dioksidas, kuris susidaro skaidant silpną anglies rūgštį. Atkreipkite dėmesį, kad kalcio karbonatas yra netirpi medžiaga ir neskyla į jonus. Visoje joninėje lygtyje jonais rašome tik vandenilio chloridą ir kalcio chloridą. Likusios formulės išlieka nepakitusios, nes šios medžiagos nėra veikiamos.
Išvada: Jonų mainų reakcijos baigiasi, jei susidaro dujos.
Šioje pamokoje išnagrinėjote sąlygas, kad jonų mainų reakcijos vyktų iki galo. Jonų mainų reakcijos baigiasi, jei susidaro nuosėdos, šiek tiek atsiskirianti medžiaga arba dujos.
1. Rudzitis G.E. Neorganinė ir organinė chemija. 9 klasė: vadovėlis bendrojo ugdymo įstaigoms: pagrindinis lygis / G. E. Rudzitis, F.G. Feldmanas. M.: Nušvitimas. 2009 119 p.: iliustr.
2. Popelis P.P.Chemija: 8 klasė: vadovėlis bendrojo ugdymo įstaigoms / P.P. Popelis, L.S. Krivlya. -K.: IC “Akademija”, 2008.-240 p.: iliustr.
3. Gabrielyan O.S. Chemija. 9 klasė. Vadovėlis. Leidykla: Bustard: 2001 m. 224s.
1. Nr.3,4,5 (p.22) Rudzitis G.E. Neorganinė ir organinė chemija. 9 klasė: vadovėlis bendrojo ugdymo įstaigoms: pagrindinis lygis / G. E. Rudzitis, F.G. Feldmanas. M.: Nušvitimas. 2009 119 p.: iliustr.
2. Į ką atsižvelgiate gamindami tešlą, kai į soda įpilate acto? Parašykite reakcijos lygtį.
3. Kodėl virdulyje susidaro nuosėdos? Kaip jį pašalinti? Parašykite reakcijų lygtis.
Tikslai:
- Studentai turi įgyti žinių apie jonų mainų reakcijas ir sąlygas, kuriomis jos vyksta.
- toliau lavinti medžiagų disociacijų lygčių rašymo įgūdžius;
- dirbti su tirpumo lentele;
- ugdyti loginį mąstymą atpažįstant elektrolitus ir neelektrolitus, palyginimą, stebėjimą; ugdyti praktinius įgūdžius ir gebėjimus, daryti išvadas;
- parašyti reakcijų lygtis molekuline, pilnajonine ir redukuota jonine forma.
Metodai ir metodiniai metodai: verbalinis-vaizdinis, euristinis, grupinis frontalinis laboratorinis darbas.
Įranga:
- ant mokinių stalų: H 2 SO 4, BaCl 2, Na 2 CO 3, fenolftaleinas, NaOH, 4 švirkštai, tabletė, tirpumo lentelė, lentelė, kurią reikia užpildyti.
- mokytojai: H 2 SO 4, BaCl 2, Na 2 CO 3, fenolftaleinas, NaOH, 3 mėgintuvėliai, 2 induose: soda ir druska, vanduo, acto rūgštis.
Per užsiėmimus
1. Organizacinis momentas.
2. Tikslo nustatymas.
Mokytojas. Vaikinai, įsivaizduokite, kad jūsų virtuvėje 2 vienoduose indeliuose be etikečių yra druskos ir soda. Kaip atpažinti šias dvi medžiagas jų neparagavęs?
Mokytojas. Norėdami tai išsiaiškinti, turime susipažinti su jonų mainų reakcijomis, nustatyti jų atsiradimo sąlygas, išmokti rašyti pilnas, sutrumpintas jonines lygtis. Norėdami geriau suprasti jonų mainų reakcijų mechanizmą, prisiminkime, kokios medžiagos vadinamos elektrolitais.
Studentas. Elektrolitai yra medžiagos, kurios lydaluose ir tirpaluose praleidžia elektros srovę.
Mokytojas. Kodėl tirpaluose ir lydaluose esantys elektrolitai praleidžia elektros srovę?
Studentas. Elektrolitai praleidžia elektrą, nes jonai susidaro tirpaluose ir tirpsta.
Mokytojas. Kas yra elektrolitinė disociacija?
Studentas. Elektrolitų skilimo į jonus procesas vadinamas elektrolitine disociacija.
Mokytojas. Parašykime įvairių medžiagų disociacijos lygtis. (3 mokiniai dirba su kortelėmis lentoje):
- Kortelė Nr.1. Parašykite apibendrinančias disociacijos lygtis medžiagoms: H 2 SO 4, HCl.
- Žemėlapis Nr.2. Parašykite bendrąsias medžiagų disociacijos lygtis: Na 2 CO 3, BaCl 2.
- Kortelė Nr. 3. Parašykite bendrąsias medžiagų disociacijos lygtis: NaOH, Ba(OH) 2
Mokytojas. Klasės užduotis: iš šio medžiagų sąrašo pasirinkite elektrolitus ir neelektrolitus.
KCl, CuO, CuSO 4, Cu(OH) 2, BaSO 4, K 2 SO 4. (iš lapo).
Elektrolitams parašykite suvestines disociacijos lygtis. (prie lentos).
Mokytojas. Patikrinkime užrašus lentoje.
Mokytojas. Vaikinai, pavadinkite iš kokių jonų susidaro netirpi medžiaga BaSO 4?
Studentas. Bario sulfatas susidaro iš bario jonų ir sulfato jonų.
Mokytojas. Naudodami tirpumo lentelę įvardykite medžiagas, kurių tirpaluose yra Ba 2+ jonų ir SO 4 2- ?
Studentas. Pavyzdžiui, bario chloridas ir sieros rūgštis.
Mokytojas. Užrašykime reakcijos tarp H 2 SO 4 ir BaCl 2 lygtį (mokinys prie lentos).
BaCl2 + H2SO4 = BaSO4 + 2HCl
Mokytojas. Reakcijos, vykstančios elektrolitų tirpaluose, vadinamos jonų mainų reakcijomis. Norėdami sužinoti, kokiomis sąlygomis vyksta jonų mainų reakcijos, atlikime laboratorinius darbus:
Tikslas: Susipažinti su tokių reakcijų sąlygomis. (įrašyk į sąsiuvinį)
Patirtis Nr.1. BaSO gavimas 4. (vietoj patirties galite panaudoti „virtualios Kirilo ir Metodijaus mokyklos“ 9 klasės pamokos Nr. 6 pamokos fragmentą)
Tą patį daro mokytojas prie lentos.
Mokytojas komentuoja: į BaCl 2 tirpalą įpilkite H 2 SO 4. Ką stebime?
Mokinys: Iškrito baltos nuosėdos.
Mokytojas: Užrašykime visą joninę lygtį, tam surašykime, kokie jonai buvo paimtų medžiagų tirpaluose ir kokios medžiagos susidarė.
2H 1+ + SO 4 2- + Ba 2+ +2Cl 1- - > BaSO 4v + 2H 1+ +2Cl 1-
Tai yra visa joninė lygtis.
Jei dešinę ir kairę lygties puses sumažinsime vienodais jonais, gausime sutrumpintą joninę lygtį.
SO 4 2- + Ba 2+ -> BaSO 4v
Diskusija:
Klausimai klasei:
- Kokie jonai buvo tirpale prieš reakciją?
- Kokie jonai liko tirpale po reakcijos?
- Kokia šių reakcijų esmė?
Pokalbis su klase: aptariame, kad reakcijos esmė ta, kad įvyko Ba 2+ ir SO 4 2- jonų surišimas.
Ši lygtis parodo šios reakcijos esmę.
Patirtis Nr.2. Anglies dioksido gavimas.
Mokytojas komentuoja: į Na 2 CO 3 tirpalą įpilkite H 2 SO 4 tirpalo.(1 mokinys lentoje užrašo reakciją)
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + H 2 O + CO 2
Ką mes matome?
Studentas: dujų burbuliukų išleidimas.
Mokytojas užrašo visą joninę lygtį ir sutrumpintą joninę lygtį.
2Na 1+ +CO 3 2- +2H 1+ +SO 4 2- - >2Na 1+ + SO 4 2- + H 2 O+ CO 2
CO 3 2- +2H 1+ -> H 2 O+ CO 2
Patirtis Nr.3. H 2 O susidarymas (mažai disociuojanti medžiaga).
Mokytojas komentuoja: į NaOH tirpalą įlašinkite 1-2 lašus ftaleino fenolio, tirpalas pasidaro raudonas, įpilkite H 2 SO 4. (1 mokinys lentoje užrašo reakciją)
2 NaOH + H 2 SO 4 = Na 2 SO 4 + 2 H 2 O
Ką mes matome?
Studentas. Tirpalas tapo bespalvis.
Mokytojas. Ant lentos užrašykime pilną joninę lygtį ir sutrumpintą joninę lygtį (1 mokinys).
2Na 1+ +2OH 1- +2H 1+ + SO 4 2- -> 2Na 1+ + SO 4 2- + 2H 2 O
2OH 1- +2H1+ ->2H2O
| Reakcijos sąlygos Tarp elektrolitų tirpalų (užpildo studentas). |
Jonų mainų reakcijų pavyzdžiai. |
| 1. | Na 2 CO 3 +CaCl 2 =CaCO 3 +2NaCl 2Na + + CO 3 2- +Ca 2+ + 2Cl - = CaCO 3 +2Na + + 2Cl - Ca 2+ + CO 3 2- = CaCO 3 |
| 2. | K 2 CO 3 + 2HCl = 2KCl + H 2 O + CO 2 2K + + CO 3 2- +2H + +2Cl - =2K + +2Cl - +H 2 O + CO 2 CO32- +2H+ = CO2^+H2O |
| 3. | NaOH + HNO 3 = NaNO 3 + H 2 O Na + +OH - +H + +NO 3 =Na + +NO 3 - + H 2 O H + + OH - =H 2 O |
Mokytojas: Vaikinai, atlikome jonų mainų reakcijas. Padarykite išvadą: kokiomis sąlygomis jonų mainų reakcijos baigiasi? (užpildykite pateiktas lenteles)
Studentas: Jonų mainų reakcijos baigiasi, jei dėl to susidaro nuosėdos, išsiskiria dujos ir susidaro blogai disocijuojanti medžiaga, tokia kaip vanduo.
Mokytojas: Grįžkime prie savo problemos. Pasiūlykite druskos (NaCl) ir sodos (Na 2 CO 3) atpažinimo būdą.
Studentas: Į šias medžiagas reikia pridėti rūgšties. Kuriame inde bus stebimas dujų išsiskyrimas, ten bus soda.
Medžiagos tvirtinimas:
Užduotis prie lentos: 1 Iš šio sąrašo pasirinkite reakcijas, kurios baigiasi (vienas mokinys)
NaOH+ NaCl -> NaCl+ H 2 O
AgNO 3 + NaCl ->NaNO 3 + AgCl
CuCl 2 +2NaOH ->Cu(OH) 2 +2NaCl
KNO 3 +LiCl ->KCl+LiNO 3
Duota:
Pilna joninė lygtis.
Fe 3+ +3Cl - +3Na + +3OH - = Fe(OH) 3 +3Na + +3Cl -
Atitinkamai parašykite molekulines ir sutrumpintas jonines lygtis.
Mokytojas. Apibendrinkime savo pamoką: Su kokiomis reakcijomis susipažinome pamokoje?
Studentas. Sužinojome apie jonų mainų reakcijas.
Mokytojas. Kokiomis sąlygomis šios reakcijos gali baigtis?
Studentas. Jonų mainų reakcijos baigiasi, jei susidaro nuosėdos, išsiskiria dujos ir susidaro šiek tiek disocijuojanti medžiaga.
Mokytojas. Namų darbas: §37 pratimas. 4, 5.
Literatūra.
- Gabrielyan O.S. Chemija. 8 klasė: Bustard, 1999 m.
- “Virtuali Kirilo ir Metodijaus mokykla” Chemijos pamokos 8-9 kl., 2004 m.
Siūlomoje medžiagoje pateikiami 9 klasei skirtų praktinių darbų metodiniai tobulėjimai: „Eksperimentinių uždavinių sprendimas temoje „Azotas ir fosforas“, „Mineralinių trąšų nustatymas“, taip pat laboratoriniai eksperimentai tema „Maitinimosi reakcijos tarp elektrolitų tirpalų“.
Keitimosi reakcijos tarp elektrolitų tirpalų
Metodinis tobulinimas susideda iš trijų dalių: teorijos, dirbtuvių, kontrolės. Teorinėje dalyje pateikiami keli molekulinių, pilnųjų ir sutrumpintų joninių cheminių reakcijų lygčių pavyzdžiai, atsirandantys susidarant nuosėdoms, šiek tiek disociuojančiai medžiagai ir išsiskiriant dujoms. Praktinėje dalyje pateikiamos užduotys ir rekomendacijos studentams, kaip atlikti laboratorinius eksperimentus. Kontrolę sudaro testinės užduotys su teisingo atsakymo pasirinkimu.
teorija
1. Reakcijos, dėl kurių susidaro nuosėdos.
a) Vario(II) sulfatui reaguojant su natrio hidroksidu susidaro mėlynos vario(II) hidroksido nuosėdos.
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4.
Cu 2+ + + 2Na + + 2OH – = Cu(OH) 2 + 2Na + +,
Cu 2+ + 2OH – = Cu(OH) 2.
b) Bario chloridui reaguojant su natrio sulfatu, nusėda baltos pieniškos bario sulfato nuosėdos.
Cheminės reakcijos molekulinė lygtis:
BaCl 2 + Na 2 SO 4 = 2NaCl + BaSO 4.
Pilnos ir sutrumpintos joninės reakcijos lygtys:
Ba 2+ + 2Cl – + 2Na + + = 2Na + + 2Cl – + BaSO 4,
Ba 2+ + = BaSO 4 .
2.
Kai natrio karbonatas arba bikarbonatas (kepimo soda) sąveikauja su druskos ar kita tirpia rūgštimi, stebimas verdantis arba intensyvus dujų burbuliukų išsiskyrimas. Dėl to išsiskiria anglies dioksidas CO 2, todėl skaidraus kalkių vandens (kalcio hidroksido) tirpalas tampa drumstas. Kalkių vanduo tampa drumstas, nes... susidaro netirpus kalcio karbonatas.
a) Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2;
b) NaHCO 3 + HCl = NaCl + CO 2 + H 2 O;
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O.
a) 2Na + + + 2H + + 2Cl – = 2Na + + 2Cl – + CO 2 + H 2 O,
2H+ = CO2 + H2O;
b) Na + + + H + + Cl – = Na + + Cl – + CO 2 + H 2 O,
H + = CO 2 + H 2 O.
3. Reakcijos, atsirandančios susidarant šiek tiek besiskiriančiai medžiagai.
Natrio arba kalio hidroksidui reaguojant su druskos rūgštimi ar kitomis tirpiomis rūgštimis, esant fenolftaleino indikatoriui, šarmo tirpalas tampa bespalvis, o dėl neutralizacijos reakcijos susidaro mažai disocijuojanti medžiaga H 2 O.
Cheminių reakcijų molekulinės lygtys:
a) NaOH + HCl = NaCl + H2O;
c) 3KOH + H3PO4 = K3PO4 + 3H2O.
Pilnos ir sutrumpintos joninės reakcijos lygtys:
a) Na + + OH – + H + + Cl – = Na + + Cl – + H 2 O,
OH – + H + = H2O;
b) 2Na + + 2OH – + 2H + + = 2Na + + + 2H 2O,
2OH – + 2H+ = 2H2O;
c) 3K + + 3OH – +3H + + = 3K + + + 3H 2O,
3OH – + 3H+ = 3H2O.
Seminaras
1. Keičiasi elektrolitų tirpalų reakcijos, dėl kurių susidaro nuosėdos.
a) Atlikite vario(II) sulfato ir natrio hidroksido tirpalų reakciją. Parašykite molekulines, pilnąsias ir sutrumpintas cheminių reakcijų jonines lygtis, atkreipkite dėmesį į cheminės reakcijos požymius.
b) Atlikite bario chlorido ir natrio sulfato tirpalų reakciją. Parašykite molekulines, pilnąsias ir sutrumpintas cheminių reakcijų jonines lygtis, atkreipkite dėmesį į cheminės reakcijos požymius.
2. Reakcijos, kurių metu išsiskiria dujos.
Atlikite reakcijas tarp natrio karbonato arba natrio bikarbonato (kepimo sodos) tirpalų su druskos ar kita tirpia rūgštimi. Išsiskyrusias dujas perleiskite (naudojant dujų išleidimo vamzdelį) per skaidrų kalkių vandenį, supiltą į kitą mėgintuvėlį, kol jis taps drumstas. Parašykite molekulines, pilnąsias ir sutrumpintas cheminių reakcijų jonines lygtis, atkreipkite dėmesį į šių reakcijų požymius.
3. Reakcijos, atsirandančios susidarant šiek tiek besiskiriančiai medžiagai.
Atlikite neutralizacijos reakcijas tarp šarmo (NaOH arba KOH) ir rūgšties (HCl, HNO 3 arba H 2 SO 4), įdėjus fenolftaleino į šarmo tirpalą. Užsirašykite pastebėjimus ir parašykite molekulines, pilnas ir sutrumpintas cheminių reakcijų jonines lygtis.
Ženklai, lydinčius šias reakcijas, galima pasirinkti iš šio sąrašo:
1) dujų burbuliukų išleidimas; 2) nusėdimas; 3) kvapo atsiradimas; 4) nuosėdų ištirpimas; 5) šilumos išsiskyrimas; 6) tirpalo spalvos pasikeitimas.
Kontrolė (bandymas)
1. Reakcijos, kurios metu susidaro mėlynos nuosėdos, joninė lygtis yra tokia:
a) Cu 2+ + 2OH – = Cu(OH) 2;
c) Fe 3+ + 3OH – = Fe(OH) 3;
d) Al 3+ + 3OH – = Al(OH) 3.
2. Reakcijos, kurios metu išsiskiria anglies dioksidas, joninė lygtis yra tokia:
a) CaCO 3 + CO 2 + H 2 O = Ca 2+ +;
b) 2H + + SO2-3 = H2O + SO2;
c) CO2-3 + 2H+ = CO2 + H2O;
d) 2H + + 2OH – = 2H 2 O.
3. Reakcijos, kurios metu susidaro mažai disociuojanti medžiaga, joninė lygtis yra tokia:
a) Ag + + Cl – = AgCl;
b) OH – + H + = H2O;
c) Zn + 2H+ = Zn2+ + H2;
d) Fe 3+ + 3OH – = Fe(OH) 3.
4. Reakcijos, dėl kurios susidaro baltos nuosėdos, joninė lygtis yra tokia:
a) Cu 2+ + 2OH – = Cu(OH) 2;
b) CuO + 2H+ = Cu 2+ + H2O;
c) Fe 3+ + 3OH – = Fe(OH) 3;
d) Ba 2+ + SO 2- 4 = BaSO 4 .
5. Molekulinė lygtis, atitinkanti reakcijos 3OH – + 3H + = 3H 2 O sutrumpintą joninę lygtį, yra:
a) NaOH + HCl = NaCl + H2O;
b) 2NaOH + H2SO4 = Na2SO4 + 2H2O;
c) 3KOH + H3PO4 = K3PO4 + 3H2O;
d) Ba(OH) 2 + 2HCl = BaCl 2 + H 2 O.
6. Molekulinė lygtis, atitinkanti sutrumpintą joninės reakcijos lygtį
H + + = H 2 O + CO 2, –
a) MgCO 3 + 2HCl = MgCl 2 + CO 2 + H 2 O;
b) Na2CO3 + 2HCl = 2NaCl + CO2 + H2O;
c) NaHCO 3 + HCl = NaCl + CO 2 + H 2 O;
d) Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O.
| Atsakymai. 1 -A; 2 -V; 3 -b; 4 -G; 5 -V; 6 -V. |
Eksperimentinių uždavinių sprendimas tema „Azotas ir fosforas“
Studijuodami naują medžiagą tema „Azotas ir fosforas“, studentai atlieka eilę eksperimentų, susijusių su amoniako gamyba, nitratų, fosfatų, amonio druskų nustatymu, įgyja tam tikrų įgūdžių ir gebėjimų. Šį metodinį tobulinimą sudaro šešios užduotys. Praktiniam darbui atlikti pakanka trijų užduočių: vienos apie medžiagos gavimą, dviejų apie medžiagų atpažinimą. Atliekant praktinius darbus, studentams gali būti pasiūlytos tokios formos užduotys, kurios palengvins ataskaitos rengimą (žr. 1, 2 užduotis). (Atsakymai pateikiami mokytojui.)
1 pratimas
Gaukite amoniako ir eksperimentiškai įrodykite jo buvimą.
a) Amoniako gamyba.
Vienodų tūrių kieto amonio chlorido ir kalcio hidroksido miltelių mišinį pašildykite mėgintuvėlyje su dujų išleidimo vamzdeliu. Tokiu atveju išsiskirs amoniakas, kuris turi būti surinktas į kitą sausą mėgintuvėlį su skylute ............ ( Kodėl?).
Parašykite amoniako gamybos reakcijos lygtį.
…………………………………………………..
b) Amoniako nustatymas.
Galima atpažinti pagal kvapą……… (medžiagos pavadinimas), taip pat dėl lakmuso ar fenolftaleino spalvos pokyčių. Kai amoniakas ištirpsta vandenyje, susidaro ....... (bazės pavadinimas), taigi lakmuso popierėlis...... (nurodykite spalvą), o bespalvis fenolftaleinas tampa …………. (nurodykite spalvą).
Vietoj taškų įterpkite žodžius pagal jų reikšmę. Parašykite reakcijos lygtį.
…………………………………………………..


* Amoniakas, vandeninis amoniako tirpalas, kvepia amoniaku. – Pastaba red.
2 užduotis
Ruoškite vario nitratą dviem skirtingais būdais, turėdami šias medžiagas: koncentruotą azoto rūgštį, vario drožles, vario (II) sulfatą, natrio hidroksidą. Parašykite cheminių reakcijų lygtis molekuline forma ir atkreipkite dėmesį į pokyčius. 1 metodu redokso reakcijai parašykite elektronų balanso lygtis, nustatykite oksidatorių ir reduktorius. 2 metodu parašykite sutrumpintas joninių reakcijų lygtis.
1-oji s p o s o b. Varis + azoto rūgštis. Lengvai pašildykite mėgintuvėlio turinį. Bespalvis tirpalas tampa... (nurodykite spalvą), nes yra suformuotas….. (medžiagos pavadinimas); išsiskiria nemalonaus kvapo spalvos…………. (medžiagos pavadinimas).
2-oji s p o s o b. Kai vario(II) sulfatas reaguoja su natrio hidroksidu, susidaro ..... spalvos nuosėdos, tai yra ...... (medžiagos pavadinimas). Įpilkite azoto rūgšties, kol nuosėdos visiškai ištirps...... (nuosėdų pavadinimas). Susidaro skaidrus mėlynas tirpalas...... (druskos pavadinimas).


3 užduotis
Eksperimentiškai įrodykite, kad amonio sulfate yra NH 4 + ir SO 2- 4 jonų. Atkreipkite dėmesį į pastebėjimus ir parašykite reakcijų molekulines ir sutrumpintas jonines lygtis.


4 užduotis
Kaip eksperimentiškai nustatyti natrio ortofosfato, natrio chlorido, natrio nitrato tirpalų buvimą mėgintuvėliuose Nr.1, Nr.2, Nr.3? Atkreipkite dėmesį į pastebėjimus ir parašykite reakcijų molekulines ir sutrumpintas jonines lygtis.

5 užduotis
Turėdami šias medžiagas: azoto rūgštį, vario drožles ar vielą, universalų indikatorinį popierių arba metilo apelsiną, eksperimentiškai įrodykite azoto rūgšties sudėtį. Parašykite azoto rūgšties disociacijos lygtį; Vario reakcijos su koncentruota azoto rūgštimi molekulinė lygtis ir elektronų balanso lygtys, identifikuokite oksidatorių ir reduktorius.

6 užduotis
Vario nitrato tirpalą ruoškite įvairiais būdais, naudodami medžiagas: azoto rūgštį, vario oksidą, bazinį vario karbonatą arba hidroksivario(II) karbonatą. Parašykite molekulines, pilnas ir sutrumpintas jonines cheminių reakcijų lygtis. Atkreipkite dėmesį į cheminių reakcijų požymius.


Lyginamieji testai
1. Pateikite reakcijos lygtį, kurioje susidaro geltonos nuosėdos.

2. Reakcijos, kurios metu susidaro baltos sūrio nuosėdos, joninė lygtis yra tokia:

3. Norėdami įrodyti nitratų jonų buvimą nitratuose, turite imtis:
a) druskos rūgštis ir cinkas;
b) sieros rūgštis ir natrio chloridas;
c) sieros rūgštis ir varis.
4. Chlorido jonų reagentas yra:
a) vario ir sieros rūgšties;
b) sidabro nitratas;
c) bario chloridas.
5. Reakcijos lygtyje, kurios diagramoje
HNO 3 + Cu -> Cu(NO 3) 2 + NO 2 + H 2 O,
Prieš oksidatorių reikia nurodyti koeficientą:
a) 2; b) 4; 6 val.
6. Bazinės ir rūgštinės druskos atitinka poras:
a) Cu(OH)2, Mg(HCO3)2;
b) Cu(NO 3) 2, HNO 3;
c) 2 CO 3, Ca(HCO 3) 2.
|
Atsakymai. 1 -A; 2 -b; 3 -V; 4 -b; 5 -b; 6 -V. |
Mineralinių trąšų nustatymas
Šio praktinio darbo metodinė plėtra susideda iš trijų dalių: teorijos, dirbtuvės, kontrolės. Teorinėje dalyje pateikiama bendra informacija apie katijonų ir anijonų, esančių mineralinėse trąšose, kokybinį nustatymą. Seminare pateikiami septynių mineralinių trąšų pavyzdžiai su būdingų savybių aprašymu, taip pat pateikiamos kokybinių reakcijų lygtys. Tekste vietoj taškų ir klaustukų reikia įterpti prasmę atitinkančius atsakymus. Praktiniam darbui atlikti mokytojo nuožiūra pakanka paimti keturias trąšas. Mokinių žinių patikrinimą sudaro bandymo užduotys trąšų formulėms nustatyti, kurios pateikiamos šiame praktiniame darbe.
teorija
1. Chlorido jonų reagentas yra sidabro nitratas. Reakcija vyksta susidarius baltoms sūrio nuosėdoms:
Ag + + Cl – = AgCl.
2. Amonio jonus galima aptikti naudojant šarmą. Kaitinant amonio druskos tirpalą šarminiu tirpalu, išsiskiria amoniakas, turintis aštrų būdingą kvapą:
NH + 4 + OH – = NH 3 + H 2 O.
Amonio jonui nustatyti taip pat galite naudoti raudoną lakmuso popierių, suvilgytą vandeniu, universalų indikatorių arba fenolftaleino popieriaus juostelę. Popieriaus gabalas turi būti laikomas virš garų, išsiskiriančių iš mėgintuvėlio. Raudonas lakmusas tampa mėlynas, universalus indikatorius tampa purpurinis, o fenolftaleinas - tamsiai raudonas.
3. Nitratų jonams nustatyti į druskos tirpalą dedama vario drožlių ar gabalėlių, po to įpilama koncentruotos sieros rūgšties ir kaitinama. Po kurio laiko pradeda išsiskirti rudos nemalonaus kvapo dujos. Rudųjų NO2 dujų išsiskyrimas rodo jonų buvimą.
Pavyzdžiui:
NaNO 3 + H 2 SO 4 NaHSO 4 + HNO 3,
4HNO 3 + Cu = Cu(NO 3) 2 + 2NO 2 + 2H 2 O.
4. Fosfato jonų reagentas yra sidabro nitratas. Įdėjus jo į fosfato tirpalą, iškrenta geltonos sidabro fosfato nuosėdos:
3Ag + + PO 3-4 = Ag 3 PO 4.
5. Sulfato jonų reagentas yra bario chloridas. Baltos pieniškos bario sulfato nuosėdos, netirpios acto rūgštyje, nusėda:
Ba 2+ + SO 2- 4 = BaSO 4 .
Seminaras
1. Silvinitas (NaCl KCl), rausvi kristalai, gerai tirpsta vandenyje. Liepsna pasidaro geltona. Žiūrint į liepsną per mėlyną stiklą, pastebima violetinė spalva. SU …….. (reagento pavadinimas) susidaro baltos nuosėdos.... (druskos pavadinimas).
KCl + ? -> KNO 3 + AgCl.
2. Amonio nitratas NH 4 NO 3 arba…….. (trąšų pavadinimas), balti kristalai, gerai tirpsta vandenyje. Rudos dujos išsiskiria su sieros rūgštimi ir variu... (medžiagos pavadinimas). Su sprendimu……. (reagento pavadinimas) Kaitinant jaučiamas amoniako kvapas, jo garai raudoną lakmusą paverčia....... spalva.
NH 4 NO 3 + H 2 SO 4 NH 4 HSO 4 + HNO 3,
HNO 3 + Cu -> Cu(NO 3) 2 + ? + ? .
NH 4 NO 3 + ? -> NH3 + H2O + NaNO3.
3. Kalio nitratas (KNO 3) arba…… (trąšų pavadinimas), su H2SO4 ir ……… (medžiagos pavadinimas) gamina rudas dujas. Liepsna pasidaro purpurinė.
KNO 3 + H 2 SO 4 KHSO 4 + HNO 3,
4HNO3+? -> Cu(NO 3) 2 + ? + 2H 2 O.
4. Amonio chloridas NH 4 Cl su tirpalu……. (reagento pavadinimas) Kaitinant susidaro amoniakas, jo garai pasidaro raudonai lakmuso mėlyni. SU …… (reagento anijono pavadinimas) sidabras suteikia baltų sūrių nuosėdų...... (nuosėdų pavadinimas).
NH4Cl+? = NH 4 NO 3 + AgCl,
NH4Cl+? = NH3 + H2O + NaCl.
5. Kaitinant, amonio sulfatas (NH 4) 2 SO 4 su šarmo tirpalu sudaro amoniaką, jo garai tampa raudonai lakmuso mėlyna spalva. SU …….. (reagento pavadinimas) suteikia baltų pieniškų nuosėdų...... (nuosėdų pavadinimas).
(NH 4) 2 SO 4 + 2NaOH = 2NH3 + 2H 2 O + ? ,
(NH 4) 2 SO 4 + ? -> NH 4 Cl + ? .
6. Natrio nitratas NaNO 3 arba…… (trąšų pavadinimas), balti kristalai, gerai tirpsta vandenyje, gamina rudas dujas su H 2 SO 4 ir Cu. Liepsna pagelsta.
NaNO 3 + H 2 SO 4 NaHSO 4 + ? ,
Cu -> Cu(NO 3) 2 + ? + 2H 2 O.
7. Kalcio divandenilio fosfatas Ca(H 2 PO 4) 2 arba…… (trąšų pavadinimas), pilki smulkiagrūdžiai milteliai arba granulės, blogai tirpūs vandenyje, su ..... (reagento pavadinimas) suteikia ….. (nurodykite spalvą) nuosėdas ……… (medžiagos pavadinimas) AgH 2 PO 4.
Ca(H2PO4)2+? -> 2AgH 2PO 4 + Ca(NO 3) 2.

Kontrolė (bandymas)
1. Rožiniai kristalai, gerai tirpūs vandenyje, nuspalvina liepsną geltonai; sąveikaujant su AgNO 3 susidaro baltos nuosėdos - tai:
a) Ca(H2PO4)2; b) NaCl KCl;
c) KNO 3; d) NH4Cl.
2. Kristalai gerai tirpsta vandenyje; reaguojant su H 2 SO 4 ir variu, išsiskiria rudos dujos; su šarmo tirpalu kaitinant susidaro amoniakas, kurio garai pasidaro raudonai lakmuso mėlyni - tai:
a) NaNO3; b) (NH4)2SO4;
c) NH4NO3; d) KNO 3.
3. Lengvi kristalai, gerai tirpūs vandenyje; sąveikaujant su H 2 SO 4 ir Cu, išsiskiria rudos dujos; liepsna nusidažo purpurine - tai yra:
a) KNO 3; b) NH4H2PO4;
c) Ca(H2PO4)2CaSO4; d) NH4 NO3.
4. Kristalai gerai tirpsta vandenyje; su sidabro nitratu gauna baltas nuosėdas, su šarmu kaitinant - amoniaką, kurio garai pasidaro raudonai lakmuso mėlyni - tai:
a) (NH4)2SO4; b) NH4H2PO4;
c) NaCl KCl; d) NH4Cl.
5. Lengvi kristalai, gerai tirpūs vandenyje; su BaCl 2 gauna baltas pieniškas nuosėdas, su šarmu - amoniaką, kurio garai pasidaro raudonai lakmuso mėlyni - tai yra:
c) NH4Cl; d) NH4H2PO4.
6. Lengvi kristalai, gerai tirpūs vandenyje; sąveikaudamas su H 2 SO 4 ir Cu, susidaro rudos dujos, liepsna pagelsta - tai yra:
a) NH4NO3; b) (NH4)2SO4;
c) KNO 3; d) NaNO 3.
7. Pilki smulkiagrūdžiai milteliai ar granulės, blogai tirpsta vandenyje, su sidabro nitrato tirpalu susidaro geltonos nuosėdos – tai:
a) (NH4)2SO4; b) NaCl KCl;
c) Ca(H2PO4)2; d) KNO 3.
| Atsakymai. 1 -b; 2 -V; 3 -A; 4 -G; 5 -b; 6 -G; 7 -V. |