ആൽക്കെയ്നുകളുടെ അടിസ്ഥാന രാസ ഗുണങ്ങൾ. ആൽക്കെയ്നുകൾ: ഭൗതികവും രാസപരവുമായ ഗുണങ്ങൾ, പ്രയോഗം
പൂരിത ഹൈഡ്രോകാർബണുകളുടെ രാസ ഗുണങ്ങൾ നിർണ്ണയിക്കുന്നത് അവയുടെ തന്മാത്രകളിലെ കാർബൺ, ഹൈഡ്രജൻ ആറ്റങ്ങളുടെയും $C-H$, $C-C$ ബോണ്ടുകളുടെയും സാന്നിധ്യമാണ്.
ഏറ്റവും ലളിതമായ ആൽക്കെയ്ൻ തന്മാത്രയിൽ, മീഥെയ്ൻ, കെമിക്കൽ ബോണ്ടുകൾ രൂപപ്പെടുന്നത് 8 വാലൻസ് ഇലക്ട്രോണുകളാണ് (കാർബൺ ആറ്റത്തിൽ നിന്നുള്ള 4 ഇലക്ട്രോണുകളും ഹൈഡ്രജൻ ആറ്റങ്ങളിൽ നിന്ന് 4 ഇലക്ട്രോണുകളും), അവ നാല് ബോണ്ടിംഗ് മോളിക്യുലാർ ഓർബിറ്റലുകളിൽ സ്ഥിതിചെയ്യുന്നു.
അതിനാൽ, ഒരു മീഥേൻ തന്മാത്രയിൽ, കാർബൺ ആറ്റത്തിൻ്റെ നാല് $sp3$-ഹൈബ്രിഡൈസ്ഡ് ഓർബിറ്റലുകളിൽ നിന്നും നാല് ഹൈഡ്രജൻ ആറ്റങ്ങളുടെ s-ഓർബിറ്റലുകളിൽ നിന്നും നാല് $sp3-s (C-H)$ കോവാലൻ്റ് ബോണ്ടുകൾ രൂപപ്പെടുന്നു (ചിത്രം 1).
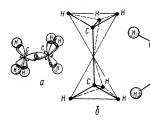
രണ്ട് കാർബൺ ടെട്രാഹെഡ്രയിൽ നിന്നാണ് ഈഥെയ്ൻ തന്മാത്ര രൂപപ്പെടുന്നത് - ഒരു $sp3-sp3 (C-C)$ കോവാലൻ്റ് ബോണ്ടും ആറ് $sp3-s (C-H)$ കോവാലൻ്റ് ബോണ്ടുകളും (ചിത്രം 2).

ചിത്രം 2. ഈഥെയ്ൻ തന്മാത്രയുടെ ഘടന: a - തന്മാത്രയിൽ $\sigma $ ബോണ്ടുകളുടെ സ്ഥാനം; b - തന്മാത്രയുടെ ടെട്രാഹെഡ്രൽ മോഡൽ; c - തന്മാത്രയുടെ ബോൾ-ആൻഡ്-സ്റ്റിക്ക് മോഡൽ; d - Stewart - Briegleb അനുസരിച്ച് ഒരു തന്മാത്രയുടെ സ്കെയിൽ മോഡൽ
ആൽക്കെയ്നുകളിലെ കെമിക്കൽ ബോണ്ടുകളുടെ സവിശേഷതകൾ
പരിഗണിക്കപ്പെടുന്ന കോവാലൻ്റ് ബോണ്ടുകളുടെ തരങ്ങളിൽ, ഏറ്റവും വലിയ ഇലക്ട്രോൺ സാന്ദ്രതയുള്ള പ്രദേശങ്ങൾ ആറ്റോമിക് ന്യൂക്ലിയസുകളെ ബന്ധിപ്പിക്കുന്ന രേഖയിലാണ് സ്ഥിതി ചെയ്യുന്നത്. ഈ കോവാലൻ്റ് ബോണ്ടുകൾ പ്രാദേശികവൽക്കരിച്ച $\sigma $-$(\rm M)$$(\rm O)$ വഴി രൂപപ്പെട്ടതാണ്, അവയെ $\sigma $ ബോണ്ടുകൾ എന്ന് വിളിക്കുന്നു. ഈ ബോണ്ടുകളുടെ ഒരു പ്രധാന സവിശേഷത, അവയിലെ ഇലക്ട്രോൺ സാന്ദ്രത ആറ്റോമിക് ന്യൂക്ലിയസിലൂടെ കടന്നുപോകുന്ന അക്ഷവുമായി (ഇലക്ട്രോൺ സാന്ദ്രതയുടെ സിലിണ്ടർ സമമിതി) ആപേക്ഷികമായി സമമിതിയായി വിതരണം ചെയ്യപ്പെടുന്നു എന്നതാണ്. ഇതിന് നന്ദി, ഈ ബോണ്ട് വഴി ബന്ധിപ്പിച്ചിരിക്കുന്ന ആറ്റങ്ങൾ അല്ലെങ്കിൽ ആറ്റങ്ങളുടെ ഗ്രൂപ്പുകൾക്ക് ബോണ്ടിൻ്റെ രൂപഭേദം വരുത്താതെ സ്വതന്ത്രമായി കറങ്ങാൻ കഴിയും. ആൽക്കെയ്ൻ തന്മാത്രകളിലെ കാർബൺ ആറ്റങ്ങളുടെ വാലൻസിയുടെ ദിശകൾ തമ്മിലുള്ള കോൺ $109^\circ 28"$ ആണ്. അതിനാൽ, ഈ പദാർത്ഥങ്ങളുടെ തന്മാത്രകളിൽ, നേരായ കാർബൺ ശൃംഖലയിൽ പോലും, കാർബൺ ആറ്റങ്ങൾ യഥാർത്ഥത്തിൽ ഒരു നേർരേഖയിലല്ല സ്ഥിതി ചെയ്യുന്നത്. ഈ ശൃംഖലയ്ക്ക് ഒരു സിഗ്സാഗ് ആകൃതിയുണ്ട്, അത് ആറ്റങ്ങളുടെ കാർബണിൻ്റെ (ചിത്രം 3) ഇടവേള കോണുകളുടെ സംരക്ഷണവുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു.

ചിത്രം 3. ഒരു സാധാരണ ആൽക്കെയ്നിൻ്റെ കാർബൺ ശൃംഖലയുടെ ഘടനയുടെ സ്കീം
ആവശ്യത്തിന് നീളമുള്ള കാർബൺ ശൃംഖലയുള്ള ആൽക്കെയ്ൻ തന്മാത്രകളിൽ, പരസ്പരം ബന്ധിതമല്ലാത്ത കാർബൺ ആറ്റങ്ങളുടെ വികർഷണം കാരണം ഈ കോണിൽ $2^\circ$ വർദ്ധിക്കുന്നു.
കുറിപ്പ് 1
ഓരോ കെമിക്കൽ ബോണ്ടിനും ഒരു നിശ്ചിത ഊർജ്ജം ഉണ്ട്. ഒരു മീഥേൻ തന്മാത്രയിലെ $C-H$ ബോണ്ട് ഊർജ്ജം 422.9 kJ/mol ഉം ഈഥെയ്ൻ - 401.9 kJ/mol ഉം മറ്റ് ആൽക്കെയ്നുകൾ - ഏകദേശം 419 kJ/mol ഉം ആണെന്ന് പരീക്ഷണാടിസ്ഥാനത്തിൽ സ്ഥാപിക്കപ്പെട്ടു. $C-C$ ബോണ്ട് ഊർജ്ജം 350 kJ/mol ആണ്.
ആൽക്കെയ്നുകളുടെ ഘടനയും അവയുടെ പ്രതിപ്രവർത്തനവും തമ്മിലുള്ള ബന്ധം
$C-C$, $C-H$ ബോണ്ടുകളുടെ ഉയർന്ന ഊർജ്ജം ഊഷ്മാവിൽ പൂരിത ഹൈഡ്രോകാർബണുകളുടെ കുറഞ്ഞ പ്രതിപ്രവർത്തനം നിർണ്ണയിക്കുന്നു. അതിനാൽ, ആൽക്കെയ്നുകൾ ബ്രോമിൻ ജലം, പൊട്ടാസ്യം പെർമാങ്കനേറ്റ് ലായനി, അയോണിക് റിയാക്ടറുകളുമായി (ആസിഡുകൾ, ക്ഷാരങ്ങൾ) ഇടപഴകുന്നില്ല, കൂടാതെ ഓക്സിഡൈസിംഗ് ഏജൻ്റുമാരുമായോ സജീവ ലോഹങ്ങളുമായോ പ്രതിപ്രവർത്തിക്കുന്നില്ല. അതിനാൽ, ഉദാഹരണത്തിന്, സോഡിയം ലോഹം മണ്ണെണ്ണയിൽ സൂക്ഷിക്കാം, ഇത് പൂരിത ഹൈഡ്രോകാർബണുകളുടെ മിശ്രിതമാണ്. അനേകം ഓർഗാനിക് പദാർത്ഥങ്ങളെ സംയോജിപ്പിക്കുന്ന സാന്ദ്രീകൃത സൾഫ്യൂറിക് ആസിഡ് പോലും ഊഷ്മാവിൽ ആൽക്കെയ്നുകളെ ബാധിക്കുന്നില്ല. പൂരിത ഹൈഡ്രോകാർബണുകളുടെ താരതമ്യേന കുറഞ്ഞ പ്രതിപ്രവർത്തനം കണക്കിലെടുത്ത്, അവയെ ഒരിക്കൽ പാരഫിനുകൾ എന്ന് വിളിച്ചിരുന്നു. ആൽക്കെയ്നുകൾക്ക് ഹൈഡ്രജൻ, ഹാലൊജനുകൾ, മറ്റ് റിയാക്ടറുകൾ എന്നിവ ചേർക്കാനുള്ള കഴിവില്ല. അതിനാൽ, ഈ തരം ജൈവ പദാർത്ഥങ്ങളെ പൂരിത ഹൈഡ്രോകാർബണുകൾ എന്ന് വിളിക്കുന്നു.
$C-C$ അല്ലെങ്കിൽ $C-H$ ബോണ്ടുകളുടെ പിളർപ്പ് കാരണം പൂരിത ഹൈഡ്രോകാർബണുകളുടെ രാസപ്രവർത്തനങ്ങൾ സംഭവിക്കാം. $C-H$ ബോണ്ടുകളുടെ വിള്ളലിനൊപ്പം ഹൈഡ്രജൻ ആറ്റങ്ങളുടെ ഉന്മൂലനം അപൂരിത സംയുക്തങ്ങളുടെ രൂപീകരണത്തോടൊപ്പമുണ്ട്, അല്ലെങ്കിൽ മറ്റ് ആറ്റങ്ങൾ അല്ലെങ്കിൽ ആറ്റങ്ങളുടെ ഗ്രൂപ്പുകൾ ഉപയോഗിച്ച് ഹൈഡ്രജൻ ആറ്റങ്ങളെ ഇല്ലാതാക്കുന്നു.
ആൽക്കെയ്നിൻ്റെ ഘടനയെയും പൂരിത ഹൈഡ്രോകാർബണുകളുടെ തന്മാത്രകളിലെ പ്രതിപ്രവർത്തന സാഹചര്യങ്ങളെയും ആശ്രയിച്ച്, $C-H$ ബോണ്ട് ഹോമോളിറ്റിക്കായി തകർക്കാൻ കഴിയും:

ചിത്രം 4. ആൽക്കെയ്നുകളുടെ രാസ ഗുണങ്ങൾ
അയോണുകളുടെയും കാറ്റേഷനുകളുടെയും രൂപീകരണത്തോടുകൂടിയ ഹെറ്ററോലൈറ്റിക്:
ചിത്രം 5. ആൽക്കെയ്നുകളുടെ രാസ ഗുണങ്ങൾ
ഈ സാഹചര്യത്തിൽ, ജോടിയാക്കാത്ത ഇലക്ട്രോണുകളുള്ള ഫ്രീ റാഡിക്കലുകൾ രൂപപ്പെടാം, പക്ഷേ വൈദ്യുത ചാർജ് ഇല്ല, അല്ലെങ്കിൽ അനുബന്ധ വൈദ്യുത ചാർജുകൾ ഉള്ള കാർബോക്കേഷനുകൾ അല്ലെങ്കിൽ കാർബനിയനുകൾ. ഫ്രീ റാഡിക്കലുകൾ റാഡിക്കൽ മെക്കാനിസത്തിൻ്റെ പ്രതിപ്രവർത്തനങ്ങളിൽ ഇൻ്റർമീഡിയറ്റ് കണികകളായും അയോണിക് മെക്കാനിസത്തിൻ്റെ പ്രതിപ്രവർത്തനങ്ങളിൽ കാർബോക്കേഷനുകളും കാർബനിയനുകളും രൂപപ്പെടുന്നു.
$C-C$ ബോണ്ടുകൾ ധ്രുവീയമല്ലാത്തതും $C-H$ ബോണ്ടുകൾ ലോ-പോളാർ ആയതിനാലും ഈ $\sigma $-ബോണ്ടുകൾക്ക് കുറഞ്ഞ ധ്രുവീകരണക്ഷമതയുള്ളതിനാലും, ആൽക്കെയ്ൻ തന്മാത്രകളിലെ $\sigma $-ബോണ്ടുകളുടെ ഹെറ്ററോലൈറ്റിക് പിളർപ്പ് അയോണുകൾക്ക് ധാരാളം ഊർജ്ജം ആവശ്യമാണ്. ഈ ബോണ്ടുകളുടെ ഹീമോലിറ്റിക് പിളർപ്പിന് കുറച്ച് ഊർജ്ജം ആവശ്യമാണ്. അതിനാൽ, പൂരിത ഹൈഡ്രോകാർബണുകൾക്ക്, ഒരു റാഡിക്കൽ മെക്കാനിസം വഴി നടക്കുന്ന പ്രതിപ്രവർത്തനങ്ങൾ കൂടുതൽ സാധാരണമാണ്. $\sigma $-ബോണ്ട് $C-C$ വിഭജിക്കുന്നതിന് $C-H$ ബോണ്ടിൻ്റെ വിഭജനത്തേക്കാൾ കുറച്ച് ഊർജ്ജം ആവശ്യമാണ്, കാരണം $C-C$ ബോണ്ടിൻ്റെ ഊർജ്ജം $C-H$ ബോണ്ടിൻ്റെ ഊർജ്ജത്തേക്കാൾ കുറവാണ്. എന്നിരുന്നാലും, രാസപ്രവർത്തനങ്ങളിൽ പലപ്പോഴും $C-H$ ബോണ്ടുകളുടെ പിളർപ്പ് ഉൾപ്പെടുന്നു, കാരണം അവ റിയാക്ടറുകൾക്ക് കൂടുതൽ ആക്സസ് ചെയ്യാവുന്നതാണ്.
ആൽക്കെയ്നുകളുടെ ശാഖകളുടെയും വലുപ്പത്തിൻ്റെയും സ്വാധീനം അവയുടെ പ്രതിപ്രവർത്തനത്തിൽ
രേഖീയ ഘടനയുള്ള ആൽക്കെയ്നുകളിൽ നിന്ന് ശാഖിതമായ ഘടനയുള്ള ആൽക്കെയ്നുകളിലേക്ക് മാറുമ്പോൾ $C-H$ ബോണ്ടിൻ്റെ പ്രതിപ്രവർത്തനം മാറുന്നു. ഉദാഹരണത്തിന്, ഫ്രീ റാഡിക്കലുകളുടെ രൂപീകരണ സമയത്ത് $C-H$ ബോണ്ടിൻ്റെ (kJ/mol) ഡിസോസിയേഷൻ ഊർജ്ജം ഇനിപ്പറയുന്ന രീതിയിൽ മാറുന്നു:

ചിത്രം 6. ആൽക്കെയ്നുകളുടെ രാസ ഗുണങ്ങൾ
കൂടാതെ, ആൽക്കെയ്നുകളുടെ അയോണൈസേഷൻ എനർജിയുടെ (IE) മൂല്യം കാണിക്കുന്നത് $\sigma $-ബോണ്ടുകളുടെ ആകെ എണ്ണത്തിലെ വർദ്ധനവ് അവയുടെ ദാതാക്കളുടെ ഗുണങ്ങൾ വർദ്ധിപ്പിക്കുകയും ഉയർന്ന തന്മാത്രാ ഭാരം ഉള്ള സംയുക്തങ്ങൾക്കായി ഒരു ഇലക്ട്രോൺ നീക്കം ചെയ്യുന്നത് എളുപ്പമാക്കുകയും ചെയ്യുന്നു, ഉദാഹരണത്തിന്. :
ചിത്രം 7. ആൽക്കെയ്നുകളുടെ രാസ ഗുണങ്ങൾ
അതിനാൽ, ഫ്രീ റാഡിക്കൽ പ്രക്രിയകളിൽ, പ്രതികരണങ്ങൾ പ്രധാനമായും ത്രിതീയ കാർബൺ ആറ്റത്തിലും പിന്നീട് ദ്വിതീയത്തിലും അവസാനമായി പ്രാഥമികമായും സംഭവിക്കുന്നു, ഇത് ഫ്രീ റാഡിക്കലുകളുടെ സ്ഥിരത ശ്രേണിയുമായി പൊരുത്തപ്പെടുന്നു. എന്നിരുന്നാലും, താപനില വർദ്ധിക്കുന്നതിനനുസരിച്ച്, നിരീക്ഷിച്ച പ്രവണത കുറയുന്നു അല്ലെങ്കിൽ പൂർണ്ണമായും നിരപ്പാക്കുന്നു.
അതിനാൽ, ആൽക്കെയ്നുകൾ രണ്ട് തരം രാസപ്രവർത്തനങ്ങളാൽ സവിശേഷതയാണ്:
- ഹൈഡ്രജൻ മാറ്റിസ്ഥാപിക്കൽ, പ്രധാനമായും റാഡിക്കൽ മെക്കാനിസവും
- $C-C$ അല്ലെങ്കിൽ $C-H$ ബോണ്ടുകൾക്ക് പിന്നിലെ തന്മാത്രയുടെ പിളർപ്പ്.
ആൽക്കെയ്നുകൾ :
ആൽക്കെയ്നുകൾ പൂരിത ഹൈഡ്രോകാർബണുകളാണ്, എല്ലാ ആറ്റങ്ങളും ഒറ്റ ബോണ്ടുകളാൽ ബന്ധിപ്പിച്ചിരിക്കുന്ന തന്മാത്രകളിൽ. ഫോർമുല -
ഭൌതിക ഗുണങ്ങൾ :
- കാർബൺ നട്ടെല്ലിൻ്റെ തന്മാത്രാ ഭാരവും നീളവും അനുസരിച്ച് ഉരുകൽ, തിളപ്പിക്കൽ പോയിൻ്റുകൾ വർദ്ധിക്കുന്നു
- സാധാരണ അവസ്ഥയിൽ, CH 4 മുതൽ C 4 H 10 വരെയുള്ള ശാഖകളില്ലാത്ത ആൽക്കെയ്നുകൾ വാതകങ്ങളാണ്; C 5 H 12 മുതൽ C 13 H 28 വരെ - ദ്രാവകങ്ങൾ; C 14 H 30 ന് ശേഷം - ഖര.
- ദ്രവണാങ്കങ്ങളും തിളച്ചുമറിയുന്ന പോയിൻ്റുകളും കുറഞ്ഞ ശാഖകളിൽ നിന്ന് കൂടുതൽ ശാഖകളിലേക്ക് കുറയുന്നു. ഉദാഹരണത്തിന്, 20 ഡിഗ്രി സെൽഷ്യസിൽ n-പെൻ്റെയ്ൻ ഒരു ദ്രാവകവും നിയോപെൻ്റെയ്ൻ ഒരു വാതകവുമാണ്.
രാസ ഗുണങ്ങൾ:
· ഹാലൊജനേഷൻ
ഇത് പകരക്കാരനായ പ്രതികരണങ്ങളിൽ ഒന്നാണ്. ഏറ്റവും കുറവ് ഹൈഡ്രജനേറ്റഡ് കാർബൺ ആറ്റം ആദ്യം ഹാലൊജനേറ്റ് ചെയ്യപ്പെടുന്നു (തൃതീയ ആറ്റം, പിന്നെ ദ്വിതീയ, പ്രാഥമിക ആറ്റങ്ങൾ അവസാനമായി ഹാലൊജനേറ്റ് ചെയ്യുന്നു). ആൽക്കെയ്നുകളുടെ ഹാലൊജനേഷൻ ഘട്ടങ്ങളിലാണ് സംഭവിക്കുന്നത് - ഒരു ഘട്ടത്തിൽ ഒന്നിൽ കൂടുതൽ ഹൈഡ്രജൻ ആറ്റങ്ങൾ മാറ്റിസ്ഥാപിക്കില്ല:
- CH 4 + Cl 2 → CH 3 Cl + HCl (ക്ലോറോമീഥെയ്ൻ)
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (ഡൈക്ലോറോമീഥെയ്ൻ)
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (ട്രൈക്ലോറോമീഥെയ്ൻ)
- CHCl 3 + Cl 2 → CCL 4 + HCl (കാർബൺ ടെട്രാക്ലോറൈഡ്).
പ്രകാശത്തിൻ്റെ സ്വാധീനത്തിൽ, ഒരു ക്ലോറിൻ തന്മാത്ര റാഡിക്കലുകളായി വിഘടിക്കുന്നു, തുടർന്ന് അവ ആൽക്കെയ്ൻ തന്മാത്രകളെ ആക്രമിക്കുകയും അവയിൽ നിന്ന് ഒരു ഹൈഡ്രജൻ ആറ്റം എടുക്കുകയും ചെയ്യുന്നു, അതിൻ്റെ ഫലമായി മീഥൈൽ റാഡിക്കലുകൾ CH 3 രൂപം കൊള്ളുന്നു, അവ ക്ലോറിൻ തന്മാത്രകളുമായി കൂട്ടിയിടിച്ച് അവയെ നശിപ്പിക്കുകയും രൂപപ്പെടുകയും ചെയ്യുന്നു. പുതിയ റാഡിക്കലുകൾ.
· ജ്വലനം
പൂരിത ഹൈഡ്രോകാർബണുകളുടെ പ്രധാന രാസവസ്തു, ഇന്ധനമായി അവയുടെ ഉപയോഗം നിർണ്ണയിക്കുന്നത് ജ്വലന പ്രതികരണമാണ്. ഉദാഹരണം:
CH 4 + 2O 2 → CO 2 + 2H 2 O + ക്യു
ഓക്സിജൻ്റെ അഭാവത്തിൽ, കാർബൺ ഡൈ ഓക്സൈഡിന് പകരം കാർബൺ മോണോക്സൈഡ് അല്ലെങ്കിൽ കൽക്കരി ഉത്പാദിപ്പിക്കപ്പെടുന്നു (ഓക്സിജൻ സാന്ദ്രതയെ ആശ്രയിച്ച്).
പൊതുവേ, ആൽക്കെയ്നുകളുടെ ജ്വലന പ്രതികരണം ഇനിപ്പറയുന്ന രീതിയിൽ എഴുതാം:
കൂടെ എൻഎച്ച് 2 എൻ +2 +(1,5എൻ+0.5)O2 = എൻ CO 2 + ( എൻ+1)എച്ച് 2 ഒ
· വിഘടനം
ഉയർന്ന താപനിലയുടെ സ്വാധീനത്തിൽ മാത്രമാണ് വിഘടിപ്പിക്കൽ പ്രതികരണങ്ങൾ സംഭവിക്കുന്നത്. താപനിലയിലെ വർദ്ധനവ് കാർബൺ ബോണ്ടുകളുടെ വിള്ളലിലേക്കും ഫ്രീ റാഡിക്കലുകളുടെ രൂപീകരണത്തിലേക്കും നയിക്കുന്നു.
ഉദാഹരണങ്ങൾ:
CH 4 → C + 2H 2 (t > 1000 °C)
C 2 H 6 → 2C + 3H 2
ആൽകെൻസ് :
തന്മാത്രയിൽ അടങ്ങിയിരിക്കുന്ന അപൂരിത ഹൈഡ്രോകാർബണുകളാണ് ആൽക്കീനുകൾ, സിംഗിൾ ബോണ്ടുകൾക്ക് പുറമേ, ഒരു കാർബൺ-കാർബൺ ഡബിൾ ബോണ്ട് - C n H 2n
ഒരു ഹൈഡ്രോകാർബണിൻ്റെ ആൽക്കീനുകളുടെ വർഗ്ഗത്തിൽ പെട്ടത് അതിൻ്റെ പേരിലുള്ള ജനറിക് സഫിക്സായ -eനെ പ്രതിഫലിപ്പിക്കുന്നു.
ഭൌതിക ഗുണങ്ങൾ :
- കാർബൺ നട്ടെല്ലിൻ്റെ തന്മാത്രാ ഭാരവും നീളവും അനുസരിച്ച് ആൽക്കീനുകളുടെ (ലളിതമാക്കിയ) ഉരുകൽ, തിളപ്പിക്കൽ പോയിൻ്റുകൾ വർദ്ധിക്കുന്നു.
- സാധാരണ അവസ്ഥയിൽ, C 2 H 4 മുതൽ C 4 H 8 വരെയുള്ള ആൽക്കീനുകൾ വാതകങ്ങളാണ്; C 5 H 10 മുതൽ C 17 H 34 വരെ - ദ്രാവകങ്ങൾ, C 18 H 36 ന് ശേഷം - ഖര. ആൽക്കീനുകൾ വെള്ളത്തിൽ ലയിക്കില്ല, പക്ഷേ ജൈവ ലായകങ്ങളിൽ എളുപ്പത്തിൽ ലയിക്കുന്നു.
രാസ ഗുണങ്ങൾ :
· നിർജ്ജലീകരണംഒരു ഓർഗാനിക് സംയുക്തത്തിൻ്റെ തന്മാത്രയിൽ നിന്ന് ഒരു ജല തന്മാത്രയെ വിഭജിക്കുന്ന പ്രക്രിയയാണ്.
· പോളിമറൈസേഷൻകുറഞ്ഞ തന്മാത്രാ ഭാരം പദാർത്ഥത്തിൻ്റെ പല പ്രാരംഭ തന്മാത്രകളെയും വലിയ പോളിമർ തന്മാത്രകളാക്കി സംയോജിപ്പിക്കുന്ന ഒരു രാസ പ്രക്രിയയാണ്.
പോളിമർഒരു ഉയർന്ന തന്മാത്രാ സംയുക്തമാണ്, അതിൻ്റെ തന്മാത്രകൾ സമാനമായ നിരവധി ഘടനാപരമായ യൂണിറ്റുകൾ ഉൾക്കൊള്ളുന്നു.
അൽകാഡിയൻസ് :
തന്മാത്രയിൽ അടങ്ങിയിരിക്കുന്ന അപൂരിത ഹൈഡ്രോകാർബണുകളാണ് ആൽക്കാഡിയൻസ്, ഒറ്റ ബോണ്ടുകൾക്ക് പുറമേ, ഇരട്ട കാർബൺ-കാർബൺ ബോണ്ടുകൾ -
. ആൽക്കൈനുകളുടെ ഘടനാപരമായ ഐസോമറുകളാണ് ഡൈനുകൾ.ഭൌതിക ഗുണങ്ങൾ :
ബ്യൂട്ടാഡീൻ ഒരു വാതകമാണ് (തിളയ്ക്കുന്ന പോയിൻ്റ് -4.5 °C), ഐസോപ്രീൻ 34 °C താപനിലയിൽ തിളച്ചുമറിയുന്ന ദ്രാവകമാണ്, ഡൈമെതൈൽബുട്ടാഡീൻ 70 ഡിഗ്രി സെൽഷ്യസിൽ തിളച്ചുമറിയുന്ന ദ്രാവകമാണ്. ഐസോപ്രീനും മറ്റ് ഡൈൻ ഹൈഡ്രോകാർബണുകളും റബ്ബറിലേക്ക് പോളിമറൈസ് ചെയ്യാൻ കഴിവുള്ളവയാണ്. പ്രകൃതിദത്ത റബ്ബർ അതിൻ്റെ ശുദ്ധീകരിക്കപ്പെട്ട അവസ്ഥയിൽ പൊതു ഫോർമുല (C5H8)n ഉള്ള ഒരു പോളിമർ ആണ്, ചില ഉഷ്ണമേഖലാ സസ്യങ്ങളുടെ ക്ഷീര സ്രവത്തിൽ നിന്നാണ് ഇത് ലഭിക്കുന്നത്.
ബെൻസീൻ, ഗ്യാസോലിൻ, കാർബൺ ഡൈസൾഫൈഡ് എന്നിവയിൽ റബ്ബർ വളരെ ലയിക്കുന്നതാണ്. കുറഞ്ഞ ഊഷ്മാവിൽ ചൂടാക്കിയാൽ പൊട്ടുന്നതും ഒട്ടിപ്പിടിക്കുന്നതുമായിരിക്കും. റബ്ബറിൻ്റെ മെക്കാനിക്കൽ, കെമിക്കൽ ഗുണങ്ങൾ മെച്ചപ്പെടുത്തുന്നതിന്, അത് വൾക്കനൈസേഷൻ വഴി റബ്ബറാക്കി മാറ്റുന്നു. റബ്ബർ ഉൽപ്പന്നങ്ങൾ ലഭിക്കുന്നതിന്, അവ ആദ്യം സൾഫറിനൊപ്പം റബ്ബർ മിശ്രിതത്തിൽ നിന്ന് രൂപപ്പെടുത്തുന്നു, അതുപോലെ ഫില്ലറുകൾ: മണം, ചോക്ക്, കളിമണ്ണ്, വൾക്കനൈസേഷൻ ത്വരിതപ്പെടുത്തുന്നതിന് സഹായിക്കുന്ന ചില ജൈവ സംയുക്തങ്ങൾ. അപ്പോൾ ഉൽപ്പന്നങ്ങൾ ചൂടാക്കപ്പെടുന്നു - ചൂടുള്ള വൾക്കനൈസേഷൻ. വൾക്കനൈസേഷൻ സമയത്ത്, സൾഫർ റബ്ബറുമായി രാസപരമായി ബന്ധിപ്പിക്കുന്നു. കൂടാതെ, വൾക്കനൈസ്ഡ് റബ്ബറിൽ ചെറിയ കണങ്ങളുടെ രൂപത്തിൽ സ്വതന്ത്രമായ അവസ്ഥയിൽ സൾഫർ അടങ്ങിയിരിക്കുന്നു.
ഡൈൻ ഹൈഡ്രോകാർബണുകൾ എളുപ്പത്തിൽ പോളിമറൈസ് ചെയ്യുന്നു. ഡൈൻ ഹൈഡ്രോകാർബണുകളുടെ പോളിമറൈസേഷൻ പ്രതിപ്രവർത്തനം റബ്ബറിൻ്റെ സമന്വയത്തിന് അടിവരയിടുന്നു. അവ കൂട്ടിച്ചേർക്കൽ പ്രതികരണങ്ങൾക്ക് വിധേയമാകുന്നു (ഹൈഡ്രജനേഷൻ, ഹാലൊജനേഷൻ, ഹൈഡ്രോഹലോജനേഷൻ):
H 2 C=CH-CH=CH 2 + H 2 -> H 3 C-CH=CH-CH 3
ആൽക്കൈൻസ് :
ആൽക്കൈനുകൾ അപൂരിത ഹൈഡ്രോകാർബണുകളാണ്, അവയുടെ തന്മാത്രകളിൽ ഒറ്റ ബോണ്ടുകൾക്ക് പുറമേ, ഒരു ട്രിപ്പിൾ കാർബൺ-കാർബൺ ബോണ്ട് ഫോർമുല-സി n H 2n-2 അടങ്ങിയിരിക്കുന്നു
ഭൌതിക ഗുണങ്ങൾ :
ആൽക്കൈനുകൾ അവയുടെ ഭൗതിക ഗുണങ്ങളിൽ അനുബന്ധ ആൽക്കീനുകളോട് സാമ്യമുള്ളതാണ്. താഴെയുള്ളത് (സി 4 വരെ) നിറമില്ലാത്തതും മണമില്ലാത്തതുമായ വാതകങ്ങളാണ്, ആൽക്കീനുകളിലെ അവയുടെ അനലോഗുകളേക്കാൾ ഉയർന്ന തിളപ്പിക്കൽ പോയിൻ്റുകൾ ഉണ്ട്.
ആൽക്കൈനുകൾ വെള്ളത്തിൽ മോശമായി ലയിക്കുന്നവയാണ്, എന്നാൽ ഓർഗാനിക് ലായകങ്ങളിൽ മികച്ചതാണ്.
രാസ ഗുണങ്ങൾ :
ഹാലൊജനേഷൻ പ്രതികരണങ്ങൾ
ഒന്നോ രണ്ടോ ഹാലൊജൻ തന്മാത്രകൾ ചേർത്ത് അനുബന്ധ ഹാലൊജൻ ഡെറിവേറ്റീവുകൾ ഉണ്ടാക്കാൻ ആൽക്കൈനുകൾക്ക് കഴിയും:
ജലാംശം
മെർക്കുറി ലവണങ്ങളുടെ സാന്നിധ്യത്തിൽ, ആൽക്കൈനുകൾ ജലം ചേർത്ത് അസറ്റാൽഡിഹൈഡ് (അസെറ്റിലീൻ വേണ്ടി) അല്ലെങ്കിൽ കെറ്റോൺ (മറ്റ് ആൽക്കൈനുകൾക്ക്) ഉണ്ടാകുന്നു.

പൂരിത ഹൈഡ്രോകാർബണുകൾ sp 3 ഹൈബ്രിഡൈസേഷൻ അവസ്ഥയിലുള്ള കാർബൺ ആറ്റങ്ങൾ അടങ്ങിയ തന്മാത്രകളാണ്. കോവാലൻ്റ് സിഗ്മ ബോണ്ടുകൾ വഴി അവ പരസ്പരം ബന്ധിപ്പിച്ചിരിക്കുന്നു. "പൂരിത" അല്ലെങ്കിൽ "പൂരിത" ഹൈഡ്രോകാർബണുകൾ എന്ന പേര് വന്നത് ഈ സംയുക്തങ്ങൾക്ക് ഏതെങ്കിലും ആറ്റങ്ങളെ ഘടിപ്പിക്കാനുള്ള കഴിവില്ല എന്ന വസ്തുതയിൽ നിന്നാണ്. അവ അങ്ങേയറ്റം, പൂർണ്ണമായും പൂരിതമാണ്. സൈക്ലോആൽക്കെയ്നുകളാണ് അപവാദം.
എന്താണ് ആൽക്കെയ്നുകൾ?
ആൽക്കെയ്നുകൾ പൂരിത ഹൈഡ്രോകാർബണുകളാണ്, അവയുടെ കാർബൺ ശൃംഖല തുറന്നതും ഒറ്റ ബോണ്ടുകൾ ഉപയോഗിച്ച് പരസ്പരം ബന്ധിപ്പിച്ചിരിക്കുന്ന കാർബൺ ആറ്റങ്ങളും ഉൾക്കൊള്ളുന്നു. ഇതിൽ മറ്റ് (അതായത്, ആൽക്കീനുകൾ പോലെ ഇരട്ട, അല്ലെങ്കിൽ ആൽക്കൈലുകൾ പോലെയുള്ള ട്രിപ്പിൾ) ബോണ്ടുകൾ അടങ്ങിയിട്ടില്ല. ആൽക്കെയ്നുകളെ പാരഫിനുകൾ എന്നും വിളിക്കുന്നു. അറിയപ്പെടുന്ന പാരഫിനുകൾ പ്രധാനമായും ഈ പൂരിത ഹൈഡ്രോകാർബണുകൾ C 18 -C 35 പ്രത്യേക നിഷ്ക്രിയത്വത്തിൻ്റെ മിശ്രിതമായതിനാലാണ് അവർക്ക് ഈ പേര് ലഭിച്ചത്.
ആൽക്കെയ്നുകളെക്കുറിച്ചും അവയുടെ റാഡിക്കലുകളെക്കുറിച്ചും പൊതുവായ വിവരങ്ങൾ
അവയുടെ ഫോർമുല: C n P 2 n +2, ഇവിടെ n എന്നത് 1-നേക്കാൾ വലുതോ തുല്യമോ ആണ്. മോളാർ പിണ്ഡം ഫോർമുല ഉപയോഗിച്ച് കണക്കാക്കുന്നു: M = 14n + 2. സ്വഭാവ സവിശേഷത: അവയുടെ പേരുകളിലെ അവസാനങ്ങൾ "-an" ആണ്. ഹൈഡ്രജൻ ആറ്റങ്ങളെ മറ്റ് ആറ്റങ്ങളുമായി മാറ്റിസ്ഥാപിച്ചതിൻ്റെ ഫലമായി രൂപം കൊള്ളുന്ന അവയുടെ തന്മാത്രകളുടെ അവശിഷ്ടങ്ങളെ അലിഫാറ്റിക് റാഡിക്കലുകൾ അല്ലെങ്കിൽ ആൽക്കൈലുകൾ എന്ന് വിളിക്കുന്നു. അവയെ R എന്ന അക്ഷരത്താൽ നിയുക്തമാക്കിയിരിക്കുന്നു. മോണോവാലൻ്റ് അലിഫാറ്റിക് റാഡിക്കലുകളുടെ പൊതു സൂത്രവാക്യം: C n P 2 n +1, ഇവിടെ n എന്നത് 1-നേക്കാൾ വലുതോ തുല്യമോ ആണ്. 1. അലിഫാറ്റിക് റാഡിക്കലുകളുടെ ഒരു സ്വഭാവ സവിശേഷത: "- സിൽറ്റ്" എന്ന പേരുകളിൽ അവസാനിക്കുന്നു. ആൽക്കെയ്ൻ തന്മാത്രകൾക്ക് അവയുടെ ഘടനാപരമായ സവിശേഷതകൾ ഉണ്ട്:
- C-C ബോണ്ടിൻ്റെ ദൈർഘ്യം 0.154 nm ആണ്;
- C-H ബോണ്ടിൻ്റെ ദൈർഘ്യം 0.109 nm ആണ്;
- ബോണ്ട് കോൺ (കാർബൺ-കാർബൺ ബോണ്ടുകൾ തമ്മിലുള്ള കോൺ) 109 ഡിഗ്രിയും 28 മിനിറ്റുമാണ്.

ആൽക്കെയ്നുകൾ ഹോമോലോഗസ് സീരീസ് ആരംഭിക്കുന്നു: മീഥെയ്ൻ, ഈഥെയ്ൻ, പ്രൊപ്പെയ്ൻ, ബ്യൂട്ടെയ്ൻ തുടങ്ങിയവ.
ആൽക്കെയ്നുകളുടെ ഭൗതിക സവിശേഷതകൾ
നിറമില്ലാത്തതും വെള്ളത്തിൽ ലയിക്കാത്തതുമായ പദാർത്ഥങ്ങളാണ് ആൽക്കെയ്നുകൾ. ആൽക്കെയ്നുകൾ ഉരുകാൻ തുടങ്ങുന്ന താപനിലയും അവ തിളയ്ക്കുന്ന താപനിലയും തന്മാത്രാഭാരത്തിൻ്റെയും ഹൈഡ്രോകാർബൺ ചെയിൻ നീളത്തിൻ്റെയും വർദ്ധനവിന് അനുസൃതമായി വർദ്ധിക്കുന്നു. കുറഞ്ഞ ശാഖകൾ മുതൽ കൂടുതൽ ശാഖകളുള്ള ആൽക്കെയ്നുകൾ വരെ, തിളപ്പിക്കുന്നതും ഉരുകുന്നതും കുറയുന്നു. വാതക ആൽക്കെയ്നുകൾക്ക് ഇളം നീല അല്ലെങ്കിൽ നിറമില്ലാത്ത ജ്വാല ഉപയോഗിച്ച് കത്തിക്കുകയും ധാരാളം ചൂട് ഉത്പാദിപ്പിക്കുകയും ചെയ്യും. CH 4 -C 4 H 10 മണമില്ലാത്ത വാതകങ്ങളാണ്. C 5 H 12 -C 15 H 32 ഒരു പ്രത്യേക ഗന്ധമുള്ള ദ്രാവകങ്ങളാണ്. C 15 H 32 എന്നിവയും മണമില്ലാത്ത ഖരവസ്തുക്കളാണ്.
ആൽക്കെയ്നുകളുടെ രാസ ഗുണങ്ങൾ
ഈ സംയുക്തങ്ങൾ രാസപരമായി നിഷ്ക്രിയമാണ്, ഇത് തകർക്കാൻ പ്രയാസമുള്ള സിഗ്മ ബോണ്ടുകളുടെ ശക്തിയാൽ വിശദീകരിക്കാം - സി-സി, സി-എച്ച്. C-C ബോണ്ടുകൾ നോൺ-പോളാർ ആണെന്നും C-H ബോണ്ടുകൾ ലോ-പോളാർ ആണെന്നും പരിഗണിക്കേണ്ടതാണ്. ഇവ സിഗ്മ തരത്തിൽ പെടുന്ന ലോ-പോളറൈസ്ഡ് ബോണ്ടുകളാണ്, അതനുസരിച്ച്, അവ ഒരു ഹോമോലിറ്റിക് മെക്കാനിസം വഴി തകർക്കാൻ സാധ്യതയുണ്ട്, അതിൻ്റെ ഫലമായി റാഡിക്കലുകൾ രൂപപ്പെടും. അതിനാൽ, ആൽക്കെയ്നുകളുടെ രാസ ഗുണങ്ങൾ പ്രധാനമായും റാഡിക്കൽ സബ്സ്റ്റിറ്റ്യൂഷൻ പ്രതിപ്രവർത്തനങ്ങളിൽ പരിമിതപ്പെടുത്തിയിരിക്കുന്നു.

നൈട്രേഷൻ പ്രതികരണങ്ങൾ
ആൽക്കെയ്നുകൾ 10% സാന്ദ്രതയുള്ള നൈട്രിക് ആസിഡുമായോ 140 ഡിഗ്രി സെൽഷ്യസ് താപനിലയിൽ വാതക അന്തരീക്ഷത്തിൽ ടെട്രാവാലൻ്റ് നൈട്രജൻ ഓക്സൈഡുമായോ മാത്രമേ പ്രതിപ്രവർത്തിക്കുന്നുള്ളൂ. ആൽക്കെയ്നുകളുടെ നൈട്രേഷൻ പ്രതികരണത്തെ കൊനോവലോവ് പ്രതിപ്രവർത്തനം എന്ന് വിളിക്കുന്നു. തൽഫലമായി, നൈട്രോ സംയുക്തങ്ങളും ജലവും രൂപം കൊള്ളുന്നു: CH 4 + നൈട്രിക് ആസിഡ് (നേർപ്പിച്ചത്) = CH 3 - NO 2 (നൈട്രോമെതെയ്ൻ) + വെള്ളം.
ജ്വലന പ്രതികരണങ്ങൾ
പൂരിത ഹൈഡ്രോകാർബണുകൾ പലപ്പോഴും ഇന്ധനമായി ഉപയോഗിക്കുന്നു, ഇത് കത്തിക്കാനുള്ള കഴിവ് കൊണ്ട് ന്യായീകരിക്കപ്പെടുന്നു: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
ഓക്സിഡേഷൻ പ്രതികരണങ്ങൾ
ആൽക്കെയ്നുകളുടെ രാസ ഗുണങ്ങളിൽ അവയുടെ ഓക്സിഡൈസ് ചെയ്യാനുള്ള കഴിവും ഉൾപ്പെടുന്നു. പ്രതികരണത്തിനൊപ്പം ഏത് സാഹചര്യങ്ങളാണുള്ളത്, അവ എങ്ങനെ മാറുന്നു എന്നതിനെ ആശ്രയിച്ച്, ഒരേ പദാർത്ഥത്തിൽ നിന്ന് വ്യത്യസ്ത അന്തിമ ഉൽപ്പന്നങ്ങൾ ലഭിക്കും. പ്രതിപ്രവർത്തനത്തെ ത്വരിതപ്പെടുത്തുന്ന ഒരു ഉൽപ്രേരകത്തിൻ്റെ സാന്നിധ്യത്തിൽ ഓക്സിജനുമായി മീഥേനിൻ്റെ നേരിയ ഓക്സിഡേഷനും ഏകദേശം 200 ° C താപനിലയും ഇനിപ്പറയുന്ന പദാർത്ഥങ്ങൾക്ക് കാരണമാകും:
1) 2CH 4 (ഓക്സിജൻ്റെ കൂടെ ഓക്സിഡേഷൻ) = 2CH 3 OH (മദ്യം - മെഥനോൾ).
2) CH 4 (ഓക്സിജൻ ഉള്ള ഓക്സിഡേഷൻ) = CH 2 O (ആൽഡിഹൈഡ് - മെഥനൽ അല്ലെങ്കിൽ ഫോർമാൽഡിഹൈഡ്) + H 2 O.
3) 2CH 4 (ഓക്സിജൻ ഉള്ള ഓക്സിഡേഷൻ) = 2HCOOH (കാർബോക്സിലിക് ആസിഡ് - മീഥേൻ അല്ലെങ്കിൽ ഫോർമിക്) + 2H 2 O.

കൂടാതെ, ആൽക്കെയ്നുകളുടെ ഓക്സീകരണം വായുവുള്ള ഒരു വാതക അല്ലെങ്കിൽ ദ്രാവക മാധ്യമത്തിൽ നടത്താം. അത്തരം പ്രതികരണങ്ങൾ ഉയർന്ന ഫാറ്റി ആൽക്കഹോളുകളുടെയും അനുബന്ധ ആസിഡുകളുടെയും രൂപീകരണത്തിലേക്ക് നയിക്കുന്നു.
ചൂടുമായുള്ള ബന്ധം
+ 150-250 ഡിഗ്രി സെൽഷ്യസിൽ കൂടാത്ത താപനിലയിൽ, എല്ലായ്പ്പോഴും ഒരു കാറ്റലിസ്റ്റിൻ്റെ സാന്നിധ്യത്തിൽ, ഓർഗാനിക് വസ്തുക്കളുടെ ഘടനാപരമായ പുനഃക്രമീകരണം സംഭവിക്കുന്നു, അതിൽ ആറ്റങ്ങളുടെ കണക്ഷൻ്റെ ക്രമത്തിൽ മാറ്റം ഉൾപ്പെടുന്നു. ഈ പ്രക്രിയയെ ഐസോമറൈസേഷൻ എന്നും പ്രതിപ്രവർത്തനത്തിൻ്റെ ഫലമായുണ്ടാകുന്ന പദാർത്ഥങ്ങളെ ഐസോമറുകൾ എന്നും വിളിക്കുന്നു. അങ്ങനെ, സാധാരണ ബ്യൂട്ടെയ്നിൽ നിന്ന്, അതിൻ്റെ ഐസോമർ ലഭിക്കുന്നു - ഐസോബ്യൂട്ടെയ്ൻ. 300-600 ഡിഗ്രി സെൽഷ്യസ് താപനിലയിലും ഒരു ഉൽപ്രേരകത്തിൻ്റെ സാന്നിധ്യത്തിലും, ഹൈഡ്രജൻ തന്മാത്രകൾ (ഡീഹൈഡ്രജനേഷൻ പ്രതികരണങ്ങൾ), ഹൈഡ്രജൻ തന്മാത്രകൾ, കാർബൺ ശൃംഖലയെ ഒരു ചക്രത്തിലേക്ക് അടയ്ക്കുന്നതിലൂടെ (ആൽക്കെയ്നുകളുടെ സൈക്ലൈസേഷൻ അല്ലെങ്കിൽ അരോമാറ്റിസേഷൻ പ്രതികരണങ്ങൾ) രൂപപ്പെടുന്നതിലൂടെ സി-എച്ച് ബോണ്ടുകൾ തകരുന്നു. :
1) 2CH 4 = C 2 H 4 (ഈഥീൻ) + 2H 2.
2) 2CH 4 = C 2 H 2 (എഥൈൻ) + 3H 2.
3) C 7 H 16 (സാധാരണ ഹെപ്റ്റെയ്ൻ) = C 6 H 5 - CH 3 (ടൊലുയിൻ) + 4 H 2.

ഹാലൊജനേഷൻ പ്രതികരണങ്ങൾ
അത്തരം പ്രതിപ്രവർത്തനങ്ങളിൽ ഒരു ഓർഗാനിക് പദാർത്ഥത്തിൻ്റെ തന്മാത്രയിൽ ഹാലൊജനുകൾ (അവയുടെ ആറ്റങ്ങൾ) അവതരിപ്പിക്കുന്നത് ഉൾപ്പെടുന്നു, അതിൻ്റെ ഫലമായി ഒരു സി-ഹാലൊജൻ ബോണ്ട് രൂപപ്പെടുന്നു. ആൽക്കെയ്നുകൾ ഹാലൊജനുമായി പ്രതിപ്രവർത്തിക്കുമ്പോൾ, ഹാലൊജൻ ഡെറിവേറ്റീവുകൾ രൂപം കൊള്ളുന്നു. ഈ പ്രതികരണത്തിന് പ്രത്യേക സവിശേഷതകളുണ്ട്. ഇത് ഒരു റാഡിക്കൽ മെക്കാനിസം അനുസരിച്ച് മുന്നോട്ട് പോകുന്നു, അത് ആരംഭിക്കുന്നതിന്, ഹാലൊജനുകളുടെയും ആൽക്കെയ്നുകളുടെയും മിശ്രിതം അൾട്രാവയലറ്റ് വികിരണത്തിലേക്ക് തുറന്നുകാട്ടുകയോ ചൂടാക്കുകയോ ചെയ്യേണ്ടത് ആവശ്യമാണ്. ആൽക്കെയ്നുകളുടെ ഗുണവിശേഷതകൾ ഹാലൊജനേഷൻ പ്രതിപ്രവർത്തനം ഹാലൊജെൻ ആറ്റങ്ങളുമായി പൂർണ്ണമായി മാറ്റിസ്ഥാപിക്കുന്നത് വരെ തുടരാൻ അനുവദിക്കുന്നു. അതായത്, മീഥേനിൻ്റെ ക്ലോറിനേഷൻ ഒരു ഘട്ടത്തിലും മീഥൈൽ ക്ലോറൈഡിൻ്റെ ഉൽപാദനത്തിലും അവസാനിക്കില്ല. പ്രതികരണം കൂടുതൽ മുന്നോട്ട് പോകും, സാധ്യമായ എല്ലാ സബ്സ്റ്റിറ്റ്യൂഷൻ ഉൽപ്പന്നങ്ങളും രൂപം കൊള്ളും, ക്ലോറോമീഥേനിൽ ആരംഭിച്ച് കാർബൺ ടെട്രാക്ലോറൈഡിൽ അവസാനിക്കും. ഈ അവസ്ഥകളിൽ മറ്റ് ആൽക്കെയ്നുകൾ ക്ലോറിനിലേക്ക് എക്സ്പോഷർ ചെയ്യുന്നത് വിവിധ കാർബൺ ആറ്റങ്ങളിൽ ഹൈഡ്രജനെ മാറ്റിസ്ഥാപിക്കുന്നതിൻ്റെ ഫലമായി വിവിധ ഉൽപ്പന്നങ്ങളുടെ രൂപീകരണത്തിന് കാരണമാകും. പ്രതികരണം സംഭവിക്കുന്ന താപനില അന്തിമ ഉൽപ്പന്നങ്ങളുടെ അനുപാതവും അവയുടെ രൂപീകരണ നിരക്കും നിർണ്ണയിക്കും. ആൽക്കെയ്നിൻ്റെ ഹൈഡ്രോകാർബൺ ശൃംഖല ദൈർഘ്യമേറിയതായിരിക്കും, പ്രതികരണം എളുപ്പമായിരിക്കും. ഹാലൊജനേഷൻ സമയത്ത്, ഏറ്റവും കുറവ് ഹൈഡ്രജൻ (ത്രിതീയ) കാർബൺ ആറ്റം ആദ്യം മാറ്റിസ്ഥാപിക്കും. മറ്റെല്ലാവർക്കും ശേഷം പ്രൈമറി പ്രതികരിക്കും. ഹാലൊജനേഷൻ പ്രതികരണം ഘട്ടങ്ങളിൽ സംഭവിക്കും. ആദ്യ ഘട്ടത്തിൽ, ഒരു ഹൈഡ്രജൻ ആറ്റം മാത്രമേ മാറ്റിസ്ഥാപിക്കുകയുള്ളൂ. ആൽക്കെയ്നുകൾ ഹാലൊജൻ ലായനികളുമായി (ക്ലോറിൻ, ബ്രോമിൻ വെള്ളം) ഇടപെടുന്നില്ല.

സൾഫോക്ലോറിനേഷൻ പ്രതികരണങ്ങൾ
ആൽക്കെയ്നുകളുടെ രാസ ഗുണങ്ങളും സൾഫോക്ലോറിനേഷൻ റിയാക്ഷൻ (റീഡ് റിയാക്ഷൻ എന്ന് വിളിക്കുന്നു) വഴി പൂർത്തീകരിക്കപ്പെടുന്നു. അൾട്രാവയലറ്റ് വികിരണത്തിന് വിധേയമാകുമ്പോൾ, ക്ലോറിൻ, സൾഫർ ഡയോക്സൈഡ് എന്നിവയുടെ മിശ്രിതവുമായി പ്രതികരിക്കാൻ ആൽക്കെയ്നുകൾക്ക് കഴിയും. തൽഫലമായി, ഹൈഡ്രജൻ ക്ലോറൈഡ് രൂപം കൊള്ളുന്നു, അതുപോലെ സൾഫർ ഡയോക്സൈഡ് ചേർക്കുന്ന ഒരു ആൽക്കൈൽ റാഡിക്കൽ. ക്ലോറിൻ ആറ്റം പിടിച്ചെടുക്കുന്നതും അതിൻ്റെ അടുത്ത തന്മാത്രയുടെ നാശവും കാരണം സ്ഥിരത കൈവരിക്കുന്ന ഒരു സങ്കീർണ്ണ സംയുക്തമാണ് ഫലം: R-H + SO 2 + Cl 2 + അൾട്രാവയലറ്റ് വികിരണം = R-SO 2 Cl + HCl. പ്രതിപ്രവർത്തനത്തിൻ്റെ ഫലമായി രൂപംകൊണ്ട സൾഫോണൈൽ ക്ലോറൈഡുകൾ സർഫക്റ്റൻ്റുകളുടെ ഉത്പാദനത്തിൽ വ്യാപകമായി ഉപയോഗിക്കുന്നു.
ആൽക്കെയ്നുകളുടെ ഉപയോഗം തികച്ചും വൈവിധ്യപൂർണ്ണമാണ് - അവ ഇന്ധനമായും മെക്കാനിക്സ്, മെഡിസിൻ മുതലായവയിലും ഉപയോഗിക്കുന്നു. ആധുനിക മനുഷ്യൻ്റെ ജീവിതത്തിൽ ഈ രാസ സംയുക്തങ്ങളുടെ പങ്ക് അമിതമായി വിലയിരുത്താൻ കഴിയില്ല.
ആൽക്കെയ്നുകൾ: ഗുണങ്ങളും ഹ്രസ്വ വിവരണവും
കാർബൺ ആറ്റങ്ങളെ ലളിതമായ പൂരിത ബോണ്ടുകളാൽ ബന്ധിപ്പിച്ചിരിക്കുന്ന ചാക്രികമല്ലാത്ത കാർബൺ സംയുക്തങ്ങളാണ് ആൽക്കെയ്നുകൾ. ഈ പദാർത്ഥങ്ങൾ ചില ഗുണങ്ങളും സവിശേഷതകളും ഉള്ള ഒരു മുഴുവൻ ശ്രേണിയെ പ്രതിനിധീകരിക്കുന്നു. ഇനിപ്പറയുന്ന രീതിയിൽ:
N ഇവിടെ കാർബൺ ആറ്റങ്ങളുടെ എണ്ണത്തെ പ്രതിനിധീകരിക്കുന്നു. ഉദാഹരണത്തിന്, CH3, C2H6.
ആൽക്കെയ്ൻ ശ്രേണിയിലെ ആദ്യത്തെ നാല് പ്രതിനിധികൾ വാതക പദാർത്ഥങ്ങളാണ്: മീഥെയ്ൻ, ഈഥെയ്ൻ, പ്രൊപ്പെയ്ൻ, ബ്യൂട്ടെയ്ൻ. ഇനിപ്പറയുന്ന സംയുക്തങ്ങൾ (C5 മുതൽ C17 വരെ) ദ്രാവകങ്ങളാണ്. സാധാരണ അവസ്ഥയിൽ ഖരരൂപത്തിലുള്ള സംയുക്തങ്ങളുമായി പരമ്പര തുടരുന്നു.
രാസ ഗുണങ്ങളെ സംബന്ധിച്ചിടത്തോളം, ആൽക്കെയ്നുകൾ കുറഞ്ഞ സജീവമാണ് - അവ പ്രായോഗികമായി ക്ഷാരങ്ങളുമായും ആസിഡുകളുമായും ഇടപഴകുന്നില്ല. വഴിയിൽ, ആൽക്കെയ്നുകളുടെ ഉപയോഗം നിർണ്ണയിക്കുന്നത് രാസ ഗുണങ്ങളാണ്.
എന്നിരുന്നാലും, ഹൈഡ്രജൻ ആറ്റങ്ങളുടെ മാറ്റിസ്ഥാപിക്കൽ, തന്മാത്രാ വിഭജന പ്രക്രിയകൾ എന്നിവ ഉൾപ്പെടെയുള്ള ചില പ്രതിപ്രവർത്തനങ്ങളാൽ ഈ സംയുക്തങ്ങളുടെ സവിശേഷതയുണ്ട്.
- ഹൈഡ്രജൻ ആറ്റങ്ങളെ ഹാലോജനുകൾ ഉപയോഗിച്ച് മാറ്റിസ്ഥാപിക്കുന്ന ഹാലോജനേഷൻ ആണ് ഏറ്റവും സ്വഭാവ സവിശേഷത. ഈ സംയുക്തങ്ങളുടെ ക്ലോറിനേഷനും ബ്രോമിനേഷൻ പ്രതികരണങ്ങളും വളരെ പ്രാധാന്യമർഹിക്കുന്നു.
- നേർപ്പിച്ച (10% കോൺസൺട്രേഷൻ) ഒരു പ്രതിപ്രവർത്തന സമയത്ത് ഹൈഡ്രജൻ ആറ്റത്തെ നൈട്രോ ഗ്രൂപ്പ് ഉപയോഗിച്ച് മാറ്റിസ്ഥാപിക്കുന്നതാണ് നൈട്രേഷൻ, സാധാരണ അവസ്ഥയിൽ, ആൽക്കെയ്നുകൾ ആസിഡുകളുമായി പ്രതിപ്രവർത്തിക്കില്ല. അത്തരമൊരു പ്രതികരണം നടത്താൻ, 140 ° C താപനില ആവശ്യമാണ്.
- ഓക്സിഡേഷൻ - സാധാരണ അവസ്ഥയിൽ, ആൽക്കെയ്നുകളെ ഓക്സിജൻ ബാധിക്കില്ല. എന്നിരുന്നാലും, വായുവിൽ ജ്വലനത്തിനുശേഷം, ഈ പദാർത്ഥങ്ങൾ വെള്ളവും അവയുടെ അന്തിമ ഉൽപ്പന്നങ്ങളിലേക്ക് പ്രവേശിക്കുന്നു
- ക്രാക്കിംഗ് - ഈ പ്രതികരണം ആവശ്യമായ കാറ്റലിസ്റ്റുകളുടെ സാന്നിധ്യത്തിൽ മാത്രമേ സംഭവിക്കൂ. കാർബൺ ആറ്റങ്ങൾ തമ്മിലുള്ള സ്ഥിരതയുള്ള ഹോമോലോഗസ് ബോണ്ടുകളുടെ പിളർപ്പ് പ്രക്രിയയിൽ ഉൾപ്പെടുന്നു. ഉദാഹരണത്തിന്, ബ്യൂട്ടെയ്ൻ പൊട്ടുമ്പോൾ, പ്രതികരണത്തിന് ഈഥെയ്നും എഥിലീനും ഉത്പാദിപ്പിക്കാൻ കഴിയും.
- ഐസോമറൈസേഷൻ - ചില കാറ്റലിസ്റ്റുകളുടെ പ്രവർത്തനത്തിൻ്റെ ഫലമായി, ആൽക്കെയ്നിൻ്റെ കാർബൺ അസ്ഥികൂടത്തിൻ്റെ ചില പുനഃക്രമീകരണം സാധ്യമാണ്.
ആൽക്കെയ്നുകളുടെ പ്രയോഗങ്ങൾ
ഈ പദാർത്ഥങ്ങളുടെ പ്രധാന സ്വാഭാവിക ഉറവിടം പ്രകൃതി വാതകവും എണ്ണയും പോലുള്ള വിലയേറിയ ഉൽപ്പന്നങ്ങളാണ്. ഇന്ന് ആൽക്കെയ്നുകളുടെ പ്രയോഗ മേഖലകൾ വളരെ വിശാലവും വൈവിധ്യപൂർണ്ണവുമാണ്.
ഉദാഹരണത്തിന്, വാതക പദാർത്ഥങ്ങൾ ഇന്ധനത്തിൻ്റെ വിലയേറിയ സ്രോതസ്സായി ഉപയോഗിക്കുന്നു. പ്രകൃതിവാതകവും പ്രൊപ്പെയ്ൻ-ബ്യൂട്ടെയ്ൻ മിശ്രിതവും ചേർന്ന മീഥെയ്ൻ ഒരു ഉദാഹരണമാണ്.
ആൽക്കെയ്നുകളുടെ മറ്റൊരു ഉറവിടം എണ്ണ , ആധുനിക മനുഷ്യരാശിക്ക് ഇതിൻ്റെ പ്രാധാന്യം അമിതമായി വിലയിരുത്താൻ പ്രയാസമാണ്. പെട്രോളിയം ഉൽപ്പന്നങ്ങളിൽ ഇവ ഉൾപ്പെടുന്നു:
- ഗ്യാസോലിൻ - ഇന്ധനമായി ഉപയോഗിക്കുന്നു;
- മണ്ണെണ്ണ;
- ഡീസൽ ഇന്ധനം, അല്ലെങ്കിൽ ലൈറ്റ് ഗ്യാസ് ഓയിൽ;
- കനത്ത വാതക എണ്ണ, ഇത് ലൂബ്രിക്കറ്റിംഗ് എണ്ണയായി ഉപയോഗിക്കുന്നു;
- അവശിഷ്ടങ്ങൾ അസ്ഫാൽറ്റ് നിർമ്മിക്കാൻ ഉപയോഗിക്കുന്നു.
പ്ലാസ്റ്റിക്, സിന്തറ്റിക് നാരുകൾ, റബ്ബറുകൾ, ചില ഡിറ്റർജൻ്റുകൾ എന്നിവ ഉൽപ്പാദിപ്പിക്കുന്നതിനും പെട്രോളിയം ഉൽപ്പന്നങ്ങൾ ഉപയോഗിക്കുന്നു.
വാസ്ലിൻ, പെട്രോളിയം ജെല്ലി എന്നിവ ആൽക്കെയ്നുകളുടെ മിശ്രിതം അടങ്ങിയ ഉൽപ്പന്നങ്ങളാണ്. അവർ വൈദ്യശാസ്ത്രത്തിലും കോസ്മെറ്റോളജിയിലും (പ്രധാനമായും തൈലങ്ങളും ക്രീമുകളും തയ്യാറാക്കാൻ), അതുപോലെ സുഗന്ധദ്രവ്യങ്ങളിലും ഉപയോഗിക്കുന്നു.
ഖര ആൽക്കെയ്നുകളുടെ മിശ്രിതമായ മറ്റൊരു അറിയപ്പെടുന്ന ഉൽപ്പന്നമാണ് പാരഫിൻ. ഇതൊരു സോളിഡ് വൈറ്റ് പിണ്ഡമാണ്, ഇതിൻ്റെ ചൂടാക്കൽ താപനില 50 - 70 ഡിഗ്രിയാണ്. ആധുനിക ഉൽപാദനത്തിൽ, മെഴുകുതിരികൾ നിർമ്മിക്കാൻ പാരഫിൻ ഉപയോഗിക്കുന്നു. പൊരുത്തങ്ങൾ ഒരേ പദാർത്ഥം കൊണ്ട് സന്നിവേശിപ്പിക്കപ്പെടുന്നു. വൈദ്യത്തിൽ, പാരഫിൻ ഉപയോഗിച്ച് വിവിധ താപ നടപടിക്രമങ്ങൾ നടത്തുന്നു.
ആൽക്കെയ്നുകൾ എന്ന ആശയത്തിൻ്റെ നിർവചനത്തിൽ നിന്ന് ആരംഭിക്കുന്നത് ഉപയോഗപ്രദമാകും. ഇവ പൂരിതമോ പൂരിതമോ ആണ്, സി ആറ്റങ്ങളുടെ കണക്ഷൻ ലളിതമായ ബോണ്ടുകൾ വഴി നടക്കുന്ന കാർബണുകളാണെന്നും നമുക്ക് പറയാം. പൊതുവായ ഫോർമുല ഇതാണ്: CnH₂n+ 2.
മറ്റ് ക്ലാസുകളുമായി താരതമ്യപ്പെടുത്തുമ്പോൾ അവയുടെ തന്മാത്രകളിലെ H, C ആറ്റങ്ങളുടെ എണ്ണത്തിൻ്റെ അനുപാതം പരമാവധി ആണെന്ന് അറിയാം. എല്ലാ വാലൻസുകളും C അല്ലെങ്കിൽ H ഉൾക്കൊള്ളുന്നു എന്ന വസ്തുത കാരണം, ആൽക്കെയ്നുകളുടെ രാസ ഗുണങ്ങൾ വ്യക്തമായി പ്രകടിപ്പിക്കപ്പെടുന്നില്ല, അതിനാൽ അവയുടെ രണ്ടാമത്തെ പേര് പൂരിത അല്ലെങ്കിൽ പൂരിത ഹൈഡ്രോകാർബണുകൾ എന്ന പദമാണ്.
അവയുടെ ആപേക്ഷിക രാസ നിഷ്ക്രിയത്വത്തെ മികച്ച രീതിയിൽ പ്രതിഫലിപ്പിക്കുന്ന ഒരു പഴയ പേരുമുണ്ട് - പാരഫിൻസ്, അതായത് "ആഭിമുഖ്യം ഇല്ലാത്തത്".
അതിനാൽ, ഇന്നത്തെ നമ്മുടെ സംഭാഷണത്തിൻ്റെ വിഷയം ഇതാണ്: "ആൽക്കെയ്നുകൾ: ഹോമോളജിക്കൽ സീരീസ്, നാമകരണം, ഘടന, ഐസോമെറിസം." അവയുടെ ഭൗതിക ഗുണങ്ങളെക്കുറിച്ചുള്ള വിവരങ്ങളും അവതരിപ്പിക്കും.
ആൽക്കെയ്നുകൾ: ഘടന, നാമകരണം
അവയിൽ, സി ആറ്റങ്ങൾ sp3 ഹൈബ്രിഡൈസേഷൻ എന്ന അവസ്ഥയിലാണ്. ഇക്കാര്യത്തിൽ, ആൽക്കെയ്ൻ തന്മാത്രയെ ടെട്രാഹെഡ്രൽ സി ഘടനകളുടെ ഒരു കൂട്ടമായി പ്രദർശിപ്പിക്കാൻ കഴിയും, അത് പരസ്പരം മാത്രമല്ല, എച്ച്.
സി, എച്ച് ആറ്റങ്ങൾക്കിടയിൽ ശക്തമായ, വളരെ താഴ്ന്ന ധ്രുവീയ എസ്-ബോണ്ടുകൾ ഉണ്ട്. ആറ്റങ്ങൾ എല്ലായ്പ്പോഴും ലളിതമായ ബോണ്ടുകൾക്ക് ചുറ്റും കറങ്ങുന്നു, അതിനാലാണ് ആൽക്കെയ്ൻ തന്മാത്രകൾ വിവിധ രൂപങ്ങൾ എടുക്കുന്നത്, ബോണ്ട് നീളവും അവയ്ക്കിടയിലുള്ള കോണും സ്ഥിരമായ മൂല്യങ്ങളാണ്. σ ബോണ്ടുകൾക്ക് ചുറ്റുമുള്ള തന്മാത്രയുടെ ഭ്രമണം കാരണം പരസ്പരം രൂപാന്തരപ്പെടുന്ന രൂപങ്ങളെ സാധാരണയായി കോൺഫോർമേഷൻ എന്ന് വിളിക്കുന്നു.

സംശയാസ്പദമായ തന്മാത്രയിൽ നിന്ന് ഒരു എച്ച് ആറ്റത്തിൻ്റെ അമൂർത്തീകരണ പ്രക്രിയയിൽ, ഹൈഡ്രോകാർബൺ റാഡിക്കലുകൾ എന്ന് വിളിക്കപ്പെടുന്ന 1-വാലൻ്റ് സ്പീഷീസ് രൂപപ്പെടുന്നു. മാത്രമല്ല, അജൈവ സംയുക്തങ്ങളുടെയും ഫലമായി അവ പ്രത്യക്ഷപ്പെടുന്നു. ഒരു പൂരിത ഹൈഡ്രോകാർബൺ തന്മാത്രയിൽ നിന്ന് നിങ്ങൾ 2 ഹൈഡ്രജൻ ആറ്റങ്ങൾ കുറച്ചാൽ, നിങ്ങൾക്ക് 2-വാലൻ്റ് റാഡിക്കലുകൾ ലഭിക്കും.
അതിനാൽ, ആൽക്കെയ്നുകളുടെ നാമകരണം ഇതായിരിക്കാം:
- റേഡിയൽ (പഴയ പതിപ്പ്);
- പകരക്കാരൻ (അന്താരാഷ്ട്ര, വ്യവസ്ഥാപിതം). ഐയുപിഎസിയാണ് ഇത് നിർദ്ദേശിച്ചത്.
റേഡിയൽ നാമകരണത്തിൻ്റെ സവിശേഷതകൾ
ആദ്യ സന്ദർഭത്തിൽ, ആൽക്കെയ്നുകളുടെ നാമകരണം ഇപ്രകാരമാണ്:
- ഹൈഡ്രോകാർബണുകളെ മീഥേനിൻ്റെ ഡെറിവേറ്റീവുകളായി കണക്കാക്കുന്നു, അതിൽ ഒന്നോ അതിലധികമോ H ആറ്റങ്ങളെ റാഡിക്കലുകൾ ഉപയോഗിച്ച് മാറ്റിസ്ഥാപിക്കുന്നു.
- വളരെ സങ്കീർണ്ണമല്ലാത്ത കണക്ഷനുകളുടെ കാര്യത്തിൽ ഉയർന്ന സൗകര്യം.
സബ്സ്റ്റിറ്റ്യൂഷൻ നാമകരണത്തിൻ്റെ സവിശേഷതകൾ
ആൽക്കെയ്നുകളുടെ പകര നാമകരണത്തിന് ഇനിപ്പറയുന്ന സവിശേഷതകൾ ഉണ്ട്:
- പേരിൻ്റെ അടിസ്ഥാനം 1 കാർബൺ ശൃംഖലയാണ്, ശേഷിക്കുന്ന തന്മാത്രാ ശകലങ്ങൾ പകരക്കാരായി കണക്കാക്കുന്നു.
- സമാനമായ നിരവധി റാഡിക്കലുകൾ ഉണ്ടെങ്കിൽ, അവയുടെ പേരിന് മുമ്പായി നമ്പർ സൂചിപ്പിച്ചിരിക്കുന്നു (കർശനമായി വാക്കുകളിൽ), കൂടാതെ റാഡിക്കൽ സംഖ്യകളെ കോമകളാൽ വേർതിരിക്കുന്നു.
രസതന്ത്രം: ആൽക്കെയ്നുകളുടെ നാമകരണം
സൗകര്യാർത്ഥം, വിവരങ്ങൾ പട്ടിക രൂപത്തിൽ അവതരിപ്പിച്ചിരിക്കുന്നു.
പദാർത്ഥത്തിൻ്റെ പേര് | പേരിൻ്റെ അടിസ്ഥാനം (റൂട്ട്) | തന്മാത്രാ സൂത്രവാക്യം | കാർബൺ പകരക്കാരൻ്റെ പേര് | കാർബൺ സബ്സ്റ്റിറ്റ്യൂട്ട് ഫോർമുല |
ആൽക്കെയ്നുകളുടെ മേൽപ്പറഞ്ഞ നാമകരണത്തിൽ ചരിത്രപരമായി വികസിച്ച പേരുകൾ ഉൾപ്പെടുന്നു (പൂരിത ഹൈഡ്രോകാർബണുകളുടെ പരമ്പരയിലെ ആദ്യത്തെ 4 അംഗങ്ങൾ).
5 അല്ലെങ്കിൽ അതിൽ കൂടുതൽ സി ആറ്റങ്ങളുള്ള വികസിക്കാത്ത ആൽക്കെയ്നുകളുടെ പേരുകൾ ഗ്രീക്ക് അക്കങ്ങളിൽ നിന്ന് ഉരുത്തിരിഞ്ഞതാണ്, അത് നൽകിയിട്ടുള്ള സി ആറ്റങ്ങളുടെ എണ്ണം പ്രതിഫലിപ്പിക്കുന്നു, അതിനാൽ പദാർത്ഥം പൂരിത സംയുക്തങ്ങളുടെ ഒരു ശ്രേണിയിൽ നിന്നുള്ളതാണെന്ന് സൂചിപ്പിക്കുന്നു.

അൺഫോൾഡ് ആൽക്കെയ്നുകളുടെ പേരുകൾ രചിക്കുമ്പോൾ, ഏറ്റവും കുറഞ്ഞ എണ്ണം സി ആറ്റങ്ങൾ ഉൾക്കൊള്ളുന്ന പ്രധാന ശൃംഖലയാണ്. ഒരേ നീളമുള്ള രണ്ടോ അതിലധികമോ ശൃംഖലകളുടെ കാര്യത്തിൽ, പ്രധാനമായത് ഏറ്റവും കൂടുതൽ പകരക്കാർ അടങ്ങിയിരിക്കുന്ന ഒന്നായി മാറുന്നു.
ആൽക്കെയ്നുകളുടെ ഐസോമെറിസം
അവയുടെ ശ്രേണിയുടെ മാതൃ ഹൈഡ്രോകാർബൺ മീഥേൻ CH₄ ആണ്. മീഥെയ്ൻ ശ്രേണിയുടെ ഓരോ തുടർന്നുള്ള പ്രതിനിധിയിലും, മുമ്പത്തേതിൽ നിന്നുള്ള വ്യത്യാസം മെത്തിലീൻ ഗ്രൂപ്പിൽ നിരീക്ഷിക്കപ്പെടുന്നു - CH₂. ആൽക്കെയ്നുകളുടെ മുഴുവൻ ശ്രേണിയിലും ഈ പാറ്റേൺ കണ്ടെത്താനാകും.
ജർമ്മൻ ശാസ്ത്രജ്ഞനായ ഷൈൽ ഈ പരമ്പരയെ ഹോമോളജിക്കൽ എന്ന് വിളിക്കാനുള്ള നിർദ്ദേശം മുന്നോട്ടുവച്ചു. ഗ്രീക്കിൽ നിന്ന് വിവർത്തനം ചെയ്തതിൻ്റെ അർത്ഥം "സമാനമായ, സമാനമായ" എന്നാണ്.
അതിനാൽ, ഒരേ ഘടനയും സമാന രാസ ഗുണങ്ങളുമുള്ള അനുബന്ധ ജൈവ സംയുക്തങ്ങളുടെ ഒരു കൂട്ടമാണ് ഹോമോലോഗസ് സീരീസ്. നൽകിയിരിക്കുന്ന പരമ്പരയിലെ അംഗങ്ങളാണ് ഹോമോലോഗുകൾ. ഹോമോലോഗസ് വ്യത്യാസം ഒരു മെത്തിലീൻ ഗ്രൂപ്പാണ്, അതിൽ 2 അയൽ ഹോമോലോഗുകൾ വ്യത്യാസപ്പെട്ടിരിക്കുന്നു.
നേരത്തെ സൂചിപ്പിച്ചതുപോലെ, ഏതെങ്കിലും പൂരിത ഹൈഡ്രോകാർബണിൻ്റെ ഘടന CnH₂n + 2 എന്ന പൊതു സൂത്രവാക്യം ഉപയോഗിച്ച് പ്രകടിപ്പിക്കാൻ കഴിയും. അങ്ങനെ, മീഥേനിന് ശേഷമുള്ള ഹോമോലോഗസ് ശ്രേണിയിലെ അടുത്ത അംഗം ഈഥെയ്ൻ - C₂H₆ ആണ്. അതിൻ്റെ ഘടന മീഥേനിൽ നിന്ന് പരിവർത്തനം ചെയ്യുന്നതിന്, 1 H ആറ്റം CH₃ ഉപയോഗിച്ച് മാറ്റിസ്ഥാപിക്കേണ്ടതുണ്ട് (ചുവടെയുള്ള ചിത്രം).

തുടർന്നുള്ള ഓരോ ഹോമോലോഗിൻ്റെയും ഘടന മുമ്പത്തേതിൽ നിന്ന് അതേ രീതിയിൽ കണക്കാക്കാം. തൽഫലമായി, ഈഥെയ്നിൽ നിന്ന് പ്രൊപ്പെയ്ൻ രൂപം കൊള്ളുന്നു - C₃H₈.
എന്താണ് ഐസോമറുകൾ?
ഒരേ ഗുണപരവും അളവ്പരവുമായ തന്മാത്രാ ഘടന (സമാന തന്മാത്രാ സൂത്രവാക്യം), എന്നാൽ വ്യത്യസ്ത രാസഘടനയുള്ളതും വ്യത്യസ്ത രാസ ഗുണങ്ങളുള്ളതുമായ പദാർത്ഥങ്ങളാണിവ.
മുകളിൽ ചർച്ച ചെയ്ത ഹൈഡ്രോകാർബണുകൾ തിളയ്ക്കുന്ന പോയിൻ്റ് പോലെയുള്ള പരാമീറ്ററിൽ വ്യത്യാസപ്പെട്ടിരിക്കുന്നു: -0.5 ° - ബ്യൂട്ടെയ്ൻ, -10 ° - ഐസോബ്യൂട്ടെയ്ൻ. ഈ തരത്തിലുള്ള ഐസോമെറിസത്തെ കാർബൺ അസ്ഥികൂടം ഐസോമെറിസം എന്ന് വിളിക്കുന്നു, ഇത് ഘടനാപരമായ തരത്തിൽ പെടുന്നു.
കാർബൺ ആറ്റങ്ങളുടെ എണ്ണം കൂടുന്നതിനനുസരിച്ച് ഘടനാപരമായ ഐസോമറുകളുടെ എണ്ണം അതിവേഗം വർദ്ധിക്കുന്നു. അങ്ങനെ, C₁₀H₂₂ 75 ഐസോമറുകളുമായി പൊരുത്തപ്പെടും (സ്പേഷ്യൽ ഐസോമറുകൾ ഉൾപ്പെടെ), കൂടാതെ C₁₅H₃₂ 4347 ഐസോമറുകൾക്ക് ഇതിനകം അറിയാം, C₂₀H₄₂ - 366,319.
അതിനാൽ, ആൽക്കെയ്നുകൾ എന്താണെന്ന് ഇതിനകം വ്യക്തമായിട്ടുണ്ട്, ഹോമോലോഗസ് സീരീസ്, ഐസോമെറിസം, നാമകരണം. ഇപ്പോൾ IUPAC അനുസരിച്ച് പേരുകൾ കംപൈൽ ചെയ്യുന്നതിനുള്ള നിയമങ്ങളിലേക്ക് നീങ്ങുന്നത് മൂല്യവത്താണ്.

IUPAC നാമകരണം: പേരുകളുടെ രൂപീകരണത്തിനുള്ള നിയമങ്ങൾ
ഒന്നാമതായി, ഹൈഡ്രോകാർബൺ ഘടനയിൽ ഏറ്റവും ദൈർഘ്യമേറിയതും പരമാവധി എണ്ണം പകരമുള്ളതുമായ കാർബൺ ശൃംഖല കണ്ടെത്തേണ്ടത് ആവശ്യമാണ്. അപ്പോൾ നിങ്ങൾ ശൃംഖലയിലെ സി ആറ്റങ്ങളെ അക്കമിടേണ്ടതുണ്ട്, പകരക്കാരൻ ഏറ്റവും അടുത്തിരിക്കുന്ന അവസാനം മുതൽ.
രണ്ടാമതായി, അടിസ്ഥാനം എന്നത് ഒരു ശാഖയില്ലാത്ത പൂരിത ഹൈഡ്രോകാർബണിൻ്റെ പേരാണ്, ഇത് സി ആറ്റങ്ങളുടെ എണ്ണത്തിൻ്റെ അടിസ്ഥാനത്തിൽ പ്രധാന ശൃംഖലയുമായി യോജിക്കുന്നു.
മൂന്നാമതായി, അടിസ്ഥാനത്തിന് മുമ്പ്, പകരക്കാർ സ്ഥിതിചെയ്യുന്ന ലോക്കൻ്റുകളുടെ എണ്ണം സൂചിപ്പിക്കേണ്ടത് ആവശ്യമാണ്. പകരക്കാരുടെ പേരുകൾ ഒരു ഹൈഫൻ ഉപയോഗിച്ച് അവർക്ക് ശേഷം എഴുതിയിരിക്കുന്നു.
നാലാമതായി, വ്യത്യസ്ത സി ആറ്റങ്ങളിൽ സമാനമായ പകരക്കാരുടെ സാന്നിധ്യത്തിൽ, ലൊക്കൻ്റുകൾ സംയോജിപ്പിച്ച്, പേരിന് മുമ്പായി ഗുണിക്കുന്ന പ്രിഫിക്സ് പ്രത്യക്ഷപ്പെടുന്നു: di - രണ്ട് സമാന പകരക്കാർക്ക്, മൂന്ന് - മൂന്ന്, ടെട്ര - നാല്, പെൻ്റ - അഞ്ച് , മുതലായവ. അക്കങ്ങൾ പരസ്പരം ഒരു കോമ ഉപയോഗിച്ചും വാക്കുകളിൽ നിന്ന് ഒരു ഹൈഫൻ ഉപയോഗിച്ചും വേർതിരിക്കേണ്ടതാണ്.
ഒരേ C ആറ്റത്തിൽ ഒരേസമയം രണ്ട് പകരക്കാർ അടങ്ങിയിട്ടുണ്ടെങ്കിൽ, ലൊക്കൻ്റും രണ്ടുതവണ എഴുതപ്പെടും.
ഈ നിയമങ്ങൾ അനുസരിച്ച്, ആൽക്കെയ്നുകളുടെ അന്താരാഷ്ട്ര നാമകരണം രൂപപ്പെടുന്നു.

ന്യൂമാൻ പ്രവചനങ്ങൾ
ഈ അമേരിക്കൻ ശാസ്ത്രജ്ഞൻ അനുരൂപീകരണങ്ങളുടെ ഗ്രാഫിക്കൽ പ്രകടനത്തിനായി പ്രത്യേക പ്രൊജക്ഷൻ ഫോർമുലകൾ നിർദ്ദേശിച്ചു - ന്യൂമാൻ പ്രൊജക്ഷനുകൾ. അവ എ, ബി ഫോമുകളുമായി പൊരുത്തപ്പെടുന്നു, അവ ചുവടെയുള്ള ചിത്രത്തിൽ അവതരിപ്പിച്ചിരിക്കുന്നു.

ആദ്യ സന്ദർഭത്തിൽ, ഇത് എ-ഒക്ലൂഡഡ് കൺഫർമേഷൻ ആണ്, രണ്ടാമത്തേതിൽ, ഇത് ബി-ഇൻഹിബിറ്റഡ് കൺഫർമേഷൻ ആണ്. എ സ്ഥാനത്ത്, എച്ച് ആറ്റങ്ങൾ പരസ്പരം കുറഞ്ഞ അകലത്തിലാണ് സ്ഥിതി ചെയ്യുന്നത്. ഈ ഫോം ഏറ്റവും ഉയർന്ന ഊർജ്ജ മൂല്യവുമായി യോജിക്കുന്നു, കാരണം അവയ്ക്കിടയിലുള്ള വികർഷണം ഏറ്റവും വലുതാണ്. ഇത് ഊർജ്ജസ്വലമായി പ്രതികൂലമായ അവസ്ഥയാണ്, അതിൻ്റെ ഫലമായി തന്മാത്ര അത് ഉപേക്ഷിച്ച് കൂടുതൽ സ്ഥിരതയുള്ള സ്ഥാനത്തേക്ക് നീങ്ങുന്നു B. ഇവിടെ H ആറ്റങ്ങൾ പരസ്പരം കഴിയുന്നത്ര അകലെയാണ്. അങ്ങനെ, ഈ സ്ഥാനങ്ങൾ തമ്മിലുള്ള ഊർജ്ജ വ്യത്യാസം 12 kJ/mol ആണ്, ഇതുമൂലം മീഥൈൽ ഗ്രൂപ്പുകളെ ബന്ധിപ്പിക്കുന്ന ഈഥെയ്ൻ തന്മാത്രയിലെ അച്ചുതണ്ടിന് ചുറ്റുമുള്ള സ്വതന്ത്ര ഭ്രമണം അസമമാണ്. ഊർജ്ജസ്വലമായി അനുകൂലമായ ഒരു സ്ഥാനത്ത് പ്രവേശിച്ച ശേഷം, തന്മാത്ര അവിടെ തുടരുന്നു, മറ്റൊരു വിധത്തിൽ പറഞ്ഞാൽ, "മന്ദഗതിയിലാകുന്നു." അതുകൊണ്ടാണ് ഇതിനെ ഇൻഹിബിറ്റഡ് എന്ന് വിളിക്കുന്നത്. 10,000 ഈഥെയ്ൻ തന്മാത്രകൾ ഊഷ്മാവിൽ നിരോധിത രൂപത്തിലാണ്. ഒന്നിന് മാത്രം വ്യത്യസ്ത ആകൃതിയുണ്ട് - അവ്യക്തമാണ്.
പൂരിത ഹൈഡ്രോകാർബണുകൾ നേടുന്നു
ഇവ ആൽക്കെയ്നുകളാണെന്ന് ലേഖനത്തിൽ നിന്ന് ഇതിനകം തന്നെ അറിയപ്പെട്ടു (അവയുടെ ഘടനയും നാമകരണവും മുമ്പ് വിശദമായി വിവരിച്ചിട്ടുണ്ട്). അവ നേടാനുള്ള വഴികൾ പരിഗണിക്കുന്നത് ഉപയോഗപ്രദമാകും. എണ്ണ, പ്രകൃതി, കൽക്കരി തുടങ്ങിയ പ്രകൃതിദത്ത സ്രോതസ്സുകളിൽ നിന്നാണ് അവ പുറത്തുവരുന്നത്. സിന്തറ്റിക് രീതികളും ഉപയോഗിക്കുന്നു. ഉദാഹരണത്തിന്, H₂ 2H₂:
- ഹൈഡ്രജനേഷൻ പ്രക്രിയ CnH₂n (ആൽക്കീനുകൾ)→ CnH₂n+2 (ആൽക്കെയ്നുകൾ)← CnH₂n-2 (ആൽക്കൈൻസ്).
- സി, എച്ച് മോണോക്സൈഡ് - സിന്തസിസ് വാതകത്തിൻ്റെ മിശ്രിതത്തിൽ നിന്ന്: nCO+(2n+1)H₂→ CnH₂n+2+nH₂O.
- കാർബോക്സിലിക് ആസിഡുകളിൽ നിന്ന് (അവയുടെ ലവണങ്ങൾ): ആനോഡിലെ വൈദ്യുതവിശ്ലേഷണം, കാഥോഡിൽ:
- കോൾബെ വൈദ്യുതവിശ്ലേഷണം: 2RCOONa+2H₂O→R-R+2CO₂+H₂+2NaOH;
- ഡുമാസ് പ്രതികരണം (ക്ഷാരത്തോടുകൂടിയ അലോയ്): CH₃COONa+NaOH (t)→CH₄+Na₂CO₃.
- ഓയിൽ ക്രാക്കിംഗ്: CnH₂n+2 (450-700°)→ CmH₂m+2+ Cn-mH₂(n-m).
- ഇന്ധനത്തിൻ്റെ ഗ്യാസിഫിക്കേഷൻ (ഖര): C+2H₂→CH₄.
- കുറച്ച് C ആറ്റങ്ങളുള്ള സങ്കീർണ്ണമായ ആൽക്കെയ്നുകളുടെ (ഹാലോജൻ ഡെറിവേറ്റീവുകൾ) സിന്തസിസ്: 2CH₃Cl (ക്ലോറോമീഥെയ്ൻ) +2Na →CH₃- CH₃ (ഈഥെയ്ൻ) +2NaCl.
- വെള്ളം വഴി മെത്തനൈഡുകളുടെ (മെറ്റൽ കാർബൈഡുകൾ) വിഘടിപ്പിക്കൽ: Al₄C₃+12H₂O→4Al(OH₃)↓+3CH₄.
പൂരിത ഹൈഡ്രോകാർബണുകളുടെ ഭൗതിക സവിശേഷതകൾ
സൗകര്യാർത്ഥം, ഡാറ്റ ഒരു പട്ടികയിൽ ഗ്രൂപ്പുചെയ്യുന്നു.
ഫോർമുല | ആൽക്കെയ്ൻ | ഡിഗ്രി സെൽഷ്യസിൽ ദ്രവണാങ്കം | ഡിഗ്രി സെൽഷ്യസിൽ തിളയ്ക്കുന്ന സ്ഥലം | സാന്ദ്രത, g/ml |
0.415 t = -165 ° С |
||||
0.561 t= -100°C |
||||
0.583 t = -45 ° C |
||||
0.579 t =0°C |
||||
2-മെഥൈൽപ്രൊപെയ്ൻ | 0.557 t = -25°C |
|||
2,2-ഡൈമെതൈൽപ്രോപ്പെയ്ൻ | ||||
2-മെഥിൽബ്യൂട്ടെയ്ൻ | ||||
2-മെഥൈൽപെൻ്റെയ്ൻ | ||||
2,2,3,3-ടെട്രാ-മെഥിൽബ്യൂട്ടേൻ | ||||
2,2,4-ട്രൈമെഥൈൽപെൻ്റെയ്ൻ | ||||
n-C₁₀H₂₂ | ||||
n-C₁₁H₂₄ | n-Undecane | |||
n-C₁₂H₂₆ | എൻ-ഡോഡെകെയ്ൻ | |||
n-C₁₃H₂₈ | എൻ-ട്രിഡെകാൻ | |||
n-C₁₄H₃₀ | n-ടെട്രാഡെകെയ്ൻ | |||
n-C₁₅H₃₂ | n-പെൻ്റഡെകെയ്ൻ | |||
n-C₁₆H₃₄ | n-ഹെക്സാഡെകെയ്ൻ | |||
n-C₂₀H₄₂ | n-Eicosane | |||
n-C₃₀H₆₂ | n-Triacontan | 1 എംഎംഎച്ച്ജി സെൻ്റ് | ||
n-C₄₀H₈₂ | n-ടെട്രാകോണ്ടെയ്ൻ | 3 എംഎംഎച്ച്ജി കല. | ||
n-C₅₀H₁₀₂ | n-പെൻ്റകോണ്ടൻ | 15 എംഎംഎച്ച്ജി കല. | ||
n-C₆₀H₁₂₂ | n-ഹെക്സകണ്ടെയ്ൻ | |||
n-C₇₀H₁₄₂ | n-ഹെപ്റ്റകോണ്ടെയ്ൻ | |||
n-C₁₀₀H₂₀₂ |
ഉപസംഹാരം
ആൽക്കെയ്നുകൾ (ഘടന, നാമകരണം, ഐസോമെറിസം, ഹോമോലോഗസ് സീരീസ് മുതലായവ) പോലുള്ള ഒരു ആശയം ലേഖനം പരിശോധിച്ചു. റേഡിയൽ, സബ്സ്റ്റിറ്റ്യൂട്ടീവ് നാമകരണങ്ങളുടെ സവിശേഷതകളെക്കുറിച്ച് കുറച്ച് പറയുന്നു. ആൽക്കെയ്നുകൾ ലഭിക്കുന്നതിനുള്ള രീതികൾ വിവരിച്ചിരിക്കുന്നു.
കൂടാതെ, ആൽക്കെയ്നുകളുടെ മുഴുവൻ നാമകരണവും ലേഖനം വിശദമായി പട്ടികപ്പെടുത്തുന്നു (സ്വീകരിച്ച വിവരങ്ങൾ സ്വാംശീകരിക്കാൻ പരിശോധന നിങ്ങളെ സഹായിക്കും).