अल्केनचे मूलभूत रासायनिक गुणधर्म. अल्केनेस: भौतिक आणि रासायनिक गुणधर्म, अनुप्रयोग
संतृप्त हायड्रोकार्बन्सचे रासायनिक गुणधर्म कार्बन आणि हायड्रोजन अणू आणि $C-H$ आणि $C-C$ बाँड्स यांच्या रेणूंच्या उपस्थितीने निर्धारित केले जातात.
सर्वात सोप्या अल्केन, मिथेनच्या रेणूमध्ये, 8 व्हॅलेन्स इलेक्ट्रॉन्स (कार्बन अणूमधून 4 इलेक्ट्रॉन आणि हायड्रोजन अणूपासून 4) रासायनिक बंध तयार होतात, जे चार बंधनकारक आण्विक कक्षामध्ये स्थित असतात.
तर, मिथेन रेणूमध्ये, चार $sp3-s (C-H)$ सहसंयोजक बंध कार्बन अणूच्या चार $sp3$-संकरित ऑर्बिटल्स आणि चार हायड्रोजन अणूंच्या s-ऑर्बिटल्सपासून तयार होतात (चित्र 1).
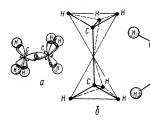
इथेन रेणू दोन कार्बन टेट्राहेड्रापासून तयार होतो - एक $sp3-sp3 (C-C)$ सहसंयोजक बंध आणि सहा $sp3-s (C-H)$ सहसंयोजक बंध (चित्र 2).

आकृती 2. इथेन रेणूची रचना: a - रेणूमध्ये $\sigma $ बॉन्ड्सचे स्थान; b - रेणूचे टेट्राहेड्रल मॉडेल; c - रेणूचे बॉल आणि स्टिक मॉडेल; d - स्टीवर्ट - ब्रिग्लेबनुसार रेणूचे स्केल मॉडेल
अल्केन्समधील रासायनिक बंधांची वैशिष्ट्ये
विचारात घेतलेल्या सहसंयोजक बंधांच्या प्रकारांमध्ये, सर्वात जास्त इलेक्ट्रॉन घनतेचे क्षेत्र अणू केंद्रकांना जोडणाऱ्या रेषेवर स्थित असतात. हे सहसंयोजक बंध स्थानिकीकृत $\sigma $-$(\rm M)$$(\rm O)$ द्वारे तयार केले जातात आणि त्यांना $\sigma $ बंध म्हणतात. या बंधांचे एक महत्त्वाचे वैशिष्ट्य म्हणजे त्यातील इलेक्ट्रॉन घनता अणू केंद्रकातून जाणाऱ्या अक्षाच्या सापेक्ष सममितीने वितरीत केली जाते (इलेक्ट्रॉन घनतेची दंडगोलाकार सममिती). याबद्दल धन्यवाद, या बाँडने जोडलेले अणू किंवा अणूंचे गट बंधाचे विकृतीकरण न करता मुक्तपणे फिरू शकतात. अल्केन रेणूंमधील कार्बन अणूंच्या व्हॅलेन्सच्या दिशांमधील कोन $109^\circ 28"$ आहे. म्हणून, या पदार्थांच्या रेणूंमध्ये, अगदी सरळ कार्बन साखळीसह, कार्बन अणू प्रत्यक्षात एका सरळ रेषेत नसतात. या साखळीला झिगझॅग आकार आहे, जो कार्बनच्या अणूंच्या मध्यांतर कोनांच्या संवर्धनाशी संबंधित आहे (चित्र 3).

आकृती 3. सामान्य अल्केनच्या कार्बन साखळीच्या संरचनेची योजना
पुरेशी लांब कार्बन साखळी असलेल्या अल्केन रेणूंमध्ये, हा कोन एकमेकांशी संयोजित नसलेल्या कार्बन अणूंच्या प्रतिकर्षणामुळे $2^\circ$ ने वाढतो.
टीप १
प्रत्येक रासायनिक बंध एक विशिष्ट ऊर्जा द्वारे दर्शविले जाते. हे प्रायोगिकरित्या स्थापित केले गेले आहे की मिथेन रेणूमध्ये $C-H$ बाँड ऊर्जा 422.9 kJ/mol, इथेन - 401.9 kJ/mol, आणि इतर अल्केन - सुमारे 419 kJ/mol आहे. $C-C$ बाँड ऊर्जा 350 kJ/mol आहे.
अल्केन्सची रचना आणि त्यांची प्रतिक्रिया यांच्यातील संबंध
$C-C$ आणि $C-H$ बाँडची उच्च ऊर्जा खोलीच्या तपमानावर संतृप्त हायड्रोकार्बन्सची कमी प्रतिक्रिया ठरवते. अशा प्रकारे, अल्केन्स ब्रोमाइनचे पाणी, पोटॅशियम परमँगनेट द्रावणाचा रंग बदलत नाहीत, आयनिक अभिकर्मकांशी (ॲसिड, अल्कली) संवाद साधत नाहीत आणि ऑक्सिडायझिंग एजंट्स किंवा सक्रिय धातूंवर प्रतिक्रिया देत नाहीत. म्हणून, उदाहरणार्थ, सोडियम धातू केरोसीनमध्ये साठवले जाऊ शकते, जे संतृप्त हायड्रोकार्बन्सचे मिश्रण आहे. अगदी एकाग्र सल्फ्यूरिक ऍसिड, जे अनेक सेंद्रिय पदार्थांना अक्षरशः बनवते, खोलीच्या तपमानावर अल्केन्सवर कोणताही प्रभाव पडत नाही. संतृप्त हायड्रोकार्बन्सची तुलनेने कमी प्रतिक्रिया लक्षात घेता, त्यांना एकेकाळी पॅराफिन म्हटले जात असे. अल्केन्समध्ये हायड्रोजन, हॅलोजन आणि इतर अभिकर्मक जोडण्याची क्षमता नसते. म्हणून, सेंद्रिय पदार्थांच्या या वर्गाला संतृप्त हायड्रोकार्बन्स म्हणतात.
संतृप्त हायड्रोकार्बन्सच्या रासायनिक अभिक्रिया $C-C$ किंवा $C-H$ बंधांच्या विघटनामुळे होऊ शकतात. $C-H$ बॉण्ड्सचे तुटणे हे हायड्रोजन अणूंच्या उच्चाटनासह असंतृप्त संयुगे तयार होण्यासोबत किंवा इतर अणू किंवा अणूंच्या गटांद्वारे हायड्रोजन अणूंच्या निर्मूलनाच्या नंतरच्या बदलीसह आहे.
अल्केनच्या संरचनेवर आणि संतृप्त हायड्रोकार्बन्सच्या रेणूंमधील प्रतिक्रिया परिस्थितीवर अवलंबून, $C-H$ बाँड समलैंगिकरित्या तोडले जाऊ शकते:

आकृती 4. अल्केन्सचे रासायनिक गुणधर्म
आणि anions आणि cations निर्मिती सह heterolytic:
आकृती 5. अल्केनचे रासायनिक गुणधर्म
या प्रकरणात, मुक्त रॅडिकल्स तयार केले जाऊ शकतात ज्यात जोडलेले इलेक्ट्रॉन नसतात, परंतु विद्युत शुल्क नसतात, किंवा कार्बोकेशन्स किंवा कार्बेनियन्स नसतात, ज्यांचे संबंधित विद्युत शुल्क असते. रेडिकल मेकॅनिझमच्या प्रतिक्रियांमध्ये फ्री रॅडिकल्स मध्यवर्ती कण म्हणून तयार होतात, आणि कार्बोकेशन्स आणि कार्बनियन्स - आयनिक यंत्रणेच्या प्रतिक्रियांमध्ये.
$C-C$ बॉन्ड्स नॉन-ध्रुवीय आहेत आणि $C-H$ बॉन्ड्स कमी-ध्रुवीय आहेत आणि या $\sigma $-बॉन्ड्समध्ये कमी ध्रुवीकरणक्षमता असल्यामुळे, अल्केन रेणूंमध्ये $\sigma $-बॉन्ड्सची हेटरोलाइटिक क्लीवेज तयार होते. आयनांना भरपूर ऊर्जा लागते. या बंधांच्या हेमोलाइटिक क्लीव्हेजसाठी कमी ऊर्जा लागते. म्हणून, संतृप्त हायड्रोकार्बन्ससाठी, मूलगामी यंत्रणेद्वारे होणाऱ्या प्रतिक्रिया अधिक वैशिष्ट्यपूर्ण असतात. $\sigma $-बॉन्ड $C-C$ च्या विभाजनासाठी $C-H$ बाँडच्या विभाजनापेक्षा कमी ऊर्जा लागते, कारण $C-C$ बाँडची ऊर्जा $C-H$ बाँडच्या ऊर्जेपेक्षा कमी असते. तथापि, रासायनिक अभिक्रियांमध्ये अधिक वेळा $C-H$ बॉन्ड्सचे विघटन होते, कारण ते अभिकर्मकांसाठी अधिक प्रवेशयोग्य असतात.
त्यांच्या प्रतिक्रियाशीलतेवर अल्केन्सच्या शाखा आणि आकाराचा प्रभाव
$C-H$ बाँडची रिऍक्टिव्हिटी एका रेषीय रचना असलेल्या अल्केन्सपासून ब्रँच्ड स्ट्रक्चरसह अल्केनमध्ये संक्रमण झाल्यावर बदलते. उदाहरणार्थ, मुक्त रॅडिकल्सच्या निर्मितीदरम्यान $C-H$ बाँड (kJ/mol) ची पृथक्करण ऊर्जा खालीलप्रमाणे बदलते:

आकृती 6. अल्केन्सचे रासायनिक गुणधर्म
याव्यतिरिक्त, अल्केनसाठी आयनीकरण ऊर्जा (IE) चे मूल्य असे दर्शविते की $\sigma $-बॉन्डच्या एकूण संख्येत वाढ झाल्याने त्यांचे दाता गुणधर्म वाढतात आणि उच्च आण्विक वजन असलेल्या संयुगांसाठी इलेक्ट्रॉन काढणे सोपे होते, उदाहरणार्थ :
आकृती 7. अल्केनचे रासायनिक गुणधर्म
म्हणून, मुक्त रॅडिकल प्रक्रियेमध्ये, प्रतिक्रिया प्रामुख्याने तृतीयक कार्बन अणूवर, नंतर दुय्यम अणूवर आणि शेवटी प्राथमिक अणूवर होतात, जी मुक्त रॅडिकल्सच्या स्थिरतेच्या मालिकेशी जुळते. तथापि, वाढत्या तापमानासह, साजरा केलेला कल कमी होतो किंवा पूर्णपणे समतल होतो.
अशा प्रकारे, अल्केन्स दोन प्रकारच्या रासायनिक अभिक्रियांद्वारे दर्शविले जातात:
- हायड्रोजन प्रतिस्थापन, प्रामुख्याने मूलगामी यंत्रणा आणि
- $C-C$ किंवा $C-H$ बॉन्ड्सच्या मागे रेणूचे विघटन.
अल्केनेस :
अल्केन्स हे संतृप्त हायड्रोकार्बन्स आहेत, ज्याच्या रेणूंमध्ये सर्व अणू एकल बंधांनी जोडलेले आहेत. सुत्र -
भौतिक गुणधर्म :
- आण्विक वजन आणि कार्बन पाठीचा कणा लांबी सह वितळणे आणि उकळत्या बिंदू वाढतात
- सामान्य परिस्थितीत, CH 4 ते C 4 H 10 पर्यंत शाखा नसलेले अल्केन हे वायू आहेत; C 5 H 12 पासून C 13 H 28 पर्यंत - द्रव; C 14 H 30 नंतर - घन पदार्थ.
- वितळणे आणि उकळण्याचे बिंदू कमी फांद्यापासून अधिक फांद्यापर्यंत कमी होतात. तर, उदाहरणार्थ, 20 °C वर n-पेंटेन एक द्रव आहे आणि निओपेंटेन एक वायू आहे.
रासायनिक गुणधर्म:
· हॅलोजनेशन
ही प्रतिस्थापन प्रतिक्रियांपैकी एक आहे. सर्वात कमी हायड्रोजनेटेड कार्बन अणू प्रथम हॅलोजनेटेड असतो (तृतीय अणू, नंतर दुय्यम, प्राथमिक अणू शेवटी हॅलोजनेटेड असतात). अल्केनचे हॅलोजनेशन टप्प्याटप्प्याने होते - एका टप्प्यात एकापेक्षा जास्त हायड्रोजन अणू बदलले जात नाहीत:
- CH 4 + Cl 2 → CH 3 Cl + HCl (क्लोरोमेथेन)
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (डायक्लोरोमेथेन)
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (ट्रायक्लोरोमेथेन)
- CHCl 3 + Cl 2 → CCl 4 + HCl (कार्बन टेट्राक्लोराइड).
प्रकाशाच्या प्रभावाखाली, क्लोरीनचा रेणू रॅडिकल्समध्ये मोडतो, नंतर ते अल्केन रेणूंवर हल्ला करतात, त्यांच्यापासून हायड्रोजन अणू काढून घेतात, परिणामी मिथाइल रेडिकल सीएच 3 तयार होतात, जे क्लोरीन रेणूंशी टक्कर देतात, त्यांचा नाश करतात आणि तयार होतात. नवीन मूलगामी.
· ज्वलन
संतृप्त हायड्रोकार्बन्सची मुख्य रासायनिक मालमत्ता, जी इंधन म्हणून त्यांचा वापर निर्धारित करते, ही दहन प्रतिक्रिया आहे. उदाहरण:
CH 4 + 2O 2 → CO 2 + 2H 2 O + प्र
ऑक्सिजनच्या कमतरतेच्या बाबतीत, कार्बन डायऑक्साइड (ऑक्सिजनच्या एकाग्रतेवर अवलंबून) ऐवजी कार्बन मोनोऑक्साइड किंवा कोळसा तयार होतो.
सर्वसाधारणपणे, अल्केन्सची ज्वलन प्रतिक्रिया खालीलप्रमाणे लिहिली जाऊ शकते:
सह nएच 2 n +2 +(1,5n+0.5)O 2 = n CO 2 + ( n+1)H 2 O
· कुजणे
विघटन प्रतिक्रिया केवळ उच्च तापमानाच्या प्रभावाखालीच होते. तापमानात वाढ झाल्यामुळे कार्बन बंध तुटतात आणि मुक्त रॅडिकल्स तयार होतात.
उदाहरणे:
CH 4 → C + 2H 2 (t > 1000 °C)
C 2 H 6 → 2C + 3H 2
अल्केनेस :
अल्केन्स हे असंतृप्त हायड्रोकार्बन्स असतात ज्यात एकल बंध, एक कार्बन-कार्बन दुहेरी फॉर्म्युला - C n H 2n असतो
हायड्रोकार्बनचा अल्केन्सच्या वर्गाशी संबंध त्याच्या नावातील जेनेरिक प्रत्यय –ene द्वारे परावर्तित होतो.
भौतिक गुणधर्म :
- आण्विक वजन आणि कार्बन पाठीचा कणा लांबी सह alkenes (सरलीकृत) वितळणे आणि उकळत्या बिंदू वाढते.
- सामान्य परिस्थितीत, C 2 H 4 ते C 4 H 8 पर्यंतचे अल्केन्स वायू असतात; C 5 H 10 पासून C 17 H 34 पर्यंत - द्रव, C 18 H 36 नंतर - घन. अल्केन्स पाण्यात अघुलनशील असतात, परंतु सेंद्रिय सॉल्व्हेंट्समध्ये विद्रव्य असतात.
रासायनिक गुणधर्म :
· निर्जलीकरणसेंद्रिय संयुगाच्या रेणूपासून पाण्याचे रेणू विभाजित करण्याची प्रक्रिया आहे.
· पॉलिमरायझेशनकमी आण्विक वजनाच्या पदार्थाचे अनेक प्रारंभिक रेणू मोठ्या पॉलिमर रेणूंमध्ये एकत्रित करण्याची रासायनिक प्रक्रिया आहे.
पॉलिमरएक उच्च-आण्विक संयुग आहे ज्याच्या रेणूंमध्ये अनेक समान संरचनात्मक एकके असतात.
अल्केडियन्स :
अल्काडियन्स हे असंतृप्त हायड्रोकार्बन्स असतात ज्यात एकल बंध, दुहेरी कार्बन-कार्बन बंध - फॉर्म्युला असतात.
. Dienes alkynes च्या संरचनात्मक isomers आहेत.भौतिक गुणधर्म :
बुटाडीन हा एक वायू आहे (उकळणारा बिंदू −4.5 °C), आयसोप्रीन एक द्रव आहे जो 34 °C वर उकळतो, डायमिथाइलबुटाडियन एक द्रव आहे जो 70 °C वर उकळतो. आयसोप्रीन आणि इतर डायन हायड्रोकार्बन्स रबरमध्ये पॉलिमरायझिंग करण्यास सक्षम आहेत. शुद्ध अवस्थेतील नैसर्गिक रबर हे सामान्य सूत्र (C5H8)n असलेले पॉलिमर आहे आणि ते काही उष्णकटिबंधीय वनस्पतींच्या दुधाच्या रसापासून मिळते.
रबर हे बेंझिन, गॅसोलीन आणि कार्बन डायसल्फाइडमध्ये अत्यंत विरघळणारे असते. कमी तापमानात गरम केल्यावर ते ठिसूळ आणि चिकट होते. रबराचे यांत्रिक आणि रासायनिक गुणधर्म सुधारण्यासाठी, व्हल्कनीकरणाद्वारे त्याचे रबरमध्ये रूपांतर केले जाते. रबर उत्पादने मिळविण्यासाठी, ते प्रथम सल्फर, तसेच फिलरसह रबरच्या मिश्रणातून तयार केले जातात: काजळी, खडू, चिकणमाती आणि काही सेंद्रिय संयुगे जे व्हल्कनीकरणास गती देतात. नंतर उत्पादने गरम केली जातात - गरम व्हल्कनाइझेशन. व्हल्कनाइझेशन दरम्यान, सल्फर रासायनिकरित्या रबराशी जोडले जाते. याव्यतिरिक्त, व्हल्कनाइज्ड रबरमध्ये लहान कणांच्या स्वरूपात मुक्त स्थितीत सल्फर असते.
डायने हायड्रोकार्बन्स सहजपणे पॉलिमराइज करतात. डायन हायड्रोकार्बन्सची पॉलिमरायझेशन प्रतिक्रिया रबरच्या संश्लेषणास अधोरेखित करते. ते अतिरिक्त प्रतिक्रियांमधून जातात (हायड्रोजनेशन, हॅलोजनेशन, हायड्रोहॅलोजनेशन):
H 2 C=CH-CH=CH 2 + H 2 -> H 3 C-CH=CH-CH 3
अल्काइन्स :
अल्काइन्स हे असंतृप्त हायड्रोकार्बन्स आहेत ज्यांच्या रेणूंमध्ये एकल बंधाव्यतिरिक्त, एक तिहेरी कार्बन-कार्बन बंध असतो
भौतिक गुणधर्म :
अल्काइन्स त्यांच्या भौतिक गुणधर्मांमध्ये संबंधित अल्केन्ससारखे दिसतात. खालच्या (C 4 पर्यंत) रंगहीन आणि गंधहीन वायू असतात ज्यांचे उकळण्याचे बिंदू अल्केन्समधील त्यांच्या ॲनालॉग्सपेक्षा जास्त असतात.
अल्काइन्स पाण्यात कमी विरघळणारे असतात, परंतु सेंद्रिय सॉल्व्हेंट्समध्ये चांगले असतात.
रासायनिक गुणधर्म :
हॅलोजनेशन प्रतिक्रिया
संबंधित हॅलोजन डेरिव्हेटिव्ह तयार करण्यासाठी अल्काइन्स एक किंवा दोन हॅलोजन रेणू जोडण्यास सक्षम आहेत:
हायड्रेशन
पारा क्षारांच्या उपस्थितीत, अल्काइन्स पाणी घालून एसीटाल्डिहाइड (ॲसिटिलीनसाठी) किंवा केटोन (इतर अल्काइन्ससाठी) तयार करतात.

संतृप्त हायड्रोकार्बन्स ही संयुगे असतात जी sp 3 संकरित अवस्थेत कार्बन अणूंचा समावेश असलेले रेणू असतात. ते केवळ सहसंयोजक सिग्मा बाँडद्वारे एकमेकांशी जोडलेले आहेत. "संतृप्त" किंवा "संतृप्त" हायड्रोकार्बन्स हे नाव या संयुगेमध्ये कोणतेही अणू जोडण्याची क्षमता नसल्यामुळे आले आहे. ते अत्यंत, पूर्णपणे संतृप्त आहेत. अपवाद म्हणजे सायक्लोअल्केन्स.
अल्केन्स म्हणजे काय?
अल्केन्स हे संतृप्त हायड्रोकार्बन्स आहेत आणि त्यांची कार्बन साखळी खुली आहे आणि त्यात एकल बंध वापरून एकमेकांशी जोडलेले कार्बन अणू असतात. त्यात इतर (म्हणजे अल्केन्ससारखे दुहेरी, किंवा तिप्पट, अल्किलसारखे) बंध नसतात. अल्केन्सला पॅराफिन देखील म्हणतात. त्यांना हे नाव मिळाले कारण सुप्रसिद्ध पॅराफिन हे प्रामुख्याने या संतृप्त हायड्रोकार्बन्स C 18 -C 35 चे विशिष्ट जडत्व असलेले मिश्रण आहे.
अल्केन्स आणि त्यांच्या रॅडिकल्सबद्दल सामान्य माहिती
त्यांचे सूत्र: C n P 2 n +2, येथे n हे 1 पेक्षा मोठे किंवा समान आहे. मोलर वस्तुमान हे सूत्र वापरून मोजले जाते: M = 14n + 2. वैशिष्ट्यपूर्ण वैशिष्ट्य: त्यांच्या नावांचे शेवट “-an” आहेत. त्यांच्या रेणूंचे अवशेष, जे हायड्रोजन अणूंच्या इतर अणूंच्या बदलीमुळे तयार होतात, त्यांना ॲलिफॅटिक रेडिकल किंवा अल्किल म्हणतात. त्यांना R या अक्षराने नियुक्त केले आहे. मोनोव्हॅलेंट ॲलिफॅटिक रॅडिकल्सचे सामान्य सूत्र: C n P 2 n +1, येथे n हे 1 पेक्षा मोठे किंवा समान आहे. ॲलिफॅटिक रॅडिकल्सचे मोलर वस्तुमान सूत्रानुसार मोजले जाते: M = 14n + 1. ॲलिफॅटिक रॅडिकल्सचे वैशिष्ट्यपूर्ण वैशिष्ट्य: "- गाळ" या नावांचा शेवट. अल्केन रेणूंची स्वतःची संरचनात्मक वैशिष्ट्ये आहेत:
- C-C बाँड 0.154 nm लांबीने वैशिष्ट्यीकृत आहे;
- C-H बाँड 0.109 nm लांबीने वैशिष्ट्यीकृत आहे;
- बाँड अँगल (कार्बन-कार्बन बाँडमधील कोन) 109 अंश आणि 28 मिनिटे आहे.

अल्केनेस एकसंध मालिका सुरू करतात: मिथेन, इथेन, प्रोपेन, ब्युटेन इ.
अल्केनचे भौतिक गुणधर्म
अल्केन्स हे पदार्थ रंगहीन आणि पाण्यात अघुलनशील असतात. ज्या तापमानात अल्केन वितळू लागतात आणि ज्या तापमानात ते उकळतात ते तापमान आण्विक वजन आणि हायड्रोकार्बन साखळीच्या लांबीच्या वाढीनुसार वाढते. कमी फांद्यापासून ते अधिक फांद्या असलेल्या अल्केनपर्यंत, उकळण्याचे आणि वितळण्याचे बिंदू कमी होतात. वायूयुक्त अल्केन फिकट निळ्या किंवा रंगहीन ज्वालाने जळू शकतात आणि भरपूर उष्णता निर्माण करू शकतात. CH 4 -C 4 H 10 हे वायू आहेत ज्यांना गंधही नाही. C 5 H 12 -C 15 H 32 हे विशिष्ट गंध असलेले द्रव आहेत. C 15 H 32 आणि असेच घन पदार्थ आहेत जे गंधहीन आहेत.
अल्केनचे रासायनिक गुणधर्म
हे संयुगे रासायनिकदृष्ट्या निष्क्रिय आहेत, ज्याचे स्पष्टीकरण कठीण-टू-ब्रेक सिग्मा बाँड्स - C-C आणि C-H च्या सामर्थ्याने केले जाऊ शकते. हे देखील विचारात घेण्यासारखे आहे की सी-सी बॉण्ड्स नॉन-ध्रुवीय आहेत आणि सी-एच बॉन्ड कमी-ध्रुवीय आहेत. हे सिग्मा प्रकाराशी संबंधित कमी-ध्रुवीकृत प्रकारचे बंध आहेत आणि त्यानुसार, ते होमोलाइटिक यंत्रणेद्वारे तोडले जाण्याची शक्यता आहे, परिणामी रेडिकल तयार होतील. अशाप्रकारे, अल्केन्सचे रासायनिक गुणधर्म प्रामुख्याने मूलगामी प्रतिस्थापन प्रतिक्रियांपुरते मर्यादित आहेत.

नायट्रेशन प्रतिक्रिया
अल्केनेस केवळ 10% च्या एकाग्रतेसह नायट्रिक ऍसिडसह किंवा 140 डिग्री सेल्सिअस तापमानात वायू वातावरणात टेट्राव्हॅलेंट नायट्रोजन ऑक्साईडसह प्रतिक्रिया देतात. अल्केन्सच्या नायट्रेशन प्रतिक्रियाला कोनोव्हालोव्ह प्रतिक्रिया म्हणतात. परिणामी, नायट्रो संयुगे आणि पाणी तयार होतात: CH 4 + नायट्रिक ऍसिड (पातळ) = CH 3 - NO 2 (नायट्रोमेथेन) + पाणी.
ज्वलन प्रतिक्रिया
संतृप्त हायड्रोकार्बन्स बऱ्याचदा इंधन म्हणून वापरले जातात, जे त्यांच्या बर्न करण्याच्या क्षमतेद्वारे न्याय्य आहे: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
ऑक्सिडेशन प्रतिक्रिया
अल्केनच्या रासायनिक गुणधर्मांमध्ये ऑक्सिडायझेशन करण्याची क्षमता देखील समाविष्ट आहे. प्रतिक्रियेसह कोणत्या परिस्थिती येतात आणि त्या कशा बदलल्या जातात यावर अवलंबून, एकाच पदार्थापासून भिन्न अंतिम उत्पादने मिळवता येतात. उत्प्रेरकाच्या उपस्थितीत ऑक्सिजनसह मिथेनचे सौम्य ऑक्सीकरण आणि सुमारे 200 डिग्री सेल्सिअस तापमान खालील पदार्थांना कारणीभूत ठरू शकते:
1) 2CH 4 (ऑक्सिजनसह ऑक्सीकरण) = 2CH 3 OH (अल्कोहोल - मिथेनॉल).
2) CH 4 (ऑक्सिजनसह ऑक्सिडेशन) = CH 2 O (अल्डिहाइड - मिथेनल किंवा फॉर्मल्डिहाइड) + H 2 O.
3) 2CH 4 (ऑक्सिजनसह ऑक्सीकरण) = 2HCOOH (कार्बोक्झिलिक ऍसिड - मिथेन किंवा फॉर्मिक) + 2H 2 O.

तसेच, अल्केनचे ऑक्सिडेशन हवेसह वायू किंवा द्रव माध्यमात केले जाऊ शकते. अशा प्रतिक्रियांमुळे उच्च फॅटी अल्कोहोल आणि संबंधित ऍसिड तयार होतात.
उष्णतेशी संबंध
+150-250°C पेक्षा जास्त नसलेल्या तापमानात, नेहमी उत्प्रेरकाच्या उपस्थितीत, सेंद्रिय पदार्थांची संरचनात्मक पुनर्रचना होते, ज्यामध्ये अणूंच्या कनेक्शनच्या क्रमात बदल होतो. या प्रक्रियेला आयसोमरायझेशन म्हणतात आणि प्रतिक्रियेमुळे निर्माण होणाऱ्या पदार्थांना आयसोमर म्हणतात. अशा प्रकारे, सामान्य ब्युटेनपासून, त्याचे आयसोमर मिळते - आयसोब्युटेन. 300-600°C तापमानात आणि उत्प्रेरकाच्या उपस्थितीत, C-H बंध हायड्रोजन रेणूंच्या निर्मितीसह (डिहायड्रोजनेशन प्रतिक्रिया), हायड्रोजन रेणू एका चक्रात कार्बन साखळी बंद झाल्यामुळे तुटतात (अल्केनचे चक्रीकरण किंवा सुगंधीकरण प्रतिक्रिया) :
1) 2CH 4 = C 2 H 4 (ethene) + 2H 2.
2) 2CH 4 = C 2 H 2 (इथिन) + 3H 2.
3) C 7 H 16 (सामान्य हेप्टेन) = C 6 H 5 - CH 3 (टोल्यूनि) + 4 H 2.

हॅलोजनेशन प्रतिक्रिया
अशा प्रतिक्रियांमध्ये सेंद्रिय पदार्थाच्या रेणूमध्ये हॅलोजनचा (त्यांचे अणू) परिचय समाविष्ट असतो, परिणामी सी-हॅलोजन बाँड तयार होतो. जेव्हा अल्केन्स हॅलोजनसह प्रतिक्रिया देतात तेव्हा हॅलोजन डेरिव्हेटिव्ह तयार होतात. या प्रतिक्रियेची विशिष्ट वैशिष्ट्ये आहेत. हे मूलगामी यंत्रणेनुसार पुढे जाते आणि ते सुरू करण्यासाठी, हॅलोजन आणि अल्केनचे मिश्रण अल्ट्राव्हायोलेट किरणोत्सर्गात उघड करणे किंवा फक्त गरम करणे आवश्यक आहे. अल्केनचे गुणधर्म हॅलोजन अणूंसह पूर्ण बदली होईपर्यंत हॅलोजनेशन प्रतिक्रिया पुढे चालू ठेवण्याची परवानगी देतात. म्हणजेच, मिथेनचे क्लोरीनेशन एका टप्प्यात संपणार नाही आणि मिथाइल क्लोराईडचे उत्पादन. प्रतिक्रिया पुढे जाईल, क्लोरोमेथेनपासून सुरू होणारी आणि कार्बन टेट्राक्लोराईडसह समाप्त होणारी सर्व संभाव्य प्रतिस्थापन उत्पादने तयार होतील. या परिस्थितीत इतर अल्केनच्या क्लोरीनच्या संपर्कात आल्याने विविध कार्बन अणूंमध्ये हायड्रोजनच्या प्रतिस्थापनामुळे विविध उत्पादने तयार होतील. ज्या तापमानावर प्रतिक्रिया येते ते अंतिम उत्पादनांचे गुणोत्तर आणि त्यांच्या निर्मितीचा दर ठरवेल. अल्केनची हायड्रोकार्बन साखळी जितकी लांब असेल तितकी प्रतिक्रिया सुलभ होईल. हॅलोजनेशन दरम्यान, कमीत कमी हायड्रोजनेटेड (तृतीय) कार्बन अणू प्रथम बदलला जाईल. इतर सर्वांनंतर प्राथमिक प्रतिक्रिया देईल. हॅलोजनेशन प्रतिक्रिया टप्प्याटप्प्याने होईल. पहिल्या टप्प्यात, फक्त एक हायड्रोजन अणू बदलला जातो. अल्केनेस हॅलोजन द्रावणाशी (क्लोरीन आणि ब्रोमिन पाणी) संवाद साधत नाहीत.

सल्फोक्लोरीनेशन प्रतिक्रिया
अल्केन्सचे रासायनिक गुणधर्म देखील सल्फोक्लोरीनेशन अभिक्रियाने पूरक आहेत (ज्याला रीड प्रतिक्रिया म्हणतात). अल्ट्राव्हायोलेट किरणोत्सर्गाच्या संपर्कात असताना, अल्केन क्लोरीन आणि सल्फर डायऑक्साइडच्या मिश्रणासह प्रतिक्रिया करण्यास सक्षम असतात. परिणामी, हायड्रोजन क्लोराईड तयार होते, तसेच अल्काइल रॅडिकल, जे सल्फर डायऑक्साइड जोडते. परिणामी एक जटिल संयुग आहे जो क्लोरीन अणूच्या कॅप्चरमुळे आणि त्याच्या पुढील रेणूच्या नाशामुळे स्थिर होतो: R-H + SO 2 + Cl 2 + अल्ट्राव्हायोलेट विकिरण = R-SO 2 Cl + HCl. प्रतिक्रियेच्या परिणामी तयार होणारे सल्फोनिल क्लोराईड सर्फॅक्टंट्सच्या उत्पादनात मोठ्या प्रमाणावर वापरले जातात.
अल्केन्सचा वापर खूप वैविध्यपूर्ण आहे - ते इंधन म्हणून वापरले जातात, तसेच यांत्रिकी, औषध इ. आधुनिक माणसाच्या जीवनात या रासायनिक संयुगेची भूमिका क्वचितच जास्त मोजली जाऊ शकत नाही.
अल्केनेस: गुणधर्म आणि संक्षिप्त वर्णन
अल्केन हे चक्रीय कार्बन नसलेले संयुगे आहेत ज्यात कार्बन अणू साध्या संतृप्त बंधांनी जोडलेले असतात. हे पदार्थ विशिष्ट गुणधर्म आणि वैशिष्ट्यांसह संपूर्ण श्रेणीचे प्रतिनिधित्व करतात. पुढीलप्रमाणे:
N येथे कार्बन अणूंची संख्या दर्शवते. उदाहरणार्थ, CH3, C2H6.
अल्केन्स मालिकेतील पहिले चार प्रतिनिधी वायू पदार्थ आहेत: मिथेन, इथेन, प्रोपेन आणि ब्युटेन. खालील संयुगे (C5 ते C17) द्रव आहेत. ही मालिका अशा संयुगांसह चालू राहते जी सामान्य परिस्थितीत घन असतात.
रासायनिक गुणधर्मांबद्दल, अल्केन कमी-सक्रिय आहेत - ते व्यावहारिकपणे अल्कली आणि ऍसिडशी संवाद साधत नाहीत. तसे, हे रासायनिक गुणधर्म आहेत जे अल्केन्सचा वापर निर्धारित करतात.
तथापि, ही संयुगे हायड्रोजन अणूंच्या बदली, तसेच आण्विक विभाजन प्रक्रियेसह काही विशिष्ट प्रतिक्रियांद्वारे दर्शविले जातात.
- सर्वात वैशिष्ट्यपूर्ण प्रतिक्रिया म्हणजे हॅलोजनेशन, ज्यामध्ये हायड्रोजन अणू हॅलोजनद्वारे बदलले जातात. या संयुगांच्या क्लोरीनेशन आणि ब्रोमिनेशन प्रतिक्रियांना खूप महत्त्व आहे.
- नायट्रेशन म्हणजे डायल्युट (10% एकाग्रता) सह प्रतिक्रिया दरम्यान हायड्रोजन अणूला नायट्रो ग्रुपसह बदलणे सामान्य परिस्थितीत, अल्केन्स ऍसिडसह प्रतिक्रिया देत नाहीत. अशी प्रतिक्रिया पार पाडण्यासाठी, 140 डिग्री सेल्सियस तापमान आवश्यक आहे.
- ऑक्सिडेशन - सामान्य परिस्थितीत, अल्केनवर ऑक्सिजनचा परिणाम होत नाही. तथापि, हवेत प्रज्वलन केल्यानंतर, हे पदार्थ अंतिम उत्पादनांमध्ये प्रवेश करतात ज्यापैकी पाणी आणि
- क्रॅकिंग - ही प्रतिक्रिया केवळ आवश्यक उत्प्रेरकांच्या उपस्थितीतच होते. या प्रक्रियेमध्ये कार्बन अणूंमधील स्थिर होमोलोगस बंधांचे विघटन समाविष्ट असते. उदाहरणार्थ, जेव्हा ब्युटेन क्रॅक होते तेव्हा प्रतिक्रिया इथेन आणि इथिलीन तयार करू शकते.
- आयसोमेरायझेशन - विशिष्ट उत्प्रेरकांच्या कृतीचा परिणाम म्हणून, अल्केनच्या कार्बन कंकालची काही पुनर्रचना शक्य आहे.
अल्केन्सचे अनुप्रयोग
या पदार्थांचे मुख्य नैसर्गिक स्त्रोत नैसर्गिक वायू आणि तेल सारख्या मौल्यवान उत्पादने आहेत. आज अल्केन वापरण्याचे क्षेत्र खूप विस्तृत आणि विविध आहेत.
उदाहरणार्थ, वायू पदार्थ इंधनाचा मौल्यवान स्त्रोत म्हणून वापरला जातो. एक उदाहरण म्हणजे मिथेन, ज्याचा नैसर्गिक वायू बनलेला आहे, तसेच प्रोपेन-ब्युटेन मिश्रण आहे.
अल्केन्सचा आणखी एक स्त्रोत आहे तेल आधुनिक मानवतेसाठी ज्याचे महत्त्व जास्त सांगणे कठीण आहे. पेट्रोलियम उत्पादनांमध्ये हे समाविष्ट आहे:
- गॅसोलीन - इंधन म्हणून वापरले;
- रॉकेल;
- डिझेल इंधन किंवा हलके वायू तेल;
- हेवी गॅस तेल, जे वंगण तेल म्हणून वापरले जाते;
- अवशेष डांबर तयार करण्यासाठी वापरले जातात.
पेट्रोलियम उत्पादनांचा वापर प्लास्टिक, सिंथेटिक फायबर, रबर आणि काही डिटर्जंट्स तयार करण्यासाठी देखील केला जातो.
व्हॅसलीन आणि पेट्रोलियम जेली ही उत्पादने आहेत ज्यात अल्केनचे मिश्रण असते. ते औषध आणि कॉस्मेटोलॉजीमध्ये (प्रामुख्याने मलम आणि क्रीम तयार करण्यासाठी), तसेच सुगंधी द्रव्यांमध्ये वापरले जातात.
पॅराफिन हे आणखी एक प्रसिद्ध उत्पादन आहे, जे घन अल्केन्सचे मिश्रण आहे. हे एक घन पांढरे वस्तुमान आहे, ज्याचे गरम तापमान 50 - 70 अंश आहे. आधुनिक उत्पादनात, मेणबत्त्या तयार करण्यासाठी पॅराफिनचा वापर केला जातो. सामने समान पदार्थ सह impregnated आहेत. औषधांमध्ये, पॅराफिन वापरून विविध थर्मल प्रक्रिया केल्या जातात.
अल्केन्स संकल्पनेच्या व्याख्येसह प्रारंभ करणे उपयुक्त ठरेल. हे संतृप्त किंवा संतृप्त आहेत असे आपण असेही म्हणू शकतो की हे कार्बन आहेत ज्यात सी अणूंचे कनेक्शन साध्या बंधांद्वारे केले जाते. सामान्य सूत्र आहे: CnH₂n+ 2.
हे ज्ञात आहे की त्यांच्या रेणूंमधील H आणि C अणूंच्या संख्येचे गुणोत्तर इतर वर्गांच्या तुलनेत जास्तीत जास्त आहे. सर्व व्हॅलेन्स सी किंवा एच द्वारे व्यापलेले असल्यामुळे, अल्केनचे रासायनिक गुणधर्म स्पष्टपणे व्यक्त केले जात नाहीत, म्हणून त्यांचे दुसरे नाव संतृप्त किंवा संतृप्त हायड्रोकार्बन्स आहे.
एक जुने नाव देखील आहे जे त्यांच्या सापेक्ष रासायनिक जडत्वाला उत्तम प्रकारे प्रतिबिंबित करते - पॅराफिन्स, ज्याचा अर्थ "आपुलकी नसलेला."
तर, आज आमच्या संभाषणाचा विषय आहे: "अल्केनेस: समलिंगी मालिका, नामकरण, रचना, आयसोमेरिझम." त्यांच्या भौतिक गुणधर्मांबद्दल डेटा देखील सादर केला जाईल.
अल्केनेस: रचना, नामकरण
त्यांच्यामध्ये, सी अणू sp3 संकरीकरण नावाच्या स्थितीत असतात. या संदर्भात, अल्केन रेणू हे टेट्राहेड्रल सी स्ट्रक्चर्सच्या संचाच्या रूपात प्रदर्शित केले जाऊ शकते जे केवळ एकमेकांशीच नव्हे तर एचशी देखील जोडलेले आहेत.
C आणि H अणूंमध्ये मजबूत, अत्यंत कमी-ध्रुवीय s-बंध असतात. अणू नेहमी साध्या बंधांभोवती फिरतात, म्हणूनच अल्केन रेणू विविध आकार घेतात आणि बाँडची लांबी आणि त्यांच्यामधील कोन ही स्थिर मूल्ये असतात. σ बंधाभोवती रेणूच्या फिरण्यामुळे एकमेकांमध्ये रूपांतरित होणाऱ्या आकारांना सामान्यतः कन्फर्मेशन असे म्हणतात.

प्रश्नातील रेणूपासून H अणूच्या अमूर्ततेच्या प्रक्रियेत, हायड्रोकार्बन रॅडिकल्स नावाच्या 1-व्हॅलेंट प्रजाती तयार होतात. ते केवळ अकार्बनिक संयुगेच नव्हे तर परिणामी देखील दिसतात. जर तुम्ही संतृप्त हायड्रोकार्बन रेणूमधून 2 हायड्रोजन अणू वजा केले तर तुम्हाला 2-व्हॅलेंट रॅडिकल्स मिळतील.
अशा प्रकारे, अल्केनचे नामकरण असे असू शकते:
- रेडियल (जुनी आवृत्ती);
- प्रतिस्थापन (आंतरराष्ट्रीय, पद्धतशीर). हे IUPAC ने प्रस्तावित केले होते.
रेडियल नामकरणाची वैशिष्ट्ये
पहिल्या प्रकरणात, अल्केन्सचे नामकरण खालीलप्रमाणे आहे:
- मिथेनचे डेरिव्हेटिव्ह म्हणून हायड्रोकार्बन्सचा विचार करणे, ज्यामध्ये 1 किंवा अनेक H अणू रॅडिकल्सद्वारे बदलले जातात.
- अतिशय जटिल कनेक्शनच्या बाबतीत उच्च दर्जाची सोय.
प्रतिस्थापन नामांकनाची वैशिष्ट्ये
अल्केन्सच्या पर्यायी नामांकनामध्ये खालील वैशिष्ट्ये आहेत:
- नावाचा आधार 1 कार्बन शृंखला आहे, तर उर्वरित आण्विक तुकड्यांचा पर्याय म्हणून विचार केला जातो.
- जर तेथे अनेक समान मूलगामी असतील, तर संख्या त्यांच्या नावापूर्वी दर्शविली जाते (शब्दांमध्ये काटेकोरपणे), आणि मूलगामी संख्या स्वल्पविरामाने विभक्त केली जातात.
रसायनशास्त्र: अल्केन्सचे नामकरण
सोयीसाठी, माहिती सारणी स्वरूपात सादर केली आहे.
पदार्थाचे नाव | नावाचा आधार (मूळ) | आण्विक सूत्र | कार्बन घटकाचे नाव | कार्बन सबस्टिट्यूंट फॉर्म्युला |
अल्केन्सच्या वरील नामांकनामध्ये ऐतिहासिकदृष्ट्या विकसित झालेल्या नावांचा समावेश आहे (संतृप्त हायड्रोकार्बनच्या मालिकेतील पहिले 4 सदस्य).
5 किंवा अधिक C अणू असलेल्या अविस्तारित अल्केन्सची नावे ग्रीक अंकांवरून घेतली गेली आहेत जी C अणूंची संख्या दर्शवतात अशा प्रकारे, प्रत्यय -an सूचित करतो की पदार्थ संतृप्त संयुगांच्या मालिकेतून आहे.

उलगडलेल्या अल्केन्सची नावे तयार करताना, मुख्य शृंखला अशी असते ज्यामध्ये C अणूंची संख्या सर्वात कमी असते. समान लांबीच्या दोन किंवा अधिक साखळ्यांच्या बाबतीत, मुख्य एक बनते ज्यामध्ये सर्वात जास्त प्रमाणात पर्याय असतात.
अल्केनचे आयसोमेरिझम
त्यांच्या मालिकेतील मूळ हायड्रोकार्बन मिथेन CH₄ आहे. मिथेन मालिकेच्या प्रत्येक त्यानंतरच्या प्रतिनिधीसह, मिथिलीन गट - CH₂ मध्ये मागीलपेक्षा फरक दिसून येतो. अल्केनच्या संपूर्ण मालिकेत हा नमुना शोधला जाऊ शकतो.
जर्मन शास्त्रज्ञ शिएल यांनी या मालिकेला समलिंगी म्हणण्याचा प्रस्ताव मांडला. ग्रीकमधून अनुवादित याचा अर्थ "समान, समान."
अशाप्रकारे, समरूप मालिका ही संबंधित सेंद्रिय संयुगांचा संच आहे ज्याची रचना आणि समान रासायनिक गुणधर्म आहेत. Homologues दिलेल्या मालिकेचे सदस्य आहेत. होमोलोगस फरक हा एक मिथिलीन गट आहे ज्यामध्ये 2 शेजारील समरूप भिन्न आहेत.
आधी सांगितल्याप्रमाणे, कोणत्याही संतृप्त हायड्रोकार्बनची रचना सामान्य सूत्र CnH₂n + 2 वापरून व्यक्त केली जाऊ शकते. अशा प्रकारे, मिथेन नंतर समरूप मालिकेतील पुढील सदस्य इथेन आहे - C₂H₆. त्याची रचना मिथेनपासून रूपांतरित करण्यासाठी, 1 H अणूला CH₃ ने बदलणे आवश्यक आहे (खालील आकृती).

प्रत्येक पुढील होमोलॉगची रचना मागील एकापासून त्याच प्रकारे काढली जाऊ शकते. परिणामी, इथेनपासून प्रोपेन तयार होतो - C₃H₈.
आयसोमर्स म्हणजे काय?
हे असे पदार्थ आहेत ज्यात एकसमान गुणात्मक आणि परिमाणात्मक आण्विक रचना (समान आण्विक सूत्र), परंतु भिन्न रासायनिक रचना आहे आणि भिन्न रासायनिक गुणधर्म देखील आहेत.
वरील चर्चा केलेले हायड्रोकार्बन्स उकळत्या बिंदूसारख्या पॅरामीटरमध्ये भिन्न आहेत: -0.5° - ब्युटेन, -10° - आयसोब्युटेन. या प्रकारच्या आयसोमेरिझमला कार्बन स्केलेटन आयसोमेरिझम म्हणतात ते संरचनात्मक प्रकाराशी संबंधित आहे.
कार्बन अणूंची संख्या वाढत असताना संरचनात्मक आयसोमर्सची संख्या वेगाने वाढते. अशाप्रकारे, C₁₀H₂₂ 75 isomers (स्थानिक समाविष्ट नाही) शी संबंधित असेल आणि C₁₅H₃₂ साठी 4347 isomers आधीच ज्ञात आहेत, C₂₀H₄₂ - 366,319 साठी.
तर, हे आधीच स्पष्ट झाले आहे की अल्केनेस म्हणजे काय, समरूप मालिका, आयसोमेरिझम, नामकरण. आता IUPAC नुसार नावे संकलित करण्याच्या नियमांकडे जाणे योग्य आहे.

IUPAC नामकरण: नावे तयार करण्याचे नियम
प्रथम, हायड्रोकार्बनच्या संरचनेत कार्बन साखळी शोधणे आवश्यक आहे जी सर्वात लांब आहे आणि त्यात जास्तीत जास्त घटक आहेत. मग तुम्हाला साखळीच्या सी अणूंची संख्या करणे आवश्यक आहे, ज्याच्या टोकापासून पर्याय सर्वात जवळ आहे.
दुसरे म्हणजे, बेस हे शाखा नसलेल्या संतृप्त हायड्रोकार्बनचे नाव आहे, जे C अणूंच्या संख्येच्या बाबतीत, मुख्य साखळीशी संबंधित आहे.
तिसरे म्हणजे, बेसच्या आधी ज्या स्थानाजवळ पर्याय आहेत त्यांची संख्या सूचित करणे आवश्यक आहे. पर्यायांची नावे त्यांच्या नंतर हायफनने लिहिली जातात.
चौथे, वेगवेगळ्या C अणूंमध्ये एकसारखे घटक असल्यास, लोकंट एकत्र केले जातात आणि नावापुढे गुणाकार उपसर्ग दिसतो: di - दोन समान घटकांसाठी, तीन - तीनसाठी, टेट्रा - चार, पेंटा - पाचसाठी , इ. संख्या एकमेकांपासून स्वल्पविरामाने आणि शब्दांपासून हायफनने विभक्त करणे आवश्यक आहे.
जर एकाच C अणूमध्ये एकाच वेळी दोन घटक असतील तर लोकंट देखील दोनदा लिहिला जातो.
या नियमांनुसार, अल्केनेसचे आंतरराष्ट्रीय नामकरण तयार होते.

न्यूमन अंदाज
या अमेरिकन शास्त्रज्ञाने कॉन्फॉर्मेशन्सच्या ग्राफिकल प्रात्यक्षिकासाठी विशेष प्रोजेक्शन सूत्र प्रस्तावित केले - न्यूमन अंदाज. ते फॉर्म A आणि B शी संबंधित आहेत आणि खालील आकृतीमध्ये सादर केले आहेत.

पहिल्या प्रकरणात, हे A-अवरोधित रचना आहे आणि दुसऱ्या बाबतीत, ते B-प्रतिबंधित रचना आहे. स्थिती A मध्ये, H अणू एकमेकांपासून कमीत कमी अंतरावर असतात. हा फॉर्म सर्वोच्च उर्जा मूल्याशी संबंधित आहे, कारण त्यांच्यामधील प्रतिकर्षण सर्वात जास्त आहे. ही एक उत्साही प्रतिकूल स्थिती आहे, ज्याचा परिणाम म्हणून रेणू ते सोडून अधिक स्थिर स्थिती B मध्ये जाण्यास प्रवृत्त होतो. येथे H अणू एकमेकांपासून शक्य तितक्या दूर आहेत. अशा प्रकारे, या पोझिशन्समधील उर्जेचा फरक 12 kJ/mol आहे, ज्यामुळे इथेन रेणूमधील अक्षाभोवती मुक्त रोटेशन, जे मिथाइल गटांना जोडते, असमान आहे. उत्साही अनुकूल स्थितीत प्रवेश केल्यानंतर, रेणू तिथे रेंगाळतो, दुसऱ्या शब्दांत, "मंद होतो." म्हणूनच त्याला प्रतिबंधित म्हणतात. याचा परिणाम असा होतो की 10 हजार इथेन रेणू खोलीच्या तपमानावर प्रतिबंधित स्वरूपात असतात. फक्त एक वेगळा आकार आहे - अस्पष्ट.
संतृप्त हायड्रोकार्बन्स प्राप्त करणे
लेखावरून हे आधीच ज्ञात झाले आहे की हे अल्केन आहेत (त्यांची रचना आणि नामकरण आधी तपशीलवार वर्णन केले होते). ते मिळविण्याचे मार्ग विचारात घेणे उपयुक्त ठरेल. ते तेल, नैसर्गिक आणि कोळसा यांसारख्या नैसर्गिक स्त्रोतांपासून सोडले जातात. सिंथेटिक पद्धती देखील वापरल्या जातात. उदाहरणार्थ, H₂ 2H₂:
- हायड्रोजनेशन प्रक्रिया CnH₂n (alkenes)→ CnH₂n+2 (alkanes)← CnH₂n-2 (alkynes).
- C आणि H मोनोऑक्साइडच्या मिश्रणातून - संश्लेषण वायू: nCO+(2n+1)H₂→ CnH₂n+2+nH₂O.
- कार्बोक्झिलिक ऍसिडपासून (त्यांचे क्षार): एनोडवर इलेक्ट्रोलिसिस, कॅथोडवर:
- कोल्बे इलेक्ट्रोलिसिस: 2RCOONa+2H₂O→R-R+2CO₂+H₂+2NaOH;
- ड्युमास प्रतिक्रिया (अल्कलीसह मिश्रधातू): CH₃COONa+NaOH (t)→CH₄+Na₂CO₃.
- तेल क्रॅकिंग: CnH₂n+2 (450-700°)→ CmH₂m+2+ Cn-mH₂(n-m).
- इंधनाचे गॅसिफिकेशन (घन): C+2H₂→CH₄.
- जटिल अल्केन्स (हॅलोजन डेरिव्हेटिव्ह) चे संश्लेषण ज्यामध्ये कमी C अणू आहेत: 2CH₃Cl (क्लोरोमेथेन) +2Na →CH₃- CH₃ (इथेन) +2NaCl.
- पाण्याद्वारे मेथॅनाइड्स (मेटल कार्बाइड्स) चे विघटन: Al₄C₃+12H₂O→4Al(OH₃)↓+3CH₄.
संतृप्त हायड्रोकार्बन्सचे भौतिक गुणधर्म
सोयीसाठी, डेटा टेबलमध्ये गटबद्ध केला आहे.
सुत्र | अल्केने | °C मध्ये वितळण्याचा बिंदू | उकळत्या बिंदू °C मध्ये | घनता, g/ml |
0.415 at t = -165°С |
||||
t= -100°C वर 0.561 |
||||
t = -45°C वर 0.583 |
||||
०.५७९ t = ०° से |
||||
2-मिथिलप्रोपेन | t = -25°C वर 0.557 |
|||
2,2-डायमिथाइलप्रोपेन | ||||
2-मिथिलब्युटेन | ||||
2-मिथिलपेंटेन | ||||
2,2,3,3-टेट्रा-मिथाइलब्युटेन | ||||
2,2,4-Trimethylpentane | ||||
n-C₁₀H₂₂ | ||||
n-C₁₁H₂₄ | n-अनकेन | |||
n-C₁₂H₂₆ | n-डोडेकेन | |||
n-C₁₃H₂₈ | n-Tridecan | |||
n-C₁₄H₃₀ | n-टेट्रेडेकेन | |||
n-C₁₅H₃₂ | n-पेंटाडेकन | |||
n-C₁₆H₃₄ | n-हेक्साडेकेन | |||
n-C₂₀H₄₂ | n-इकोसेन | |||
n-C₃₀H₆₂ | n-ट्रायकोंटन | 1 mmHg st | ||
n-C₄₀H₈₂ | n-टेट्राकॉन्टेन | 3 mmHg कला. | ||
n-C₅₀H₁₀₂ | n-पेंटाकंटन | 15 mmHg कला. | ||
n-C₆₀H₁₂₂ | n-हेक्साकॉन्टेन | |||
n-C₇₀H₁₄₂ | n-हेप्टाकॉन्टेन | |||
n-C₁₀₀H₂₀₂ |
निष्कर्ष
लेखात अल्केनेस (रचना, नामकरण, आयसोमेरिझम, होमोलोगस मालिका इ.) सारख्या संकल्पनेचे परीक्षण केले आहे. रेडियल आणि पर्यायी नामांकनांच्या वैशिष्ट्यांबद्दल थोडेसे सांगितले जाते. अल्केन मिळविण्याच्या पद्धती वर्णन केल्या आहेत.
याव्यतिरिक्त, लेखात अल्केनेसचे संपूर्ण नामकरण तपशीलवार सूचीबद्ध केले आहे (चाचणी आपल्याला प्राप्त माहिती आत्मसात करण्यात मदत करू शकते).