Jadual proses isoterma. Hukum gas ideal
Proses utama dalam termodinamik ialah:
- isokorik, mengalir pada isipadu tetap;
- isobarik mengalir pada tekanan malar;
- isoterma, berlaku pada suhu malar;
- adiabatik, di mana tiada pertukaran haba dengan persekitaran;
- politropik, memuaskan persamaan pvn= const.
Proses isochorik, isobarik, isoterma dan adiabatik adalah kes khas proses politropik.
Dalam kajian proses termodinamik tentukan:
- persamaan proses dalam hlm— v Dan T— s koordinat;
- hubungan antara parameter keadaan gas;
- perubahan dalam tenaga dalaman;
- jumlah kerja luaran;
- jumlah haba yang dibekalkan kepada proses atau jumlah haba yang dikeluarkan.
Proses Isokhorik


Proses Isokhorik dalamhlm, v— , T, s- Dani, s-koordinat (rajah)
Dalam proses isochorik, keadaan v= const.
Daripada persamaan gas ideal keadaan ( pv = RT) ikut:
p/T = R/V= const,
iaitu, tekanan gas adalah berkadar terus dengan suhu mutlaknya:
p2/p1 = T2 /T1.
Kerja pengembangan dalam proses isokhorik adalah sifar ( l= 0), kerana isipadu bendalir kerja tidak berubah (Δ v= const).
Jumlah haba yang dibekalkan kepada bendalir kerja dalam proses 1-2 pada CV
q= CV(T 2 — T 1 ).
T. kepada. l= 0, maka berdasarkan hukum pertama termodinamik Δ u = q, yang bermaksud bahawa perubahan dalam tenaga dalaman boleh ditentukan oleh formula:
Δ u = c v (T 2 - T 1).
Perubahan dalam entropi dalam proses isochoric ditentukan oleh formula:
s2–s1= Δ s = CV ln( p2/p1) = CV ln( T2 /T1).
proses isobarik



proses isobarik dalamhlm, v— , T, s- Dani, s-koordinat (rajah)
Proses isobarik ialah proses yang berlaku pada tekanan malar. hlm= const. Daripada persamaan keadaan untuk gas ideal ia berikut:
v/T = R/p= const
v2/v1 = T 2 / T 1 ,
iaitu, dalam proses isobarik, isipadu gas adalah berkadar dengan suhu mutlaknya.
Kerja itu akan menjadi:
l = hlm(v 2 – v 1 ).
T. kepada. pv 1 = RT 1 Dan pv 2 = RT 2 , Itu
l = R(T2-T1).
Jumlah haba pada cp= const ditentukan oleh formula:
q = cp(T2-T1).
Perubahan dalam entropi ialah:
s2–s1= Δ s = cp ln( T2 /T1).
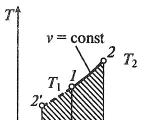
Proses isoterma



Proses isoterma dalamhlm, v— , T, s- Dani, s-koordinat (rajah)
Dalam proses isoterma, suhu bendalir kerja kekal malar T= const, jadi:
pv = RT= const
p2/p1 = v1/v2,
iaitu, tekanan dan isipadu adalah berkadar songsang antara satu sama lain, supaya semasa pemampatan isoterma tekanan gas meningkat, dan semasa pengembangan ia berkurangan.
Kerja proses akan sama dengan:
l = RT ln( v2 – v1) = RT ln( p1 – p2).
Oleh kerana suhu kekal tidak berubah, tenaga dalaman gas ideal dalam proses isoterma kekal malar (Δ u= 0) dan semua haba yang dibekalkan kepada bendalir kerja ditukar sepenuhnya kepada kerja pengembangan:
q = l.
Semasa pemampatan isoterma, haba dikeluarkan daripada bendalir kerja dalam jumlah yang sama dengan kerja yang dibelanjakan untuk pemampatan.
Perubahan dalam entropi ialah:
s2–s1= Δ s = R ln( p1/p2) = R ln( v2/v1).
proses adiabatik



proses adiabatik dalamhlm, v— , T, s- Dani, s-koordinat (rajah)
Proses adiabatik ialah perubahan keadaan gas yang berlaku tanpa pertukaran haba dengan persekitaran. Sejak d q= 0, maka persamaan hukum pertama termodinamik untuk proses adiabatik akan mempunyai bentuk:
d u + hlm d v = 0
Δ u+ l = 0,
oleh itu
Δ u= —l.
Dalam proses adiabatik, kerja pengembangan dilakukan hanya disebabkan oleh perbelanjaan tenaga dalaman gas, dan semasa pemampatan, yang berlaku disebabkan oleh tindakan daya luaran, semua kerja yang dilakukan oleh mereka pergi untuk meningkatkan tenaga dalaman. daripada gas itu.
Mari kita nyatakan kapasiti haba dalam proses adiabatik melalui c neraka, dan keadaan d q= 0 dinyatakan seperti berikut:
d q = c neraka d T = 0.
Keadaan ini mengatakan bahawa kapasiti haba dalam proses adiabatik adalah sifar ( c neraka = 0).
Adalah diketahui bahawa
Denganhlm/CV= k
dan persamaan keluk proses adiabatik (adiabatik) dalam hlm, v-rajah kelihatan seperti:
p.v.k= const.
Dalam ungkapan ini k dipanggil eksponen adiabatik(juga dipanggil nisbah Poisson).
Nilai eksponen adiabatikkuntuk beberapa gas:
k udara = 1.4
k wap panas lampau = 1.3
k Ekzos ICE = 1.33
k wap basah tepu = 1.135
Daripada formula sebelumnya berikut:
l= — Δ u = CV(T 1 – T 2 );
i 1 – i 2 = cp(T 1 – T 2 ).
Kerja teknikal proses adiabatik ( l teknologi) adalah sama dengan perbezaan antara entalpi permulaan dan akhir proses ( i 1 – i 2 ).
Proses adiabatik yang berlaku tanpa geseran dalaman dalam bendalir kerja dipanggil isentropik. DALAM T, s dalam rajah, ia diwakili oleh garis menegak.
Biasanya, proses adiabatik sebenar diteruskan dengan kehadiran geseran dalaman dalam bendalir kerja, akibatnya haba sentiasa dilepaskan, yang disampaikan kepada bendalir kerja itu sendiri. Dalam kes ini d s> 0 dan proses dipanggil proses adiabatik sebenar.
Proses politropik
Satu proses dipanggil politropik, yang diterangkan oleh persamaan:
pvn= const.
Indeks politropik n boleh mengambil sebarang nilai dari -∞ hingga +∞, tetapi untuk proses ini ia adalah nilai malar.
Daripada persamaan proses politropik dan persamaan Claiperon, seseorang boleh mendapatkan ungkapan yang mewujudkan hubungan antara hlm, v Dan T pada mana-mana dua titik pada politrop:
p2/p1 = (v1/v2)n; T2 /T1 = (v1/v2) n-1 ; T2 /T1 = (p2/p1) (n-1)/n .
Kerja pengembangan gas dalam proses politropik ialah:

Dalam kes gas ideal, formula ini boleh diubah:

Jumlah haba yang dibekalkan atau dikeluarkan dalam proses ditentukan menggunakan hukum pertama termodinamik:
q = (u 2 – u 1) + l.
Kerana ia

ialah kapasiti haba bagi gas ideal dalam proses politropik.
Pada CV, k Dan n= const c n= const, jadi proses politropik kadangkala ditakrifkan sebagai proses dengan kapasiti haba malar.
Proses politropik mempunyai makna umum, kerana ia merangkumi keseluruhan set proses termodinamik asas.
Perwakilan grafik politrop dalam hlm, v koordinat bergantung kepada indeks politrop n.

pv 0= const ( n= 0) ialah isobar;
pv= const ( n= 1) ialah isoterma;
p 0 v= const, hlm 1/∞v= const, pv∞= const - isochore;
p.v.k= const ( n = k) ialah adiabat.
n > 0 – lengkung hiperbolik,
n < 0 ialah parabola.
Berdasarkan bahan nota kuliah saya mengenai termodinamik dan buku teks "Asas Tenaga". Pengarang G. F. Bystritsky. ed. ke-2, rev. dan tambahan - M.: KNORUS, 2011. - 352 p.
Apakah proses isobarik
Definisi
Proses isobarik (atau isobarik) ialah proses yang berlaku dalam jisim gas malar pada tekanan malar.
Mari kita tulis persamaan untuk dua keadaan gas ideal:
\ \
Kami membahagikan persamaan (2) dengan persamaan (1), kami memperoleh persamaan proses isobarik:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \kiri(4\kanan).\]
Persamaan (4) dipanggil undang-undang Gay-Lussac.
Tenaga dalaman dan jumlah haba proses isobarik
Proses ini berlaku dengan input haba jika isipadu meningkat atau penyingkiran haba untuk mengurangkan isipadu. Mari kita tuliskan undang-undang pertama termodinamik, kita akan memperoleh ungkapan untuk kerja, tenaga dalaman dan jumlah haba proses isobarik berturut-turut:
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \kiri(5\kanan).\] \[\segitiga Q=\int\limits^(T_2)_ (T_1)(dU)+\int\limits^(V_2)_(V_1)(dA)(6)\]
di mana $\delta Q\ $ ialah haba asas yang dibekalkan kepada sistem, $dU$ ialah perubahan dalam tenaga dalaman gas dalam proses yang sedang berjalan, $dA$ ialah kerja asas yang dilakukan oleh gas dalam proses itu, i ialah bilangan darjah kebebasan molekul gas, R ialah pemalar gas universal, d ialah bilangan mol gas.
Perubahan dalam tenaga dalaman gas:
\[\segitiga U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
Persamaan (8) mentakrifkan kerja untuk proses isobarik. Kami menolak persamaan (1) daripada (2), kami memperoleh satu lagi persamaan untuk operasi gas dalam proses isobarik:
\ \[\segitiga Q=\frac(i)(2)нR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \triangle T\ ( 10),\]
di mana $c_(\mu p)$ ialah kapasiti haba molar gas dalam proses isobarik. Persamaan (10) menentukan jumlah haba yang diberikan kepada gas berjisim m dalam proses isobarik dengan peningkatan suhu sebanyak $\segitiga T.$
Isoproses sering digambarkan dalam gambar rajah termodinamik. Jadi, garisan yang menggambarkan proses isobarik pada rajah sedemikian dipanggil isobar (Rajah 1).
Contoh 1
Tugasan: Tentukan bagaimana tekanan $p_1$ dan $p_2$ berkaitan pada rajah V(T) dalam Rajah 1c.
Lukis isoterma $T_1$

Pada titik A dan B, suhu adalah sama, oleh itu, gas mematuhi undang-undang Boyle-Mariotte:
\ \
Mari tukarkan isipadu ini kepada SI: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
Mari buat pengiraan:
Jawapan: Kerja gas dalam proses isobarik ialah 600 J.
Contoh 3
Tugasan: Bandingkan kerja gas dalam proses ABC dan kerja gas dalam proses CDA Rajah 3.

Sebagai asas untuk penyelesaian, kami mengambil formula yang menentukan kerja gas:
Daripada makna geometri kamiran pasti, diketahui bahawa kerja ialah luas rajah, yang dihadkan oleh fungsi kamiran, paksi absis, dan isokor pada titik $V_1\ dan\ V_2$ (paksi p(V)). Kami menterjemahkan graf proses ke dalam paksi p(V).
Pertimbangkan setiap segmen graf proses yang ditunjukkan dalam Rajah (3).
AB: Proses isochorik (p=const), $V\uparrow \left(\ Volume\ grows\right),\ T\uparrow $;
VS: Proses Isokhorik (V =const), $T\uparrow $ (daripada graf), p$\uparrow $, daripada hukum untuk proses isochoric ($\frac(p)(T)=const$);
CD: (p=const), $V\downarrow ,\ T\downarrow ;$
DA: (V =const), $T\downarrow ,\ p\downarrow .$
Mari kita gambarkan graf proses dalam paksi p(V) (Rajah 4):

Kerja gas $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- luas segi empat tepat ABFE) (Gamb. 3). Bekerja pada gas $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -luas\ segi empat tepat\ $EFCD.Jelas sekali $A_(CDA)>A_(ABC).$
, proses termodinamik ialah perubahan keadaan sistem, akibatnya sekurang-kurangnya satu daripada parameternya (suhu, isipadu atau tekanan) mengubah nilainya. Walau bagaimanapun, jika kita mengambil kira bahawa semua parameter sistem termodinamik adalah berkait rapat, maka perubahan dalam mana-mana daripada mereka tidak dapat dielakkan memerlukan perubahan dalam sekurang-kurangnya satu (ideal) atau beberapa (dalam realiti) parameter. Dalam kes umum, kita boleh mengatakan bahawa proses termodinamik dikaitkan dengan pelanggaran keseimbangan sistem, dan jika sistem berada dalam keadaan keseimbangan, maka tiada proses termodinamik boleh berlaku di dalamnya.
Keadaan keseimbangan sistem adalah konsep abstrak, kerana adalah mustahil untuk mengasingkan apa-apa bahan dari dunia sekeliling, oleh itu pelbagai proses termodinamik tidak dapat dielakkan berlaku dalam mana-mana sistem sebenar. Pada masa yang sama, dalam sesetengah sistem, perubahan yang perlahan dan hampir tidak dapat dilihat boleh berlaku sehingga proses yang berkaitan dengannya boleh dianggap secara bersyarat terdiri daripada urutan keadaan keseimbangan sistem. Proses sedemikian dipanggil keseimbangan atau semu statik.
Satu lagi kemungkinan senario perubahan berturut-turut dalam sistem, selepas itu ia kembali ke keadaan asalnya, dipanggil proses pekeliling atau kitaran. Konsep keseimbangan dan proses bulat mendasari banyak kesimpulan teori dan kaedah terpakai termodinamik.
Kajian proses termodinamik terdiri daripada menentukan kerja yang dilakukan dalam proses ini, perubahan tenaga dalaman, jumlah haba, dan juga dalam mewujudkan hubungan antara kuantiti individu yang mencirikan keadaan gas.
Daripada semua proses termodinamik yang mungkin, proses isochorik, isobarik, isoterma, adiabatik dan politropik adalah yang paling diminati.
Proses Isokhorik
Proses isochorik ialah proses termodinamik yang berlaku pada isipadu tetap. Proses sedemikian boleh dilakukan dengan memanaskan gas yang diletakkan di dalam bekas tertutup. Gas menjadi panas akibat bekalan haba, dan tekanannya meningkat.
Perubahan dalam parameter gas dalam proses isochorik menerangkan hukum Charles: p 1 /T 1 \u003d p 2 /T 2, atau dalam kes umum:
p/T = const .
Tekanan gas pada dinding kapal adalah berkadar terus dengan suhu mutlak gas.
Oleh kerana dalam proses isochorik perubahan dalam isipadu dV adalah sama dengan sifar, kita boleh membuat kesimpulan bahawa semua haba yang dibekalkan kepada gas dibelanjakan untuk menukar tenaga dalaman gas. (tiada kerja dibuat).
proses isobarik
Proses isobarik ialah proses termodinamik yang berlaku pada tekanan malar. Proses sedemikian boleh dijalankan dengan meletakkan gas dalam silinder tumpat dengan omboh boleh alih, yang digerakkan oleh daya luaran yang berterusan semasa penyingkiran dan bekalan haba.
Apabila suhu gas berubah, omboh bergerak ke satu arah atau yang lain; manakala isipadu gas berubah mengikut undang-undang Gay-Lussac:
V/T = const .
Ini bermakna bahawa dalam proses isobarik isipadu yang diduduki oleh gas adalah berkadar terus dengan suhu.
Dapat disimpulkan bahawa perubahan suhu dalam proses ini pasti akan membawa kepada perubahan dalam tenaga dalaman gas, dan perubahan dalam isipadu dikaitkan dengan prestasi kerja, iaitu, dalam proses isobarik, sebahagian daripada haba. tenaga dibelanjakan untuk menukar tenaga dalaman gas, dan sebahagian lagi dibelanjakan untuk prestasi kerja gas untuk mengatasi tindakan daya luar. Dalam kes ini, nisbah antara kos haba untuk meningkatkan tenaga dalaman dan untuk melaksanakan kerja bergantung kepada kapasiti haba gas.
Proses isoterma
Proses isoterma ialah proses termodinamik yang berlaku pada suhu malar.
Sangat sukar untuk menjalankan proses isoterma dengan gas dalam amalan. Lagipun, adalah perlu untuk mematuhi syarat bahawa dalam proses pemampatan atau pengembangan, gas mempunyai masa untuk menukar suhu dengan alam sekitar, mengekalkan pemalar suhu sendiri.
Proses isoterma diterangkan oleh undang-undang Boyle-Mariotte: pV \u003d const, iaitu pada suhu malar, tekanan gas adalah berkadar songsang dengan isipadunya.
Jelas sekali, dalam proses isoterma, tenaga dalaman gas tidak berubah, kerana suhunya adalah malar.
Untuk memenuhi syarat kestabilan suhu gas, adalah perlu untuk mengeluarkan haba daripadanya, bersamaan dengan kerja yang dibelanjakan untuk pemampatan:
dq = dA = pdv .
Dengan menggunakan persamaan keadaan gas, setelah melakukan beberapa perubahan dan penggantian, kita boleh membuat kesimpulan bahawa kerja gas dalam proses isoterma ditentukan oleh ungkapan:
A = RT ln(p 1 /p 2).
proses adiabatik
Proses adiabatik ialah proses termodinamik yang berlaku tanpa pertukaran haba antara bendalir kerja dan persekitaran. Seperti proses isoterma, sangat sukar untuk melaksanakan proses adiabatik dalam amalan. Proses sedemikian boleh diteruskan dengan medium kerja yang diletakkan di dalam kapal, sebagai contoh, silinder dengan omboh, dikelilingi oleh bahan penebat haba berkualiti tinggi.
Tetapi tidak kira apa penebat haba berkualiti tinggi yang kita gunakan dalam kes ini, sesetengah, walaupun boleh diabaikan, jumlah haba pasti akan ditukar antara bendalir kerja dan persekitaran.
Oleh itu, dalam amalan, adalah mungkin untuk mencipta hanya model anggaran proses adiabatik. Walau bagaimanapun, banyak proses termodinamik yang dijalankan dalam kejuruteraan haba berjalan dengan pantas sehingga bendalir kerja dan medium tidak mempunyai masa untuk menukar haba, oleh itu, dengan tahap ralat tertentu, proses tersebut boleh dianggap sebagai adiabatik.
Untuk mendapatkan persamaan yang berkaitan tekanan dan isipadu 1 kg gas dalam proses adiabatik, kita menulis persamaan hukum pertama termodinamik:
dq = du + pdv .
Oleh kerana untuk proses adiabatik pemindahan haba dq adalah sama dengan sifar, dan perubahan dalam tenaga dalaman adalah fungsi kekonduksian terma suhu: du = c v dT , maka kita boleh menulis:
c v dT + pdv = 0 (3) .
Membezakan persamaan Clapeyron pv = RT , kita dapat:
pdv + vdp = RdT .
Mari kita ungkapkan dT dari sini dan gantikannya ke dalam persamaan (3) . Selepas penyusunan semula dan transformasi, kami mendapat:
pdvc v /(R + 1) + c v vdp/R = 0.
Dengan mengambil kira persamaan Mayer R = c p – c v, ungkapan terakhir boleh ditulis semula sebagai:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
Membahagikan ungkapan yang terhasil dengan c v dan menandakan nisbah c p / c v dengan huruf k , selepas menyepadukan persamaan (4) kita dapat (pada k = const):
ln vk + ln p = const atau ln pvk = const atau pvk = const .
Persamaan yang terhasil ialah persamaan proses adiabatik, di mana k ialah eksponen adiabatik.
Jika kita mengandaikan bahawa kapasiti haba isipadu c v ialah nilai malar, iaitu c v \u003d const, maka kerja proses adiabatik boleh diwakili sebagai formula (diberi tanpa keluaran):
l \u003d c v (T 1 - T 2) atau l \u003d (p 1 v 1 - p 2 v 2) / (k-1).
Proses politropik
Tidak seperti proses termodinamik yang dipertimbangkan di atas, apabila mana-mana parameter gas kekal tidak berubah, proses politropik dicirikan oleh kemungkinan menukar mana-mana parameter gas utama. Semua proses termodinamik di atas adalah kes khas proses politropik.
Persamaan umum proses politropik mempunyai bentuk pv n = const , di mana n ialah indeks politropik - nilai tetap untuk proses ini, yang boleh mengambil nilai dari - ∞ hingga + ∞ .
Adalah jelas bahawa dengan memberikan nilai tertentu kepada indeks politropik, satu atau satu lagi proses termodinamik boleh diperolehi - isochoric, isobaric, isothermal atau adiabatic.
Jadi, jika kita mengambil n = 0 , kita mendapat p = const - proses isobarik, jika kita mengambil n = 1 , kita mendapat proses isoterma yang diterangkan oleh pergantungan pv = const ; untuk n = k proses adalah adiabatik, dan untuk n sama dengan - ∞ atau + ∞ . kita mendapat proses isokhorik.
Topik pengekod PENGGUNAAN: isoproses - proses isoterma, isochorik, isobaric.
Sepanjang risalah ini, kami akan mematuhi andaian berikut: jisim dan komposisi kimia gas kekal tidak berubah. Dengan kata lain, kami percaya bahawa:
Iaitu, tiada kebocoran gas dari kapal atau, sebaliknya, aliran masuk gas ke dalam kapal;
Iaitu, zarah gas tidak mengalami sebarang perubahan (katakan, tidak ada penceraian - pereputan molekul menjadi atom).
Kedua-dua syarat ini dipenuhi dalam banyak situasi yang menarik secara fizikal (contohnya, dalam model mudah enjin haba) dan oleh itu patut dipertimbangkan secara berasingan.
Jika jisim gas dan jisim molarnya tetap, maka keadaan gas ditentukan oleh tiga parameter makroskopik: tekanan, isipadu Dan suhu. Parameter ini berkaitan antara satu sama lain dengan persamaan keadaan (persamaan Mendeleev-Clapeyron).
Proses termodinamik(atau hanya proses) ialah perubahan keadaan gas dari semasa ke semasa. Semasa proses termodinamik, nilai parameter makroskopik - tekanan, isipadu dan suhu - berubah.
Kepentingan khusus ialah isoproses- proses termodinamik di mana nilai salah satu parameter makroskopik kekal tidak berubah. Membetulkan setiap tiga parameter secara bergilir-gilir, kami mendapat tiga jenis isoproses.
1. Proses isoterma pergi pada suhu gas tetap: .
2. proses isobarik berjalan pada tekanan gas malar: .
3. Proses Isokhorik berjalan pada isipadu gas tetap: .
Isoprocesses diterangkan oleh undang-undang Boyle yang sangat mudah - Mariotte, Gay-Lussac dan Charles. Mari kita teruskan untuk mengkaji mereka.
Proses isoterma
Biarkan gas ideal melakukan proses isoterma pada suhu . Semasa proses itu, hanya tekanan gas dan isipadunya berubah.
Pertimbangkan dua keadaan gas yang sewenang-wenangnya: dalam salah satu daripadanya, nilai parameter makroskopik adalah , dan dalam kedua, mereka adalah . Nilai-nilai ini dikaitkan dengan persamaan Mendeleev-Clapeyron:
Seperti yang kita katakan dari awal lagi, jisim dan jisim molar diandaikan tetap.
Oleh itu, bahagian kanan persamaan bertulis adalah sama. Oleh itu, bahagian kiri juga sama:
(1)
Oleh kerana kedua-dua keadaan gas dipilih secara sewenang-wenangnya, kita boleh membuat kesimpulan bahawa semasa proses isoterma, hasil darab tekanan dan isipadu gas kekal malar:
(2)
Kenyataan ini dipanggil Undang-undang Boyle - Mariotte.
Setelah menulis undang-undang Boyle-Mariotte dalam borang
(3)
seseorang juga boleh merumuskannya seperti ini: Dalam proses isoterma, tekanan gas adalah berkadar songsang dengan isipadunya.. Jika, sebagai contoh, semasa pengembangan isoterma gas, isipadunya meningkat tiga kali ganda, maka tekanan gas berkurangan tiga kali ganda.
Bagaimana untuk menerangkan hubungan songsang antara tekanan dan isipadu dari sudut fizikal? Pada suhu malar, tenaga kinetik purata molekul gas kekal tidak berubah, iaitu, secara ringkasnya, daya hentaman molekul pada dinding kapal tidak berubah. Dengan peningkatan dalam jumlah, kepekatan molekul berkurangan, dan, dengan itu, bilangan impak molekul per unit masa per unit luas dinding berkurangan - tekanan gas menurun. Sebaliknya, dengan penurunan jumlah, kepekatan molekul meningkat, kesannya lebih kerap, dan tekanan gas meningkat.
Graf Proses Isoterma
Secara umum, adalah lazim untuk menggambarkan graf proses termodinamik dalam sistem koordinat berikut:
-rajah: paksi absis, paksi ordinat;
-rajah: paksi absis, paksi ordinat.
Graf proses isoterma dipanggil isoterma.
Isoterm pada carta - ialah plot berkadar songsang.
Graf sedemikian ialah hiperbola (ingat algebra - graf fungsi). Isoterma-hiperbola ditunjukkan dalam rajah. 1 .

nasi. 1. Isoterma pada -rajah
Setiap isoterma sepadan dengan nilai suhu tetap tertentu. Ternyata begitu semakin tinggi suhu, semakin tinggi isoterma yang sepadan terletak pada -gambar rajah.
Malah, mari kita pertimbangkan dua proses isoterma yang dilakukan oleh gas yang sama (Rajah 2). Proses pertama berlaku pada suhu, kedua - pada suhu.

nasi. 2. Semakin tinggi suhu, semakin tinggi isoterma
Kami menetapkan beberapa nilai volum. Pada isoterma pertama ia sepadan dengan tekanan , pada kedua - class="tex" alt="p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
Dalam dua sistem koordinat yang tinggal, isoterma kelihatan sangat mudah: ia adalah garis lurus berserenjang dengan paksi ( rajah 3):

nasi. 3. Isoterma pada dan -rajah
proses isobarik
Ingat sekali lagi bahawa proses isobarik ialah proses yang berlaku pada tekanan malar. Semasa proses isobarik, hanya isipadu gas dan suhunya berubah.
Contoh biasa proses isobarik: gas berada di bawah omboh besar yang boleh bergerak bebas. Jika jisim omboh dan keratan rentas omboh, maka tekanan gas adalah malar dan sama dengan
di manakah tekanan atmosfera.
Biarkan gas ideal melakukan proses isobarik pada tekanan. Pertimbangkan sekali lagi dua keadaan gas yang sewenang-wenangnya; kali ini nilai parameter makroskopik akan sama dengan dan .
Mari kita tulis persamaan keadaan:
Membahagikannya dengan satu sama lain, kita mendapat:
Pada dasarnya, ini sudah cukup, tetapi kita akan pergi lebih jauh. Mari kita tulis semula hubungan yang terhasil supaya hanya parameter keadaan pertama muncul dalam satu bahagian, dan hanya parameter keadaan kedua muncul di bahagian lain (dengan kata lain, kita "memecahkan indeks" ke bahagian yang berbeza):
(4)
Dan sekarang dari sini - memandangkan sewenang-wenangnya pilihan negeri! - kita mendapatkan Undang-undang Gay-Lussac:
(5)
Dalam kata lain, Pada tekanan malar, isipadu gas adalah berkadar terus dengan suhunya.:
(6)
Mengapa isipadu meningkat dengan suhu? Apabila suhu meningkat, molekul mula memukul lebih kuat dan menaikkan omboh. Pada masa yang sama, kepekatan molekul berkurangan, impak menjadi kurang kerap, sehingga pada akhirnya tekanan tetap sama.
Plot proses isobarik
Graf proses isobarik dipanggil isobar. Pada rajah -, isobar ialah garis lurus (Rajah 4):

nasi. 4. Isobar pada -rajah
Bahagian bertitik pada graf bermakna bahawa dalam kes gas sebenar pada suhu yang cukup rendah, model gas ideal (dan dengannya undang-undang Gay-Lussac) tidak lagi berfungsi. Sesungguhnya, apabila suhu menurun, zarah gas bergerak lebih dan lebih perlahan, dan daya interaksi antara molekul mempunyai pengaruh yang semakin ketara ke atas pergerakan mereka (analogi: bola perlahan lebih mudah ditangkap daripada bola laju). Nah, pada suhu yang sangat rendah, gas bertukar menjadi cecair.
Sekarang mari kita fikirkan bagaimana kedudukan isobar berubah dengan perubahan tekanan. Ternyata begitu Semakin tinggi tekanan, semakin rendah isobarnya. -gambar rajah.
Untuk mengesahkan ini, pertimbangkan dua isobar dengan tekanan dan (Rajah 5):

nasi. 5. Semakin rendah isobar, semakin besar tekanannya
Mari kita betulkan beberapa nilai suhu. Kita nampak itu. Tetapi pada suhu tetap, isipadu adalah lebih kecil, lebih besar tekanan (hukum Boyle - Mariotte!).
Jadi class="tex" alt="p_2 > p_1"> .!}
Dalam dua sistem koordinat yang tinggal, isobar ialah garis lurus berserenjang dengan paksi (Rajah 6):

nasi. 6. Isobar pada dan -rajah
Proses Isokhorik
Proses isochoric, kita ingat, adalah proses yang berlaku pada volum tetap. Dalam proses isochorik, hanya tekanan gas dan suhunya berubah.
Proses isochorik adalah sangat mudah untuk dibayangkan: ia adalah proses yang berlaku dalam bekas tegar dengan isipadu tetap (atau dalam silinder di bawah omboh apabila omboh dibetulkan).
Biarkan gas ideal melakukan proses isochorik dalam bekas isipadu. Sekali lagi, pertimbangkan dua keadaan gas sewenang-wenangnya dengan parameter dan . Kami ada:
Kami membahagikan persamaan ini kepada satu sama lain:
Seperti dalam terbitan undang-undang Gay-Lussac, kami "memecahkan" indeks kepada bahagian yang berbeza:
(7)
Memandangkan sewenang-wenangnya pilihan negeri, kita tiba di undang-undang Charles:
(8)
Dalam kata lain, Pada isipadu gas yang tetap, tekanannya adalah berkadar terus dengan suhunya.:
(9)
Peningkatan tekanan gas dengan isipadu tetap apabila ia dipanaskan adalah perkara yang jelas dari sudut fizikal. Anda boleh menerangkannya sendiri dengan mudah.
Plot Proses Isokhorik
Graf proses isokhorik dipanggil isochore. Pada rajah -, isokor ialah garis lurus ( rajah 7):

nasi. 7. Isochore pada -rajah
Maksud kawasan bertitik adalah sama: ketidakcukupan model gas ideal pada suhu rendah.

nasi. 8. Semakin rendah isochore, semakin besar isipadu
Buktinya serupa dengan yang sebelumnya. Kami menetapkan suhu dan melihatnya. Tetapi pada suhu tetap, tekanan adalah lebih kecil, lebih besar isipadu (sekali lagi, undang-undang Boyle-Mariotte). Jadi class="tex" alt="V_2 > V_1"> .!}
Dalam dua sistem koordinat yang tinggal, isokor ialah garis lurus berserenjang dengan paksi (Rajah 9):

nasi. 9. Isochores pada dan -rajah
Undang-undang Boyle - Mariotte, Gay-Lussac dan Charles juga dipanggil undang-undang gas.
Kami memperoleh undang-undang gas daripada persamaan Mendeleev-Clapeyron. Tetapi dari segi sejarah ia adalah sebaliknya: undang-undang gas telah ditubuhkan secara eksperimen, dan lebih awal lagi. Persamaan keadaan muncul kemudiannya sebagai generalisasi mereka.
proses isobarik
Plot isoproses dalam sistem koordinat yang berbeza
proses isobarik( ισος Yunani lain, isos - "sama" + βαρος, baros - "berat") - proses mengubah keadaan sistem termodinamik pada tekanan malar ()
Kebergantungan isipadu gas pada suhu pada tekanan malar telah disiasat secara eksperimen pada tahun 1802 oleh Joseph Louis Gay-Lussac. Hukum Gay-Lussac: Pada tekanan malar dan nilai malar bagi jisim gas dan jisim molarnya, nisbah isipadu gas kepada suhu mutlaknya kekal malar: V / T = const.
Proses Isokhorik
Proses Isokhorik(daripada korus Yunani - tempat yang diduduki) - proses mengubah keadaan sistem termodinamik pada isipadu tetap (). Untuk gas ideal, proses isochorik diterangkan oleh hukum Charles: untuk jisim gas tertentu pada isipadu tetap, tekanan adalah berkadar terus dengan suhu:
Garis yang menggambarkan proses isochore dalam rajah dipanggil isochore.
Ia juga bernilai menunjukkan bahawa tenaga yang dibekalkan kepada gas dibelanjakan untuk menukar tenaga dalaman, iaitu, Q = 3* ν*R*T/2=3*V*ΔP, di mana R ialah pemalar gas sejagat, ν ialah bilangan mol dalam gas, T ialah suhu dalam Kelvin , V ialah isipadu gas, ΔP ialah pertambahan perubahan tekanan. dan garisan yang menggambarkan proses isokhorik dalam rajah, dalam paksi P(T), hendaklah dipanjangkan dan disambungkan dengan garis putus-putus ke asal, kerana salah faham mungkin timbul.
Proses isoterma
Proses isoterma(dari bahasa Yunani "termos" - hangat, panas) - proses mengubah keadaan sistem termodinamik pada suhu malar () (). Proses isoterma diterangkan oleh undang-undang Boyle - Mariotte:
Pada suhu malar dan nilai malar jisim gas dan jisim molarnya, hasil darab isipadu gas dan tekanannya kekal malar: PV = const.
Proses isentropik
Proses isentropik- proses menukar keadaan sistem termodinamik pada entropi malar (). Sebagai contoh, proses adiabatik boleh balik adalah isentropik: dalam proses sedemikian tiada pertukaran haba dengan persekitaran. Gas ideal dalam proses sedemikian diterangkan oleh persamaan berikut:
di manakah eksponen adiabatik, ditentukan oleh jenis gas.
Yayasan Wikimedia. 2010 .
Lihat apa "Isoprocesses" dalam kamus lain:
Isoproses ialah proses termodinamik di mana jisim dan satu lagi kuantiti fizik parameter keadaan: tekanan, isipadu atau suhu kekal tidak berubah. Jadi, proses isobarik sepadan dengan tekanan malar, isipadu isochorik ... Wikipedia
Teori kinetik molekul (disingkatkan MKT) ialah teori yang menganggap struktur jirim dari sudut pandangan tiga peruntukan utama yang kira-kira betul: semua jasad terdiri daripada zarah, saiznya boleh diabaikan: atom, molekul dan ion; zarah ... ... Wikipedia
- (disingkat MKT) teori yang menganggap struktur jirim dari sudut pandangan tiga peruntukan utama yang kira-kira betul: semua jasad terdiri daripada zarah yang saiznya boleh diabaikan: atom, molekul dan ion; zarah berada dalam berterusan ... ... Wikipedia
Buku
- Ramalan statistik ciri ubah bentuk-kekuatan bahan struktur , G. Pluvinazh , VT Sapunov , Buku ini membentangkan kaedah baru yang mencadangkan metodologi biasa untuk meramalkan ciri-ciri proses kinetik, biasa untuk bahan logam dan polimer. Kaedah… Kategori: Buku teks untuk universiti Penerbit: