Grunnleggende kjemiske egenskaper til alkaner. Alkaner: fysiske og kjemiske egenskaper, anvendelse
De kjemiske egenskapene til mettede hydrokarboner bestemmes av tilstedeværelsen av karbon- og hydrogenatomer og $C-H$- og $C-C$-bindinger i molekylene deres.
I molekylet til den enkleste alkanen, metan, dannes kjemiske bindinger av 8 valenselektroner (4 elektroner fra karbonatomet og 4 fra hydrogenatomene), som befinner seg i fire bindende molekylorbitaler.
Så, i et metanmolekyl, dannes fire $sp3-s (C-H)$ kovalente bindinger fra fire $sp3$-hybridiserte orbitaler av karbonatomet og s-orbitaler av fire hydrogenatomer (fig. 1).
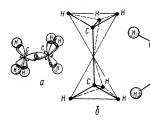
Etanmolekylet er dannet av to karbontetraedre - en $sp3-sp3 (C-C)$ kovalent binding og seks $sp3-s (C-H)$ kovalente bindinger (fig. 2).

Figur 2. Etanmolekylets struktur: a - plassering av $\sigma $-bindinger i molekylet; b - tetraedrisk modell av molekylet; c - ball-and-stick-modell av molekylet; d - skalamodell av et molekyl ifølge Stewart - Briegleb
Kjennetegn ved kjemiske bindinger i alkaner
I de typer kovalente bindinger som vurderes, er områdene med størst elektrontetthet lokalisert på linjen som forbinder atomkjernene. Disse kovalente bindingene dannes av lokaliserte $\sigma $-$(\rm M)$$(\rm O)$ og kalles $\sigma $-bindinger. Et viktig trekk ved disse bindingene er at elektrontettheten i dem er fordelt symmetrisk i forhold til aksen som går gjennom atomkjernene (sylindrisk symmetri av elektrontettheten). Takket være dette kan atomer eller grupper av atomer som er forbundet med denne bindingen rotere fritt uten å forårsake deformasjon av bindingen. Vinkelen mellom valensretningene til karbonatomer i alkanmolekyler er $109^\circ 28"$. Derfor, i molekylene til disse stoffene, selv med en rett karbonkjede, er karbonatomene faktisk ikke lokalisert i en rett linje. Denne kjeden har en sikksakkform, som er assosiert med bevaring av intervalensvinklene til atomets karbon (fig. 3).

Figur 3. Skjema av strukturen til karbonkjeden til en normal alkan
I alkanmolekyler med en tilstrekkelig lang karbonkjede økes denne vinkelen med $2^\circ$ på grunn av frastøtingen av karbonatomer som ikke er valensbundet til hverandre.
Merknad 1
Hver kjemisk binding er preget av en viss energi. Det er eksperimentelt fastslått at $C-H$-bindingsenergien i et metanmolekyl er 422,9 kJ/mol, etan - 401,9 kJ/mol og andre alkaner - omtrent 419 kJ/mol. $C-C$ bindingsenergien er 350 kJ/mol.
Forholdet mellom strukturen til alkaner og deres reaktivitet
Den høye energien til $C-C$ og $C-H$ bindinger bestemmer den lave reaktiviteten til mettede hydrokarboner ved romtemperatur. Således misfarger ikke alkaner bromvann, kaliumpermanganatløsning, interagerer ikke med ioniske reagenser (syrer, alkalier), og reagerer ikke med oksidasjonsmidler eller aktive metaller. Derfor kan for eksempel natriummetall lagres i parafin, som er en blanding av mettede hydrokarboner. Selv konsentrert svovelsyre, som forkuller mange organiske stoffer, har ingen effekt på alkaner ved romtemperatur. Gitt den relativt lave reaktiviteten til mettede hydrokarboner, ble de en gang kalt parafiner. Alkaner har ikke evnen til å tilsette hydrogen, halogener og andre reagenser. Derfor ble denne klassen av organiske stoffer kalt mettede hydrokarboner.
Kjemiske reaksjoner av mettede hydrokarboner kan oppstå på grunn av spaltning av $C-C$ eller $C-H$ bindinger. Brudd på $C-H$-bindinger er ledsaget av eliminering av hydrogenatomer med dannelse av umettede forbindelser eller den påfølgende erstatning av eliminering av hydrogenatomer med andre atomer eller grupper av atomer.
Avhengig av strukturen til alkanen og reaksjonsbetingelsene i molekyler av mettede hydrokarboner, kan $C-H$-bindingen brytes homolytisk:

Figur 4. Kjemiske egenskaper til alkaner
Og heterolytisk med dannelse av anioner og kationer:
Figur 5. Kjemiske egenskaper til alkaner
I dette tilfellet kan det dannes frie radikaler som har et uparet elektron, men som ikke har en elektrisk ladning, eller karbokasjoner eller karbanioner, som har de tilsvarende elektriske ladningene. Frie radikaler dannes som mellompartikler i reaksjoner av radikalmekanismen, og karbokasjoner og karbanioner - i reaksjoner av den ioniske mekanismen.
På grunn av det faktum at $C-C$-bindinger er upolare, og $C-H$-bindinger er lavpolare, og disse $\sigma $-bindingene har lav polariserbarhet, vil den heterolytiske spaltningen av $\sigma $-bindinger i alkanmolekyler med dannelsen av ioner krever mye energi. Hemolytisk spaltning av disse bindingene krever mindre energi. Derfor, for mettede hydrokarboner, er reaksjoner som foregår ved hjelp av en radikal mekanisme mer typiske. Splittingen av $\sigma $-bindingen $C-C$ krever mindre energi enn delingen av $C-H$-bindingen, siden energien til $C-C$-bindingen er mindre enn energien til $C-H$-bindingen. Imidlertid involverer kjemiske reaksjoner oftere spaltning av $C-H$-bindinger, siden de er mer tilgjengelige for reagenser.
Påvirkningen av forgrening og størrelse på alkaner på deres reaktivitet
Reaktiviteten til $C-H$-bindingen endres ved overgang fra alkaner med lineær struktur til alkaner med forgrenet struktur. For eksempel endres dissosiasjonsenergien til $C-H$-bindingen (kJ/mol) under dannelsen av frie radikaler som følger:

Figur 6. Kjemiske egenskaper til alkaner
I tillegg viser verdien av ioniseringsenergi (IE) for alkaner at en økning i det totale antallet $\sigma $-bindinger øker deres donoregenskaper og det blir lettere å fjerne et elektron for forbindelser med høyere molekylvekt, for eksempel :
Figur 7. Kjemiske egenskaper til alkaner
Så i frie radikalprosesser skjer reaksjoner hovedsakelig ved det tertiære karbonatomet, deretter ved det sekundære, og til slutt ved det primære, som sammenfaller med stabilitetsserien til frie radikaler. Men med økende temperatur avtar den observerte trenden eller jevnes helt ut.
Dermed er alkaner preget av to typer kjemiske reaksjoner:
- hydrogensubstitusjon, hovedsakelig ved radikal mekanisme og
- spaltning av molekylet bak $C-C$- eller $C-H$-bindingene.
Alkaner :
Alkaner er mettede hydrokarboner, i molekylene som alle atomer er forbundet med enkeltbindinger. Formel -
Fysiske egenskaper :
- Smelte- og kokepunkt øker med molekylvekten og lengden på karbonryggraden
- Under normale forhold er uforgrenede alkaner fra CH 4 til C 4 H 10 gasser; fra C5H12 til C13H28 - væsker; etter C14H30 - faste stoffer.
- Smelte- og kokepunkt synker fra mindre forgrenet til mer forgrenet. Så, for eksempel, ved 20 °C er n-pentan en væske, og neopentan er en gass.
Kjemiske egenskaper:
· Halogenering
dette er en av substitusjonsreaksjonene. Det minst hydrogenerte karbonatomet halogeneres først (tertiært atom, deretter sekundære, primære atomer halogeneres sist). Halogeneringen av alkaner skjer i trinn - ikke mer enn ett hydrogenatom erstattes i ett trinn:
- CH 4 + Cl 2 → CH 3 Cl + HCl (klormetan)
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (diklormetan)
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (triklormetan)
- CHCl 3 + Cl 2 → CCl 4 + HCl (karbontetraklorid).
Under påvirkning av lys brytes et klormolekyl ned til radikaler, deretter angriper de alkanmolekyler, tar bort et hydrogenatom fra dem, som et resultat av at det dannes metylradikaler CH 3, som kolliderer med klormolekyler, ødelegger dem og danner nye radikaler.
· Forbrenning
Den viktigste kjemiske egenskapen til mettede hydrokarboner, som bestemmer deres bruk som drivstoff, er forbrenningsreaksjonen. Eksempel:
CH 4 + 2O 2 → CO 2 + 2H 2 O+ Q
Ved mangel på oksygen produseres karbonmonoksid eller kull i stedet for karbondioksid (avhengig av oksygenkonsentrasjonen).
Generelt kan forbrenningsreaksjonen til alkaner skrives som følger:
MED n H 2 n +2 +(1,5n+0,5)02 = n CO 2 + ( n+1)H20
· Dekomponering
Nedbrytingsreaksjoner skjer bare under påvirkning av høye temperaturer. En økning i temperatur fører til brudd av karbonbindinger og dannelse av frie radikaler.
Eksempler:
CH4 → C + 2H 2 (t > 1000 °C)
C2H6 → 2C + 3H2
Alkenes :
Alkener er umettede hydrokarboner som inneholder i molekylet, i tillegg til enkeltbindinger, en karbon-karbon dobbeltbinding Formel - C n H 2n
Tilhørigheten til et hydrokarbon til klassen alkener reflekteres av det generiske suffikset -ene i navnet.
Fysiske egenskaper :
- Smelte- og kokepunktene til alkener (forenklet) øker med molekylvekten og lengden på karbonryggraden.
- Under normale forhold er alkener fra C 2 H 4 til C 4 H 8 gasser; fra C5H10 til C17H34 - væsker, etter C18H36 - faste stoffer. Alkener er uløselige i vann, men løselige i organiske løsemidler.
Kjemiske egenskaper :
· Dehydrering er prosessen med å splitte et vannmolekyl fra et molekyl av en organisk forbindelse.
· Polymerisasjon er en kjemisk prosess for å kombinere mange initiale molekyler av et lavmolekylært stoff til store polymermolekyler.
Polymer er en høymolekylær forbindelse hvis molekyler består av mange identiske strukturelle enheter.
Alcadienes :
Alkadiener er umettede hydrokarboner som inneholder i molekylet, i tillegg til enkeltbindinger, doble karbon-karbon-bindinger.
. Diener er strukturelle isomerer av alkyner.Fysiske egenskaper :
Butadien er en gass (kokepunkt -4,5 °C), isopren er en væske som koker ved 34 °C, dimetylbutadien er en væske som koker ved 70 °C. Isopren og andre dienhydrokarboner er i stand til å polymerisere til gummi. Naturgummi i renset tilstand er en polymer med den generelle formelen (C5H8)n og er hentet fra melkesaften fra noen tropiske planter.
Gummi er svært løselig i benzen, bensin og karbondisulfid. Ved lave temperaturer blir den sprø og klissete når den varmes opp. For å forbedre de mekaniske og kjemiske egenskapene til gummi, omdannes den til gummi ved vulkanisering. For å oppnå gummiprodukter, støpes de først av en blanding av gummi med svovel, samt fyllstoffer: sot, kritt, leire og noen organiske forbindelser som tjener til å akselerere vulkanisering. Deretter varmes produktene opp - varm vulkanisering. Under vulkanisering binder svovel seg kjemisk til gummien. I tillegg inneholder vulkanisert gummi svovel i fri tilstand i form av bittesmå partikler.
Dienhydrokarboner polymeriserer lett. Polymerisasjonsreaksjonen av dienhydrokarboner ligger til grunn for syntesen av gummi. De gjennomgår addisjonsreaksjoner (hydrogenering, halogenering, hydrohalogenering):
H 2 C=CH-CH=CH 2 + H 2 -> H 3 C-CH=CH-CH 3
Alkyner :
Alkyner er umettede hydrokarboner hvis molekyler inneholder, i tillegg til enkeltbindinger, en trippel karbon-karbonbinding Formel-C n H 2n-2
Fysiske egenskaper :
Alkyner ligner de tilsvarende alkenene i sine fysiske egenskaper. Lavere (opptil C 4) er fargeløse og luktfrie gasser som har høyere kokepunkter enn deres analoger i alkener.
Alkyner er dårlig løselige i vann, men bedre i organiske løsemidler.
Kjemiske egenskaper :
Halogeneringsreaksjoner
Alkyner er i stand til å legge til ett eller to halogenmolekyler for å danne de tilsvarende halogenderivatene:
Hydrering
I nærvær av kvikksølvsalter tilsetter alkyner vann for å danne acetaldehyd (for acetylen) eller keton (for andre alkyner)

Mettede hydrokarboner er forbindelser som er molekyler som består av karbonatomer i en tilstand av sp 3 hybridisering. De er utelukkende forbundet med hverandre ved kovalente sigmabindinger. Navnet "mettede" eller "mettede" hydrokarboner kommer fra det faktum at disse forbindelsene ikke har evnen til å feste noen atomer. De er ekstreme, fullstendig mettede. Unntaket er sykloalkaner.
Hva er alkaner?
Alkaner er mettede hydrokarboner, og deres karbonkjede er åpen og består av karbonatomer koblet til hverandre ved hjelp av enkeltbindinger. Den inneholder ikke andre (det vil si doble, som alkener, eller trippel, som alkyler) bindinger. Alkaner kalles også parafiner. De fikk dette navnet fordi velkjente parafiner er en blanding av hovedsakelig disse mettede hydrokarboner C 18 - C 35 med spesiell inerthet.
Generell informasjon om alkaner og deres radikaler
Formelen deres: C n P 2 n +2, her er n større enn eller lik 1. Den molare massen beregnes ved å bruke formelen: M = 14n + 2. Karakteristisk trekk: endelsene i navnene deres er "-an". Restene av molekylene deres, som dannes som et resultat av erstatning av hydrogenatomer med andre atomer, kalles alifatiske radikaler, eller alkyler. De er betegnet med bokstaven R. Den generelle formelen for enverdige alifatiske radikaler: C n P 2 n +1, her er n større enn eller lik 1. Den molare massen til alifatiske radikaler beregnes ved formelen: M = 14n + 1. Et karakteristisk trekk ved alifatiske radikaler: avslutninger i navnene "- silt." Alkanmolekyler har sine egne strukturelle egenskaper:
- C-C-bindingen er karakterisert ved en lengde på 0,154 nm;
- CH-bindingen er karakterisert ved en lengde på 0,109 nm;
- bindingsvinkelen (vinkelen mellom karbon-karbonbindinger) er 109 grader og 28 minutter.

Alkaner begynner den homologe serien: metan, etan, propan, butan og så videre.
Fysiske egenskaper til alkaner
Alkaner er stoffer som er fargeløse og uløselige i vann. Temperaturen der alkaner begynner å smelte og temperaturen de koker ved øker i samsvar med økningen i molekylvekt og hydrokarbonkjedelengde. Fra mindre forgrenede til mer forgrenede alkaner synker koke- og smeltepunktene. Gassformige alkaner kan brenne med en lyseblå eller fargeløs flamme og produsere ganske mye varme. CH 4 -C 4 H 10 er gasser som heller ikke har lukt. C 5 H 12 - C 15 H 32 er væsker som har en spesifikk lukt. C 15 H 32 og så videre er faste stoffer som også er luktfrie.
Kjemiske egenskaper til alkaner
Disse forbindelsene er kjemisk inaktive, noe som kan forklares med styrken til sigmabindinger som er vanskelige å bryte - C-C og C-H. Det er også verdt å vurdere at C-C-bindinger er ikke-polare, og CH-bindinger er lavpolare. Dette er lavpolariserte typer bindinger som tilhører sigma-typen, og følgelig vil de mest sannsynlig bli brutt av en homolytisk mekanisme, som et resultat av at radikaler vil bli dannet. Dermed er de kjemiske egenskapene til alkaner hovedsakelig begrenset til radikale substitusjonsreaksjoner.

Nitreringsreaksjoner
Alkaner reagerer kun med salpetersyre med en konsentrasjon på 10 % eller med fireverdig nitrogenoksid i et gassformig miljø ved en temperatur på 140°C. Nitreringsreaksjonen til alkaner kalles Konovalov-reaksjonen. Som et resultat dannes nitroforbindelser og vann: CH 4 + salpetersyre (fortynnet) = CH 3 - NO 2 (nitrometan) + vann.
Forbrenningsreaksjoner
Mettede hydrokarboner brukes svært ofte som brensel, noe som er begrunnet med deres evne til å brenne: C n P 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n CO 2.
Oksidasjonsreaksjoner
De kjemiske egenskapene til alkaner inkluderer også deres evne til å oksidere. Avhengig av hvilke forhold som følger med reaksjonen og hvordan de endres, kan forskjellige sluttprodukter oppnås fra samme stoff. Mild oksidasjon av metan med oksygen i nærvær av en katalysator som akselererer reaksjonen og en temperatur på omtrent 200 ° C kan resultere i følgende stoffer:
1) 2CH 4 (oksidasjon med oksygen) = 2CH 3 OH (alkohol - metanol).
2) CH 4 (oksidasjon med oksygen) = CH 2 O (aldehyd - metanal eller formaldehyd) + H 2 O.
3) 2CH 4 (oksidasjon med oksygen) = 2HCOOH (karboksylsyre - metan eller maursyre) + 2H 2 O.

Også oksidasjonen av alkaner kan utføres i et gassformig eller flytende medium med luft. Slike reaksjoner fører til dannelse av høyere fettalkoholer og tilsvarende syrer.
Forhold til varme
Ved temperaturer som ikke overstiger +150-250°C, alltid i nærvær av en katalysator, oppstår en strukturell omorganisering av organiske stoffer, som består av en endring i rekkefølgen på atomforbindelsen. Denne prosessen kalles isomerisering, og stoffene som oppstår ved reaksjonen kalles isomerer. Således, fra normal butan, oppnås dens isomer - isobutan. Ved temperaturer på 300-600°C og tilstedeværelsen av en katalysator brytes CH-bindinger med dannelse av hydrogenmolekyler (dehydrogeneringsreaksjoner), hydrogenmolekyler med lukking av karbonkjeden inn i en syklus (cykliserings- eller aromatiseringsreaksjoner av alkaner) :
1) 2CH4 = C2H4 (eten) + 2H2.
2) 2CH4 = C2H2 (etyn) + 3H2.
3) C 7 H 16 (normal heptan) = C 6 H 5 - CH 3 (toluen) + 4 H 2.

Halogeneringsreaksjoner
Slike reaksjoner involverer innføring av halogener (deres atomer) i molekylet til et organisk stoff, noe som resulterer i dannelsen av en C-halogenbinding. Når alkaner reagerer med halogener, dannes halogenderivater. Denne reaksjonen har spesifikke egenskaper. Det fortsetter i henhold til en radikal mekanisme, og for å starte det, er det nødvendig å utsette blandingen av halogener og alkaner for ultrafiolett stråling eller bare varme den opp. Egenskapene til alkaner lar halogeneringsreaksjonen fortsette til fullstendig erstatning med halogenatomer er oppnådd. Det vil si at kloreringen av metan ikke vil ende i ett trinn og produksjonen av metylklorid. Reaksjonen vil gå videre, alle mulige substitusjonsprodukter vil bli dannet, starter med klormetan og slutter med karbontetraklorid. Eksponering av andre alkaner for klor under disse forholdene vil resultere i dannelse av forskjellige produkter som følge av substitusjon av hydrogen ved forskjellige karbonatomer. Temperaturen ved hvilken reaksjonen finner sted vil bestemme forholdet mellom sluttproduktene og dannelseshastigheten. Jo lengre hydrokarbonkjeden til alkanen er, jo lettere vil reaksjonen være. Under halogenering vil det minst hydrogenerte (tertiære) karbonatomet erstattes først. Den primære vil reagere etter alle de andre. Halogeneringsreaksjonen vil skje i trinn. I det første trinnet erstattes bare ett hydrogenatom. Alkaner interagerer ikke med halogenløsninger (klor- og bromvann).

Sulfokloreringsreaksjoner
De kjemiske egenskapene til alkaner kompletteres også av sulfokloreringsreaksjonen (kalt Reed-reaksjonen). Når de utsettes for ultrafiolett stråling, er alkaner i stand til å reagere med en blanding av klor og svoveldioksid. Som et resultat dannes det hydrogenklorid, samt et alkylradikal, som tilfører svoveldioksid. Resultatet er en kompleks forbindelse som blir stabil på grunn av fangsten av et kloratom og ødeleggelsen av dets neste molekyl: R-H + SO 2 + Cl 2 + ultrafiolett stråling = R-SO 2 Cl + HCl. Sulfonylkloridene dannet som et resultat av reaksjonen er mye brukt i produksjonen av overflateaktive stoffer.
Bruken av alkaner er ganske variert - de brukes som drivstoff, så vel som i mekanikk, medisin, etc. Rollen til disse kjemiske forbindelsene i det moderne menneskets liv kan neppe overvurderes.
Alkaner: egenskaper og kort beskrivelse
Alkaner er ikke-sykliske karbonforbindelser der karbonatomene er bundet sammen med enkle mettede bindinger. Disse stoffene representerer en hel rekke med visse egenskaper og egenskaper. følgende:
N representerer her antall karbonatomer. For eksempel CH3, C2H6.
De fire første representantene for alkanserien er gassformige stoffer: metan, etan, propan og butan. Følgende forbindelser (C5 til C17) er væsker. Serien fortsetter med forbindelser som er faste stoffer under normale forhold.
Når det gjelder kjemiske egenskaper, er alkaner lavaktive - de samhandler praktisk talt ikke med alkalier og syrer. Det er forresten de kjemiske egenskapene som bestemmer bruken av alkaner.
Imidlertid er disse forbindelsene preget av visse reaksjoner, inkludert erstatning av hydrogenatomer, samt molekylære spaltningsprosesser.
- Den mest karakteristiske reaksjonen er halogenering, hvor hydrogenatomer erstattes av halogener. Klorerings- og bromeringsreaksjonene til disse forbindelsene er av stor betydning.
- Nitrering er erstatning av et hydrogenatom med en nitrogruppe under en reaksjon med en fortynnet (10 % konsentrasjon) Under normale forhold reagerer ikke alkaner med syrer. For å utføre en slik reaksjon er det nødvendig med en temperatur på 140 °C.
- Oksidasjon - under normale forhold påvirkes ikke alkaner av oksygen. Imidlertid, etter antennelse i luft, kommer disse stoffene inn i sluttproduktene som er vann og
- Sprekking - denne reaksjonen skjer bare i nærvær av de nødvendige katalysatorene. Prosessen involverer spaltning av stabile homologe bindinger mellom karbonatomer. For eksempel, når butan er sprukket, kan reaksjonen produsere etan og etylen.
- Isomerisering - som et resultat av virkningen av visse katalysatorer, er en viss omorganisering av karbonskjelettet til alkanen mulig.
Anvendelser av alkaner
Den viktigste naturlige kilden til disse stoffene er slike verdifulle produkter som naturgass og olje. Bruksområdene for alkaner i dag er svært brede og varierte.
For eksempel, gassformige stoffer brukes som en verdifull drivstoffkilde. Et eksempel er metan, som naturgass er laget av, samt en propan-butanblanding.
En annen kilde til alkaner er olje , hvor viktigheten for den moderne menneskeheten er vanskelig å overvurdere. Petroleumsprodukter inkluderer:
- bensin - brukt som drivstoff;
- parafin;
- diesel eller lett gassolje;
- tung gassolje, som brukes som smøreolje;
- restene brukes til å lage asfalt.
Petroleumsprodukter brukes også til å produsere plast, syntetiske fibre, gummi og enkelte vaskemidler.
Vaselin og vaselin er produkter som består av en blanding av alkaner. De brukes i medisin og kosmetikk (hovedsakelig for fremstilling av salver og kremer), samt i parfymeri.
Parafin er et annet kjent produkt, som er en blanding av faste alkaner. Dette er en solid hvit masse, hvis oppvarmingstemperatur er 50 - 70 grader. I moderne produksjon brukes parafin til å lage lys. Fyrstikker er impregnert med samme stoff. I medisin utføres forskjellige termiske prosedyrer ved bruk av parafin.
Det ville være nyttig å starte med en definisjon av begrepet alkaner. Disse er mettede eller mettede Vi kan også si at dette er karboner der koblingen av C-atomer utføres gjennom enkle bindinger. Den generelle formelen er: CnH2n+ 2.
Det er kjent at forholdet mellom antall H- og C-atomer i molekylene deres er maksimalt sammenlignet med andre klasser. På grunn av det faktum at alle valenser er okkupert av enten C eller H, er de kjemiske egenskapene til alkaner ikke klart uttrykt, så deres andre navn er uttrykket mettede eller mettede hydrokarboner.
Det er også et eldre navn som best gjenspeiler deres relative kjemiske treghet - parafiner, som betyr "fri for affinitet."
Så, temaet for samtalen vår i dag er: "Alkaner: homologiske serier, nomenklatur, struktur, isomerisme." Data om deres fysiske egenskaper vil også bli presentert.
Alkaner: struktur, nomenklatur
I dem er C-atomene i en tilstand som kalles sp3-hybridisering. I denne forbindelse kan alkanmolekylet demonstreres som et sett med tetraedriske C-strukturer som er koblet ikke bare til hverandre, men også til H.
Mellom C- og H-atomene er det sterke, svært lavpolare s-bindinger. Atomer roterer alltid rundt enkle bindinger, og det er grunnen til at alkanmolekyler antar ulike former, og bindingslengden og vinkelen mellom dem er konstante verdier. Former som forvandles til hverandre på grunn av rotasjonen av molekylet rundt σ-bindinger kalles vanligvis konformasjoner.

I prosessen med abstraksjon av et H-atom fra det aktuelle molekylet, dannes 1-valente arter kalt hydrokarbonradikaler. De vises som et resultat av ikke bare, men også uorganiske forbindelser. Hvis du trekker 2 hydrogenatomer fra et mettet hydrokarbonmolekyl, får du 2-valente radikaler.
Dermed kan nomenklaturen til alkaner være:
- radial (gammel versjon);
- substitusjon (internasjonal, systematisk). Det ble foreslått av IUPAC.
Funksjoner av radiell nomenklatur
I det første tilfellet er nomenklaturen til alkaner karakterisert som følger:
- Betraktning av hydrokarboner som derivater av metan, hvor 1 eller flere H-atomer er erstattet av radikaler.
- Høy grad av bekvemmelighet ved ikke veldig komplekse forbindelser.
Funksjoner ved substitusjonsnomenklatur
Den substitutive nomenklaturen til alkaner har følgende egenskaper:
- Grunnlaget for navnet er 1 karbonkjede, mens de resterende molekylære fragmentene betraktes som substituenter.
- Hvis det er flere identiske radikaler, er tallet angitt foran navnet deres (strengt i ord), og de radikale tallene er atskilt med komma.
Kjemi: nomenklatur av alkaner
For enkelhets skyld er informasjonen presentert i tabellform.
Stoffnavn | Grunnlaget for navnet (roten) | Molekylær formel | Navn på karbonsubstituent | Karbonsubstituentformel |
Ovennevnte nomenklatur av alkaner inkluderer navn som har utviklet seg historisk (de første 4 medlemmene av serien av mettede hydrokarboner).
Navnene på uekspanderte alkaner med 5 eller flere C-atomer er avledet fra greske tall som gjenspeiler det gitte antallet C-atomer. Dermed indikerer suffikset -an at stoffet er fra en serie mettede forbindelser.

Når du komponerer navnene på utfoldede alkaner, er hovedkjeden den som inneholder maksimalt antall C-atomer. Den er nummerert slik at substituentene har det laveste antallet. I tilfelle av to eller flere kjeder av samme lengde, blir hovedkjeden den som inneholder flest substituenter.
Isomerisme av alkaner
Moderhydrokarbonet i deres serie er metan CH4. Med hver påfølgende representant for metanserien observeres en forskjell fra den forrige i metylengruppen - CH2. Dette mønsteret kan spores gjennom hele serien av alkaner.
Den tyske forskeren Schiel fremmet et forslag om å kalle denne serien homologisk. Oversatt fra gresk betyr det «lik, lignende».
Dermed er en homolog serie et sett med beslektede organiske forbindelser som har samme struktur og lignende kjemiske egenskaper. Homologer er medlemmer av en gitt serie. Homolog forskjell er en metylengruppe der 2 nabohomologer er forskjellige.
Som nevnt tidligere kan sammensetningen av ethvert mettet hydrokarbon uttrykkes ved å bruke den generelle formelen CnH2n + 2. Således er det neste medlem av den homologe serie etter metan etan - C2H6. For å konvertere strukturen fra metan, er det nødvendig å erstatte 1 H-atom med CH3 (figur nedenfor).

Strukturen til hver påfølgende homolog kan utledes fra den forrige på samme måte. Som et resultat dannes propan fra etan - C₃H₈.
Hva er isomerer?
Dette er stoffer som har identisk kvalitativ og kvantitativ molekylsammensetning (identisk molekylformel), men en annen kjemisk struktur, og også har ulike kjemiske egenskaper.
Hydrokarbonene diskutert ovenfor er forskjellige i en parameter som kokepunkt: -0,5° - butan, -10° - isobutan. Denne typen isomerisme kalles karbonskjelettisomerisme, den tilhører strukturtypen.
Antall strukturelle isomerer øker raskt når antallet karbonatomer øker. Således vil C10H22 tilsvare 75 isomerer (ikke inkludert romlige), og for C15H32 er 4347 isomerer allerede kjent, for C20H42 - 366.319.
Så det har allerede blitt klart hva alkaner er, homologe serier, isomerisme, nomenklatur. Nå er det verdt å gå videre til reglene for sammenstilling av navn i henhold til IUPAC.

IUPAC-nomenklatur: regler for dannelse av navn
Først er det nødvendig å finne i hydrokarbonstrukturen den karbonkjeden som er lengst og inneholder maksimalt antall substituenter. Deretter må du nummerere C-atomene i kjeden, fra den enden som substituenten er nærmest.
For det andre er basen navnet på et uforgrenet mettet hydrokarbon, som, når det gjelder antall C-atomer, tilsvarer hovedkjeden.
For det tredje, før basen er det nødvendig å indikere numrene til lokantene nær som substituentene er lokalisert. Navnene på substituentene er skrevet etter dem med en bindestrek.
For det fjerde, i tilfelle av tilstedeværelsen av identiske substituenter ved forskjellige C-atomer, kombineres lokantene, og et multipliserende prefiks vises foran navnet: di - for to identiske substituenter, tre - for tre, tetra - fire, penta - for fem , osv. Tall må skilles fra hverandre med komma, og fra ord med bindestrek.
Hvis det samme C-atomet inneholder to substituenter samtidig, skrives også lokanten to ganger.
I henhold til disse reglene dannes den internasjonale nomenklaturen for alkaner.

Newman-projeksjoner
Denne amerikanske vitenskapsmannen foreslo spesielle projeksjonsformler for grafisk demonstrasjon av konformasjoner - Newman-projeksjoner. De tilsvarer skjemaene A og B og er presentert i figuren nedenfor.

I det første tilfellet er dette en A-hindret konformasjon, og i det andre er det en B-hemmet konformasjon. I posisjon A er H-atomene plassert i minimumsavstand fra hverandre. Denne formen tilsvarer den høyeste energiverdien, på grunn av at frastøtingen mellom dem er størst. Dette er en energimessig ugunstig tilstand, som et resultat av at molekylet har en tendens til å forlate det og bevege seg til en mer stabil posisjon B. Her er H-atomene så langt fra hverandre som mulig. Dermed er energiforskjellen mellom disse posisjonene 12 kJ/mol, på grunn av dette er den frie rotasjonen rundt aksen i etanmolekylet, som forbinder metylgruppene, ujevn. Etter å ha kommet inn i en energisk gunstig posisjon, henger molekylet der, med andre ord, "bremser ned." Det er derfor det kalles hemmet. Resultatet er at 10 tusen etanmolekyler er i hemmet form av konformasjon ved romtemperatur. Bare én har en annen form - skjult.
Innhenting av mettede hydrokarboner
Fra artikkelen har det allerede blitt kjent at disse er alkaner (deres struktur og nomenklatur ble beskrevet i detalj tidligere). Det ville være nyttig å vurdere måter å skaffe dem på. De frigjøres fra naturlige kilder som olje, naturlig og kull. Syntetiske metoder brukes også. For eksempel, H₂ 2H₂:
- Hydrogeneringsprosess CnH₂n (alkener)→ CnH₂n+2 (alkaner)← CnH₂n-2 (alkyner).
- Fra en blanding av C- og H-monoksid - syntesegass: nCO+(2n+1)H₂→ CnH₂n+2+nH₂O.
- Fra karboksylsyrer (deres salter): elektrolyse ved anoden, ved katoden:
- Kolbe-elektrolyse: 2RCOONa+2H2O-→R-R+2CO2+H2+2NaOH;
- Dumas reaksjon (legering med alkali): CH3COONa+NaOH (t)→CH4+Na₂CO₃.
- Oljesprekking: CnH2n+2 (450-700°) → CmH2m+2+ Cn-mH2(n-m).
- Gassifisering av brensel (faststoff): C+2H₂→CH4.
- Syntese av komplekse alkaner (halogenderivater) som har færre C-atomer: 2CH₃Cl (klormetan) +2Na →CH₃- CH₃ (etan) +2NaCl.
- Dekomponering av metanider (metallkarbider) med vann: Al4C3+12H₂O→4Al(OH₃)↓+3CH4.
Fysiske egenskaper til mettede hydrokarboner
For enkelhets skyld er dataene gruppert i en tabell.
Formel | Alkan | Smeltepunkt i °C | Kokepunkt i °C | Tetthet, g/ml |
0,415 ved t = -165°C |
||||
0,561 ved t= -100°C |
||||
0,583 ved t = -45°C |
||||
0,579 ved t = 0°C |
||||
2-metylpropan | 0,557 ved t = -25°C |
|||
2,2-dimetylpropan | ||||
2-metylbutan | ||||
2-metylpentan | ||||
2,2,3,3-tetra-metylbutan | ||||
2,2,4-trimetylpentan | ||||
n-C10H22 | ||||
n-C11H24 | n-Undecane | |||
n-C12H26 | n-dodekan | |||
n-C13H28 | n-Tridecan | |||
n-C14H30 | n-tetradekan | |||
n-C15H32 | n-Pentadecan | |||
n-C16H34 | n-heksadekan | |||
n-C20H42 | n-Eicosane | |||
n-C30H62 | n-Triakontan | 1 mmHg st | ||
n-C40H82 | n-tetrakontan | 3 mmHg Kunst. | ||
n-C50H102 | n-Pentacontan | 15 mmHg Kunst. | ||
n-C60H122 | n-heksakontan | |||
n-C70H142 | n-heptakontan | |||
n-C100H202 |
Konklusjon
Artikkelen undersøkte et slikt konsept som alkaner (struktur, nomenklatur, isomerisme, homologe serier, etc.). Det sies litt om egenskapene til radielle og substitutive nomenklaturer. Metoder for å oppnå alkaner er beskrevet.
I tillegg lister artikkelen i detalj hele nomenklaturen av alkaner (testen kan hjelpe deg med å assimilere informasjonen som mottas).