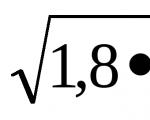Ionebytterreaksjoner vil fullføres. Ioniske reaksjonsligninger
Oppgave 1. Beregn konsentrasjonen av hydrogenioner i HCN-løsningen (C m = 10 -3 M), hvis = 4,2∙10 -3 .
Løsning: Dissosiasjonen av blåsyre fortsetter i henhold til ligningen HCN ↔ H + + CN - ; konsentrasjonene av ioner og i løsningen er lik hverandre (siden H+: C N - = 1:1, hvor
- støkiometriske koeffisienter) dvs. = = C m, mol/l; Da = = 4,2∙10 -3 ∙ 10 -3 = 4,210 -7 mol/l.
Løsning : Ammoniumhydroksid dissosieres som følger:
NH 4 OH ↔ NH 4 + + OH -, dissosiasjonskonstanten har formen
K d =;
konsentrasjonene av ammonium- og hydroksidioner er de samme ( (NH4+): (OH -) = 1:1), betegner vi dem som X:
= = x mol/l , så vil uttrykket for K d ha formen
1,810 -5 = X 2 / 0,01-X. Vurderer X<< С м, решаем уравнение
1,810 -5 =x 2 / 0,01, relativ X:
X=
 =4,2∙10-4 mol/l; = 4,2∙10 -4 mol/l.
=4,2∙10-4 mol/l; = 4,2∙10 -4 mol/l.
Konsentrasjonene av hydrogen og hydroksidioner er relatert gjennom det ioniske produktet av vann K w= =10 -14, la oss uttrykke konsentrasjonen av hydrogenioner = K w/ og beregn verdien:
110 -14 /4,210 -4 = 2,310 -11 mol/l.
Oppgave 3. Bestem pH til HCl-løsningen ( =1), hvis Cm =2∙10 -3 M
Løsning: Dissosiasjonen av saltsyre fortsetter i henhold til ligningen
HCl H + + Cl - , konsentrasjon av hydrogenioner = C m =1∙2∙10 -3 = =2∙10 -3 mol/l. Hydrogenindikator pH = - log = - log2∙10 -3 = 2,7.
Oppgave 4. Bestem den molare konsentrasjonen av ammoniumhydroksid hvis pH=11 og Kd=1,8∙10 -5.
Løsning: Konsentrasjon av hydrogenioner =10 - pH =10 -11 mol/l. Fra det ioniske produktet av vann bestemmer vi konsentrasjonen = K w / = 10 -14 /10 -11 =10 -3 mol/l. Ammoniumhydroksid er en svak base og er preget av dissosiasjonsreaksjonsligningen
NH 4 OH ↔ NH 4 + + OH - . Uttrykk for dissosiasjonskonstanten
K d =. 
Fra Ostwalds lov følger det at = = ∙C m, a TIL d = 2 C m. Ved å kombinere ligningene får vi C m = 2 / K d = 10 -6 / 1,8∙10 -5 = 0,056 mol/l
Løselighetsprodukt
Stoffer, avhengig av deres natur, har forskjellig løselighet i vann, som varierer fra fraksjoner av et milligram til hundrevis av gram per liter. Lite løselige elektrolytter danner mettede løsninger med svært lave konsentrasjoner, så vi kan anta at graden av deres dissosiasjon når enhet. En mettet løsning av en lite løselig elektrolytt er således et system som består av selve løsningen, som er i likevekt med et bunnfall av det oppløste stoffet. Under konstante ytre forhold er bunnfallsoppløsningshastigheten lik hastigheten på krystalliseringsprosessen: K n EN m ↔ n K+ m + m EN- n (1)
utfellingsløsning
For å beskrive denne heterogene likevektsprosessen brukes en likevektskonstant, kalt løselighetsproduktet PR = n m, hvor og er konsentrasjonene av ioner i en mettet løsning (mol/l). For eksempel:
AgCl= Ag + +Cl-, PR = ; Her n=m=1.
PbI2 = Pb2+ +2I-, PR = 2; Her n=1, m=2.
PR avhenger av arten av det oppløste stoffet og temperaturen. PR er en tabellverdi. Å kunne PR , du kan beregne konsentrasjonen av en mettet løsning av et stoff, og også beregne dens løselighet i g per 100 ml vann (verdi s, gitt i referanselitteraturen) og bestemme muligheten for utfelling av stoffet.
For ligning (1) er forholdet mellom konsentrasjonen av en mettet løsning av et vanskelig løselig stoff (C m, mol/l) og PR-verdien bestemt av følgende ligning: 
 ,
,
Hvor n Og m –støkiometriske koeffisienter i lign. 1.
Oppgave 5. Konsentrasjonen av den mettede løsningen (C m)Mg(OH) 2 er 1,1 10 -4 mol/l. Skriv ned uttrykket for PR og beregne verdien.
Løsning: I en mettet løsning av Mg(OH) 2 etableres likevekt mellom bunnfallet og løsningen Mg(OH) 2 ↔Mg 2+ + 2OH - , hvor PR-uttrykket har formen PR = 2. Når du kjenner konsentrasjonen av ioner, kan du finne dens numeriske verdi. Gitt den fullstendige dissosiasjonen
Mg(OH) 2, dens konsentrasjon mettet løsning C m = = 1,110 -4 mol/l, a = 2 = 2,210 -4 mol/l. Derfor er PR= 2 = 1,1. 10 -4 (2,2 10 -4) 2 = 5,3. 10 -12.
Oppgave 6. Beregn konsentrasjonen av den mettede løsningen og PR av sølvkromat hvis 0,011 g salt er oppløst i 0,5 l vann.
Løsning:
For å bestemme molkonsentrasjonen til en mettet løsning Ag 2 CrO 4 bruker vi formelen C M =
 ,
Hvor m- masse av oppløst stoff (g), M - molar masse (g/mol), V- volum av løsning (l). M (Ag 2
CrO 4
)
=332 g/mol. cm = 9,48. 10 -5 mol/l. Oppløsningen av sølv (I) kromat er ledsaget av fullstendig ( = 1) dissosiasjon av saltet: Ag 2 CrO 4 ↔ 2Ag + +CrO 4 2-, PR = 2, hvor = C m = 9,48. 10 -5 mol/l, a = 2 =1,89610 -4.
,
Hvor m- masse av oppløst stoff (g), M - molar masse (g/mol), V- volum av løsning (l). M (Ag 2
CrO 4
)
=332 g/mol. cm = 9,48. 10 -5 mol/l. Oppløsningen av sølv (I) kromat er ledsaget av fullstendig ( = 1) dissosiasjon av saltet: Ag 2 CrO 4 ↔ 2Ag + +CrO 4 2-, PR = 2, hvor = C m = 9,48. 10 -5 mol/l, a = 2 =1,89610 -4.
Dermed PR = (1,89610 -4) 2 (9,4810 -5) = 3,410 -12.
Oppgave 7. Er det mulig å fremstille løsninger av CaCO 3 salt med konsentrasjoner av CaCO 3 C 1 = 10 -2 M og C 2 = 10 -6 M, hvis PR CaCO 3 = 3,810 -9.
Løsning: Når du kjenner PR-verdien, kan du beregne konsentrasjonen
mettet saltløsning og sammenligne den med den foreslåtte
konsentrasjoner, trekke en konklusjon om muligheten eller umuligheten av å tilberede løsninger. Oppløsningen av kalsiumkarbonat fortsetter i henhold til skjemaet CaCO 3 ↔Ca 2+ +CO 3 2- I denne ligningen n = m = 1 da
 =
=
 ≈ 6,2 10 -5 mol/l,
≈ 6,2 10 -5 mol/l,
C 1 > C m – løsningen kan ikke tilberedes, siden det dannes et bunnfall;
C 2< С м – раствор приготовить можно.
Ionebytterreaksjoner
Elektrolyttløsninger er preget av ionebytterreaksjoner. En forutsetning for at slike reaksjoner skal skje nesten fullstendig er fjerning av visse ioner fra løsningen på grunn av:
1) sedimentdannelse
FeSO 4 + 2 NaOH Fe(OH) 2 + Na 2 SO 4 - molekylligning (MU)
Fe 2+ +SO 4 2- +2Na + +2OH - Fe(OH) 2 +2Na + +SO 4 2- ion-molekylær ligning (IMU).
Fe 2+ +2OH - Fe(OH) 2 (PR Fe (OH) 2 = 4,810 -16) – en kort ione-molekylær ligning for dannelse av bunnfall;
2) gassfrigjøring
Na 2 CO 3 + 2H 2 SO 4 H 2 CO 3 + 2NaHSO 4 (MU)
2Na + +CO 3 2- + 2H + + 2HSO 4 - H 2 C0 3 + 2Na + + 2HSO 4 - (IMU)
2H + + CO 3 2- H 2 C0 3 H 2 O + C0 2 - ion - molekylært nivå
dannelse av en flyktig forbindelse.
3) dannelse av svake elektrolytter
a) enkle stoffer:
2KCN + H 2 SO 4 2HCN + K 2 SO 4 (MU)
2K + + 2CN - + 2H + +SO 4 2- 2HCN + 2K + +SO 4 2- (IMU)
CN - +H + HCN (K d HCN = 7,8 10 -10) – ionemolekylært nivå for dannelse av den svake elektrolytten HCN.
b) komplekse forbindelser:
ZnCl 2 + 4NH 3 Cl 2 (MU)
Zn 2+ + 2Cl - +4NH 3 2+ + 2Cl - -(IMU)
Zn 2+ +4NH 3 2+ - en kort ionisk-molekylær ligning for dannelsen av et komplekst kation.
Det er prosesser der svake elektrolytter eller dårlig løselige forbindelser er blant utgangsmaterialene og reaksjonsproduktene. I dette tilfellet skifter likevekten mot dannelsen av stoffer som har den laveste dissosiasjonskonstanten eller mot dannelsen av et mindre løselig stoff:
A) NH 4 OH + HCl NH 4 Cl + H 2 O (MU)
NH 4 OH + H + + Cl - NH 4 + + Cl - + H 2 O
NH 4 OH + H + NH 4 + + H 2 O (IMU)
K d ( NH 4 OH) =1,8 10 -5 > K d ( H 2 O) =1,810 -16.
Likevekten forskyves mot dannelsen av vannmolekyler.
B) AgCl + NaI AgI + NaCl (MU)
AgCl + Na + +I - AgI+ Na + +Cl -
AgCl + I - AgI + Cl - (IMU)
ETC AgCl =1,7810 -10 > ETC AgI =8,310 -17.
Likevekten forskyves mot dannelsen av et AgI-utfelling.
C) Det kan være prosesser i ligningene hvor det er både en dårlig løselig forbindelse og en svak elektrolytt
MnS + 2HCl MnCl 2 + H 2 S (MU)
MnS + 2H + +2Cl - Mn 2+ + 2Cl - + H 2S
MnS + 2 H + Mn 2+ + H 2 S (IMU)
PR MnS =2,510 -10; =  =1.58.10 -5 mol/l
=1.58.10 -5 mol/l
K d H 2 S = K 1 K 2 = 610 -22; =  =5.4.10 -8 mol/l
=5.4.10 -8 mol/l
Bindingen av S 2- ioner til H 2 S-molekyler skjer mer fullstendig enn i MnS, derfor fortsetter reaksjonen i foroverretningen, mot dannelsen av H 2 S
Hydrolyse av salter
Hydrolyse er resultatet av polarisasjonsinteraksjonen mellom salioner og deres hydreringsskall. Hydrolyse er en utvekslingsreaksjon i løsning mellom vannmolekyler og saltioner. Som et resultat av hydrolyse, på grunn av dannelsen av en svak elektrolytt (svak syre eller svak base), endres den ioniske likevekten H 2 O⇄H + + OH - på grunn av bindingen av H + eller OH - og pH-miljøet endres . Salter som inneholder svake syre- eller svake baseioner gjennomgår hydrolyse. Salter dannet av ioner av en sterk syre og en sterk base gjennomgår ikke hydrolyse (NaCl, Na 2 SO 4). Hydrolyseproduktene kan være svake elektrolytter, dårlig dissosierende, lite løselige og flyktige stoffer. Hydrolyse er en trinnvis reaksjon; i tilfelle av et flerdobbelt ladet ion, er antall trinn lik ladningen. Hydrolyse ved kation salter dannet av sterke sure anioner og svake basekationer påvirkes. For eksempel inkluderer svake baser hydroksyder s- Og d-metaller (K d 10 -4), samt ammoniumhydroksid.
Sinkklorid er et salt dannet av den svake basen Zn(OH) 2 og den sterke syren HCl. Sinkkationen har en ladning på 2+, så hydrolyse vil skje i to trinn:
Zn 2+ + HOH ↔ ZnOH + + H + I trinn
ZnOH + +HOH↔ Zn(OH)2 +H + II trinn
Som et resultat av denne interaksjonen oppstår et overskudd av H + ioner ([H + ] [OH - ]), løsningen surgjøres (pH<7).
Hydrolyse ved anion. Denne typen hydrolyse er typisk for salter dannet av anioner av en svak syre (K d 10 -3) og kationer av en sterk base (K d > 10 -3). La oss vurdere hydrolysen av kaliumkarbonat - et salt dannet av svak karbonsyreH 2 CO 3 (K d I = 4,5. 10 -7) og den sterke basen KOH, har karboksoanionet en ladning (2-). Hydrolyse skjer i to stadier:
CO 3 2- +H 2 O↔HCO 3 - +OH - Trinn I
HCO 3 - +H 2 O↔H 2 CO 3 + OH - II trinn
I dette tilfellet frigjøres OH - ioner ([H + ] [OH - ]) - løsningen blir alkalisk (pH > 7).
Irreversibel hydrolyse. Salter dannet av en svak base og en svak syre hydrolyserer ved kation og anion. Resultatet av hydrolyse vil avhenge av verdien Til d baser og syrer. La oss vurdere hydrolysen av ammoniumfluorid, et salt dannet av svak
base NH4OH (Kd = 1,8 . 10-5) og svak syre HF (Kd = 6,8 . 10-4):
NH 4 F + HOH NH 4 OH + HF
I dette tilfellet K d ( NH 4 OH) K d ( HF), derfor vil hydrolyse (hovedsakelig) fortsette langs kationet og reaksjonen til mediet vil være svakt sur.
Utvekslingsreaksjoner mellom elektrolyttløsninger
Reaksjoner som fører til dannelse av et bunnfall. Hell 3-4 ml kobber(I)sulfatløsning i ett reagensrør, samme mengde kalsiumkloridløsning i det andre, og aluminiumsulfat i det tredje. Tilsett litt natriumhydroksidløsning i det første reagensglasset, natriumortofosfatløsning i det andre og bariumnitratløsning i det tredje. Det dannes utfellinger i alle reagensglass.
Trening. Skriv reaksjonsligninger i molekylær, ionisk og forkortet ionisk form. Forklar hvorfor det ble dannet nedbør. Løsninger av hvilke andre stoffer kan helles i reagensglass for å forårsake nedbør? Skriv ligninger for disse reaksjonene i molekylær, ionisk og forkortet ionisk form.
Reaksjoner som involverer utslipp av gass. Hell 3-4 ml natriumsulfittløsning i det ene reagensrøret, og det samme volumet natriumkarbonatløsning i det andre. Tilsett samme mengde svovelsyre til hver av dem. Det første reagensrøret avgir en gass med en skarp lukt, det andre reagensrøret avgir en luktfri gass.
Trening. Skriv ligninger for reaksjonene som skjer i molekylær, ionisk og forkortet ionisk form. Tenk på hvilke andre syrer som kan brukes på disse løsningene for å oppnå lignende resultater. Skriv ligninger for disse reaksjonene i molekylær, ionisk og forkortet ionisk form.
Reaksjoner som oppstår med dannelse av et lett dissosierende stoff. Hell 3-4 ml natriumhydroksidløsning i ett reagensglass og tilsett to eller tre dråper fenolftalein. Løsningen får en karmosinrød farge. Tilsett deretter salt- eller svovelsyre til fargen blir misfarget.
Hell ca. 10 ml kobber(II)sulfat i et annet reagensrør og tilsett litt natriumhydroksidløsning. Det dannes et blått bunnfall av kobber(II)hydroksid. Hell svovelsyre i reagensrøret til bunnfallet er oppløst.
Trening. Skriv ligninger for reaksjonene som skjer i molekylær, ionisk og forkortet ionisk form. Forklar hvorfor misfarging oppsto i det første reagensglasset, og oppløsning av bunnfallet i det andre. Hvilke vanlige egenskaper har løselige og uløselige baser?
Kvalitativ reaksjon på kloridion. Hell 1-2 ml fortynnet saltsyre i ett reagensrør, samme mengde natriumkloridløsning i det andre og kalsiumkloridløsning i det tredje. Tilsett noen dråper sølv(I)nitratløsning AgNO3 i alle reagensglass. Sjekk om bunnfallet løses opp i konsentrert salpetersyre.
Trening. Skriv likningene for de tilsvarende kjemiske reaksjonene i molekylær, ionisk og forkortet ionisk form. Tenk på hvordan du kan skille: a) saltsyre fra andre syrer; b) klorider fra andre salter; c) løsninger av klorider fra saltsyre. Hvorfor kan man også bruke bly(II)nitratløsning i stedet for sølv(I)nitratløsning?
Leksjonen vil undersøke betingelsene for at ionebytterreaksjoner kan fortsette til fullføring. For bedre å forstå hvilke forhold som må overholdes for at ionebytterreaksjoner skal fullføres, vil vi gjennomgå hva disse reaksjonene er og deres essens. Det er gitt eksempler for å forsterke disse konseptene.
Tema: Kjemisk binding. Elektrolytisk dissosiasjon
Leksjon: Strømningsforholdionebytterreaksjoner til ferdigstillelse
Hvis du prøver å reagere natriumhydroksid med kaliumklorid, vil reaksjonen ikke skje. I en reaksjon utveksles ioner, men det dannes ingen produkter. La oss se på årsakene til dette. Stoffer dannet som et resultat av gjensidig tiltrekning kan dissosiere.
1. Ionebytterreaksjoner som fører til dannelse av et bunnfall.
Tidligere ble reaksjonsligningene som resulterte i dannelsen av et bunnfall vurdert.
Alle disse reaksjonene tilhørte ionebytterreaksjoner. Det kan konkluderes med at en av betingelsene for at ionebytterreaksjonen kan fullføres er dannelsen av et bunnfall.
BaCl 2 + Na 2 CO 3 → BaCO 3 ↓ + 2 NaCl.
Ba 2+ +2Cl - + 2Na + + CO 3 2- →BaCO 3 ↓ + 2Na + +2Cl - komplett ionisk ligning
Ba 2+ + CO 3 2- → BaCO 3 ↓ forkortet ionisk ligning.
La oss skrive en annen reaksjonsligning som fører til dannelsen av et bunnfall.
CuSO 4 + 2NaOH → Cu(OH) 2 ↓ + Na 2 SO 4
Cu 2+ + SO 4 2- +2Na + + 2OH - → Cu(OH) 2 ↓ + 2Na + + SO 4 2- komplett ionisk ligning
Cu 2+ + 2OH - → Cu(OH) 2 ↓ forkortet ionisk ligning.
Konklusjon: Ionebytterreaksjoner fortsetter til fullførelse hvis resultatet er et bunnfall.
Ris. 1. Nøytraliseringsreaksjon ()
Vurder reaksjonen av nøytralisering av natriumhydroksid med saltsyre.
NaOH + HCl → NaCl+ H 2 O
Na + + OH - + H + + Cl - →Na + + Cl - + H 2 O komplett ionisk ligning
OH - + H + → H 2 O redusert ionisk ligning
Denne reaksjonen fortsetter til fullføring, fordi resultatet er et lett dissosierende stoff - vann.
Konklusjon: Ionebytterreaksjoner fortsetter til fullførelse hvis resultatet er et lett dissosierende stoff.
Du vet at kalsiumkarbonat reagerer godt med saltsyre.
CaCO 3 + 2 HCl → CaCl 2 + H 2 O + CO 2
CaCO 3 +2H + + 2Cl - → Ca 2+ +2Cl - + H 2 O + CO 2 komplett ionisk ligning
2H + + CaCO 3 → Ca 2+ + H 2 O + CO 2 forkortet ionisk ligning.
Som et resultat av denne reaksjonen produseres karbondioksid, som dannes under nedbrytningen av svak karbonsyre. Vær oppmerksom på at kalsiumkarbonat er et uløselig stoff og brytes ikke ned til ioner. I den komplette ioniske ligningen skriver vi bare hydrogenklorid og kalsiumklorid som ioner. De resterende formlene forblir uendret, siden disse stoffene ikke er eksponert.
Konklusjon: Ionebytterreaksjoner fortsetter til fullføring hvis de resulterer i en gass.
I denne leksjonen undersøkte du betingelsene for at ionebytterreaksjoner kan fortsette til fullføring. Ionebytterreaksjoner fortsetter til fullførelse hvis resultatet er en utfelling, lett dissosierende substans eller gass.
1. Rudzitis G.E. Uorganisk og organisk kjemi. 9. klasse: lærebok for allmenne utdanningsinstitusjoner: grunnnivå / G. E. Rudzitis, F.G. Feldman. M.: Opplysning. 2009 119 s.: ill.
2. Popel P.P. Kjemi: 8. klasse: lærebok for allmenne utdanningsinstitusjoner / P.P. Popel, L.S. Krivlya. -K.: IC “Academy”, 2008.-240 s.: ill.
3. Gabrielyan O.S. Kjemi. 9. klasse. Lærebok. Utgiver: Bustard: 2001. 224s.
1. nr. 3,4,5 (s.22) Rudzitis G.E. Uorganisk og organisk kjemi. 9. klasse: lærebok for allmenne utdanningsinstitusjoner: grunnnivå / G. E. Rudzitis, F.G. Feldman. M.: Opplysning. 2009 119 s.: ill.
2. Hva observerer du når du lager deig når du tilsetter eddik i brus? Skriv reaksjonsligningen.
3. Hvorfor dannes det avleiring i kjelen? Hvordan fjerne den? Skriv reaksjonslikningene.
Mål:
- Elevene skal tilegne seg kunnskap om ionebytterreaksjoner og forholdene de oppstår under.
- fortsette å utvikle ferdighetene til å skrive ligninger av dissosiasjoner av stoffer;
- arbeid med løselighetstabellen;
- utvikle logisk tenkning når du gjenkjenner elektrolytter og ikke-elektrolytter, sammenligning, observasjon; utvikle praktiske ferdigheter og evner, trekke konklusjoner;
- skrive reaksjonsligninger i molekylære, fullioniske og reduserte ioniske former.
Metoder og metodiske teknikker: verbalt-visuelt, heuristisk, gruppefrontalt laboratoriearbeid.
Utstyr:
- på elevenes skrivebord: H 2 SO 4, BaCl 2, Na 2 CO 3, fenolftalein, NaOH, 4 sprøyter, tablett, løselighetstabell, tabell å fylle ut.
- til læreren: H 2 SO 4, BaCl 2, Na 2 CO 3, fenolftalein, NaOH, 3 reagensglass, i 2 beholdere: brus og salt, vann, eddiksyre.
I løpet av timene
1. Organisatorisk øyeblikk.
2. Målsetting.
Lærer. Gutter, forestill deg at på kjøkkenet ditt er det salt og brus i 2 identiske glass uten etiketter. Hvordan kan du gjenkjenne disse to stoffene uten å smake på dem?
Lærer. For å finne det ut, må vi bli kjent med ionebytterreaksjoner, bestemme betingelsene for deres forekomst og lære å skrive komplette, forkortede ioniske ligninger. For bedre å forstå mekanismen for ionebytterreaksjoner, la oss huske hvilke stoffer som kalles elektrolytter.
Student. Elektrolytter er stoffer som leder elektrisk strøm i smelter og løsninger.
Lærer. Hvorfor leder elektrolytter i løsninger og smelter elektrisk strøm?
Student. Elektrolytter leder elektrisitet fordi ioner dannes i løsninger og smelter.
Lærer. Hva er elektrolytisk dissosiasjon?
Student. Prosessen med å bryte ned elektrolytten til ioner kalles elektrolytisk dissosiasjon.
Lærer. La oss skrive dissosiasjonsligningene for ulike stoffer. (3 elever jobber med kortene på tavlen):
- Kort nr. 1. Skriv oppsummerende dissosiasjonsligninger for stoffer: H 2 SO 4, HCl.
- Kart nr. 2. Skriv de overordnede dissosiasjonsligningene for stoffene: Na 2 CO 3, BaCl 2.
- Kort nr. 3. Skriv de totale dissosiasjonsligningene for stoffer: NaOH, Ba(OH) 2
Lærer. Klasseoppgave: velg elektrolytter og ikke-elektrolytter fra denne listen over stoffer.
KCl, CuO, CuSO4, Cu(OH)2, BaSO4, K2SO4. (fra et ark).
For elektrolytter, skriv oppsummerende dissosiasjonsligninger. (ved tavlen).
Lærer. La oss sjekke notatene på tavlen.
Lærer. Gutter, navn fra hvilke ioner det uløselige stoffet BaSO 4 dannes?
Student. Bariumsulfat dannes fra bariumioner og sulfationer.
Lærer. Nevn stoffene, ved hjelp av løselighetstabellen, hvis løsninger inneholder Ba 2+-ionet og SO 4 2- ?
Student. For eksempel bariumklorid og svovelsyre.
Lærer. La oss skrive ned ligningen for reaksjonen mellom H 2 SO 4 og BaCl 2 (elev ved tavlen).
BaCl2 + H2SO4 = BaS04 + 2HCl
Lærer. Reaksjoner som oppstår i elektrolyttløsninger kalles ionebytterreaksjoner. For å finne ut under hvilke forhold ionebytterreaksjoner oppstår, la oss gjøre laboratoriearbeid:
Formål: Å gjøre seg kjent med betingelsene for slike reaksjoner. (skriv i notatbok)
Erfaring nr. 1.Å oppnå BaSO 4. (i stedet for erfaring kan du bruke et fragment av en leksjon fra den "virtuelle skolen til Cyril og Methodius" 9. klasse leksjon nr. 6)
Læreren gjør det samme ved tavlen.
Læreren kommenterer: tilsett en løsning av H 2 SO 4 til BaCl 2-løsningen Hva observerer vi?
Elev: Et hvitt bunnfall falt.
Lærer: La oss skrive ned den komplette ioniske ligningen; for dette skriver vi ned hvilke ioner som var i løsningene av de tatt stoffene og hvilke stoffer som ble dannet.
2H 1+ + SO 4 2- + Ba 2+ +2Cl 1- - > BaSO 4v + 2H 1+ +2Cl 1-
Dette er den komplette ioniske ligningen.
Hvis vi reduserer høyre og venstre side av ligningen med identiske ioner, får vi den forkortede ioniske ligningen.
SO 4 2- + Ba 2+ -> BaSO 4v
Diskusjon:
Spørsmål til klassen:
- Hvilke ioner var inneholdt i løsningen før reaksjonen?
- Hvilke ioner forble i løsningen etter reaksjonen?
- Hva er essensen av disse reaksjonene?
Samtale med klassen: vi diskuterer at essensen av reaksjonen er at bindingen av Ba 2+ og SO 4 2- ioner skjedde.
Denne ligningen viser essensen av denne reaksjonen.
Erfaring nr. 2. Innhenting av karbondioksid.
Læreren kommenterer: legg til en løsning av H 2 SO 4 til Na 2 CO 3 løsningen.(1 elev skriver reaksjonen på tavlen)
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + H 2 O + CO 2
Hva er det vi ser?
Elev: Utslipp av gassbobler.
Læreren skriver ned den fullstendige ioniske ligningen og den forkortede ioniske ligningen.
2Na 1+ +CO 3 2- +2H 1+ +SO 4 2- - >2Na 1+ + SO 4 2- + H 2 O+ CO 2
CO 3 2- +2H 1+ -> H 2 O+ CO 2
Erfaring nr. 3. Dannelse av H 2 O (lavt dissosierende stoff).
Læreren kommenterer: tilsett 1-2 dråper ftaleinfenol til NaOH-løsningen, løsningen blir rød, tilsett H 2 SO 4. (1 elev skriver reaksjonen på tavlen)
2 NaOH + H 2 SO 4 = Na 2 SO 4 + 2 H 2 O
Hva er det vi ser?
Student. Løsningen ble fargeløs.
Lærer. La oss skrive den fullstendige ioniske ligningen og den forkortede ioniske ligningen på tavlen (1 elev).
2Na 1+ +2OH 1- +2H 1+ + SO 4 2- ->2Na 1+ + SO 4 2- + 2H 2 O
2OH 1- +2H1+ ->2H20
| Reaksjonsforhold Mellom elektrolyttløsninger (utfylles av eleven). |
Eksempler på ionebytterreaksjoner. |
| 1. | Na 2 CO 3 + CaCl 2 = CaCO 3 + 2 NaCl 2Na + + CO 3 2- +Ca 2+ + 2Cl - = CaCO 3 +2Na + + 2Cl - Ca 2+ + CO 3 2- = CaCO 3 |
| 2. | K2CO3 +2HCl =2KCl+H2O+CO2 2K + + CO 3 2- +2H + +2Cl - =2K + +2Cl - +H 2 O+CO 2 CO 3 2- +2H + = CO 2 ^+ H 2 O |
| 3. | NaOH+HNO3 = NaNO3 +H2O Na + +OH - +H + +NO3 =Na + +NO3- + H2O H + + OH - =H2O |
Lærer: Gutter, vi utførte ionebytterreaksjoner. La oss konkludere: under hvilke forhold fortsetter ionebytterreaksjoner til fullføring? (fyll ut tabellene som følger med)
Student: Ionebytterreaksjoner fortsetter til fullførelse hvis det dannes et bunnfall, en gass frigjøres og et dårlig dissosierende stoff, for eksempel vann, dannes.
Lærer: La oss gå tilbake til problemet vårt. Foreslå en metode for å gjenkjenne salt (NaCl) og brus (Na 2 CO 3).
Elev: Du må tilsette syre til disse stoffene. I hvilken beholder gassutviklingen vil bli observert, vil det være brus.
Feste materialet:
Oppgave i styret: 1 Velg fra denne listen reaksjonene som går til slutten (én student)
NaOH+ NaCl -> NaCl+ H 2 O
AgNO3 + NaCl ->NaNO3 + AgCl
CuCl2 +2NaOH ->Cu(OH)2 +2NaCl
KNO 3 + LiCl -> KCl + LiNO 3
Gitt:
Komplett ionisk ligning.
Fe 3+ +3Cl - +3Na + +3OH - = Fe(OH) 3 +3Na + +3Cl -
Skriv de molekylære og forkortede ioniske ligningene tilsvarende.
Lærer. La oss oppsummere leksjonen vår: Hvilke reaksjoner ble vi kjent med i timen?
Student. Vi lærte om ionebytterreaksjoner.
Lærer. Under hvilke forhold er det mulig for disse reaksjonene å fortsette til fullføring?
Student. Ionebytterreaksjoner fortsetter til fullførelse hvis det dannes et bunnfall, en gass frigjøres og et lett dissosierende stoff dannes.
Lærer. Lekser: §37 øvelse. 4, 5.
Litteratur.
- Gabrielyan O.S. Kjemi. 8. klasse: Bustard, 1999.
- "Virtual School of Cyril and Methodius" Kjemitimer 8-9 klassetrinn, 2004.
Det foreslåtte materialet presenterer metodologisk utvikling av praktisk arbeid for 9. klasse: "Løse eksperimentelle problemer om emnet "Nitrogen og fosfor", "Bestemmelse av mineralgjødsel", samt laboratorieeksperimenter om emnet "Utvekslingsreaksjoner mellom elektrolyttløsninger".
Utvekslingsreaksjoner mellom elektrolyttløsninger
Metodeutvikling består av tre deler: teori, verksted, kontroll. Den teoretiske delen gir noen eksempler på molekylære, komplette og forkortede ioniske ligninger av kjemiske reaksjoner som oppstår ved dannelse av et bunnfall, et lett dissosierende stoff og frigjøring av gass. Den praktiske delen inneholder oppgaver og anbefalinger til studentene om hvordan de skal utføre laboratorieforsøk. Kontrollen består av testoppgaver med valg av riktig svar.
Teori
1. Reaksjoner som fører til dannelse av et bunnfall.
a) Når kobber(II)sulfat reagerer med natriumhydroksid, dannes det et blått bunnfall av kobber(II)hydroksid.
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4.
Cu 2+ + + 2Na + + 2OH – = Cu(OH) 2 + 2Na + + ,
Cu 2+ + 2OH – = Cu(OH) 2.
b) Når bariumklorid reagerer med natriumsulfat, utfelles et hvitt melkeaktig bunnfall av bariumsulfat.
Molekylær ligning for en kjemisk reaksjon:
BaCl 2 + Na 2 SO 4 = 2 NaCl + BaSO 4.
Fullstendige og forkortede ioniske reaksjonsligninger:
Ba 2+ + 2Cl – + 2Na + + = 2Na + + 2Cl – + BaSO 4 ,
Ba2++ = BaS04.
2.
Når natriumkarbonat eller bikarbonat (natron) interagerer med saltsyre eller annen løselig syre, observeres koking eller intens frigjøring av gassbobler. Dette frigjør karbondioksid CO 2, som forårsaker uklarhet i den klare løsningen av kalkvann (kalsiumhydroksid). Kalkvann blir grumsete fordi... uløselig kalsiumkarbonat dannes.
a) Na2CO3 + 2HCl = 2NaCl + H2O + CO2;
b) NaHC03 + HCl = NaCl + CO2 + H20;
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O.
a) 2Na + + + 2H + + 2Cl – = 2Na + + 2Cl – + CO 2 + H 2 O,
2H+ = CO2 + H20;
b) Na + + + H + + Cl – = Na + + Cl – + CO 2 + H 2 O,
H+ = CO 2 + H 2 O.
3. Reaksjoner som oppstår med dannelse av et lett dissosierende stoff.
Når natrium- eller kaliumhydroksid reagerer med saltsyre eller andre løselige syrer i nærvær av fenolftaleinindikatoren, blir alkaliløsningen fargeløs, og som et resultat av nøytraliseringsreaksjonen dannes et lavdissosierende stoff H 2 O.
Molekylære ligninger for kjemiske reaksjoner:
a) NaOH + HCl = NaCl + H20;
c) 3KOH + H3PO4 = K3PO4 + 3H2O.
Fullstendige og forkortede ioniske reaksjonsligninger:
a) Na + + OH – + H + + Cl – = Na + + Cl – + H 2 O,
OH – + H+ = H20;
b) 2Na + + 2OH – + 2H + + = 2Na + + + 2H2O,
2OH – + 2H+ = 2H20;
c) 3K + + 3OH – +3H + + = 3K + + + 3H2O,
3OH – + 3H+ = 3H2O.
Verksted
1. Utvekslingsreaksjoner mellom elektrolyttløsninger som fører til dannelse av et bunnfall.
a) Utfør en reaksjon mellom løsninger av kobber(II)sulfat og natriumhydroksid. Skriv molekylære, fullstendige og forkortede ioniske ligninger av kjemiske reaksjoner, legg merke til tegnene på en kjemisk reaksjon.
b) Utfør en reaksjon mellom løsninger av bariumklorid og natriumsulfat. Skriv molekylære, fullstendige og forkortede ioniske ligninger av kjemiske reaksjoner, legg merke til tegnene på en kjemisk reaksjon.
2. Reaksjoner som involverer utslipp av gass.
Utfør reaksjoner mellom løsninger av natriumkarbonat eller natriumbikarbonat (natron) med saltsyre eller annen løselig syre. Før den frigjorte gassen (ved hjelp av et gassutløpsrør) gjennom klart kalkvann som helles over i et annet reagensrør til det blir uklart. Skriv molekylære, fullstendige og forkortede ioniske ligninger for kjemiske reaksjoner, legg merke til tegnene på disse reaksjonene.
3. Reaksjoner som oppstår med dannelse av et lett dissosierende stoff.
Utfør nøytraliseringsreaksjoner mellom en alkali (NaOH eller KOH) og en syre (HCl, HNO 3 eller H 2 SO 4), etter å ha plassert fenolftalein i alkaliløsningen. Noter observasjoner og skriv molekylære, komplette og forkortede ioniske ligninger for kjemiske reaksjoner.
Tegn, som følger med disse reaksjonene, kan velges fra følgende liste:
1) frigjøring av gassbobler; 2) sedimentering; 3) utseendet av lukt; 4) oppløsning av sedimentet; 5) varmeavgivelse; 6) endring i fargen på løsningen.
Kontroll (test)
1. Den ioniske ligningen for reaksjonen som produserer det blå bunnfallet er:
a) Cu 2+ + 2OH – = Cu(OH)2;
c) Fe3+ + 3OH – = Fe(OH)3;
d) Al 3+ + 3OH – = Al(OH) 3.
2. Den ioniske ligningen for reaksjonen der karbondioksid frigjøres er:
a) CaCO 3 + CO 2 + H 2 O = Ca 2+ +;
b) 2H+ + SO2-3 = H20 + SO2;
c) CO2-3 + 2H+ = CO2 + H20;
d) 2H + + 2OH – = 2H20.
3. Den ioniske ligningen for reaksjonen der et lavdissosierende stoff dannes er:
a) Ag + + Cl - = AgCl;
b) OH – + H+ = H20;
c) Zn + 2H+ = Zn2+ + H2;
d) Fe 3+ + 3OH – = Fe(OH) 3.
4. Den ioniske ligningen for reaksjonen som produserer det hvite bunnfallet er:
a) Cu 2+ + 2OH – = Cu(OH)2;
b) CuO + 2H+ = Cu2+ + H20;
c) Fe3+ + 3OH – = Fe(OH)3;
d) Ba 2+ + SO 2-4 = BaS04.
5. Den molekylære ligningen som tilsvarer den forkortede ioniske ligningen for reaksjonen 3OH – + 3H + = 3H 2 O er:
a) NaOH + HCl = NaCl + H20;
b) 2NaOH + H2SO4 = Na2S04 + 2H20;
c) 3KOH + H3P04 = K3P04 + 3H20;
d) Ba(OH)2 + 2HCl = BaCl2 + H2O.
6. Molekylligning som tilsvarer den forkortede ioniske reaksjonsligningen
H + + = H 2 O + CO 2, –
a) MgCO3 + 2HCl = MgCl2 + CO2 + H20;
b) Na2CO3 + 2HCl = 2NaCl + CO2 + H20;
c) NaHC03 + HCl = NaCl + CO2 + H20;
d) Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O.
| Svar. 1 -EN; 2 -V; 3 -b; 4 -G; 5 -V; 6 -V. |
Løse eksperimentelle problemer om emnet "Nitrogen og fosfor"
Når de studerer nytt materiale om emnet "Nitrogen og fosfor", utfører studentene en serie eksperimenter relatert til produksjon av ammoniakk, bestemmelse av nitrater, fosfater og ammoniumsalter, og tilegner seg visse ferdigheter og evner. Denne metodiske utviklingen inneholder seks oppgaver. For å fullføre praktisk arbeid er tre oppgaver nok: en om å skaffe et stoff, to om å gjenkjenne stoffer. Ved utførelse av praktisk arbeid kan elevene få tilbud om oppgaver i en form som skal gjøre det lettere for dem å utarbeide en rapport (se oppgave 1, 2). (Svarene er gitt til læreren.)
Øvelse 1
Skaff ammoniakk og bevis eksperimentelt dens tilstedeværelse.
a) Produksjon av ammoniakk.
Varm en blanding av like volumdeler fast ammoniumklorid og kalsiumhydroksidpulver i et reagensrør med et gassutløpsrør. I dette tilfellet vil ammoniakk frigjøres, som må samles opp i et annet tørt reagensglass plassert med et hull ............ ( Hvorfor?).
Skriv reaksjonslikningen for produksjon av ammoniakk.
…………………………………………………..
b) Bestemmelse av ammoniakk.
Kan identifiseres ved lukt………… (navn på stoff), så vel som ved endringer i fargen på lakmus eller fenolftalein. Når ammoniakk løses i vann, dannes ....... (navn på base), så lakmusprøven...... (spesifiser farge), og fargeløst fenolftalein blir …………. (spesifiser farge).
I stedet for prikker, sett inn ord i henhold til deres betydning. Skriv reaksjonsligningen.
…………………………………………………..


* Ammoniakk, en vandig løsning av ammoniakk, lukter ammoniakk. – Merk utg.
Oppgave 2
Tilbered kobbernitrat på to forskjellige måter, ha følgende stoffer tilgjengelig: konsentrert salpetersyre, kobberspon, kobber(II)sulfat, natriumhydroksid. Skriv ligninger for kjemiske reaksjoner i molekylform og noter endringene. I metode 1, for en redoksreaksjon, skriv elektronbalanseligninger, bestem oksidasjonsmidlet og reduksjonsmidlet. I metode 2 skriver du forkortede ioniske reaksjonsligninger.
1. s p o s o b. Kobber + salpetersyre. Varm opp innholdet i reagensglasset lett. Den fargeløse løsningen blir... (spesifiser farge), fordi er formet….. (navn på stoff); gass frigjøres……..farget med en ubehagelig lukt, dette er……. (navn på stoff).
2. s p o s o b. Når kobber(II)sulfat reagerer med natriumhydroksid, oppnås et bunnfall av ..... farge, dette er ...... (navn på stoff). Tilsett salpetersyre til bunnfallet er helt oppløst......... (navn på sediment). Det dannes en klar blå løsning...... (navnet på salt).


Oppgave 3
Bevis eksperimentelt at ammoniumsulfat inneholder NH 4 + og SO 2- 4 ioner. Legg merke til observasjonene og skriv molekylære og forkortede ioniske ligninger for reaksjonene.


Oppgave 4
Hvordan eksperimentelt bestemme tilstedeværelsen av løsninger av natriumortofosfat, natriumklorid, natriumnitrat i reagensrør nr. 1, nr. 2, nr. 3? Legg merke til observasjonene og skriv molekylære og forkortede ioniske ligninger for reaksjonene.

Oppgave 5
Å ha følgende stoffer: salpetersyre, kobberspon eller tråd, universelt indikatorpapir eller metyloransje, beviser eksperimentelt sammensetningen av salpetersyre. Skriv ligningen for dissosiasjonen av salpetersyre; molekylær ligning for reaksjonen av kobber med konsentrert salpetersyre og elektronbalanseligninger, identifisere oksidasjonsmiddel og reduksjonsmiddel.

Oppgave 6
Forbered en løsning av kobbernitrat på forskjellige måter ved å bruke stoffene: salpetersyre, kobberoksid, basisk kobberkarbonat eller hydroksykobber(II)karbonat. Skriv molekylære, fullstendige og forkortede ioniske ligninger for kjemiske reaksjoner. Legg merke til tegn på kjemiske reaksjoner.


Benchmark-tester
1. Gi reaksjonslikningen der det dannes et gult bunnfall.

2. Ioneligningen for reaksjonen der det hvite osteaktige bunnfallet dannes er:

3. For å bevise tilstedeværelsen av nitrat-ion i nitrater, må du ta:
a) saltsyre og sink;
b) svovelsyre og natriumklorid;
c) svovelsyre og kobber.
4. Reagenset for kloridion er:
a) kobber og svovelsyre;
b) sølvnitrat;
c) bariumklorid.
5. I reaksjonsligningen, diagrammet som
HNO 3 + Cu -> Cu(NO 3) 2 + NO 2 + H 2 O,
Før oksidasjonsmidlet må du sette koeffisienten:
a) 2; b) 4; klokken 6.
6. Basiske og sure salter tilsvarer parene:
a) Cu(OH)2, Mg(HC03)2;
b) Cu(NO3)2, HNO3;
c) 2 CO 3, Ca(HCO 3) 2.
|
Svar. 1 -EN; 2 -b; 3 -V; 4 -b; 5 -b; 6 -V. |
Bestemmelse av mineralgjødsel
Metodeutviklingen av dette praktiske arbeidet består av tre deler: teori, verksted, kontroll. Den teoretiske delen gir generell informasjon om kvalitativ bestemmelse av kationer og anioner som inngår i mineralgjødsel. Verkstedet gir eksempler på syv mineralgjødsel med beskrivelse av deres karakteristiske trekk, og gir også ligninger for kvalitative reaksjoner. I teksten, i stedet for prikker og spørsmålstegn, må du sette inn svar som er passende i betydningen. For å fullføre praktisk arbeid etter lærerens skjønn, er det nok å ta fire gjødsel. Testing av elevenes kunnskap består av testoppgaver for å bestemme gjødselformler, som er gitt i dette praktiske arbeidet.
Teori
1. Reagenset for kloridion er sølvnitrat. Reaksjonen fortsetter med dannelsen av et hvitt osteaktig bunnfall:
Ag + + Cl – = AgCl.
2. Ammoniumion kan påvises ved bruk av alkali. Når en løsning av ammoniumsalt oppvarmes med en alkaliløsning, frigjøres ammoniakk, som har en skarp karakteristisk lukt:
NH + 4 + OH – = NH 3 + H 2 O.
Du kan også bruke rødt lakmuspapir fuktet med vann, en universalindikator eller fenolftaleinstrimmel for å bestemme ammoniumionet. Papiret må holdes over dampene som slippes ut fra reagensrøret. Rød lakmus blir blå, den universelle indikatoren blir lilla, og fenolftalein blir rød.
3. For å bestemme nitrationer tilsettes kobberspon eller -stykker til saltløsningen, deretter tilsettes konsentrert svovelsyre og varmes opp. Etter en tid begynner en brun gass med en ubehagelig lukt å slippes ut. Frigjøringen av brun NO2-gass indikerer tilstedeværelsen av ioner.
For eksempel:
NaNO 3 + H 2 SO 4 NaHSO 4 + HNO 3,
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O.
4. Reagenset for fosfationer er sølvnitrat. Når det tilsettes til en fosfatløsning, utfelles et gult bunnfall av sølvfosfat:
3Ag + + PO 3- 4 = Ag 3 PO 4.
5. Reagenset for sulfation er bariumklorid. Et hvitt melkeaktig bunnfall av bariumsulfat, uløselig i eddiksyre, feller ut:
Ba 2+ + SO 2-4 = BaS04.
Verksted
1. Sylvinitt (NaCl KCl), rosa krystaller, god løselighet i vann. Flammen blir gul. Når du ser på flammen gjennom blått glass, er en fiolett farge merkbar. MED …….. (navn på reagens) gir et hvitt bunnfall...... (navn på salt).
KCl + ? -> KNO 3 + AgCl.
2. Ammoniumnitrat NH 4 NO 3, eller…….. (navn på gjødsel), hvite krystaller, svært løselig i vann. Brun gass frigjøres med svovelsyre og kobber... (navn på stoff). Med løsning……. (navn på reagens) Ved oppvarming kjennes lukten av ammoniakk, dampen blir rød lakmus til ...... farge.
NH 4 NO 3 + H 2 SO 4 NH 4 HSO 4 + HNO 3,
HNO 3 + Cu -> Cu(NO 3) 2 + ? + ? .
NH 4 NO 3 + ? -> NH3 + H2O + NaNO3.
3. Kaliumnitrat (KNO 3), eller…… (navn på gjødsel), med H 2 SO 4 og ……… (navn på stoff) produserer brun gass. Flammen blir lilla.
KNO 3 + H 2 SO 4 KHSO 4 + HNO 3,
4HNO 3 + ? -> Cu(NO 3) 2 + ? + 2H20.
4. Ammoniumklorid NH 4 Cl med løsning……. (navn på reagens) Ved oppvarming danner den ammoniakk, dampene blir røde lakmusblå. MED …… (navnet på reagensanionen) sølv gir en hvit osteaktig bunnfall...... (navn på sediment).
NH4Cl+? = NH4NO3 + AgCl,
NH4Cl+? = NH3 + H2O + NaCl.
5. Ved oppvarming danner ammoniumsulfat (NH 4) 2 SO 4 med en alkaliløsning ammoniakk, og dampen blir rød lakmusblå. MED …….. (navn på reagens) gir et hvitt melkeaktig sediment......... (navn på sediment).
(NH 4) 2 SO 4 + 2 NaOH = 2NH 3 + 2H 2 O + ? ,
(NH 4) 2 SO 4 + ? -> NH4Cl + ? .
6. Natriumnitrat NaNO 3, eller …… (navn på gjødsel), hvite krystaller, god løselighet i vann, produserer en brun gass med H 2 SO 4 og Cu. Flammen blir gul.
NaNO 3 + H 2 SO 4 NaHSO 4 + ? ,
Cu -> Cu(NO 3) 2 + ? + 2H20.
7. Kalsiumdihydrogenfosfat Ca(H 2 PO 4) 2, eller…… (navn på gjødsel), grått finkornet pulver eller granulat, lite løselig i vann, med ..... (navn på reagens) gir ….. (spesifiser farge) bunnfall ………… (navn på stoff) AgH 2 PO 4.
Ca(H 2 PO 4) 2 + ? -> 2AgH 2 PO 4 + Ca(NO 3) 2.

Kontroll (test)
1. Rosa krystaller, svært løselige i vann, farger flammen gul; når det interagerer med AgNO 3, dannes et hvitt bunnfall - dette er:
a) Ca(H2PO4)2; b) NaCl KCl;
c) KNO 3; d) NH4Cl.
2. Krystallene er svært løselige i vann; i reaksjon med H 2 SO 4 og kobber frigjøres en brun gass; med en alkaliløsning, når den varmes opp, produserer den ammoniakk, hvis damp blir rød lakmusblå - dette er:
a) NaN03; b) (NH4)2SO4;
c) NH4NO3; d) KNO 3.
3. Lette krystaller, svært løselige i vann; ved interaksjon med H 2 SO 4 og Cu frigjøres brun gass; flammen blir lilla - dette er:
a) KNO 3; b) NH4H2PO4;
c) Ca(H2PO4)2CaSO4; d) NH 4 NO 3.
4. Krystallene er svært løselige i vann; med sølvnitrat gir det et hvitt bunnfall, med alkali når det oppvarmes gir det ammoniakk, hvis damp blir rød lakmusblå - dette er:
a) (NH4)2SO4; b) NH4H2PO4;
c) NaCl KCl; d) NH4Cl.
5. Lette krystaller, svært løselige i vann; med BaCl 2 gir det et hvitt melkeaktig bunnfall, med alkali gir det ammoniakk, hvis damp blir rød lakmusblå - dette er:
c) NH4Cl; d) NH 4 H 2 PO 4.
6. Lette krystaller, svært løselige i vann; når den samhandler med H 2 SO 4 og Cu, produserer den en brun gass, flammen blir gul - dette er:
a) NH4NO3; b) (NH4)2SO4;
c) KNO 3; d) NaNO 3.
7. Grått finkornet pulver eller granulat, løseligheten i vann er dårlig, med en løsning av sølvnitrat gir det et gult bunnfall - dette er:
a) (NH4)2SO4; b) NaCl KCl;
c) Ca(H2PO4)2; d) KNO 3.
| Svar. 1 -b; 2 -V; 3 -EN; 4 -G; 5 -b; 6 -G; 7 -V. |