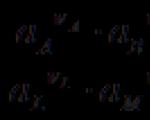Elektrokimya. Galvanik hücre Elektrokimyasal hücre
Elektrokimyasal elementler. Elektrik hareket gücü. Galvanik hücrenin termodinamiği. EMF ölçümü.
Elektrikli çift katman, oluşum mekanizması ve yapısı.
GALVANİK ELEMANLAR. EMF.
Bir elektrik akımı bir elektrolitten geçtiğinde, elektrotların yüzeyinde elektrokimyasal reaksiyonlar meydana gelir. Elektrokimyasal reaksiyonların oluşması harici bir akım kaynağı tarafından üretilebilir. Bunun tersi de mümkündür: Bir elektrolite batırılmış iki elektrot üzerinde meydana gelen elektrokimyasal reaksiyonlar bir elektrik akımı üretir ve reaksiyonlar yalnızca kapalı bir devrede (akım geçtiğinde) meydana gelir.
Elektrokimyasal (veya galvanik) hücre elektrokimyasal reaksiyonlar yoluyla elektrik akımı üreten bir cihazdır. En basit elektrokimyasal eleman, bir elektrolite (ikinci türden iletken) indirilmiş ve birbirine metal bir kontakla bağlanan iki metal elektrottan (birinci türden iletkenler) oluşur. Seri biçimde bağlanmış birkaç elektrokimyasal element elektrokimyasal devre .
Bir elektrokimyasal elementin en önemli niceliksel özelliği elektromotor kuvvetidir.(EMF, E), potansiyel farka eşittir elemanı doğru şekilde aç (aynı malzemeden birinci türden iletkenlerin, elemanın son elektrotlarına bağlandığı iletken).
Bir elektrik akımı farklı yönlere geçtiğinde, elektrotun yüzeyinde ancak zıt yönlerde aynı reaksiyon meydana gelirse, bu tür elektrotlara ve bunlardan oluşan eleman veya devre denir. geri dönüşümlü . Tersinir elemanların emk'si onların termodinamik özelliğidir, yani. yalnızca T, P'ye, elektrotları ve çözeltileri oluşturan maddelerin doğasına ve bu çözeltilerin konsantrasyonuna bağlıdır. Tersinir bir elemanın bir örneği Daniel-Jacobi öğesi :
(-) Cu çZn çZnSO 4 ççCuSO 4 çCu (+)
burada her elektrot tersine çevrilebilir. Eleman çalıştığında aşağıdaki reaksiyonlar meydana gelir: Zn ® Zn 2+ + 2 e, Cu 2+ + 2 e® Cu. Harici bir kaynaktan çok küçük bir kuvvette akım geçtiğinde elektrotlarda ters reaksiyonlar meydana gelir.
Geri dönüşü olmayan bir elementin örneği Volta öğesi :
(-) Zn ç H 2 SO 4 ç Cu (+)
Eleman çalıştığında aşağıdaki reaksiyonlar meydana gelir: Zn ® Zn 2+ + 2 e, 2H + + 2 e® H 2 . Akımı harici bir kaynaktan geçirirken elektrot reaksiyonları şöyle olacaktır: 2H + + 2 e® H 2 , Cu ® Cu 2+ + 2 e .
Bir elektrokimyasal elementin EMF'si pozitif bir değerdir çünkü pozitif iş üreten belirli bir spontane sürece karşılık gelir. Bağımsız olarak gerçekleşemeyen ters süreç, negatif bir EMF'ye karşılık gelecektir. Bir elektrokimyasal element zinciri oluştururken, elementlerden birindeki süreç, buna dışarıdan iş harcaması (kendiliğinden olmayan süreç) eşlik edecek şekilde yönlendirilebilir, bunun için zincirin başka bir elementinin çalışması kullanılır. kendiliğinden gelişen bir süreç. Herhangi bir devrenin toplam emk'si, pozitif ve negatif niceliklerin cebirsel toplamına eşittir. Bu nedenle, bir devre şeması yazarken, kabul edilen kuralları kullanarak EMF işaretlerini dikkate almak çok önemlidir.
Elektrokimyasal devrenin emk'si pozitif kabul edilir Devreyi yazarken sağ elektrot sola göre pozitif yüklüyse (devrenin çalışması sırasında çözeltideki katyonlar solda yazılan elektrottan sağda yazılan elektrota doğru geçer ve elektronlar içeri doğru hareket eder) harici devrede aynı yönde). Örnek.
GALVANİK HÜCRENİN TERMODİNAMİĞİ .
Reaksiyonun bir elektrokimyasal sistemde tersinir ve izotermal olarak ilerlemesine izin verin:
n A A + n B B + ... ± nF Û n L L + n M M + ... ±
Elemanın ürettiği elektrik enerjisi, toplam sürecin faydalı işine A¢ eşittir. Tersinir sürecin faydalı işi A¢ maksimumdur ve P'de, T = sabit sistemin izobarik potansiyelindeki azalmaya eşittir:
DG P, T = nFE P, T
E P , T - sistemin geri dönüşümlü EMF'si.
E P,T = -DG P,T / nF , E V,T = -DF V,T / nF
Böylece elemanın EMF'si ve sıcaklık katsayısı ölçülerek galvanik hücrede meydana gelen toplam proses için DG ve DS değerlerini bulmak mümkündür. Bu süreç kendiliğinden gerçekleşir, dolayısıyla DG< 0.
Gibbs-Helmholtz denklemini kullanarak sürecin entalpisindeki değişimi hesaplayabiliriz:
DH = DG - T = -nFE P + TnF
nFE P = -DH + nFT = + nFT
nFE V = -DU + nFT = + nFT
Denklemlerden, bir elektrokimyasal sistemde tersinir olarak üretilen veya emilen elektrik enerjisi ile içinde meydana gelen reaksiyonun termal etkisi arasındaki ilişkinin, emk'nin sıcaklık katsayısının işaretine ve büyüklüğüne bağlı olduğu anlaşılmaktadır. dE/ dT :
1. EğerdE / dT > 0 , o zaman nFE > (DG > DH) ve sistem yalnızca reaksiyonun termal etkisine karşılık gelen ısı miktarını değil aynı zamanda ek ısıyı da elektrik enerjisine dönüştürecektir - Peletier'in sıcaklığı Q P = nFT dE/ dTçevreden ödünç alınmıştır. Adyabatik koşullar altında (ısı yalıtımı koşulları altında, çevre ile değişimin imkansız olduğu durumlarda) sistemin T değeri azalır. Sistemin soğutulması özellikle şu durumlarda fark edilir: dE/ dT > 0 < 0 (реакция эндотермична).
2. EğerdE / dT < 0 , sonra nFE< (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. EğerdE / dT = 0 , bu durumda DG = DH ve nFE = - sistem tarafından tersinir olarak üretilen elektrik enerjisi, kimyasal reaksiyonun termal etkisine eşdeğerdir. Bu ilişki şu şekilde bilinir: Thomson ilkesi (kural) .
EMF'yi hesaplamak için denklemler şu şekilde yeniden yazılabilir:
Denklemleri kullanırken unutmamak gerekir ki yalnızca tersinir elektrokimyasal sistemler için geçerlidir bu nedenle, EMF'nin T'ye bağımlılığını incelerken, sıvı sınırları olan elektrokimyasal sistemlerin kullanımından kaçınmak gerekir, çünkü üzerlerinde ortaya çıkan difüzyon potansiyelleri dengede değildir.
Elementin EMF'sini elementte meydana gelen reaksiyonun denge sabiti ile ilişkilendirelim. Kimyasal reaksiyon izoterm denklemi:
DG = RT içinde k A -RT
E = - = içinde k A -
Verilen P, T için denklemin sağ tarafındaki ilk terim sabit bir değerdir; E o ile gösterilebilir. E o - Bir elementin standart EMF'si (elektrokimyasal sistem) yani Kesinlikle EMF bir ben = 0.
E = E o + içinde
 = E o + 2,303 lg
= E o + 2,303 lg 
Bu nedenle, bir elektrokimyasal sistemin EMF'si, elektrokimyasal reaksiyona katılanların faaliyetlerinin bir fonksiyonudur. Yukarıdaki denklemler DG ve K değerlerini hesaplamayı mümkün kılar A E'nin deneysel değerlerine dayanarak ve tersine, kimyasal reaksiyonun termodinamik özelliklerini bilerek E'yi hesaplayın.
EMF ÖLÇÜMÜ .
Bir elektrokimyasal elemanın EMF'sinin denge (tersine çevrilebilir) değerini ölçmek için işlemin sonsuz yavaşlıkta gerçekleşmesi gerekir; böylece eleman sonsuz küçük bir akımda çalışır. Bu koşul, elemanın harici bir potansiyel farkına karşı seri olarak bağlanması ve devrede akım olmayacak şekilde seçilmesi esasına dayanan kompanzasyon yönteminde karşılanır. Daha sonra harici potansiyel farkı devrenin EMF'sine eşittir.
Kompanzasyon yöntemini kullanarak, EMF'nin değerini doğrudan ölçebilirsiniz, ancak bu oldukça karmaşık bir işlemdir, bu nedenle laboratuvar uygulamasında, incelenen elemanın EMF'sini sözde standardın (normal) EMF'si ile karşılaştırmayı tercih ederler. farklı T'de dikkatlice ölçülen elemanlar. Bu karşılaştırmalı yöntem aynı zamanda telafidir.
Temel normal unsur doymuş Weston elemanı .
(EMF ölçüm devresi - bağımsız olarak).
ELEKTROT SINIRININ YAPISI - ÇÖZÜM. ÇİFT ELEKTRİK KATMAN .
Birinci türden bir iletken bir elektrolit ile temasa geçtiğinde, elektrikli çift katmanlı . Örnek olarak CuSO4 çözeltisine daldırılmış bir bakır elektrodu düşünün. Belirli bir T değerinde bir metaldeki bakır iyonlarının kimyasal potansiyeli sabit kabul edilebilirken, çözeltideki bakır iyonlarının kimyasal potansiyeli tuz konsantrasyonuna bağlıdır; genel olarak bu kimyasal potansiyeller aynı değildir.
CuS04 konsantrasyonu > olacak şekilde olsun. Daha sonra metal çözeltiye daldırıldığında çözeltideki Cu 2+ iyonlarının bir kısmı dehidre olur ve metale aktarılarak üzerinde pozitif bir yük oluşturulur. Bu yük, Cu2+ iyonlarının çözeltiden metale daha fazla aktarılmasını önleyecek ve elektrotun yakınında kendisine çekilen bir SO42-anyon tabakasının oluşmasına yol açacaktır. Sözde elektrokimyasal denge metaldeki ve çözeltideki iyonların kimyasal potansiyellerinin, ortaya çıkan çift elektrik katmanının (DEL) potansiyel farkının büyüklüğüne göre farklılık göstereceği:
Elektriksel potansiyel farkı ve kimyasal potansiyel farkı elektrokimyasal dengede telafi edilir.
CuSO 4 konsantrasyonunun o kadar düşük olmasına izin verin ki< . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
Metaldeki ve çözeltideki iyonların kimyasal potansiyellerinin aynı olduğu bir elektrolit konsantrasyonu seçebilirsiniz. Bu konsantrasyonun çözümleri denir sıfır çözümler . Bir metal sıfır çözeltisine daldırıldığında elektrot yüzeyinde EDL oluşmaz ancak bu durumda bile metal ile çözelti arasındaki potansiyel farkı sıfır değildir.
Nernst'e göre bir elektrokimyasal hücrenin EMF'sinin tek kaynağı elektrotların yüzeyindeki EMF'dir. Nernst, sıfır çözeltideki metallerin potansiyelini mutlak sıfır potansiyel olarak tanımladı. A.N. Frumkin'in çalışmalarında Nernst'in fikirlerinin yanlış olduğu gösterildi. Sıfır çözeltilerine batırılmış iki farklı elektrottan oluşan bir elemanın EMF'sinin sıfırdan çok farklı olduğu (belki 1 V'den fazla) deneysel olarak tespit edilmiştir. Bir metalin sıfır çözelti içindeki potansiyeline denir sıfır şarj potansiyeli , mutlak sıfır potansiyeli olarak kabul edilemez.
YOĞUNLAŞTIRILMIŞ HELMHOLTZ ÇİFT KATMANIN TEORİSİ. Metal-çözelti arayüzündeki DEL'in yapısına ilişkin ilk kantitatif teori Helmholtz (1853) tarafından oluşturuldu. Helmholtz'a göre bir EDL, plakalarından biri metaldeki yüzey yüklerinden geçen düzlemle, diğeri ise çözeltideki iyon yüklerinin merkezlerini birleştiren düzlemle çakışan düz bir kapasitöre benzetilebilir. elektrostatik kuvvetler tarafından metalin yüzeyine çekilir. Çift katman kalınlığı ben iyon yarıçapına eşit R. Elektriksel nötrlük durumuna göre, metalin yüzeyine çekilen iyonların sayısı, yükleri metalin yüzey yüklerini telafi edecek şekilde olmalıdır;
Yoğunlaştırılmış bir çift katman teorisi, deneyle tutarlı olan EDL kapasitansı değerlerinin ve EDL'nin fiziksel olarak makul bir kalınlığının elde edilmesini mümkün kılar. Bununla birlikte, birçok deneysel düzenliliği yorumlayamaz: elektrokinetik potansiyelin (x-potansiyel) deneysel olarak bulunan değerleri ve bunların elektrolit konsantrasyonuna bağımlılığı, bir yüzey aktif cismi varlığında metal yüzeyindeki yük işaretindeki değişiklik .
DİFÜZ ÇİFT KATMANLI GUI TEORİSİ- ŞAPMAN. Helmholtz'un teorisi, DES'in özelliklerinin elektrolit konsantrasyonuyla değiştiğini hesaba katmaz ve T. Gouy (1910) ve Chapman (1913), DES'teki yük yoğunluğunu çözeltinin bileşimi ile ilişkilendirmeye çalıştı. Metal ve iyonlar arasında ortaya çıkan elektrostatik kuvvetlere ek olarak iyonların termal moleküler hareket kuvvetlerinden de etkilendiğini dikkate aldılar. Bu iki kuvvet uygulandığında, çözeltideki iyonların metal yüzeye göre dağınık bir şekilde dağılması gerekir; hacimsel yük yoğunluğu metalden uzaklaştıkça azalır.
Gouy ve Chapman, iyonların kendi hacmi olmayan ancak yükü olan maddesel noktalar olarak değerlendirilebileceğine ve elektrot yük alanındaki dağılımlarının Boltzmann dağılımına uyduğuna inanıyorlardı.
Gouy-Chapman teorisi, elektrokinetik olayların yasalarıyla Helmholtz teorisinden daha iyi uyum sağlar. Belli bir mesafeden başladığını varsayarsak ben 1 iyonları artık katı ve sıvı fazların göreceli hareketi ile elektrot yüzeyine sıkı bir şekilde bağlı değildir, bu durumda bu mesafeye karşılık gelen potansiyel, x potansiyeli (x) olarak düşünülebilir.< j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
Dolayısıyla Gouy-Chapman teorisi, Helmholtz teorisinin uygulanamaz olduğu durumlarda en iyi şekilde doğrulanır ve bunun tersine, ilkinin yanlış sonuçlar verdiği durumlarda ikincisi deneyle daha iyi yakınsama sağlar. Sonuç olarak, DES'in yapısı Helmholtz ve Gouy-Chapman tarafından önerilen modellerin bazı kombinasyonlarına karşılık gelmelidir. Bu varsayım Stern (1924) tarafından DEL adsorpsiyon teorisinde yapılmıştır.
STERN ADSORPSİYON TEORİSİ. Stern, iyonların belirli bir kısmının metal-elektrolit arayüzünün yakınında tutulduğuna ve elektrolit iyonlarının ortalama yarıçapına karşılık gelen bir kalınlığa sahip bir Helmholtz veya yoğunlaştırılmış çift katmanlı plaka oluşturduğuna inanıyordu. EDL'de bulunan geri kalan iyonlar, giderek azalan yük yoğunluğuyla dağınık olarak dağıtılır. EDL'nin dağınık kısmı için Gouy gibi Stern de iyonların gerçek boyutlarını ihmal etti. Ek olarak Stern, EDL'nin yoğun kısmında iyonların yalnızca elektrostatik kuvvetler nedeniyle değil aynı zamanda spesifik adsorpsiyon kuvvetleri nedeniyle tutulduğunu öne sürdü. Coulomb kökenli olmayan kuvvetler. Bu nedenle yüzey aktif iyonlar içeren çözeltilerde, EDL'nin yoğun kısmındaki sayıları, iyonların özelliklerine ve metalin yüküne bağlı olarak metal yüzeyinin yükünü belirli bir miktarda aşabilir. Bu nedenle, Stern'e göre, biri yüzeyde aktif olmayan elektrolitlerin çözeltileriyle, diğeri ise spesifik olarak adsorbe edilmiş iyonları içeren çözeltilerle ilgili olan iki DES modeli ayırt edilmelidir.
Adsorpsiyon teorisinde eşitlik de korunur:
Q M = q L = q 1 + q 2
Çözüm tarafındaki yük yoğunluğu q L iki bölümden oluşur: Helmholtz katmanındaki yük yoğunluğu q 1 ve yaygın katmandaki q 2 yük yoğunluğu.
Stern'ün teorisi, x potansiyelini, metal ile iyonlar arasındaki güçlü bağın zaten kaybolduğu EDL'nin dağınık kısmındaki potansiyel düşüş olarak tanımlamamıza olanak tanır. Bu tanımla deneysel olarak gözlemlendiği gibi x potansiyelinin Nerst potansiyeli ile çakışmaması gerekir. Stern'ün teorisi katı bir cismin yüzeyinin yeniden yüklenmesini açıklayabildi.
Sonsuz küçük bir konsantrasyonda, çözeltideki tüm yükler dağınık olarak dağıtılır ve EDL'nin yapısı Gouy-Chapman teorisi ile tanımlanır. Aksine, konsantre çözümlerde DES'in yapısı Helmholtz tarafından önerilen modele yaklaşmaktadır. X'in büyüklük olarak RT/F ile karşılaştırılabilir olduğu ortalama konsantrasyonlar bölgesinde, konsantrasyona bağımlılığı yaklaşık denklemlerle ifade edilebilir:
pozitif x değerleri için: x = B - içindeİle
x'in negatif değerleri için: x = B¢ + içindeİle
Stern'ün teorisi DEL'in niteliksel olarak doğru bir resmini veriyor. Stern modeli kullanılarak kapasitansın belirlenmesi, hem kapasitans değerleri hem de elektrot potansiyeline ve çözelti konsantrasyonuna bağımlılığının doğası açısından deneyimle tutarlıdır. Ancak Stern'ün teorisi eksikliklerden arınmış değil. Bunlar, özellikle sıfır yük potansiyelinden uzaklaşıldığında, kapasitans eğrilerinin niceliksel bir açıklamasının imkansızlığını içerir.
TASARIM DURUMU TEORİSİNİN DAHA DA GELİŞTİRİLMESİ. Deneysel verilerle niceliksel olarak tutarlı olan bir DES teorisi geliştirmek için birçok girişimde bulunulmuştur (Rice, Frumkin ve diğerleri, Bockris, Devanathan, Esin, Muller, Parsons, Ershler, vb.). En yaygın kabul gören model Graham'dır (1947). Graham'a göre çözümdeki DES kaplaması iki değil üç parçadan oluşuyor. Metalin yüzeyinden sayılan ilkine iç Helmholtz düzlemi denir; yalnızca yüzey aktif iyonlar içerir (düzlemin yükü q 1'dir) veya çözeltide bulunmuyorlarsa solvent molekülleri (q 1 = 0); çözüme ilişkin potansiyeli y 1 ile gösterilir. İyonların (yük merkezlerinin) yaklaşabileceği mesafede metal yüzeyinden çıkarılan bir sonrakine dış Helmholtz düzlemi denir; toplam yükü q 2'dir ve uçağın potansiyeli y 2'dir. Dış Helmholtz düzleminin arkasında, potansiyeli y2 ile sıfır arasında değişen ve yük yoğunluğu q2 ile çakışan dağınık bir katman vardır.
Graham'ın modeli metal-elektrolit DES yapısının ana özelliklerini ve özelliklerini yansıtıyor. Çözümlerinden en az biri için deneysel bir eğri varsa, belirli bir elektrolitin herhangi bir konsantrasyonu için diferansiyel kapasitans eğrilerini hesaplamanıza olanak tanır. Ancak bu model sorunun tüm yönlerini kapsamamaktadır.
Bir elektrik akımı bir çözeltiden geçtiğinde, elektrotların yüzeyinden akımlar akar. elektrokimyasal reaksiyonlar Bunlara elektrottan veya elektrottan elektron akışı eşlik eder. Ters işlemlerde, birinci ve ikinci tür iletkenler arasındaki arayüzlerde meydana gelen elektrokimyasal reaksiyonlar, elektrik akımının oluşmasına yol açar.
Elektrokimyasal prosesler, bir takım özellikler bakımından geleneksel kimyasal reaksiyonlardan farklılık gösterir.
Kimyasal reaksiyon ancak reaksiyona giren parçacıklar çarpıştığında mümkündür. Temasa geçtiklerinde elektronların bir parçacıktan diğerine aktarılması mümkün hale gelir. Böyle bir geçişin gerçekten gerçekleşip gerçekleşmeyeceği parçacıkların enerjisine ve karşılıklı yönelimlerine bağlıdır. Aktivasyon enerjisi kimyasal reaksiyonun doğasına bağlıdır ve iyonik reaksiyonlar için genellikle düşüktür. Elektron geçiş yolunun çok kısa olması da kimyasal reaksiyonun bir özelliğidir. Parçacıkların çarpışması reaksiyon alanının herhangi bir noktasında farklı karşılıklı konumlarda meydana gelebilir, bu nedenle elektronik geçişler keyfi yönlerde meydana gelebilir; Kimyasal sürecin özellikleri, çarpışmaların rastgeleliği ve elektronik geçişlerin yönlülüğünün olmamasıdır. Sonuç olarak, kimyasal reaksiyonların enerjik etkileri öncelikle ısı şeklinde ortaya çıkar (küçük bir genişleme çalışması da mümkündür).
Kimyasal dönüşüme karşılık gelen enerji değişimlerinin elektrik enerjisi şeklinde ortaya çıkabilmesi için; Elektrokimyasal prosesin ilerlemesi için reaksiyon koşullarının değiştirilmesi gerekmektedir.
Elektrik enerjisi her zaman elektrik akımının geçişiyle ilişkilidir, yani. Elektronların belirli bir yönde akışı. Bu nedenle reaksiyonun, elektronik geçişlerin rastgele değil, tek yönde meydana geleceği ve bunların yolunun atom boyutundan önemli ölçüde daha büyük olacağı şekilde gerçekleştirilmesi gerekir. Bu nedenle, elektrokimyasal süreçlerde, elektronların bir katılımcıdan diğerine geçişi, reaksiyon katılımcılarının mekansal olarak ayrılmasının gerekli olduğu önemli bir mesafede gerçekleşmelidir. Ancak mekansal ayırma tek başına yeterli değildir çünkü reaksiyonun durmasına neden olur.
Elektrokimyasal işlemi gerçekleştirmek için ek koşullar gereklidir: Elektronların bazı parçacıklardan kopması ve diğerlerine ortak bir şekilde aktarılması gerekir. Bu, reaksiyondaki katılımcılar arasındaki doğrudan temasın, birbirine bir metal iletken ile bağlanan iki metalle temasıyla değiştirilmesiyle başarılabilir. Elektron akışının sürekli olması için, genellikle elektrokimyasal reaksiyona katılanların kendileri tarafından (iyonize durumdalarsa) gerçekleştirilen reaksiyon alanı boyunca elektrik akımının geçişini sağlamak da gereklidir veya yüksek iyonik iletkenliğe sahip özel bileşiklerle.
Elektrokimyasal tepkimeler yoluyla elektrik enerjisi elde etmeye yarayan aygıta ne ad verilir? elektrokimyasal(veya galvanik)eleman. En basit elektrokimyasal eleman, bir elektrolit çözeltisine (ikinci türden iletken) daldırılmış iki metal elektrottan (birinci türden iletkenler) oluşur.
Bir elektrik akımı farklı yönlere geçtiğinde, elektrot yüzeyinde aynı reaksiyon meydana gelir, ancak zıt yönlerde meydana gelirse, bu tür elektrotlara ve bunlardan oluşan elektrokimyasal elementlere denir. geri dönüşümlü. Tersinir bir elemente örnek olarak Daniel-Jacobi elementi verilebilir.
(–) Zn | ZnSO 4, çözelti || CuSO 4, çözüm | Cu(+)
Böyle bir eleman çalıştığında elektrotlarda elektrokimyasal reaksiyonlar meydana gelir:
Zn Zn 2 + + 2e
Cu 2 + + 2eCu
Bir elementteki genel reaksiyon denklemi şu şekilde temsil edilebilir:
Zn + Cu 2 + Zn 2 + + Cu
Eleman üzerinden dış bir kaynaktan sonsuz küçük bir akım geçtiğinde bu reaksiyonlar ters yönde ilerler.
Örnek geri döndürülemez element Volta elementidir
(–) Zn | H2SO4 | Cu(+)
Böyle bir eleman çalıştığında elektrotlarda aşağıdaki reaksiyonlar meydana gelir:
Zn Zn 2 + + 2e
2H + + 2eH 2 ,
ve elementteki reaksiyon denklemle temsil edilir
Zn + 2H + Zn 2+ + H 2
Akım harici bir kaynaktan iletildiğinde elektrotlarda başka reaksiyonlar meydana gelir:
Cu Cu 2 + + 2e,
onlar. bir elektrokimyasal hücrede bakır, hidrojenin salınmasıyla sülfürik asitte çözünür:
Cu + 2H + Cu 2 + + H 2
Bir elektrokimyasal hücrenin en önemli özelliği, elektrik hareket gücü(EMF) e– uygun şekilde açık bir elemanın potansiyel farkı, ör. galvanik hücrenin elektrotlarına bağlanan aynı malzemeden birinci tür iletkenlerin uçları arasındaki potansiyel fark. Başka bir deyişle EMF, devrede elektrik akımının akmadığı denge koşullarındaki potansiyel farktır. Elektrotları kapatırsanız devrede bir elektrik akımı akacaktır ve potansiyel fark şunu temsil eder: Gerilim EMF'den, elemanın iç direncindeki voltaj düşüşü miktarı kadar farklılık gösteren bir elektrokimyasal element.
Elektrokimyasal elementlerin amacı, faydalı elementin dahil olduğu dış devrede elektronların hareketini teşvik etmektir.
yük. Bu nedenle, görevini yerine getirmek için bir yakıt hücresinin bir elektron kaynağı ve bir elektron havuzu içermesi gerekir (Şekil 7.1).
Bir elektrokimyasal hücrede meydana gelen reaksiyonlara indirgeme reaksiyonu denir, çünkü "oksidasyon" terimi elektronların serbest bırakılması sürecine karşılık gelir ve "indirgeme" terimi de elektronların serbest bırakılması işlemine karşılık gelir.
Çok sayıda güncelliğini yitirmiş bilimsel kavramın anlamı çoğu zaman adlarından anlaşılamamaktadır.“Yükseltgenme” ve “indirgenme” terimleri açıklama gerektirir. Güneydoğu'da oksijen (oksijen), Latince oxus (ekşi veya sıcak, keskin) kökünden gelir ve "asit üreticisi" anlamına gelir. Bu isim ilk kez Morveau ve Lavoisier'in 1787 yılında yayınlanan Nomenclature Chimique adlı eserinde kullanılmıştır. O dönemde kimyagerler yanlış bir inanışa sahiptiler. asitlerin içerdiği ana elementin oksijen olduğu; bir asit suda çözündüğünde, bileşimindeki hidrojen atomlarının bir kısmı elektronunu kaybeder - su asidik hale gelir ve hidrojen oksitlenir. Analitik olarak elektron kaybı süreciyle ilişkili herhangi bir reaksiyona oksidasyon denir. Ters reaksiyona (elektron yakalama reaksiyonu) ■oluş denir.
Akış
J elektronları
Elektron kaynağı >
(oksidasyon)
Pozitif< -
Elektrik akımının yönü Şekil. 7.1. Bir elektrokimyasal hücrenin bir elektron kaynağı ve elektron havuzu içermesi gerekir
Bir elektrokimyasal hücrede genel reaksiyon, cihazın ayrı alanlarında meydana gelen iki ara reaksiyona bölünür. Bu alanlar, iyonların iletkeni olan, ancak ara oksidasyon reaksiyonunda salınan elektronları ileten elektrolit tarafından kaynaştırılır; elektronlar, indirgeme reaksiyonunun meydana geldiği alana, ancak harici bir devre aracılığıyla girebilir. Böylece dış devrede bir elektrik akımı ortaya çıkar ve elektrokimyasal hücre onun kaynağıdır - amacı budur. Dış devredeki elektrik a'nın pozitif yönü, elemanın indirgeyici oksidasyon bölgesinden gelen yön olarak kabul edildi - elektrik akımı, elemanın yakıtın katodu olan indirgeme bölgesinin elemanını terk eder ve anot olan oksidasyon bölgesine girer. Diğer herhangi bir elektrik kaynağında olduğu gibi katot pozitif yüklüdür
aktif elektrot ve anot negatif yüklü bir elektrottur. Elektrik enerjisi tüketicileri (yük) söz konusu olduğunda ise isimler tam tersi yönde değişmektedir. Ch.'nin girişinde. 6 "Anot" ve "katot" terimleri daha ayrıntılı olarak tartışılmaktadır.
Elektrokimyasal hücreye örnek olarak, elektrolit görevi gören bir zarı düşünün. Membranların yan yüzeylerinden biri hidrojenle temas etsin. Normal koşullar altında gaz ağırlıklı olarak moleküler hidrojenden oluşacaktır, ancak az sayıda molekül atomlara ayrışabilir.
ve bazı atomlar oksitlenecek (iyonlaşacak), yani elektronlarını kaybedecek
N -> Nt + e~ .
Membran elektronlara karşı geçirimsiz olduğundan, oluşan iyonlar diff; zardan geçerek kendilerini diğer tarafta bulacaklar. Bu durumda iyonlar pozitif yük taşır, dolayısıyla hidrojenin bulunduğu zarın yüzeyi, üzerinde biriken elektronların fazlalığından dolayı negatif yüklenecek, karşı yüzey ise pozitif yük nedeniyle pozitif yüklenecektir. Difüzyon nedeniyle üzerinde ortaya çıkan iyonlar. Elektrik alanı bazı iyonların zarın "hidrojen" yüzeyine ters yönde hareket etmesine neden olur. Söz konusu sistemdeki dinamik denge, iyonların difüzyon akışı st olduğunda kurulur. i ters akıma eşittir.
Şimdi zarın her iki yüzeyine de elektriksel olarak iletken toz uygulayalım.Bunun sonucunda elektrot görevi görecek iki gözenekli, elektriksel olarak iletken katman elde edilecektir. Elektrotların elektriksel bağlantısını sağlayarak elektrotlara harici bir ısıtıcı1 bağlayalım. Önemli Rl'ye kadar yük direnci. İyonlar dış devrede hareket edemezler ve elektronlar, fazlalığın olduğu "hidrojen" kısmından zarın karşı tarafına doğru hareket etmeye başlar ve Şekil 2'deki gibi dış devrede bir elektrik akımı oluşturur. 7.2. Bizi ilgilendiren reaksiyon “su” elektrotunda meydana gelir ve denklemle tanımlanır.
2H2 -> 4H+ + 4e (anodik reaksiyon)
Elemanın açıklanan çalışma şemasının önemli bir dezavantajı vardır: termodinamiğin birinci yasasıyla çelişir. Aslında, bir elektrik akımı harici bir yükten aktığında, miktarı I2RL ürünü tarafından belirlenen miktarda serbest bırakılır. Aynı zamanda elektrikli
Katot bölgesine giderek H+ iyonlarıyla birleşerek membrandan geçerek hidrojen atomları oluşturur ve sonuçta "yakıt" olarak kullanılan H2 gazı moleküllerini oluşturur. Eğer süreç verilen şemaya göre ilerleseydi yakıt tüketimi olmadan ısı alırdık.
Dış devre yalnızca elektronların hareketi için bir yol oluşturur, ancak kendi başına elektrik akımının oluşmasının nedeni olamaz. Tıpkı bir borunun bir ucunu göle indirdiğinizde suyun kendisi borunun içine akmayacağı gibi. Suyun akabilmesi için diğer ucunun su yüzeyinin altında olması gerekir. Benzer şekilde, harici bir devreye elektrik akımı vermek için katot bölgesindeki rmodinamik potansiyeli azaltmak gerekir. Bunu yapmanın en kolay yolu, molekülleri elektronlar ve iyonlarla birleşerek suyun oluşmasına neden olan oksijeni eklemektir:
4е“ + 4Н+ + 02 -» 2Н20 (katot reaksiyonu). (4)
Reaksiyon ekzotermiktir, yani hidrojen yanarken olduğu gibi termal enerjinin değil, ağırlıklı olarak elektrik enerjisinin salınmasıyla ilerler. Açıkçası, yakıt elemanına güç veren bu enerjidir.
Elektrokimyasal hücrenin açıklanan diyagramı Şekil 2'de gösterilmektedir. 7.2.
Normal koşullar altında, tam bölgede dağılan hidrojen moleküllerinin* oranı küçüktür. Fiziksel parametreler değiştirilerek biraz artırılabilir
Le Chatelier prensibine göre sayaçlar. örneğin sistem sıcaklığını artırarak. Hidrojen moleküllerinin ayrışma derecesi, katalizörlerin etkisi kullanılarak da arttırılabilir1.
Bir elektrokimyasal hücrede meydana gelen reaksiyonun tamamı aşağıdaki denklemle tanımlanır:
2H2 + 02 -> 2H?0.
Alessandro Volta (1745-1, 1800) tarafından icat edilen elektrokimyasal hücre, sürekli modda elektrik akımı üreten ilk cihazdı. Tuz çözeltisine batırılmış kağıt tabakalarıyla ayrılmış çinko ve gümüş (veya bakır) bazlardan oluşuyordu. Galvanik pil oluşturuldu Elemanların seri bağlanmasıyla, bir elemanın elektrodu doğrudan başka bir elemanın ÇİNKO elektroduna bağlandı.
Bir elektrokimyasal Volta hücresi, kaynaklı ve bakır elektrotların bu asidin seyreltik (örneğin %10) bir çözeltisine daldırılmasıyla yapılabilir. Çinko oksitlenecektir:
Zn -> Zr,++ + 2e >
Sonuç olarak serbest elektronlar oluşur. Çinko iyonlarını suda çözün. Güçlü bir asit olan sülfürik asit1), iyonlara ayrışır:
H2S04 - "2Н+ + SOf"
Çinko iyonları sülfat iyonlarıyla birleşerek çinko sülfat oluşturur. Hidronyum iyonu H"(H20)x formundaki Pons, elektrolit içinden elektrota doğru hareket edecek ve burada gaz kabarcıkları şeklinde salınacaklardır (hidronyum iyonu, elektrota II'nin dışından gelen elektronları yakaladığında) Bu tip elektrokimyasal hücre pratikte neredeyse işe yaramaz çünkü bakır elektrot çok hızlı bir şekilde yüzeyine yapışan hidrojen kabarcıklarıyla kaplanır ve bu da elektrota giren iyonların akışını önemli ölçüde azaltır. "Kuru hücreler" olarak adlandırılanlar, yüzeyde yalıtkan bir gaz tabakasının oluşumunu önlemek için bazı yöntemler kullanır. Hidrojeni absorbe etmek için kullanılan kimyasal reaktife depolarizatör denir. Tüketilen reaktiflerden biri genellikle
"> Bir asidin gücü, moleküllerinin sulu bir çözeltide ayrışma derecesine göre belirlenir. C asidi tamamen H+ ve C1_ iyonlarına ayrışır - bu güçlü bir asittir. Sülfürik asit biraz daha zayıftır ancak aynı zamanda güçlü asitlere de aittir. Şaşırtıcı bir şekilde, hidroflorik asit, yüksek aşındırıcılık aktivitesine rağmen oda sıcaklığında zayıf bir asit - n t çözeltisidir, nötr HF moleküllerinin toplam konsantrasyonundaki H+ iyonlarının oranı %3'ten azdır.
kolayca oksidasyona maruz kalan safra; Çinko en sık kullanılır. Volta elemanındaki bakır elektrotun kimyasal reaksiyonlara girmediğini ve dolayısıyla bakırın tüketilmediğini unutmayın.
Yakın zamana kadar, ucuz galvanik piller, anotun çinkodan yapıldığı ve katodun, grafit ilavesiyle (elektrik iletkenliğini arttırmak için) toz halinde manganez dioksit tabakasıyla kaplanmış bir grafit çubuktan yapıldığı Leclanchet hücreleri kullanıldı. Manganez dioksit açığa çıkan hidrojeni emer ve bu da katot yüzeyinde bir gaz tabakasının oluşmasını engeller. Elektrolit olarak amonyum klorür kullanılır. Modern (alkalin) piller alkalin elektrolit kullanır.
Anot malzemesi olarak kullanılan çinko tamamen saf olsaydı, yalnızca elektrik akımı elementin içinden geçtiğinde tüketilirdi. Yabancı maddelerin varlığı, eleman kullanılmadığında bile elektrotun korozyonuna neden olur (kirlilikler, elektrot malzemesinin içinde çok sayıda mikroskobik elektrokimyasal hücre oluşturur). Bu tür pillerin raf ömrünün uzun olmasını sağlamak için anot, çinko ve cıva alaşımından (birleştirilmiş) yapılır. Şu anda Leclanche hücrelerinin yerini neredeyse tamamen alkalin piller aldı.
Birçok kimyasal reaksiyon yalnızca enerji dışarıdan sağlandığında meydana gelir. Genellikle harici bir akım kaynağına bağlı elektrotlar üzerindeki elektrolitik hücrelerde (elektrolizörler) gerçekleştirilirler. Bu reaksiyonların incelenmesi, çeşitli maddelerin doğası ve özellikleri hakkında bilgi sağlar ve ayrıca elektrosentez kullanılarak yeni kimyasal bileşiklerin elde edilmesini mümkün kılar. Elektrokimyasal prosesler endüstride yaygın olarak kullanılmaktadır. Örnekler arasında klor ve alüminyum üretimi, elektrokaplama ve elektrikle ekstraksiyon yer alır. Kimyasal enerjiyi elektrik enerjisine dönüştüren galvanik hücreler, yakıt hücrelerinin yanı sıra piller ve akümülatörler gibi mevcut kaynakların temelini oluşturur. Elektrokimya ayrıca diğer elektriksel olayları da inceler: elektrolit çözeltilerdeki iyonların davranışı ve bu tür çözeltilerden akımın geçişi; iyonların bir elektrik alanında ayrılması (elektroforez); metallerin korozyonu ve pasifleşmesi; biyolojik sistemlerde elektriksel etkiler (biyoelektrokimya); fotoelektrokimyasal süreçler (ışığın hücrelerdeki elektrokimyasal reaksiyonlar üzerindeki etkisi).
Tarihsel referans.
Sistematik elektrokimyasal araştırmaların yapılması ancak sabit, yeterince güçlü bir elektrik akımı kaynağının yaratılmasından sonra mümkün hale geldi. Böyle bir kaynak 18. ve 19. yüzyılların başında ortaya çıktı. L. Galvani ve A. Volta'nın çalışmaları sonucunda. Kurbağanın fizyolojik fonksiyonlarını incelerken Galvani, yanlışlıkla iki farklı metal ve parçalanmış kurbağa bacağının kasından oluşan bir elektrokimyasal devre yarattı. Bakır bir tutucuyla sabitlenen pençeye, yine tutucuya bağlı olan demir bir telle dokunulduğunda kas kasıldı. Elektrik deşarjının etkisi altında da benzer kasılmalar meydana geldi. Galvani bu olguyu “hayvan elektriğinin” varlığıyla açıkladı. Bu deneylerin farklı bir yorumu, elektriğin iki metalin temas ettiği noktada ortaya çıktığına ve kurbağa kasının kasılmasının elektrik akımının içinden geçmesinin bir sonucu olduğuna inanan Volta tarafından yapılmıştır. Tuzlu suya batırılmış süngerimsi bir malzeme (kumaş veya kağıt) iki metal disk (örneğin çinko ve bakır) arasına yerleştirildiğinde ve devre kapatıldığında da bir akım meydana geliyordu. 1800 yılında Volta, bu "elementlerin" 15-20'sini seri olarak bağlayarak ilk kimyasal akım kaynağını - "voltaik sütunu" yarattı.
Elektriğin kimyasal sistemler üzerindeki etkisi hemen birçok bilim insanının ilgisini çekti. Zaten 1800 yılında, W. Nicholson ve A. Carlyle, bir "voltaik sütuna" bağlı platin ve altın teller kullanılarak içinden bir elektrik akımı geçirildiğinde suyun hidrojen ve oksijene ayrıştığını bildirdi. İlk elektrokimyasal çalışmaların en önemlisi İngiliz kimyager H. Davy'nin çalışmasıydı. 1807 yılında hafif nemlendirilmiş katı potasyum hidroksitten akım geçirerek potasyum elementini izole etti. Gerilim kaynağı 100 galvanik hücreden oluşan bir bataryaydı. Metalik sodyum da benzer şekilde elde edildi. Davy daha sonra bir cıva elektrotu kullanarak elektroliz yoluyla magnezyum, kalsiyum, stronsiyum ve baryumu izole etti.
Davy'nin asistanı M. Faraday, elektrot/çözelti arayüzünden akan elektrik miktarı (güncel çarpı zaman) ile bunun neden olduğu kimyasal değişiklikler arasındaki ilişkiyi araştırdı. Bir elektrolitik hücrede salınan hidrojen ve oksijenin hacminden gelen elektrik miktarını ölçmek için (şu anda gaz kulometresi olarak bilinen) bir alet oluşturuldu ve belirli bir miktarda gaz elde etmek için gereken elektrik miktarının gerekli olduğu gösterildi (1833). Maddenin elektrotların boyutuna, aralarındaki mesafeye ve hücreyi besleyen pildeki plaka sayısına bağlı olmadığı belirtiliyor. Ayrıca Faraday, elektroliz sırasında açığa çıkan madde miktarının, kimyasal eşdeğeri ve elektrolitten geçen elektrik miktarıyla doğru orantılı olduğunu keşfetti. (Kimyasal eşdeğer, bileşiklerdeki bir mol atomla (1.0078 g) hidrojenle reaksiyona giren veya yerini alan bir element veya bileşiğin gram sayısıdır; santimetre. EŞDEĞER KÜTLE). Bu iki temel hükme Faraday yasaları denir. Faraday, klasik filoloji uzmanı arkadaşı W. Whewell ile birlikte elektrokimyada da yeni bir terminoloji geliştirdi. Çözeltiye batırılmış iletkenlere elektrotlar adını verdi (daha önce bunlara kutup deniyordu); “Elektroliz” (akımın geçişine bağlı kimyasal değişiklikler), “elektrolit” (elektrokimyasal hücrelerde sıvının iletilmesi), “anot” (üzerinde oksidasyon reaksiyonunun meydana geldiği elektrot) ve “katot” (üzerinde oksidasyon reaksiyonunun meydana geldiği elektrot) kavramlarını tanıttı. indirgeme reaksiyonu meydana gelir). Sıvılardaki yük taşıyıcılarına iyonlar (Yunanca "gezgin", "gezgin" kelimesinden gelir) adını verdi ve anoda (pozitif elektrot) doğru hareket eden iyonlara "anyon", katoda doğru hareket eden iyonlara ise "katyon" adı verildi. Faraday'ın elektromanyetik indüksiyon üzerine araştırması, endüstriyel ölçekte elektrokimyasal süreçlerin gerçekleştirilmesini mümkün kılan elektrik jeneratörlerinin yaratılmasına yol açtı.
Faraday, çözeltilerin elektrik akımını geçirme yeteneğini içlerindeki iyonların varlığıyla açıkladı, ancak kendisi ve I. Hittorf ve F. Kohlrausch gibi diğer bilim adamları iyonların akımın etkisi altında ortaya çıktığına inanıyorlardı. 1884 yılında S. Arrhenius, iyonların aslında tuzun suda çözünmesiyle oluştuğunu öne sürdü. S. Arrhenius, J. van't Hoff ve W. Ostwald'ın çalışmaları, elektrolit teorisinin ve çözeltilerin fizikokimyasal özellikleri ve termodinamiği hakkındaki fikirlerin geliştirilmesinde önemli bir kilometre taşıydı. İyonik iletkenlik ve çözeltideki dengeye ilişkin teori ve deneysel veriler arasındaki yazışma, P. Debye ve E. Hückel'in 1923'te iyonlar arasındaki uzun menzilli elektrostatik etkileşimleri hesaba katmasından sonra daha da eksiksiz hale geldi.
J. Gibbs ve W. Nernst, elektrokimyasal termodinamiğe ve özellikle bir elektrokimyasal hücredeki elektrik potansiyelinin (voltaj) doğasını ve elektrik, kimyasal ve termal enerji arasındaki dengeyi açıklamaya büyük bir katkı yaptı. Elektrokimyasal potansiyel, hücrede meydana gelen işlemlerin kimyasal enerjisi ile belirlenir, ancak aynı zamanda hızlarına da (kinetik) bağlıdır. Elektrotlar üzerindeki kinetik süreçlerin modellenmesi Y. Tafel (1905), J. Butler (1924), M. Volmer (1930), A.N. Frumkin (1930–1933) tarafından yapılmıştır.
Elektrokimyasal hücreler.
Bir elektrokimyasal hücre genellikle her biri kendi elektrolitine daldırılmış bir elektrot olan iki yarım hücreden oluşur. Elektrotlar elektriksel olarak iletken malzemeden (metal veya karbon) veya daha az sıklıkla yarı iletkenden yapılır. Elektrotlardaki yük taşıyıcıları elektronlar, elektrolitteki yük taşıyıcıları ise iyonlardır. Bir elektrolit olan sulu bir sofra tuzu çözeltisi (sodyum klorür NaCl), yüklü parçacıklar içerir: sodyum katyonları Na + ve klor anyonları Cl –. Böyle bir çözeltiyi bir elektrik alanına yerleştirirseniz, Na + iyonları negatif kutba, Cl – iyonları ise pozitif kutba hareket edecektir. NaCl gibi erimiş tuzlar da elektrolitlerdir. Elektrolitler aynı zamanda katı da olabilir, örneğin B- hareketli sodyum iyonları veya iyon değiştirici polimerler içeren alümina (sodyum polialüminat).
Yarı hücreler, iyonların hareketini engellemeyen ancak elektrolitlerin karışmasını önleyen bir bölmeyle ayrılır. Böyle bir bölümün rolü, bir tuz köprüsü, her iki ucu cam yünü ile kapatılmış sulu bir çözelti içeren bir tüp, bir iyon değişim membranı veya gözenekli bir cam plaka ile gerçekleştirilebilir. Elektrolitik hücrenin her iki elektrotu da aynı elektrolite daldırılabilir.
İki tür elektrokimyasal hücre vardır: galvanik hücreler ve elektrolitik hücreler (elektrolizörler). Galvanik hücrede, elektrot/elektrolit arayüzünde kimyasal reaksiyonlar kendiliğinden meydana gelir ve elektrotlar birbirine bir iletken aracılığıyla bağlanır. Seri olarak bağlanan birkaç galvanik hücre, kimyasal bir akım kaynağı olan bir pil oluşturur. Bir elektrolitik hücrede, elektrot/elektrolit arayüzündeki reaksiyonlar, harici bir elektrik enerjisi kaynağı nedeniyle meydana gelir; ikincisi elektrotlarda meydana gelen reaksiyon ürünlerinin kimyasal enerjisine dönüştürülür. Galvanik hücrenin yapısı Şekil 2'de gösterilmektedir. 1 ve elektrolizör - Şekil 2'de. 2. Aynı hücrenin, çalışma moduna bağlı olarak galvanik hücre veya elektrolizör olarak davranabileceğini unutmayın. Bu nedenle, kurşun-asitli bir araba aküsü, motoru çalıştırmak için kullanıldığında (boşalırken) galvanik hücre görevi görür ve bir araba jeneratöründen veya şarj cihazından şarj edildiğinde bir elektrolizör görevi görür.
1836'da J. Daniel tarafından oluşturulan basit bir galvanik hücre (Şekil 1), iki elektrottan oluşur: sulu bir çinko sülfat çözeltisine daldırılmış çinko ve sulu bir bakır (II) sülfat çözeltisine daldırılmış bakır. Böyle bir element, voltaik kolondaki bakır-çinko çiftlerine benzer. Dış devre kapatıldığında çinko elektrotun yüzeyindeki çinko atomları, elektronların salınmasıyla iyonlara oksitlenir: Zn ® Zn 2+ + 2e – . Bu elektronlar dış devre boyunca bakır elektroda doğru hareket eder ve bakır iyonlarını atomlara indirger: Cu 2+ + 2e – ® Cu. Dış devredeki elektronların akışı, eleman tarafından üretilen akımdır. Kimyasal dönüşüme ve elektrik enerjisi üretimine yol açan genel reaksiyon şu şekildedir:
Tam olarak aynı reaksiyon, bir bakır sülfat çözeltisine metalik çinko eklendiğinde meydana gelir, ancak bu durumda kimyasal enerji termal enerjiye dönüştürülür.
Elektrokimyasal hücreler genellikle elektrot ile elektrolit arasındaki sınırın dikey veya eğik çizgiyle (| veya /) ve tuz köprüsünün iki eğik çizgiyle (//) gösterilmesiyle şematik olarak temsil edilir. Yani, Şekil 2'deki galvanik hücre. 1 cevap girişi
burada M, çözeltinin molar konsantrasyonudur.
Şekil 2'de gösterilen elektrolitik hücrede. Şekil 2'de, klor ve alkali üretimi için endüstriyel elektrolizörlerde olduğu gibi aynı reaksiyonlar meydana gelir: tuzlu suyun (konsantre sulu bir sodyum klorür çözeltisi) klor ve sodyum hidroksit NaOH'a dönüştürülmesi:
Grafit elektrot üzerindeki klorür iyonları, klor gazına oksitlenir ve demir elektrot üzerindeki su, hidrojen ve hidroksit iyonlarına indirgenir. Elektrolitler, sodyum iyonlarının bir bölme (iyon değiştirme zarı) boyunca hareketi nedeniyle elektriksel olarak nötr kalır. Oksidasyonun meydana geldiği elektrota (Şekil 1'de çinko ve Şekil 2'de grafit) anot, indirgemenin meydana geldiği elektrota ise katot adı verilir.
Elektrot potansiyeli.
Elektrokimyasal hücrelerin ana elektriksel parametreleri akım (amper, A cinsinden ölçülür) ve potansiyeldir (volt, V cinsinden ölçülür). Akım gücü, elektrot reaksiyonlarının hızı ile belirlenir ve potansiyel, hücrede meydana gelen işlemlerin kimyasal enerjisi ile belirlenir. Enerjinin (joule cinsinden ölçülen, J) elektrik miktarına (coulomb cinsinden ölçülen, C) bölünmesine eşittir, yani. 1V = 1J / Cl. Bu nedenle bir elementin potansiyeli (elektromotor kuvvet, emk), içinde meydana gelen reaksiyonlar sırasında üretilen enerjinin bir ölçüsüdür. Harici devre açıksa elektrot reaksiyonu meydana gelmez.
Açık bir dış devreye sahip bir galvanik hücrenin potansiyeli, reaksiyonlarının termodinamiği hakkında bilgi sağlar. Şekil 2'de gösterilen elemanın potansiyeli. 1, 1 M çözelti konsantrasyonunda ve 25 ° C sıcaklıkta - standart potansiyeli e° – 1,10 V'ye eşittir. İlgili enerji, Gibbs termodinamik potansiyeli, D G° tarafından verilir
Nerede N– reaksiyon sırasında aktarılan elektronların sayısı (bu durumda 2), F– Faraday numarası (96 485 C / köstebek). Bir galvanik hücrenin potansiyeli, iki yarı hücresi arasındaki potansiyel farkına eşittir; elektrot potansiyellerindeki fark. Elektrot potansiyelleri, geleneksel olarak sıfır olarak alınan referans elektrot potansiyeline göre ölçülür ( santimetre. masa). Anlaşmaya göre standart elektrot olarak normal bir hidrojen elektrotu (N.H.E.) seçildi; platin siyahı ile kaplanmış, 1.01H 10 5 Pa (1 atm.) basınçta hidrojen gazı ile doyurulmuş ve termodinamik aktiviteye sahip H+ iyonları içeren bir çözeltiye daldırılmış bir platin plakadır. A= 1. Şematik olarak bu elektrot Pt/H2 (1,01H 10 5 Pa)/H + ( A= 1). Üzerinde 2H + + 2e – ® H2 reaksiyonu meydana gelir. Cu/Cu2+ bakır elektrodun standart potansiyelini belirlemek için aşağıdaki galvanik hücreyi monte edin:
ve yarı reaksiyon Cu 2+ + 2e – ® Cu için ölçüm şunu verir:
Benzer şekilde Zn 2+ + 2e – ® Zn reaksiyonunun meydana geldiği Zn/Zn 2+ yarı hücresi için şunu elde ederiz:
Bu iki standart elektrot potansiyeli arasındaki fark, Zn-Cu elementinin standart potansiyeline eşittir.
Aslında hidrojen elektrotu potansiyometrik ölçümlerde nadiren kullanılır çünkü pratikte uygulanması zor olan ideal bir sistemi temsil eder. Çok daha sık olarak, akıma göre spesifik, dikkatlice ölçülmüş bir potansiyel değere sahip, çeşitli tiplerde daha kullanışlı ve kompakt karşılaştırma elektrotları kullanılır. Genellikle metalik cıva, cıva klorür (kalomel) ve bir potasyum klorür çözeltisinden oluşan bir kalomel elektrot (CE) kullanırlar: Hg /Hg2Cl2/KCl. Elektrotta aşağıdaki reaksiyon meydana gelir:
Potansiyel k.e. cıva iyonlarının konsantrasyonuna bağlıdır ve ikincisi KCl çözeltisinin konsantrasyonuna bağlıdır. Doymuş KCl çözeltisi için e° (k.e.) av = 0,2412 V (n.e.), 25° C'de.
|
STANDART ELEKTROT POTANSİYELLERİ |
|
| Elektrot reaksiyonu |
e o, V |
| Li + + e – ® Li | |
| Mg 2+ + 2e – ® Mg | |
| Al 3+ + 3e – ® Al | |
| Zn 2+ + 2e – ® Zn | |
| Cr 3+ + e – ® Cr 2+ | |
| 2H + + 2e – ® H 2 | |
| Cu 2+ + 2e – ® Cu | |
| Fe 3+ + e – ® Fe 2+ | |
| O 2 + 4H + + 4e – ® 2H 2 O | |
| Cl 2 + 2e – ® 2Cl – | |
| F 2 + 2e – ® 2F – | |
Bazı elektrotların maddelerinin karşılık gelen reaksiyonun denklemine dahil edilmediğine dikkat edin. Evet tepki
aslında bir Pt/Fe 3+, Fe 2+ hücresindeki platin elektrotta meydana gelir. Platin elektrot inerttir ve yalnızca elementin oksitlenmiş ve indirgenmiş formlarını (bu durumda iki değerlikli ve üç değerlikli demir iyonları) içeren elektrolitle temas sağlar. Platin elektrot N.V.E.'de aynı rolü oynar.
Elektrot potansiyeli tabloları, galvanik hücrenin EMF'sini elektrot potansiyellerine göre hesaplamanıza olanak tanır. Belirli bir redoks reaksiyonunun meydana gelip gelmeyeceğini tahmin etmek için de kullanılabilirler. Standart elektrot potansiyelinden ancak reaksiyona katılan bileşenlerin aktivitesi 1'e eşit olduğunda bahsedebiliriz. çözeltideki konsantrasyonları 1M'ye yakındır. Elektrot potansiyeli eçözeltideki oksitlenmiş ve indirgenmiş formların konsantrasyonuna bağlıdır ve bunlarla ve standart potansiyelle ilgilidir. e° Nernst denklemi. Genelleştirilmiş bir reaksiyon için
öküz + N e – = kırmızı
bu denklem şu şekle sahiptir
Nerede R- Evrensel gaz sabiti, T– mutlak sıcaklık ve – oksitlenmiş ve indirgenmiş formların aktiviteleri. Saf katı ve sıvıların aktiviteleri 1 olarak kabul edilir. 25°C'de RT/F= 0,025 V. Referans elektrot potansiyeline göre elektrot potansiyellerini ölçerek, denklem (10) kullanılarak çözeltideki maddelerin konsantrasyonlarını belirlemek mümkündür; bu yönteme potansiyometri denir.
Elektrot reaksiyonları.
Potansiyometrik ölçümler, elektrokimyasal hücrede akımın olmadığı koşullar altında gerçekleştirilir. Bu, içinde genel bir kimyasal değişimin meydana gelmediği ve ölçülen potansiyelin (dengenin) reaksiyonların termodinamiği tarafından belirlendiği anlamına gelir. Bu koşullar altında elektrotların boyutu ve şekli ya da çözeltiyi karıştırmanın yoğunluğu gibi faktörler ölçülen potansiyeli etkilemez. Akım bir elektrokimyasal hücreden akarsa, elektrot reaksiyonlarının hızı yalnızca termodinamik parametrelere değil aynı zamanda denklem uyarınca akımın gücüne de bağlıdır.
Nerede N– belirli bir elektrot reaksiyonuna katılan elektronların sayısı, F– Faraday numarası. Bu durumda elektrokimyasal hücrenin potansiyeli kinetik faktörlerin yanı sıra elektrotun yapıldığı malzemeye, elektrotun boyutuna ve şekline, çözeltiyi karıştırmanın yoğunluğuna ve diğer birçok faktöre bağlıdır. Hücrenin iç direnci ihmal edilemez. Her iki elektrot/elektrolit sınırlarındaki potansiyel farkına ek olarak, direncinden dolayı çözeltinin kendisinde de bir voltaj düşüşü meydana gelir. Bu voltaj düşüşü, her iki elektrotta meydana gelen reaksiyonlarla ilişkili etkilerin incelenmesini zorlaştırır. Genellikle reaksiyon, üç elektrotlu bir hücre kullanılarak çalışma veya gösterge elektrotu adı verilen bir elektrot üzerinde incelenir (Şekil 3): üçüncü elektrot (örneğin doymuş kalomel) çalışma ile aynı bölmeye yerleştirilir. Ohmik voltaj düşüşünün etkisini en aza indirgemek için mümkün olduğu kadar yakın bir tane. Çalışma elektrodundan geçen akımın, bu elektrodun referans elektroduna göre potansiyelinin bir fonksiyonu olarak ölçülmesiyle, sözde polarizasyon eğrisi.
Harici bir akım geçtiğinde elektrot potansiyeli denge potansiyelinden farklı olur. Bu sapmaya polarizasyon, büyüklüğüne ise aşırı gerilim denir. Aşırı gerilim, elektrot reaksiyonlarının hızını sınırlayan çeşitli faktörlere bağlıdır. Belirli bir akım yoğunluğunda (birim elektrot yüzeyi başına akım gücü) hızlı elektrot reaksiyonları, termodinamiğe yakın potansiyellerde ve dolayısıyla düşük aşırı voltajda meydana gelir. Yavaş reaksiyonlar yüksek aşırı gerilim ile karakterize edilir. Elektrot reaksiyonlarının oranları ve dolayısıyla aşırı gerilim, reaktiflerin konsantrasyonuna, sıcaklığa, çözücüye, elektrot malzemesine, kütle aktarım yöntemine ve hızına ve akım yoğunluğuna bağlıdır. Toplam aşırı gerilim birkaç bileşene ayrılabilir: konsantrasyon, aktivasyon ve reaksiyon.
Konsantrasyon aşırı gerilimi, bir akım geçtiğinde elektrot yüzeyindeki reaksiyona giren iyonun konsantrasyonunun değişmesi, bu alanda elektroaktif maddelerin tüketilmesi ve reaksiyon ürünlerinin oluşması nedeniyle oluşur. Bir bakır elektrot üzerinde Cu2+'nın indirgenmesini ele alalım. Başlangıçta çözeltideki Cu2+ konsantrasyonu 1M'dir. Devrede akım olmadığında bakır elektrotun potansiyeli Cu/Cu 2+ çiftinin standart potansiyeline yakındır; N.E'ye göre 0,34 V. [ santimetre. denklem (6)]. Katot akımı geçtikçe elektrot yüzeyindeki Cu2+ iyonlarının konsantrasyonu azalır ve Nernst denklemine (10) göre katot potansiyeli giderek negatif hale gelir. Reaktifin taze kısımları çözeltiden elektroda farklı yollarla ulaşır: difüzyon, konveksiyon ve migrasyonun bir sonucu olarak. Bu işlemlerin hızı ne kadar yüksek olursa (örneğin, karıştırma ne kadar yoğun olursa), konsantrasyon aşırı voltajı da o kadar düşük olur. Toplam aşırı voltajın bu bileşeni sıklıkla hesaplanabilir. Konsantrasyon polarizasyonu toplam aşırı gerilime ana katkıyı sağlıyorsa (bu, elektrot reaksiyonunun geri kalan aşamalarının oranının yüksek olduğu anlamına gelir), o zaman reaksiyona tersinir veya Nernstian adı verilir.
Aktivasyon aşırı gerilimi, elektrot yüzeyindeki elektron transferinin anında değil, sonlu bir hızda gerçekleşmesi sonucu meydana gelir. Genelleştirilmiş elektrot reaksiyonunu ele alalım ox + N e – = kırmızı. Elektronları oksitlenmiş bileşiklere belirli bir hızda (yani belirli bir akım yoğunluğunda) aktarmak için, elektrot reaksiyonunun aktivasyon enerjisi adı verilen bir enerji bariyerinin aşılması gerekir. Bu enerji uygulanan potansiyel tarafından sağlanır. Akım yoğunluğu ile aktivasyon aşırı gerilimi arasındaki ilişki, elektrot reaksiyonlarının kinetik parametrelerini belirlemek için kullanılabilen Butler-Volmer ve Tafel denklemleriyle tanımlanır. Suyun hidrojene indirgenmesi ve oksijene oksidasyonu gibi birçok elektrot reaksiyonu yavaş yavaş gerçekleşir. Elektrot reaksiyonunun hızı büyük ölçüde elektrotun yapıldığı malzemeye ve yüzeyinin özelliklerine bağlı olabilir. Örneğin, bir cıva elektrotunda suyun hidrojene indirgenmesi oldukça zordur: bu, yüksek hidrojen aşırı voltajıyla karakterize edilir. Bu reaksiyon platin üzerinde çok daha hızlı ve daha az aşırı gerilimle gerçekleşir; Bu nedenle hidrojen referans elektrotunda platin kullanılır. Reaksiyonların hızı aynı zamanda elektrot yüzeyine adsorbe edilen veya bağlanan maddelere de bağlıdır; Böylece siyanür iyonu ve bir dizi organik bileşik, platin elektrotun yüzeyinde hidrojen oluşum hızını azaltır. Aynı zamanda, bazı yüzey aktif maddeler elektrot reaksiyonunun hızını önemli ölçüde artırabilir - bunlara elektrokatalizörler denir.
Reaksiyon aşırı gerilimi, elektrottaki elektronların transferi çözeltideki kimyasal reaksiyonla birleştiğinde meydana gelir. Böyle bir reaksiyon, elektron transferinde yer alan parçacıkların kaynağı olarak hizmet edebilir ve aynı zamanda tüm elektrot işleminin hızını sınırlayabilir. Bu nedenle elektrot reaksiyonlarının mekanizmasının (yani aşamaları ve ara durumları) ayrıntılarını bilmek çok önemlidir. Birçok durumda başlangıç malzemesi, oksijenin suya indirgenmesi durumunda olduğu gibi, elektrotta son ürün haline gelmeden önce çeşitli dönüşümlere uğrar; bu, pratik açıdan büyük öneme sahiptir. Toplam reaksiyon şu şekildedir:
ve birinde oksijen-oksijen bağının kırıldığı birkaç aşamadan oluşur. Bu çok aşamalı reaksiyon nedeniyle çoğu elektrottaki reaksiyon yavaştır ve endüstriyel ölçekte elektrokatalizörlerin varlığında gerçekleştirilir. Elektrot reaksiyonlarının mekanizması aşağıda açıklanan elektroanalitik yöntemler kullanılarak incelenmiştir. Genellikle çözeltinin bileşimi ve çözücünün doğası değiştiğinde reaksiyonun seyri de değişir. Örneğin, proton eksikliğinin olduğu asetonitrilde oksijenin indirgenmesi, basit bir tek elektron mekanizmasına göre ilerler:
Elektrokimyasal analiz yöntemleri.
Kimyasal maddelerin niteliksel ve niceliksel analizi için çeşitli elektrokimyasal yöntemler geliştirilmiştir; bunlar genellikle elektrot reaksiyonlarının termodinamik ve kinetik parametrelerinin belirlenmesinde ve mekanizmalarının incelenmesinde de faydalıdır.
İletkenlik ölçümü
bir çözeltinin elektriksel iletkenliğinin ölçülmesine dayanır ve tuzların, asitlerin, bazların vb. konsantrasyonunu belirlemek için kullanılır. Kondüktometrik belirlemelerde genellikle aynı malzemelerden yapılmış elektrotlar kullanılır ve bunların iletkenliği için koşullar, her iki elektrot/elektrolit arayüzündeki potansiyel sıçramaların katkısını en aza indirecek şekilde seçilir (örneğin, yüksek frekanslı alternatif akım kullanılır). ). Bu durumda ölçülen hücre potansiyeline asıl katkı omik voltaj düşüşünden sağlanır. IR, Nerede R– çözüm direnci. Tek bileşenli bir çözeltinin elektriksel iletkenliği, konsantrasyonuyla ilişkili olabilir ve karmaşık bileşimdeki elektrolitlerin elektriksel iletkenliğinin ölçülmesi, çözeltideki toplam iyon içeriğinin tahmin edilmesine olanak tanır ve örneğin damıtılmış çözeltinin kalitesinin izlenmesinde kullanılır. veya deiyonize su. Başka bir kondüktometri türü olan kondüktometrik titrasyonda, bilinen bir reaktif, analiz edilen çözeltiye porsiyonlar halinde eklenir ve elektriksel iletkenlikteki değişiklik izlenir. Elektriksel iletkenlikte keskin bir değişikliğin kaydedildiği eşdeğerlik noktası, bu değerin eklenen reaktif hacmine bağımlılığının grafiğinden belirlenir.
Potansiyometri
galvanik bir hücrenin potansiyeline ilişkin verilere dayanarak çeşitli fizikokimyasal parametreleri belirlemek için kullanılır. Referans elektrota göre ölçülen, elektrokimyasal devrede akım yokluğunda elektrot potansiyeli, Nernst denklemi ile çözeltinin konsantrasyonuyla ilişkilidir. Potansiyometrik ölçümlerde, öncelikle çözeltideki bir iyona duyarlı iyon seçici elektrotlar yaygın olarak kullanılır: pH ölçümü için bir cam elektrot ve sodyum, amonyum, flor, kalsiyum, magnezyum vb. iyonların seçici tespiti için elektrotlar. İyon seçici elektrotun katmanı enzimler içerebilir ve sonuç, uygun substrata duyarlı bir sistemdir. İyon seçici elektrotun potansiyelinin, elektronik iletkenliğe sahip maddelerde olduğu gibi elektron transferi ile değil, esas olarak iyonların transferi veya değişimi ile belirlendiğine dikkat edin. Ancak elektrot potansiyelini çözeltideki bir maddenin konsantrasyonunun (veya aktivitesinin) logaritmasıyla ilişkilendiren Nernst denklemi bu tür bir elektrot için de geçerlidir. Potansiyometrik titrasyonda analiz edilen çözeltiye reaktif porsiyonlar halinde eklenir ve potansiyeldeki değişim izlenir. Bu tip titrasyonun S şeklindeki eğrileri, eşdeğerlik noktasının belirlenmesine ve denge sabiti ve standart potansiyel gibi termodinamik parametrelerin bulunmasına olanak tanır.
Voltametri.
Tüm voltametrik yöntem çeşitleri, 10–7–10–1 cm2 yüzey alanına sahip çalışan bir mikroelektrot kullanır. Onun yardımıyla elde edilen akım-voltaj eğrileri, çözünmüş maddelerin tanımlanmasını, konsantrasyonlarının belirlenmesini ve sıklıkla termodinamik ve kinetik parametrelerin belirlenmesini mümkün kılar. İlk voltametrik yöntem - polarografi - 1922'de Çek kimyager J. Heyrovsky tarafından önerildi. Düzeneğindeki çalışma elektrodu damlayan bir cıva elektroduydu. Cıva yüksek hidrojen aşırı voltajına sahiptir, bu nedenle cıva elektrotu negatif potansiyellerde meydana gelen süreçleri incelemek için uygundur. Elektrot yüzeyi ölçüm işlemi sırasında sürekli olarak yenilenir, bu da elektrotun kirlenmesini ortadan kaldırır. Voltametrik çalışmalar ayrıca platin ve karbon gibi katı elektrotlar kullanılarak ve pozitif potansiyellerde meydana gelen işlemler kullanılarak yürütülür. Doğrusal potansiyel taramalı voltametride (kronoamperometri), potansiyel zamanla doğrusal olarak değişir ve çözelti karıştırılmaz, böylece kütle aktarımı yalnızca difüzyon nedeniyle gerçekleşir. Döngüsel voltametride, bir elektroda tekrarlanan üçgensel voltaj darbeleri uygulanır. Döngünün yükselen bölümünde oluşan maddeler, azalan bölümünde incelenir. Bu yöntem, farklı potansiyel tarama hızlarında ve farklı çözelti konsantrasyonlarında polarizasyon eğrilerini analiz ederek elektrot reaksiyonlarının mekanizmasını incelemek için özellikle etkilidir. Farklı şekillerdeki voltaj darbelerinin doğrusal olarak artan bir potansiyel üzerine bindirildiği başka voltametri türleri de vardır - diferansiyel darbe ve kare dalga. Bu yöntemler, çözeltideki küçük madde konsantrasyonlarını belirlemek için yaygın olarak kullanılır. Voltametrik ölçüm sırasında çözelti karıştırılırsa, yani kütle aktarımı konveksiyon ve difüzyon kullanılarak aynı anda meydana gelir, o zaman hidrodinamik voltametriden söz ederiz. Bu durumda, deneysel akım-gerilim eğrileri teorik olanlarla doğrudan karşılaştırılabileceğinden, dönen bir disk elektrotunun kullanılması uygundur.
Amperometri.
Yöntem, gösterge elektrotu ile referans elektrotu arasında sabit bir voltajda bir çözeltiden geçen sınırlayıcı difüzyon akımının ölçülmesine dayanmaktadır. Amperometrik titrasyonda eşdeğerlik noktası, mevcut eğrideki kırılma (eklenen çalışma çözeltisinin hacmi) ile belirlenir. Kronoamperometrik yöntemler akımın zamana bağımlılığının ölçülmesine dayanır ve esas olarak difüzyon katsayılarını ve hız sabitlerini belirlemek için kullanılır. Sıvı kromatografi kolonlarının çıkışında sensör görevi gören minyatür elektrokimyasal hücreler, amperometri (aynı zamanda voltametri) prensibine göre çalışır. Galvanostatik yöntemler amperometrik yöntemlere benzer ancak hücreden belirli miktarda akım geçtiğinde potansiyeli ölçerler. Böylece kronopotansiyometride potansiyelin zaman içindeki değişimi kontrol edilir. Bu yöntemler esas olarak elektrot reaksiyonlarının kinetiğini incelemek için kullanılır.
Kulometri.
Kulometride, kontrollü bir potansiyelde, bir çözeltinin tam elektrolizi, bir elektrolizörde nispeten büyük bir çalışma elektrotuyla (alt cıva veya platin ağ) yoğun bir şekilde karıştırılmasıyla gerçekleştirilir. Toplam elektrik miktarı ( Q, C) Elektroliz için gerekli olan, oluşturan maddenin miktarıyla ilgilidir ( A, d) Faraday yasası:
Nerede M- onlar söylüyor kütle (g/mol), F- Faraday numarası. Kulometrik titrasyon, belirlenen maddeyle reaksiyona giren bir reaktifin elektrolitik olarak üretilmesi için sabit bir akımın kullanılmasını içerir. Titrasyonun ilerlemesi potansiyometrik veya amperometrik olarak kontrol edilir. Kulometrik yöntemler kullanışlıdır çünkü doğası gereği mutlaktırlar (yani, kalibrasyon eğrilerine başvurmadan analit miktarını hesaplamanıza izin verirler) ve elektroliz koşullarındaki ve elektrolizör parametrelerindeki (elektrot yüzey alanı veya karıştırma yoğunluğu) değişikliklere karşı duyarsızdırlar. Kulogravimetride, elektrolizden geçen madde miktarı, elektrolizden önce ve sonra elektrotun tartılmasıyla belirlenir.
Başka elektroanalitik yöntemler de var. Alternatif akım polarografisinde, geniş bir frekans aralığında doğrusal olarak değişen bir potansiyele düşük genlikli sinüzoidal bir voltaj uygulanır ve ortaya çıkan alternatif akımın genliği ve faz kayması veya empedansı belirlenir. Bu verilerden çözeltideki maddelerin doğası ve elektrot reaksiyonlarının mekanizması ve kinetiği hakkında bilgi elde edilir. İnce katman yöntemleri, 10-100 µm kalınlığında bir elektrolit katmanına sahip elektrokimyasal hücreleri kullanır. Bu tür hücrelerde elektroliz, geleneksel elektrolizörlere göre daha hızlı ilerler. Elektrot süreçlerini incelemek için spektrofotometrik kayıtlı spektrokimyasal yöntemler kullanılır. Elektrotun yüzeyinde oluşan maddeleri analiz etmek için görünür, UV ve IR bölgelerindeki ışık emilimi ölçülür. Elektrot yüzeyinin ve ortamın özelliklerindeki değişiklikler, radyasyonun elektrot yüzeyinden yansımasının ölçülmesine dayanan elektriksel yansıma ve elipsometri yöntemleri kullanılarak izlenir. Bunlar arasında speküler yansıma ve ışığın Raman saçılımı (Raman spektroskopisi), ikinci harmonik spektroskopi (Fourier spektroskopisi) yöntemleri yer alır.
Diğer elektrokimyasal olaylar ve yöntemler.
Elektrolitin ve yüklü parçacıkların veya yüzeylerin göreceli hareketi ile elektrokinetik etkiler meydana gelir. Bu türün önemli bir örneği, bir elektrik alanında hareket eden yüklü parçacıkların (örneğin protein molekülleri veya kolloidal parçacıklar) ayrılmasının meydana geldiği elektroforezdir. Elektroforetik yöntemler, jellerdeki proteinleri veya deoksiribonükleik asitleri (DNA) ayırmak için yaygın olarak kullanılır. Elektriksel olaylar canlı organizmaların işleyişinde büyük rol oynar: sinir uyarılarının üretilmesinden ve yayılmasından, zar ötesi potansiyellerin ortaya çıkmasından vb. sorumludurlar. Biyolojik sistemleri ve bileşenlerini incelemek için çeşitli elektrokimyasal yöntemler kullanılır. Işığın elektrokimyasal süreçler üzerindeki etkisini incelemek de ilgi çekicidir. Dolayısıyla fotoelektrokimyasal araştırmanın konusu, güneş enerjisinin elektrik enerjisine dönüştürülme verimliliğinin arttırılması için çok önemli olan, ışığın etkisi altında elektrik enerjisinin üretilmesi ve kimyasal reaksiyonların başlatılmasıdır. Burada genellikle titanyum dioksit, kadmiyum sülfür, galyum arsenit ve silikondan yapılmış yarı iletken elektrotlar kullanılır. Bir başka ilginç olgu ise elektrokemilüminesanstır, yani. Elektrokimyasal hücrede ışık üretimi. Elektrotlar üzerinde yüksek enerjili ürünler oluştuğunda gözlenir. Çoğunlukla işlem, belirli bir bileşiğin hem oksitlenmiş hem de indirgenmiş formlarını elde etmek için döngüsel bir şekilde gerçekleştirilir. Birbirleriyle etkileşimleri, ışık emisyonu ile temel duruma geçen uyarılmış moleküllerin oluşumuna yol açar.
Uygulamalı elektrokimya.
Elektrokimyanın birçok pratik uygulaması vardır. Pillere bağlanan birincil galvanik hücreler (tek kullanımlık elemanlar) yardımıyla kimyasal enerji, elektrik enerjisine dönüştürülür. İkincil akım kaynakları - piller - elektrik enerjisini depolar. Yakıt hücreleri, sürekli olarak reaktanların (hidrojen ve oksijen gibi) beslenmesi yoluyla elektrik üreten birincil güç kaynaklarıdır. Uzay istasyonlarında, elektrikli araçlarda ve elektronik cihazlarda kullanılan taşınabilir güç kaynaklarının ve pillerin temelinde bu ilkeler yatmaktadır.
Birçok maddenin büyük ölçekli üretimi elektrokimyasal senteze dayanmaktadır. Klor-alkali işleminde tuzlu suyun elektrolizi, daha sonra organik bileşikler ve polimerlerin yanı sıra kağıt hamuru ve kağıt endüstrisinde kullanılan klor ve alkali üretir. Elektroliz ürünleri, sodyum klorat, persülfat, sodyum permanganat gibi bileşiklerdir; Endüstriyel açıdan önemli metaller elektroekstraksiyonla elde edilir: alüminyum, magnezyum, lityum, sodyum ve titanyum. Erimiş tuzların elektrolit olarak kullanılması daha iyidir, çünkü bu durumda sulu çözeltilerin aksine, metallerin indirgenmesi hidrojenin salınması nedeniyle karmaşık değildir. Flor, erimiş tuzdaki elektroliz yoluyla üretilir. Elektrokimyasal işlemler bazı organik bileşiklerin sentezinin temelini oluşturur; örneğin adiponitril (naylon sentezinde bir ara madde) akrilonitrilin hidrodimerizasyonuyla elde edilir.
Gümüş, altın, krom, pirinç, bronz ve diğer metaller ve alaşımların elektrokaplaması, çelik ürünleri korozyondan korumak, dekoratif amaçlar, elektronik endüstrisinde elektrik konnektörleri ve baskılı devre kartlarının imalatı için çeşitli nesneler üzerinde yaygın olarak uygulanmaktadır. Elektrokimyasal yöntemler, metal ve alaşımlardan yapılmış iş parçalarının, özellikle geleneksel mekanik yöntemlerle işlenemeyenlerin yüksek hassasiyetli boyutsal işlenmesinin yanı sıra karmaşık profillere sahip parçaların imalatı için kullanılır. Alüminyum ve titanyum gibi metallerin yüzeyi anodize edildiğinde koruyucu oksit filmler oluşur. Bu tür filmler, elektrolitik kapasitörlerin imalatında alüminyum, tantal ve niyobyumdan yapılmış iş parçalarının yüzeyinde ve bazen dekoratif amaçlarla oluşturulur.
Korozyon süreçlerine ve bu süreçleri yavaşlatan malzemelerin seçimine ilişkin çalışmalara temel oluşturmak için sıklıkla elektrokimyasal yöntemler kullanılır. Metal yapıların korozyonu, korunan yapıya harici bir kaynağın bağlandığı ve anot ve yapının oksidasyonunu önleyecek bir potansiyelde tutulduğu katodik koruma kullanılarak önlenebilir. Diğer elektrokimyasal proseslerin pratik uygulama olanakları araştırılmaktadır. Yani suyu arıtmak için elektroliz kullanılabilir. Çok umut verici bir yön, güneş enerjisinin fotokimyasal yöntemler kullanılarak dönüştürülmesidir. Çalışma prensibi elektrokemilüminesansa dayanan elektrokimyasal monitörler geliştirilmektedir. Elektrot reaksiyonları sonucunda elektrot yüzeyinin renginde meydana gelen geri dönüşümlü değişikliklere ilişkin çalışmadan da bahsedelim.
Edebiyat:
Agladze R.I. Uygulamalı elektrokimya. M. – L., 1975
İzmailov N.A. Çözeltilerin elektrokimyası. M., 1976
Elektrokimyada ölçüm yöntemleri, cilt. 1–2. M., 1977
Korita İ. İyonlar, elektrotlar, membranlar. M., 1983
Bagotsky V.S. Elektrokimyanın temelleri. M., 1988