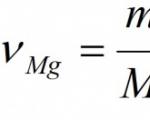Calcoli utilizzando equazioni chimiche. Calcoli utilizzando equazioni chimiche. Lavoro 6 calcoli utilizzando equazioni di reazioni chimiche
Stechiometria- rapporti quantitativi tra sostanze reagenti.
Se i reagenti entrano in un'interazione chimica in quantità rigorosamente definite e come risultato della reazione si formano sostanze, la cui quantità può essere calcolata, tali reazioni vengono chiamate stechiometrico.
Leggi della stechiometria:
Vengono chiamati i coefficienti nelle equazioni chimiche prima delle formule dei composti chimici stechiometrico.
Tutti i calcoli che utilizzano equazioni chimiche si basano sull'uso di coefficienti stechiometrici e sono associati alla ricerca delle quantità di una sostanza (numero di moli).
La quantità di sostanza nell'equazione di reazione (numero di moli) = il coefficiente davanti alla molecola corrispondente.
N / A=6,02×10 23 mol -1.
η - rapporto tra la massa effettiva del prodotto m pag ad un teoricamente possibile M t, espresso in frazioni di unità o in percentuale.
Se la resa dei prodotti di reazione non è indicata nella condizione, nei calcoli viene considerata pari al 100% (resa quantitativa).
Schema di calcolo utilizzando le equazioni delle reazioni chimiche:
- Scrivi un'equazione per una reazione chimica.
- Sopra le formule chimiche delle sostanze scrivi le quantità note e sconosciute con le unità di misura.
- Sotto le formule chimiche delle sostanze con note e incognite, annota i valori corrispondenti di queste quantità trovate dall'equazione di reazione.
- Componi e risolvi una proporzione.
Esempio. Calcolare la massa e la quantità di ossido di magnesio formatosi durante la combustione completa di 24 g di magnesio.
|
Dato: M(Mg) = 24 g Trovare: ν (MgO) M (MgO) |
Soluzione: 1. Creiamo un'equazione per una reazione chimica: 2Mg + O2 = 2MgO. 2. Sotto le formule delle sostanze indichiamo la quantità di sostanza (numero di moli) che corrisponde ai coefficienti stechiometrici: 2Mg + O2 = 2MgO 2 talpe 2 talpe 3. Determinare la massa molare del magnesio: Massa atomica relativa del magnesio Ar (Mg) = 24. Perché il valore della massa molare è quindi uguale alla massa atomica o molecolare relativa M (Mg)= 24 g/mol. 4. Utilizzando la massa della sostanza specificata nella condizione, calcoliamo la quantità della sostanza:
5. Sopra la formula chimica dell'ossido di magnesio MgO, la cui massa è sconosciuta, poniamo Xneo, sopra la formula del magnesio Mg scriviamo la sua massa molare: 1 talpa Xneo 2Mg + O2 = 2MgO 2 talpe 2 talpe
Secondo le regole per risolvere le proporzioni:
Quantità di ossido di magnesio ν (MgO)= 1 mol. 7. Calcola la massa molare dell'ossido di magnesio: M (Mg)=24 g/mol, M(O)=16 g/mol. M(MgO)= 24 + 16 = 40 g/mol. Calcoliamo la massa dell'ossido di magnesio: m (MgO) = ν (MgO) × M (MgO) = 1 mol × 40 g/mol = 40 g. Risposta: ν (MgO) = 1 mol; m(MgO) = 40 g. |
Qualunque cosa studi, tu
studi per te stesso.
Petronio
Obiettivi della lezione:
- introdurre gli studenti ai metodi di base per risolvere i problemi utilizzando le equazioni chimiche:
- trovare la quantità, massa e volume dei prodotti di reazione dalla quantità, massa o volume delle sostanze di partenza,
- continuare a sviluppare abilità nel lavorare con il testo di un problema, la capacità di scegliere razionalmente un metodo per risolvere un problema educativo e la capacità di comporre equazioni di reazioni chimiche.
- sviluppare la capacità di analizzare, confrontare, evidenziare la cosa principale, elaborare un piano d'azione e trarre conclusioni.
- coltivare la tolleranza verso gli altri, l’indipendenza nel processo decisionale e la capacità di valutare oggettivamente i risultati del proprio lavoro.
Forme di lavoro: frontale, individuale, di coppia, di gruppo.
Tipologia di lezione: combinata con l'uso delle ICT
I Momento organizzativo.
Ciao ragazzi. Oggi impareremo come risolvere i problemi utilizzando le equazioni delle reazioni chimiche. Diapositiva 1 (vedi presentazione).
Obiettivi della lezione Diapositiva 2.
II.Aggiornamento di conoscenze, competenze e abilità.
La chimica è una scienza molto interessante e allo stesso tempo complessa. Per conoscere e comprendere la chimica non è necessario solo assimilare la materia, ma anche essere in grado di applicare le conoscenze acquisite. Hai imparato quali segni indicano il verificarsi di reazioni chimiche, hai imparato a scrivere equazioni per le reazioni chimiche. Spero che tu abbia una buona conoscenza di questi argomenti e che tu possa rispondere alle mie domande senza difficoltà.
Quale fenomeno non è un segno di trasformazioni chimiche:
a) l'aspetto del sedimento; c) variazione di volume;
b) rilascio di gas; d) la comparsa di un odore. Diapositiva 3
Si prega di indicare in numeri:
a) equazioni delle reazioni composte
b) equazioni delle reazioni di sostituzione
c) equazioni delle reazioni di decomposizione Diapositiva 4
Per imparare a risolvere i problemi, è necessario creare un algoritmo di azioni, ad es. determinare la sequenza delle azioni.
Algoritmo per calcoli tramite equazioni chimiche (sul banco di ogni studente)
5. Scrivi la risposta.
Iniziamo a risolvere i problemi utilizzando un algoritmo
Calcolo della massa di una sostanza dalla massa nota di un'altra sostanza che partecipa alla reazione
Calcolare la massa di ossigeno rilasciata a seguito della decomposizione
porzioni d'acqua del peso di 9 g.
Troviamo la massa molare di acqua e ossigeno:
M(H2O) = 18 g/mol
M(O2) = 32 g/mol Diapositiva 6
Scriviamo l'equazione della reazione chimica:
2H2O = 2H2 + O2
Sopra la formula nell'equazione di reazione scriviamo ciò che abbiamo trovato
il valore della quantità di una sostanza e sotto le formule delle sostanze -
visualizzati i rapporti stechiometrici
equazione chimica
0,5 mol x mol
2H2O = 2H2 + O2
2mol 1mol
Calcoliamo la quantità di sostanza di cui vogliamo trovare la massa.
Per fare ciò, creiamo una proporzione
0,5 mol = luppolo
2mol 1mol
dove x = 0,25 mol Diapositiva 7
Pertanto, n(O2) = 0,25 mol
Trova la massa della sostanza da calcolare
m(O2)= n(O2)*M(O2)
m(O2) = 0,25 mol 32 g/mol = 8 g
Scriviamo la risposta
Risposta: m(O2) = 8 g Diapositiva 8
Calcolare il volume di una sostanza dalla massa nota di un'altra sostanza che partecipa alla reazione
Calcolare il volume di ossigeno (n.) rilasciato a seguito della decomposizione di una porzione di acqua del peso di 9 g.

V(0 2)=?l(n.s.)
M(H2O) = 18 g/mol
Vm=22,4 l/mol Diapositiva 9
Scriviamo l'equazione di reazione. Sistemiamo i coefficienti
2H2O = 2H2 + O2
Sopra la formula nell'equazione di reazione scriviamo il valore trovato della quantità della sostanza e sotto le formule delle sostanze - i rapporti stechiometrici visualizzati dall'equazione chimica
0,5 mol - x mol
2H2O = 2H2 + O2 Diapositiva10
2mol - 1mol
Calcoliamo la quantità di sostanza di cui vogliamo trovare la massa. Per fare ciò, creiamo una proporzione
![]()
dove x = 0,25 mol
Troviamo il volume della sostanza che deve essere calcolato
V(0 2)=n(0 2) Vm
V(O2) = 0,25 mol 22,4 l/mol = 5,6 l (n.)
Risposta: 5,6 l Diapositiva 11
III.Consolidamento del materiale studiato.
Compiti per una soluzione indipendente:
1. Riducendo gli ossidi Fe 2 O 3 e SnO 2 con carbone, si sono ottenuti 20 g di Fe e Sn. Quanti grammi di ciascun ossido sono stati prelevati?
2.In tal caso si forma più acqua:
a) quando si riducono 10 g di ossido di rame (I) (Cu 2 O) con idrogeno o
b) quando si riducono 10 g di ossido di rame(II) (CuO) con idrogeno? Diapositiva 12
Controlliamo la soluzione al problema 1

M(Fe2O3)=160 g/mol
M(Fe)=56g/mol, ![]()
m(Fe2O3)=, m(Fe2O3)= 0,18*160=28,6g
Risposta: 28,6 g
Diapositiva 13
Controlliamo la soluzione al problema 2

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mol,
n(H2O)=0,07 mol
m(H2O) = 0,07 mol*18 g/mol = 1,26 g
Diapositiva 14
CuO + H2 = Cu + H2O
n(CuO) = m/ M(CuO)
n(CuO) = 10 g/ 80 g/mol = 0,125 mol
0,125mol di luppolo
CuO + H2 = Cu + H2O
1 mol 1 mol
![]()
x mol = 0,125 mol, n(H 2 O) = 0,125 mol
m(H2O) = n*M (H2O);
m(H2O) = 0,125mol*18g/mol=2,25g
Risposta: 2,25 g Diapositiva 15
Compiti a casa: studiare il materiale del libro di testo p. 45-47, risolvi il problema
Qual è la massa dell'ossido di calcio e qual è il volume dell'anidride carbonica (n.s.)
si può ottenere decomponendo carbonato di calcio del peso di 250 g?
CaCO3 = CaO+CO Diapositiva 16.
Letteratura
1. Gabrielyan O.S. Programma del corso di chimica per le classi 8-11 negli istituti di istruzione generale. M. Otarda 2006
2. Gabrielyan O.S. Chimica. 8 ° grado. Libro di testo per gli istituti di istruzione generale. Otarda. M.2005
3. Gorbuntsova S.V. Prove sulle principali sezioni del percorso scolastico. Classi 8a - 9. VAKO, Mosca, 2006.
4. Gorkovenko M.Yu.Sviluppi della lezione in chimica. Ai libri di testo di O.S. Gabrielyan, L.S. Guzey, V.V. Sorokin, R.P. Surovtseva e G.E. Rudzitis, F.G. Feldman. Classe 8. VAKO, Mosca, 2004.
5. Gabrielyan O.S. Chimica. Grado 8: test e test. – M.: Otarda, 2003.
6. Radetsky A.M., Gorshkova V.P. Materiale didattico sulla chimica per le classi 8-9: un manuale per gli insegnanti. – M.: Educazione, 2000
Applicazione.
Calcoli utilizzando equazioni chimiche
Algoritmo delle azioni.
Per risolvere un problema di calcolo in chimica, puoi utilizzare il seguente algoritmo: esegui cinque passaggi:
1. Scrivi un'equazione per una reazione chimica.
2. Sopra le formule delle sostanze scrivere le quantità note e sconosciute con le corrispondenti unità di misura (solo per sostanze pure, senza impurità). Se, in base alle condizioni del problema, le sostanze contenenti impurità entrano in reazione, è necessario prima determinare il contenuto della sostanza pura.
3. Sotto le formule delle sostanze con note e incognite, annota i valori corrispondenti di queste quantità trovate dall'equazione di reazione.
4. Componi e risolvi una proporzione.
5. Scrivi la risposta.
La relazione tra alcune quantità fisiche e chimiche e le loro unità
Massa (m): g; kg; mg
Quantità di sostanze (n): mole; kmol; mmol
Massa molare (M): g/mol; kg/kmol; mg/mmol
Volume (V): l; m3/kmol; ml
Volume molare (Vm): l/mol; m3/kmol; ml/mmol
Numero di particelle (N): 6 1023 (numero di Avagadro – N A); 6 1026 ; 6 1020
La lezione è dedicata alla continuazione dello studio dell'argomento "Equazione di una reazione chimica". La lezione discute i calcoli più semplici utilizzando l'equazione di una reazione chimica, relativa al rapporto tra le quantità di sostanze che partecipano alla reazione.
Argomento: idee chimiche iniziali
Lezione: Equazione della reazione chimica
1. Il rapporto tra le quantità di sostanze che partecipano alla reazione
I coefficienti nell'equazione di reazione mostrano non solo il numero di molecole di ciascuna sostanza, ma anche il rapporto tra le quantità di sostanze che partecipano alla reazione. Pertanto, secondo l'equazione di reazione: 2H2 + O2 = 2H2O - si può sostenere che per formare una certa quantità di acqua (ad esempio 2 mol), lo stesso numero di moli della sostanza semplice idrogeno (2 mol) e metà quante moli della sostanza semplice ossigeno (1 mol) sono necessarie). Diamo esempi di tali calcoli.
2. Compito 1
COMPITO 1. Determiniamo la quantità di sostanza ossigeno formata a seguito della decomposizione di 4 moli di acqua.
ALGORITMO per la risoluzione del problema:
1. Annota l'equazione di reazione
2. Componi una proporzione determinando le quantità di sostanze secondo l'equazione di reazione e secondo le condizioni del problema (designa la quantità sconosciuta della sostanza come x mole).
3. Crea un'equazione (dalla proporzione).
4. Risolvi l'equazione, trova x.
Riso. 1. Formulazione di una breve condizione e soluzione del problema 1
3. Compito 2COMPITO 2. Quale quantità di ossigeno è necessaria per bruciare completamente 3 moli di rame?Usiamo un algoritmo per risolvere i problemi utilizzando l'equazione di una reazione chimica.

Riso. 2. Formulazione di una breve condizione e soluzione del problema 2.
Studia attentamente gli algoritmi e scrivili su un quaderno, risolvi tu stesso i problemi proposti
IO. Utilizzando l'algoritmo, risolvi tu stesso i seguenti problemi:
1. Calcolare la quantità di sostanza ossido di alluminio formata come risultato dell'interazione dell'alluminio con una quantità di 0,27 mol di sostanza con una quantità sufficiente di ossigeno (4Al+3O 2 =2Al2O3).
2. Calcolare la quantità di sostanza di ossido di sodio formata a seguito dell'interazione del sodio con una quantità di sostanza di 2,3 moli con una quantità sufficiente di ossigeno(4Na+O2 =2Na2O).
Algoritmo n. 1
Calcolare la quantità di una sostanza da una quantità nota della sostanza coinvolta in una reazione.
Esempio. Calcola la quantità di ossigeno rilasciata a seguito della decomposizione dell'acqua con una quantità di sostanza di 6 mol.



II. Utilizzando l'algoritmo, risolvi tu stesso i seguenti problemi:
1. Calcolare la massa di zolfo necessaria per ottenere l'ossido di zolfo (IV) con una quantità di sostanza di 4 mol (S + O 2
=SO2).
2. Calcolare la massa di litio necessaria per ottenere cloruro di litio con una quantità di sostanza di 0,6 mol (2Li+Cl2 = 2LiCl).
Algoritmo n. 2
Calcolo della massa di una sostanza a partire da una quantità nota di un'altra sostanza coinvolta in una reazione.
Esempio: calcolare la massa di alluminio necessaria per ottenere ossido di alluminio con una quantità di sostanza di 8 mol.



III. Utilizzando l'algoritmo, risolvi tu stesso i seguenti problemi:
1. Calcolare la quantità di solfuro di sodio se lo zolfo del peso di 12,8 g (2Na+S=Na2S) reagisce con il sodio.
2. Calcolare la quantità di sostanza di rame formata se l'ossido di rame (II) del peso di 64 g reagisce con l'idrogeno (CuO + H2 = Cu + H2 O).
Studia attentamente l'algoritmo e scrivilo sul tuo quaderno.
Algoritmo n. 3
Calcolare la quantità di una sostanza dalla massa nota di un'altra sostanza coinvolta in una reazione.
Esempio. Calcolare la quantità di ossido di rame (I) se il rame del peso di 19,2 g reagisce con l'ossigeno.



Studia attentamente l'algoritmo e scrivilo sul tuo quaderno.
IV. Utilizzando l'algoritmo, risolvi tu stesso i seguenti problemi:
1. Calcola la massa di ossigeno necessaria per reagire con il ferro che pesa 112 g
(3Fe + 4O2 =Fe3 O4).
Algoritmo n. 4
Calcolo della massa di una sostanza dalla massa nota di un'altra sostanza che partecipa alla reazione
Esempio. Calcolare la massa di ossigeno necessaria per la combustione del fosforo, del peso di 0,31 g.



COMPITI PER UNA SOLUZIONE INDIPENDENTE
1. Calcolare la quantità di sostanza ossido di alluminio formata come risultato dell'interazione dell'alluminio con una quantità di sostanza di 0,27 moli con una quantità sufficiente di ossigeno (4Al + 3O2 = 2Al2 O3).
2. Calcolare la quantità di sostanza di ossido di sodio formata come risultato dell'interazione del sodio con una quantità di sostanza di 2,3 moli con una quantità sufficiente di ossigeno (4Na + O2 = 2Na2 O).
3. Calcolare la massa di zolfo necessaria per ottenere l'ossido di zolfo (IV) con una quantità di sostanza di 4 mol (S+O2 =SO2).
4. Calcolare la massa di litio necessaria per ottenere cloruro di litio con una quantità di sostanza di 0,6 mol (2Li+Cl2 = 2LiCl).
5. Calcolare la quantità di solfuro di sodio se lo zolfo del peso di 12,8 g (2Na+S=Na2S) reagisce con il sodio.
6. Calcolare la quantità di sostanza di rame formata se l'ossido di rame (II) del peso di 64 g reagisce con l'idrogeno (CuO + H2 = Cu + H2 O).
ESERCIZI
Simulatore n. 1 - Analisi dell'equazione della reazione chimica
Simulatore n. 6 - Calcoli stechiometrici
Riepilogo della lezione “Calcoli utilizzando equazioni chimiche”
1. Controllo dei compiti
Come compito a casa ti è stato chiesto di inserire i coefficienti nelle equazioni di reazione.Puoi vedere il lavoro svolto durante la pausa. Ci saranno sicuramente degli errori.Ha funzionato tutto, qualcuno ha qualche domanda?Lascia che parlino della loro esperienza domestica.
2. Annuncio dell'argomento e aggiornamento delle conoscenze
L'argomento della lezione di oggi sono i calcoli utilizzando equazioni chimiche. Per prima cosa ricordiamo tutto ciò che può esserci utile oggi. Abbiamo già incontrato le equazioni chimiche in precedenti lavori di laboratorio, nei compiti a casa e anche prima nell'argomento dei composti binari. Ricordiamo la definizione dell'equazione di una reazione chimica.
(questa è una notazione convenzionale di una reazione chimica che utilizza formule e coefficienti chimici.)
Sorprendente.
Quando si producono composti, è necessario sapere quanto materiale di partenza utilizzare per ottenere la massa richiesta del prodotto di reazione. Per fare ciò, crea un'equazione per la reazione chimica in corso e durante il calcolo le masse tengono conto delle masse molari sostanze e durante il calcolo volumi di gas tener conto del valorevolume molare gas
Chi ricorda il valore del volume molare dei gas in condizioni normali? (22,4 l/mol)
E quali sono queste condizioni normali? (pressione 101,3 kPa e temperatura 0 oC)
Cioè, in queste condizioni, 1 mole di QUALSIASI gas occupa un volume di 22,4 litri.
In realtà, per risolvere i problemi, dobbiamo ricordare diverse quantità:
Massa molare – M (g/mol)
Quantità di sostanza – n (mol)
Volume – V (l)
È meglio così: ricordati che la massa molare è numericamente uguale alla massa atomica relativa o alla massa molecolare relativa di una sostanza. Per fare ciò è necessario utilizzare la tavola periodica, dove in fondo ad ogni “cella” è indicata la relativa massa atomica. Senza dimenticare le regole di arrotondamento, nei calcoli utilizziamo l'intero valore di questa massa.
La chimica è una scienza molto chiara, logica e coerente, quindi sarà conveniente utilizzare l'ALGORITMO fornito nel libro di testo per risolvere i problemi. Questa è una sequenza universale di azioni che viene utilizzata per risolvere qualsiasi problema di questo tipo.
Per favore apri il libro di testo e conosciamo tutti l'algoritmo.
(qui apriamo tutti insieme i libri di testo, una persona, forse io, legge l'algoritmo, gli altri seguono per capire cosa devono fare adesso)
Sembra esteso, ma spero che non sia troppo confuso. Proviamo a capirlo con un esempio.
Compito 1. Per produrre idrogeno, l'alluminio viene sciolto nell'acido solforico: 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 (Il primo punto del nostro algoritmo). Per la reazione abbiamo prelevato 10,8 g di alluminio. Calcolare la massa di acido solforico consumato.
Dato: m(Al) = 10,8 g | Soluzione: m=10,8 gm - ? 2Al + 3H2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 M=27 g/mol M=98 g/mol Qui possiamo menzionare che infatti nella reazione non entrano 2 atomi di alluminio e 3 molecole di acido, ma una parte di atomi di alluminio e una parte di molecole di acido. Questa porzione in chimica è chiamata la parola breve “talpa”. n=2 mol n=3 mol m = M∙ n m=54 gm=294 g Calcolo in proporzione: |
||||
m(H2SO4) - ? |
|||||
10,8 g | |||||
54 g | 294 g | ||||
10,8 g ∙ 294 g | |||||
54 g | |||||
X = 58,8 g Risposta: m (H 2 SO 4 ) = 58,8 g |
|||||
Questa è tutta la soluzione al problema. Hai domande? Parliamo ancora una volta della soluzione:
Inventato un'equazione
Sopra le sostanze abbiamo firmato ciò che SAPPIAMO e ciò che VOGLIAMO TROVARE
Sotto le formule abbiamo annotato la massa molare, la quantità di sostanza estechiometrico massa della sostanza ( è meglio indicare “massa secondo la tavola periodica”)
Composto da una proporzione
Risolto la proporzione
Registrato la risposta
Risolviamo un problema simile, ma con sostanze gassose (qui non useremo la massa molare della sostanza, ma cosa?...il volume molare)
Problema 2. 25 grammi lo zinco viene sciolto in acido cloridrico, durante la reazione chimica viene rilasciato un gas: idrogeno. Calcolare il volume di idrogeno rilasciato.
Dato: m(Zn) = 10,8 g | Soluzione: m=25 g V - ? Zn + 2HCl → ZnCl2 + H2 M=65 g/mol V m=22,4 l/mol n=1 mol n=1 mol m=65 gV=22,4 l Calcolo in proporzione: |
||||
m(HCl) - ? |
|||||
25 g | |||||
65 g | 22,4 l | ||||
25 g ∙ 22,4 l | |||||
65 g | |||||
X = 8,61 litri Risposta: V(H2) = 8,61 l |
|||||
Controlliamo come hai padroneggiato il materiale. Utilizzando lo stesso algoritmo, risolvi il problema:
NON È UN FATTO CHE AVRAI SUCCESSO:
Quando reagisci con utilizzando gli ossidi di carbone Fe2O3 (prima opzione) e SnO2 (seconda opzione) hanno ricevuto ciascuno 20 g di Fe e Sn. Quanti grammi di ciascun ossido sono stati prelevati?
Tieni presente che ora stiamo calcolando la massa delle sostanze di partenza, non dei prodotti di reazione)
(lasciamo che tutti lo risolvano su un quaderno e chiediamo loro selettivamente di mostrare la soluzione, scriveremo l'equazione tutti insieme alla lavagna e ognuno proverà a risolverla da solo)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 g
Compiti a casa: studiare il materiale del libro di testo p. 146-150, risolvere il problema
Qual è la massa dell'ossido di calcio e qual è il volume dell'anidride carbonica (n.s.)
si può ottenere decomponendo carbonato di calcio del peso di 250 g?DOVREBBE ESSERE DATO AGLI SCOLARIEQUAZIONE PRONTAPER COMPLETARE QUESTO COMPITO
Sviluppo della lezione metodologica (2 ore)
Calcoli utilizzando equazioni chimiche
Khapugina Polina Ivanovna,
insegnante di chimica GBOU scuola secondaria 277
Distretto Kirovsky di San Pietroburgo
Obiettivi della lezione: Insegna agli alunni di terza media a eseguire calcoli utilizzando le equazioni chimiche: trova la quantità, la massa e il volume dei prodotti di reazione dalla quantità, il volume e la massa delle sostanze di partenza.
Durante le lezioni:
Prima di passare allo studio di un nuovo argomento, è necessario ricordare le quantità e le formule che già conosci. Ricorda i tipi di reazioni chimiche. E sai già come creare equazioni chimiche e renderle uguali. Mettiamo alla prova le tue conoscenze effettuando le seguenti operazioni: test di assestamento.(il contenuto del test è visionabile sul mio sito personale nella cartella files e foto)
Spiegazione dell'insegnante:
1. Prima di imparare a fare calcoli utilizzando le equazioni chimiche, è necessario ricordare ancora una volta le formule che già conosciamo per trovare la quantità di una sostanza, massa e volume delle sostanze; in un solo passaggio puoi metterti alla prova dopo il lavoro svolto . Per fare ciò, passiamo alla seguente presentazione, che aiuterà a ripristinare la nostra conoscenza in memoria. Presentazione n. 1.
Annota sul tuo quaderno le formule che già conosci:
n- quantità di sostanza (mol)
m- massa della sostanza (g)
M - massa molare (g/mol)
V - volume del gas (l)
V m - volume molare = 22,4 l/mol
n = m/M; m = n.M
n = V/Vm; V = n.V m
2. Ora, dobbiamo capire che un'equazione chimica mostra non solo il lato qualitativo (trasformazione delle sostanze) del processo, ma anche il lato quantitativo di esso. Per fare ciò, passiamo a quanto segue Presentazioni#2(la presentazione è visionabile sul mio sito personale nella cartella files e foto)
Scrivi nel tuo taccuino:
Il coefficiente nell'equazione di reazione indica il numero di particelle e il numero di particelle a sua volta determina il numero di moli!
2H₂ +O₂ = 2 ore₂ DI
Numero di particelle 2 molecole 1 molecole 2 molecole
Quantità ↓ ↓ ↓
sostanze,N2 mole 1 mole 2 mole
2 Fe(OH)3 = Fe2 O3 + 3 H2 O
↓ ↓ ↓
N= 2mol 1mol 3mol
3. La fase successiva che dobbiamo esaminare è la capacità di creare una proporzione utilizzando l'equazione di reazione, nonché di risolverla. Per fare ciò, passiamo a quanto segue Presentazioni 3.(la presentazione è visionabile sul mio sito personale nella cartella files e foto)
Scrivi nel tuo taccuino:
Conosciuto dalla condizione: 2 mol X mol (numeratore)
4P+5O₂ = 2P₂ O₅
Conosciuto dall'equazione: 4 mol 5 mol 2 mol (denominatore)
Componiamo e risolviamo la proporzione:
2 mol X mol
_______ = _______
4mol 2mol
X mole = 2 mol. 2 mol= 1 mol
4 mol
X =N(P₂ O₅ )= 1 mol
4. Passiamo alla risoluzione dei problemi utilizzando le equazioni delle reazioni chimiche. Per risolvere un problema di calcolo in chimica, è necessario utilizzare il seguente algoritmo: eseguire cinque passaggi. Presentazione 4. (la presentazione è visionabile sul mio sito personale nella cartella files e foto) Libro di testo p.101
Nel tuo quaderno:
Agli studenti viene fornito un algoritmo di soluzione già pronto da incollare sui loro quaderni.
Algoritmo per risolvere problemi di calcolo utilizzando le equazioni delle reazioni chimiche:
1. Crea un'equazione per una reazione chimica (ovvero, assicurati di impostare i coefficienti!)
2. Sopra le formule corrispondenti nell'equazione, annotare i dati quantitativi sulle sostanze con unità di misura note o che possono essere calcolate in base alle condizioni del problema e il valore desiderato X anche con unità di misura.
3. Sotto queste formule, annotare le corrispondenti quantità quantitative specificate dall'equazione stessa, anche con unità di misura.
4. Componi e risolvi una proporzione.
5. Formalizzare la risposta.
5. Risolviamo il problema.
Calcolare la massa d'acqua che si forma a seguito dell'interazione di 0,5 moli di ossido di alluminio con acido solforico quando riscaldati.
Leggi il problema.
Annotare la dichiarazione del problema. (Dato, trova.)
Nel tuo quaderno: (gli studenti scrivono la soluzione secondo le spiegazioni dell’insegnante secondo Presentazioni 5 ) (la presentazione è visionabile sul mio sito personale nella cartella files e foto)
Dato:
n(Al₂O₃)=0,5 mol
_________________
Trovare:
Soluzione:
N=0,5 mol X mol
Al₂ O₃ +3 H₂ COSÌ₄ = Al₂ (COSÌ₄ ) ₃ +3 H₂ O
N= 1 mol 3 mol
M = 102 g/mol 18 g/mol
Calcolo del peso molecolare:
Ìr(Al₂O₃)= 2,27+3,16= 54+48=102
Ìr(H₂O)= 2,1+16=18
Componi e risolvi una proporzione.
0,5 moli = Talpa X
1 mole 3 mole
X mole =N(H₂ O) = 0,5 moli. 3 moli= 1,5mol
1 talpa
Troviamo la massa dell'acqua.
M(H₂ O) = N(H₂ O) . M(H₂ O)
M(H₂ O) = 1,5 mol.18 g/mol = 27 g
Risposta:M(H₂ O)=27 g
6. Risolvi i problemi da solo.
Due studenti vengono chiamati in commissione per la valutazione.
1. Determinare il volume di cloro (n.) necessario per ottenere 634 g di cloruro di alluminio secondo l'equazione: 2Al + 3Cl 2 = 2AlCl 3. Risposta: 159,6 l
2. Calcolare la quantità di sostanza e massa di litio necessaria per la reazione con ossigeno del peso di 128 g secondo l'equazione: 4Li + O 2 = 2Li 2 O Risposta: 16 mol, 112 g
7. Compiti a casa.
Compito.
Trova la massa dell'ossido di zinco, che si forma dall'interazione di 13 g di zinco con l'ossigeno.