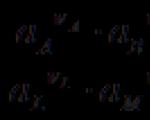Elektrochemija. Galvaninis elementas Elektrocheminis elementas
Elektrocheminiai elementai. Elektrovaros jėga. Galvaninio elemento termodinamika. EMF matavimas.
Elektrinis dvigubas sluoksnis, atsiradimo mechanizmas ir sandara.
GALVANINIAI ELEMENTAI. EMF.
Kai elektros srovė praeina per elektrolitą, elektrodų paviršiuje vyksta elektrocheminės reakcijos. Elektrocheminių reakcijų atsiradimą gali sukelti išorinis srovės šaltinis. Galimas ir priešingas reiškinys: elektrocheminės reakcijos, vykstančios ant dviejų į elektrolitą panardintų elektrodų, sukuria elektros srovę, o reakcijos vyksta tik uždaroje grandinėje (srovei tekant).
Elektrocheminis (arba galvaninis) elementas yra prietaisas elektros srovei gaminti per elektrochemines reakcijas. Paprasčiausias elektrocheminis elementas susideda iš dviejų metalinių elektrodų (pirmojo tipo laidininkų), nuleistų į elektrolitą (antrosios rūšies laidininką) ir sujungtų vienas su kitu metaliniu kontaktu. Keletas elektrocheminių elementų, sujungtų nuosekliai elektrocheminė grandinė .
Svarbiausia kiekybinė elektrocheminio elemento charakteristika yra elektrovaros jėga(EMF, E), kuris yra lygus potencialų skirtumui teisingai atidarytas elementas (kuriame pirmosios rūšies laidininkai iš tos pačios medžiagos yra prijungti prie galutinių elemento elektrodų).
Jei elektros srovei tekant skirtingomis kryptimis, elektrodo paviršiuje vyksta ta pati reakcija, bet priešingomis kryptimis, tai tokie elektrodai, kaip ir iš jų sudarytas elementas ar grandinė, vadinami grįžtamasis . Grįžtamųjų elementų emf yra jų termodinaminė savybė, t.y. priklauso tik nuo T, P, medžiagų, sudarančių elektrodus ir tirpalus, pobūdžio ir šių tirpalų koncentracijos. Grįžtamojo elemento pavyzdys yra Daniel-Jacobi elementas :
(-) Cu çZn çZnSO 4 ççCuSO 4 çCu (+)
kuriame kiekvienas elektrodas yra grįžtamasis. Kai elementas veikia, vyksta šios reakcijos: Zn ® Zn 2+ + 2 e, Cu 2+ + 2 e® Cu. Kai iš išorinio šaltinio perduodama be galo mažos stiprio srovė, elektroduose vyksta atvirkštinės reakcijos.
Negrįžtamo elemento pavyzdys yra Volta elementas :
(-) Zn ç H 2 SO 4 ç Cu (+)
Kai elementas veikia, vyksta šios reakcijos: Zn ® Zn 2+ + 2 e, 2H + + 2 e® H 2 . Praleidžiant srovę iš išorinio šaltinio, elektrodų reakcijos bus: 2H + + 2 e® H 2 , Cu ® Cu 2+ + 2 e .
Elektrocheminio elemento EML yra teigiama reikšmė, nes tai atitinka tam tikrą spontanišką procesą, kuris sukuria teigiamą darbą. Atvirkštinis procesas, kuris negali vykti savarankiškai, atitiktų neigiamą EML. Sudarant elektrocheminių elementų grandinę, procesas viename iš elementų gali būti nukreiptas taip, kad jį lydėtų darbas iš išorės (nesavaiminis procesas), tam naudojant kito grandinės elemento darbą. kuriame įvyksta savaiminis procesas. Bendra bet kurios grandinės emf yra lygi teigiamų ir neigiamų dydžių algebrinei sumai. Todėl labai svarbu rašant grandinės schemą atsižvelgti į EML požymius, vadovaujantis priimtomis taisyklėmis.
Elektrocheminės grandinės emf laikomas teigiamu, jei rašant grandinę dešinysis elektrodas įkraunamas teigiamai kairiojo atžvilgiu (grandinės veikimo metu katijonai tirpale praeina nuo elektrodo, užrašyto kairėje, link elektrodo, parašyto dešinėje, o elektronai juda ta pati kryptis išorinėje grandinėje). Pavyzdys.
GALVANINĖS LĄSTELĖS TERMODINAMIKA .
Tegul reakcija vyksta grįžtamai ir izotermiškai elektrocheminėje sistemoje:
n A A + n B B + ... ± nF Û n L L + n M M + ... ±
Elemento generuojama elektros energija yra lygi viso proceso naudingajam darbui A¢. Naudingas grįžtamojo proceso darbas A¢ yra maksimalus ir esant P,T = const yra lygus sistemos izobarinio potencialo sumažėjimui:
DG P, T = nFE P, T
E P , T - grįžtamasis sistemos EMF.
E P,T = -DG P,T / nF , E V,T = -DF V,T / nF
Taigi, išmatavus elemento EML ir jo temperatūros koeficientą, galima rasti DG ir DS reikšmes visam procesui, vykstančiam galvaniniame elemente. Šis procesas yra spontaniškas, taigi ir DG< 0.
Naudodami Gibbso-Helmholtzo lygtį galime apskaičiuoti proceso entalpijos pokytį:
DH = DG - T = -nFE P + TnF
nFE P = -DH + nFT = + nFT
nFE V = -DU + nFT = + nFT
Iš lygčių matyti, kad ryšys tarp elektrocheminėje sistemoje grįžtamai generuojamos arba absorbuojamos elektros energijos ir joje vykstančios reakcijos šiluminio efekto priklauso nuo emf temperatūros koeficiento ženklo ir dydžio. dE/ dT :
1. JeigudE / dT > 0 , tada nFE > (DG > DH) ir sistema į elektros energiją pavers ne tik šilumos kiekį, kuris atitinka šiluminį reakcijos efektą, bet ir papildomą šilumą - Peletier šiluma Q P = nFT dE/ dT pasiskolintas iš aplinkos. Adiabatinėmis sąlygomis (šilumos izoliacijos sąlygomis, kai neįmanoma keistis su aplinka), sistemos T mažėja. Sistemos aušinimas ypač pastebimas, jei dE/ dT > 0 < 0 (реакция эндотермична).
2. JeigudE / dT < 0 , tada nFE< (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. JeigudE / dT = 0 , tada DG = DH ir nFE = - sistemos grįžtamai pagaminama elektros energija yra lygi cheminės reakcijos šiluminiam efektui. Šis ryšys žinomas kaip Tomsono principas (taisyklė) .
Norint apskaičiuoti EML, lygtis gali būti perrašyta taip:
Naudojant lygtis, reikia atsiminti, kad jos galioja tik reversinėms elektrocheminėms sistemoms, todėl tiriant EML priklausomybę nuo T, būtina vengti naudoti elektrochemines sistemas su skysčio ribomis, nes ant jų atsirandantys difuzijos potencialai nėra pusiausvyros.
Elemento EML susiekime su elemente vykstančios reakcijos pusiausvyros konstanta. Cheminės reakcijos izotermų lygtis:
DG = RT ln K a - RT
E = - = ln K a -
Pirmasis dešinėje lygties pusėje esantis duotos P, T narys yra pastovi reikšmė; ją galima pažymėti E o. E o - standartinis elemento EML (elektrocheminė sistema) , t.y. EMF apskritai a i = 0.
E = E o + ln
 = E o + 2,303 lg
= E o + 2,303 lg 
Taigi elektrocheminės sistemos EML yra elektrocheminės reakcijos dalyvių veiklos funkcija. Aukščiau pateiktos lygtys leidžia apskaičiuoti DG ir K reikšmes A remiantis eksperimentinėmis E vertėmis ir, atvirkščiai, apskaičiuokite E, žinodami cheminės reakcijos termodinamines charakteristikas.
EMF MATAVIMAS .
Norint išmatuoti elektrocheminio elemento EML pusiausvyrinę (grįžtamąją) reikšmę, būtina, kad procesas vyktų be galo lėtai, t.y. kad elementas veiktų be galo maža srove. Šią sąlygą tenkina kompensavimo metodas, pagrįstas tuo, kad elementas nuosekliai jungiamas prieš išorinį potencialų skirtumą, o pastarasis parenkamas taip, kad grandinėje nebūtų srovės. Tada išorinio potencialo skirtumas yra lygus grandinės EMF.
Naudojant kompensavimo metodą, galite tiesiogiai išmatuoti EML vertę, tačiau tai yra gana sudėtinga operacija, todėl laboratorinėje praktikoje jie nori palyginti tiriamo elemento EML su vadinamojo standartinio (normalaus) EML. elementai, kurie kruopščiai matuojami esant skirtingam T. Šis lyginamasis metodas taip pat yra kompensacija.
Pagrindinis normalus elementas yra prisotintas Weston elementas .
(EMF matavimo grandinė – nepriklausomai).
ELEKTRODŲ RIBŲ STRUKTŪRA - SPRENDIMAS. DVIGUBAS ELEKTROS SLUOKSNIS .
Kai pirmosios rūšies laidininkas liečiasi su elektrolitu, a elektrinis dvigubas sluoksnis . Kaip pavyzdį apsvarstykite varinį elektrodą, panardintą į CuSO 4 tirpalą. Vario jonų cheminis potencialas metale esant tam tikram T gali būti laikomas pastoviu, o vario jonų cheminis potencialas tirpale priklauso nuo druskos koncentracijos; apskritai šie cheminiai potencialai nėra vienodi.
Tegul CuSO 4 koncentracija yra tokia, kad > Tada, panardinus metalą į tirpalą, dalis Cu 2+ jonų iš tirpalo dehidratuojama ir perkeliama į metalą, sukuriant teigiamą jo krūvį. Šis krūvis neleis tolesniam Cu 2+ jonų perkėlimui iš tirpalo į metalą ir prie elektrodo susidarys į jį pritrauktų SO 4 2- anijonų sluoksnis. Taip vadinamas elektrocheminė pusiausvyra , kai jonų cheminiai potencialai metale ir tirpale skirsis susidarančio dvigubo elektrinio sluoksnio (DEL) potencialų skirtumo dydžiu:
Elektrinio potencialo skirtumas ir cheminio potencialo skirtumas kompensuojami esant elektrocheminei pusiausvyrai.
Tegul CuSO 4 koncentracija būna tokia maža, kad< . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
Galima pasirinkti tokią elektrolito koncentraciją, kuriai esant metalo ir tirpalo jonų cheminiai potencialai yra vienodi. Tokios koncentracijos tirpalai vadinami nuliniai sprendimai . Panardinus metalą į nulinį tirpalą, elektrodo paviršiuje EDL neatsiranda, tačiau net ir šiuo atveju potencialų skirtumas tarp metalo ir tirpalo nėra lygus nuliui.
Pasak Nernsto, vienintelis elektrocheminio elemento EML šaltinis yra elektrodų paviršiuje esantis EML. Nernstas apibrėžė metalų potencialą nuliniame tirpale kaip absoliutų nulinį potencialą. A. N. Frumkino darbuose buvo parodyta, kad Nernsto idėjos yra neteisingos. Eksperimentiškai nustatyta, kad elemento, sudaryto iš dviejų skirtingų elektrodų, panardintų į nulinius tirpalus, EML labai skiriasi nuo nulio (galbūt daugiau nei 1 V). Metalo potencialas nuliniame tirpale, vadinamas nulinio įkrovimo potencialas , negali būti laikomas absoliučiu nuliniu potencialu.
KONDENSUOTO HELMHOLTZO DVIGUBO sluoksnio TEORIJA. Pirmąją kiekybinę DEL struktūros teoriją metalo ir tirpalo sąsajoje sukūrė Helmholtzas (1853). Pasak Helmholtzo, EDL galima palyginti su plokščiu kondensatoriumi, kurio viena iš plokščių sutampa su plokštuma, einančia per metalo paviršiaus krūvius, o kita su plokštuma, jungiančia tirpalo jonų krūvių centrus. traukiamas prie metalo paviršiaus elektrostatinių jėgų. Dvigubo sluoksnio storis l lygus jono spinduliui r. Pagal elektrinio neutralumo sąlygą jonų, pritraukiamų prie metalo paviršiaus, skaičius turi būti toks, kad jų krūviai kompensuotų metalo paviršinius krūvius, t.y.
Kondensuoto dvigubo sluoksnio teorija leidžia gauti EDL talpos vertes, kurios atitinka eksperimentą ir fiziškai tikėtiną EDL storį. Tačiau ji negali interpretuoti daugelio eksperimentinių dėsningumų: eksperimentiškai rastų elektrokinetinio potencialo (x potencialo) verčių ir jų priklausomybės nuo elektrolito koncentracijos, metalo paviršiaus krūvio ženklo pokyčio esant aktyviajai paviršiaus medžiagai. .
DIFUZINĖS DVIGUBO sluoksnio GUI TEORIJA- CHAPMAN. Helmholtzo teorijoje neatsižvelgiama į tai, kad DES savybės kinta priklausomai nuo elektrolito koncentracijos, o T. Gouy (1910) ir Chapman (1913) bandė susieti krūvio tankį DES su tirpalo sudėtimi. Jie atsižvelgė į tai, kad be elektrostatinių jėgų, atsirandančių tarp metalo ir jonų, jonus veikia ir terminio molekulinio judėjimo jėgos. Kai veikia šios dvi jėgos, jonai tirpale turi būti difuziškai pasiskirstę metalo paviršiaus atžvilgiu – tūrinio krūvio tankis mažėja didėjant atstumui nuo jo.
Gouy ir Chapman manė, kad jonai gali būti laikomi materialiais taškais, kurie neturi savo tūrio, bet turi krūvį, ir kad jų pasiskirstymas elektrodo krūvio lauke paklūsta Boltzmanno skirstiniui.
Gouy-Chapman teorija geriau nei Helmholtzo teorija sutampa su elektrokinetinių reiškinių dėsniais. Jei manytume, kad pradedant nuo tam tikro atstumo l 1 jonai nebėra tvirtai prijungti prie elektrodo paviršiaus santykiniam kietosios ir skystosios fazės judėjimui, tada potencialą, atitinkantį šį atstumą, galima laikyti x potencialu (x< j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
Taigi Gouy-Chapman teorija geriausiai pateisinama ten, kur Helmholtzo teorija pasirodo esanti netaikytina, ir, atvirkščiai, pastaroji suteikia geresnę konvergenciją su eksperimentu tais atvejais, kai pirmoji duoda neteisingus rezultatus. Vadinasi, DES struktūra turi atitikti tam tikrą Helmholtzo ir Gouy-Chapman pasiūlytų modelių derinį. Šią prielaidą padarė Sternas (1924) savo DEL adsorbcijos teorijoje.
STERN ADSORBCIJOS TEORIJA. Sternas manė, kad tam tikra jonų dalis išlieka šalia metalo ir elektrolito sąsajos, sudarydama Helmholtz arba kondensuotą dvisluoksnę plokštę, kurios storis atitinka vidutinį elektrolito jonų spindulį. Likę jonai, įtraukti į EDL, pasiskirsto difuziškai, palaipsniui mažėjant krūvio tankiui. Dėl difuzinės EDL dalies Sternas, kaip ir Gouy, nepaisė būdingų jonų dydžių. Be to, Sternas pasiūlė, kad tankioje EDL dalyje jonai sulaikomi ne tik dėl elektrostatinių jėgų, bet ir dėl specifinių adsorbcijos jėgų, t.y. ne Kulono kilmės jėgos. Todėl tirpaluose, kuriuose yra paviršinio aktyvumo jonų, jų skaičius tankioje EDL dalyje gali viršyti metalo paviršiaus krūvį tam tikru dydžiu, priklausomai nuo jonų savybių ir metalo krūvio. Taigi, pasak Sterno, reikėtų išskirti du DES modelius, iš kurių vienas yra susijęs su paviršinio neaktyvių elektrolitų tirpalais, o kitas su tirpalais, kuriuose yra specialiai adsorbuotų jonų.
Adsorbcijos teorijoje taip pat išsaugoma lygybė:
Q M = q L = q 1 + q 2
Krūvio tankis tirpalo pusėje q L susideda iš dviejų dalių: krūvio tankio Helmholtzo sluoksnyje q 1 ir krūvio tankio difuziniame sluoksnyje q 2 .
Sterno teorija leidžia apibrėžti x-potencialą kaip potencialo kritimą difuzinėje EDL dalyje, kur stiprus metalo ir jonų ryšys jau buvo prarastas. Taikant šį apibrėžimą, x potencialas neturėtų sutapti su Nersto potencialu, kaip pastebėta eksperimentiškai. Sterno teorija galėjo paaiškinti kieto kūno paviršiaus įkrovimą.
Esant be galo mažai koncentracijai, visi krūviai tirpale pasiskirsto difuziškai, o EDL struktūrą apibūdina Gouy-Chapman teorija. Priešingai, koncentruotuose sprendimuose DES struktūra artėja prie Helmholtzo pasiūlyto modelio. Vidutinių koncentracijų srityje, kur x dydis yra panašus į RT/F, jo priklausomybę nuo koncentracijos galima išreikšti apytikslėmis lygtimis:
teigiamoms x reikšmėms: x = B - ln Su
neigiamoms x reikšmėms: x = B¢ + ln Su
Sterno teorija pateikia kokybiškai teisingą DEL vaizdą. Talpos nustatymas naudojant Stern modelį atitinka patirtį tiek talpos verčių, tiek jos priklausomybės nuo elektrodo potencialo ir tirpalo koncentracijos požiūriu. Tačiau Sterno teorija nėra laisva nuo trūkumų. Tai apima tai, kad neįmanoma kiekybiškai aprašyti talpos kreivių, ypač tolstant nuo nulinio įkrovimo potencialo.
TOLESNIS DES STANDINGO TEORIJOS PLĖTRA. Buvo daug bandymų sukurti DES teoriją, kuri kiekybiškai atitiktų eksperimentinius duomenis (Rice, Frumkin ir kt., Bockris, Devanathan, Esin, Muller, Parsons, Ershler ir kt.). Plačiausiai priimtas modelis yra Grahamas (1947). Anot Graham, tirpale esanti DES danga susideda ne iš dviejų, o iš trijų dalių. Pirmoji, skaičiuojant nuo metalo paviršiaus, vadinama vidine Helmholco plokštuma; jame yra tik paviršinio aktyvumo jonai (plokštumos krūvis q 1) arba, jei jų tirpale nėra, tirpiklio molekulės (q 1 = 0); jo potencialas, susijęs su sprendimu, žymimas y 1. Kitas, pašalintas nuo metalo paviršiaus tokiu atstumu, iki kurio gali priartėti jonai (jų krūvio centrai), vadinama išorine Helmholco plokštuma; jo bendras krūvis yra q 2, o plokštumos potencialas yra y 2. Už išorinės Helmholtzo plokštumos yra difuzinis sluoksnis, kurio potencialas svyruoja nuo y 2 iki nulio ir kurio krūvio tankis sutampa su q 2 .
Grahamo modelis atspindi pagrindines metalo-elektrolito DES struktūros ypatybes ir charakteristikas. Tai leidžia apskaičiuoti bet kokios tam tikro elektrolito koncentracijos diferencines talpos kreives, jei yra bent vieno jo tirpalo eksperimentinė kreivė. Tačiau šis modelis neapima visų problemos aspektų.
Kai elektros srovė teka per tirpalą, srovės teka elektrodų paviršiumi. elektrocheminės reakcijos, kuriuos lydi elektronų srautas į elektrodą arba iš jo. Atvirkštiniuose procesuose elektrocheminės reakcijos, vykstančios pirmos ir antros rūšies laidininkų sąsajose, sukelia elektros srovės generavimą.
Elektrocheminiai procesai nuo įprastų cheminių reakcijų skiriasi daugybe savybių.
Cheminė reakcija galima tik tada, kai susiduria dalelės. Kai jie liečiasi, elektronams tampa įmanoma perkelti iš vienos dalelės į kitą. Ar toks perėjimas iš tikrųjų įvyks, priklauso nuo dalelių energijos ir jų tarpusavio orientacijos. Aktyvinimo energija priklauso nuo cheminės reakcijos pobūdžio, o joninėms reakcijoms ji paprastai yra maža. Elektronų perėjimo kelias yra labai trumpas, o tai taip pat yra cheminės reakcijos ypatybė. Dalelių susidūrimai gali įvykti bet kuriuose reakcijos erdvės taškuose skirtingose tarpusavio padėtyse, todėl elektroniniai perėjimai gali vykti savavališkomis kryptimis, t.y. Cheminio proceso ypatumai yra susidūrimų atsitiktinumas ir elektroninių perėjimų kryptingumo stoka. Dėl to cheminių reakcijų energetinis poveikis pirmiausia pasireiškia šilumos pavidalu (galimas ir nedidelis plėtimosi darbas).
Tam, kad cheminį virsmą atitinkantys energijos pokyčiai pasireikštų elektros energijos pavidalu, t.y. Kad elektrocheminis procesas vyktų, būtina keisti reakcijos sąlygas.
Elektros energija visada siejama su elektros srovės pratekėjimu, t.y. elektronų srautas tam tikra kryptimi. Todėl reakcija turi būti vykdoma taip, kad elektroniniai perėjimai nebūtų atsitiktiniai, o vyktų viena kryptimi, o jų kelias turi būti žymiai didesnis už atomo dydį. Todėl elektrocheminiuose procesuose elektronų perėjimas iš vieno dalyvio į kitą turi vykti dideliu atstumu, o tam būtinas erdvinis reakcijos dalyvių atskyrimas. Tačiau vien erdvinio atskyrimo nepakanka, nes dėl to reakcija tiesiog sustos.
Norint atlikti elektrocheminį procesą, būtinos papildomos sąlygos: elektronai turi būti atplėšti nuo kai kurių dalelių ir vienu bendru būdu perkelti į kitas. Tai galima pasiekti pakeičiant tiesioginį reakcijos dalyvių kontaktą su dviem metalais, sujungtais vienas su kitu metaliniu laidininku. Tam, kad elektronų srautas būtų nenutrūkstamas, būtina užtikrinti ir elektros srovės praėjimą per reakcijos erdvę, kurią dažniausiai atlieka patys elektrocheminės reakcijos dalyviai (jei jie yra jonizuotoje būsenoje) arba specialiais junginiais, turinčiais didelį joninį laidumą.
Vadinamas prietaisas, gaminantis elektros energiją per elektrochemines reakcijas elektrocheminis(arba galvaninis)elementas. Paprasčiausias elektrocheminis elementas susideda iš dviejų metalinių elektrodų (pirmojo tipo laidininkų), panardintų į elektrolito tirpalą (antrojo tipo laidininkas).
Jeigu elektros srovei tekant skirtingomis kryptimis, elektrodo paviršiuje vyksta ta pati reakcija, bet priešingomis kryptimis, tai tokie elektrodai, kaip ir iš jų sudaryti elektrocheminiai elementai, vadinami grįžtamasis. Grįžtamojo elemento pavyzdys yra Daniel-Jacobi elementas
(–) Zn | ZnSO 4, tirpalas || CuSO 4, tirpalas | Cu(+)
Kai toks elementas veikia, ant elektrodų vyksta elektrocheminės reakcijos:
Zn Zn 2 + + 2e
Cu 2 + + 2eCu
Bendra reakcijos lygtis elemente gali būti pavaizduota kaip
Zn + Cu 2 + Zn 2 + + Cu
Kai per elementą praeina be galo maža srovė iš išorinio šaltinio, šios reakcijos vyksta priešinga kryptimi.
Pavyzdys negrįžtamas elementas yra Volta elementas
(–) Zn | H2SO4 | Cu(+)
Kai toks elementas veikia, ant elektrodų vyksta šios reakcijos:
Zn Zn 2 + + 2e
2H + + 2eH2,
o reakcija elemente pavaizduota lygtimi
Zn + 2H + Zn 2+ + H2
Kai srovė perduodama iš išorinio šaltinio, ant elektrodų vyksta kitos reakcijos:
Cu Cu 2 + + 2e,
tie. elektrocheminėje ląstelėje varis ištirpsta sieros rūgštyje, išskirdamas vandenilį:
Cu + 2H + Cu 2 + + H2
Svarbiausia elektrocheminio elemento savybė yra jos elektrovaros jėga(EMF) E– tinkamai atidaryto elemento potencialų skirtumas, t.y. potencialų skirtumas tarp tos pačios medžiagos pirmosios rūšies laidininkų, prijungtų prie galvaninio elemento elektrodų, galų. Kitaip tariant, EML yra potencialų skirtumas pusiausvyros sąlygomis, kai grandinėje neteka elektros srovė. Jei uždarysite elektrodus, grandinėje tekės elektros srovė, o potencialų skirtumas Įtampa elektrocheminis elementas, kuris skiriasi nuo EML įtampos kritimo dydžiu per elemento vidinę varžą.
Elektrocheminių elementų paskirtis – skatinti elektronų judėjimą išorinėje grandinėje, kurioje yra naudingas elementas
apkrova. Taigi, kad kuro elementas atliktų savo užduotį, turi turėti elektronų šaltinį ir kriauklę (7.1 pav.).
Reakcijos, vykstančios elektrocheminėje ląstelėje, vadinamos redukcija-reakcija, nes terminas „oksidacija“ atitinka elektronų atpalaidavimo procesą, o terminas „redukcija“ – elektronų atpalaidavimo procesą.
Daugelio pasenusių mokslinių sąvokų reikšmė dažnai neaiški iš jų pavadinimų. Sąvokas „oksidacija“ ir „redukcija“ reikia paaiškinti. Pietryčiuose deguonis (deguonis) kilęs iš lotyniško žodžio oxus (rūgštus arba karštas, aštrus) ir reiškia „rūgšties gamintoja“. Šis pavadinimas pirmą kartą pavartotas Morveau ir Lavoisier veikale „Nomenclature Chimique“, išleistame 1787 m. Tuo metu chemikai laikėsi klaidingo įsitikinimo. kad deguonis yra pagrindinis rūgščių sudėtyje esantis elementas; kai rūgštis ištirpsta vandenyje, dalis jos sudėtyje esančių vandenilio atomų praranda savo elektroną – vanduo tampa rūgštus, o vandenilis oksiduojasi. Analitiškai bet kokia reakcija, susijusi su elektronų praradimo procesu, vadinama oksidacija. Atvirkštinė reakcija – elektronų gaudymo reakcija – vadinama ■tapimu.
Srautas
J elektronai
Elektronų šaltinis >
(oksidacija)
Teigiamas< -
elektros srovės kryptis pav. 7.1. Elektrocheminėje ląstelėje turi būti elektronų šaltinis ir kriaukle
Elektrocheminėje ląstelėje bendra reakcija yra padalinta į dvi tarpines reakcijas, kurios vyksta atskirose įrenginio srityse. Šios sritys yra sulydomos elektrolitu, kuris yra jonų laidininkas, bet praleidžia elektronus, išsiskiriančius tarpinėje oksidacijos reakcijoje, elektronai gali patekti į zoną, kurioje vyksta redukcijos reakcija, bet per išorinę grandinę. Taigi išorinėje grandinėje atsiranda elektros srovė, o elektrocheminis elementas yra jos šaltinis – tokia yra jos paskirtis. Teigiama elektros a kryptis išorinėje grandinėje buvo sutarta kaip kryptis iš elemento redukuojančios oksidacijos srities - elektros srovė palieka redukcijos srities elementą, kuris tokiu būdu yra kuro katodas - o elementas, ir patenka į oksidacijos sritį, kuri yra anodas. Kaip ir bet kuriame kitame elektros šaltinyje, katodas yra teigiamai įkrautas
aktyvus elektrodas, o anodas yra neigiamo krūvio elektrodas. Kalbant apie elektros energijos (apkrovos) vartotojus, pavadinimai keičiasi priešingai. Įžangoje Ch. 6 Sąvokos „anodas“ ir „katodas“ aptariamos išsamiau.
Kaip elektrocheminės ląstelės pavyzdį apsvarstykite membraną, kuri atlieka elektrolito vaidmenį. Tegul vienas iš šoninių membranų paviršių liečiasi su vandeniliu. Normaliomis sąlygomis dujas daugiausia sudarys molekulinis vandenilis, tačiau nedidelis molekulių skaičius gali išsiskirti į atomus.
o dalis atomų oksiduosis (jonizuosis), t.y. praras savo elektroną
N -> Nt + e~ .
Kadangi membrana yra nepralaidi elektronams, jie visi liks vienoje jos pusėje, o susidarę jonai per dif. per membraną jie atsidurs kitoje pusėje. Tokiu atveju jonai neša teigiamą krūvį, todėl membranos paviršius, ant kurio yra vandenilis, dėl jame susikaupusių elektronų pertekliaus bus neigiamai įkrautas, o priešingas paviršius bus teigiamai įkrautas dėl teigiamo. jonų, atsiradusių ant jo dėl difuzijos. Dėl elektrinio lauko kai kurie jonai juda priešinga kryptimi nei membranos „vandenilio“ paviršius. Dinaminė pusiausvyra nagrinėjamoje sistemoje susidaro, kai jonų difuzijos srautas yra st. i yra lygus atvirkštinei srovei.
Dabar abu membranos paviršius užtepkime elektrai laidžiais milteliais. Taip susidarys du porėti elektrai laidžiai sluoksniai, kurie veiks kaip elektrodai. Prie elektrodų prijungkime išorinį šildytuvą1, užtikrindami elektrodų elektrinį pajungimą. Atsparumas apkrovai iki reikšmingo Rl. Jonai negali judėti išorinėje grandinėje, o elektronai pradeda judėti iš „vandenilio“ dalies, kurioje yra jų perteklius, į priešingą membranos pusę, sudarydami elektros srovę išorinėje grandinėje, kaip parodyta Fig. 7.2. Mus dominanti reakcija vyksta prie „vandens“ elektrodo ir apibūdinama lygtimi
2H2 -> 4H+ + 4e (anodinė reakcija)
Apibūdinta elemento veikimo schema turi vieną reikšmingą trūkumą: ji prieštarauja pirmajam termodinamikos dėsniui. Iš tiesų, kai elektros srovė teka per išorinę apkrovą, jos kiekis išsiskiria, kurio kiekį lemia sandauga I2RL. Tuo pačiu metu elektrinis
eidami į katodo sritį, jungiasi su H+ jonais, kurie difunduoja per membraną, sudarydami vandenilio atomus, galiausiai generuodami H2 dujų molekules, naudojamas kaip „degalai“. Jei procesas vyktų pagal pateiktą schemą, šilumą gautume be jokių kuro sąnaudų.
Išorinė grandinė sudaro tik elektronų judėjimo kelią, bet pati savaime negali būti elektros srovės atsiradimo priežastimi. Lygiai taip pat, kaip nuleidus vieną vamzdžio galą į ežerą, pats vanduo į vamzdį nepateks. Kad vanduo tekėtų, kitas galas turi būti žemiau vandens paviršiaus. Panašiai, norint įvesti elektros srovę į išorinę grandinę, katodo srityje reikia sumažinti katodo dinaminį potencialą. Lengviausias būdas tai padaryti – pridėti deguonies, kurio molekulės susijungia su elektronais ir jonais, todėl susidaro vanduo:
4е“ + 4Н+ + 02 -» 2Н20 (katodinė reakcija). (4)
Reakcija yra egzoterminė, ty išsiskiria daugiausia elektros energijos, o ne šiluminės energijos, kaip nutinka deginant vandenilį. Akivaizdu, kad būtent ši energija maitina kuro elementą.
Aprašyta elektrocheminio elemento schema parodyta fig. 7.2.
Normaliomis sąlygomis išsklaidytų vandenilio molekulių * dalis visame regione yra nedidelė. Jį galima šiek tiek padidinti keičiant fizinius parametrus
metrų pagal Le Chatelier principą. pavyzdžiui, padidinus sistemos temperatūrą. Vandenilio molekulių disociacijos laipsnį taip pat galima padidinti1 naudojant katalizatorius.
Visa elektrocheminėje ląstelėje vykstanti reakcija apibūdinama lygtimi:
2H2 + 02 -> 2H20.
Alessandro Voltos (1745–1800 m.) išrastas elektrocheminis elementas buvo pirmasis nuolatinis elektros srovės generavimo įrenginys. Jį sudarė cinko ir sidabro (arba vario) pagrindai, atskirti druskos tirpale suvilgytais popieriaus lapais. Galvaninė baterija buvo suformuota Sujungiant elementus nuosekliai, vieno elemento elektrodas buvo tiesiogiai prijungtas prie kito elemento CINKO elektrodo.
Elektrocheminis Volta elementas gali būti pagamintas panardinant suvirintus ir varinius elektrodus į praskiestą (pavyzdžiui, 10%) šios rūgšties tirpalą. Cinkas oksiduosis:
Zn -> Zr,++ + 2e >
Dėl to susidaro laisvieji elektronai. Ištirpinkite cinko jonus vandenyje. Sieros rūgštis, būdama stipri rūgštis1), disocijuoja į jonus:
H2S04 – „2Н+ + SOf“
Cinko jonai susijungia su sulfato jonais ir sudaro cinko sulfatą. Hidronio jono H" (H20)x pavidalo taškai pajudės per elektrolitą į elektrodą, ant kurio jie bus išleisti dujų burbuliukų pavidalu (kai hidronio jonas sugauna elektronus, ateinančius į elektrodą iš II išorės). Šio tipo elektrocheminiai elementai praktiškai nenaudingi, nes labai greitai varinis elektrodas pasidengs prie jo paviršiaus prilipusiais vandenilio burbuliukais, o tai žymiai sumažins į elektrodą patenkančių jonų srautą. Vadinamieji „sausieji elementai" naudoja tam tikrą metodą, neleidžiantį paviršiuje susidaryti izoliuojančiam dujų sluoksniui. Cheminis reagentas, naudojamas vandeniliui absorbuoti, vadinamas depoliarizatoriumi. Vienas iš sunaudojamų reagentų dažniausiai yra
"> Rūgšties stiprumą lemia jos molekulių disociacijos laipsnis vandeniniame tirpale C rūgštis visiškai disocijuoja į H+ ir C1_ jonus - tai stipri rūgštis Sieros rūgštis yra kiek silpnesnė, bet taip pat priklauso stiprioms rūgštims Keista, kad vandenilio fluorido rūgštis, nepaisant didelio korozinio aktyvumo, yra silpnas rūgšties tirpalas - n t kambario temperatūroje, H+ jonų dalis nuo bendros neutra HF molekulių koncentracijos yra mažesnė nei 3%.
tulžis, lengvai oksiduojamas; Dažniausiai naudojamas cinkas. Atkreipkite dėmesį, kad vario elektrodas Volta elemente nedalyvauja cheminėse reakcijose, todėl varis nėra sunaudojamas.
Dar visai neseniai nebrangios galvaninės baterijos naudojo Leclanchet elementus, kurių anodas pagamintas iš cinko, o katodas – iš grafito strypo, padengto miltelinio mangano dioksido sluoksniu, pridedant grafito (elektros laidumui padidinti). Mangano dioksidas sugeria išsiskyrusį vandenilį, kuris neleidžia ant katodo paviršiaus susidaryti dujų sluoksniui. Amonio chloridas naudojamas kaip elektrolitas. Šiuolaikinėse (šarminėse) baterijose naudojamas šarminis elektrolitas.
Jei anodo medžiagai naudojamas cinkas būtų visiškai grynas, jis būtų suvartojamas tik tada, kai per elementą teka elektros srovė. Priemaišų buvimas sukelia elektrodo koroziją net tada, kai elementas nenaudojamas (priemaišos sudaro daugybę mikroskopinių elektrocheminių elementų elektrodo medžiagos viduje). Siekiant užtikrinti ilgą tokių baterijų galiojimo laiką, anodas pagamintas iš cinko ir gyvsidabrio lydinio (amalgamuotas). Šiuo metu Leclanche elementai beveik visiškai pakeisti šarminėmis baterijomis.
Daugelis cheminių reakcijų vyksta tik tada, kai energija tiekiama iš išorės. Jie dažnai atliekami elektrolitinėse ląstelėse (elektrolizatoriuose) ant elektrodų, prijungtų prie išorinio srovės šaltinio. Šių reakcijų tyrimas suteikia informacijos apie įvairių medžiagų prigimtį ir savybes, taip pat leidžia gauti naujų cheminių junginių naudojant elektrosintezę. Elektrocheminiai procesai plačiai naudojami pramonėje. Pavyzdžiui, chloro ir aliuminio gamyba, galvanizavimas ir elektrinis ekstrahavimas. Galvaniniai elementai, paverčiantys cheminę energiją elektros energija, sudaro srovės šaltinių – baterijų ir akumuliatorių, taip pat kuro elementų – pagrindą. Elektrochemija tiria ir kitus elektros reiškinius: jonų elgseną elektrolitų tirpaluose ir srovės praėjimą per tokius tirpalus; jonų atskyrimas elektriniame lauke (elektroforezė); metalų korozija ir pasyvavimas; elektrinis poveikis biologinėse sistemose (bioelektrochemija); fotoelektrocheminiai procesai (šviesos poveikis elektrocheminėms reakcijoms ląstelėse).
Istorinė nuoroda.
Sisteminius elektrocheminius tyrimus tapo įmanoma atlikti tik sukūrus pastovų, pakankamai galingą elektros srovės šaltinį. Toks šaltinis atsirado XVIII–XIX amžių sandūroje. kaip L. Galvani ir A. Voltos darbo rezultatas. Tyrinėdamas fiziologines varlės funkcijas, Galvani atsitiktinai sukūrė elektrocheminę grandinę, susidedančią iš dviejų skirtingų metalų ir išpjaustytos varlės kojos raumens. Kai letenėlė, pritvirtinta variniu laikikliu, buvo paliesta geležine viela, taip pat prijungta prie laikiklio, raumuo susitraukė. Panašūs susitraukimai įvyko veikiant elektros iškrovai. Galvani šį reiškinį paaiškino „gyvūnų elektros energijos“ egzistavimu. Kitaip šiuos eksperimentus interpretavo Volta, manęs, kad elektra atsiranda dviejų metalų sąlyčio taške, o varlės raumens susitraukimas yra elektros srovės pratekėjimo pro jį rezultatas. Srovė taip pat atsirado, kai sūriame vandenyje suvilgyta kempinė medžiaga (audinys ar popierius) buvo dedama tarp dviejų metalinių diskų, pavyzdžiui, cinko ir vario, ir grandinė buvo uždaryta. Sujungusi 15–20 šių „elementų“ nuosekliai, Volta 1800 m. sukūrė pirmąjį cheminės srovės šaltinį – „voltinę koloną“.
Elektros įtaka cheminėms sistemoms iškart sudomino daugelį mokslininkų. Jau 1800 m. W. Nicholsonas ir A. Carlyle'as pranešė, kad vanduo skyla į vandenilį ir deguonį, kai per jį praleidžiama elektros srovė naudojant platinos ir aukso laidus, sujungtus su „voltinės kolonos“. Svarbiausias iš ankstyvųjų elektrocheminių tyrimų buvo anglų chemiko H. Davy darbas. 1807 m. jis išskyrė elementą kalį, leisdamas srovę per šiek tiek sudrėkintą kietą kalio hidroksidą. Įtampos šaltinis buvo 100 galvaninių elementų baterija. Metalinis natris buvo gautas panašiu būdu. Vėliau Davy išskyrė magnį, kalcį, stroncį ir barį elektrolizės būdu, naudodamas gyvsidabrio elektrodą.
Davy'o padėjėjas M. Faraday ištyrė ryšį tarp elektros kiekio (dabartinis laikas), tekančio per elektrodo/tirpalo sąsają, ir jo sukeltų cheminių pokyčių. Buvo sukurtas prietaisas (dabar žinomas kaip dujų kulonometras), skirtas išmatuoti elektros kiekį iš vandenilio ir deguonies tūrio, išleisto elektrolizės elemente, ir buvo parodyta (1833), kad elektros energijos kiekis, reikalingas tam tikram kiekiui gauti medžiaga nepriklauso nuo elektrodų dydžio, atstumo tarp jų ir elementą maitinančio akumuliatoriaus plokščių skaičiaus. Be to, Faradėjus atrado, kad elektrolizės metu išsiskiriančios medžiagos kiekis yra tiesiogiai proporcingas jos cheminiam ekvivalentui ir elektros kiekiui, praleidžiamam per elektrolitą. (Cheminis ekvivalentas – elemento arba junginio, kuris junginiuose reaguoja su vienu molio atomų (1,0078 g) vandenilio, skaičius gramų; cm. EKVIVALENTINĖ MASĖ). Šios dvi pagrindinės nuostatos vadinamos Faradėjaus dėsniais. Kartu su savo draugu W. Whewellu, klasikinės filologijos specialistu, Faradėjus sukūrė ir naują elektrochemijos terminiją. Jis vadino laidininkus, panardintus į tirpalą, elektrodus (anksčiau jie buvo vadinami poliais); įvedė sąvokas „elektrolizė“ (cheminiai pokyčiai, susiję su srovės pratekėjimu), „elektrolitas“ (laidus skystis elektrocheminėse ląstelėse), „anodas“ (elektrodas, ant kurio vyksta oksidacijos reakcija) ir „katodas“ (elektrodas, ant kurio įvyksta redukcijos reakcija). Skysčiuose esančius krūvininkus jis vadino jonais (iš graikų kalbos „klajotojas“, „klajoklis“), o jonus, judančius link anodo (teigiamas elektrodas), vadino „anijonais“, o judančius link katodo – „katijonais“. Faradėjaus elektromagnetinės indukcijos tyrimai paskatino sukurti elektros generatorius, kurie leido atlikti elektrocheminius procesus pramoniniu mastu.
Faradėjus aiškino tirpalų gebėjimą praleisti elektros srovę juose esančių jonų buvimu, tačiau jis pats ir kiti mokslininkai, tokie kaip I. Hittorfas ir F. Kohlrauschas, manė, kad jonai atsiranda veikiami srovės. 1884 metais S. Arrhenius pasiūlė, kad iš tikrųjų jonai susidaro tiesiog druskai ištirpus vandenyje. S. Arrhenius, J. Van't Hoff ir W. Ostwald darbai buvo svarbus etapas plėtojant elektrolitų teoriją ir idėjas apie fizikines ir chemines tirpalų savybes bei jų termodinamiką. Atitiktis tarp teorijos ir eksperimentinių duomenų apie jonų laidumą ir pusiausvyrą tirpale tapo išsamesnė po to, kai P. Debye ir E. Hückel atsižvelgė į tolimojo nuotolio elektrostatinę sąveiką tarp jonų 1923 m.
Didelį indėlį į elektrocheminę termodinamiką ir konkrečiai į elektrocheminio elemento elektrinio potencialo (įtampos) prigimtį bei elektros, cheminės ir šiluminės energijos pusiausvyrą išaiškino J. Gibbsas ir W. Nernstas. Elektrocheminį potencialą lemia ląstelėje vykstančių procesų cheminė energija, bet priklauso ir nuo jų greičio (kinetikos). Kinetinių procesų modeliavimą ant elektrodų atliko Y. Tafel (1905), J. Butler (1924), M. Volmer (1930), A. N. Frumkin (1930–1933).
Elektrocheminės ląstelės.
Elektrocheminis elementas paprastai susideda iš dviejų pusinių elementų, kurių kiekviena yra elektrodas, panardintas į savo elektrolitą. Elektrodai gaminami iš elektrai laidžios medžiagos (metalo arba anglies), rečiau – iš puslaidininkio. Elektroduose esantys krūvininkai yra elektronai, o elektrolito – jonai. Vandeniniame valgomosios druskos (natrio chlorido NaCl) tirpale, kuris yra elektrolitas, yra įkrautų dalelių: natrio katijonų Na + ir chloro anijonų Cl –. Jei tokį tirpalą patalpinsite į elektrinį lauką, Na + jonai judės į neigiamą polių, o Cl – jonai – į teigiamą. Išlydytos druskos, tokios kaip NaCl, taip pat yra elektrolitai. Pavyzdžiui, elektrolitai taip pat gali būti kietos medžiagos b- aliuminio oksidas (natrio polialiuminatas), turintis judrių natrio jonų, arba jonų mainų polimerai.
Pusinės ląstelės atskirtos pertvara, kuri netrukdo jonams judėti, tačiau neleidžia maišytis elektrolitams. Tokios pertvaros vaidmenį gali atlikti druskos tiltelis, vamzdelis su vandeniniu tirpalu, iš abiejų galų uždarytas stiklo vata, jonų mainų membrana arba porėta stiklo plokštė. Abu elektrolizės elemento elektrodai gali būti panardinti į tą patį elektrolitą.
Yra dviejų tipų elektrocheminiai elementai: galvaniniai elementai ir elektrolitiniai elementai (elektrolizatoriai). Galvaniniame elemente cheminės reakcijos vyksta spontaniškai elektrodo/elektrolito sąsajoje, o elektrodai tarpusavyje sujungiami laidininku. Keli nuosekliai sujungti galvaniniai elementai sudaro akumuliatorių – cheminį srovės šaltinį. Elektrolizės elemente reakcijos elektrodo/elektrolito sąsajoje vyksta dėl išorinio elektros energijos šaltinio; pastaroji paverčiama prie elektrodų atsirandančių reakcijos produktų chemine energija. Galvaninio elemento struktūra parodyta fig. 1, o elektrolizatorius - pav. 2. Atkreipkite dėmesį, kad tas pats elementas, priklausomai nuo darbo režimo, gali veikti kaip galvaninis elementas arba kaip elektrolizatorius. Taigi, švino-rūgštinis automobilio akumuliatorius veikia kaip galvaninis elementas, kai naudojamas varikliui užvesti (iškraunant jį), ir kaip elektrolizatorius, kai kraunamas iš automobilio generatoriaus ar įkroviklio.
Paprastas galvaninis elementas, kurį 1836 metais sukūrė J. Daniel (1 pav.), susideda iš dviejų elektrodų: cinko, panardinto į vandeninį cinko sulfato tirpalą, ir vario, panardinto į vandeninį vario (II) sulfato tirpalą. Toks elementas yra panašus į vario-cinko poras voltinėje kolonoje. Uždarius išorinę grandinę, cinko elektrodo paviršiuje esantys cinko atomai, išsiskiriant elektronams, oksiduojasi į jonus: Zn ® Zn 2+ + 2e – . Šie elektronai išilgai išorinės grandinės juda iki vario elektrodo ir redukuoja vario jonus iki atomų: Cu 2+ + 2e – ® Cu. Elektronų srautas išorinėje grandinėje yra elemento generuojama srovė. Bendra reakcija, vedanti į cheminę transformaciją ir elektros energijos generavimą, turi formą
Lygiai tokia pati reakcija vyksta, kai į vario sulfato tirpalą įdedama metalinio cinko, tačiau tokiu atveju cheminė energija paverčiama šilumine energija.
Elektrocheminiai elementai dažnai vaizduojami schematiškai, ribą tarp elektrodo ir elektrolito žymint vertikalia arba pasviruoju brūkšniu (| arba /), o druskos tiltelį – dviem brūkšniais (//). Taigi galvaninis elementas Fig. 1 atsakymo įrašas
čia M – tirpalo molinė koncentracija.
Elektrolitiniame elemente, parodytame Fig. 2, vyksta tos pačios reakcijos kaip ir pramoniniuose elektrolizatoriuose chlorui ir šarmams gaminti: sūrymas (koncentruotas vandeninis natrio chlorido tirpalas) virsta chloru ir natrio hidroksidu NaOH:
Chlorido jonai ant grafito elektrodo oksiduojami iki chloro dujų, o vanduo ant geležies elektrodo redukuojamas į vandenilio ir hidroksido jonus. Elektrolitai išlieka elektriškai neutralūs dėl natrio jonų judėjimo per pertvarą – jonų mainų membraną. Elektrodas, prie kurio vyksta oksidacija (cinkas 1 pav. ir grafitas 2 pav.), vadinamas anodu, o elektrodas, prie kurio vyksta redukcija, vadinamas katodu.
Elektrodo potencialas.
Pagrindiniai elektrocheminių elementų elektriniai parametrai yra srovė (matuojama amperais, A) ir potencialas (matuojamas voltais, V). Srovės stiprumą lemia elektrodų reakcijų greitis, o potencialą – ląstelėje vykstančių procesų cheminė energija. Ji lygi energijai (matuojama džauliais, J), padalytai iš elektros energijos kiekio (matuojama kulonais, C), t.y. 1 V = 1 J / Cl. Todėl elemento potencialas (elektrovaros jėga, emf) yra energijos, susidarančios jame vykstančių reakcijų metu, matas. Jei išorinė grandinė yra atvira, elektrodų reakcijos nevyksta.
Galvaninio elemento potencialas su atvira išorine grandine suteikia informacijos apie jo reakcijų termodinamiką. Elemento potencialas, parodytas Fig. 1, esant 1 M tirpalo koncentracijai ir 25 ° C temperatūrai - jo standartinis potencialas E° – lygi 1,10 V. Atitinkama energija, Gibso termodinaminis potencialas, D G°, suteikia
Kur n– reakcijos metu perduotų elektronų skaičius (šiuo atveju 2), F– Faradėjaus numeris (96 485 C / apgamas). Galvaninio elemento potencialas lygus potencialų skirtumui tarp jo dviejų puselementų, t.y. jo elektrodų potencialų skirtumas. Elektrodų potencialai matuojami lyginant su etaloninio elektrodo potencialu, kuris paprastai laikomas nuliu ( cm. lentelė). Pagal susitarimą standartiniu elektrodu buvo pasirinktas įprastas vandenilio elektrodas (N.H.E.); tai platinos plokštelė, padengta juoda platina, prisotinta 1,01H 10 5 Pa (1 atm.) slėgio vandenilio dujomis ir panardinta į tirpalą, kuriame yra termodinaminio aktyvumo H + jonų. a= 1. Schematiškai šis elektrodas gali būti pavaizduotas kaip Pt/H 2 (1,01H 10 5 Pa)/H + ( a= 1). Ant jo vyksta reakcija 2H + + 2e – ® H 2. Norėdami nustatyti standartinį Cu/Cu 2+ vario elektrodo potencialą, surinkite šį galvaninį elementą:
o pusinės reakcijos Cu 2+ + 2e – ® Cu matavimas duoda
Panašiai Zn/Zn 2+ pusląstelei, kurioje vyksta reakcija Zn 2+ + 2e – ® Zn, gauname
Skirtumas tarp šių dviejų standartinių elektrodų potencialų yra lygus standartiniam Zn-Cu elemento potencialui.
Tiesą sakant, vandenilio elektrodas retai naudojamas potenciometriniams matavimams, nes jis yra ideali sistema, kurią sunku įgyvendinti praktiškai. Daug dažniau naudojami patogesni ir kompaktiškesni įvairių tipų palyginamieji elektrodai, turintys specifinę, kruopščiai išmatuotą potencialo vertę srovės atžvilgiu. Paprastai jie naudoja kalomelio elektrodą (CE), susidedantį iš metalinio gyvsidabrio, gyvsidabrio chlorido (kalomelio) ir kalio chlorido tirpalo: Hg /Hg 2 Cl 2 /KCl. Ant elektrodo vyksta tokia reakcija:
Potencialus k.e. priklauso nuo gyvsidabrio jonų koncentracijos, o pastaroji – nuo KCl tirpalo koncentracijos. Sočiajam KCl tirpalui E° (k.e.) av = 0,2412 V (n.e.) esant 25 °C temperatūrai.
|
STANDARTINIAI ELEKTRODŲ POTENCIALAI |
|
| Elektrodų reakcija |
E o, V |
| Li + + e – ® Li | |
| Mg 2+ + 2e – ® Mg | |
| Al 3+ + 3e – ® Al | |
| Zn 2+ + 2e – ® Zn | |
| Cr 3+ + e – ® Cr 2+ | |
| 2H + + 2e – ® H 2 | |
| Cu 2+ + 2e – ® Cu | |
| Fe 3+ + e – ® Fe 2+ | |
| O 2 + 4H + + 4e – ® 2H 2 O | |
| Cl 2 + 2e – ® 2Cl – | |
| F 2 + 2e – ® 2F – | |
Atkreipkite dėmesį, kad kai kurių elektrodų medžiaga nėra įtraukta į atitinkamos reakcijos lygtį. Taip, reakcija
iš tikrųjų atsiranda ant platinos elektrodo Pt/Fe 3+, Fe 2+ ląstelėje. Platinos elektrodas yra inertiškas ir kontaktuoja tik su elektrolitu, kuriame yra oksiduotos ir redukuotos elemento formos (šiuo atveju dvivalenčiai ir trivalečiai geležies jonai). Platinos elektrodas atlieka tą patį vaidmenį N.V.E.
Elektrodų potencialų lentelės leidžia apskaičiuoti galvaninio elemento EML pagal jo elektrodo potencialą. Jie taip pat gali būti naudojami nuspėti, ar įvyks tam tikra redokso reakcija. Apie standartinį elektrodo potencialą galime kalbėti tik tada, kai reakcijoje dalyvaujančių komponentų aktyvumas lygus 1, t.y. jų koncentracija tirpale yra artima 1M. Elektrodo potencialas E priklauso nuo oksiduotų ir redukuotų formų koncentracijos tirpale ir yra susijusi su jomis bei standartiniu potencialu E° Nernsto lygtis. Dėl apibendrintos reakcijos
jautis + n e – = raudona
ši lygtis turi formą
Kur R- universali dujų konstanta, T– absoliuti temperatūra ir – oksiduotų ir redukuotų formų aktyvumas. Grynųjų kietųjų medžiagų ir skysčių aktyvumas laikomas 1. Esant 25° C RT/F= 0,025 V. Matuojant elektrodų potencialus, palyginti su etaloninio elektrodo potencialu, galima nustatyti medžiagų koncentracijas tirpale naudojant (10) lygtį; šis metodas vadinamas potenciometrija.
Elektrodų reakcijos.
Potenciometriniai matavimai atliekami tokiomis sąlygomis, kai elektrocheminėje kameroje nėra srovės. Tai reiškia, kad jame nevyksta jokie bendri cheminiai pokyčiai, o išmatuotą potencialą (pusiausvyrą) lemia reakcijų termodinamika. Tokiomis sąlygomis tokie veiksniai kaip elektrodų dydis ir forma arba tirpalo maišymo intensyvumas neturi įtakos išmatuotam potencialui. Jei srovė teka per elektrocheminį elementą, tai elektrodų reakcijų greitis priklauso ne tik nuo termodinaminių parametrų, bet ir nuo srovės stiprumo pagal lygtį.
Kur n– elektronų, dalyvaujančių tam tikroje elektrodo reakcijoje, skaičius, F– Faradėjaus numeris. Šiuo atveju elektrocheminio elemento potencialas priklauso nuo kinetinių faktorių, taip pat nuo medžiagos, iš kurios pagamintas elektrodas, elektrodo dydžio ir formos, tirpalo maišymo intensyvumo ir daugelio kitų faktorių. Negalima nepaisyti ir vidinio ląstelės pasipriešinimo. Be potencialų skirtumo abiejose elektrodo/elektrolito ribose, pačiame tirpale dėl jo varžos nukrenta įtampa. Dėl šio įtampos kritimo sunku ištirti poveikį, susijusį su abiejuose elektroduose vykstančiomis reakcijomis. Paprastai reakcija tiriama ant vieno elektrodo, kuris vadinamas darbiniu arba indikatoriniu elektrodu, naudojant trijų elektrodų elementą (3 pav.): trečiasis elektrodas (pavyzdžiui, prisotintas kalomelis) dedamas į tą patį skyrių kaip ir darbinis. vienas, kuo arčiau jo, kad būtų sumažintas ominės įtampos kritimo poveikis. Matuojant srovę per darbinį elektrodą kaip šio elektrodo potencialo funkciją etaloninio elektrodo atžvilgiu, vadinamasis. poliarizacijos kreivė.
Kai praeina išorinė srovė, elektrodo potencialas skiriasi nuo pusiausvyros. Šis nuokrypis vadinamas poliarizacija, o jo dydis vadinamas viršįtampiu. Viršįtampa priklauso nuo kelių veiksnių, ribojančių elektrodų reakcijų greitį. Greitos elektrodų reakcijos esant tam tikram srovės tankiui (srovės stipris vienam elektrodo paviršiaus vienetui) vyksta esant potencialams, artimiems termodinaminei, taigi, esant žemai viršįtampai. Lėtoms reakcijoms būdingas didelis viršįtampis. Elektrodų reakcijų greičiai, taigi ir viršįtampis, priklauso nuo reagentų koncentracijos, temperatūros, tirpiklio, elektrodo medžiagos, masės perdavimo būdo ir greičio bei srovės tankio. Bendras viršįtampis gali būti suskirstytas į kelis komponentus: koncentraciją, aktyvavimą ir reakciją.
Koncentracijos viršįtampis atsiranda dėl to, kad praeinant srovei keičiasi reaguojančio jono koncentracija elektrodo paviršiuje, nes šioje srityje sunaudojamos elektroaktyvios medžiagos ir susidaro reakcijos produktai. Panagrinėkime Cu 2+ redukciją ant vario elektrodo. Iš pradžių Cu 2+ koncentracija tirpale yra 1M. Jei grandinėje nėra srovės, vario elektrodo potencialas yra artimas Cu/Cu 2+ poros standartiniam potencialui, t.y. 0,34 V, palyginti su N.E. [ cm. (6) lygtis]. Tekant katodo srovei, Cu 2+ jonų koncentracija elektrodo paviršiuje mažėja, o katodo potencialas pagal Nernsto lygtį (10) tampa vis neigiamas. Šviežios reagento dalys iš tirpalo į elektrodą patenka įvairiais būdais: dėl difuzijos, konvekcijos ir migracijos. Kuo didesnis šių procesų greitis (pavyzdžiui, kuo intensyvesnis maišymas), tuo mažesnė koncentracijos viršįtampis. Šį bendros viršįtampio komponentą dažnai galima apskaičiuoti. Jei koncentracijos poliarizacija daugiausia prisideda prie bendros viršįtampio (tai reiškia, kad likusių elektrodo reakcijos etapų greitis yra didelis), tada reakcija vadinama grįžtamąja arba Nernstian.
Aktyvinimo viršįtampis atsiranda dėl to, kad elektronų perdavimas ant elektrodo paviršiaus vyksta ne akimirksniu, o ribotu greičiu. Panagrinėkime apibendrintą elektrodo reakciją ox + n e – = raudona. Norint pernešti elektronus į oksiduotus junginius tam tikru greičiu (t.y. esant tam tikram srovės tankiui), būtina įveikti energijos barjerą, vadinamą elektrodo reakcijos aktyvavimo energija. Šią energiją tiekia pritaikytas potencialas. Ryšys tarp srovės tankio ir aktyvacijos viršįtampio aprašomas Butlerio – Volmerio ir Tafelio lygtimis, kuriomis galima nustatyti elektrodų reakcijų kinetinius parametrus. Daugelis elektrodų reakcijų, tokių kaip vandens redukcija į vandenilį ir oksidacija iki deguonies, vyksta lėtai. Elektrodo reakcijos greitis gali labai priklausyti nuo medžiagos, iš kurios pagamintas elektrodas, ir nuo jo paviršiaus savybių. Pavyzdžiui, ant gyvsidabrio elektrodo vandenį redukuoti iki vandenilio yra labai sunku: jam būdinga didelė vandenilio viršįtampi. Ši reakcija vyksta daug greičiau ir su mažesniu platinos viršįtampiu; Būtent dėl šios priežasties vandenilio etaloniniame elektrode naudojama platina. Reakcijų greitis taip pat priklauso nuo medžiagų, kurios adsorbuojamos arba surišamos su elektrodo paviršiumi; Taigi cianido jonai ir daugybė organinių junginių sumažina vandenilio išsiskyrimo greitį platinos elektrodo paviršiuje. Tuo pačiu metu kai kurios aktyviosios paviršiaus medžiagos gali žymiai padidinti elektrodų reakcijos greitį – jos vadinamos elektrokatalizatoriais.
Reakcijos viršįtampis atsiranda, kai elektronų perdavimas prie elektrodo yra susietas su chemine reakcija tirpale. Tokia reakcija gali būti dalelių, dalyvaujančių elektronų pernešime, šaltinis ir tuo pačiu apriboti viso elektrodo proceso greitį. Štai kodėl taip svarbu žinoti elektrodų reakcijų mechanizmo detales (ty etapus ir tarpines būsenas). Daugeliu atvejų pradinė medžiaga patiria keletą transformacijų, kol ji tampa galutiniu produktu prie elektrodo, pavyzdžiui, deguonies redukavimo į vandenį atveju, o tai turi didelę praktinę reikšmę. Visa reakcija turi formą
ir susideda iš kelių etapų, kurių viename nutrūksta deguonies ir deguonies ryšys. Dėl šios daugiapakopės reakcijos reakcija daugumoje elektrodų yra lėta, o pramoniniu mastu ji vykdoma dalyvaujant elektrokatalizatoriams. Elektrodų reakcijų mechanizmas tiriamas naudojant toliau aprašytus elektroanalitinius metodus. Dažnai reakcijos eiga pasikeičia, kai pasikeičia tirpalo sudėtis ir tirpiklio pobūdis. Pavyzdžiui, deguonies redukcija acetonitrile, kai trūksta protonų, vyksta pagal paprastą vieno elektrono mechanizmą:
Elektrocheminiai analizės metodai.
Cheminių medžiagų kokybinei ir kiekybinei analizei sukurti įvairūs elektrocheminiai metodai, kurie dažnai praverčia ir elektrodų reakcijų termodinaminiams bei kinetiniams parametrams nustatyti, jų mechanizmams tirti.
Konduktometrija
yra pagrįstas tirpalo elektrinio laidumo matavimu ir naudojamas druskų, rūgščių, bazių ir kt. koncentracijai nustatyti. Atliekant konduktometrinius tyrimus dažniausiai naudojami elektrodai iš identiškų medžiagų, o jų laidumo sąlygos parenkamos taip, kad būtų kuo mažiau potencialių šuolių abiejose elektrodo/elektrolito sąsajose (pvz., naudojama aukšto dažnio kintamoji srovė ). Šiuo atveju pagrindinis indėlis į išmatuotą elemento potencialą yra ominis įtampos kritimas IR, Kur R– atsparumas tirpalui. Vienkomponenčio tirpalo elektrinis laidumas gali būti siejamas su jo koncentracija, o kompleksinės sudėties elektrolitų elektrinio laidumo matavimas leidžia įvertinti bendrą jonų kiekį tirpale ir naudojamas, pavyzdžiui, stebint distiliuoto tirpalo kokybę. arba dejonizuotas vanduo. Atliekant kitą konduktometrijos tipą – konduktometrinį titravimą – į analizuojamą tirpalą dalimis pridedamas žinomas reagentas ir stebimas elektros laidumo pokytis. Lygiavertiškumo taškas, kuriame pastebimas staigus elektros laidumo pokytis, nustatomas pagal šios vertės priklausomybės nuo pridėto reagento tūrio grafiką.
Potenciometrija
naudojamas įvairiems fizikiniams ir cheminiams parametrams nustatyti remiantis galvaninio elemento potencialo duomenimis. Elektrodo potencialas, kai elektrocheminėje grandinėje nėra srovės, matuojamas etaloninio elektrodo atžvilgiu, yra susietas su tirpalo koncentracija pagal Nernsto lygtį. Atliekant potenciometrinius matavimus, plačiai naudojami jonų selektyvūs elektrodai, jautrūs pirmiausia vienam jonui tirpale: stiklinis elektrodas pH matavimui ir elektrodai, skirti selektyviam natrio, amonio, fluoro, kalcio, magnio ir kt. jonų nustatymui. Jonų selektyvaus elektrodo sluoksnyje gali būti fermentų, o rezultatas yra sistema, jautri atitinkamam substratui. Atkreipkite dėmesį, kad jonams selektyvaus elektrodo potencialą lemia ne elektronų perdavimas, kaip elektroninio laidumo medžiagų atveju, o daugiausia jonų pernešimas arba mainai. Tačiau tokiam elektrodui taikytina ir Nernsto lygtis, siejanti elektrodo potencialą su tirpale esančios medžiagos koncentracijos (arba aktyvumo) logaritmu. Atliekant potenciometrinį titravimą, reagentas į analizuojamą tirpalą įpilamas dalimis ir stebimas potencialo pokytis. Šio tipo titravimui būdingos S formos kreivės leidžia nustatyti ekvivalentiškumo tašką ir rasti termodinaminius parametrus, tokius kaip pusiausvyros konstanta ir standartinis potencialas.
Voltametrija.
Visuose voltamperiniuose metoduose naudojamas darbinis mikroelektrodas, kurio paviršiaus plotas yra 10–7–10–1 cm2. Jo pagalba gautos srovės-įtampos kreivės leidžia identifikuoti ištirpusias medžiagas, nustatyti jų koncentraciją, o neretai ir termodinaminius bei kinetinius parametrus. Pirmąjį voltamperinį metodą – polarografiją – 1922 metais pasiūlė čekų chemikas J. Heyrovskis. Darbinis elektrodas jo sąrankoje buvo varvantis gyvsidabrio elektrodas. Gyvsidabris turi didelę vandenilio viršįtampą, todėl gyvsidabrio elektrodas yra patogus tiriant procesus, vykstančius esant neigiamam potencialui. Matavimo proceso metu elektrodo paviršius nuolat atnaujinamas, o tai pašalina elektrodo užteršimą. Voltametriniai tyrimai taip pat atliekami naudojant kietus elektrodus, tokius kaip platina ir anglis, ir naudojami procesai, kurie vyksta esant teigiamam potencialui. Taikant linijinę potencialo bangavimo voltamperometriją (chronoamperometriją), potencialas laikui bėgant kinta tiesiškai ir tirpalas nemaišomas, todėl masės perdavimas vyksta tik dėl difuzijos. Atliekant ciklinę voltamperometriją, ant elektrodo paleidžiami pakartotiniai trikampiai įtampos impulsai. Medžiagos, susidarančios didėjančioje ciklo atkarpoje, tiriamos jo mažėjančioje atkarpoje. Šis metodas ypač efektyvus tiriant elektrodų reakcijų mechanizmą, analizuojant poliarizacijos kreives esant skirtingiems potencialų braukimo greičiams ir skirtingoms tirpalo koncentracijoms. Yra ir kitų tipų voltamperometrijos – diferencialinis impulsas ir kvadratinė banga – kai skirtingų formų įtampos impulsai dedami ant tiesiškai didėjančio potencialo. Šie metodai plačiai naudojami mažoms medžiagų koncentracijoms tirpale nustatyti. Jei atliekant voltamperinį matavimą tirpalas sumaišomas, o tai reiškia, kad masės perdavimas vyksta vienu metu naudojant konvekciją ir difuziją, tada kalbame apie hidrodinaminę voltamperometriją. Šiuo atveju patogu naudoti besisukantį diskinį elektrodą, nes eksperimentines srovės ir įtampos kreives galima tiesiogiai palyginti su teorinėmis.
Amperometrija.
Metodas pagrįstas ribinės difuzijos srovės, praeinančios per tirpalą esant fiksuotai įtampai tarp indikatoriaus elektrodo ir etaloninio elektrodo, matavimu. Atliekant amperometrinį titravimą, lygiavertiškumo tašką lemia srovės kreivės lūžis – pridėto darbinio tirpalo tūris. Chronoamperometriniai metodai yra pagrįsti srovės priklausomybės nuo laiko matavimu ir daugiausia naudojami difuzijos koeficientams bei greičio konstantoms nustatyti. Miniatiūriniai elektrocheminiai elementai, kurie tarnauja kaip jutikliai skysčių chromatografų kolonėlių išėjime, veikia amperometrijos (taip pat voltamperometrijos) principu. Galvanostatiniai metodai yra panašūs į amperometrinius, tačiau jie matuoja potencialą, kai per elementą praeina tam tikras srovės kiekis. Taigi chronopotenciometrijoje potencialo pokytis laikui bėgant yra kontroliuojamas. Šie metodai daugiausia naudojami elektrodų reakcijų kinetikai tirti.
Kulometrija.
Kulometrijoje, esant kontroliuojamam potencialui, visa tirpalo elektrolizė atliekama intensyviai maišant jį elektrolizatoriuje su gana dideliu darbiniu elektrodu (apačioje gyvsidabrio arba platinos tinkleliu). Bendras elektros energijos kiekis ( K, C) reikalingas elektrolizei, yra susijęs su formuojančios medžiagos kiekiu ( A, d) Faradėjaus dėsnis:
Kur M- jie sako masė (g/mol), F- Faradėjaus numeris. Kulonometrinis titravimas apima nuolatinės srovės naudojimą, kad elektrolitiniu būdu generuotų reagentą, kuris reaguoja su nustatoma medžiaga. Titravimo eiga kontroliuojama potenciometriškai arba amperometriškai. Kulonometriniai metodai yra patogūs, nes yra absoliutaus pobūdžio (t. y. leidžia apskaičiuoti analitės kiekį nenaudojant kalibravimo kreivių) ir yra nejautrūs elektrolizės sąlygų ir elektrolizatoriaus parametrų pokyčiams (elektrodo paviršiaus plotui ar maišymo intensyvumui). Atliekant kulogravimetriją, elektrolizės metu atliktos medžiagos kiekis nustatomas pasveriant elektrodą prieš ir po elektrolizės.
Yra ir kitų elektroanalizės metodų. Kintamosios srovės poliarografijoje žemos amplitudės sinusinė įtampa taikoma tiesiškai kintamam potencialui plačiame dažnių diapazone ir nustatoma susidariusios kintamosios srovės amplitudė ir fazės poslinkis arba varža. Iš šių duomenų gaunama informacija apie tirpale esančių medžiagų prigimtį ir apie elektrodų reakcijų mechanizmą bei kinetiką. Plonasluoksniuose metoduose naudojami elektrocheminiai elementai, kurių elektrolito sluoksnis yra 10–100 µm storio. Tokiose ląstelėse elektrolizė vyksta greičiau nei įprastuose elektrolizatoriuose. Elektrodų procesams tirti naudojami spektrocheminiai metodai su spektrofotometrine registracija. Norint analizuoti elektrodo paviršiuje susidariusias medžiagas, matuojama jų šviesos sugertis matomoje, UV ir IR srityse. Elektrodo paviršiaus ir terpės savybių pokyčiai stebimi naudojant elektrinio atspindžio ir elipsometrijos metodus, kurie yra pagrįsti spinduliuotės atspindžio nuo elektrodo paviršiaus matavimu. Tai yra veidrodinio atspindžio ir Ramano sklaidos metodai (Raman spektroskopija), antroji harmoninė spektroskopija (Furjė spektroskopija).
Kiti elektrocheminiai reiškiniai ir metodai.
Santykiniam elektrolitui ir įkrautoms dalelėms ar paviršiams judant, atsiranda elektrokinetinis poveikis. Svarbus tokio pobūdžio pavyzdys yra elektroforezė, kurios metu išsiskiria įkrautos dalelės (pavyzdžiui, baltymų molekulės ar koloidinės dalelės), judančios elektriniame lauke. Elektroforetiniai metodai plačiai naudojami atskiriant baltymus arba dezoksiribonukleino rūgštis (DNR) gelyje. Elektros reiškiniai vaidina didelį vaidmenį gyvų organizmų funkcionavimui: jie yra atsakingi už nervinių impulsų generavimą ir sklidimą, transmembraninių potencialų atsiradimą ir kt. Biologinėms sistemoms ir jų komponentams tirti taikomi įvairūs elektrocheminiai metodai. Taip pat įdomu ištirti šviesos poveikį elektrocheminiams procesams. Taigi fotoelektrocheminių tyrimų objektas yra elektros energijos generavimas ir cheminių reakcijų inicijavimas veikiant šviesai, o tai labai svarbu didinant saulės energijos pavertimo elektros energija efektyvumą. Čia dažniausiai naudojami puslaidininkiniai elektrodai, pagaminti iš titano dioksido, kadmio sulfido, galio arsenido ir silicio. Kitas įdomus reiškinys – elektrochemiliuminescencija, t.y. šviesos generavimas elektrocheminėje ląstelėje. Jis pastebimas, kai ant elektrodų susidaro didelės energijos produktai. Dažnai procesas atliekamas cikliškai, siekiant gauti tiek oksiduotą, tiek redukuotą tam tikro junginio formas. Jų sąveika sukelia sužadintų molekulių susidarymą, kurios pereina į pradinę būseną, skleisdamos šviesą.
Taikomoji elektrochemija.
Elektrochemija turi daug praktinių pritaikymų. Pirminių galvaninių elementų (vienkartinių elementų), prijungtų prie baterijų, pagalba cheminė energija paverčiama elektros energija. Antriniai srovės šaltiniai – baterijos – kaupia elektros energiją. Kuro elementai yra pirminiai energijos šaltiniai, generuojantys elektros energiją nuolat tiekiant reagentus (pvz., vandenilį ir deguonį). Šiais principais grindžiami nešiojamieji energijos šaltiniai ir baterijos, naudojamos kosminėse stotyse, elektrinėse transporto priemonėse ir elektroniniuose prietaisuose.
Didelio masto daugelio medžiagų gamyba pagrįsta elektrochemine sinteze. Sūrymo elektrolizės metu chloro-šarminio proceso metu susidaro chloras ir šarmai, kurie vėliau naudojami organiniams junginiams ir polimerams gaminti, taip pat celiuliozės ir popieriaus pramonėje. Elektrolizės produktai yra junginiai, tokie kaip natrio chloratas, persulfatas, natrio permanganatas; Elektroekstrakcijos būdu gaunami pramoniniu požiūriu svarbūs metalai: aliuminis, magnis, litis, natris ir titanas. Išlydytas druskas geriau naudoti kaip elektrolitus, nes šiuo atveju, skirtingai nei vandeniniuose tirpaluose, metalų redukcija nėra sudėtinga dėl vandenilio išsiskyrimo. Fluoras susidaro elektrolizės būdu išlydytoje druskoje. Elektrocheminiai procesai yra kai kurių organinių junginių sintezės pagrindas; pavyzdžiui, adiponitrilas (tarpinis junginys nailono sintezėje) gaunamas hidrodimerizuojant akrilnitrilą.
Sidabro, aukso, chromo, žalvario, bronzos ir kitų metalų bei lydinių galvanizavimas plačiai taikomas įvairiems objektams, siekiant apsaugoti plieno gaminius nuo korozijos, dekoratyviniais tikslais, elektros jungčių ir spausdintinių plokščių gamybai elektronikos pramonėje. Elektrocheminiai metodai naudojami didelio tikslumo matmenų apdirbimui ruošinių, pagamintų iš metalų ir lydinių, ypač tų, kurių negalima apdirbti įprastiniais mechaniniais metodais, taip pat sudėtingų profilių detalių gamybai. Kai anoduojamas metalų, tokių kaip aliuminis ir titanas, paviršius, susidaro apsauginės oksido plėvelės. Tokios plėvelės sukuriamos ant ruošinių, pagamintų iš aliuminio, tantalo ir niobio, paviršiaus gaminant elektrolitinius kondensatorius, o kartais ir dekoratyviniais tikslais.
Elektrocheminiai metodai dažnai naudojami korozijos procesų tyrimams ir medžiagų, kurios sulėtina šiuos procesus, parinkimui. Metalinių konstrukcijų korozijai galima užkirsti kelią naudojant katodinę apsaugą, kuriai prie saugomos konstrukcijos prijungiamas išorinis šaltinis, o anodo ir konstrukcijos potencialas palaikomas toks, kad būtų išvengta jo oksidacijos. Nagrinėjamos kitų elektrocheminių procesų praktinio pritaikymo galimybės. Taigi, elektrolizė gali būti naudojama vandens valymui. Labai perspektyvi kryptis – saulės energijos konvertavimas fotocheminiais metodais. Kuriami elektrocheminiai monitoriai, kurių veikimo principas pagrįstas elektrochemiliuminescencija. Paminėsime ir grįžtamųjų elektrodo paviršiaus spalvos pokyčių, atsirandančių dėl elektrodų reakcijų, tyrimą.
Literatūra:
Agladze R.I. Taikomoji elektrochemija. M. – L., 1975 m
Izmailovas N.A. Tirpalų elektrochemija. M., 1976 m
Elektrochemijos matavimo metodai, t. 1–2. M., 1977 m
Koryta I. Jonai, elektrodai, membranos. M., 1983 m
Bagotskis V.S. Elektrochemijos pagrindai. M., 1988 m