ഐസോതെർമൽ പ്രക്രിയകളുടെ പട്ടിക. അനുയോജ്യമായ വാതകങ്ങളുടെ നിയമങ്ങൾ
തെർമോഡൈനാമിക്സിലെ പ്രധാന പ്രക്രിയകൾ ഇവയാണ്:
- ഐസോകോറിക്, സ്ഥിരമായ അളവിൽ ഒഴുകുന്നു;
- ഐസോബാറിക്നിരന്തരമായ സമ്മർദ്ദത്തിൽ ഒഴുകുന്നു;
- ഐസോതർമൽ, സ്ഥിരമായ താപനിലയിൽ സംഭവിക്കുന്നത്;
- അഡിയബാറ്റിക്, പരിസ്ഥിതിയുമായി താപ വിനിമയം ഇല്ല;
- പോളിട്രോപിക്, സമവാക്യം തൃപ്തിപ്പെടുത്തുന്നു പിവിഎൻ= കോൺസ്റ്റ്.
ഐസോകോറിക്, ഐസോബാറിക്, ഐസോതെർമൽ, അഡിയബാറ്റിക് പ്രക്രിയകൾ ഒരു പോളിട്രോപിക് പ്രക്രിയയുടെ പ്രത്യേക കേസുകളാണ്.
തെർമോഡൈനാമിക് പ്രക്രിയകളെക്കുറിച്ചുള്ള പഠനത്തിൽ നിർണ്ണയിക്കുന്നു:
- പ്രക്രിയ സമവാക്യം പി— വി ഒപ്പം ടി— എസ്കോർഡിനേറ്റുകൾ;
- ഗ്യാസ് സ്റ്റേറ്റ് പാരാമീറ്ററുകൾ തമ്മിലുള്ള ബന്ധം;
- ആന്തരിക ഊർജ്ജത്തിൽ മാറ്റം;
- ബാഹ്യ ജോലിയുടെ അളവ്;
- പ്രക്രിയയിലേക്ക് വിതരണം ചെയ്യുന്ന താപത്തിന്റെ അളവ് അല്ലെങ്കിൽ നീക്കം ചെയ്ത താപത്തിന്റെ അളവ്.
ഐസോകോറിക് പ്രക്രിയ


ഐസോകോറിക് പ്രക്രിയപി, വി— , ടി, എസ്- ഒപ്പംഐ, എസ്-കോർഡിനേറ്റുകൾ (ഡയഗ്രമുകൾ)
ഒരു ഐസോകോറിക് പ്രക്രിയയിൽ, അവസ്ഥ വി= കോൺസ്റ്റ്.
സംസ്ഥാനത്തിന്റെ അനുയോജ്യമായ വാതക സമവാക്യത്തിൽ നിന്ന് ( പി.വി = RT) താഴെ പറയുന്നു:
p/T = ആർ/വി= കോൺസ്റ്റ്,
അതായത്, വാതക സമ്മർദ്ദം അതിന്റെ കേവല താപനിലയ്ക്ക് നേരിട്ട് ആനുപാതികമാണ്:
p2/p1 = T2 /T1.
ഐസോകോറിക് പ്രക്രിയയിലെ വിപുലീകരണ പ്രവർത്തനം പൂജ്യമാണ് ( എൽ= 0), പ്രവർത്തിക്കുന്ന ദ്രാവകത്തിന്റെ അളവ് മാറാത്തതിനാൽ (Δ വി= കോൺസ്റ്റ്).
പ്രക്രിയയിൽ പ്രവർത്തിക്കുന്ന ദ്രാവകത്തിലേക്ക് വിതരണം ചെയ്യുന്ന താപത്തിന്റെ അളവ് 1-2 at സിവി
q= സിവി(ടി 2 — ടി 1 ).
ടി. ടു. എൽ= 0, പിന്നെ തെർമോഡൈനാമിക്സിന്റെ ആദ്യ നിയമത്തെ അടിസ്ഥാനമാക്കി Δ യു = q, അതിനർത്ഥം ആന്തരിക ഊർജ്ജത്തിലെ മാറ്റം ഫോർമുല ഉപയോഗിച്ച് നിർണ്ണയിക്കാൻ കഴിയും എന്നാണ്:
Δ യു = c v (T 2 - T 1).
ഐസോകോറിക് പ്രക്രിയയിലെ എൻട്രോപ്പിയിലെ മാറ്റം നിർണ്ണയിക്കുന്നത് ഫോർമുലയാണ്:
s2-s1= Δ എസ് = സിവി ln( p2/p1) = സിവി ln( T2 /T1).
ഐസോബാറിക് പ്രക്രിയ



ഐസോബാറിക് പ്രക്രിയപി, വി— , ടി, എസ്- ഒപ്പംഐ, എസ്-കോർഡിനേറ്റുകൾ (ഡയഗ്രമുകൾ)
സ്ഥിരമായ മർദ്ദത്തിൽ നടക്കുന്ന ഒന്നാണ് ഐസോബാറിക് പ്രക്രിയ. പി= കോൺസ്റ്റ്. ഒരു ആദർശ വാതകത്തിന്റെ അവസ്ഥയുടെ സമവാക്യത്തിൽ നിന്ന് ഇത് പിന്തുടരുന്നു:
v/T = R/p= കോൺസ്റ്റ്
v2/v1 = T 2/T 1,
അതായത്, ഒരു ഐസോബാറിക് പ്രക്രിയയിൽ, ഒരു വാതകത്തിന്റെ അളവ് അതിന്റെ കേവല താപനിലയ്ക്ക് ആനുപാതികമാണ്.
ജോലി ഇതായിരിക്കും:
എൽ = പി(വി 2 – വി 1 ).
ടി. ടു. പി.വി 1 = RT 1 ഒപ്പം പി.വി 2 = RT 2 , അത്
എൽ = ആർ(T2-T1).
താപത്തിന്റെ അളവ് cp= കോൺസ്റ്റ് നിർണ്ണയിക്കുന്നത് ഫോർമുലയാണ്:
q = cp(T2-T1).
എൻട്രോപ്പിയിലെ മാറ്റം ഇതായിരിക്കും:
s2-s1= Δ എസ് = cp ln( T2 /T1).
ഐസോതെർമൽ പ്രക്രിയ



ഐസോതെർമൽ പ്രക്രിയപി, വി— , ടി, എസ്- ഒപ്പംഐ, എസ്-കോർഡിനേറ്റുകൾ (ഡയഗ്രമുകൾ)
ഒരു ഐസോതെർമൽ പ്രക്രിയയിൽ, പ്രവർത്തന ദ്രാവകത്തിന്റെ താപനില സ്ഥിരമായി തുടരുന്നു ടി= കോൺസ്റ്റ്, അങ്ങനെ:
പി.വി = RT= കോൺസ്റ്റ്
p2/p1 = v1/v2,
അതായത്, മർദ്ദവും വോളിയവും പരസ്പരം വിപരീത അനുപാതത്തിലാണ്, അതിനാൽ ഐസോതെർമൽ കംപ്രഷൻ സമയത്ത് വാതക സമ്മർദ്ദം വർദ്ധിക്കുകയും വികാസ സമയത്ത് അത് കുറയുകയും ചെയ്യുന്നു.
പ്രക്രിയയുടെ പ്രവർത്തനം ഇതിന് തുല്യമായിരിക്കും:
എൽ = RT ln ( v2 - v1) = RT ln ( p1 - p2).
താപനില മാറ്റമില്ലാതെ തുടരുന്നതിനാൽ, ഒരു ഐസോതെർമൽ പ്രക്രിയയിൽ അനുയോജ്യമായ വാതകത്തിന്റെ ആന്തരിക ഊർജ്ജം സ്ഥിരമായി തുടരുന്നു (Δ യു= 0) കൂടാതെ പ്രവർത്തന ദ്രാവകത്തിലേക്ക് വിതരണം ചെയ്യുന്ന എല്ലാ താപവും പൂർണ്ണമായും വിപുലീകരണ പ്രവർത്തനമായി പരിവർത്തനം ചെയ്യപ്പെടുന്നു:
q = എൽ.
ഐസോതെർമൽ കംപ്രഷൻ സമയത്ത്, കംപ്രഷനിൽ ചെലവഴിച്ച ജോലിക്ക് തുല്യമായ അളവിൽ പ്രവർത്തിക്കുന്ന ദ്രാവകത്തിൽ നിന്ന് ചൂട് നീക്കംചെയ്യുന്നു.
എൻട്രോപ്പിയിലെ മാറ്റം ഇതാണ്:
s2-s1= Δ എസ് = ആർ ln( p1/p2) = ആർ ln( v2/v1).
adiabatic പ്രക്രിയ



അഡിയബാറ്റിക് പ്രക്രിയപി, വി— , ടി, എസ്- ഒപ്പംഐ, എസ്-കോർഡിനേറ്റുകൾ (ഡയഗ്രമുകൾ)
പരിസ്ഥിതിയുമായി ചൂട് കൈമാറ്റം ചെയ്യാതെ സംഭവിക്കുന്ന വാതകത്തിന്റെ അവസ്ഥയിലെ മാറ്റമാണ് അഡിയാബാറ്റിക് പ്രക്രിയ. ഡി മുതൽ q= 0, അപ്പോൾ ഒരു അഡിയാബാറ്റിക് പ്രക്രിയയ്ക്കുള്ള തെർമോഡൈനാമിക്സിന്റെ ആദ്യ നിയമത്തിന്റെ സമവാക്യത്തിന് ഫോം ഉണ്ടായിരിക്കും:
ഡി യു + പിഡി വി = 0
Δ യു+ എൽ = 0,
അതിനാൽ
Δ യു= —എൽ.
അഡിയബാറ്റിക് പ്രക്രിയയിൽ, വാതകത്തിന്റെ ആന്തരിക energy ർജ്ജത്തിന്റെ ചെലവ് കാരണം മാത്രമാണ് വിപുലീകരണ പ്രവർത്തനം നടത്തുന്നത്, കൂടാതെ ബാഹ്യശക്തികളുടെ പ്രവർത്തനം കാരണം സംഭവിക്കുന്ന കംപ്രഷൻ സമയത്ത്, അവർ ചെയ്യുന്ന എല്ലാ പ്രവർത്തനങ്ങളും ആന്തരിക energy ർജ്ജം വർദ്ധിപ്പിക്കുന്നതിന് പോകുന്നു. വാതകത്തിന്റെ.
അഡിയബാറ്റിക് പ്രക്രിയയിലെ താപ ശേഷി നമുക്ക് സൂചിപ്പിക്കാം സിനരകം, അവസ്ഥ ഡി q= 0 ഇനിപ്പറയുന്ന രീതിയിൽ പ്രകടിപ്പിക്കുന്നു:
ഡി q = സിനരകം ഡി ടി = 0.
അഡിയബാറ്റിക് പ്രക്രിയയിലെ താപ ശേഷി പൂജ്യമാണെന്ന് ഈ അവസ്ഥ പറയുന്നു ( സിനരകം = 0).
എന്ന് അറിയപ്പെടുന്നു
കൂടെപി/സിവി= കെ
അഡിയാബാറ്റിക് പ്രോസസ് കർവിന്റെ (അഡിയബാറ്റിക്) സമവാക്യവും പി, വി- ഡയഗ്രം ഇതുപോലെ കാണപ്പെടുന്നു:
പി.വി.കെ= കോൺസ്റ്റ്.
ഈ പ്രയോഗത്തിൽ കെവിളിച്ചു അഡിയബാറ്റിക് എക്സ്പോണന്റ്(പോയിസന്റെ അനുപാതം എന്നും അറിയപ്പെടുന്നു).
അഡിയാബാറ്റിക് എക്സ്പോണന്റിന്റെ മൂല്യങ്ങൾകെചില വാതകങ്ങൾക്ക്:
കെവായു = 1.4
കെസൂപ്പർഹീറ്റഡ് ആവി = 1.3
കെ ICE എക്സ്ഹോസ്റ്റ് = 1.33
കെപൂരിത ആർദ്ര നീരാവി = 1.135
മുമ്പത്തെ സൂത്രവാക്യങ്ങളിൽ നിന്ന് ഇനിപ്പറയുന്നവ:
എൽ= — Δ യു = സിവി(ടി 1 – ടി 2 );
ഐ 1 – ഐ 2 = cp(ടി 1 – ടി 2 ).
അഡിയബാറ്റിക് പ്രക്രിയയുടെ സാങ്കേതിക പ്രവർത്തനം ( എൽടെക്) പ്രക്രിയയുടെ തുടക്കത്തിന്റെയും അവസാനത്തിന്റെയും എന്താൽപികൾ തമ്മിലുള്ള വ്യത്യാസത്തിന് തുല്യമാണ് ( ഐ 1 – ഐ 2 ).
പ്രവർത്തന ദ്രാവകത്തിൽ ആന്തരിക ഘർഷണം കൂടാതെ സംഭവിക്കുന്ന ഒരു അഡിയാബാറ്റിക് പ്രക്രിയയെ വിളിക്കുന്നു ഐസെൻട്രോപിക്. IN ടി, എസ്ഡയഗ്രാമിൽ, ഇത് ഒരു ലംബ വരയാൽ പ്രതിനിധീകരിക്കുന്നു.
സാധാരണയായി, യഥാർത്ഥ അഡിയാബാറ്റിക് പ്രക്രിയകൾ പ്രവർത്തിക്കുന്ന ദ്രാവകത്തിൽ ആന്തരിക ഘർഷണത്തിന്റെ സാന്നിധ്യത്തിൽ തുടരുന്നു, അതിന്റെ ഫലമായി താപം എല്ലായ്പ്പോഴും പുറത്തുവിടുന്നു, ഇത് പ്രവർത്തന ദ്രാവകത്തിലേക്ക് തന്നെ പകരുന്നു. ഈ സാഹചര്യത്തിൽ ഡി എസ്> 0, പ്രക്രിയയെ വിളിക്കുന്നു യഥാർത്ഥ അഡിയബാറ്റിക് പ്രക്രിയ.
പോളിട്രോപിക് പ്രക്രിയ
ഒരു പ്രക്രിയയെ പോളിട്രോപിക് എന്ന് വിളിക്കുന്നു, ഇത് സമവാക്യം വിവരിക്കുന്നു:
പിവിഎൻ= കോൺസ്റ്റ്.
പോളിട്രോപിക് സൂചിക എൻ-∞ മുതൽ +∞ വരെയുള്ള ഏത് മൂല്യവും എടുക്കാം, എന്നാൽ ഈ പ്രക്രിയയ്ക്ക് ഇത് ഒരു സ്ഥിരമായ മൂല്യമാണ്.
പോളിട്രോപിക് പ്രോസസ് സമവാക്യത്തിൽ നിന്നും ക്ലൈപെറോൺ സമവാക്യത്തിൽ നിന്നും, തമ്മിൽ ഒരു ബന്ധം സ്ഥാപിക്കുന്ന ഒരു പദപ്രയോഗം ലഭിക്കും. പി, വിഒപ്പം ടിപോളിട്രോപ്പിലെ ഏതെങ്കിലും രണ്ട് പോയിന്റുകളിൽ:
p2/p1 = (v1/v2)n; T2 /T1 = (v1/v2) n-1 ; T2 /T1 = (p2/p1) (n-1)/n .
ഒരു പോളിട്രോപിക് പ്രക്രിയയിൽ വാതക വികാസത്തിന്റെ പ്രവർത്തനം:

അനുയോജ്യമായ വാതകത്തിന്റെ കാര്യത്തിൽ, ഈ ഫോർമുല രൂപാന്തരപ്പെടുത്താം:

ഈ പ്രക്രിയയിൽ വിതരണം ചെയ്തതോ നീക്കം ചെയ്തതോ ആയ താപത്തിന്റെ അളവ് തെർമോഡൈനാമിക്സിന്റെ ആദ്യ നിയമം ഉപയോഗിച്ച് നിർണ്ണയിക്കപ്പെടുന്നു:
q = (u 2 - u 1) + എൽ.
എന്തുകൊണ്ടെന്നാല്

ഒരു പോളിട്രോപിക് പ്രക്രിയയിൽ അനുയോജ്യമായ വാതകത്തിന്റെ താപ ശേഷിയാണ്.
ചെയ്തത് സിവി, കെഒപ്പം എൻ= കോൺസ്റ്റ് സി എൻ= const, അതിനാൽ ഒരു പോളിട്രോപിക് പ്രക്രിയ ചിലപ്പോൾ സ്ഥിരമായ താപ ശേഷിയുള്ള ഒരു പ്രക്രിയയായി നിർവചിക്കപ്പെടുന്നു.
പോളിട്രോപിക് പ്രക്രിയയ്ക്ക് പൊതുവായ ഒരു അർത്ഥമുണ്ട്, കാരണം ഇത് അടിസ്ഥാന തെർമോഡൈനാമിക് പ്രക്രിയകളുടെ മുഴുവൻ സെറ്റും ഉൾക്കൊള്ളുന്നു.
ഒരു പോളിട്രോപ്പിന്റെ ഗ്രാഫിക്കൽ പ്രാതിനിധ്യം പി, വിപോളിട്രോപ്പ് സൂചികയെ ആശ്രയിച്ച് കോർഡിനേറ്റുകൾ എൻ.

പിവി 0= കോൺസ്റ്റ്( എൻ= 0) isobar ആണ്;
പി.വി= കോൺസ്റ്റ്( എൻ= 1) isotherm ആണ്;
p 0 v= കോൺസ്റ്റ്, p 1/∞ v= കോൺസ്റ്റ്, pv∞= const - isochore;
പി.വി.കെ= കോൺസ്റ്റ്( എൻ = കെ) ഒരു അടിയാബാറ്റ് ആണ്.
എൻ > 0 - ഹൈപ്പർബോളിക് കർവുകൾ,
എൻ < 0 പരവലയങ്ങളാണ്.
തെർമോഡൈനാമിക്സിനെക്കുറിച്ചുള്ള എന്റെ പ്രഭാഷണ കുറിപ്പുകളുടെയും "ഫണ്ടമെന്റൽസ് ഓഫ് എനർജി" എന്ന പാഠപുസ്തകത്തിന്റെയും മെറ്റീരിയലുകളെ അടിസ്ഥാനമാക്കി. രചയിതാവ് ജി.എഫ്. ബൈസ്ട്രിറ്റ്സ്കി. രണ്ടാം പതിപ്പ്, റവ. കൂടാതെ അധികവും - എം.: നോറസ്, 2011. - 352 പേ.
എന്താണ് ഒരു ഐസോബാറിക് പ്രക്രിയ
നിർവ്വചനം
ഒരു ഐസോബാറിക് (അല്ലെങ്കിൽ ഐസോബാറിക്) പ്രക്രിയ എന്നത് സ്ഥിരമായ സമ്മർദ്ദത്തിൽ സ്ഥിരമായ വാതക പിണ്ഡത്തിൽ സംഭവിക്കുന്ന ഒരു പ്രക്രിയയാണ്.
ഒരു ആദർശ വാതകത്തിന്റെ രണ്ട് അവസ്ഥകൾക്കുള്ള സമവാക്യം നമുക്ക് എഴുതാം:
\ \
ഞങ്ങൾ സമവാക്യം (2) സമവാക്യം (1) കൊണ്ട് ഹരിക്കുന്നു, ഐസോബാറിക് പ്രക്രിയയുടെ സമവാക്യം നമുക്ക് ലഭിക്കും:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \ഇടത്(4\വലത്).\]
സമവാക്യം (4) ഗേ-ലുസാക് നിയമം എന്ന് വിളിക്കുന്നു.
ആന്തരിക ഊർജ്ജവും ഐസോബാറിക് പ്രക്രിയയുടെ താപത്തിന്റെ അളവും
വോളിയം വർദ്ധിക്കുകയോ അല്ലെങ്കിൽ വോളിയം കുറയ്ക്കുന്നതിന് ചൂട് നീക്കം ചെയ്യുകയോ ആണെങ്കിൽ ചൂട് ഇൻപുട്ടിനൊപ്പം ഈ പ്രക്രിയ സംഭവിക്കുന്നു. നമുക്ക് തെർമോഡൈനാമിക്സിന്റെ ആദ്യ നിയമം എഴുതാം, ജോലി, ആന്തരിക ഊർജ്ജം, ഐസോബാറിക് പ്രക്രിയയുടെ താപത്തിന്റെ അളവ് എന്നിവയ്ക്കുള്ള പദപ്രയോഗങ്ങൾ നമുക്ക് തുടർച്ചയായി ലഭിക്കും:
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \left(5\right).\] \[\triangle Q=\int\limits^(T_2)_ (T_1)(dU)+\int\പരിധികൾ^(V_2)_(V_1)(dA)(6)\]
ഇവിടെ $\delta Q\ $ എന്നത് സിസ്റ്റത്തിലേക്ക് വിതരണം ചെയ്യുന്ന പ്രാഥമിക താപമാണ്, $dU$ എന്നത് നിലവിലുള്ള പ്രക്രിയയിൽ വാതകത്തിന്റെ ആന്തരിക ഊർജ്ജത്തിലുണ്ടാകുന്ന മാറ്റമാണ്, $dA$ എന്നത് വാതകം പ്രക്രിയയിൽ ചെയ്യുന്ന പ്രാഥമിക പ്രവർത്തനമാണ്, i വാതക തന്മാത്രയുടെ സ്വാതന്ത്ര്യത്തിന്റെ ഡിഗ്രികളുടെ എണ്ണമാണ്, R എന്നത് സാർവത്രിക വാതക സ്ഥിരാങ്കമാണ്, d എന്നത് വാതകത്തിന്റെ മോളുകളുടെ എണ്ണമാണ്.
വാതകത്തിന്റെ ആന്തരിക ഊർജ്ജത്തിലെ മാറ്റം:
\[\ത്രികോണം U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
സമവാക്യം (8) ഒരു ഐസോബാറിക് പ്രക്രിയയുടെ പ്രവർത്തനത്തെ നിർവചിക്കുന്നു. (2) ൽ നിന്ന് ഞങ്ങൾ സമവാക്യം (1) കുറയ്ക്കുന്നു, ഒരു ഐസോബാറിക് പ്രക്രിയയിൽ വാതക പ്രവർത്തനത്തിനായി നമുക്ക് ഒരു സമവാക്യം കൂടി ലഭിക്കും:
\\[\ത്രികോണം Q=\frac(i)(2)nR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \triangle T\ ( 10),\]
ഇവിടെ $c_(\mu p)$ എന്നത് ഒരു ഐസോബാറിക് പ്രക്രിയയിലെ വാതകത്തിന്റെ മോളാർ ഹീറ്റ് കപ്പാസിറ്റിയാണ്. ഇക്വേഷൻ (10) ഒരു ഐസോബാറിക് പ്രക്രിയയിൽ $\ത്രികോണം T.$ കൊണ്ട് താപനില വർദ്ധിക്കുന്ന ഒരു വാതകത്തിൽ m പിണ്ഡമുള്ള ഒരു വാതകത്തിലേക്ക് നൽകുന്ന താപത്തിന്റെ അളവ് നിർണ്ണയിക്കുന്നു.
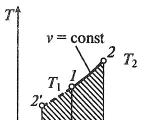
ഐസോപ്രോസസ്സ് പലപ്പോഴും തെർമോഡൈനാമിക് ഡയഗ്രമുകളിൽ ചിത്രീകരിച്ചിരിക്കുന്നു. അതിനാൽ, അത്തരമൊരു ഡയഗ്രാമിൽ ഒരു ഐസോബാറിക് പ്രക്രിയയെ ചിത്രീകരിക്കുന്ന ഒരു വരിയെ ഐസോബാർ എന്ന് വിളിക്കുന്നു (ചിത്രം 1).
ഉദാഹരണം 1
ടാസ്ക്: ചിത്രം 1c-ലെ V(T) ഡയഗ്രാമിൽ $p_1$, $p_2$ എന്നിവ എങ്ങനെ ബന്ധപ്പെട്ടിരിക്കുന്നുവെന്ന് നിർണ്ണയിക്കുക.
ഐസോതെർം $T_1$ വരയ്ക്കുക

എ, ബി പോയിന്റുകളിൽ, താപനില ഒന്നുതന്നെയാണ്, അതിനാൽ, വാതകം ബോയിൽ-മരിയറ്റ് നിയമം അനുസരിക്കുന്നു:
\ \
നമുക്ക് ഈ വോള്യങ്ങളെ SI ആയി പരിവർത്തനം ചെയ്യാം: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
നമുക്ക് കണക്കുകൂട്ടലുകൾ നടത്താം:
ഉത്തരം: ഐസോബാറിക് പ്രക്രിയയിൽ വാതകത്തിന്റെ പ്രവർത്തനം 600 ജെ ആണ്.
ഉദാഹരണം 3
ടാസ്ക്: എബിസി പ്രക്രിയയിലെ ഗ്യാസ് ജോലിയും സിഡിഎ പ്രക്രിയയിലെ ഗ്യാസ് വർക്കും ചിത്രം 3 താരതമ്യം ചെയ്യുക.

പരിഹാരത്തിന്റെ അടിസ്ഥാനമായി, വാതകത്തിന്റെ പ്രവർത്തനം നിർണ്ണയിക്കുന്ന ഫോർമുല ഞങ്ങൾ എടുക്കുന്നു:
നിശ്ചിത അവിഭാജ്യത്തിന്റെ ജ്യാമിതീയ അർത്ഥത്തിൽ നിന്ന്, $V_1\,\ V_2$ എന്നീ പോയിന്റുകളിലെ ഇന്റഗ്രാൻഡ്, abscissa axis, isochores എന്നിവയുടെ പ്രവർത്തനത്താൽ പരിമിതപ്പെടുത്തിയിരിക്കുന്ന ചിത്രത്തിന്റെ വിസ്തീർണ്ണമാണ് സൃഷ്ടിയെന്ന് അറിയാം. (അക്ഷം p(V)). ഞങ്ങൾ പ്രോസസ് ഗ്രാഫുകൾ p (V) അക്ഷങ്ങളിലേക്ക് വിവർത്തനം ചെയ്യുന്നു.
ചിത്രം (3) ൽ കാണിച്ചിരിക്കുന്ന പ്രക്രിയകളുടെ ഗ്രാഫുകളുടെ ഓരോ സെഗ്മെന്റും പരിഗണിക്കുക.
AB: ഐസോകോറിക് പ്രോസസ് (p=const), $V\uparrow \left(\ Volume\ grows\right),\ T\uparrow $;
VS: ഐസോകോറിക് പ്രോസസ് (V =const), $T\uparrow $ (ഗ്രാഫിൽ നിന്ന്), p$\uparrow $, ഐസോകോറിക് പ്രക്രിയയ്ക്കുള്ള നിയമത്തിൽ നിന്ന് ($\frac(p)(T)=const$);
CD: (p=const), $V\downarrow ,\ T\downarrow ;$
DA: (V =const), $T\downarrow ,\ p\downarrow .$
പി(വി) അക്ഷങ്ങളിലെ പ്രക്രിയകളുടെ ഗ്രാഫുകൾ നമുക്ക് ചിത്രീകരിക്കാം (ചിത്രം 4):

ഗ്യാസ് വർക്ക് $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- ദീർഘചതുരത്തിന്റെ വിസ്തീർണ്ണം ABFE) (ചിത്രം 3). ഗ്യാസിൽ പ്രവർത്തിക്കുക $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -ഏരിയ \ ദീർഘചതുരം\ $EFCD. തീർച്ചയായും $A_(CDA)>A_(ABC).$
, ഒരു സിസ്റ്റത്തിന്റെ അവസ്ഥയിലെ മാറ്റമാണ് തെർമോഡൈനാമിക് പ്രക്രിയ, അതിന്റെ ഫലമായി അതിന്റെ പാരാമീറ്ററുകളിലൊന്നെങ്കിലും (താപനില, വോള്യം അല്ലെങ്കിൽ മർദ്ദം) അതിന്റെ മൂല്യം മാറ്റുന്നു. എന്നിരുന്നാലും, ഒരു തെർമോഡൈനാമിക് സിസ്റ്റത്തിന്റെ എല്ലാ പാരാമീറ്ററുകളും അഭേദ്യമായി ബന്ധപ്പെട്ടിരിക്കുന്നുവെന്ന് ഞങ്ങൾ കണക്കിലെടുക്കുകയാണെങ്കിൽ, അവയിലേതെങ്കിലും മാറ്റം അനിവാര്യമായും കുറഞ്ഞത് ഒരു (അനുയോജ്യമായ) അല്ലെങ്കിൽ നിരവധി (യാഥാർത്ഥ്യത്തിൽ) പാരാമീറ്ററുകളിൽ മാറ്റം വരുത്തുന്നു. പൊതുവായ സാഹചര്യത്തിൽ, തെർമോഡൈനാമിക് പ്രക്രിയ സിസ്റ്റത്തിന്റെ സന്തുലിതാവസ്ഥയുടെ ലംഘനവുമായി ബന്ധപ്പെട്ടിരിക്കുന്നുവെന്ന് നമുക്ക് പറയാൻ കഴിയും, കൂടാതെ സിസ്റ്റം ഒരു സന്തുലിതാവസ്ഥയിലാണെങ്കിൽ, അതിൽ തെർമോഡൈനാമിക് പ്രക്രിയകളൊന്നും സംഭവിക്കില്ല.
ഒരു സിസ്റ്റത്തിന്റെ സന്തുലിതാവസ്ഥ ഒരു അമൂർത്തമായ ആശയമാണ്, കാരണം ചുറ്റുമുള്ള ലോകത്ത് നിന്ന് ഒരു വസ്തുവിനെയും വേർതിരിക്കുന്നത് അസാധ്യമാണ്, അതിനാൽ ഏത് യഥാർത്ഥ സിസ്റ്റത്തിലും വിവിധ തെർമോഡൈനാമിക് പ്രക്രിയകൾ അനിവാര്യമായും സംഭവിക്കുന്നു. അതേ സമയം, ചില സിസ്റ്റങ്ങളിൽ അത്തരം സാവധാനത്തിലുള്ള, ഏതാണ്ട് അദൃശ്യമായ മാറ്റങ്ങൾ സംഭവിക്കാം, അവയുമായി ബന്ധപ്പെട്ട പ്രക്രിയകൾ വ്യവസ്ഥാപിതമായി വ്യവസ്ഥാപിതമായി കണക്കാക്കാം, സിസ്റ്റത്തിന്റെ സന്തുലിതാവസ്ഥകളുടെ ഒരു ക്രമം ഉൾക്കൊള്ളുന്നു. അത്തരം പ്രക്രിയകളെ സന്തുലിതാവസ്ഥ അല്ലെങ്കിൽ അർദ്ധ-സ്ഥിരമായ.
സിസ്റ്റത്തിലെ തുടർച്ചയായ മാറ്റങ്ങളുടെ മറ്റൊരു സാഹചര്യത്തെ വിളിക്കുന്നു, അതിനുശേഷം അത് അതിന്റെ യഥാർത്ഥ അവസ്ഥയിലേക്ക് മടങ്ങുന്നു വൃത്താകൃതിയിലുള്ള പ്രക്രിയഅല്ലെങ്കിൽ ഒരു ചക്രം. സന്തുലിതാവസ്ഥയുടെയും വൃത്താകൃതിയിലുള്ള പ്രക്രിയകളുടെയും ആശയങ്ങൾ തെർമോഡൈനാമിക്സിന്റെ നിരവധി സൈദ്ധാന്തിക നിഗമനങ്ങൾക്കും പ്രായോഗിക രീതികൾക്കും അടിവരയിടുന്നു.
ഒരു തെർമോഡൈനാമിക് പ്രക്രിയയുടെ പഠനം ഈ പ്രക്രിയയിൽ ചെയ്യുന്ന ജോലി, ആന്തരിക ഊർജ്ജത്തിലെ മാറ്റം, താപത്തിന്റെ അളവ്, കൂടാതെ ഒരു വാതകത്തിന്റെ അവസ്ഥയെ ചിത്രീകരിക്കുന്ന വ്യക്തിഗത അളവുകൾ തമ്മിലുള്ള ബന്ധം സ്ഥാപിക്കുന്നതിലും ഉൾപ്പെടുന്നു.
സാധ്യമായ എല്ലാ തെർമോഡൈനാമിക് പ്രക്രിയകളിലും, ഐസോകോറിക്, ഐസോബാറിക്, ഐസോതെർമൽ, അഡിയാബാറ്റിക്, പോളിട്രോപിക് പ്രക്രിയകൾ ഏറ്റവും താൽപ്പര്യമുള്ളവയാണ്.
ഐസോകോറിക് പ്രക്രിയ
ഒരു ഐസോകോറിക് പ്രക്രിയ സ്ഥിരമായ വോളിയത്തിൽ സംഭവിക്കുന്ന ഒരു തെർമോഡൈനാമിക് പ്രക്രിയയാണ്. അടച്ച പാത്രത്തിൽ സ്ഥാപിച്ചിരിക്കുന്ന വാതകം ചൂടാക്കി അത്തരമൊരു പ്രക്രിയ നടത്താം. താപ വിതരണത്തിന്റെ ഫലമായി വാതകം ചൂടാക്കുന്നു, അതിന്റെ മർദ്ദം വർദ്ധിക്കുന്നു.
ഐസോകോറിക് പ്രക്രിയയിലെ ഗ്യാസ് പാരാമീറ്ററുകളിലെ മാറ്റം ചാൾസിന്റെ നിയമത്തെ വിവരിക്കുന്നു: p 1 /T 1 \u003d p 2 /T 2, അല്ലെങ്കിൽ പൊതുവായ സാഹചര്യത്തിൽ:
p/T = const.
ഒരു പാത്രത്തിന്റെ ചുമരുകളിൽ ഒരു വാതകത്തിന്റെ മർദ്ദം വാതകത്തിന്റെ കേവല താപനിലയ്ക്ക് നേരിട്ട് ആനുപാതികമാണ്.
ഒരു ഐസോകോറിക് പ്രക്രിയയിൽ ഡിവി വോളിയത്തിലെ മാറ്റം പൂജ്യത്തിന് തുല്യമായതിനാൽ, വാതകത്തിലേക്ക് വിതരണം ചെയ്യുന്ന എല്ലാ താപവും വാതകത്തിന്റെ ആന്തരിക ഊർജ്ജം മാറ്റുന്നതിനാണ് ചെലവഴിക്കുന്നതെന്ന് നമുക്ക് നിഗമനം ചെയ്യാം. (ഒരു ജോലിയും ചെയ്തിട്ടില്ല).
ഐസോബാറിക് പ്രക്രിയ
സ്ഥിരമായ മർദ്ദത്തിൽ സംഭവിക്കുന്ന ഒരു തെർമോഡൈനാമിക് പ്രക്രിയയാണ് ഐസോബാറിക് പ്രക്രിയ. ചലിക്കുന്ന പിസ്റ്റൺ ഉപയോഗിച്ച് സാന്ദ്രമായ സിലിണ്ടറിൽ വാതകം സ്ഥാപിച്ച് അത്തരം ഒരു പ്രക്രിയ നടത്താം, ഇത് താപം നീക്കം ചെയ്യുമ്പോഴും വിതരണം ചെയ്യുമ്പോഴും സ്ഥിരമായ ബാഹ്യശക്തിയാൽ പ്രവർത്തിക്കുന്നു.
വാതകത്തിന്റെ താപനില മാറുമ്പോൾ, പിസ്റ്റൺ ഒരു ദിശയിലോ മറ്റൊന്നിലോ നീങ്ങുന്നു; ഗേ-ലുസാക്കിന്റെ നിയമത്തിന് അനുസൃതമായി വാതകത്തിന്റെ അളവ് മാറുമ്പോൾ:
V/T = const.
ഇതിനർത്ഥം ഒരു ഐസോബാറിക് പ്രക്രിയയിൽ വാതകം ഉൾക്കൊള്ളുന്ന അളവ് താപനിലയ്ക്ക് നേരിട്ട് ആനുപാതികമാണ്.
ഈ പ്രക്രിയയിലെ താപനിലയിലെ മാറ്റം അനിവാര്യമായും വാതകത്തിന്റെ ആന്തരിക ഊർജ്ജത്തിലെ മാറ്റത്തിന് കാരണമാകുമെന്ന് നിഗമനം ചെയ്യാം, കൂടാതെ വോളിയത്തിലെ മാറ്റം ജോലിയുടെ പ്രകടനവുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു, അതായത്, ഒരു ഐസോബാറിക് പ്രക്രിയയിൽ, താപത്തിന്റെ ഭാഗമാണ്. വാതകത്തിന്റെ ആന്തരിക ഊർജ്ജം മാറ്റുന്നതിനാണ് ഊർജ്ജം ചെലവഴിക്കുന്നത്, മറ്റൊരു ഭാഗം ബാഹ്യശക്തികളുടെ പ്രവർത്തനത്തെ മറികടക്കാൻ വാതക പ്രവർത്തനത്തിന്റെ പ്രകടനത്തിനായി ചെലവഴിക്കുന്നു. ഈ സാഹചര്യത്തിൽ, ആന്തരിക ഊർജ്ജം വർദ്ധിപ്പിക്കുന്നതിനും ജോലി നിർവഹിക്കുന്നതിനുമുള്ള ചൂട് ചെലവുകൾ തമ്മിലുള്ള അനുപാതം വാതകത്തിന്റെ താപ ശേഷിയെ ആശ്രയിച്ചിരിക്കുന്നു.
ഐസോതെർമൽ പ്രക്രിയ
ഒരു ഐസോതെർമൽ പ്രക്രിയ ഒരു സ്ഥിരമായ താപനിലയിൽ സംഭവിക്കുന്ന ഒരു തെർമോഡൈനാമിക് പ്രക്രിയയാണ്.
പ്രായോഗികമായി ഗ്യാസ് ഉപയോഗിച്ച് ഒരു ഐസോതെർമൽ പ്രക്രിയ നടത്തുന്നത് വളരെ ബുദ്ധിമുട്ടാണ്. എല്ലാത്തിനുമുപരി, കംപ്രഷൻ അല്ലെങ്കിൽ വിപുലീകരണ പ്രക്രിയയിൽ, വാതകത്തിന് പരിസ്ഥിതിയുമായി താപനില കൈമാറ്റം ചെയ്യാനും അതിന്റേതായ താപനില സ്ഥിരമായി നിലനിർത്താനും സമയമുണ്ട് എന്ന വ്യവസ്ഥ പാലിക്കേണ്ടത് ആവശ്യമാണ്.
ഐസോതെർമൽ പ്രക്രിയയെ ബോയിൽ-മാരിയറ്റ് നിയമം വിവരിക്കുന്നു: pV \u003d const, അതായത് സ്ഥിരമായ താപനിലയിൽ, വാതക മർദ്ദം അതിന്റെ വോളിയത്തിന് വിപരീത അനുപാതത്തിലാണ്.
വ്യക്തമായും, ഒരു ഐസോതെർമൽ പ്രക്രിയയിൽ, വാതകത്തിന്റെ ആന്തരിക ഊർജ്ജം മാറില്ല, കാരണം അതിന്റെ താപനില സ്ഥിരമാണ്.
വാതക താപനിലയുടെ സ്ഥിരതയുടെ അവസ്ഥ നിറവേറ്റുന്നതിന്, അതിൽ നിന്ന് ചൂട് നീക്കംചെയ്യേണ്ടത് ആവശ്യമാണ്, ഇത് കംപ്രഷനിൽ ചെലവഴിച്ച ജോലിക്ക് തുല്യമാണ്:
dq = dA = pdv .
വാതകത്തിന്റെ അവസ്ഥയുടെ സമവാക്യം ഉപയോഗിച്ച്, നിരവധി പരിവർത്തനങ്ങളും പകരക്കാരും നടത്തി, ഒരു ഐസോതെർമൽ പ്രക്രിയയിൽ വാതകത്തിന്റെ പ്രവർത്തനം നിർണ്ണയിക്കുന്നത് എക്സ്പ്രഷൻ അനുസരിച്ചാണെന്ന് നമുക്ക് നിഗമനം ചെയ്യാം:
A = RT ln(p 1 /p 2).
adiabatic പ്രക്രിയ
പ്രവർത്തന ദ്രാവകവും പരിസ്ഥിതിയും തമ്മിലുള്ള താപ വിനിമയമില്ലാതെ തുടരുന്ന ഒരു തെർമോഡൈനാമിക് പ്രക്രിയയാണ് അഡിയബാറ്റിക് പ്രക്രിയ. ഒരു ഐസോതെർമൽ പ്രക്രിയ പോലെ, പ്രായോഗികമായി ഒരു അഡിയാബാറ്റിക് പ്രക്രിയ നടപ്പിലാക്കുന്നത് വളരെ ബുദ്ധിമുട്ടാണ്. അത്തരമൊരു പ്രക്രിയ ഒരു പാത്രത്തിൽ സ്ഥാപിച്ചിരിക്കുന്ന പ്രവർത്തന മാധ്യമവുമായി മുന്നോട്ട് പോകാം, ഉദാഹരണത്തിന്, ഒരു പിസ്റ്റൺ ഉള്ള ഒരു സിലിണ്ടർ, ഉയർന്ന നിലവാരമുള്ള ചൂട്-ഇൻസുലേറ്റിംഗ് മെറ്റീരിയൽ കൊണ്ട് ചുറ്റപ്പെട്ടിരിക്കുന്നു.
എന്നാൽ ഈ സാഹചര്യത്തിൽ നമ്മൾ ഏത് ഉയർന്ന നിലവാരമുള്ള ചൂട് ഇൻസുലേറ്റർ ഉപയോഗിച്ചാലും, ചിലത്, നിസ്സാരമാണെങ്കിലും, ജോലി ചെയ്യുന്ന ദ്രാവകത്തിനും പരിസ്ഥിതിക്കും ഇടയിൽ താപത്തിന്റെ അളവ് അനിവാര്യമായും കൈമാറ്റം ചെയ്യപ്പെടും.
അതിനാൽ, പ്രായോഗികമായി, അഡിയബാറ്റിക് പ്രക്രിയയുടെ ഏകദേശ മാതൃക മാത്രമേ സൃഷ്ടിക്കാൻ കഴിയൂ. എന്നിരുന്നാലും, ഹീറ്റ് എഞ്ചിനീയറിംഗിൽ നടത്തുന്ന പല തെർമോഡൈനാമിക് പ്രക്രിയകളും വളരെ വേഗത്തിൽ നടക്കുന്നു, പ്രവർത്തിക്കുന്ന ദ്രാവകത്തിനും മാധ്യമത്തിനും താപം കൈമാറ്റം ചെയ്യാൻ സമയമില്ല, അതിനാൽ, ഒരു നിശ്ചിത അളവിലുള്ള പിശകിനൊപ്പം, അത്തരം പ്രക്രിയകളെ അഡിബാറ്റിക് ആയി കണക്കാക്കാം.
മർദ്ദവും വോളിയവും സംബന്ധിച്ച ഒരു സമവാക്യം ഉണ്ടാക്കാൻ 1 കി.ഗ്രാംഒരു അഡിയാബാറ്റിക് പ്രക്രിയയിൽ വാതകം, തെർമോഡൈനാമിക്സിന്റെ ആദ്യ നിയമത്തിന്റെ സമവാക്യം ഞങ്ങൾ എഴുതുന്നു:
dq = du + pdv .
ഒരു അഡിയാബാറ്റിക് പ്രക്രിയയ്ക്ക് താപ കൈമാറ്റം dq പൂജ്യത്തിന് തുല്യമായതിനാൽ, ആന്തരിക ഊർജ്ജത്തിലെ മാറ്റം താപനിലയുടെ താപ ചാലകതയുടെ പ്രവർത്തനമാണ്: du = c v dT , അപ്പോൾ നമുക്ക് എഴുതാം:
c v dT + pdv = 0 (3) .
Clapeyron സമവാക്യം pv = RT വേർതിരിച്ചുകൊണ്ട്, നമുക്ക് ലഭിക്കുന്നത്:
pdv + vdp = RdT.
നമുക്ക് ഇവിടെ നിന്ന് dT പ്രകടിപ്പിക്കുകയും അതിനെ സമവാക്യം (3) ആക്കി മാറ്റുകയും ചെയ്യാം. പുനഃക്രമീകരണത്തിനും പരിവർത്തനങ്ങൾക്കും ശേഷം, നമുക്ക് ലഭിക്കുന്നത്:
pdvc v /(R + 1) + c v vdp/R = 0.
R = c p – c v എന്ന മേയർ സമവാക്യം കണക്കിലെടുക്കുമ്പോൾ, അവസാന പദപ്രയോഗം ഇങ്ങനെ മാറ്റിയെഴുതാം:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
തത്ഫലമായുണ്ടാകുന്ന പദപ്രയോഗത്തെ c v കൊണ്ട് ഹരിച്ച്, സമവാക്യം സമന്വയിപ്പിച്ച ശേഷം, c p / c v എന്ന അനുപാതത്തെ k അക്ഷരം കൊണ്ട് സൂചിപ്പിക്കുന്നു (4) നമുക്ക് ലഭിക്കുന്നു (at k = കോൺസ്റ്റ്):
ln vk + ln p = const അല്ലെങ്കിൽ ln pvk = const അല്ലെങ്കിൽ pvk = കോൺസ്റ്റ്.
തത്ഫലമായുണ്ടാകുന്ന സമവാക്യം ഒരു അഡിയാബാറ്റിക് പ്രക്രിയയുടെ സമവാക്യമാണ്, അതിൽ k എന്നത് അഡിയാബാറ്റിക് എക്സ്പോണന്റാണ്.
വോള്യൂമെട്രിക് ഹീറ്റ് കപ്പാസിറ്റി c v ഒരു സ്ഥിരമായ മൂല്യമാണെന്ന് ഞങ്ങൾ അനുമാനിക്കുകയാണെങ്കിൽ, അതായത് c v \u003d കോൺസ്റ്റ്, അഡിയബാറ്റിക് പ്രക്രിയയുടെ പ്രവർത്തനത്തെ ഫോർമുലയായി പ്രതിനിധീകരിക്കാം. (ഔട്ട്പുട്ട് ഇല്ലാതെ നൽകിയത്):
l \u003d c v (T 1 - T 2) അല്ലെങ്കിൽ l \u003d (p 1 v 1 - p 2 v 2) / (k-1).
പോളിട്രോപിക് പ്രക്രിയ
മുകളിൽ പരിഗണിച്ച തെർമോഡൈനാമിക് പ്രക്രിയകളിൽ നിന്ന് വ്യത്യസ്തമായി, ഏതെങ്കിലും വാതക പാരാമീറ്ററുകൾ മാറ്റമില്ലാതെ തുടരുമ്പോൾ, ഏതെങ്കിലും പ്രധാന ഗ്യാസ് പാരാമീറ്ററുകൾ മാറ്റാനുള്ള സാധ്യതയാണ് പോളിട്രോപിക് പ്രക്രിയയുടെ സവിശേഷത. മുകളിലുള്ള എല്ലാ തെർമോഡൈനാമിക് പ്രക്രിയകളും പോളിട്രോപിക് പ്രക്രിയകളുടെ പ്രത്യേക കേസുകളാണ്.
പോളിട്രോപിക് പ്രക്രിയയുടെ പൊതുവായ സമവാക്യത്തിന് pv n = const എന്ന രൂപമുണ്ട്, ഇവിടെ n എന്നത് പോളിട്രോപിക് സൂചികയാണ് - ഈ പ്രക്രിയയുടെ സ്ഥിരമായ മൂല്യം, ഇതിന് - ∞ മുതൽ + ∞ വരെയുള്ള മൂല്യങ്ങൾ എടുക്കാം.
പോളിട്രോപിക് സൂചികയ്ക്ക് ചില മൂല്യങ്ങൾ നൽകുന്നതിലൂടെ, ഒന്നോ അല്ലെങ്കിൽ മറ്റൊരു തെർമോഡൈനാമിക് പ്രക്രിയ നേടാനാകുമെന്ന് വ്യക്തമാണ് - ഐസോകോറിക്, ഐസോബാറിക്, ഐസോതെർമൽ അല്ലെങ്കിൽ അഡിയബാറ്റിക്.
അതിനാൽ, നമ്മൾ n = 0 എടുക്കുകയാണെങ്കിൽ, നമുക്ക് p = കോൺസ്റ്റ് ലഭിക്കും - ഒരു ഐസോബാറിക് പ്രക്രിയ, നമ്മൾ n = 1 എടുക്കുകയാണെങ്കിൽ, ആശ്രിതത്വം pv = കോൺസ്റ്റ് വിവരിക്കുന്ന ഒരു ഐസോതെർമൽ പ്രക്രിയ ലഭിക്കും; n = k ന് പ്രക്രിയ അഡിയാബാറ്റിക് ആണ്, കൂടാതെ n ന് - ∞ അല്ലെങ്കിൽ + ∞ ന് തുല്യമാണ്. നമുക്ക് ഒരു ഐസോകോറിക് പ്രക്രിയ ലഭിക്കുന്നു.
USE കോഡിഫയറിന്റെ വിഷയങ്ങൾ: ഐസോപ്രോസസ് - ഐസോതെർമൽ, ഐസോകോറിക്, ഐസോബാറിക് പ്രക്രിയകൾ.
ഈ ലഘുലേഖയിലുടനീളം, ഞങ്ങൾ ഇനിപ്പറയുന്ന അനുമാനം പാലിക്കും: വാതകത്തിന്റെ പിണ്ഡവും രാസഘടനയും മാറ്റമില്ലാതെ തുടരുന്നു. മറ്റൊരു വിധത്തിൽ പറഞ്ഞാൽ, ഞങ്ങൾ വിശ്വസിക്കുന്നു:
അതായത്, പാത്രത്തിൽ നിന്ന് വാതക ചോർച്ച ഇല്ല, അല്ലെങ്കിൽ, പാത്രത്തിലേക്ക് വാതക പ്രവാഹം ഇല്ല;
അതായത്, വാതക കണികകൾക്ക് മാറ്റങ്ങളൊന്നും അനുഭവപ്പെടില്ല (പറയുക, വിഘടനം ഇല്ല - തന്മാത്രകളുടെ ആറ്റങ്ങളിലേക്കുള്ള ക്ഷയം).
ഈ രണ്ട് വ്യവസ്ഥകളും ശാരീരികമായി രസകരമായ നിരവധി സാഹചര്യങ്ങളിൽ സംതൃപ്തമാണ് (ഉദാഹരണത്തിന്, ചൂട് എഞ്ചിനുകളുടെ ലളിതമായ മോഡലുകളിൽ) അതിനാൽ ഒരു പ്രത്യേക പരിഗണന അർഹിക്കുന്നു.
ഒരു വാതകത്തിന്റെ പിണ്ഡവും അതിന്റെ മോളാർ പിണ്ഡവും നിശ്ചയിച്ചിട്ടുണ്ടെങ്കിൽ, വാതകത്തിന്റെ അവസ്ഥ നിർണ്ണയിക്കപ്പെടുന്നു മൂന്ന്മാക്രോസ്കോപ്പിക് പാരാമീറ്ററുകൾ: മർദ്ദം, വോളിയംഒപ്പം താപനില. ഈ പരാമീറ്ററുകൾ സംസ്ഥാനത്തിന്റെ സമവാക്യം (മെൻഡലീവ്-ക്ലാപ്പിറോൺ സമവാക്യം) വഴി പരസ്പരം ബന്ധപ്പെട്ടിരിക്കുന്നു.
തെർമോഡൈനാമിക് പ്രക്രിയ(അല്ലെങ്കിൽ ലളിതമായി പ്രക്രിയ) കാലക്രമേണ വാതകാവസ്ഥയിലുണ്ടാകുന്ന മാറ്റമാണ്. തെർമോഡൈനാമിക് പ്രക്രിയയിൽ, മാക്രോസ്കോപ്പിക് പാരാമീറ്ററുകളുടെ മൂല്യങ്ങൾ മാറുന്നു - മർദ്ദം, വോളിയം, താപനില.
പ്രത്യേക താൽപ്പര്യമുള്ളവയാണ് ഐസോപ്രോസസുകൾ- മാക്രോസ്കോപ്പിക് പാരാമീറ്ററുകളിലൊന്നിന്റെ മൂല്യം മാറ്റമില്ലാതെ തുടരുന്ന തെർമോഡൈനാമിക് പ്രക്രിയകൾ. മൂന്ന് പാരാമീറ്ററുകളിൽ ഓരോന്നും ശരിയാക്കുമ്പോൾ, നമുക്ക് മൂന്ന് തരം ഐസോപ്രോസസുകൾ ലഭിക്കും.
1. ഐസോതെർമൽ പ്രക്രിയസ്ഥിരമായ വാതക താപനിലയിൽ പോകുന്നു: .
2. ഐസോബാറിക് പ്രക്രിയസ്ഥിരമായ വാതക സമ്മർദ്ദത്തിൽ പ്രവർത്തിക്കുന്നു: .
3. ഐസോകോറിക് പ്രക്രിയവാതകത്തിന്റെ സ്ഥിരമായ അളവിൽ പോകുന്നു: .
മാരിയോട്ട്, ഗേ-ലുസാക്ക്, ചാൾസ് - ബോയിലിന്റെ വളരെ ലളിതമായ നിയമങ്ങളാൽ ഐസോപ്രോസസുകളെ വിവരിക്കുന്നു. നമുക്ക് അവ പഠിക്കാൻ പോകാം.
ഐസോതെർമൽ പ്രക്രിയ
ഒരു ആദർശ വാതകം ഒരു താപനിലയിൽ ഒരു ഐസോതെർമൽ പ്രക്രിയ നടത്തട്ടെ. പ്രക്രിയയിൽ, വാതകത്തിന്റെ മർദ്ദവും അതിന്റെ വോള്യവും മാത്രം മാറുന്നു.
വാതകത്തിന്റെ രണ്ട് ഏകപക്ഷീയമായ അവസ്ഥകൾ പരിഗണിക്കുക: അവയിലൊന്നിൽ, മാക്രോസ്കോപ്പിക് പാരാമീറ്ററുകളുടെ മൂല്യങ്ങൾ , രണ്ടാമത്തേതിൽ, അവ . ഈ മൂല്യങ്ങൾ മെൻഡലീവ്-ക്ലാപ്പിറോൺ സമവാക്യവുമായി ബന്ധപ്പെട്ടിരിക്കുന്നു:
ഞങ്ങൾ ആദ്യം മുതൽ പറഞ്ഞതുപോലെ, പിണ്ഡവും മോളാർ പിണ്ഡവും സ്ഥിരമാണെന്ന് അനുമാനിക്കപ്പെടുന്നു.
അതിനാൽ, എഴുതിയ സമവാക്യങ്ങളുടെ ശരിയായ ഭാഗങ്ങൾ തുല്യമാണ്. അതിനാൽ, ഇടത് വശവും തുല്യമാണ്:
(1)
വാതകത്തിന്റെ രണ്ട് സംസ്ഥാനങ്ങൾ ഏകപക്ഷീയമായി തിരഞ്ഞെടുത്തതിനാൽ, നമുക്ക് അത് നിഗമനം ചെയ്യാം ഒരു ഐസോതെർമൽ പ്രക്രിയയിൽ, വാതക സമ്മർദ്ദത്തിന്റെയും വോളിയത്തിന്റെയും ഉൽപ്പന്നം സ്ഥിരമായി തുടരുന്നു:
(2)
ഈ പ്രസ്താവനയെ വിളിക്കുന്നു ബോയിലിന്റെ നിയമം - മാരിയോട്ട്.
ബോയിൽ-മാരിയറ്റ് നിയമം രൂപത്തിൽ എഴുതിയിട്ടുണ്ട്
(3)
ഒരാൾക്ക് ഇത് ഇതുപോലെ രൂപപ്പെടുത്താനും കഴിയും: ഒരു ഐസോതെർമൽ പ്രക്രിയയിൽ, ഒരു വാതകത്തിന്റെ മർദ്ദം അതിന്റെ വോള്യത്തിന് വിപരീത അനുപാതത്തിലാണ്.. ഉദാഹരണത്തിന്, ഒരു വാതകത്തിന്റെ ഐസോതെർമൽ വികാസ സമയത്ത്, അതിന്റെ അളവ് മൂന്ന് മടങ്ങ് വർദ്ധിക്കുന്നുവെങ്കിൽ, വാതകത്തിന്റെ മർദ്ദം മൂന്ന് മടങ്ങ് കുറയുന്നു.
ശാരീരിക വീക്ഷണകോണിൽ നിന്ന് സമ്മർദ്ദവും വോളിയവും തമ്മിലുള്ള വിപരീത ബന്ധം എങ്ങനെ വിശദീകരിക്കാം? സ്ഥിരമായ താപനിലയിൽ, വാതക തന്മാത്രകളുടെ ശരാശരി ഗതികോർജ്ജം മാറ്റമില്ലാതെ തുടരുന്നു, അതായത്, ലളിതമായി പറഞ്ഞാൽ, പാത്രത്തിന്റെ ചുമരുകളിൽ തന്മാത്രകളുടെ സ്വാധീനത്തിന്റെ ശക്തി മാറില്ല. വോളിയം കൂടുന്നതിനനുസരിച്ച്, തന്മാത്രകളുടെ സാന്ദ്രത കുറയുന്നു, അതനുസരിച്ച്, മതിലിന്റെ ഒരു യൂണിറ്റ് ഏരിയയിൽ ഒരു യൂണിറ്റ് സമയത്തിന് തന്മാത്രാ ആഘാതങ്ങളുടെ എണ്ണം കുറയുന്നു - വാതക മർദ്ദം കുറയുന്നു. നേരെമറിച്ച്, വോളിയം കുറയുന്നതോടെ, തന്മാത്രകളുടെ സാന്ദ്രത വർദ്ധിക്കുന്നു, അവയുടെ ആഘാതങ്ങൾ പതിവായി, വാതകത്തിന്റെ മർദ്ദം വർദ്ധിക്കുന്നു.
ഐസോതെർമൽ പ്രോസസ് ഗ്രാഫുകൾ
പൊതുവേ, ഇനിപ്പറയുന്ന കോർഡിനേറ്റ് സിസ്റ്റങ്ങളിൽ തെർമോഡൈനാമിക് പ്രക്രിയകളുടെ ഗ്രാഫുകൾ ചിത്രീകരിക്കുന്നത് പതിവാണ്:
-ഡയഗ്രം: abscissa axis, ordinate axis;
-ഡയഗ്രം: abscissa axis, ordinate axis.
ഒരു ഐസോതെർമൽ പ്രക്രിയയുടെ ഗ്രാഫ് എന്ന് വിളിക്കുന്നു ഐസോതെർം.
ചാർട്ടിലെ ഒരു ഐസോതെർം വിപരീത അനുപാതത്തിലുള്ള പ്ലോട്ടാണ്.
അത്തരമൊരു ഗ്രാഫ് ഒരു ഹൈപ്പർബോളയാണ് (ബീജഗണിതം ഓർക്കുക - ഫംഗ്ഷൻ ഗ്രാഫ്). ഐസോതെർം-ഹൈപ്പർബോള അത്തിപ്പഴത്തിൽ കാണിച്ചിരിക്കുന്നു. 1 .

അരി. 1. ഐസോതെർം ഓൺ -ഡയഗ്രം
ഓരോ ഐസോതെർമും ഒരു നിശ്ചിത താപനില മൂല്യവുമായി പൊരുത്തപ്പെടുന്നു. അത് മാറുന്നു ഉയർന്ന ഊഷ്മാവ്, ഉയർന്ന ഐസോതെർം സ്ഥിതിചെയ്യുന്നു -ഡയഗ്രം.
തീർച്ചയായും, ഒരേ വാതകം നടത്തുന്ന രണ്ട് ഐസോതെർമൽ പ്രക്രിയകൾ നമുക്ക് പരിഗണിക്കാം (ചിത്രം 2). ആദ്യ പ്രക്രിയ ഒരു താപനിലയിൽ നടക്കുന്നു, രണ്ടാമത്തേത് - ഒരു താപനിലയിൽ.

അരി. 2. ഉയർന്ന താപനില, ഉയർന്ന ഐസോതെർം
വോളിയത്തിന്റെ ചില മൂല്യങ്ങൾ ഞങ്ങൾ ഉറപ്പിക്കുന്നു. ആദ്യത്തെ ഐസോതെർമിൽ അത് മർദ്ദവുമായി പൊരുത്തപ്പെടുന്നു, രണ്ടാമത്തേതിൽ - class="tex" alt="p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
ശേഷിക്കുന്ന രണ്ട് കോർഡിനേറ്റ് സിസ്റ്റങ്ങളിൽ, ഐസോതെർം വളരെ ലളിതമായി കാണപ്പെടുന്നു: ഇത് അക്ഷത്തിന് ലംബമായ ഒരു നേർരേഖയാണ് (ചിത്രം 3):

അരി. 3. ഐസോതെർമുകൾ ഓൺ ആൻഡ് -ഡയഗ്രമുകൾ
ഐസോബാറിക് പ്രക്രിയ
ഐസോബാറിക് പ്രക്രിയ നിരന്തരമായ സമ്മർദ്ദത്തിൽ നടക്കുന്ന ഒരു പ്രക്രിയയാണെന്ന് ഒരിക്കൽ കൂടി ഓർക്കുക. ഐസോബാറിക് പ്രക്രിയയിൽ, വാതകത്തിന്റെ അളവും അതിന്റെ താപനിലയും മാത്രം മാറുന്നു.
ഐസോബാറിക് പ്രക്രിയയുടെ ഒരു സാധാരണ ഉദാഹരണം: സ്വതന്ത്രമായി നീങ്ങാൻ കഴിയുന്ന ഒരു വലിയ പിസ്റ്റണിന് കീഴിലാണ് വാതകം. പിസ്റ്റണിന്റെ പിണ്ഡവും പിസ്റ്റണിന്റെ ക്രോസ് സെക്ഷനും ആണെങ്കിൽ, വാതക മർദ്ദം സ്ഥിരവും തുല്യവുമാണ്
അന്തരീക്ഷമർദ്ദം എവിടെയാണ്.
ഒരു ആദർശ വാതകം സമ്മർദ്ദത്തിൽ ഐസോബാറിക് പ്രക്രിയ നടത്തട്ടെ. വാതകത്തിന്റെ രണ്ട് ഏകപക്ഷീയമായ അവസ്ഥകൾ വീണ്ടും പരിഗണിക്കുക; ഈ സമയം മാക്രോസ്കോപ്പിക് പാരാമീറ്ററുകളുടെ മൂല്യങ്ങൾ തുല്യമായിരിക്കും.
നമുക്ക് സംസ്ഥാനത്തിന്റെ സമവാക്യങ്ങൾ എഴുതാം:
അവയെ പരസ്പരം വിഭജിക്കുമ്പോൾ, നമുക്ക് ലഭിക്കുന്നത്:
തത്വത്തിൽ, ഇത് ഇതിനകം മതിയാകും, പക്ഷേ ഞങ്ങൾ കുറച്ചുകൂടി മുന്നോട്ട് പോകും. തത്ഫലമായുണ്ടാകുന്ന ബന്ധം നമുക്ക് മാറ്റിയെഴുതാം, അതിലൂടെ ആദ്യത്തെ അവസ്ഥയുടെ പാരാമീറ്ററുകൾ മാത്രമേ ഒരു ഭാഗത്ത് ദൃശ്യമാകൂ, രണ്ടാമത്തെ അവസ്ഥയുടെ പാരാമീറ്ററുകൾ മാത്രമേ മറ്റൊരു ഭാഗത്ത് ദൃശ്യമാകൂ (മറ്റൊരു രീതിയിൽ പറഞ്ഞാൽ, ഞങ്ങൾ "സൂചികകളെ വ്യത്യസ്ത ഭാഗങ്ങളായി വിഭജിക്കുന്നു"):
(4)
ഇപ്പോൾ ഇവിടെ നിന്ന് - സംസ്ഥാനങ്ങളുടെ തിരഞ്ഞെടുപ്പിന്റെ ഏകപക്ഷീയത കണക്കിലെടുത്ത്! - നമുക്ക് ലഭിക്കും ഗേ-ലുസാക്കിന്റെ നിയമം:
(5)
മറ്റൊരു വാക്കിൽ, സ്ഥിരമായ മർദ്ദത്തിൽ, വാതകത്തിന്റെ അളവ് അതിന്റെ താപനിലയ്ക്ക് നേരിട്ട് ആനുപാതികമാണ്.:
(6)
താപനിലയനുസരിച്ച് വോളിയം വർദ്ധിക്കുന്നത് എന്തുകൊണ്ട്? താപനില ഉയരുമ്പോൾ, തന്മാത്രകൾ ശക്തമായി അടിക്കാനും പിസ്റ്റൺ ഉയർത്താനും തുടങ്ങുന്നു. അതേ സമയം, തന്മാത്രകളുടെ സാന്ദ്രത കുറയുന്നു, ആഘാതം കുറയുന്നു, അങ്ങനെ അവസാനം മർദ്ദം അതേപടി തുടരുന്നു.
ഐസോബാറിക് പ്രക്രിയയുടെ പ്ലോട്ടുകൾ
ഐസോബാറിക് പ്രക്രിയയുടെ ഗ്രാഫ് എന്ന് വിളിക്കുന്നു ഐസോബാർ. ഡയഗ്രാമിൽ, ഐസോബാർ ഒരു നേർരേഖയാണ് (ചിത്രം 4):

അരി. 4. ഐസോബാർ ഓൺ -ഡയഗ്രം
ഗ്രാഫിന്റെ ഡോട്ട് ഇട്ട വിഭാഗം അർത്ഥമാക്കുന്നത്, മതിയായ കുറഞ്ഞ താപനിലയിൽ ഒരു യഥാർത്ഥ വാതകത്തിന്റെ കാര്യത്തിൽ, അനുയോജ്യമായ വാതക മോഡൽ (അതിനൊപ്പം ഗേ-ലുസാക് നിയമവും) പ്രവർത്തിക്കുന്നത് നിർത്തുന്നു എന്നാണ്. തീർച്ചയായും, താപനില കുറയുന്നതിനനുസരിച്ച്, വാതക കണങ്ങൾ കൂടുതൽ കൂടുതൽ സാവധാനത്തിൽ നീങ്ങുന്നു, കൂടാതെ ഇന്റർമോളിക്യുലർ ഇന്ററാക്ഷന്റെ ശക്തികൾ അവയുടെ ചലനത്തെ ഗണ്യമായി സ്വാധീനിക്കുന്നു (ഒരു സാമ്യം: വേഗത കുറഞ്ഞ പന്തിനേക്കാൾ പിടിക്കാൻ എളുപ്പമാണ്). നന്നായി, വളരെ താഴ്ന്ന ഊഷ്മാവിൽ, വാതകങ്ങൾ ദ്രാവകമായി മാറുന്നു.
മർദ്ദത്തിലെ മാറ്റത്തിനൊപ്പം ഐസോബാറിന്റെ സ്ഥാനം എങ്ങനെ മാറുന്നുവെന്ന് ഇപ്പോൾ നമുക്ക് കണ്ടെത്താം. അത് മാറുന്നു മർദ്ദം കൂടുന്തോറും ഐസോബാർ കുറയുന്നു. -ഡയഗ്രം.
ഇത് സ്ഥിരീകരിക്കുന്നതിന്, സമ്മർദ്ദങ്ങളുള്ള രണ്ട് ഐസോബാറുകൾ പരിഗണിക്കുക കൂടാതെ (ചിത്രം 5):

അരി. 5. ഐസോബാർ താഴ്ന്നാൽ മർദ്ദം കൂടും
നമുക്ക് താപനിലയുടെ ചില മൂല്യങ്ങൾ നിശ്ചയിക്കാം. ഞങ്ങൾ അത് കാണുന്നു. എന്നാൽ ഒരു നിശ്ചിത ഊഷ്മാവിൽ, വോളിയം ചെറുതായിരിക്കും, സമ്മർദ്ദം കൂടുതലാണ് (ബോയ്ലിന്റെ നിയമം - മാരിയോട്ട്!).
അതിനാൽ class="tex" alt="p_2 > p_1"> .!}
ശേഷിക്കുന്ന രണ്ട് കോർഡിനേറ്റ് സിസ്റ്റങ്ങളിൽ, ഐസോബാർ അക്ഷത്തിന് ലംബമായ ഒരു നേർരേഖയാണ് (ചിത്രം 6):

അരി. 6. ഐസോബാറുകൾ ഓൺ ആൻഡ് -ഡയഗ്രമുകൾ
ഐസോകോറിക് പ്രക്രിയ
ഒരു ഐസോകോറിക് പ്രക്രിയ, ഒരു സ്ഥിരമായ വോളിയത്തിൽ നടക്കുന്ന ഒരു പ്രക്രിയയാണ്. ഒരു ഐസോകോറിക് പ്രക്രിയയിൽ, വാതകത്തിന്റെ മർദ്ദവും അതിന്റെ താപനിലയും മാത്രം മാറുന്നു.
ഒരു ഐസോകോറിക് പ്രക്രിയ സങ്കൽപ്പിക്കാൻ വളരെ ലളിതമാണ്: ഇത് ഒരു നിശ്ചിത വോള്യത്തിന്റെ (അല്ലെങ്കിൽ പിസ്റ്റൺ ഉറപ്പിക്കുമ്പോൾ ഒരു പിസ്റ്റണിന് താഴെയുള്ള ഒരു സിലിണ്ടറിൽ) ഒരു കർക്കശമായ പാത്രത്തിൽ നടക്കുന്ന ഒരു പ്രക്രിയയാണ്.
വോള്യമുള്ള ഒരു പാത്രത്തിൽ ഒരു ഐസോകോറിക് പ്രക്രിയ നടത്താൻ അനുയോജ്യമായ വാതകം അനുവദിക്കുക. വീണ്ടും, പാരാമീറ്ററുകൾ ഉള്ള രണ്ട് അനിയന്ത്രിതമായ വാതക അവസ്ഥകൾ പരിഗണിക്കുക. നമുക്ക് ഉണ്ട്:
ഞങ്ങൾ ഈ സമവാക്യങ്ങളെ പരസ്പരം വിഭജിക്കുന്നു:
ഗേ-ലുസാക് നിയമത്തിന്റെ വ്യുൽപ്പന്നത്തിലെന്നപോലെ, ഞങ്ങൾ സൂചികകളെ വ്യത്യസ്ത ഭാഗങ്ങളായി "വിഭജിക്കുന്നു":
(7)
സംസ്ഥാനങ്ങളുടെ തിരഞ്ഞെടുപ്പിന്റെ ഏകപക്ഷീയത കണക്കിലെടുത്ത്, ഞങ്ങൾ എത്തിച്ചേരുന്നു ചാൾസ് നിയമം:
(8)
മറ്റൊരു വാക്കിൽ, ഒരു വാതകത്തിന്റെ സ്ഥിരമായ അളവിൽ, അതിന്റെ മർദ്ദം അതിന്റെ താപനിലയ്ക്ക് നേരിട്ട് ആനുപാതികമാണ്.:
(9)
ഒരു നിശ്ചിത അളവിലുള്ള വാതകം ചൂടാക്കുമ്പോൾ അതിന്റെ മർദ്ദം വർദ്ധിക്കുന്നത് ഭൗതിക വീക്ഷണകോണിൽ നിന്ന് തികച്ചും വ്യക്തമായ ഒരു കാര്യമാണ്. നിങ്ങൾക്ക് അത് സ്വയം വിശദീകരിക്കാൻ എളുപ്പമാണ്.
ഐസോകോറിക് പ്രോസസ് പ്ലോട്ടുകൾ
ഐസോകോറിക് പ്രക്രിയയുടെ ഗ്രാഫ് എന്ന് വിളിക്കുന്നു ഐസോകോർ. ഡയഗ്രാമിൽ, ഐസോകോർ ഒരു നേർരേഖയാണ് (ചിത്രം 7):

അരി. 7. ഐസോചോർ ഓൺ -ഡയഗ്രം
ഡോട്ട് ചെയ്ത പ്രദേശത്തിന്റെ അർത്ഥം ഒന്നുതന്നെയാണ്: കുറഞ്ഞ താപനിലയിൽ അനുയോജ്യമായ വാതക മോഡലിന്റെ അപര്യാപ്തത.

അരി. 8. ഐസോചോർ കുറയുന്തോറും വോളിയം കൂടും
തെളിവ് മുമ്പത്തേതിന് സമാനമാണ്. ഞങ്ങൾ താപനില ശരിയാക്കി അത് കാണുന്നു. എന്നാൽ ഒരു നിശ്ചിത ഊഷ്മാവിൽ, മർദ്ദം ചെറുതും വലുതുമായ വോള്യം (വീണ്ടും, ബോയിൽ-മരിയറ്റ് നിയമം). അതിനാൽ class="tex" alt="V_2 > V_1"> .!}
ശേഷിക്കുന്ന രണ്ട് കോർഡിനേറ്റ് സിസ്റ്റങ്ങളിൽ, ഐസോകോർ അക്ഷത്തിന് ലംബമായ ഒരു നേർരേഖയാണ് (ചിത്രം 9):

അരി. 9. ഐസോകോർസ് ഓൺ ആൻഡ് -ഡയഗ്രംസ്
ബോയിലിന്റെ നിയമങ്ങൾ - മാരിയോട്ട്, ഗേ-ലുസാക്ക്, ചാൾസ് എന്നിവയും വിളിക്കപ്പെടുന്നു വാതക നിയമങ്ങൾ.
മെൻഡലീവ്-ക്ലാപ്പൈറോൺ സമവാക്യത്തിൽ നിന്നാണ് ഞങ്ങൾ വാതക നിയമങ്ങൾ ഉരുത്തിരിഞ്ഞത്. എന്നാൽ ചരിത്രപരമായി ഇത് വിപരീതമായിരുന്നു: വാതക നിയമങ്ങൾ പരീക്ഷണാടിസ്ഥാനത്തിൽ സ്ഥാപിക്കപ്പെട്ടു, വളരെ നേരത്തെ തന്നെ. സംസ്ഥാനത്തിന്റെ സമവാക്യം പിന്നീട് അവയുടെ സാമാന്യവൽക്കരണമായി പ്രത്യക്ഷപ്പെട്ടു.
ഐസോബാറിക് പ്രക്രിയ
വ്യത്യസ്ത കോർഡിനേറ്റ് സിസ്റ്റങ്ങളിലെ ഐസോപ്രോസസുകളുടെ പ്ലോട്ടുകൾ
ഐസോബാറിക് പ്രക്രിയ(മറ്റ് ഗ്രീക്ക് ισος, isos - "അതേ" + βαρος, ബറോസ് - "ഭാരം") - സ്ഥിരമായ മർദ്ദത്തിൽ ഒരു തെർമോഡൈനാമിക് സിസ്റ്റത്തിന്റെ അവസ്ഥ മാറ്റുന്ന പ്രക്രിയ ()
സ്ഥിരമായ മർദ്ദത്തിൽ വാതകത്തിന്റെ അളവ് താപനിലയെ ആശ്രയിക്കുന്നത് 1802-ൽ ജോസഫ് ലൂയിസ് ഗേ-ലുസാക്ക് പരീക്ഷണാത്മകമായി അന്വേഷിച്ചു. ഗേ-ലുസാക്കിന്റെ നിയമം: സ്ഥിരമായ സമ്മർദ്ദത്തിലും ഒരു വാതകത്തിന്റെ പിണ്ഡത്തിന്റെയും അതിന്റെ മോളാർ പിണ്ഡത്തിന്റെയും സ്ഥിരമായ മൂല്യങ്ങളിലും, ഒരു വാതകത്തിന്റെ അളവും അതിന്റെ കേവല താപനിലയും തമ്മിലുള്ള അനുപാതം സ്ഥിരമായി തുടരുന്നു: V / T = const.
ഐസോകോറിക് പ്രക്രിയ
ഐസോകോറിക് പ്രക്രിയ(ഗ്രീക്ക് കോറസിൽ നിന്ന് - അധിനിവേശ സ്ഥലം) - സ്ഥിരമായ അളവിൽ () ഒരു തെർമോഡൈനാമിക് സിസ്റ്റത്തിന്റെ അവസ്ഥ മാറ്റുന്ന പ്രക്രിയ. അനുയോജ്യമായ വാതകങ്ങൾക്ക്, ഐസോകോറിക് പ്രക്രിയയെ ചാൾസിന്റെ നിയമം വിവരിക്കുന്നു: ഒരു നിശ്ചിത അളവിൽ വാതക പിണ്ഡത്തിന്, സമ്മർദ്ദം താപനിലയ്ക്ക് നേരിട്ട് ആനുപാതികമാണ്:
ഒരു ഡയഗ്രാമിൽ ഒരു ഐസോകോറിക് പ്രക്രിയയെ ചിത്രീകരിക്കുന്ന വരിയെ ഐസോകോർ എന്ന് വിളിക്കുന്നു.
വാതകത്തിന് നൽകുന്ന ഊർജ്ജം ആന്തരിക ഊർജ്ജം മാറ്റുന്നതിനാണ് ചെലവഴിക്കുന്നത് എന്നതും എടുത്തുപറയേണ്ടതാണ്, അതായത് Q = 3* ν*R*T/2=3*V*ΔP, ഇവിടെ R എന്നത് സാർവത്രിക വാതക സ്ഥിരാങ്കമാണ്, ν എന്നത് വാതകത്തിലെ മോളുകളുടെ എണ്ണമാണ്, T എന്നത് കെൽവിനിലെ താപനിലയാണ്, V എന്നത് വാതകത്തിന്റെ അളവാണ്, ΔP എന്നത് മർദ്ദം മാറുന്നതിന്റെ വർദ്ധനവാണ്. കൂടാതെ, ഡയഗ്രാമിലെ ഐസോകോറിക് പ്രക്രിയയെ ചിത്രീകരിക്കുന്ന ലൈൻ, പി(ടി) അക്ഷങ്ങളിൽ, തെറ്റിദ്ധാരണ ഉണ്ടാകാനിടയുള്ളതിനാൽ, ഉത്ഭവത്തിലേക്ക് ഒരു ഡോട്ട് ഇട്ട രേഖയുമായി ബന്ധിപ്പിക്കുകയും വിപുലീകരിക്കുകയും വേണം.
ഐസോതെർമൽ പ്രക്രിയ
ഐസോതെർമൽ പ്രക്രിയ(ഗ്രീക്കിൽ നിന്ന് "തെർമോസ്" - ചൂട്, ചൂട്) - സ്ഥിരമായ താപനിലയിൽ () () ഒരു തെർമോഡൈനാമിക് സിസ്റ്റത്തിന്റെ അവസ്ഥ മാറ്റുന്ന പ്രക്രിയ. ഐസോതെർമൽ പ്രക്രിയയെ ബോയിൽ - മാരിയോട്ട് നിയമം വിവരിക്കുന്നു:
സ്ഥിരമായ താപനിലയിലും വാതക പിണ്ഡത്തിന്റെയും അതിന്റെ മോളാർ പിണ്ഡത്തിന്റെയും സ്ഥിരമായ മൂല്യങ്ങളിലും, വാതകത്തിന്റെ അളവിന്റെയും മർദ്ദത്തിന്റെയും ഉൽപ്പന്നം സ്ഥിരമായി തുടരുന്നു: PV = const.
ഐസെൻട്രോപിക് പ്രക്രിയ
ഐസെൻട്രോപിക് പ്രക്രിയ- സ്ഥിരമായ എൻട്രോപ്പിയിൽ () തെർമോഡൈനാമിക് സിസ്റ്റത്തിന്റെ അവസ്ഥ മാറ്റുന്ന പ്രക്രിയ. ഉദാഹരണത്തിന്, റിവേഴ്സിബിൾ അഡിയാബാറ്റിക് പ്രക്രിയ ഐസെൻട്രോപിക് ആണ്: അത്തരമൊരു പ്രക്രിയയിൽ പരിസ്ഥിതിയുമായി താപ വിനിമയം ഉണ്ടാകില്ല. അത്തരമൊരു പ്രക്രിയയിലെ അനുയോജ്യമായ വാതകത്തെ ഇനിപ്പറയുന്ന സമവാക്യം വിവരിക്കുന്നു:
വാതകത്തിന്റെ തരം അനുസരിച്ച് നിർണ്ണയിക്കപ്പെടുന്ന അഡിയബാറ്റിക് എക്സ്പോണന്റ് എവിടെയാണ്.
വിക്കിമീഡിയ ഫൗണ്ടേഷൻ. 2010.
മറ്റ് നിഘണ്ടുവുകളിൽ "ഐസോപ്രോസസ്സ്" എന്താണെന്ന് കാണുക:
ഐസോപ്രോസസുകൾ തെർമോഡൈനാമിക് പ്രക്രിയകളാണ്, ഈ സമയത്ത് പിണ്ഡവും സംസ്ഥാന പാരാമീറ്ററുകളുടെ ഒരു ഭൗതിക അളവും: മർദ്ദം, വോളിയം അല്ലെങ്കിൽ താപനില മാറ്റമില്ലാതെ തുടരുന്നു. അതിനാൽ, ഒരു ഐസോബാറിക് പ്രക്രിയ സ്ഥിരമായ മർദ്ദം, ഒരു ഐസോകോറിക് വോള്യം ... വിക്കിപീഡിയ
തന്മാത്രാ ചലനാത്മക സിദ്ധാന്തം (MKT എന്ന് ചുരുക്കത്തിൽ) മൂന്ന് പ്രധാന ഏകദേശ ശരിയായ വ്യവസ്ഥകളുടെ വീക്ഷണകോണിൽ നിന്ന് ദ്രവ്യത്തിന്റെ ഘടനയെ പരിഗണിക്കുന്ന ഒരു സിദ്ധാന്തമാണ്: എല്ലാ ശരീരങ്ങളും കണികകൾ ഉൾക്കൊള്ളുന്നു, അവയുടെ വലുപ്പം അവഗണിക്കാം: ആറ്റങ്ങൾ, തന്മാത്രകൾ, അയോണുകൾ; കണികകൾ ... ... വിക്കിപീഡിയ
- (MKT എന്ന് ചുരുക്കി) മൂന്ന് പ്രധാന ഏകദേശം ശരിയായ വ്യവസ്ഥകളുടെ വീക്ഷണകോണിൽ നിന്ന് ദ്രവ്യത്തിന്റെ ഘടനയെ പരിഗണിക്കുന്ന ഒരു സിദ്ധാന്തം: എല്ലാ ശരീരങ്ങളും അവയുടെ വലിപ്പം അവഗണിക്കാവുന്ന കണങ്ങൾ ഉൾക്കൊള്ളുന്നു: ആറ്റങ്ങൾ, തന്മാത്രകൾ, അയോണുകൾ; കണികകൾ തുടർച്ചയായി ... ... വിക്കിപീഡിയ
പുസ്തകങ്ങൾ
- ഘടനാപരമായ വസ്തുക്കളുടെ രൂപഭേദം-ശക്തി സ്വഭാവസവിശേഷതകളുടെ സ്റ്റാറ്റിസ്റ്റിക്കൽ പ്രവചനം, ജി. പ്ലൂവിനാജ്, വി.ടി. സപുനോവ്, ലോഹ, പോളിമെറിക് വസ്തുക്കൾക്ക് പൊതുവായുള്ള ചലനാത്മക പ്രക്രിയകളുടെ സവിശേഷതകൾ പ്രവചിക്കുന്നതിനുള്ള ഒരു പൊതു രീതിശാസ്ത്രം നിർദ്ദേശിക്കുന്ന ഒരു പുതിയ രീതി ഈ പുസ്തകം അവതരിപ്പിക്കുന്നു. രീതി… വിഭാഗം: സർവ്വകലാശാലകൾക്കുള്ള പാഠപുസ്തകങ്ങൾപ്രസാധകൻ: