समतापीय प्रक्रियांची सारणी. आदर्श वायूंचे नियम
थर्मोडायनामिक्समधील मुख्य प्रक्रिया आहेत:
- isochoric, स्थिर व्हॉल्यूमवर वाहते;
- समसमानसतत दाबाने वाहते;
- समतापिक, स्थिर तापमानात उद्भवते;
- adiabatic, ज्यावर वातावरणासह उष्णता विनिमय होत नाही;
- पॉलीट्रॉपिक, समीकरण समाधानकारक pvn= const.
आयसोकोरिक, आयसोबॅरिक, समतापिक आणि एडियाबॅटिक प्रक्रिया ही पॉलिट्रॉपिक प्रक्रियेची विशेष प्रकरणे आहेत.
थर्मोडायनामिक प्रक्रियेच्या अभ्यासात हे निर्धारित केले जाते:
- मध्ये प्रक्रिया समीकरण p— वि आणि ट— sसमन्वय;
- गॅस स्टेट पॅरामीटर्समधील संबंध;
- अंतर्गत ऊर्जा बदल;
- बाह्य कामाचे प्रमाण;
- प्रक्रियेला पुरविलेल्या उष्णतेचे प्रमाण किंवा काढून टाकलेल्या उष्णतेचे प्रमाण.
आयसोकोरिक प्रक्रिया


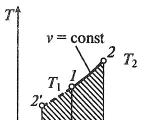
मध्ये आयसोकोरिक प्रक्रियाp, वि— , ट, s- आणिi, s- समन्वय (आकृती)
आयसोकोरिक प्रक्रियेत, स्थिती वि= const.
राज्याच्या आदर्श वायू समीकरणावरून ( pv = RT) खालीलप्रमाणे
p/T = आर/व्ही= const,
म्हणजे, गॅसचा दाब त्याच्या परिपूर्ण तापमानाशी थेट प्रमाणात असतो:
p2/p1 = T2 /T1.
आयसोकोरिक प्रक्रियेत विस्तार कार्य शून्य आहे ( l= 0), कारण कार्यरत द्रवपदार्थाचे प्रमाण बदलत नाही (Δ वि= const).
1-2 वाजता प्रक्रियेत कार्यरत द्रवपदार्थास पुरवलेल्या उष्णतेचे प्रमाण cv
q= cv(ट 2 — ट 1 ).
टी. ते. l= 0, नंतर थर्मोडायनामिक्सच्या पहिल्या नियमावर आधारित Δ u = q, याचा अर्थ असा की अंतर्गत उर्जेतील बदल सूत्राद्वारे निर्धारित केला जाऊ शकतो:
Δ u = c v (T 2 - T 1).
आयसोकोरिक प्रक्रियेतील एन्ट्रॉपीमधील बदल सूत्राद्वारे निर्धारित केला जातो:
s2–s1= Δ s = cv ln( p2/p1) = cv ln( T2 /T1).
आयसोबॅरिक प्रक्रिया



मध्ये isobaric प्रक्रियाp, वि— , ट, s- आणिi, s- समन्वय (आकृती)
आयसोबॅरिक प्रक्रिया अशी आहे जी सतत दाबाने होते. p= const. आदर्श वायूसाठी राज्याच्या समीकरणावरून ते खालीलप्रमाणे आहे:
v/T = आर/पी= const
v2/v1 = टी २ / टी १ ,
म्हणजे, आयसोबॅरिक प्रक्रियेत, वायूचे प्रमाण त्याच्या परिपूर्ण तापमानाच्या प्रमाणात असते.
काम असेल:
l = p(वि 2 – वि 1 ).
टी. ते. pv 1 = RT 1 आणि pv 2 = RT 2 , ते
l = आर(T2-T1).
येथे उष्णतेचे प्रमाण cp= const सूत्राद्वारे निर्धारित केले जाते:
q = cp(T2-T1).
एन्ट्रॉपीमध्ये होणारे बदल असे असतील:
s2–s1= Δ s = cp ln( T2 /T1).
Isothermal प्रक्रिया



मध्ये आइसोथर्मल प्रक्रियाp, वि— , ट, s- आणिi, s- समन्वय (आकृती)
समतापिक प्रक्रियेत, कार्यरत द्रवपदार्थाचे तापमान स्थिर राहते ट= const, त्यामुळे:
pv = RT= const
p2/p1 = v1/v2,
म्हणजे, दाब आणि आवाज एकमेकांच्या व्यस्त प्रमाणात असतात, ज्यामुळे समतापीय कॉम्प्रेशन दरम्यान गॅसचा दाब वाढतो आणि विस्तारादरम्यान तो कमी होतो.
प्रक्रियेचे कार्य समान असेल:
l = RT ln( v2 - v1) = RT ln( p1 - p2).
तापमान अपरिवर्तित राहिल्यामुळे, समतापीय प्रक्रियेत आदर्श वायूची अंतर्गत ऊर्जा स्थिर राहते (Δ u= 0) आणि कार्यरत द्रवपदार्थाला पुरवलेली सर्व उष्णता पूर्णपणे विस्ताराच्या कामात रूपांतरित होते:
q = l.
आयसोथर्मल कॉम्प्रेशन दरम्यान, कार्यरत द्रवपदार्थातून उष्णता संपीडनवर खर्च केलेल्या कामाच्या समान प्रमाणात काढून टाकली जाते.
एन्ट्रॉपीमध्ये होणारा बदल आहे:
s2–s1= Δ s = आर ln( p1/p2) = आर ln( v2/v1).
adiabatic प्रक्रिया



मध्ये adiabatic प्रक्रियाp, वि— , ट, s- आणिi, s- समन्वय (आकृती)
अॅडिबॅटिक प्रक्रिया म्हणजे वायूच्या स्थितीत होणारा बदल जो वातावरणाशी उष्णतेच्या देवाणघेवाणीशिवाय होतो. पासून दि q= 0, तर अॅडियाबॅटिक प्रक्रियेसाठी थर्मोडायनामिक्सच्या पहिल्या नियमाचे समीकरण हे स्वरूप असेल:
d u + p d वि = 0
Δ u+ l = 0,
म्हणून
Δ u= —l.
अॅडिबॅटिक प्रक्रियेत, विस्ताराचे कार्य केवळ वायूच्या अंतर्गत उर्जेच्या खर्चामुळे केले जाते आणि बाह्य शक्तींच्या क्रियेमुळे उद्भवणार्या कॉम्प्रेशन दरम्यान, त्यांच्याद्वारे केलेले सर्व कार्य अंतर्गत उर्जा वाढविण्याकडे जाते. गॅसचा
द्वारे adiabatic प्रक्रियेतील उष्णता क्षमता दर्शवू cनरक, आणि स्थिती डी q= 0 खालीलप्रमाणे व्यक्त केले आहे:
d q = cनरक डी ट = 0.
ही स्थिती म्हणते की अॅडिबॅटिक प्रक्रियेतील उष्णता क्षमता शून्य आहे ( cनरक = 0).
अशी माहिती आहे
सहp/cv= k
आणि adiabatic प्रक्रिया वक्र (adiabatic) मध्ये समीकरण p, वि- आकृती असे दिसते:
p.v.k= const.
या अभिव्यक्तीमध्ये kअसे म्हणतात adiabatic घातांक(याला पॉसन्सचे गुणोत्तर देखील म्हणतात).
adiabatic घातांकाची मूल्येkकाही वायूंसाठी:
kहवा = 1.4
kसुपरहिटेड स्टीम = 1.3
k ICE एक्झॉस्ट = 1.33
kसंतृप्त ओले वाफ = 1.135
मागील सूत्रांमधून खालीलप्रमाणे:
l= — Δ u = cv(ट 1 – ट 2 );
i 1 – i 2 = cp(ट 1 – ट 2 ).
अॅडिबॅटिक प्रक्रियेचे तांत्रिक कार्य ( lटेक) प्रक्रियेच्या सुरुवातीच्या आणि शेवटच्या एन्थाल्पीजमधील फरक समान आहे ( i 1 – i 2 ).
कार्यरत द्रवपदार्थातील अंतर्गत घर्षणाशिवाय उद्भवणारी अॅडिबॅटिक प्रक्रिया म्हणतात isentropic. IN ट, sआकृतीमध्ये, ते उभ्या रेषेने दर्शविले जाते.
सहसा, वास्तविक अॅडिबॅटिक प्रक्रिया कार्यरत द्रवपदार्थातील अंतर्गत घर्षणाच्या उपस्थितीत पुढे जातात, परिणामी उष्णता नेहमीच सोडली जाते, जी कार्यरत द्रवपदार्थालाच दिली जाते. या प्रकरणात दि s> 0 आणि प्रक्रिया म्हणतात वास्तविक adiabatic प्रक्रिया.
पॉलीट्रॉपिक प्रक्रिया
प्रक्रियेला पॉलीट्रॉपिक म्हणतात, ज्याचे वर्णन समीकरणाद्वारे केले जाते:
pvn= const.
पॉलीट्रॉपिक निर्देशांक n-∞ ते +∞ पर्यंत कोणतेही मूल्य घेऊ शकते, परंतु या प्रक्रियेसाठी ते स्थिर मूल्य आहे.
पॉलीट्रॉपिक प्रक्रिया समीकरण आणि क्लेपेरॉन समीकरणातून, एक अभिव्यक्ती मिळू शकते जी दरम्यान संबंध स्थापित करते p, विआणि टपॉलीट्रॉपवरील कोणत्याही दोन बिंदूंवर:
p2/p1 = (v1/v2 n; T2 /T1 = (v1/v2) n-1 ; T2 /T1 = (p2/p1) (n-1)/n .
पॉलीट्रॉपिक प्रक्रियेत वायूच्या विस्ताराचे कार्य आहे:

आदर्श वायूच्या बाबतीत, हे सूत्र रूपांतरित केले जाऊ शकते:

थर्मोडायनामिक्सचा पहिला नियम वापरून प्रक्रियेत पुरवलेल्या किंवा काढून टाकलेल्या उष्णतेचे प्रमाण निश्चित केले जाते:
q = (u 2 - u 1) + l.
कारण द

पॉलिट्रॉपिक प्रक्रियेत आदर्श वायूची उष्णता क्षमता असते.
येथे cv, kआणि n= const c n= const, म्हणून पॉलीट्रॉपिक प्रक्रिया कधीकधी स्थिर उष्णता क्षमता असलेली प्रक्रिया म्हणून परिभाषित केली जाते.
पॉलीट्रॉपिक प्रक्रियेचा एक सामान्य अर्थ आहे, कारण ती मूलभूत थर्मोडायनामिक प्रक्रियांचा संपूर्ण संच समाविष्ट करते.
मध्ये पॉलिट्रोपचे ग्राफिकल प्रतिनिधित्व p, विपॉलीट्रोप निर्देशांकावर अवलंबून समन्वय n.

pv 0= const( n= 0) isobar आहे;
pv= const( n= 1) isotherm आहे;
p 0 वि= const, p 1/∞v= const, pv∞= const - isochore;
p.v.k= const( n = k) एक अदबात आहे.
n > 0 - हायपरबोलिक वक्र,
n < 0 हे पॅराबोलास आहेत.
थर्मोडायनामिक्सवरील माझ्या व्याख्यानाच्या नोट्स आणि "उर्जेची मूलभूत तत्त्वे" या पाठ्यपुस्तकाच्या सामग्रीवर आधारित. लेखक जी.एफ. बायस्ट्रिस्की. दुसरी आवृत्ती, रेव्ह. आणि अतिरिक्त - एम.: नोरस, 2011. - 352 पी.
आयसोबॅरिक प्रक्रिया म्हणजे काय
व्याख्या
आयसोबॅरिक (किंवा आयसोबॅरिक) प्रक्रिया ही एक प्रक्रिया आहे जी स्थिर दाबाने वायूच्या स्थिर वस्तुमानात उद्भवते.
आदर्श वायूच्या दोन अवस्थांचे समीकरण लिहू.
\ \
आम्ही समीकरण (2) समीकरण (1) ने विभाजित करतो, आम्हाला आयसोबॅरिक प्रक्रियेचे समीकरण मिळते:
\[\frac(V_2)(V_1)=\frac(T_2)(T_1)\ (3)\]
\[\frac(V)(T)=const\ \left(4\right).\]
समीकरण (4) ला गे-लुसाक कायदा म्हणतात.
अंतर्गत ऊर्जा आणि आयसोबॅरिक प्रक्रियेच्या उष्णतेचे प्रमाण
व्हॉल्यूम वाढत असल्यास किंवा आवाज कमी करण्यासाठी उष्णता काढून टाकल्यास ही प्रक्रिया उष्णता इनपुटसह होते. चला थर्मोडायनामिक्सचा पहिला नियम लिहू या, आपण कार्य, अंतर्गत ऊर्जा आणि आयसोबॅरिक प्रक्रियेच्या उष्णतेचे प्रमाण क्रमशः प्राप्त करू:
\[\delta Q=dU+dA=\frac(i)(2)\nu RdT+pdV,\ \left(5\right).\] \[\triangle Q=\int\limits^(T_2)_ (T_1)(dU)+\int\limit^(V_2)_(V_1)(dA)(6)\]
जेथे $\delta Q\ $ ही प्रणालीला पुरवलेली प्राथमिक उष्णता आहे, $dU$ म्हणजे चालू प्रक्रियेत वायूच्या अंतर्गत ऊर्जेमध्ये होणारा बदल, $dA$ हे या प्रक्रियेतील वायूने केलेले प्राथमिक कार्य आहे, i वायूच्या रेणूच्या स्वातंत्र्याच्या अंशांची संख्या आहे, R हा सार्वत्रिक वायू स्थिरांक आहे, d ही वायूच्या मोलची संख्या आहे.
गॅसच्या अंतर्गत उर्जेमध्ये बदल:
\[\त्रिकोण U=\frac(i)(2)\nu R((T)_2-T_1)\ (7)\] \
समीकरण (8) आयसोबॅरिक प्रक्रियेसाठी कार्य परिभाषित करते. आम्ही समीकरण (2) मधून (1) वजा करतो, आम्हाला आयसोबॅरिक प्रक्रियेत गॅस ऑपरेशनसाठी आणखी एक समीकरण मिळते:
\ [\triangle Q=\frac(i)(2)нR((T)_2-T_1)+\nu R((T)_2-T_1)=c_(\mu p)\nu \त्रिकोण T\ ( १०),\]
जेथे $c_(\mu p)$ ही आयसोबॅरिक प्रक्रियेतील वायूची मोलर उष्णता क्षमता आहे. समीकरण (10) आयसोबॅरिक प्रक्रियेत तापमानात $\triangle T.$ ने वाढ करून m वस्तुमानाच्या वायूला दिल्या जाणाऱ्या उष्णतेचे प्रमाण ठरवते.
Isoprocesses अनेकदा थर्मोडायनामिक आकृत्यांमध्ये चित्रित केल्या जातात. तर, अशा आकृतीवर आयसोबॅरिक प्रक्रिया दर्शविणाऱ्या ओळीला आयसोबार (चित्र 1) म्हणतात.
उदाहरण १
कार्य: आकृती 1c मधील V(T) आकृतीवर $p_1$ आणि $p_2$ दबाव कसे संबंधित आहेत ते ठरवा.
आयसोथर्म $T_1$ काढा

A आणि B बिंदूंवर, तापमान समान असते, म्हणून, वायू बॉयल-मॅरिओट कायद्याचे पालन करतो:
\ \
चला हे खंड SI मध्ये रूपांतरित करू: $V_1=2l=2(\cdot 10)^(-3)m^3$, $V_2=4l=4( 10)^(-3)m^3$
चला गणना करूया:
उत्तर: आयसोबॅरिक प्रक्रियेतील वायूचे कार्य 600 J आहे.
उदाहरण ३
कार्य: ABC प्रक्रियेतील गॅसच्या कामाची आणि CDA प्रक्रियेतील गॅसच्या कामाची तुलना करा. चित्र 3.

सोल्यूशनचा आधार म्हणून, आम्ही सूत्र घेतो जे गॅसचे कार्य निर्धारित करते:
निश्चित इंटिग्रलच्या भौमितीय अर्थावरून, हे ज्ञात आहे की कार्य हे आकृतीचे क्षेत्र आहे, जे $V_1\ आणि\ V_2$ बिंदूंवरील इंटिग्रँड, अॅब्सिसिसा अक्ष आणि आयसोकोर्सच्या कार्याद्वारे मर्यादित आहे. (अक्ष p(V)). आम्ही प्रक्रिया आलेख p(V) अक्षांमध्ये भाषांतरित करतो.
आकृती (3) मध्ये दर्शविलेल्या प्रक्रियांच्या आलेखांच्या प्रत्येक विभागाचा विचार करा.
AB: आयसोकोरिक प्रक्रिया (p=const), $V\uparrow \left(\ Volume\ grows\right),\ T\uparrow $;
VS: isochoric प्रक्रिया (V =const), $T\uparrow $ (ग्राफवरून), p$\uparrow $, isochoric प्रक्रियेसाठी कायद्यातून ($\frac(p)(T)=const$);
CD: (p=const), $V\downarrow,\T\downarrow ;$
DA: (V =const), $T\downarrow,\p\downarrow .$
p(V) अक्षांमध्ये प्रक्रियांचे आलेख चित्रित करूया (चित्र 4):

गॅस वर्क $A_(ABC)=S_(ABC)$ ($S_(ABC)$ -- आयत ABFE चे क्षेत्रफळ) (चित्र 3). गॅसवर काम करा $A_(CDA)=S_(CDA)$ ($S_(CDA)$)$\ -क्षेत्र\ आयत\ $EFCD. अर्थात $A_(CDA)>A_(ABC).$
, थर्मोडायनामिक प्रक्रिया म्हणजे प्रणालीच्या स्थितीत होणारा बदल, परिणामी त्याचे किमान एक पॅरामीटर (तापमान, खंड किंवा दाब) त्याचे मूल्य बदलते. तथापि, जर आपण हे लक्षात घेतले की थर्मोडायनामिक सिस्टमचे सर्व पॅरामीटर्स अविभाज्यपणे जोडलेले आहेत, तर त्यापैकी कोणत्याही बदलामुळे कमीतकमी एक (आदर्श) किंवा अनेक (वास्तविक) पॅरामीटर्समध्ये बदल होणे अनिवार्यपणे आवश्यक आहे. सर्वसाधारणपणे, आम्ही असे म्हणू शकतो की थर्मोडायनामिक प्रक्रिया सिस्टमच्या समतोलतेच्या उल्लंघनाशी संबंधित आहे आणि जर सिस्टम समतोल स्थितीत असेल तर त्यामध्ये कोणतीही थर्मोडायनामिक प्रक्रिया होऊ शकत नाही.
प्रणालीची समतोल स्थिती ही एक अमूर्त संकल्पना आहे, कारण आजूबाजूच्या जगातून कोणतीही सामग्री वेगळी करणे अशक्य आहे, म्हणून कोणत्याही वास्तविक प्रणालीमध्ये विविध थर्मोडायनामिक प्रक्रिया अपरिहार्यपणे घडतात. त्याच वेळी, काही प्रणालींमध्ये असे संथ, जवळजवळ अगोचर बदल घडू शकतात की त्यांच्याशी संबंधित प्रक्रियांना सशर्तपणे सिस्टमच्या समतोल स्थितींचा क्रम मानला जाऊ शकतो. अशा प्रक्रियांना समतोल किंवा म्हणतात अर्ध-स्थिर.
सिस्टममध्ये लागोपाठ बदलांची दुसरी संभाव्य परिस्थिती, ज्यानंतर ती त्याच्या मूळ स्थितीकडे परत येते, असे म्हणतात गोलाकार प्रक्रियाकिंवा सायकल. समतोल आणि वर्तुळाकार प्रक्रियेच्या संकल्पना अनेक सैद्धांतिक निष्कर्ष आणि थर्मोडायनामिक्सच्या लागू पद्धतींचा अंतर्भाव करतात.
थर्मोडायनामिक प्रक्रियेच्या अभ्यासामध्ये या प्रक्रियेत केलेले कार्य, अंतर्गत उर्जेतील बदल, उष्णतेचे प्रमाण आणि वायूची स्थिती दर्शविणार्या वैयक्तिक प्रमाणांमधील संबंध प्रस्थापित करणे समाविष्ट आहे.
सर्व संभाव्य थर्मोडायनामिक प्रक्रियांपैकी, आइसोकोरिक, आइसोबॅरिक, आइसोथर्मल, एडियाबॅटिक आणि पॉलीट्रॉपिक प्रक्रिया सर्वात जास्त स्वारस्यपूर्ण आहेत.
आयसोकोरिक प्रक्रिया
आयसोकोरिक प्रक्रिया ही एक थर्मोडायनामिक प्रक्रिया आहे जी स्थिर व्हॉल्यूमवर होते. बंद भांड्यात ठेवलेला गॅस गरम करून अशी प्रक्रिया करता येते. उष्णतेच्या पुरवठ्यामुळे गॅस गरम होतो आणि त्याचा दाब वाढतो.
आयसोकोरिक प्रक्रियेतील गॅस पॅरामीटर्समधील बदल चार्ल्सच्या कायद्याचे वर्णन करतात: p 1 /T 1 \u003d p 2 /T 2, किंवा सामान्य बाबतीत:
p/T = const .
भांड्याच्या भिंतींवर वायूचा दाब वायूच्या निरपेक्ष तापमानाशी थेट प्रमाणात असतो.
आयसोकोरिक प्रक्रियेत dV मधील व्हॉल्यूममधील बदल शून्याच्या बरोबरीचा असल्याने, आपण असा निष्कर्ष काढू शकतो की गॅसला पुरवलेली सर्व उष्णता गॅसची अंतर्गत ऊर्जा बदलण्यासाठी खर्च केली जाते. (कोणतेही काम होत नाही).
आयसोबॅरिक प्रक्रिया
आयसोबॅरिक प्रक्रिया ही एक थर्मोडायनामिक प्रक्रिया आहे जी सतत दाबाने होते. अशी प्रक्रिया जंगम पिस्टनसह दाट सिलेंडरमध्ये गॅस ठेवून केली जाऊ शकते, ज्यावर उष्णता काढून टाकणे आणि पुरवठा करताना स्थिर बाह्य शक्तीद्वारे कार्य केले जाते.
जेव्हा गॅसचे तापमान बदलते तेव्हा पिस्टन एका दिशेने किंवा दुसर्या दिशेने फिरतो; गे-लुसॅकच्या कायद्यानुसार गॅसचे प्रमाण बदलत असताना:
V/T = const .
याचा अर्थ असा की आयसोबॅरिक प्रक्रियेत वायूने व्यापलेले प्रमाण तापमानाच्या थेट प्रमाणात असते.
असा निष्कर्ष काढला जाऊ शकतो की या प्रक्रियेत तापमानातील बदलामुळे वायूच्या अंतर्गत उर्जेमध्ये अपरिहार्यपणे बदल होईल आणि व्हॉल्यूममधील बदल कामाच्या कामगिरीशी संबंधित आहे, म्हणजे, आयसोबॅरिक प्रक्रियेत, थर्मलचा एक भाग. ऊर्जा गॅसची अंतर्गत ऊर्जा बदलण्यासाठी खर्च केली जाते आणि दुसरा भाग बाह्य शक्तींच्या कृतीवर मात करण्यासाठी वायूच्या कार्याच्या कामगिरीवर खर्च केला जातो. या प्रकरणात, अंतर्गत ऊर्जा वाढविण्यासाठी आणि कार्य करण्यासाठी उष्णता खर्च यांच्यातील गुणोत्तर गॅसच्या उष्णता क्षमतेवर अवलंबून असते.
Isothermal प्रक्रिया
समतापीय प्रक्रिया ही एक थर्मोडायनामिक प्रक्रिया आहे जी स्थिर तापमानात होते.
व्यवहारात गॅससह समतापिक प्रक्रिया पार पाडणे फार कठीण आहे. शेवटी, या स्थितीचे पालन करणे आवश्यक आहे की कॉम्प्रेशन किंवा विस्ताराच्या प्रक्रियेत, वायूला स्वतःचे तापमान स्थिर राखून, वातावरणासह तापमानाची देवाणघेवाण करण्याची वेळ असते.
आयसोथर्मल प्रक्रियेचे वर्णन बॉयल-मॅरिओट कायद्याद्वारे केले जाते: pV \u003d const, म्हणजे स्थिर तापमानात, वायूचा दाब त्याच्या आवाजाच्या व्यस्त प्रमाणात असतो.
स्पष्टपणे, समतापिक प्रक्रियेत, वायूची अंतर्गत ऊर्जा बदलत नाही, कारण त्याचे तापमान स्थिर असते.
गॅस तपमानाच्या स्थिरतेची अट पूर्ण करण्यासाठी, त्यातून उष्णता काढून टाकणे आवश्यक आहे, कॉम्प्रेशनवर खर्च केलेल्या कामाच्या समतुल्य:
dq = dA = pdv .
वायूच्या स्थितीचे समीकरण वापरून, अनेक परिवर्तने आणि प्रतिस्थापने करून, आपण असा निष्कर्ष काढू शकतो की समतापीय प्रक्रियेतील वायूचे कार्य अभिव्यक्तीद्वारे निर्धारित केले जाते:
A = RT ln(p 1 /p 2).
adiabatic प्रक्रिया
अॅडियाबॅटिक प्रक्रिया ही एक थर्मोडायनामिक प्रक्रिया आहे जी कार्यरत द्रव आणि वातावरण यांच्यातील उष्णतेची देवाणघेवाण न करता पुढे जाते. समतापिक प्रक्रियेप्रमाणे, सराव मध्ये अॅडिबॅटिक प्रक्रिया अंमलात आणणे खूप कठीण आहे. अशी प्रक्रिया भांड्यात ठेवलेल्या कार्यरत माध्यमासह पुढे जाऊ शकते, उदाहरणार्थ, पिस्टनसह एक सिलेंडर, उच्च-गुणवत्तेची उष्णता-इन्सुलेट सामग्रीने वेढलेला.
परंतु या प्रकरणात आपण कोणते उच्च-गुणवत्तेचे उष्मा इन्सुलेटर वापरतो हे महत्त्वाचे नाही, काही, जरी नगण्य असले तरी, कार्यरत द्रवपदार्थ आणि वातावरण यांच्यात उष्णतेचे प्रमाण अपरिहार्यपणे बदलले जाईल.
म्हणून, सराव मध्ये, एडिबॅटिक प्रक्रियेचे केवळ अंदाजे मॉडेल तयार करणे शक्य आहे. तथापि, उष्णता अभियांत्रिकीमध्ये चालविल्या जाणार्या बर्याच थर्मोडायनामिक प्रक्रिया इतक्या लवकर पुढे जातात की कार्यरत द्रवपदार्थ आणि माध्यमांना उष्णतेची देवाणघेवाण करण्यास वेळ मिळत नाही, म्हणून, विशिष्ट प्रमाणात त्रुटी असल्यास, अशा प्रक्रियांना एडिबॅटिक मानले जाऊ शकते.
दाब आणि आवाजाशी संबंधित समीकरण काढण्यासाठी 1 किलोअॅडिबॅटिक प्रक्रियेत वायू, आम्ही थर्मोडायनामिक्सच्या पहिल्या नियमाचे समीकरण लिहितो:
dq = du + pdv .
अॅडिबॅटिक प्रक्रियेसाठी उष्णता हस्तांतरण dq शून्याच्या बरोबरीचे असल्याने आणि अंतर्गत ऊर्जेतील बदल हे तापमानाच्या थर्मल चालकतेचे कार्य आहे: du = c v dT, तर आपण लिहू शकतो:
c v dT + pdv = 0 (3) .
क्लेपेयरॉन समीकरण pv = RT मध्ये फरक केल्याने आपल्याला मिळते:
pdv + vdp = RdT .
चला येथून dT व्यक्त करू आणि त्यास समीकरण (3) मध्ये बदलू. पुनर्रचना आणि परिवर्तनानंतर, आम्हाला मिळते:
pdvc v /(R + 1) + c v vdp/R = 0.
मेयर समीकरण R = c p – c v लक्षात घेऊन, शेवटची अभिव्यक्ती याप्रमाणे पुन्हा लिहिली जाऊ शकते:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0,
c p pdv + c v vdp = 0 (4) .
परिणामी अभिव्यक्तीला c v ने भागणे आणि c p/c v हे गुणोत्तर k अक्षराने दर्शवणे, समीकरण एकत्रित केल्यावर (4) आम्हाला मिळते (वर k = const):
ln vk + ln p = const किंवा ln pvk = const किंवा pvk = const .
परिणामी समीकरण हे adiabatic प्रक्रियेचे समीकरण आहे, ज्यामध्ये k हा adiabatic घातांक आहे.
जर आपण असे गृहीत धरले की व्हॉल्यूमेट्रिक उष्णता क्षमता c v हे स्थिर मूल्य आहे, म्हणजे c v \u003d const, तर adiabatic प्रक्रियेचे कार्य सूत्र म्हणून प्रस्तुत केले जाऊ शकते. (आउटपुटशिवाय दिलेले):
l \u003d c v (T 1 - T 2) किंवा l \u003d (p 1 v 1 - p 2 v 2) / (k-1).
पॉलीट्रॉपिक प्रक्रिया
वर विचारात घेतलेल्या थर्मोडायनामिक प्रक्रियेच्या विपरीत, जेव्हा कोणतेही गॅस पॅरामीटर्स अपरिवर्तित राहतात, तेव्हा पॉलीट्रॉपिक प्रक्रिया मुख्य गॅस पॅरामीटर्सपैकी कोणतेही बदलण्याची शक्यता दर्शवते. वरील सर्व थर्मोडायनामिक प्रक्रिया पॉलीट्रॉपिक प्रक्रियांचे विशेष प्रकरण आहेत.
पॉलीट्रॉपिक प्रक्रियेच्या सामान्य समीकरणामध्ये pv n = const असे स्वरूप असते, जेथे n हा पॉलीट्रॉपिक निर्देशांक असतो - या प्रक्रियेसाठी एक स्थिर मूल्य, जे - ∞ ते + ∞ पर्यंत मूल्ये घेऊ शकतात.
हे स्पष्ट आहे की पॉलीट्रॉपिक इंडेक्सला काही मूल्ये देऊन, एक किंवा दुसरी थर्मोडायनामिक प्रक्रिया प्राप्त केली जाऊ शकते - आयसोकोरिक, आयसोबॅरिक, आइसोथर्मल किंवा अॅडियाबॅटिक.
म्हणून, जर आपण n = 0 घेतला, तर आपल्याला p = const - एक आयसोबॅरिक प्रक्रिया मिळेल, जर आपण n = 1 घेतल्यास, आपल्याला अवलंबन pv = const द्वारे वर्णन केलेली समतापीय प्रक्रिया मिळेल; n = k साठी प्रक्रिया adiabatic आहे आणि n साठी - ∞ किंवा + ∞ समान आहे. आम्हाला आयसोकोरिक प्रक्रिया मिळते.
USE कोडिफायरचे विषय: isoprocesses - समतापीय, isochoric, isobaric प्रक्रिया.
या संपूर्ण पत्रकात, आम्ही खालील गृहीतकांचे पालन करू: वायूचे वस्तुमान आणि रासायनिक रचना अपरिवर्तित राहते. दुसऱ्या शब्दांत, आमचा विश्वास आहे की:
म्हणजेच, जहाजातून वायूची गळती होत नाही किंवा त्याउलट, भांड्यात वायूचा प्रवाह होतो;
म्हणजेच, वायूच्या कणांमध्ये कोणतेही बदल होत नाहीत (म्हणा, कोणतेही पृथक्करण नाही - अणूंमध्ये रेणूंचा क्षय).
या दोन अटी बर्याच शारीरिकदृष्ट्या मनोरंजक परिस्थितींमध्ये (उदाहरणार्थ, उष्णता इंजिनच्या साध्या मॉडेल्समध्ये) समाधानी आहेत आणि म्हणून वेगळ्या विचारास पात्र आहेत.
जर वायूचे वस्तुमान आणि त्याचे मोलर द्रव्यमान निश्चित केले तर वायूची स्थिती निश्चित केली जाते तीनमॅक्रोस्कोपिक पॅरामीटर्स: दबाव, आवाजआणि तापमान. हे पॅरामीटर्स राज्याच्या समीकरणाने (मेंडेलीव्ह-क्लेपेयरॉन समीकरण) एकमेकांशी संबंधित आहेत.
थर्मोडायनामिक प्रक्रिया(किंवा फक्त प्रक्रिया) कालांतराने वायूच्या स्थितीत होणारा बदल आहे. थर्मोडायनामिक प्रक्रियेदरम्यान, मॅक्रोस्कोपिक पॅरामीटर्सची मूल्ये - दाब, खंड आणि तापमान - बदलतात.
विशेष स्वारस्य आहेत isoprocesses- थर्मोडायनामिक प्रक्रिया ज्यामध्ये मॅक्रोस्कोपिक पॅरामीटर्सपैकी एकाचे मूल्य अपरिवर्तित राहते. तीन पॅरामीटर्सपैकी प्रत्येक पॅरामीटर्स बदलून निश्चित केल्याने आम्हाला तीन प्रकारच्या आयसोप्रोसेस मिळतात.
1. Isothermal प्रक्रियास्थिर वायू तापमानावर जाते: .
2. आयसोबॅरिक प्रक्रियास्थिर गॅस दाबाने चालते: .
3. आयसोकोरिक प्रक्रियागॅसच्या स्थिर व्हॉल्यूमवर जातो: .
Isoprocesses बॉयल - Mariotte, Gay-Lussac आणि Charles च्या अगदी सोप्या नियमांद्वारे वर्णन केले आहेत. चला त्यांचा अभ्यास करूया.
Isothermal प्रक्रिया
आदर्श वायूला तापमानात समतापीय प्रक्रिया करू द्या. प्रक्रियेदरम्यान, फक्त वायूचा दाब आणि त्याची मात्रा बदलते.
वायूच्या दोन अनियंत्रित अवस्थांचा विचार करा: त्यापैकी एकामध्ये, मॅक्रोस्कोपिक पॅरामीटर्सची मूल्ये आहेत, आणि दुसऱ्यामध्ये, ती आहेत. ही मूल्ये मेंडेलीव्ह-क्लेपीरॉन समीकरणाने संबंधित आहेत:
आम्ही सुरुवातीपासून म्हटल्याप्रमाणे, वस्तुमान आणि मोलर वस्तुमान स्थिर असल्याचे गृहीत धरले जाते.
म्हणून, लिखित समीकरणांचे योग्य भाग समान आहेत. म्हणून, डाव्या हाताच्या बाजू देखील समान आहेत:
(1)
वायूच्या दोन अवस्था अनियंत्रितपणे निवडल्या गेल्यामुळे, आपण असा निष्कर्ष काढू शकतो समतापीय प्रक्रियेदरम्यान, वायूचा दाब आणि आवाजाचे उत्पादन स्थिर राहते:
(2)
हे विधान म्हणतात बॉयलचा कायदा - मारिओट.
फॉर्ममध्ये बॉयल-मॅरिओट कायदा लिहिणे
(3)
कोणीही ते याप्रमाणे तयार करू शकते: समतापिक प्रक्रियेत, वायूचा दाब त्याच्या आवाजाच्या व्यस्त प्रमाणात असतो.. जर, उदाहरणार्थ, गॅसच्या समथर्मल विस्तारादरम्यान, त्याचे प्रमाण तीन पटीने वाढते, तर वायूचा दाब तीन वेळा कमी होतो.
भौतिक दृष्टिकोनातून दाब आणि आवाज यांच्यातील व्यस्त संबंध कसे स्पष्ट करावे? स्थिर तापमानात, वायूच्या रेणूंची सरासरी गतीज उर्जा अपरिवर्तित राहते, म्हणजेच, सोप्या भाषेत, जहाजाच्या भिंतींवर रेणूंच्या प्रभावाची शक्ती बदलत नाही. व्हॉल्यूमच्या वाढीसह, रेणूंची एकाग्रता कमी होते आणि त्यानुसार, भिंतीच्या प्रति युनिट क्षेत्रामध्ये प्रति युनिट वेळेनुसार आण्विक प्रभावांची संख्या कमी होते - गॅसचा दाब कमी होतो. याउलट, खंड कमी झाल्यामुळे, रेणूंची एकाग्रता वाढते, त्यांचे परिणाम अधिक वारंवार होतात आणि वायूचा दाब वाढतो.
Isothermal प्रक्रिया आलेख
सर्वसाधारणपणे, खालील समन्वय प्रणालींमध्ये थर्मोडायनामिक प्रक्रियेचे आलेख चित्रित करण्याची प्रथा आहे:
-आकृती: abscissa axis, ordinate axis;
-आकृती: abscissa axis, ordinate axis.
समतापीय प्रक्रियेचा आलेख म्हणतात isotherm.
-चार्टवरील समस्थानिक हा एक व्यस्त प्रमाणात प्लॉट आहे.
असा आलेख हा हायपरबोला आहे (बीजगणित - फंक्शन आलेख लक्षात ठेवा). आयसोथर्म-हायपरबोला अंजीर मध्ये दर्शविले आहे. १.

तांदूळ. 1. आयसोथर्म ऑन -डायग्राम
प्रत्येक समताप ठराविक निश्चित तापमान मूल्याशी संबंधित असतो. ते बाहेर वळते तापमान जितके जास्त असेल तितके संबंधित समताप जास्त असेल -आकृती.
खरंच, एकाच वायूद्वारे केल्या जाणार्या दोन समतापिक प्रक्रियांचा विचार करूया (चित्र 2). पहिली प्रक्रिया तापमानात होते, दुसरी - तापमानात.

तांदूळ. 2. तापमान जितके जास्त असेल तितके समताप
आम्ही व्हॉल्यूमचे काही मूल्य निश्चित करतो. पहिल्या इसोथर्मवर ते दाबाशी संबंधित आहे, दुसऱ्यावर - class="tex" alt="p_2 > p_1"> . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, class="tex" alt="T_2 > T_1"> .!}
उर्वरित दोन समन्वय प्रणालींमध्ये, समताप अतिशय सोपी दिसते: ती अक्षावर लंब असलेली सरळ रेषा आहे ( अंजीर 3):

तांदूळ. 3. आयसोथर्म्स ऑन आणि -डायग्राम्स
आयसोबॅरिक प्रक्रिया
पुन्हा एकदा लक्षात ठेवा की आयसोबॅरिक प्रक्रिया ही एक प्रक्रिया आहे जी सतत दाबाने होते. आयसोबॅरिक प्रक्रियेदरम्यान, केवळ वायूचे प्रमाण आणि त्याचे तापमान बदलते.
आयसोबॅरिक प्रक्रियेचे एक सामान्य उदाहरण: गॅस एका मोठ्या पिस्टनच्या खाली आहे जो मुक्तपणे फिरू शकतो. जर पिस्टनचे वस्तुमान आणि पिस्टनचा क्रॉस सेक्शन असेल तर गॅसचा दाब स्थिर आणि समान असेल
वातावरणाचा दाब कुठे आहे.
एका आदर्श वायूला दाबाने आयसोबॅरिक प्रक्रिया करू द्या. वायूच्या दोन अनियंत्रित अवस्थांचा पुन्हा विचार करा; यावेळी मॅक्रोस्कोपिक पॅरामीटर्सची मूल्ये आणि बरोबर असतील.
चला राज्याची समीकरणे लिहू:
त्यांना एकमेकांद्वारे विभाजित केल्याने आम्हाला मिळते:
तत्वतः, हे आधीच पुरेसे असू शकते, परंतु आम्ही थोडे पुढे जाऊ. परिणामी संबंध पुन्हा लिहू या जेणेकरून एका भागात फक्त पहिल्या अवस्थेचे पॅरामीटर्स दिसतील आणि दुसर्या भागामध्ये फक्त दुसऱ्या स्थितीचे पॅरामीटर्स दिसतील (दुसऱ्या शब्दात, आपण “निर्देशांकांना वेगवेगळ्या भागांमध्ये विभाजित करू”):
(4)
आणि आता इथून - राज्यांच्या निवडीची मनमानी पाहता! - आम्हाला मिळते गे-लुसाकचा कायदा:
(5)
दुसऱ्या शब्दात, स्थिर दाबाने, वायूचे प्रमाण त्याच्या तापमानाशी थेट प्रमाणात असते.:
(6)
तापमानासह आवाज का वाढतो? जसजसे तापमान वाढते तसतसे रेणू जोरात आदळू लागतात आणि पिस्टन वाढवतात. त्याच वेळी, रेणूंची एकाग्रता कमी होते, प्रभाव कमी वारंवार होतात, ज्यामुळे शेवटी दबाव समान राहतो.
आयसोबॅरिक प्रक्रियेचे प्लॉट्स
आयसोबॅरिक प्रक्रियेचा आलेख म्हणतात isobar. -आकृतीवर, आयसोबार ही सरळ रेषा आहे (चित्र 4):

तांदूळ. 4. आयसोबार ऑन -डायग्राम
ग्राफच्या ठिपक्या भागाचा अर्थ असा आहे की पुरेशा कमी तापमानात वास्तविक वायूच्या बाबतीत, आदर्श वायू मॉडेल (आणि त्यासह गे-लुसॅक कायदा) कार्य करणे थांबवते. खरंच, जसजसे तापमान कमी होत जाते, तसतसे वायूचे कण अधिकाधिक हळूहळू हलतात आणि आंतरआण्विक परस्परसंवादाच्या शक्तींचा त्यांच्या हालचालींवर वाढत्या प्रमाणात लक्षणीय प्रभाव पडतो (सादृश्य: वेगवान चेंडूपेक्षा हळू चेंडू पकडणे सोपे असते). बरं, अगदी कमी तापमानात, वायू द्रवपदार्थात बदलतात.
आता दाब बदलून आयसोबारची स्थिती कशी बदलते ते पाहू. ते बाहेर वळते दाब जितका जास्त तितका आयसोबार कमी होतो. -आकृती.
हे सत्यापित करण्यासाठी, दाबांसह दोन आयसोबारचा विचार करा आणि (चित्र 5):

तांदूळ. 5. आयसोबार जितका कमी असेल तितका जास्त दाब
तापमानाचे काही मूल्य निश्चित करूया. आम्ही ते पाहतो. परंतु एका निश्चित तापमानात, आवाज जितका लहान असेल तितका जास्त दाब (बॉयलचा नियम - मारिओट!).
म्हणून class="tex" alt="p_2 > p_1"> .!}
उर्वरित दोन समन्वय प्रणालींमध्ये, आयसोबार ही अक्षावर लंब असलेली सरळ रेषा आहे (चित्र 6):

तांदूळ. 6. Isobars चालू आणि -diagrams
आयसोकोरिक प्रक्रिया
आयसोकोरिक प्रक्रिया, आम्हाला आठवते, ही एक प्रक्रिया आहे जी स्थिर व्हॉल्यूमवर होते. आयसोकोरिक प्रक्रियेत, फक्त वायूचा दाब आणि त्याचे तापमान बदलते.
आयसोकोरिक प्रक्रियेची कल्पना करणे खूप सोपे आहे: ही एक प्रक्रिया आहे जी एका निश्चित व्हॉल्यूमच्या कठोर पात्रात (किंवा पिस्टन स्थिर असताना पिस्टनच्या खाली असलेल्या सिलेंडरमध्ये) घडते.
एका आदर्श वायूला आकारमानाच्या भांड्यात आयसोकोरिक प्रक्रिया करू द्या. पुन्हा, पॅरामीटर्ससह दोन अनियंत्रित वायू अवस्थांचा विचार करा आणि . आमच्याकडे आहे:
आम्ही ही समीकरणे एकमेकांमध्ये विभागतो:
गे-लुसाक कायद्याच्या व्युत्पत्तीप्रमाणे, आम्ही निर्देशांकांना वेगवेगळ्या भागांमध्ये "विभाजित" करतो:
(7)
राज्यांच्या निवडीतील मनमानी पाहता, आम्ही येथे पोहोचतो चार्ल्स कायदा:
(8)
दुसऱ्या शब्दात, गॅसच्या स्थिर व्हॉल्यूमवर, त्याचा दाब त्याच्या तापमानाशी थेट प्रमाणात असतो.:
(9)
स्थिर व्हॉल्यूमच्या गॅसच्या दाबात वाढ होणे ही भौतिक दृष्टीकोनातून पूर्णपणे स्पष्ट गोष्ट आहे. तुम्ही स्वतःच ते सहज समजावून सांगू शकता.
Isochoric प्रक्रिया प्लॉट्स
आयसोकोरिक प्रक्रियेचा आलेख म्हणतात isochore. -आकृतीवर, आयसोकोर ही सरळ रेषा आहे ( अंजीर 7):

तांदूळ. 7. Isochore on-diagram
ठिपके असलेल्या क्षेत्राचा अर्थ समान आहे: कमी तापमानात आदर्श गॅस मॉडेलची अपुरीता.

तांदूळ. 8. आयसोकोर जितका कमी असेल तितका मोठा आवाज
पुरावा मागील एक समान आहे. आम्ही तापमान निश्चित करतो आणि ते पाहतो. परंतु एका निश्चित तापमानात, दाब जितका लहान असेल तितका मोठा आवाज (पुन्हा, बॉयल-मॅरिओट कायदा). म्हणून class="tex" alt="V_2 > V_1"> .!}
उर्वरित दोन समन्वय प्रणालींमध्ये, आयसोकोर ही अक्षावर लंब असलेली सरळ रेषा आहे (चित्र 9):

तांदूळ. 9. Isochores चालू आणि -diagrams
बॉयलचे कायदे - मारिओट, गे-लुसाक आणि चार्ल्स यांनाही म्हणतात गॅस कायदे.
आम्ही मेंडेलीव्ह-क्लेपेयरॉन समीकरणातून वायूचे नियम घेतले. परंतु ऐतिहासिकदृष्ट्या ते उलट होते: वायूचे कायदे प्रायोगिकरित्या स्थापित केले गेले होते, आणि बरेच पूर्वी. राज्याचे समीकरण नंतर त्यांचे सामान्यीकरण म्हणून दिसून आले.
आयसोबॅरिक प्रक्रिया
वेगवेगळ्या समन्वय प्रणालींमध्ये समस्थानिक प्रक्रियांचे भूखंड
आयसोबॅरिक प्रक्रिया(इतर ग्रीक ισος, isos - "समान" + βαρος, baros - "वजन") - स्थिर दाबाने थर्मोडायनामिक प्रणालीची स्थिती बदलण्याची प्रक्रिया ()
1802 मध्ये जोसेफ लुईस गे-लुसाक यांनी स्थिर दाबाने तापमानावरील वायूच्या प्रमाणाचे अवलंबित्व प्रायोगिकरित्या तपासले होते. गे-लुसॅकचा नियम: वायूचे वस्तुमान आणि त्याच्या मोलर वस्तुमानाच्या स्थिर दाब आणि स्थिर मूल्यांवर, वायूच्या घनफळाचे त्याच्या परिपूर्ण तापमानाचे गुणोत्तर स्थिर राहते: V / T = const.
आयसोकोरिक प्रक्रिया
आयसोकोरिक प्रक्रिया(ग्रीक कोरसमधून - व्यापलेले ठिकाण) - स्थिर व्हॉल्यूम () वर थर्मोडायनामिक सिस्टमची स्थिती बदलण्याची प्रक्रिया. आदर्श वायूंसाठी, आयसोकोरिक प्रक्रियेचे वर्णन चार्ल्सच्या कायद्याद्वारे केले जाते: स्थिर व्हॉल्यूममध्ये दिलेल्या वायूच्या वस्तुमानासाठी, दाब तापमानाच्या थेट प्रमाणात असतो:
आकृतीमध्ये आयसोकोरिक प्रक्रिया दर्शविणाऱ्या रेषेला आयसोकोर म्हणतात.
हे देखील लक्षात घेण्यासारखे आहे की गॅसला पुरवलेली ऊर्जा अंतर्गत ऊर्जा बदलण्यासाठी खर्च केली जाते, म्हणजे, Q = 3*ν*R*T/2=3*V*ΔP, जिथे R हा सार्वत्रिक वायू स्थिरांक आहे, ν वायूमधील मोलची संख्या आहे, केल्विनमध्ये T हे तापमान आहे, V वायूचे प्रमाण आहे, ΔP म्हणजे दाब बदलाची वाढ. आणि चित्रातील आयसोकोरिक प्रक्रियेचे चित्रण करणारी ओळ, P(T) अक्षांमध्ये, वाढवली जावी आणि उगमाशी ठिपकेदार रेषेने जोडली जावी, कारण गैरसमज निर्माण होऊ शकतो.
Isothermal प्रक्रिया
Isothermal प्रक्रिया(ग्रीक "थर्मॉस" मधून - उबदार, गरम) - स्थिर तापमानात थर्मोडायनामिक सिस्टमची स्थिती बदलण्याची प्रक्रिया () (). समतापिक प्रक्रियेचे वर्णन बॉयल-मॅरिओट कायद्याने केले आहे:
स्थिर तापमानात आणि वायूचे वस्तुमान आणि त्याच्या मोलर वस्तुमानाची स्थिर मूल्ये, वायूचे प्रमाण आणि त्याचा दाब स्थिर राहतो: PV = const.
आइसेन्ट्रोपिक प्रक्रिया
आइसेन्ट्रोपिक प्रक्रिया- स्थिर एन्ट्रॉपी () वर थर्मोडायनामिक सिस्टमची स्थिती बदलण्याची प्रक्रिया. उदाहरणार्थ, उलट करता येण्याजोग्या अॅडियाबॅटिक प्रक्रिया isentropic आहे: अशा प्रक्रियेत वातावरणाशी उष्णता विनिमय होत नाही. अशा प्रक्रियेतील आदर्श वायूचे वर्णन खालील समीकरणाद्वारे केले जाते:
वायूच्या प्रकाराने निर्धारित केलेले अॅडिबॅटिक घातांक कोठे आहे.
विकिमीडिया फाउंडेशन. 2010
इतर शब्दकोशांमध्ये "Isoprocesses" काय आहेत ते पहा:
आयसोप्रोसेस ही थर्मोडायनामिक प्रक्रिया आहेत ज्या दरम्यान वस्तुमान आणि राज्य पॅरामीटर्सचे आणखी एक भौतिक प्रमाण: दाब, खंड किंवा तापमान अपरिवर्तित राहतात. तर, आयसोबॅरिक प्रक्रिया स्थिर दाबाशी संबंधित असते, आयसोकोरिक व्हॉल्यूम ... विकिपीडिया
आण्विक गतिज सिद्धांत (MKT म्हणून संक्षिप्त) हा एक सिद्धांत आहे जो तीन मुख्य अंदाजे योग्य तरतुदींच्या दृष्टिकोनातून पदार्थाच्या संरचनेचा विचार करतो: सर्व शरीरात कण असतात, ज्याचा आकार दुर्लक्षित केला जाऊ शकतो: अणू, रेणू आणि आयन; कण ... ... विकिपीडिया
- (MKT म्हणून संक्षिप्त) एक सिद्धांत जो तीन मुख्य अंदाजे योग्य तरतुदींच्या दृष्टिकोनातून पदार्थाच्या संरचनेचा विचार करतो: सर्व शरीरात कण असतात ज्यांचा आकार दुर्लक्षित केला जाऊ शकतो: अणू, रेणू आणि आयन; कण सतत असतात ... ... विकिपीडिया
पुस्तके
- स्ट्रक्चरल सामग्रीच्या विकृती-शक्तीच्या वैशिष्ट्यांचा सांख्यिकीय अंदाज , जी. प्लुविनाझ , व्हीटी सपुनोव्ह , हे पुस्तक एक नवीन पद्धत सादर करते जे गतिज प्रक्रियांच्या वैशिष्ट्यांचा अंदाज लावण्यासाठी एक सामान्य पद्धत प्रस्तावित करते, धातू आणि पॉलिमरिक सामग्रीसाठी सामान्य. पद्धत… वर्ग: विद्यापीठांसाठी पाठ्यपुस्तकेप्रकाशक: