Struktur av metaller. Innvendig struktur av metaller og legeringer krystallstruktur av metaller Intern struktur og egenskaper av metaller og legeringer
Bokens innholdsfortegnelse Neste side>>§ 2. Strukturen til metaller og legeringer og metoder for å studere den
Krystallstruktur av metaller. Studiet av den indre strukturen og egenskapene til metaller og legeringer er en vitenskap som kalles metallurgi.
Alle metaller og legeringer er bygget av atomer hvis ytre elektroner er svakt bundet til kjernen. Elektroner er negativt ladet og hvis du lager en liten potensialforskjell vil elektronene strømme mot den positive polen og danne en elektrisk strøm. Dette forklarer den elektriske ledningsevnen til metalliske stoffer.
Alle metaller og legeringer i fast tilstand har en krystallinsk struktur.


Krystallenhetsceller
a - kubisk kroppssentrert; b - kubisk ansiktssentrert; c - sekskantet
For en visuell representasjon av arrangementet av atomer i en krystall, brukes romlige diagrammer i form av elementære krystallinske celler. De vanligste typene krystallgitter er kroppssentrerte kubiske, ansiktssentrerte kubiske og sekskantede.
Det er ni atomer i et kubisk kroppssentrert gitter.
Krom, wolfram, molybden, vanadium og jern har et slikt gitter ved temperaturer opp til 910°C.
Det relative arrangementet av atomer i rommet, antall atomer i gitteret og interatomiske rom karakteriserer egenskapene til metallet (elektrisk ledningsevne, termisk ledningsevne, smelteevne, plastisitet, etc.).
Avstanden mellom atomer i et krystallgitter kan være forskjellig i forskjellige retninger. Derfor er egenskapene til krystallen i forskjellige retninger ikke de samme. Dette fenomenet kalles anisotropi. Alle metaller er krystallinske legemer, så de er anisotrope legemer. Kroppene hvis egenskaper er like i alle retninger kalles isotrope.
Et metallstykke som består av mange krystaller har i gjennomsnitt de samme egenskapene i alle retninger, og derfor kalles det kvasiisotropisk (imaginær isotropi).
Anisotropi er av stor praktisk betydning. For eksempel, ved smiing, stempling og valsing, oppnås riktig orientering av krystaller i deler, som et resultat av at forskjellige mekaniske egenskaper oppnås langs og på tvers av delen. Ved hjelp av kaldvalsing oppnås høye magnetiske og elektriske egenskaper i en bestemt retning av delen.
Introduksjon
Metaller er enkle stoffer som under normale forhold har karakteristiske egenskaper: høy elektrisk og termisk ledningsevne, negativ temperaturkoeffisient for elektrisk ledningsevne, evnen til å reflektere elektromagnetiske bølger godt (glans og opasitet), høy styrke og duktilitet.
Egenskapene til metaller kan endres betydelig ved svært høye trykk. Mange metaller, avhengig av temperatur og trykk, kan eksistere i form av flere krystallinske modifikasjoner.
Mer enn 80 kjemiske elementer og mange metallegeringer har lignende metalliske egenskaper. Antall metalllegeringer som brukes i teknologien teller i tusenvis og øker stadig i samsvar med de nye og mangfoldige kravene som stilles av mange bransjer.
Egenskapene til metaller bestemmes av deres krystallinske struktur og tilstedeværelsen i deres krystallgitter av mange mobile ledningselektroner som ikke er assosiert med atomkjerner.
Metallegeringer har mange egenskaper til felles med metaller, så de blir ofte klassifisert som metaller.
Metaller (legeringer) i industrien er delt inn i to hovedgrupper: jernholdige og ikke-jernholdige metaller.
Jernholdige metaller er en legering av jern og karbon, som kan inneholde andre kjemiske elementer i større eller mindre mengder. Kobolt, nikkel, samt mangan, som har lignende egenskaper, klassifiseres ofte som jernholdige metaller. Jernholdige metaller er mest utbredt, noe som skyldes det relativt høye jerninnholdet i jordskorpen, lave kostnader og høye mekaniske og teknologiske egenskaper.
Ikke-jernholdige metaller er delt inn i følgende grupper i henhold til deres egenskaper:
lett (Be, Mg, Al, Ti), med en relativt lav tetthet - opptil 5000 kg/m 3;
ildfast (Ti, Cr, Zr, Nb, Mo, W, V, etc.) med et smeltepunkt høyere enn det for jern (1539°C);
edel (Ph, Pd, Ag, Os, Pt, Au, etc.), med kjemisk treghet:
uran (U, Th, Pa) - aktinider brukt i kjernefysisk teknologi;
sjeldne jordmetaller (REM), lantanider (Ce, Pro, Nd, Sm, etc.) og lignende yttrium og skandium, brukt som tilsetningsstoffer til forskjellige legeringer;
jordalkalimetaller (Li, Na, K), brukt som kjølevæsker i atomreaktorer.
Klassifiseringen av metallegeringer etter kjemisk sammensetning, basert på indikasjonen av hovedkomponenten i legeringen (jern, kobber, aluminium, etc.), er tradisjonell i naturen og har blitt mest utbredt.
Metallografi studerer makro-, mikro- og atomstrukturen til metaller og legeringer.
Makrostruktur er strukturen til metallet, synlig for det blotte øye eller med et forstørrelsesglass i et brudd eller på et etset snitt. Mikrostrukturen til metallstrukturen, observert under optiske eller elektronmikroskoper, som gjør det mulig å forstørre det aktuelle området fra ti ganger til hundretusenvis av ganger.
Atomstrukturen til metaller er det romlige arrangementet av atomer i et krystallgitter. Denne typen struktur studeres ved hjelp av røntgenstrukturanalyse.
Metallstruktur
Alle metaller har en krystallinsk struktur. Arrangert på en eller annen måte danner atomene en elementær celle i et romlig krystallgitter. Celletypen avhenger av metallets kjemiske natur og tilstand. Den krystallinske tilstanden er for det første preget av et visst, regelmessig arrangement av atomer i rommet. Dette betyr at i en krystall har hvert atom like mange nærmeste atomer - naboer som ligger i samme avstand fra det. Under krystallisering danner positivt ladede ioner, ordnet sekvensielt i form av elementære krystallgitter, krystaller i form av korn eller dendritter. Alle metaller og legeringer har en krystallinsk struktur. De resulterende krystallene vokser, krystalliserer fra den flytende smelten først fritt, forstyrrer ikke hverandre, deretter kolliderer de og krystallveksten fortsetter bare i de retningene hvor det er fri tilgang til det flytende metallet. Som et resultat blir den opprinnelige geometrisk korrekte formen til krystallene forstyrret. Etter herding har kornene og dendrittene en uregelmessig, geometrisk forvrengt form.
Figur 1. Krystalliseringsskjema: a - i form av korn; b - i form av dendritter.
Ønsket om at metallatomer (ioner) skal lokaliseres, kanskje nærmere hverandre, tettere, fører til at antallet påtreffende kombinasjoner av det relative arrangementet av metallatomer i krystaller er lite.
Det finnes en rekke skjemaer og metoder for å beskrive alternativer for det relative arrangementet av atomer i en krystall. Det relative arrangementet av atomer i et av planene er vist i diagrammet over arrangementet av atomer (Figur 2).

Figur 2. Krystallenhetscelle (enkel kubikk).
Imaginære linjer trukket gjennom sentrene til atomer danner et gitter, ved nodene som atomer (positivt ladede ioner) er plassert; dette er det såkalte krystallografiske planet. Gjentatt repetisjon av krystallografiske plan plassert parallelt reproduserer et romlig krystallgitter, hvis noder er plasseringen av atomer (ioner). Avstandene mellom sentrene til naboatomer måles i ångstrøm (1 A = 1 * 10 -8 cm) eller i kiloisker - kX (1kX = 1,00202 A). Det relative arrangementet av atomer i rommet og størrelsen på interatomære avstander bestemmes ved røntgendiffraksjonsanalyse. Arrangementet av atomer i en krystall er veldig praktisk å skildre i form av romlige diagrammer, i form av såkalte elementære krystallinske celler. En krystallinsk enhetscelle betyr det minste komplekset av atomer, som, når det gjentas mange ganger i rommet, lar en reprodusere et romlig krystallgitter. Den enkleste typen krystallcelle er det kubiske gitteret. I et enkelt kubisk gitter er ikke atomene arrangert (pakket) tett nok. Ønsket til metallatomer om å okkupere steder nærmest hverandre fører til dannelse av gitter av andre typer: kroppssentrert kubikk (Figur 3, a), ansiktssentrert kubisk (Figur 3, b) og sekskantet tettpakket (Figur 3, a). 3, c).

Figur 3. Enhetskrystallceller: a - kroppssentrert kubikk; b - kubisk ansiktssentrert; c - sekskantet tettpakket.
metall termisk ledningsevne elektromagnetisk temperatur
Sirkler som representerer atomer er plassert i midten av kuben og langs dens toppunkter (kroppssentrert terning), eller i midten av flatene og langs hjørnene av kuben (ansiktssentrert terning), eller i form av en sekskant , hvori et sekskantet også halvveis er satt inn, hvor de tre atomene i det øvre planet er inne i sekskantet prisme (sekskantet gitter).
Krystallgitteravbildningsmetoden vist i figur 3 er konvensjonell (som i alle andre). Det kan være mer korrekt å avbilde atomer i et krystallgitter i form av kuler som berører hverandre (venstre diagrammer i figur 3). Imidlertid er et slikt bilde av krystallgitteret ikke alltid mer praktisk enn det aksepterte (høyre diagrammer i figur 3).
Dimensjonene til krystallgitteret er preget av parametere, eller gitterperioder. Et kubisk gitter bestemmes av en parameter - lengden på kanten av kuben a (Figur 3, a, b). Parametrene har verdier i størrelsesorden atomstørrelser og måles i ångstrøm.
For eksempel er gitterparameteren til krom, som har en kroppssentrert kubestruktur, 2.878 A, og gitterparameteren til aluminium, som har en flatesentrert kubestruktur, er 4.041 A.
Gitterparameteren er en ekstremt viktig egenskap. Moderne røntgenmetoder gjør det mulig å måle en parameter med en nøyaktighet på opptil fjerde eller til og med femte desimal, det vil si en titusendel til en hundre tusendel av en ångstrøm.
Fra en undersøkelse av diagrammene for krystallgitter (Figur 3), hvis vi antar at atomene så å si er elastiske kuler som berører hverandre, følger det at gitterparameteren a og atomdiameteren d er relatert ved enkle geometriske relasjoner .
For en kroppssentrert kube
For en ansiktssentrert kube
Ved å ta formen av en kule for et atom, kan vi beregne at i et kubisk kroppssentrert gitter opptar atomer 68% av volumet, og i et kubisk flatesentrert gitter (som i et sekskantet tettpakket gitter) 74%, dvs. i det andre tilfellet er atomene ordnet tettere, mer kompakt.
For metaller er et sekskantet gitter vanlig (Figur 3, c).
Hvis lagene med atomer berører hverandre, det vil si at de tre atomene som er avbildet inne i gitteret (Figur 3, c) berører atomene som ligger på øvre og nedre plan, så har vi et såkalt sekskantet tettpakket gitter.
Dimensjonene til det sekskantede tettpakkede gitteret er karakterisert ved en konstant verdi c/a = 1,633. Ved andre verdier av c/a oppnås et løst pakket sekskantet gitter.
Ansiktssentrerte kubiske og sekskantede gitter representerer den tetteste måten å pakke baller med samme diameter på.
Noen metaller har et tetragonalt gitter (Figur 4); den kjennetegnes ved at kant c ikke er lik kant a. Forholdet mellom disse parameterne karakteriserer den såkalte graden av tetragonalitet. Når c/a = 1, oppnås et kubisk gitter. Avhengig av det romlige arrangementet av atomer, kan et tetragonalt gitter (som et kubisk) være enkelt, kroppssentrert eller ansiktssentrert.

Figur 4. Tetragonalt gitter
Antall atomer i gjensidig kontakt er avgjørende for egenskapene til et gitt metall eller legering. Dette bestemmes av antall atomer som er like langt i nærmeste avstand fra ethvert atom.
Antall atomer som ligger nærmest og lik avstand fra et gitt atom kalles koordinasjonstallet. For eksempel har et atom i et enkelt kubisk gitter seks nærmeste naboer med lik avstand, det vil si at koordinasjonstallet til dette gitteret er 6.
Det sentrale atomet i et kroppssentrert gitter har åtte nærmeste naboer med lik avstand, dvs. koordinasjonsnummeret til dette gitteret er 8. Koordinasjonstallet for et flatesentrert gitter er 12. I tilfellet med et sekskantet tettpakket gitter, koordinasjonsnummeret er 12, og ved c/a? 1.633 hvert atom har seks atomer på en avstand og seks på en annen (koordinasjonsnummer 6).
For en kort betegnelse av krystallgitteret, som i denne betegnelsen indikerer typen krystallgitter og koordinasjonsnummer, ble ett av følgende systemer tatt i bruk (tabell 1).
Tabell 1
Hvert metall har et spesifikt krystallgitter.
Et vesentlig kjennetegn ved en krystallstruktur er antall atomer per enhetscelle.
I ca. c. I gitteret tilhører atomene som ligger i toppunktet åtte enhetsceller. Følgelig bidrar hvert atom med bare en åttendedel av volumet til en gitt enhetscelle. Det sentrale atomet tilhører helt og holdent denne enhetscellen. Derfor er det 1/8 * 8+1=2 atomer per enhetscelle.
I en ansiktssentrert terning er det fire atomer per enhetscelle (1/8 × 8 atomer fra tallet som er plassert ved hjørnene av kuben + 1/2 × 6=3 atomer fra tallet som sentrerer flatene).
Vanligvis krystalliserer metalliske elementer på venstre side av D.I. Mendeleevs bord i tett pakking, det vil si til enkle krystallinske celler med et stort koordinasjonsnummer. Typisk er metallgitter, som angitt, o. c. k., g. k. og g.p.u. Faktisk har nesten alle metaller, fra sink, kadmium og kvikksølv og til venstre, i de fleste tilfeller enkle gitter.
Ikke-metalliske elementer er preget av et lavt koordinasjonstall (K4 eller mindre). Ikke-metaller har lavere tetthet og lavere egenvekt enn metaller.
Konklusjon
Metaller er enkle stoffer som har frie elektroner som ikke er assosiert med spesifikke atomer, som er i stand til å bevege seg gjennom hele volumet av kroppen. Denne egenskapen til tilstanden til et metallisk stoff bestemmer egenskapene til metaller.
Metallatomer gir lett fra seg sine ytre (valens) elektroner, og blir til positivt ladede nononer. De frie elektronene som gis fra atomene beveger seg kontinuerlig kaotisk, det vil si tilfeldig, gjennom hele metallvolumet. Slike frie elektroner kalles ofte elektrongass. Positivt ladede ioner, når de kolliderer med frie elektroner, kan midlertidig forvandles til nøytrale atomer.
Dermed består metaller av positivt ladede ioner ordnet på en ryddig måte, elektroner som beveger seg blant dem, og et lite antall nøytrale atomer. Metaller er aluminium, jern, kobber, nikkel, krom, etc.
Legeringer er systemer som består av to eller flere metaller eller metaller og ikke-metaller. Legeringer har alle de karakteristiske egenskapene til metaller. For eksempel er stål og støpejern legeringer av jern med karbon, silisium, mangan, fosfor og svovel; bronse - en legering av kobber med tinn eller andre elementer; messing er en legering av kobber med sink og andre elementer.
Legeringer produsert ved å smelte sammen komponenter etterfulgt av krystallisering fra flytende tilstand er mye brukt i industrien. legeringer produsert ved sintring brukes mye sjeldnere.
Under prosessen med krystallisering fra den smeltede (flytende) tilstanden til et metall eller en legering, grupperes positivt ladede ioner og nøytrale atomer i en strengt definert sekvens, og danner krystallgitter - det riktige ordnede arrangementet av atomer i en enhetscelle. Krystallgitter av metaller og legeringer kan være av ulike typer: volumkonsentrert kubikk (bcc), flatesentrert kubikk (fc), sekskantet tettpakket (h.c.). Et volumkonsentrert kubisk gitter er dannet av jern, kobber, aluminium, bly, etc.; sekskantet tettpakket - sink, magnesium, kobolt, etc.
For å karakterisere et krystallgitter, er det nødvendig å kjenne gitterperiodene - avstanden a og c mellom sentrene til atomer eller ioner lokalisert på gittersteder. Gitterperioden måles i ångstrøm (1A=10 -8 cm).
Under krystallisering danner positivt ladede ioner, ordnet sekvensielt i form av elementære krystallgitter, krystaller i form av korn eller dendritter. Alle metaller og legeringer har en krystallinsk struktur. De resulterende krystallene vokser, krystalliserer fra den flytende smelten først fritt, forstyrrer ikke hverandre, deretter kolliderer de og krystallveksten fortsetter bare i de retningene hvor det er fri tilgang til det flytende metallet. Som et resultat blir den opprinnelige geometrisk korrekte formen til krystallene forstyrret. Etter herding har kornene og dendrittene en uregelmessig, geometrisk forvrengt form.
Ved oppvarming blir varmen som absorberes av metaller brukt på vibrasjonsbevegelsene til atomer og som et resultat på metallets termiske ekspansjon. Ved smelting øker volumet av metaller med 3-4%. Når temperaturen stiger, øker vibrasjonsbevegelsene til atomer eller ioner, de krystallinske kornene går i oppløsning og legeringen, som passerer gjennom fast-flytende tilstand, blir til en smelte.
Overgangen til flytende tilstand fører ikke til fullstendig ødeleggelse av den krystallinske strukturen. I smeltingen av metaller og legeringer er det alltid bittesmå områder der den opprinnelige, arvelige strukturen til metallet, nær krystallinsk, er bevart. I tillegg er det alltid ildfaste partikler (rester av ovnsforingen, urenheter av andre elementer), som kan danne ytterligere krystalliseringssentre og forårsake utbruddet av krystallisering. Kontrollen av krystalliseringen av legeringen er basert på kunstig dannelse av krystalliseringssentre i smelten med en samtidig endring i dens kjølehastighet for å oppnå en gitt struktur av legeringen i fast tilstand.
Litteratur
1. Gulyaev A.P. Metallurgi - 5. utg., revidert. og tillegg - M.: Forlag "metallurgi", 1977.
2. Materialvitenskap for rørleggere, montører, anleggsmaskinførere: En lærebok for miljøer. prof.-tech. skoler /Yu.G.Vinogradov, K.S.Orlov, L.A.Popova. - M.: Høyere. skole, 2. utgave, 1989.
3. Materialvitenskap. Forelesning 5. Z.O.
4. Moizberg R.K. Materialvitenskap, 1991.
5. Khanapetov M.V. Sveising og skjæring av metaller. - 3. utg., revidert. og tillegg - M.: Stroyizdat, 1988.
Det er enkelt å sende inn det gode arbeidet ditt til kunnskapsbasen. Bruk skjemaet nedenfor
Studenter, hovedfagsstudenter, unge forskere som bruker kunnskapsbasen i studiene og arbeidet vil være deg veldig takknemlig.
Lagt ut på http://www.allbest.ru/
Innvendig struktur av metaller og legeringer
1. Atomstruktur av metaller
2. Polymorfisme. Anisotropi
3. Struktur av ekte krystaller og krystallgitterdefekter
1 . Atomstruktur av metaller
I det enorme utvalget av materialer kjent for mennesket siden uminnelige tider og mye brukt av ham i hans liv og aktiviteter, har metaller alltid inntatt en spesiell plass.
Bekreftelse på dette: både i navnene på epoker (gull, sølv, bronse, jernalder), som grekerne delte menneskehetens historie inn i: og i arkeologiske funn av metallprodukter (smidde kobbersmykker, landbruksverktøy); og i den utbredte bruken av metaller og legeringer i moderne teknologi.
Årsaken til dette er de spesielle egenskapene til metaller, som skiller dem gunstig fra andre materialer og gjør dem uerstattelige i mange tilfeller.
Metaller er en av klassene av strukturelle materialer, preget av et visst sett med egenskaper:
· "metallisk glans" (god reflektivitet);
· plastisitet;
· høy varmeledningsevne;
· høy elektrisk ledningsevne.
Disse egenskapene skyldes de strukturelle egenskapene til metaller. I følge teorien om den metalliske tilstanden er et metall et stoff som består av positive kjerner som elektroner roterer rundt i orbitaler. På det siste nivået er antallet elektroner lite og de er svakt bundet til kjernen. Disse elektronene har evnen til å bevege seg gjennom hele volumet av metallet, dvs. tilhører en hel samling atomer.
Dermed sikres plastisitet, termisk ledningsevne og elektrisk ledningsevne ved tilstedeværelsen av "elektrongass".
Alle metaller som størkner under normale forhold er krystallinske stoffer, det vil si at arrangementet av atomer i dem er preget av en viss rekkefølge - periodisitet, både i forskjellige retninger og i forskjellige plan. Denne rekkefølgen er definert av konseptet med et krystallgitter.
Med andre ord er et krystallgitter et imaginært romlig gitter, ved nodene hvor det er partikler som danner et fast legeme.
En enhetscelle er et volumelement av et minimum antall atomer, hvis gjentatte overføring i rommet kan bygge hele krystallen.
Enhetscellen karakteriserer de strukturelle egenskapene til krystallen. Hovedparametrene til krystallen er:
Fig.1.1. Krystallgitterdiagram
dimensjoner på kantene på enhetscellen. a, b, c - gitterperioder - avstander mellom sentrene til nærliggende atomer. I én retning holdes de strengt definert.
vinkler mellom akser ().
koordinasjonsnummer (K) indikerer antall atomer som befinner seg i nærmeste like avstand fra ethvert atom i gitteret.
gitterbasis er antall atomer per enhetscelle i gitteret.
pakkingstettheten til atomer i et krystallgitter er volumet som okkuperes av atomer, som konvensjonelt betraktes som stive kuler. Det er definert som forholdet mellom volumet okkupert av atomer og volumet av cellen (for et kroppssentrert kubisk gitter - 0,68, for et ansiktssentrert kubisk gitter - 0,74)
Klassifiseringen av mulige typer krystallgitter ble utført av den franske forskeren O. Bravais, følgelig ble de kalt "Bravais-gitter". Totalt finnes det fjorten typer gitter for krystallinske faste stoffer, fordelt på fire typer;
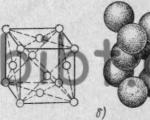
Ris. 1.2. Hovedtypene av krystallgitter: a - kroppssentrert kubikk; b- ansiktssentrert kubikk; c - sekskantet tettpakket
primitiv - gitternoder faller sammen med toppunktene til enhetsceller;
base-sentrert - atomer okkuperer toppen av celler og to steder på motsatte flater;
kroppssentrert - atomer okkuperer toppen av cellene og dens sentrum;
ansiktssentrert - atomer okkuperer toppunktene i cellen og sentrene til alle seks ansiktene
Hovedtypene av krystallgitter er:
1. Kroppssentrert kubikk (bcc) (se fig. 1.2a), atomer er lokalisert ved hjørnene av kuben og i midten (V, W, Ti,)
2. Ansiktssentrert kubikk (FCC) (se fig. 1.2b), atomer er plassert ved hjørnene av kuben og i midten av hver av de 6 flatene (Ag, Au,)
3. Sekskantet, basert på en sekskant:
o enkle - atomer er lokalisert ved hjørnene av cellen og i sentrum av 2 baser (karbon i form av grafitt);
o tettpakket (hcp) - det er 3 ekstra atomer i midtplanet (sink).
2 . Polymorfisme.Anisotropi
metall krystallinsk atompolymorfisme
Egenskapene til en kropp avhenger av arten av atomene den er sammensatt av og styrken til interaksjonen mellom disse atomene. Samspillskreftene mellom atomer bestemmes i stor grad av avstandene mellom dem. I amorfe legemer med et kaotisk arrangement av atomer i rommet er avstandene mellom atomer i forskjellige retninger like, derfor vil egenskapene være de samme, det vil si at de amorfe legene er isotropiske.
I krystallinske legemer er atomer riktig plassert i rommet, og i forskjellige retninger er avstandene mellom atomene ikke de samme, noe som bestemmer betydelige forskjeller i kreftene til interaksjon mellom dem og, som et endelig resultat, forskjellige egenskaper. Egenskapers avhengighet av retning kalles anisotropi
For å forstå fenomenet anisotropi, er det nødvendig å identifisere krystallografiske plan og krystallografiske retninger i krystallen.
Planet som går gjennom nodene til krystallgitteret kalles det krystallografiske planet.
Den rette linjen som går gjennom nodene til krystallgitteret kalles den krystallografiske retningen.
Miller-indekser brukes til å angi krystallografiske plan og retninger. For å etablere Miller-indeksene, er enhetscellen skrevet inn i et romlig koordinatsystem (X, Y, Z-akser er krystallografiske akser). Måleenheten er gitterperioden.
Fig.1.3. Eksempler på betegnelse av krystallografiske plan (a) og krystallografiske retninger (b)
For å bestemme indeksene til det krystallografiske krystallografiske planet er det nødvendig:
sett koordinatene til skjæringspunktene til planet med koordinataksene i enheter av gitterperioden;
ta de gjensidige verdiene av disse mengdene;
reduser dem til det minste heltallsmultippelet av hvert av de resulterende tallene.
De resulterende verdiene av primtall som ikke har en felles faktor er Miller-indekser for flyet og er angitt i parentes. Eksempler på betegnelse av krystallografiske plan i fig. 1,3 a.
Med andre ord viser akseindeksen hvor mange deler planet deler akseenheten langs en gitt akse. Planer parallelle med aksen har en indeks på 0 (110)
Orienteringen til en rett linje bestemmes av koordinatene til to punkter. For å bestemme de krystallografiske retningsindeksene er det nødvendig:
juster ett retningspunkt med opprinnelsen til koordinatene;
angi koordinatene til ethvert annet punkt som ligger på en rett linje, i enheter av gitterperiode
redusere forholdet mellom disse koordinatene til forholdet mellom de tre minste heltallene.
Indekser for krystallografiske retninger er angitt i firkantede parenteser
I et kubisk gitter har indeksene for retningen vinkelrett på planet (hkl) de samme indeksene.
Evnen til noen metaller til å eksistere i forskjellige krystallinske former avhengig av ytre forhold (trykk, temperatur) kalles allotropi eller polymorfisme.
Hver type gitter representerer en allotrop modifikasjon eller modifikasjon.
Et eksempel på allotrop modifikasjon avhengig av temperatur er jern (Fe).
Fe: - bcc - ;
BCC - ; (høy temperatur)
Transformasjonen av en modifikasjon til en annen skjer ved en konstant temperatur og er ledsaget av en termisk effekt. Modifikasjoner av et element er indikert med bokstaver i det greske alfabetet i form av en indeks ved siden av metallets hovedbetegnelse.
Et eksempel på en allotrop modifikasjon forårsaket av endringer i trykk er karbon: ved lavt trykk dannes grafitt, og ved høyt trykk dannes diamant.
Ved å bruke fenomenet polymorfisme er det mulig å styrke og myke legeringer ved hjelp av varmebehandling.
3 . Strukturen til ekte krystaller og krystallgitterdefekter
En enkelt krystall kan dyrkes fra en flytende smelte. De brukes vanligvis i laboratorier for å studere egenskapene til et bestemt stoff.
Metaller og legeringer oppnådd under normale forhold består av et stort antall krystaller, det vil si at de har en polykrystallinsk struktur. Disse krystallene kalles korn. De har en uregelmessig form og er annerledes orientert i rommet. Hvert korn har sin egen orientering av krystallgitteret, forskjellig fra orienteringen til nabokorn, som et resultat av at egenskapene til ekte metaller er gjennomsnittlig, og fenomenet anisotropi blir ikke observert. I krystallgitteret til ekte metaller er det ulike defekter (imperfeksjoner) som forstyrrer bindingene mellom atomer og påvirker egenskapene til metaller. Følgende strukturelle ufullkommenheter skilles ut:
· punkt - liten i alle tre dimensjoner;
· lineær - liten i to dimensjoner og vilkårlig utvidet i den tredje;
· overfladisk – liten i én dimensjon.
Meislede defekter
En av de vanlige ufullkommenhetene i krystallstrukturen er tilstedeværelsen av punktdefekter: ledige plasser, dislokerte atomer og urenheter. (Fig. 2.1.)
Fig.2.1. Punktfeil
En ledig stilling er fraværet av atomer på stedene til et krystallgitter, "hull" som ble dannet som et resultat av forskjellige årsaker. Dannes under overgangen av atomer fra overflaten til miljøet eller fra gitternoder til overflaten (korngrenser, hulrom, sprekker, etc.), som et resultat av plastisk deformasjon, når en kropp bombarderes med atomer eller partikler med høy energi ( bestråling i en syklotron eller nøytronbestråling i atomreaktor). Konsentrasjonen av ledige stillinger bestemmes i stor grad av kroppstemperaturen. Når du beveger deg gjennom krystallen, kan det oppstå enkelt ledige stillinger. Og foren deg i divakanser. Opphopning av mange ledige stillinger kan føre til dannelse av porer og tomrom.
Et dislokert atom er et atom som har forlatt et gittersted og tatt plass i et interstitielt sted. Konsentrasjonen av dislokerte atomer er mye lavere enn for ledige stillinger, siden deres dannelse krever betydelig energiforbruk. I dette tilfellet dannes en ledig stilling i stedet for det fordrevne atomet.
Urenhetsatomer er alltid til stede i et metall, siden det er nesten umulig å smelte et kjemisk rent metall. De kan være større eller mindre enn størrelsen på hovedatomene og er lokalisert ved gittersteder eller mellomrom.
Punktdefekter forårsaker mindre gitterforvrengninger, noe som kan føre til endringer i kroppens egenskaper (elektrisk ledningsevne, magnetiske egenskaper deres fremmer diffusjonsprosesser og forekomsten av fasetransformasjoner i fast tilstand). Når defektene beveger seg gjennom materialet, kan de samhandle.
Lineære defekter:
De viktigste lineære defektene er dislokasjoner. A priori-begrepet dislokasjoner ble først brukt i 1934 av Orowan og Theiler i deres studie av plastisk deformasjon av krystallinske materialer, for å forklare den store forskjellen mellom den praktiske og teoretiske styrken til et metall.
Dislokasjoner er defekter i krystallstrukturen, som er linjer langs og nær som det korrekte arrangementet av atomplan som er karakteristisk for en krystall, blir forstyrret.
De enkleste typer dislokasjoner er kant og skrue.
En kantdislokasjon er en linje langs hvilken kanten av et "ekstra" halvplan bryter av inne i krystallen (fig. 2.2)
Ris. 2.2. Kantdislokasjon (a) og mekanismen for dens dannelse (b)
Et ufullstendig plan kalles et ekstraplan.
De fleste dislokasjoner dannes av en skjærmekanisme. Dens dannelse kan beskrives ved hjelp av følgende operasjon. Skjær krystallen langs ABCD-planet, forskyv den nedre delen i forhold til den øvre en etter en gitterperiode i retning vinkelrett på AB, og bring deretter atomene sammen igjen ved kantene av kuttet under.
De største forvrengningene i arrangementet av atomer i krystallen skjer nær den nedre kanten av ekstraplanet. Til høyre og venstre for kanten av ekstraplanet er disse forvrengningene små (flere gitterperioder), og langs kanten av ekstraplanet strekker forvrengningene seg over hele krystallen og kan være veldig store (tusenvis av gitterperioder) (fig. 2.3).
Hvis ekstraplanet er plassert i den øvre delen av krystallen, er kantdislokasjonen positiv (), hvis i den nedre delen, så er den negativ (). Dislokasjoner av samme tegn frastøter, og de av motsatt tegn tiltrekker seg.
Ris. 2.3. Forvrengninger i krystallgitteret i nærvær av en kantdislokasjon
En annen type dislokasjon ble beskrevet av Burgers og ble kalt en skrueluksasjon.
En skrueforskyvning oppnås ved å bruke en delvis forskyvning langs Q-planet rundt linjen EF (fig. 2.4) Det dannes et trinn på overflaten av krystallen, som går fra punkt E til kanten av krystallen. Et slikt delvis skift forstyrrer parallelliteten til atomlagene, krystallen blir til ett atomplan, vridd langs en skrue i form av en hul helicoide rundt linjen EF, som representerer grensen som skiller den delen av glideplanet hvor skiftet. har allerede skjedd fra den delen hvor skiftet ikke har begynt. Langs EF-linjen observeres den makroskopiske karakteren til ufullkommenhetsregionen i andre retninger, dens dimensjoner er flere perioder.
Hvis overgangen fra den øvre til den nedre horisonten utføres ved å dreie med klokken, er dislokasjonen høyrehendt, og hvis den dreies mot klokken, er dislokasjonen venstrehendt.
Ris. 2.4. Mekanisme for dannelse av skruedislokasjon
En skrueforskyvning er ikke assosiert med noe glideplan; den kan bevege seg langs et hvilket som helst plan som går gjennom dislokasjonslinjen. Ledige plasser og dislokerte atomer flyter ikke til skruedislokasjonen.
Under krystalliseringsprosessen fester atomer av stoffet utfelt fra dampen eller løsningen seg lett til trinnet, noe som fører til en spiralformet krystallvekstmekanisme.
Dislokasjonslinjer kan ikke brytes inne i krystallen de må enten være lukket, danne en løkke, eller forgrene seg til flere dislokasjoner, eller gå til overflaten av krystallen.
Dislokasjonsstrukturen til et materiale er preget av tettheten av dislokasjoner.
Dislokasjonstettheten i en krystall er definert som gjennomsnittlig antall dislokasjonslinjer som krysser et område på 1 m 2 inne i kroppen, eller som den totale lengden av dislokasjonslinjer i et volum på 1 m 3
(cm -2; m -2)
Dislokasjonstettheten varierer over et bredt område og avhenger av materialets tilstand. Etter grundig gløding er dislokasjonstettheten 10 5 ... 10 7 m -2 i krystaller med et sterkt deformert krystallgitter, når dislokasjonstettheten 10 15 ... 10 16 m -2.
Dislokasjonstettheten bestemmer i stor grad plastisiteten og styrken til materialet (fig. 2.5)
Ris. 2.5. Effekt av dislokasjonstetthet på styrke
Minimumsstyrken bestemmes av den kritiske dislokasjonstettheten
Hvis tettheten er mindre enn verdien a, øker motstanden mot deformasjon kraftig, og styrken nærmer seg den teoretiske. En økning i styrke oppnås ved å lage et metall med en defektfri struktur, samt ved å øke tettheten av dislokasjoner, noe som hindrer deres bevegelse. For tiden er det laget defektfrie krystaller - værhår opp til 2 mm lange, 0,5...20 mikron tykke - "whiskers" med styrke nær teoretisk: for jern = 13000 MPa, for kobber = 30000 MPa. Når du styrker metaller ved å øke dislokasjonstettheten, bør den ikke overstige verdier på 10 15 ... 10 16 m -2. Ellers vil det dannes sprekker.
Dislokasjoner påvirker ikke bare styrke og duktilitet, men også andre egenskaper til krystaller. Når dislokasjonstettheten øker, øker den indre tettheten, de optiske egenskapene endres, og den elektriske motstanden til metallet øker. Dislokasjoner øker den gjennomsnittlige diffusjonshastigheten i krystallen, akselererer aldring og andre prosesser, reduserer kjemisk motstand, derfor, som et resultat av å behandle overflaten av krystallen med spesielle stoffer, dannes groper på punktene der dislokasjoner dukker opp.
Dislokasjoner dannes under dannelsen av krystaller fra en smelte- eller gassfase, under akkresjonen av blokker med små feilorienteringsvinkler. Når ledige plasser beveger seg inne i krystallen, konsentreres de og danner hulrom i form av disker. Hvis slike disker er store, er det energisk gunstig å "slå" dem med dannelsen av en kantforskyvning langs kanten av disken. Dislokasjoner dannes under deformasjon, under krystallisering og under varmebehandling.
Overflatedefekter er grensene for korn, fragmenter og blokker (fig. 2.6).
Ris. 2.6. Feilorientering av korn og blokker i metall
Kornstørrelsene er opptil 1000 mikron. Feilorienteringsvinklene er opptil flere titalls grader ().
Grensen mellom korn er en tynn overflatesone med 5 - 10 atomdiametre med maksimalt brudd på rekkefølgen i arrangementet av atomer.
Strukturen til overgangslaget fremmer akkumulering av dislokasjoner i det. Ved korngrensene er det en økt konsentrasjon av urenheter, som reduserer overflateenergien. Men selv inne i kornet blir den ideelle strukturen til krystallgitteret aldri observert. Det er områder som er feilorientert den ene i forhold til den andre i flere grader (). Disse områdene kalles fragmenter. Prosessen med å dele korn i fragmenter kalles fragmentering eller polygonisering.
I sin tur består hvert fragment av blokker mindre enn 10 mikron i størrelse, feilorientert i en vinkel på mindre enn én grad (). Denne strukturen kalles blokk eller mosaikk.
Skrevet på Allbest.ru
Lignende dokumenter
Grunnleggende typer rister, punkt- og lineære defekter. Sammenheng mellom strukturen til krystallgitteret og materialets mekaniske og fysiske egenskaper. Den virkelige strukturen til krystaller, former for plastisk deformasjon. Egenskaper til metaller som brukes i konstruksjon.
sammendrag, lagt til 30.07.2014
Klassifisering av defekter i krystallgitteret til metaller. Diagram over punktdefekter i en krystall. Dislokasjon under krystallisering eller skjærkraft. Arrangement av atomer i området for en skruedislokasjon. Overflate- eller todimensjonale defekter. Blokkstrukturdiagram.
foredrag, lagt til 08.08.2009
Retninger og stadier av forskning innen struktur og egenskaper av metaller, deres refleksjon i verkene til innenlandske og utenlandske forskere fra forskjellige tidsepoker. Typer av metallkrystallgitter, prinsipper for deres dannelse. Grunnleggende fysiske og kjemiske egenskaper til legeringer.
presentasjon, lagt til 29.09.2013
Punktdefekter i krystallgitteret til ekte metaller: ledige plasser, dislokerte atomer og urenheter. Dannelse av lineære defekter (dislokasjoner). Rollen til skruedislokasjon i dannelsen av en voksende krystall. Effekt av dislokasjonstetthet på styrke.
presentasjon, lagt til 14.10.2013
Kjennetegn på de kjemiske og fysiske egenskapene til metaller. Forholdet mellom metaller og oksidasjonsmidler - enkle stoffer. Fysisk betydning av indre friksjon av materialer. Eksempler på anvendelse av intern friksjonsmetoden i metallurgi. Søk etter en dynamisk modul.
kursarbeid, lagt til 30.10.2014
Egenskaper og atom-krystallinsk struktur av metaller. Energiforhold i krystalliseringsprosessen. Strukturen til en metallblokk. Studie av sammenhengen mellom egenskapene til legeringer og type fasediagram. Komponenter og faser av jern-karbon-legeringer.
kursarbeid, lagt til 07.03.2015
Utbredelsen av metaller i naturen. Innholdet av metaller i jordskorpen i fri tilstand og i form av legeringer. Klassifisering av områder av moderne metallurgi avhengig av metoder for metallisolering. Kjennetegn ved metallurgiske prosesser.
presentasjon, lagt til 19.02.2015
Klassifisering av metaller etter hovedkomponent og smeltepunkt. Karakteristiske trekk som skiller metaller fra ikke-metaller: ekstern glans, høy styrke. Karakteristiske trekk ved jernholdige og ikke-jernholdige metaller. Analyse av ikke-jernholdige metallegeringer.
test, lagt til 08.04.2012
Bestemmelse av de mekaniske egenskapene til strukturelle materialer ved å teste dem for spenning. Metoder for å studere kvaliteten, strukturen og egenskapene til metaller og legeringer, bestemme deres hardhet. Varmebehandling av deformerbare aluminiumslegeringer.
opplæring, lagt til 29.01.2011
Essensen og formålet med varmebehandling av metaller, prosedyren og reglene for dens gjennomføring, typer og særtrekk. Termomekanisk prosessering som en ny metode for å styrke metaller og legeringer. Formål med kjemisk-termisk bearbeiding av metaller.
Ved produksjon av maskiner og arbeidsinstallasjoner er metaller og deres legeringer mest brukt.
Metaller- dette er stoffer som har høy elektrisk og termisk ledningsevne, glans, formbarhet og andre egenskaper som er enkle og lite mottagelig for metallbearbeiding.
I industrien er alle metaller og legeringer delt inn i to kategorier: farget Og svart. Den såkalte jernholdige metaller– dette er rent jern og legeringer basert på materialet. TIL i farger– inkludere andre typer metaller. For å velge et metall riktig for fremstilling av mekaniske strukturer med videre analyse av bruken, mekaniske og andre egenskaper som påvirker påliteligheten og ytelsen til maskiner, må du også kjenne den indre strukturen, mekaniske, fysisk-kjemiske og teknologiske egenskaper. som hvilken metode for å behandle metallet og trenger om materialet er i metallskjæring (hvis materialet må behandles ved kutting, er det bedre å gjøre dette ved hjelp av plasmametallskjæring).

I fast tilstand har alle metaller og legeringer en krystallinsk struktur. Metallmolekyler (atomer, ioner) i rommet er lokalisert i en strengt definert rekkefølge og dannes med hverandre krystallgitter.
Et krystallgitter dannes ved metallbearbeiding, dvs. overgang av tilstanden fra flytende til fast stoff. Denne prosessen kalles - krystallisering. For første gang ble disse prosessene studert av en vitenskapsmann fra Russland - D.K. Chernov.
Krystalliseringsprosess :
Selve prosessen består av to deler. I et metall som er i flytende tilstand, beveger atomene seg konstant. Hvis du senker temperaturen, reduseres bevegelseshastigheten til atomer, de kommer nærmere og grupperer seg i krystaller (derfor, for å endre formen og strukturen til produktet, blir det utsatt for metallbehandling ved hjelp av oppvarming) - dette er den første del, under hvilken krystalliseringssentre dannes.
Så er det vekst rundt sentrene for krystallisering - dette er den andre delen av prosessen. Helt i begynnelsen går veksten av krystaller fritt, men da forstyrrer veksten av noen veksten til andre, som et resultat dannes en uregelmessig formet gruppe krystaller, som kalles korn. Størrelsen på de resulterende kornene påvirker den videre metallbearbeidingen av produktene betydelig. Et metall som består av store korn har lav motstand mot slag, hvis metall kuttes, blir det vanskelig å oppnå lav ruhet på overflaten av slikt metall. Kornstørrelsene avhenger av krystalliseringsforholdene og egenskapene til selve metallet.
Metoder for å studere metallstruktur :
Studiet av strukturen til metaller og legeringer utføres gjennom makro- og mikroanalyser, samt andre metoder. Ved hjelp av makroanalyse studeres metallets struktur, som kan sees med det blotte øye eller med forstørrelsesglass. Denne strukturen bestemmes av makroseksjoner eller brudd. Makrosliping– Dette er en prøve av metall, hvor en av sidene er etset med syre og polert.
Mikroanalyse studerer størrelsene og formene til korn, deres strukturelle komponenter, og identifiserer mikrodefekter og kvaliteten på varmebehandlingen av metallet. Denne analysen utføres på mikroseksjoner ved hjelp av et mikroskop. Mikroseksjon- dette er en viss prøve av metall som har en flat polert overflate, etset med en svak syreløsning.
Egenskaper til metaller :
Metalliske egenskaper er delt inn i fysisk-kjemiske, teknologiske og mekaniske. Mekaniske egenskaper betyr motstanden til et metall mot påvirkning av ytre krefter på det. Mekaniske egenskaper inkluderer viskositet, styrke, varighet og andre.
Styrke- dette er egenskapene til et metall under visse forhold for ikke å bli ødelagt, men for å oppfatte påvirkning av ytre krefter. Denne egenskapen er en viktig indikator når du velger en metallbehandlingsmetode.
Viskositet er motstanden til et materiale under støtbelastning.
Hardhet- egenskapene til et materiale for å motstå innføring av et annet materiale i det.

De viktigste teknologiske egenskapene inkluderer - duktilitet, sveisbarhet, smelteegenskaper, bearbeidbarhet og andre.
Duktilitet– dette er egenskapene til et materiale som skal utsettes for metallbearbeiding ved smiing og andre formingsmetoder.
Sveisbarhet– materialets egenskaper for å skape sterke sveisede skjøter.
Smelteegenskaper– egenskaper til materialet i smeltet form for å fylle støpeformer og lage tette støpegods med ønsket konfigurasjon.
Bearbeidbarhet– egenskapene til materialet som skal utsettes for metallkutting for å gi delen ønsket form, størrelse og overflateruhet. Den beste metoden for å kutte metaller er plasmametallkutting. Etter denne prosessen trenger metallet praktisk talt ikke ytterligere metallbearbeiding.
For å få et produkt av høy kvalitet med en god ytre og indre struktur, må du ha en god forståelse av strukturen til metaller, fordi dette er den eneste måten å få et utmerket resultat.
Struktur av metaller 4,33 /5 (86,67%) 3 stemte
Struktur av metaller
Metaller under et mikroskop
Alle metaller består av et stort antall krystallinske korn som henger sammen. Denne granulære krystallinske strukturen til stoffet kan sees ved hjelp av spesielle mikroskoper, kalt metallografiske. De skiller seg fra vanlige ved at de bruker sidebelysning av metallet, fordi metaller er ugjennomsiktige og ikke kan belyses nedenfra. I slike mikroskoper er lyskilden plassert slik at noen av strålene reflekteres fra overflaten av metaller og kommer inn i linsen.

Ris. 1. Metallmikroskop.
Øverst til høyre - lysstråler som reflekteres fra overflaten av den polerte delen går inn i mikroskoplinsen. Nederst til høyre er overflaten av rent jern, synlig med et metallmikroskop.
Figur 1 viser et av disse mikroskopene. Før du undersøker en prøve i den, blir metalloverflaten grundig rengjort med sandpapir, slipt og polert til en speilfinish. En slik prøve kalles en tynn seksjon. Deretter blir overflaten av seksjonen utsatt for såkalt etsning, for hvilken den fuktes i 2-3 minutter med en løsning, oftest inneholdende salpetersyre og etylalkohol. Andre løsninger brukes også for etsing av tynne seksjoner. Dette er grunnen til at de gjør dette: forskjellige korn av legeringen løses forskjellig av syre, som et resultat av at individuelle krystallflater stikker ut på overflaten av metallet, og når den etsede delen av seksjonen er opplyst, reflekterer noen av kornene lyset som faller på dem direkte på linsen. Disse områdene ser lyse ut under et mikroskop. Andre korn reflekterer lys til siden, slik at de virker mørke. Under et mikroskop får adhesjonsstedene til individuelle krystallinske korn, de såkalte interkrystallinske områdene, en annen nyanse og jevn farge under et mikroskop (fig. 2).

Ris. 2. En polert plate under et mikroskop (etse stål med en 2% alkoholløsning av salpetersyre).
Bruken av et metallmikroskop gjorde det mulig å fastslå hvilken struktur metallene har, hvordan individuelle korn befinner seg i legeringen, hvilke ikke-metalliske inneslutninger legeringene inneholder, refleksjon av sprekker på overflaten av legeringene osv. Figur 3 viser et mikrofotografi av støpejern, hvor individuelle grafittinneslutninger er godt synlige.
 />
/>
Ris. 3. Grafitt i støpejern (mørke inneslutninger):
a-storlamellgrafitt i vanlig grått støpejern; b-fin-plate grafitt i modifisert grått støpejern (modifikasjon 0,15%); β-sfæriske grafittinneslutninger i støpejern modifisert med magnesium (×100).
Et metallmikroskop er i dag et av instrumentene i ethvert laboratorium der egenskapene til ulike metaller og legeringer studeres.
Krystallgitter av metaller
Du er allerede kjent med krystaller. Så, for eksempel, når du studerer bordsalt, vet du at det består av 8 individuelle kubiske krystaller. Selve ordet "krystall" kommer fra det greske ordet "krystallos", som betyr "is". I fremtiden begynte alle faste kropper som har en viss geometrisk form å bli kalt dette. I naturen er det store flertallet av faste stoffer i krystallinsk tilstand. Jern, som et av de faste stoffene, danner også krystaller når det størkner. Jernkrystallen har et kubisk gitter. Men når vi undersøker metalloverflaten under et mikroskop, vil vi ikke se denne vanlige kubikkformen til krystallene. Den uregelmessige formen til krystaller oppstår fordi mange små kjerner dukker opp i smelten når den størkner, som danner større krystaller. Disse store krystallene, som kolliderer, begynner å samle seg og klemme hverandre. Følgelig er et stort antall krystaller tilstede samtidig i en størknende blokk av metall. Forstyrrelsen av formen deres lettes ikke bare av det faktum at de overtrenger hverandre, men også av ulik temperatur i forskjellige kjøleområder. Individuelle krystallinske korn i det størknede metallet har forskjellige former og størrelser. De er atskilt fra hverandre av et lag, som består av forskjellige ikke-metalliske inneslutninger. Disse ikke-metalliske inneslutningene er alltid til stede i en eller annen mengde i metallet.
Struktur av metaller
Figur 4 viser et diagram over dannelsen av metallets granulære struktur under størkning.

Ris. 4. Skjema for krystallvekst i en størknende smelte:
a-embryoer dannes; b-krystaller vokser; β-krystaller begynner å trenge hverandre; d-individuelle korn vokser sammen.
Stoffene som utgjør stål har forskjellige smeltepunkter, og følgelig størkningspunkter. For eksempel blir rent jern fast allerede ved en temperatur på 1539 ° C, og i kombinasjon med svovel eller andre elementer er størkningstemperaturen lavere. Derfor består metalllaget som først størkner av de mest ildfaste elementene, for eksempel jern og karbon. Urenheter som svovel og fosfor produserer mer smeltbare legeringer og er de siste som størkner. Svovel og fosfor er skadelige urenheter fordi deres tilstedeværelse reduserer legeringens styrke betydelig, noe som gjør den sprø og uegnet for produkter.
Når legeringen størkner, konsentreres de mer smeltbare forbindelsene av jern med svovel og fosfor i den øvre delen av barren og størkner sist, slik at legeringen av jern med fosfor og svovel samles i den øvre delen av barren.
I krystaller er atomene til hvert metall fordelt i en strengt definert rekkefølge. De danner et såkalt romlig gitter, som ikke kan sees i noen av de eksisterende mikroskopene. Ved hjelp av røntgenmaskiner og andre moderne instrumenter er det imidlertid mulig å studere atomenes arrangement i et krystallgitter.
Typer metallkrystallgitter
Blant metaller finnes oftest tre typer gitter, først av disse er kubisk kroppssentrert. De er kjennetegnet ved at atomene i dem er plassert i hjørnene og sentrum av kuben, for eksempel i litium, krom, vanadium og andre metaller (fig. 5a).

Fig.5. Typer metallkrystallgitter:
a-kubikk kroppssentrert;
b-kubisk ansiktssentrert;
b-sekskantet (tett pakning).
Co. andre typen tilhører det ansiktssentrerte kubiske gitteret (fig. 5.6), atomene i (som er plassert ved hjørnene av kuben og dens flater (for eksempel i aluminium, kobber, bly, nikkel, gull, sølv og platina).
Tredje type- disse er sekskantede, eller sekskantede, tettpakkede gitter (fig. 5, c). De finnes i magnesium, sink, kadmium og beryllium.
Som man kan se fra diagrammet vist i figur 6, har de tetteste pakningene av atomer ansiktssentrerte og sekskantede gitter.

Fig.6. Metallstrukturdiagram.
Det er positivt ladede ioner på gittersteder. I gapet er det frie elektroner.
Det er interessant å merke seg at noen metaller, spesielt jern, sink og nikkel, kan eksistere i flere krystallinske former, og endres fra den ene til den andre. Denne overgangen skjer ved forskjellige temperaturer. Slike modifikasjoner, når det samme stoffet kan være i forskjellige krystallinske former, kalles allotrope, og selve stoffene er allotrope. Navnet "allotropi" kommer fra de greske ordene "allos" - en annen, "tropos" - eiendom.
Karbon finnes i naturen i form av grafitt og diamant, og som du husker er grafitt et mykt stoff som setter spor på papiret, mens diamant er et av de hardeste naturlige stoffene. Smeltepunktene til diamant og grafitt er forskjellige.
Allotropisk modifikasjon av svovel er kjent (ortorombisk og prismatisk). Ortorhombisk svovel dannes ved temperaturer under 96 ° C over denne temperaturen blir det prismatisk. Avhengig av endringen i krystallstrukturen endres også egenskapene til stoffet.
De samme allotropiske endringene observeres i jern. Den har et gitter av en sentrert kube ved en temperatur på 910°C, og i temperaturområdet 910-1390°C skjer overgangen til ansiktssentrert.
Allotropiske transformasjoner av et metall kan lett observeres ved å bruke eksemplet med tinn. Vanlig sølvhvitt tinn har et komplekst krystallgitter, som er stabilt ved temperaturer over 18 ° C ved lavere temperaturer, begynner tinnatomene i krystallene å omorganisere. Pakningen av deres (atomer) blir mindre sterk, skinnende tinn mister sin glans, formbarhet og blir til sprø, grå tinn, som har et annet krystallgitter.
Dette fenomenet ble lagt merke til for lenge siden og ble kalt "tinnpest", siden tinnprodukter - tinnplater, begre, orgler i kirker - noen ganger plutselig begynte å kollapse. «Blikspesten» var en stor katastrofe. De visste ikke hvordan de skulle takle det, fordi de ikke visste årsaken til dets opprinnelse. Nå er det klart for oss at hvis vi varmer opp et tinnprodukt "syk av tinnpest", så vil krystallene av grått tinn omorganiseres til krystaller av hvitt tinn, og det vil igjen få formbarhet og hvit farge.
Struktur av metaller
I diagrammene over krystaller (fig. 5) er linjer konvensjonelt tegnet i krystallgitteret som forbinder et metallatom til et annet. I virkeligheten er det ingen linjer som forbinder atomer på gittersteder. De er pakket tett sammen og berører hverandre. Gitterstedene inneholder positivt ladede ioner omgitt av elektroner. Valenselektronene til metallatomer, som selve atomene, er i kontinuerlig vibrasjon. Men eksternt kan elektroner (valens) lettere forlate atomet sitt og flytte til naboen. Følgelig er det i krystallgitteret såkalte frie elektroner, eller fri elektron "gass", iboende i hele komplekset av atomer. Dermed oppstår samspillet mellom elektroner i de ytre skallene til metallatomer. Takket være denne ytre interaksjonen av elektroner skapes det en binding mellom metallatomene, det oppstår adhesjonskrefter som holder metallatomene fast i krystallgitteret (fig. 6). Ioner av metallatomer i et krystallgitter, omgitt av mobile (løse) elektroner, kalles atomioner, i motsetning til vanlige ioner.
Det vi sa om krystallgitteret til metaller gjelder rene metaller, men vi vet at legeringer hovedsakelig brukes i praksis.