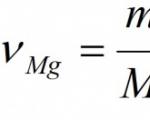Cálculos usando equações químicas. Cálculos usando equações químicas Trabalho 6 cálculos usando equações de reações químicas
Estequiometria- relações quantitativas entre substâncias reagentes.
Se os reagentes entram em uma interação química em quantidades estritamente definidas e, como resultado da reação, são formadas substâncias cuja quantidade pode ser calculada, então tais reações são chamadas estequiométrico.
Leis da estequiometria:
Os coeficientes nas equações químicas antes das fórmulas dos compostos químicos são chamados estequiométrico.
Todos os cálculos que utilizam equações químicas são baseados no uso de coeficientes estequiométricos e estão associados à descoberta de quantidades de uma substância (número de moles).
A quantidade de substância na equação de reação (número de moles) = o coeficiente na frente da molécula correspondente.
N / D=6,02×10 23 mol -1.
η - proporção da massa real do produto m p para um teoricamente possível eu t, expresso em frações de uma unidade ou em porcentagem.
Se o rendimento dos produtos da reação não estiver indicado na condição, então nos cálculos ele é considerado igual a 100% (rendimento quantitativo).
Esquema de cálculo usando equações de reação química:
- Escreva uma equação para uma reação química.
- Acima das fórmulas químicas das substâncias escreva quantidades conhecidas e desconhecidas com unidades de medida.
- Nas fórmulas químicas de substâncias conhecidas e desconhecidas, anote os valores correspondentes dessas quantidades encontradas na equação de reação.
- Componha e resolva uma proporção.
Exemplo. Calcule a massa e a quantidade de óxido de magnésio formado durante a combustão completa de 24 g de magnésio.
|
Dado: eu(Mg) = 24g Encontrar: ν (MgO) eu (MgO) |
Solução: 1. Vamos criar uma equação para uma reação química: 2Mg + O 2 = 2MgO. 2. Nas fórmulas das substâncias indicamos a quantidade de substância (número de moles) que corresponde aos coeficientes estequiométricos: 2Mg + O2 = 2MgO 2 moles 2 moles 3. Determine a massa molar do magnésio: Massa atômica relativa de magnésio Ar (Mg) = 24. Porque o valor da massa molar é igual à massa atômica ou molecular relativa, então M (Mg)= 24g/mol. 4. Usando a massa da substância especificada na condição, calculamos a quantidade da substância:
5. Acima a fórmula química do óxido de magnésio MgO, cuja massa é desconhecida, definimos xverruga, acima da fórmula do magnésio mg escrevemos sua massa molar: 1 toupeira xverruga 2Mg + O2 = 2MgO 2 moles 2 moles
De acordo com as regras para resolução de proporções:
Quantidade de óxido de magnésio ν (MgO)= 1 mol. 7. Calcule a massa molar do óxido de magnésio: M (Mg)=24g/mol, M(O)=16g/mol. M(MgO)= 24 + 16 = 40g/mol. Calculamos a massa do óxido de magnésio: m (MgO) = ν (MgO) × M (MgO) = 1 mol × 40 g/mol = 40 g. Responder: ν (MgO) = 1 mol; m (MgO) = 40g. |
Tudo o que você estuda, você
você estuda por si mesmo.
Petrônio
Lições objetivas:
- apresentar aos alunos as formas básicas de resolver problemas usando equações químicas:
- encontrar a quantidade, massa e volume dos produtos de reação a partir da quantidade, massa ou volume das substâncias iniciais;
- continuar a desenvolver competências no trabalho com o texto de um problema, a capacidade de escolher racionalmente um método para resolver um problema educacional e a capacidade de compor equações de reações químicas.
- desenvolver a capacidade de analisar, comparar, destacar o principal, traçar um plano de ação e tirar conclusões.
- cultivar a tolerância para com os outros, a independência na tomada de decisões e a capacidade de avaliar objetivamente os resultados do seu trabalho.
Formas de trabalho: frontal, individual, par, grupo.
Tipo de aula: combinada com o uso das TIC
I Momento organizacional.
Olá, pessoal. Hoje aprenderemos como resolver problemas usando equações de reações químicas. Slide 1 (ver apresentação).
Objetivos da lição Slide 2.
II.Atualização de conhecimentos, competências e habilidades.
A química é uma ciência muito interessante e ao mesmo tempo complexa. Para conhecer e compreender a química é necessário não apenas assimilar o material, mas também ser capaz de aplicar os conhecimentos adquiridos. Você aprendeu quais sinais indicam a ocorrência de reações químicas, aprendeu a escrever equações para reações químicas. Espero que você tenha um bom entendimento desses tópicos e possa responder minhas perguntas sem dificuldade.
Qual fenômeno não é sinal de transformações químicas:
a) o aparecimento de sedimentos; c) mudança de volume;
b) liberação de gás; d) o aparecimento de um odor. Diapositivo 3
Indique em números:
a) equações de reações compostas
b) equações de reações de substituição
c) equações de reações de decomposição Diapositivo 4
Para aprender a resolver problemas é necessário criar um algoritmo de ações, ou seja, determinar a sequência de ações.
Algoritmo para cálculos usando equações químicas (na carteira de cada aluno)
5. Escreva a resposta.
Vamos começar a resolver problemas usando um algoritmo
Cálculo da massa de uma substância a partir da massa conhecida de outra substância participante da reação
Calcule a massa de oxigênio liberada como resultado da decomposição
porções de água pesando 9 g.
Vamos encontrar a massa molar da água e do oxigênio:
M(H2O) = 18 g/mol
M(O 2) = 32 g/mol Diapositivo 6
Vamos escrever a equação da reação química:
2H 2 O = 2H 2 + O 2
Acima da fórmula na equação de reação escrevemos o que encontramos
o valor da quantidade de uma substância, e sob as fórmulas das substâncias -
razões estequiométricas exibidas
equação química
0,5mol x mol
2H 2 O = 2H 2 + O 2
2moles 1moles
Vamos calcular a quantidade de substância cuja massa queremos encontrar.
Para fazer isso, criamos uma proporção
0,5mol = hopmol
2moles 1moles
onde x = 0,25 mol Diapositivo 7
Portanto, n(O 2) = 0,25 mol
Encontre a massa da substância que precisa ser calculada
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0,25 mol 32 g/mol = 8 g
Vamos anotar a resposta
Resposta: m(O 2) = 8 g Diapositivo 8
Cálculo do volume de uma substância a partir da massa conhecida de outra substância participante da reação
Calcule o volume de oxigênio (nº) liberado como resultado da decomposição de uma porção de água pesando 9 g.

V(0 2)=?l(n.s.)
M(H2O) = 18 g/mol
Vm=22,4l/mol Diapositivo 9
Vamos escrever a equação da reação. Vamos organizar os coeficientes
2H 2 O = 2H 2 + O 2
Acima da fórmula na equação de reação escrevemos o valor encontrado da quantidade da substância, e sob as fórmulas das substâncias - as razões estequiométricas exibidas pela equação química
0,5 mol - x mol
2H 2 O = 2H 2 + O 2 Slide10
2moles - 1moles
Vamos calcular a quantidade de substância cuja massa queremos encontrar. Para fazer isso, vamos criar uma proporção
![]()
onde x = 0,25 mol
Vamos encontrar o volume da substância que precisa ser calculada
V(0 2)=n(0 2) Vm
V(O 2) = 0,25 mol 22,4 l/mol = 5,6 l (nº)
Resposta: 5,6 litros Diapositivo 11
III.Consolidação do material estudado.
Tarefas para solução independente:
1. Ao reduzir os óxidos Fe 2 O 3 e SnO 2 com carvão, foram obtidos 20 g de Fe e Sn. Quantos gramas de cada óxido foram ingeridos?
2. Nesse caso é formada mais água:
a) ao reduzir 10 g de óxido de cobre (I) (Cu 2 O) com hidrogênio ou
b) ao reduzir 10 g de óxido de cobre (II) (CuO) com hidrogênio? Diapositivo 12
Vamos verificar a solução do problema 1

M(Fe2O3)=160g/mol
M(Fe)=56g/mol, ![]()
m(Fe 2 O 3)=, m(Fe 2 O 3)= 0,18*160=28,6g
Resposta: 28,6g
Diapositivo 13
Vamos verificar a solução para o problema 2

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mol,
n(H2O)=0,07 mol
m(H2O) = 0,07mol*18g/mol=1,26g
Diapositivo 14
CuO + H 2 = Cu + H 2 O
n(CuO) = m/ M(CuO)
n(CuO) = 10g/ 80g/mol = 0,125 mol
0,125mol de lúpulo
CuO + H 2 = Cu + H 2 O
1mol 1mol
![]()
xmol = 0,125 mol, n(H2O) = 0,125 mol
m (H 2 O) = n * M (H 2 O);
m(H2O) = 0,125mol*18g/mol=2,25g
Resposta: 2,25g Diapositivo 15
Lição de casa: estude o material do livro didático p. 45-47, resolva o problema
Qual é a massa do óxido de cálcio e qual é o volume do dióxido de carbono (n.s.)
pode ser obtido pela decomposição do carbonato de cálcio pesando 250 g?
CaCO3 = CaO + CO Diapositivo 16.
Literatura
1.Gabriyan O.S. Programa do curso de química para 8ª a 11ª séries em instituições de ensino geral. M. Abetarda 2006
2. Gabrielyan O.S. Química. 8 ª série. Livro didático para instituições de ensino geral. Abetarda. M. 2005
3. Gorbuntsova S.V. Testes nas principais seções do curso escolar. 8ª a 9ª séries VAKO, Moscou, 2006.
4. Gorkovenko M.Yu. Desenvolvimentos de aulas de química. Aos livros didáticos de O.S. Gabrielyan, L.S. Guzey, V.V. Sorokin, R.P. Surovtseva e G.E. Rudzitis, F.G. Feldman. 8ª série VAKO, Moscou, 2004.
5. Gabrielyan O.S. Química. 8ª série: Testes e provas. – M.: Abetarda, 2003.
6. Radetsky A.M., Gorshkova V.P. Material didático de química para 8ª a 9ª série: Um manual para professores. – M.: Educação, 2000
Aplicativo.
Cálculos usando equações químicas
Algoritmo de ações.
Para resolver um problema de cálculo em química, você pode usar o seguinte algoritmo - siga cinco etapas:
1. Escreva uma equação para uma reação química.
2. Acima das fórmulas das substâncias, escreva quantidades conhecidas e desconhecidas com as unidades de medida correspondentes (somente para substâncias puras, sem impurezas). Se, de acordo com as condições do problema, substâncias contendo impurezas entrarem em reação, primeiro será necessário determinar o conteúdo da substância pura.
3. Nas fórmulas de substâncias conhecidas e desconhecidas, anote os valores correspondentes dessas quantidades encontradas na equação de reação.
4. Componha e resolva uma proporção.
5. Escreva a resposta.
A relação entre algumas grandezas físicas e químicas e suas unidades
Massa (m): g; kg; mg
Quantidade de substâncias (n): mol; quilomol; mmol
Massa molar (M): g/mol; kg/kmol; mg/mmol
Volume (V): l; m3/kmol; ml
Volume molar (Vm): l/mol; m3/kmol; ml/mmol
Número de partículas (N): 6 1023 (número Avagadro – N A); 6 1026; 6 1020
A lição é dedicada à continuação do estudo do tema “Equação de uma reação química”. A lição discute os cálculos mais simples usando a equação de uma reação química, relacionada à proporção das quantidades de substâncias que participam da reação.
Tópico: Ideias químicas iniciais
Lição: Equação de Reação Química
1. A proporção das quantidades de substâncias envolvidas na reação
Os coeficientes na equação da reação mostram não apenas o número de moléculas de cada substância, mas também a proporção das quantidades de substâncias que participam da reação. Assim, de acordo com a equação de reação: 2H2 + O2 = 2H2O - pode-se argumentar que para formar uma certa quantidade de água (por exemplo, 2 mol), o mesmo número de mols da substância simples hidrogênio (2 mol) e metade são necessários tantos moles da substância simples oxigênio (1 mol). Vamos dar exemplos de tais cálculos.
2. Tarefa 1
TAREFA 1. Vamos determinar a quantidade de substância oxigênio formada como resultado da decomposição de 4 moles de água.
ALGORITMO para resolver o problema:
1. Escreva a equação da reação
2. Faça uma proporção determinando as quantidades de substâncias de acordo com a equação de reação e de acordo com as condições do problema (designe a quantidade desconhecida de substância como x mol).
3. Faça uma equação (da proporção).
4. Resolva a equação, encontre x.
Arroz. 1. Formulação de uma breve condição e solução para o problema 1
3. Tarefa 2TAREFA 2. Que quantidade de oxigênio é necessária para queimar completamente 3 moles de cobre?Vamos usar um algoritmo para resolver problemas usando a equação de uma reação química.

Arroz. 2. Formulação de uma breve condição e solução para o problema 2.
Estude cuidadosamente os algoritmos e anote-os em um caderno, resolva você mesmo os problemas propostos
EU. Usando o algoritmo, resolva você mesmo os seguintes problemas:
1. Calcule a quantidade de substância de óxido de alumínio formada como resultado da interação do alumínio com uma quantidade de 0,27 mol de substância com uma quantidade suficiente de oxigênio (4Al +3O 2 =2Al2O3).
2. Calcule a quantidade de substância de óxido de sódio formada como resultado da interação de sódio com uma quantidade de 2,3 mol de substância com uma quantidade suficiente de oxigênio(4Na+O2 =2Na2O).
Algoritmo nº 1
Calcular a quantidade de uma substância a partir de uma quantidade conhecida da substância envolvida numa reação.
Exemplo. Calcule a quantidade de oxigênio liberada como resultado da decomposição da água com uma quantidade de substância de 6 mol.



II. Usando o algoritmo, resolva você mesmo os seguintes problemas:
1. Calcule a massa de enxofre necessária para obter óxido de enxofre (IV) com uma quantidade de substância de 4 mol (S + O 2
=SO2).
2. Calcule a massa de lítio necessária para obter cloreto de lítio com uma quantidade de substância de 0,6 mol (2Li+Cl2 = 2LiCl).
Algoritmo nº 2
Calcular a massa de uma substância a partir de uma quantidade conhecida de outra substância envolvida numa reação.
Exemplo: Calcule a massa de alumínio necessária para obter óxido de alumínio com uma quantidade de substância de 8 mol.



III. Usando o algoritmo, resolva você mesmo os seguintes problemas:
1. Calcule a quantidade de sulfeto de sódio se o enxofre pesando 12,8 g (2Na+S=Na2S) reage com o sódio.
2. Calcule a quantidade de substância de cobre formada se o óxido de cobre (II) pesando 64 g reagir com o hidrogênio (CuO + H2 = Cu + H2 O).
Estude o algoritmo com atenção e anote-o em seu caderno.
Algoritmo nº 3
Calcular a quantidade de uma substância a partir da massa conhecida de outra substância envolvida numa reação.
Exemplo. Calcule a quantidade de óxido de cobre (I) se o cobre pesando 19,2 g reage com o oxigênio.



Estude o algoritmo com atenção e anote-o em seu caderno.
4. Usando o algoritmo, resolva você mesmo os seguintes problemas:
1. Calcule a massa de oxigênio necessária para reagir com o ferro pesando 112 g
(3Fe + 4O2 =Fe3O4).
Algoritmo nº 4
Cálculo da massa de uma substância a partir da massa conhecida de outra substância participante da reação
Exemplo. Calcule a massa de oxigênio necessária para a combustão do fósforo, pesando 0,31 g.



TAREFAS PARA SOLUÇÃO INDEPENDENTE
1. Calcule a quantidade de substância de óxido de alumínio formada como resultado da interação do alumínio com uma quantidade de 0,27 mol de substância com uma quantidade suficiente de oxigênio (4Al + 3O2 = 2Al2 O3).
2. Calcule a quantidade de substância de óxido de sódio formada como resultado da interação do sódio com uma quantidade de substância de 2,3 mol com uma quantidade suficiente de oxigênio (4Na + O2 = 2Na2 O).
3. Calcule a massa de enxofre necessária para obter o óxido de enxofre (IV) com uma quantidade de substância de 4 mol (S+O2 =SO2).
4. Calcule a massa de lítio necessária para obter cloreto de lítio com uma quantidade de substância de 0,6 mol (2Li+Cl2 = 2LiCl).
5. Calcule a quantidade de sulfeto de sódio se o enxofre pesando 12,8 g (2Na+S=Na2S) reage com o sódio.
6. Calcule a quantidade de substância de cobre formada se o óxido de cobre (II) pesando 64 g reage com o hidrogênio (CuO + H2 = Cu + H2 O).
EXERCÍCIOS
Simulador nº 1 - Análise da equação da reação química
Simulador nº 6 - Cálculos estequiométricos
Resumo da lição “Cálculos usando equações químicas”
1. Verificando o dever de casa
Como lição de casa, você foi solicitado a colocar coeficientes nas equações de reação.Você pode ver o trabalho realizado durante o intervalo. Certamente haverá erros.Deu tudo certo, alguém tem alguma dúvida?Deixe-os falar sobre sua experiência em casa.
2. Divulgação do tema e atualização de conhecimentos
O tema da lição de hoje são cálculos usando equações químicas. Primeiro, vamos lembrar de tudo que pode ser útil para nós hoje. Já encontramos equações químicas em trabalhos de laboratório anteriores, em trabalhos de casa e ainda antes no tópico de compostos binários. Vamos lembrar a definição da equação de uma reação química.
(esta é uma notação convencional de uma reação química usando fórmulas e coeficientes químicos.)
Incrível.
Ao produzir qualquer composto, você precisa saber quanto material de partida usar para obter a massa necessária do produto da reação. Para fazer isso, crie uma equação para a reação química em andamento e, ao calcular massas levam em conta massas molares substâncias, e ao calcular volumes de gases leve em consideração o valorvolume molar gases
Quem se lembra do valor do volume molar dos gases em condições normais? (22,4 l/mol)
E quais são essas condições normais? (pressão 101,3 kPa e temperatura 0 o C)
Ou seja, nessas condições, 1 mol de QUALQUER gás ocupa um volume de 22,4 litros.
Na verdade, para resolver problemas, precisamos lembrar de várias quantidades:
Massa molar – M (g/mol)
Quantidade de substância – n (mol)
Volume – V (l)
É melhor assim: você lembra que a massa molar é numericamente igual à massa atômica relativa ou à massa molecular relativa de uma substância. Para isso, é necessário utilizar a tabela periódica, onde a massa atômica relativa é indicada na parte inferior de cada “célula”. Não esquecendo das regras de arredondamento, utilizamos o valor total dessa massa nos cálculos.
A Química é uma ciência muito clara, lógica e consistente, por isso será conveniente utilizar o ALGORITMO, que se encontra no livro didático, para resolver problemas. Esta é uma sequência universal de ações que serve para resolver qualquer problema deste tipo.
Por favor, abra o livro e vamos todos nos familiarizar com o algoritmo.
(aqui abrimos todos os nossos livros juntos, uma pessoa, talvez eu, lê o algoritmo, os restantes seguem para perceber o que têm que fazer agora)
Parece extenso, mas espero que não seja muito confuso. Vamos tentar descobrir com um exemplo.
Tarefa 1. Para produzir hidrogênio, o alumínio é dissolvido em ácido sulfúrico: 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 (O primeiro ponto do nosso algoritmo). Para a reação pegamos 10,8 g de alumínio. Calcule a massa de ácido sulfúrico consumida.
Dado: m(Al) = 10,8 g | Solução: m = 10,8 g m - ? 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 M=27g/mol M=98g/mol Aqui podemos mencionar que na verdade não entram na reação 2 átomos de alumínio e 3 moléculas de ácido, mas uma porção de átomos de alumínio e uma porção de moléculas de ácido. Esta parte da química é chamada de palavra abreviada “toupeira”. n=2 mols n=3 mols m = M ∙ n m=54gm=294g Cálculo por proporção: |
||||
m (H 2 SO 4 ) - ? |
|||||
10,8g | |||||
54g | 294g | ||||
10,8g ∙ 294g | |||||
54g | |||||
X = 58,8g Resposta: m (H 2 SO 4 ) = 58,8 g |
|||||
Essa é toda a solução para o problema. Tem perguntas? Vamos falar sobre a solução mais uma vez:
Formou uma equação
Acima das substâncias assinamos o que SABEMOS e o que QUEREMOS ENCONTRAR
Nas fórmulas anotamos a massa molar, a quantidade de substância eestequiométrico massa da substância ( é melhor indicar “massa de acordo com a tabela periódica”)
Compôs uma proporção
Resolvi a proporção
Gravei a resposta
Vamos resolver um problema semelhante, mas com substâncias gasosas (aqui não usaremos a massa molar da substância, mas o quê?...volume molar)
Problema 2. 25 gramas o zinco é dissolvido em ácido clorídrico, durante a reação química é liberado um gás - hidrogênio. Calcule o volume de hidrogênio liberado.
Dado: m(Zn) = 10,8g | Solução: m=25g V - ? Zn + 2HCl → ZnCl 2 + H 2 M = 65 g/mol V m = 22,4 l/mol n = 1 mol m = 65 g V = 22,4 l Cálculo por proporção: |
||||
m(HCl) - ? |
|||||
25g | |||||
65g | 22,4 litros | ||||
25g ∙ 22,4l | |||||
65g | |||||
X = 8,61 litros Resposta: V(H 2 ) = 8,61 l |
|||||
Vamos verificar como você domina o material. Usando o mesmo algoritmo, resolva o problema:
NÃO É UM FATO QUE VOCÊ TERÁ SUCESSO:
Ao reagir com utilizando óxidos de carvão Fe2O3 (primeira opção) e SnO2 (segunda opção) receberam cada um 20 g de Fe e Sn. Quantos gramas de cada óxido foram ingeridos?
Observe que agora estamos calculando a massa das substâncias iniciais, não dos produtos da reação)
(deixe que todos resolvam em um caderno e peça seletivamente que mostrem a solução, vamos escrever a equação todos juntos no quadro, e todos tentarão resolvê-la sozinhos)
Fe2O3 + 3C = 2Fe + 3COm(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 g
Lição de casa: estude o material do livro didático p. 146-150, resolva o problema
Qual é a massa do óxido de cálcio e qual é o volume do dióxido de carbono (n.s.)
pode ser obtido pela decomposição do carbonato de cálcio pesando 250 g?DEVE SER DADO AOS ESCOLARESEQUAÇÃO PRONTAPARA CONCLUIR ESTA TAREFA
Desenvolvimento metodológico da aula (2 horas)
Cálculos usando equações químicas
Khapugina Polina Ivanovna,
professor de química escola secundária GBOU 277
Distrito Kirovsky de São Petersburgo
Lições objetivas: Ensine os alunos da oitava série a fazer cálculos usando equações químicas: encontre a quantidade, massa e volume dos produtos da reação a partir da quantidade, volume e massa das substâncias iniciais.
Durante as aulas:
Antes de prosseguirmos no estudo de um novo tema, precisamos nos lembrar das quantidades e fórmulas que você já conhece. Lembre-se dos tipos de reações químicas. E você já sabe criar equações químicas e equalizá-las. Vamos testar seus conhecimentos fazendo o seguinte: teste de avaliação.(o conteúdo da prova pode ser visualizado em meu site pessoal na pasta arquivos e fotos)
Explicação do professor:
1. Antes de aprender a fazer cálculos usando equações químicas, você precisa lembrar mais uma vez as fórmulas que já conhecemos para encontrar a quantidade de uma substância, massa e volume de substâncias, em uma etapa você pode testar a si mesmo após o trabalho realizado . Para isso, recorramos à seguinte apresentação, que ajudará a restaurar nosso conhecimento na memória. Apresentação nº 1.
Anote as fórmulas que você já conhece em seu caderno:
n- quantidade de substância (mol)
m- massa da substância (g)
M - massa molar (g/mol)
V - volume de gás (l)
V m - volume molar = 22,4 l/mol
n = m/M; m = n.M
n = V/Vm; V = n.V m
2. Agora, devemos entender que uma equação química mostra não apenas o lado qualitativo (transformação de substâncias) do processo, mas também o lado quantitativo do mesmo. Para fazer isso, vamos recorrer ao seguinte Apresentações#2(a apresentação pode ser visualizada em meu site pessoal na pasta de arquivos e fotos)
Escreva no seu caderno:
O coeficiente na equação de reação indica o número de partículas, e o número de partículas, por sua vez, determina o número de moles!
2H₂ + Ó₂ = 2H₂ SOBRE
Número de partículas 2 moléculas 1 moléculas 2 moléculas
Quantidade ↓ ↓ ↓
substâncias,n2 moles 1 mole 2 moles
2 Fé(OH)3 = Fé2 Ó3 + 3 H2 Ó
↓ ↓ ↓
n= 2mol 1mol 3mol
3. A próxima etapa que devemos examinar é a capacidade de criar uma proporção usando a equação de reação, bem como resolvê-la. Para fazer isso, vamos recorrer ao seguinte Apresentações 3.(a apresentação pode ser visualizada em meu site pessoal na pasta de arquivos e fotos)
Escreva no seu caderno:
Conhecido pela condição: 2 mol X mol (numerador)
4P+5O₂ = 2P₂ Ó₅
Conhecido pela equação: 4 mol 5 mol 2 mol (denominador)
Vamos compor e resolver a proporção:
2 mol X mol
_______ = _______
4 mol 2 mol
X toupeira = 2 mol. 2 mol= 1 mol
4 mol
X =n(P₂ Ó₅ )= 1mol
4. Passemos à resolução de problemas usando equações de reações químicas. Para resolver um problema de cálculo em química, você precisa usar o seguinte algoritmo - execute cinco etapas. Apresentação 4. (a apresentação pode ser visualizada em meu site pessoal na pasta de arquivos e fotos) Livro didático página 101
No seu caderno:
Os alunos recebem um algoritmo de solução pronto para colar em seus cadernos.
Algoritmo para resolução de problemas de cálculo usando equações de reações químicas:
1. Crie uma equação para uma reação química (ou seja, certifique-se de definir os coeficientes!)
2. Acima das fórmulas correspondentes na equação, anote os dados quantitativos sobre as substâncias com unidades de medida conhecidas ou que podem ser calculadas com base nas condições do problema, e o valor desejado X também com unidades de medida.
3. Nessas fórmulas, anote as quantidades quantitativas correspondentes especificadas pela própria equação, também com unidades de medida.
4. Componha e resolva uma proporção.
5. Formalize a resposta.
5. Vamos resolver o problema.
Calcule a massa de água que se forma como resultado da interação de 0,5 mol de óxido de alumínio com ácido sulfúrico quando aquecido.
Leia o problema.
Escreva a declaração do problema. (Dado, encontre.)
No seu caderno: (os alunos escrevem a solução de acordo com as explicações do professor de acordo com Apresentações 5 ) (a apresentação pode ser visualizada em meu site pessoal na pasta de arquivos e fotos)
Dado:
n(Al₂O₃)=0,5 mol
_________________
Encontrar:
Solução:
n=0,5 mol X mol
Al₂ Ó₃ +3 H₂ ENTÃO₄ = Al₂ (ENTÃO₄ ) ₃ +3 H₂ Ó
n= 1 mol 3 mol
M = 102 g/mol 18 g/mol
Cálculo do peso molecular:
Mr(Al₂O₃)= 2,27+3,16= 54+48=102
Mr(H₂O)= 2,1+16=18
Componha e resolva uma proporção.
0,5 mol = X toupeira
1 toupeira 3 toupeiras
X toupeira =n(H₂ Ó) = 0,5 mol. 3 mol= 1,5 mol
1 toupeira
Vamos encontrar a massa de água.
eu(H₂ Ó) = n(H₂ Ó) . M(H₂ Ó)
eu(H₂ Ó) = 1,5 mol.18 g/mol = 27 g
Responder:eu(H₂ Ó)=27g
6. Resolva os problemas sozinho.
Dois alunos são chamados ao quadro para avaliação.
1. Determine o volume de cloro (nº) necessário para obter 634 g de cloreto de alumínio de acordo com a equação: 2Al + 3Cl 2 = 2AlCl 3. Resposta: 159,6 litros
2. Calcule a quantidade de substância e massa de lítio necessária para a reação com oxigênio pesando 128 g de acordo com a equação: 4Li + O 2 = 2Li 2 O Resposta: 16 mol, 112 g
7. Lição de casa.
Tarefa.
Encontre a massa de óxido de zinco, que é formada pela interação de 13 g de zinco com oxigênio.