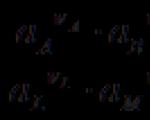Eletroquímica. Célula galvânica Célula eletroquímica
Elementos eletroquímicos. Força eletromotriz. Termodinâmica de uma célula galvânica. Medição de campos eletromagnéticos.
Dupla camada elétrica, mecanismo de ocorrência e estrutura.
ELEMENTOS GALVÂNICOS. EMF.
Quando uma corrente elétrica passa através de um eletrólito, ocorrem reações eletroquímicas na superfície dos eletrodos. A ocorrência de reações eletroquímicas pode ser gerada por uma fonte de corrente externa. O fenômeno oposto também é possível: as reações eletroquímicas que ocorrem em dois eletrodos imersos em um eletrólito geram uma corrente elétrica, e as reações ocorrem apenas em circuito fechado (quando a corrente passa).
Célula eletroquímica (ou galvânica) é um dispositivo para produzir corrente elétrica através de reações eletroquímicas. O elemento eletroquímico mais simples consiste em dois eletrodos metálicos (condutores do primeiro tipo), baixados em um eletrólito (condutor do segundo tipo) e conectados entre si por um contato metálico. Vários elementos eletroquímicos conectados em série formam circuito eletroquímico .
A característica quantitativa mais importante de um elemento eletroquímico é a força eletromotriz(EMF, E), que é igual à diferença de potencial elemento aberto corretamente (aquele em que condutores do primeiro tipo do mesmo material são conectados aos eletrodos finais do elemento).
Se, quando uma corrente elétrica passa em direções diferentes, ocorre a mesma reação na superfície do eletrodo, mas em direções opostas, então tais eletrodos, bem como o elemento ou circuito que os compõem, são chamados reversível . A fem de elementos reversíveis é sua propriedade termodinâmica, ou seja, depende apenas de T, P, da natureza das substâncias que compõem os eletrodos e das soluções e da concentração dessas soluções. Um exemplo de elemento reversível é Elemento Daniel-Jacobi :
(-) Cu çZn çZnSO 4 ççCuSO 4 çCu (+)
em que cada eletrodo é reversível. Quando o elemento opera, ocorrem as seguintes reações: Zn ® Zn 2+ + 2 e, Cu 2+ + 2 e® Cu. Quando uma corrente de intensidade infinitesimal passa de uma fonte externa, ocorrem reações reversas nos eletrodos.
Um exemplo de elemento irreversível é Elemento Volta :
(-) Zn ç H 2 SO 4 ç Cu (+)
Quando o elemento opera, ocorrem as seguintes reações: Zn ® Zn 2+ + 2 e, 2H + + 2 e®H2. Ao passar corrente de uma fonte externa, as reações do eletrodo serão: 2H + + 2 e® H 2 , Cu ® Cu 2+ + 2 e .
O EMF de um elemento eletroquímico é um valor positivo, porque corresponde a um certo processo espontâneo que produz trabalho positivo. O processo inverso, que não pode ocorrer de forma independente, corresponderia a um CEM negativo. Ao compor uma cadeia de elementos eletroquímicos, o processo em um dos elementos pode ser direcionado de forma que seja acompanhado pelo dispêndio de trabalho externo (processo não espontâneo), utilizando para isso o trabalho de outro elemento da cadeia em qual ocorre um processo espontâneo. A fem total de qualquer circuito é igual à soma algébrica de quantidades positivas e negativas. Portanto, é muito importante ao escrever um diagrama de circuito levar em consideração os sinais do EMF, utilizando as regras aceitas.
A fem do circuito eletroquímico é considerada positiva, se, ao escrever o circuito, o eletrodo direito estiver carregado positivamente em relação ao esquerdo (durante a operação do circuito, os cátions passam na solução do eletrodo escrito à esquerda em direção ao eletrodo escrito à direita, e os elétrons se movem em mesma direção no circuito externo). Exemplo.
TERMODINÂMICA DE UMA CÉLULA GALVÂNICA .
Deixe a reação prosseguir de forma reversível e isotérmica em um sistema eletroquímico:
n A A + n B B + ... ± nF Û n L L + n M M + ... ±
A energia elétrica gerada pelo elemento é igual ao trabalho útil A¢ do processo total. O trabalho útil A¢ do processo reversível é máximo e em P,T = const é igual à diminuição do potencial isobárico do sistema:
DG P, T = nFE P, T
E P , T - EMF reversível do sistema.
E P,T = -DG P,T / nF , E V,T = -DF V,T / nF
Assim, medindo o EMF do elemento e seu coeficiente de temperatura, é possível encontrar os valores de DG e DS para todo o processo que ocorre na célula galvânica. Este processo é espontâneo, portanto DG< 0.
Usando a equação de Gibbs-Helmholtz, podemos calcular a mudança na entalpia do processo:
DH = DG - T = -nFE P + TnF
nFE P = -DH + nFT = + nFT
nFE V = -DU + nFT = + nFT
Das equações segue-se que a relação entre a energia elétrica gerada ou absorvida reversivelmente em um sistema eletroquímico e o efeito térmico da reação que ocorre nele depende do sinal e da magnitude do coeficiente de temperatura da fem dE/ dT :
1. SedE / dT > 0 , então nFE > (DG > DH) e o sistema converterá em energia elétrica não apenas a quantidade de calor que corresponde ao efeito térmico da reação, mas também calor adicional - O calor de Peletier Q P = nFT dE/ dT emprestado do meio ambiente. Em condições adiabáticas (em condições de isolamento térmico, quando a troca com o meio ambiente é impossível), a T do sistema diminui. O resfriamento do sistema é especialmente perceptível se dE/ dT > 0 < 0 (реакция эндотермична).
2. SedE / dT < 0 , então nFE< (DG < DH) и часть теплоты реакции будет рассеиваться в виде теплоты Пелетье. В адиабатическом режиме система будет нагреваться.
3. SedE / dT = 0 , então DG = DH e nFE = - a energia elétrica produzida reversivelmente pelo sistema é equivalente ao efeito térmico da reação química. Essa relação é conhecida como Princípio de Thomson (regra) .
Para calcular o EMF, as equações podem ser reescritas como:
Ao usar equações, deve-se lembrar que elas válido apenas para sistemas eletroquímicos reversíveis, portanto, ao estudar a dependência do CEM em T, é necessário evitar o uso de sistemas eletroquímicos com limites líquidos, pois os potenciais de difusão que surgem neles não estão em equilíbrio.
Vamos associar o EMF do elemento à constante de equilíbrio da reação que ocorre no elemento. Equação da isoterma da reação química:
DG = TR Em K a - TR
E = - = Em K a -
O primeiro termo no lado direito da equação para determinado P, T é um valor constante; pode ser denotado por E o. E o - EMF padrão de um elemento (sistema eletroquímico) , ou seja EMF em tudo um eu = 0.
E = E o + Em
 = Eo + 2,303 LG
= Eo + 2,303 LG 
Assim, o EMF de um sistema eletroquímico é uma função das atividades dos participantes da reação eletroquímica. As equações acima permitem calcular os valores de DG e K A com base nos valores experimentais de E e, inversamente, calcular E, conhecendo as características termodinâmicas da reação química.
MEDIÇÃO DE EMF .
Para medir o valor de equilíbrio (reversível) do EMF de um elemento eletroquímico, é necessário que o processo ocorra infinitamente lentamente, ou seja, de modo que o elemento opere com uma corrente infinitesimal. Esta condição é atendida no método de compensação, que se baseia no fato de o elemento ser conectado em série contra uma diferença de potencial externa e esta última ser selecionada de forma que não haja corrente no circuito. Então a diferença de potencial externa é igual à EMF do circuito.
Usando o método de compensação, você pode medir diretamente o valor do EMF, mas esta é uma operação bastante complicada, pois na prática laboratorial eles preferem comparar o EMF do elemento em estudo com o EMF do chamado padrão (normal) elementos, que são cuidadosamente medidos em diferentes T. Este método comparativo também é uma compensação.
O elemento normal básico é elemento Weston saturado .
(Circuito de medição EMF - independentemente).
ESTRUTURA DO LIMITE DO ELETRODO - SOLUÇÃO. CAMADA ELÉTRICA DUPLA .
Quando um condutor do primeiro tipo entra em contato com um eletrólito, um dupla camada elétrica . Como exemplo, considere um eletrodo de cobre imerso em uma solução de CuSO 4. O potencial químico dos íons cobre em um metal em um determinado T pode ser considerado constante, enquanto o potencial químico dos íons cobre em solução depende da concentração de sal; em geral, esses potenciais químicos não são iguais.
Seja a concentração de CuSO 4 tal que >. Então, quando o metal é imerso na solução, alguns dos íons Cu 2+ da solução são desidratados e transferidos para o metal, criando nele uma carga positiva. Esta carga impedirá a transferência adicional de íons Cu 2+ da solução para o metal e levará à formação de uma camada de ânions SO 4 2- atraídos por ele próximo ao eletrodo. O assim chamado equilíbrio eletroquímico , no qual os potenciais químicos dos íons no metal e na solução diferirão pela magnitude da diferença de potencial da dupla camada elétrica resultante (DEL):
A diferença de potencial elétrico e a diferença de potencial químico são compensadas no equilíbrio eletroquímico.
Deixe a concentração de CuSO 4 ser tão baixa que< . В этом случае при погружении металла в раствор будет наблюдаться обратный процесс перехода ионов меди из кристаллической решетки металла в раствор и электрод окажется заряженным отрицательно. Этот заряд будет препятствовать дальнейшему переходу ионов Cu 2+ в раствор, установится новое электрохимическое равновесие.
Você pode escolher uma concentração de eletrólito na qual os potenciais químicos dos íons no metal e na solução sejam iguais. Soluções desta concentração são chamadas soluções zero . Quando um metal é imerso em sua solução zero, nenhuma EDL ocorre na superfície do eletrodo; porém, mesmo neste caso, a diferença de potencial entre o metal e a solução não é zero.
Segundo Nernst, a única fonte de CEM de uma célula eletroquímica é o CEM na superfície dos eletrodos. Nernst definiu o potencial dos metais em uma solução zero como potencial zero absoluto. Nas obras de A. N. Frumkin foi demonstrado que as ideias de Nernst estão incorretas. Foi estabelecido experimentalmente que o EMF de um elemento composto por dois eletrodos diferentes imersos em suas soluções zero difere muito significativamente de zero (talvez mais de 1 V). O potencial de um metal em uma solução zero, chamado potencial de carga zero , não pode ser considerado como potencial zero absoluto.
TEORIA DA CAMADA DUPLA DE HELMHOLTZ CONDENSADA. A primeira teoria quantitativa da estrutura do DEL na interface metal-solução foi criada por Helmholtz (1853). Segundo Helmholtz, um EDL pode ser comparado a um capacitor plano, uma das placas coincide com o plano que passa pelas cargas superficiais do metal, a outra com o plano que conecta os centros das cargas dos íons na solução, atraído para a superfície do metal por forças eletrostáticas. Espessura de camada dupla eu igual ao raio do íon R. De acordo com a condição de neutralidade elétrica, o número de íons atraídos para a superfície do metal deve ser tal que suas cargas compensem as cargas superficiais do metal, ou seja,
A teoria de uma dupla camada condensada permite obter valores de capacitância EDL consistentes com o experimento e uma espessura fisicamente plausível da EDL. No entanto, não pode interpretar muitas regularidades experimentais: os valores do potencial eletrocinético (potencial x) encontrados experimentalmente e sua dependência da concentração do eletrólito, a mudança no sinal da carga na superfície do metal na presença de um surfactante .
TEORIA DA GUI DE CAMADA DUPLA DIFUSA- CHAPMAN. A teoria de Helmholtz não leva em consideração que as propriedades do DES mudam com a concentração do eletrólito e T. Gouy (1910) e Chapman (1913) tentaram relacionar a densidade de carga no DES com a composição da solução. Eles levaram em consideração que além das forças eletrostáticas que surgem entre o metal e os íons, os íons também são afetados pelas forças do movimento molecular térmico. Quando essas duas forças são aplicadas, os íons na solução devem ser distribuídos difusamente em relação à superfície do metal, com a densidade volumétrica de carga diminuindo com a distância dela.
Gouy e Chapman acreditavam que os íons podem ser considerados como pontos materiais que não possuem volume próprio, mas possuem carga, e que sua distribuição no campo de carga do eletrodo obedece à distribuição de Boltzmann.
A teoria de Gouy-Chapman concorda melhor do que a teoria de Helmholtz com as leis dos fenômenos eletrocinéticos. Se assumirmos que a partir de uma certa distância eu 1 íons não estão mais firmemente ligados à superfície do eletrodo com movimento relativo das fases sólida e líquida, então o potencial correspondente a esta distância pode ser considerado o potencial x (x< j). Однако теория не объясняет изменение знака x-потенциала и перезарядку поверхности с изменением состава раствора. Кроме того, теория Гуи-Чапмана оказывается менее удовлетворительной, чем теория Гельмгольца, при использовании ее для количественных расчетов емкости ДЭС, т.к. она не учитывает собственного объема ионов, которые отождествляются с материальными точками.
Assim, a teoria de Gouy-Chapman justifica-se melhor onde a teoria de Helmholtz se revela inaplicável e, inversamente, esta última dá melhor convergência com a experiência nos casos em que a primeira dá resultados incorretos. Consequentemente, a estrutura do DES deve corresponder a alguma combinação dos modelos propostos por Helmholtz e Gouy-Chapman. Esta suposição foi feita por Stern (1924) em sua teoria de adsorção de DEL.
TEORIA DE ADSORÇÃO DE SEVERA. Stern acreditava que uma determinada parte dos íons fica retida próxima à interface metal-eletrólito, formando uma Helmholtz ou placa condensada de dupla camada com espessura correspondente ao raio médio dos íons eletrolíticos. Os íons restantes incluídos no EDL são distribuídos difusamente com uma densidade de carga diminuindo gradualmente. Para a parte difusa do EDL, Stern, assim como Gouy, negligenciou os tamanhos intrínsecos dos íons. Além disso, Stern sugeriu que na parte densa do EDL, os íons são retidos não apenas devido a forças eletrostáticas, mas também a forças específicas de adsorção, ou seja, forças de origem não coulombiana. Portanto, em soluções contendo íons tensoativos, seu número na parte densa do EDL pode exceder a carga da superfície metálica em uma certa quantidade, dependendo das propriedades dos íons e da carga do metal. Assim, segundo Stern, dois modelos de DES devem ser distinguidos, um dos quais se refere a soluções de eletrólitos superficialmente inativos, o outro a soluções contendo íons especificamente adsorvidos.
Na teoria da adsorção a igualdade também é preservada:
Q M = q L = q 1 + q 2
A densidade de carga no lado da solução q L consiste em duas partes: a densidade de carga na camada de Helmholtz q 1 e a densidade de carga na camada difusa q 2 .
A teoria de Stern nos permite definir o potencial x como a queda de potencial na parte difusa do EDL, onde a forte ligação entre o metal e os íons já foi perdida. Com esta definição, o potencial x não deve coincidir com o potencial Nerst, como é observado experimentalmente. A teoria de Stern foi capaz de explicar a recarga da superfície de um corpo sólido.
Em uma concentração infinitesimal, todas as cargas na solução são distribuídas difusamente, e a estrutura do EDL é descrita pela teoria de Gouy-Chapman. Pelo contrário, em soluções concentradas a estrutura do DES aproxima-se do modelo proposto por Helmholtz. Na região de concentrações médias, onde x é comparável em magnitude ao RT/F, sua dependência da concentração pode ser expressa por equações aproximadas:
para valores positivos x: x = B - Em Com
para valores negativos de x: x = B¢ + Em Com
A teoria de Stern fornece uma imagem qualitativamente correta do DEL. A determinação da capacitância usando o modelo Stern é consistente com a experiência tanto em termos dos valores de capacitância quanto na natureza de sua dependência do potencial do eletrodo e da concentração da solução. Mas a teoria de Stern não está isenta de deficiências. Estes incluem a impossibilidade de uma descrição quantitativa das curvas de capacitância, especialmente quando se afasta do potencial de carga zero.
DESENVOLVIMENTO ADICIONAL DA TEORIA DE DES STANDING. Muitas tentativas foram feitas para desenvolver uma teoria do DES que fosse quantitativamente consistente com os dados experimentais (Rice, Frumkin et al., Bockris, Devanathan, Esin, Muller, Parsons, Ershler, etc.). O modelo mais amplamente aceito é Graham (1947). Segundo Graham, o revestimento DES na solução consiste não em duas, mas em três partes. O primeiro, contado a partir da superfície do metal, é denominado plano interno de Helmholtz; contém apenas íons tensoativos (a carga do avião é q 1) ou, se não estiverem em solução, moléculas de solvente (q 1 = 0); seu potencial relacionado à solução é denotado por y 1. O próximo, removido da superfície do metal a uma distância que os íons (seus centros de carga) podem se aproximar, é chamado de plano externo de Helmholtz; sua carga total é q 2 e o potencial do avião é y 2. Atrás do plano externo de Helmholtz existe uma camada difusa com potencial variando de y 2 a zero e com densidade de carga coincidente com q 2 .
O modelo de Graham reflete as principais características e características da estrutura do DES metal-eletrólito. Permite calcular curvas de capacitância diferencial para qualquer concentração de um determinado eletrólito se houver uma curva experimental para pelo menos uma de suas soluções. No entanto, este modelo não cobre todos os aspectos do problema.
Quando uma corrente elétrica passa através de uma solução, as correntes fluem na superfície dos eletrodos. reações eletroquímicas, que são acompanhados pelo fluxo de elétrons de ou para o eletrodo. Nos processos inversos, as reações eletroquímicas que ocorrem nas interfaces entre os condutores do primeiro e do segundo tipo levam à geração de uma corrente elétrica.
Os processos eletroquímicos diferem das reações químicas convencionais em vários aspectos.
Uma reação química só é possível quando as partículas reagentes colidem. Quando eles entram em contato, é possível que os elétrons sejam transferidos de uma partícula para outra. Se tal transição realmente ocorrerá depende da energia das partículas e de sua orientação mútua. A energia de ativação depende da natureza da reação química e, para reações iônicas, geralmente é baixa. O caminho de transição dos elétrons é muito curto, o que também é uma característica da reação química. Colisões de partículas podem ocorrer em qualquer ponto do espaço de reação em diferentes posições mútuas, portanto, transições eletrônicas podem ocorrer em direções arbitrárias, ou seja, As características do processo químico são a aleatoriedade das colisões e a falta de direcionalidade das transições eletrônicas. Como resultado, os efeitos energéticos das reações químicas aparecem principalmente na forma de calor (também é possível um pequeno trabalho de expansão).
Para que as mudanças de energia correspondentes a uma transformação química se manifestem na forma de energia elétrica, ou seja, Para que o processo eletroquímico prossiga é necessário alterar as condições de reação.
A energia elétrica está sempre associada à passagem de corrente elétrica, ou seja, fluxo de elétrons em uma determinada direção. Portanto, a reação deve ser realizada de forma que as transições eletrônicas não sejam aleatórias, mas ocorram em uma direção, e seu caminho seja significativamente maior que o tamanho atômico. Portanto, em processos eletroquímicos, a transição dos elétrons de um participante para outro deve ocorrer a uma distância considerável, para a qual é necessária a separação espacial dos participantes da reação. No entanto, a separação espacial por si só não é suficiente, pois simplesmente fará com que a reação pare.
Para realizar o processo eletroquímico, são necessárias condições adicionais: os elétrons devem ser arrancados de algumas partículas e transferidos para outras de uma forma comum. Isso pode ser conseguido substituindo o contato direto entre os participantes da reação pelo contato com dois metais conectados entre si por um condutor metálico. Para que o fluxo de elétrons seja contínuo, também é necessário garantir a passagem da corrente elétrica pelo espaço de reação, o que geralmente é realizado pelos próprios participantes da reação eletroquímica (se estiverem no estado ionizado) ou por compostos especiais com alta condutividade iônica.
Um dispositivo para produzir energia elétrica através de reações eletroquímicas é chamado eletroquímico(ou galvânico)elemento. O elemento eletroquímico mais simples consiste em dois eletrodos metálicos (condutores do primeiro tipo) imersos em uma solução eletrolítica (condutor do segundo tipo).
Se, quando uma corrente elétrica passa em direções diferentes, ocorre a mesma reação na superfície do eletrodo, mas em direções opostas, então tais eletrodos, assim como os elementos eletroquímicos compostos por eles, são chamados reversível. Um exemplo de elemento reversível é o elemento Daniel – Jacobi
(–)Zn | ZnSO 4, solução || CuSO4, solução | Cu(+)
Quando tal elemento opera, ocorrem reações eletroquímicas nos eletrodos:
Zn Zn 2 + + 2e
Cu 2 + + 2eCu
A equação geral da reação em um elemento pode ser representada como
Zn + Cu 2 + Zn 2 + + Cu
Quando uma corrente infinitesimal de uma fonte externa passa através do elemento, essas reações ocorrem na direção oposta.
Exemplo irreversível elemento é o elemento Volta
(–)Zn | H2SO4 | Cu(+)
Quando tal elemento opera, ocorrem as seguintes reações nos eletrodos:
Zn Zn 2 + + 2e
2H + + 2eH 2 ,
e a reação no elemento é representada pela equação
Zn + 2H + Zn 2+ + H 2
Quando a corrente passa de uma fonte externa, outras reações ocorrem nos eletrodos:
Cu Cu 2 + + 2e,
aqueles. em uma célula eletroquímica, o cobre se dissolve em ácido sulfúrico com liberação de hidrogênio:
Cu + 2H + Cu 2 + + H 2
A característica mais importante de uma célula eletroquímica é a sua força eletromotriz(EMF) E– diferença de potencial de um elemento devidamente aberto, ou seja, a diferença de potencial entre as extremidades dos condutores do primeiro tipo do mesmo material conectados aos eletrodos de uma célula galvânica. Em outras palavras, EMF é a diferença de potencial sob condições de equilíbrio quando nenhuma corrente elétrica flui no circuito. Se você fechar os eletrodos, uma corrente elétrica fluirá no circuito e a diferença de potencial representa tensão um elemento eletroquímico que difere do EMF pela quantidade de queda de tensão na resistência interna do elemento.
A finalidade dos elementos eletroquímicos é promover o movimento dos elétrons no circuito externo no qual o elemento útil está incluído.
carregar. Assim, para cumprir sua tarefa, uma célula a combustível deve conter uma fonte e um sumidouro de elétrons (Fig. 7.1).
As reações que ocorrem em uma célula eletroquímica são chamadas de reação-redução, pois o termo “oxidação” corresponde ao processo de liberação de elétrons, e o termo “redução” corresponde ao processo de liberação de elétrons.
O significado de numerosos conceitos científicos desatualizados muitas vezes não é claro a partir dos seus nomes. Os termos “oxidação” e “redução” requerem explicação. No Sudeste, oxigênio (oxigênio) vem da raiz latina oxus (azedo ou quente, picante) e significa “produtor de ácido”. Este nome foi usado pela primeira vez no trabalho de Morveau e Lavoisier “Nomenclature Chimique”, publicado em 1787. Naquela época, os químicos aderiram a uma crença errônea. que o oxigênio é o principal elemento incluído nos ácidos; quando um ácido é dissolvido na água, parte dos átomos de hidrogênio incluídos em sua composição perde seu elétron - a água torna-se ácida e o hidrogênio é oxidado. Analiticamente, qualquer reação associada ao processo de perda de elétrons é chamada de oxidação. A reação inversa – a reação de captura de elétrons – é chamada de transformação.
Fluxo
Elétrons J
Fonte de elétrons >
(oxidação)
Positivo< -
direção da corrente elétrica Fig. 7.1. Uma célula eletroquímica deve conter uma fonte e um sumidouro de elétrons
Numa célula eletroquímica, a reação global é dividida em duas reações intermediárias que ocorrem em áreas separadas do dispositivo. Essas áreas são fundidas pelo eletrólito, que é condutor de íons, mas conduz os elétrons liberados na reação de oxidação intermediária, os elétrons podem entrar na área onde ocorre a reação de redução, mas através de um circuito externo. Assim, surge uma corrente elétrica no circuito externo, e a célula eletroquímica é sua fonte - essa é a sua finalidade. A direção positiva do elétrico a no circuito externo foi acordada como sendo a direção da região de oxidação redutora do elemento - a corrente elétrica sai do elemento da região de redução, que é, portanto, o cátodo do combustível - o elemento, e entra na região de oxidação, que é o ânodo. Como em qualquer outra fonte elétrica, o cátodo está carregado positivamente
eletrodo ativo e o ânodo é um eletrodo carregado negativamente. Quando se trata de consumidores de energia elétrica (carga), os nomes mudam para o contrário. Na introdução ao cap. 6 Os termos “ânodo” e “cátodo” são discutidos com mais detalhes.
Como exemplo de célula eletroquímica, considere uma membrana que desempenha o papel de um eletrólito. Deixe uma das superfícies laterais das membranas estar em contato com o hidrogênio. Em condições normais, o gás consistirá predominantemente de hidrogénio molecular, mas um pequeno número de moléculas pode dissociar-se em átomos.
e alguns dos átomos irão oxidar (ionizar), ou seja, perder seus elétrons
N -> Nt + e~ .
Como a membrana é impermeável aos elétrons, todos eles permanecerão de um lado dela, enquanto os íons formados passam por diff; através da membrana eles se encontrarão do outro lado. Nesse caso, os íons carregam uma carga positiva, de modo que a superfície da membrana na qual o hidrogênio está localizado ficará carregada negativamente devido ao excesso de elétrons acumulados nela, e a superfície oposta ficará carregada positivamente devido ao positivo íons que apareceram nele devido à difusão. O campo elétrico faz com que alguns dos íons se movam na direção oposta à superfície de “hidrogênio” da membrana. O equilíbrio dinâmico no sistema em consideração é estabelecido quando o fluxo de difusão de íons é st. i é igual à corrente reversa.
Agora vamos aplicar pó eletricamente condutor em ambas as superfícies da membrana. Isso resultará em duas camadas porosas eletricamente condutoras que atuarão como eletrodos. Vamos conectar um aquecedor externo1 aos eletrodos, garantindo a ligação elétrica dos eletrodos. Resistência de carga a Rl significativo. Os íons não conseguem se movimentar no circuito externo, e os elétrons passam a se deslocar da parte do “hidrogênio”, onde há excesso deles, para o lado oposto da membrana, formando uma corrente elétrica no circuito externo, como na Fig. 7.2. A reação que nos interessa ocorre no eletrodo “água” e é descrita pela equação
2H2 -> 4H+ + 4e (reação anódica)
O esquema descrito de operação do elemento tem uma desvantagem significativa: contradiz a primeira lei da termodinâmica. Na verdade, quando uma corrente elétrica flui através de uma carga externa, sua quantidade é liberada, cuja quantidade é determinada pelo produto I2RL. Ao mesmo tempo, elétrico
entrando na região do cátodo, combinam-se com íons H+, que se difundem através da membrana, formando átomos de hidrogênio, gerando, em última análise, moléculas de gás H2 usadas como “combustível”. Se o processo ocorresse de acordo com o esquema dado, receberíamos calor sem nenhum consumo de combustível.
O circuito externo apenas forma um caminho para o movimento dos elétrons, mas por si só não pode ser a causa da ocorrência de corrente elétrica. Assim como se você colocar uma extremidade de um cano em um lago, a água em si não fluirá para dentro do cano. Para que a água flua, a outra extremidade deve estar abaixo da superfície da água. Da mesma forma, para introduzir uma corrente elétrica num circuito externo, é necessário reduzir o potencial rhodinâmico na região do cátodo. A maneira mais fácil de fazer isso é adicionar oxigênio, cujas moléculas se combinam com elétrons e íons, resultando na formação de água:
4е“ + 4Н+ + 02 -» 2Н20 (reação catódica). (4)
A reação é exotérmica, ou seja, ocorre com a liberação predominantemente de energia elétrica, e não de energia térmica, como acontece na queima do hidrogênio. Obviamente, é esta energia que alimenta o elemento combustível.
O diagrama descrito da célula eletroquímica é mostrado na Fig. 7.2.
Em condições normais, a fração de moléculas de hidrogênio dissipadas* na região completa é pequena. Pode ser ligeiramente aumentado alterando os parâmetros físicos
metros de acordo com o princípio de Le Chatelier. por exemplo, aumentando a temperatura do sistema. O grau de dissociação das moléculas de hidrogênio também pode ser aumentado1 pela ação de catalisadores.
A reação completa que ocorre em uma célula eletroquímica é descrita pela equação:
2H2 + 02 -> 2H?0.
A célula eletroquímica, inventada por Alessandro Volta (1745-1 em 1800), foi o primeiro dispositivo a gerar corrente elétrica em modo contínuo. Consistia em bases de zinco e prata (ou cobre) separadas por folhas de papel embebidas em solução salina. A bateria galvânica foi formada Ao conectar os elementos em série, o eletrodo de um elemento foi conectado diretamente ao eletrodo de ZINCO de outro elemento.
Uma célula Volta eletroquímica pode ser feita imergindo eletrodos soldados e de cobre em uma solução diluída (por exemplo, 10%) deste ácido. O zinco irá oxidar:
Zn -> Zr,++ + 2e >
Como resultado, elétrons livres são formados. Dissolva os íons de zinco em água. O ácido sulfúrico, sendo um ácido forte1), dissocia-se em íons:
H2S04 - "2Н+ + SOf"
Os íons zinco combinam-se com íons sulfato para formar sulfato de zinco. Pontes na forma de íon hidrônio H" (H20)x se moverão através do eletrólito até o eletrodo, no qual serão liberadas na forma de bolhas de gás (quando o íon hidrônio captura elétrons que chegam ao eletrodo vindos de fora do II circuito) Este tipo de célula eletroquímica na prática é quase inútil, pois muito rapidamente o eletrodo de cobre ficará coberto por bolhas de hidrogênio aderidas à sua superfície, o que reduzirá significativamente o fluxo de íons que entram no eletrodo. As chamadas "células secas" utilizam algum método para evitar a formação de uma camada de gás isolante na superfície. O reagente químico usado para absorver o hidrogênio é chamado de despolarizador. Um dos reagentes consumidos geralmente é
"> A força de um ácido é determinada pelo grau de dissociação de suas moléculas em uma solução aquosa. O ácido C se dissocia completamente em íons H+ e C1_ - este é um ácido forte. O ácido sulfúrico é um pouco mais fraco, mas também pertence a ácidos fortes Surpreendentemente, o ácido fluorídrico, apesar da sua elevada actividade corrosiva, é um ácido fraco - solução t à temperatura ambiente, a proporção de iões H+ da concentração total de moléculas neutras de HF é inferior a 3%.
galha, facilmente sujeita à oxidação; O zinco é o mais usado. Observe que o eletrodo de cobre no elemento Volta não entra em reações químicas e, portanto, o cobre não é consumido.
Até recentemente, baterias galvânicas baratas usavam células Leclanchet, nas quais o ânodo é feito de zinco e o cátodo é feito de uma haste de grafite revestida com uma camada de dióxido de manganês em pó com adição de grafite (para aumentar a condutividade elétrica). O dióxido de manganês absorve o hidrogênio liberado, o que evita a formação de uma camada de gás na superfície do cátodo. O cloreto de amônio é usado como eletrólito. As baterias modernas (alcalinas) usam um eletrólito alcalino.
Se o zinco utilizado no material do ânodo fosse absolutamente puro, ele só seria consumido quando a corrente elétrica fluisse através do elemento. A presença de impurezas causa corrosão do eletrodo mesmo quando o elemento não é utilizado (as impurezas formam numerosas células eletroquímicas microscópicas dentro do material do eletrodo). Para garantir uma longa vida útil dessas baterias, o ânodo é feito de uma liga de zinco e mercúrio (amalgamado). Atualmente, as células Leclanche foram quase totalmente substituídas por baterias alcalinas.
Muitas reações químicas ocorrem apenas quando a energia é fornecida de fora. Freqüentemente, são realizados em células eletrolíticas (eletrolisadores) em eletrodos conectados a uma fonte de corrente externa. O estudo dessas reações fornece informações sobre a natureza e propriedades de diversas substâncias, além de possibilitar a obtenção de novos compostos químicos por meio da eletrossíntese. Os processos eletroquímicos são amplamente utilizados na indústria. Exemplos incluem produção de cloro e alumínio, galvanoplastia e extração elétrica. As células galvânicas, que convertem energia química em energia elétrica, constituem a base das fontes de corrente - baterias e acumuladores, bem como células de combustível. A eletroquímica também estuda outros fenômenos elétricos: o comportamento dos íons em soluções eletrolíticas e a passagem de corrente através de tais soluções; separação de íons em campo elétrico (eletroforese); corrosão e passivação de metais; efeitos elétricos em sistemas biológicos (bioeletroquímica); processos fotoeletroquímicos (o efeito da luz nas reações eletroquímicas nas células).
Referência histórica.
Só foi possível realizar pesquisas eletroquímicas sistemáticas após a criação de uma fonte de corrente elétrica constante e suficientemente poderosa. Tal fonte apareceu na virada dos séculos XVIII para XIX. como resultado do trabalho de L. Galvani e A. Volta. Ao estudar as funções fisiológicas da rã, Galvani criou acidentalmente um circuito eletroquímico composto por dois metais diferentes e o músculo de uma perna de rã dissecada. Quando a pata, presa por um suporte de cobre, foi tocada com um fio de ferro, também conectado ao suporte, o músculo se contraiu. Contrações semelhantes ocorreram sob a influência de uma descarga elétrica. Galvani explicou este fenômeno pela existência de “eletricidade animal”. Uma interpretação diferente desses experimentos foi dada por Volta, que acreditava que a eletricidade surge no ponto de contato de dois metais, e a contração do músculo da rã é resultado da passagem de uma corrente elétrica por ele. Também ocorria uma corrente quando um material esponjoso (pano ou papel) embebido em água salgada era colocado entre dois discos metálicos, por exemplo zinco e cobre, e o circuito era fechado. Ao conectar 15 a 20 desses “elementos” em série, Volta em 1800 criou a primeira fonte de corrente química - a “coluna voltaica”.
A influência da eletricidade nos sistemas químicos interessou imediatamente muitos cientistas. Já em 1800, W. Nicholson e A. Carlyle relataram que a água se decompõe em hidrogênio e oxigênio quando uma corrente elétrica passa através dela usando fios de platina e ouro conectados a uma “coluna voltaica”. O mais importante dos primeiros estudos eletroquímicos foi o trabalho do químico inglês H. Davy. Em 1807, ele isolou o elemento potássio passando uma corrente através de hidróxido de potássio sólido ligeiramente umedecido. A fonte de tensão foi uma bateria de 100 células galvânicas. O sódio metálico foi obtido de forma semelhante. Mais tarde, Davy isolou magnésio, cálcio, estrôncio e bário por eletrólise usando um eletrodo de mercúrio.
O assistente de Davy, M. Faraday, investigou a relação entre a quantidade de eletricidade (corrente vezes tempo) que flui através da interface eletrodo/solução e as alterações químicas que ela causou. Um instrumento (hoje conhecido como coulômetro de gás) foi criado para medir a quantidade de eletricidade a partir do volume de hidrogênio e oxigênio liberado em uma célula eletrolítica, e foi mostrado (1833) que a quantidade de eletricidade necessária para obter uma determinada quantidade de substância não depende do tamanho dos eletrodos, da distância entre eles e do número de placas da bateria que alimenta a célula. Além disso, Faraday descobriu que a quantidade de uma substância liberada durante a eletrólise é diretamente proporcional ao seu equivalente químico e à quantidade de eletricidade que passa pelo eletrólito. (Um equivalente químico é o número de gramas de um elemento ou composto que reage ou substitui um mol de átomos (1,0078 g) de hidrogênio em compostos; cm. MASSA EQUIVALENTE). Estas duas disposições fundamentais são chamadas de leis de Faraday. Juntamente com seu amigo W. Whewell, especialista em filologia clássica, Faraday também desenvolveu uma nova terminologia em eletroquímica. Ele chamou os condutores imersos em uma solução de eletrodos (anteriormente eram chamados de pólos); introduziu os conceitos de “eletrólise” (alterações químicas associadas à passagem de corrente), “eletrólito” (líquido condutor em células eletroquímicas), “ânodo” (eletrodo no qual ocorre a reação de oxidação) e “cátodo” (eletrodo no qual ocorre a reação de oxidação). ocorre reação de redução). Ele chamou os portadores de carga em líquidos de íons (do grego “errante”, “errante”), e os íons que se movem em direção ao ânodo (eletrodo positivo) foram chamados de “ânions”, e aqueles que se movem em direção ao cátodo - “cátions”. As pesquisas de Faraday sobre indução eletromagnética levaram à criação de geradores elétricos, que possibilitaram a realização de processos eletroquímicos em escala industrial.
Faraday explicou a capacidade das soluções de passarem corrente elétrica pela presença de íons nelas, mas ele próprio e outros cientistas, como I. Hittorf e F. Kohlrausch, acreditavam que os íons aparecem sob a influência da corrente. Em 1884, S. Arrhenius sugeriu que, na verdade, os íons são formados simplesmente quando o sal é dissolvido em água. Os trabalhos de S. Arrhenius, J. van't Hoff e W. Ostwald foram um marco importante no desenvolvimento da teoria dos eletrólitos e das ideias sobre as propriedades físico-químicas das soluções e sua termodinâmica. A correspondência entre a teoria e os dados experimentais sobre condutividade iônica e equilíbrio em solução tornou-se mais completa depois que P. Debye e E. Hückel levaram em consideração as interações eletrostáticas de longo alcance entre os íons em 1923.
Uma contribuição importante para a termodinâmica eletroquímica e especificamente para elucidar a natureza do potencial elétrico (tensão) em uma célula eletroquímica e o equilíbrio entre energia elétrica, química e térmica foi feita por J. Gibbs e W. Nernst. O potencial eletroquímico é determinado pela energia química dos processos que ocorrem na célula, mas também depende de sua velocidade (cinética). A modelagem de processos cinéticos em eletrodos foi realizada por Y. Tafel (1905), J. Butler (1924), M. Volmer (1930), A. N. Frumkin (1930–1933).
Células eletroquímicas.
Uma célula eletroquímica geralmente consiste em duas meias-células, cada uma das quais é um eletrodo imerso em seu próprio eletrólito. Os eletrodos são feitos de material eletricamente condutor (metal ou carbono) ou, menos frequentemente, de um semicondutor. Os portadores de carga nos eletrodos são os elétrons, e os portadores de carga no eletrólito são os íons. Uma solução aquosa de sal de cozinha (cloreto de sódio NaCl), que é um eletrólito, contém partículas carregadas: cátions de sódio Na + e ânions de cloro Cl –. Se você colocar tal solução em um campo elétrico, os íons Na + se moverão para o pólo negativo e os íons Cl – se moverão para o pólo positivo. Sais fundidos, como NaCl, também são eletrólitos. Os eletrólitos também podem ser sólidos, por exemplo b- alumina (polialuminato de sódio) contendo íons de sódio móveis ou polímeros de troca iônica.
As meias-células são separadas por uma divisória, que não interfere na movimentação dos íons, mas evita a mistura dos eletrólitos. O papel de tal partição pode ser desempenhado por uma ponte salina, um tubo com uma solução aquosa fechada em ambas as extremidades com lã de vidro, uma membrana de troca iônica ou uma placa de vidro porosa. Ambos os eletrodos da célula eletrolítica podem ser imersos no mesmo eletrólito.
Existem dois tipos de células eletroquímicas: células galvânicas e células eletrolíticas (eletrolisadores). Em uma célula galvânica, as reações químicas ocorrem espontaneamente na interface eletrodo/eletrólito, e os eletrodos são conectados entre si por um condutor. Várias células galvânicas conectadas em série formam uma bateria - uma fonte química de corrente. Numa célula eletrolítica, as reações na interface eletrodo/eletrólito ocorrem devido a uma fonte externa de energia elétrica; este último é convertido em energia química dos produtos da reação que ocorrem nos eletrodos. A estrutura da célula galvânica é mostrada na Fig. 1, e o eletrolisador - na Fig. 2. Observe que a mesma célula, dependendo do modo de operação, pode se comportar tanto como célula galvânica quanto como eletrolisador. Assim, uma bateria de carro de chumbo-ácido atua como uma célula galvânica quando usada para dar partida no motor (durante a descarga) e como um eletrolisador quando carregada por um gerador ou carregador de carro.
Uma célula galvânica simples, criada em 1836 por J. Daniel (Fig. 1), consiste em dois eletrodos: zinco, imerso em solução aquosa de sulfato de zinco, e cobre, imerso em solução aquosa de sulfato de cobre (II). Tal elemento é semelhante aos pares cobre-zinco em uma coluna voltaica. Quando o circuito externo é fechado, os átomos de zinco na superfície do eletrodo de zinco são oxidados a íons com liberação de elétrons: Zn ® Zn 2+ + 2e – . Esses elétrons se movem ao longo do circuito externo até o eletrodo de cobre e reduzem os íons de cobre a átomos: Cu 2+ + 2e – ® Cu. O fluxo de elétrons no circuito externo é a corrente gerada pelo elemento. A reação geral que leva a uma transformação química e à geração de energia elétrica tem a forma
Exatamente a mesma reação ocorre quando o zinco metálico é adicionado a uma solução de sulfato de cobre, mas neste caso a energia química é convertida em energia térmica.
As células eletroquímicas são frequentemente representadas esquematicamente denotando a fronteira entre o eletrodo e o eletrólito com uma vertical ou barra (| ou /) e a ponte salina com duas barras (//). Portanto, a célula galvânica da Fig. 1 entrada de resposta
onde M é a concentração molar da solução.
Na célula eletrolítica mostrada na Fig. 2, ocorrem as mesmas reações que nos eletrolisadores industriais para a produção de cloro e álcali: a conversão de salmoura (uma solução aquosa concentrada de cloreto de sódio) em cloro e hidróxido de sódio NaOH:
Os íons cloreto no eletrodo de grafite são oxidados em cloro gasoso e a água no eletrodo de ferro é reduzida a íons hidrogênio e hidróxido. Os eletrólitos permanecem eletricamente neutros devido ao movimento dos íons de sódio através de uma partição - uma membrana de troca iônica. O eletrodo no qual ocorre a oxidação (zinco na Fig. 1 e grafite na Fig. 2) é chamado de ânodo, e o eletrodo no qual ocorre a redução é chamado de cátodo.
Potencial do eletrodo.
Os principais parâmetros elétricos das células eletroquímicas são corrente (medida em amperes, A) e potencial (medido em volts, V). A intensidade da corrente é determinada pela taxa de reações dos eletrodos, e o potencial é determinado pela energia química dos processos que ocorrem na célula. É igual à energia (medida em joules, J) dividida pela quantidade de eletricidade (medida em coulombs, C), ou seja, 1V = 1J / Cl. Portanto, o potencial de um elemento (força eletromotriz, fem) é uma medida da energia gerada durante as reações que nele ocorrem. Se o circuito externo estiver aberto, não ocorrerão reações nos eletrodos.
O potencial de uma célula galvânica com circuito externo aberto fornece informações sobre a termodinâmica de suas reações. O potencial do elemento mostrado na Fig. 1, em concentrações de solução de 1 M e temperatura de 25°C - seu potencial padrão E° – igual a 1,10 V. Energia correspondente, potencial termodinâmico de Gibbs, D G°, é dado por
Onde n– o número de elétrons transferidos durante a reação (neste caso 2), F– Número de Faraday (96 485 C / verruga). O potencial de uma célula galvânica é igual à diferença de potencial entre suas duas meias-células, ou seja, a diferença em seus potenciais de eletrodo. Os potenciais do eletrodo são medidos em relação ao potencial do eletrodo de referência, que é convencionalmente considerado zero ( cm. mesa). Por acordo, um eletrodo de hidrogênio normal (NHE) foi selecionado como eletrodo padrão; é uma placa de platina revestida com negro de platina, saturada com gás hidrogênio a uma pressão de 1,01H 10 5 Pa (1 atm.) e imersa em uma solução contendo íons H + com atividade termodinâmica a= 1. Esquematicamente, este eletrodo pode ser representado como Pt/H 2 (1,01H 10 5 Pa)/H + ( a= 1). A reação 2H + + 2e – ® H 2 ocorre nele. Para determinar o potencial padrão de um eletrodo de cobre Cu/Cu 2+, monte a seguinte célula galvânica:
e para a meia reação Cu 2+ + 2e – ® Cu a medição dá
Da mesma forma, para a meia célula Zn/Zn 2+, na qual ocorre a reação Zn 2+ + 2e – ® Zn, obtemos
A diferença entre esses dois potenciais de eletrodo padrão é igual ao potencial padrão do elemento Zn – Cu.
Na verdade, o eletrodo de hidrogênio raramente é utilizado em medições potenciométricas, pois representa um sistema ideal e difícil de implementar na prática. Com muito mais frequência, são usados eletrodos de comparação mais convenientes e compactos de vários tipos, com um valor potencial específico e cuidadosamente medido em relação à corrente. Geralmente utilizam um eletrodo de calomelano (CE), composto por mercúrio metálico, cloreto de mercúrio (calomelano) e uma solução de cloreto de potássio: Hg /Hg 2 Cl 2 /KCl. A seguinte reação ocorre no eletrodo:
Potencial k.e. depende da concentração de íons de mercúrio, e esta última depende da concentração da solução de KCl. Para solução saturada de KCl E° (k.e.) av = 0,2412 V (n.e.) a 25° C.
|
POTENCIAIS DE ELETRODO PADRÃO |
|
| Reação do eletrodo |
E ah, V. |
| Li + + e – ® Li | |
| Mg 2+ + 2e – ® Mg | |
| Al 3+ + 3e – ® Al | |
| Zn 2+ + 2e – ® Zn | |
| Cr 3+ + e – ® Cr 2+ | |
| 2H + + 2e – ® H 2 | |
| Cu 2+ + 2e – ® Cu | |
| Fe 3+ + e – ® Fe 2+ | |
| O 2 + 4H + + 4e – ® 2H 2 O | |
| Cl 2 + 2e – ® 2Cl – | |
| F 2 + 2e – ® 2F – | |
Observe que a substância de alguns eletrodos não está incluída na equação da reação correspondente. Sim, reação
na verdade ocorre em um eletrodo de platina em uma célula Pt/Fe 3+, Fe 2+. O eletrodo de platina é inerte e fornece contato apenas com o eletrólito contendo as formas oxidadas e reduzidas do elemento (neste caso, íons de ferro divalentes e trivalentes). O eletrodo de platina desempenha o mesmo papel no N.V.E.
Tabelas de potenciais de eletrodo permitem calcular o EMF de uma célula galvânica com base em seus potenciais de eletrodo. Eles também podem ser usados para prever se ocorrerá uma reação redox específica. Podemos falar de um potencial de eletrodo padrão somente quando a atividade dos componentes participantes da reação for igual a 1, ou seja, sua concentração em solução é próxima de 1M. Potencial do eletrodo E depende da concentração das formas oxidadas e reduzidas em solução e está relacionado a elas e ao potencial padrão E° Equação de Nernst. Para uma reação generalizada
boi + n e – = vermelho
esta equação tem a forma
Onde R– constante universal do gás, T– temperatura absoluta, e – atividades de formas oxidadas e reduzidas. As atividades de sólidos e líquidos puros são consideradas 1. A 25° C TR/F= 0,025 V. Medindo os potenciais do eletrodo em relação ao potencial do eletrodo de referência, é possível determinar as concentrações das substâncias na solução através da equação (10); este método é chamado potenciometria.
Reações de eletrodo.
As medições potenciométricas são realizadas em condições em que não há corrente na célula eletroquímica. Isto significa que não ocorrem alterações químicas gerais nele, e o potencial medido (equilíbrio) é determinado pela termodinâmica das reações. Nestas condições, factores como o tamanho e a forma dos eléctrodos ou a intensidade de agitação da solução não afectam o potencial medido. Se a corrente flui através de uma célula eletroquímica, então a taxa de reações do eletrodo depende não apenas dos parâmetros termodinâmicos, mas também da intensidade da corrente de acordo com a equação
Onde n– número de elétrons participantes de uma determinada reação do eletrodo, F– Número de Faraday. Neste caso, o potencial da célula eletroquímica depende de fatores cinéticos, bem como do material de que é feito o eletrodo, do tamanho e formato do eletrodo, da intensidade de agitação da solução e de muitos outros fatores. A resistência interna da célula não pode ser desprezada. Além da diferença de potencial em ambos os limites eletrodo/eletrólito, ocorre uma queda de tensão na própria solução, devido à sua resistência. Esta queda de tensão dificulta o estudo dos efeitos associados às reações que ocorrem em ambos os eletrodos. Normalmente, a reação é estudada em um eletrodo, que é chamado de eletrodo de trabalho ou indicador, usando uma célula de três eletrodos (Fig. 3): o terceiro eletrodo (por exemplo, calomelano saturado) é colocado no mesmo compartimento que o de trabalho um, o mais próximo possível dele, a fim de reduzir e minimizar o efeito da queda de tensão ôhmica. Ao medir a corrente através do eletrodo de trabalho em função do potencial deste eletrodo em relação ao eletrodo de referência, o chamado curva de polarização.
Quando uma corrente externa passa, o potencial do eletrodo difere do potencial de equilíbrio. Esse desvio é chamado de polarização e sua magnitude é chamada de sobretensão. A sobretensão depende de vários fatores que limitam a taxa de reações dos eletrodos. Reações rápidas do eletrodo em uma determinada densidade de corrente (força de corrente por unidade de superfície do eletrodo) ocorrem em potenciais próximos aos termodinâmicos e, portanto, em baixa sobretensão. As reações lentas são caracterizadas por alta sobretensão. As taxas de reações do eletrodo e, portanto, a sobretensão, dependem da concentração dos reagentes, temperatura, solvente, material do eletrodo, método e velocidade de transferência de massa e densidade de corrente. A sobretensão total pode ser decomposta em vários componentes: concentração, ativação e reação.
A sobretensão de concentração é causada pelo fato de que, ao passar uma corrente, a concentração do íon reativo na superfície do eletrodo muda, uma vez que nesta área são consumidas substâncias eletroativas e formados produtos de reação. Consideremos a redução de Cu 2+ em um eletrodo de cobre. Inicialmente, a concentração de Cu 2+ na solução é 1M. Na ausência de corrente no circuito, o potencial do eletrodo de cobre está próximo do potencial padrão do par Cu/Cu 2+, ou seja, 0,34 V em relação ao N.E. [ cm. equação (6)]. À medida que a corrente catódica passa, a concentração de íons Cu 2+ na superfície do eletrodo diminui e o potencial catódico, de acordo com a equação de Nernst (10), torna-se cada vez mais negativo. Porções frescas do reagente chegam da solução ao eletrodo de diferentes maneiras: como resultado de difusão, convecção e migração. Quanto maior for a velocidade destes processos (por exemplo, quanto mais intensa for a mistura), menor será a sobretensão de concentração. Este componente da sobretensão total muitas vezes pode ser calculado. Se a polarização de concentração é a principal contribuição para a sobretensão total (isso significa que a taxa dos estágios restantes da reação do eletrodo é alta), então a reação é chamada de reversível ou Nernstiana.
A sobretensão de ativação ocorre porque a transferência de elétrons na superfície do eletrodo não ocorre instantaneamente, mas a uma velocidade finita. Consideremos a reação generalizada do eletrodo ox + n e – = vermelho. Para transferir elétrons para compostos oxidados a uma determinada taxa (isto é, a uma determinada densidade de corrente), é necessário superar uma barreira de energia chamada energia de ativação da reação do eletrodo. Essa energia é fornecida pelo potencial aplicado. A relação entre densidade de corrente e sobretensão de ativação é descrita pelas equações de Butler-Volmer e Tafel, que podem ser usadas para determinar os parâmetros cinéticos das reações dos eletrodos. Muitas reações dos eletrodos, como a redução da água a hidrogênio e sua oxidação a oxigênio, ocorrem lentamente. A taxa de reação do eletrodo pode depender muito do material do qual o eletrodo é feito e das propriedades de sua superfície. Por exemplo, num eléctrodo de mercúrio, a redução da água a hidrogénio é significativamente difícil: é caracterizada por uma elevada sobretensão de hidrogénio. Esta reação ocorre muito mais rapidamente e com menos sobretensão na platina; É por esta razão que a platina é usada no eletrodo de referência de hidrogênio. A taxa de reações também depende das substâncias que são adsorvidas ou ligadas à superfície do eletrodo; Assim, o íon cianeto e vários compostos orgânicos reduzem a taxa de evolução do hidrogênio na superfície do eletrodo de platina. Ao mesmo tempo, alguns surfactantes podem aumentar significativamente a taxa de reação do eletrodo - eles são chamados de eletrocatalisadores.
A sobretensão de reação ocorre quando a transferência de elétrons no eletrodo é acoplada a uma reação química na solução. Tal reação pode servir como fonte de partículas envolvidas na transferência de elétrons e, ao mesmo tempo, limitar a taxa de todo o processo do eletrodo. É por isso que é tão importante conhecer os detalhes do mecanismo (ou seja, estágios e estados intermediários) das reações dos eletrodos. Em muitos casos, o material de partida sofre diversas transformações antes de se tornar o produto final no eletrodo, como no caso da redução do oxigênio a água, processo de grande importância prática. A reação total tem a forma
e consiste em vários estágios, em um dos quais a ligação oxigênio-oxigênio é quebrada. Devido a esta reação em vários estágios, a reação na maioria dos eletrodos é lenta e em escala industrial é realizada na presença de eletrocatalisadores. O mecanismo das reações dos eletrodos é estudado usando métodos eletroanalíticos descritos abaixo. Freqüentemente, o curso de uma reação muda quando a composição da solução e a natureza do solvente mudam. Por exemplo, a redução de oxigênio na acetonitrila, onde há deficiência de prótons, ocorre de acordo com um mecanismo simples de um elétron:
Métodos eletroquímicos de análise.
Vários métodos eletroquímicos foram desenvolvidos para a análise qualitativa e quantitativa de substâncias químicas, que muitas vezes também são úteis para determinar os parâmetros termodinâmicos e cinéticos das reações dos eletrodos e estudar seus mecanismos.
Condutometria
baseia-se na medição da condutividade elétrica de uma solução e é usado para determinar a concentração de sais, ácidos, bases, etc. Nas determinações condutométricas, geralmente são utilizados eletrodos feitos de materiais idênticos, e as condições para sua condução são selecionadas de forma a minimizar a contribuição de saltos de potencial em ambas as interfaces eletrodo/eletrólito (por exemplo, corrente alternada de alta frequência é usada ). Neste caso, a principal contribuição para o potencial medido da célula é feita pela queda de tensão ôhmica RI, Onde R– resistência à solução. A condutividade elétrica de uma solução monocomponente pode estar relacionada à sua concentração, e a medição da condutividade elétrica de eletrólitos de composição complexa permite estimar o conteúdo total de íons na solução e é utilizada, por exemplo, no monitoramento da qualidade de destilados. ou água deionizada. Em outro tipo de condutometria - titulação condutométrica - um reagente conhecido é adicionado em porções à solução analisada e a mudança na condutividade elétrica é monitorada. O ponto de equivalência, no qual se nota uma mudança brusca na condutividade elétrica, é determinado a partir de um gráfico da dependência desse valor com o volume de reagente adicionado.
Potenciometria
usado para determinar vários parâmetros físico-químicos com base em dados sobre o potencial de uma célula galvânica. O potencial do eletrodo na ausência de corrente no circuito eletroquímico, medido em relação ao eletrodo de referência, está relacionado à concentração da solução pela equação de Nernst. Em medições potenciométricas, são amplamente utilizados eletrodos seletivos de íons que são sensíveis principalmente a um íon em solução: um eletrodo de vidro para medição de pH e eletrodos para a determinação seletiva de íons de sódio, amônio, flúor, cálcio, magnésio, etc. A camada do eletrodo seletivo de íons pode incluir enzimas e o resultado é um sistema que é sensível ao substrato apropriado. Observe que o potencial de um eletrodo íon-seletivo é determinado não pela transferência de elétrons, como no caso de substâncias com condutividade eletrônica, mas principalmente pela transferência ou troca de íons. Contudo, a equação de Nernst, que relaciona o potencial do eletrodo ao logaritmo da concentração (ou atividade) de uma substância em solução, também é aplicável a tal eletrodo. Na titulação potenciométrica, o reagente é adicionado à solução que está sendo analisada em porções e a mudança de potencial é monitorada. As curvas em forma de S características deste tipo de titulação permitem determinar o ponto de equivalência e encontrar parâmetros termodinâmicos como a constante de equilíbrio e o potencial padrão.
Voltametria.
Todas as variedades de métodos voltamétricos usam um microeletrodo funcional com uma área de superfície de 10–7–10–1 cm2. As curvas corrente-tensão obtidas com o seu auxílio permitem identificar substâncias dissolvidas, determinar sua concentração e, muitas vezes, parâmetros termodinâmicos e cinéticos. O primeiro método voltamétrico - polarografia - foi proposto em 1922 pelo químico tcheco J. Heyrovsky. O eletrodo de trabalho em sua configuração era um eletrodo de mercúrio gotejante. O mercúrio tem uma alta sobretensão de hidrogênio, portanto um eletrodo de mercúrio é conveniente para estudar processos que ocorrem em potenciais negativos. A superfície do eletrodo é constantemente renovada durante o processo de medição, o que elimina a contaminação do eletrodo. Estudos voltamétricos também são realizados utilizando eletrodos sólidos, como platina e carbono, e utilizam processos que ocorrem em potenciais positivos. Na voltametria de varredura de potencial linear (cronoamperometria), o potencial muda linearmente com o tempo e a solução não é agitada, de modo que a transferência de massa ocorre exclusivamente devido à difusão. Na voltametria cíclica, pulsos de tensão triangulares repetidos são aplicados a um eletrodo. As substâncias formadas na seção ascendente do ciclo são estudadas na seção descendente. Este método é especialmente eficaz para estudar o mecanismo das reações dos eletrodos, analisando curvas de polarização em diferentes taxas de varredura de potencial e diferentes concentrações de solução. Existem outros tipos de voltametria - pulso diferencial e onda quadrada - nos quais pulsos de tensão de diferentes formatos são sobrepostos a um potencial crescente linearmente. Esses métodos são amplamente utilizados para determinar pequenas concentrações de substâncias em solução. Se durante uma medição voltamétrica a solução é misturada, o que significa que a transferência de massa ocorre simultaneamente por convecção e difusão, então falamos de voltametria hidrodinâmica. Neste caso, é conveniente utilizar um eletrodo de disco rotativo, uma vez que as curvas experimentais de corrente-tensão podem ser comparadas diretamente com as teóricas.
Amperometria.
O método baseia-se na medição da corrente de difusão limite que passa através de uma solução a uma tensão fixa entre o eletrodo indicador e o eletrodo de referência. Na titulação amperométrica, o ponto de equivalência é determinado pela quebra na curva atual - o volume da solução de trabalho adicionada. Os métodos cronoamperométricos baseiam-se na medição da dependência da corrente no tempo e são usados principalmente para determinar coeficientes de difusão e constantes de taxa. Células eletroquímicas em miniatura que servem como sensores na saída das colunas cromatográficas líquidas operam com base no princípio da amperometria (assim como da voltametria). Os métodos galvanostáticos são semelhantes aos amperométricos, mas medem o potencial quando uma certa quantidade de corrente passa pela célula. Assim, na cronopotenciometria, a mudança de potencial ao longo do tempo é controlada. Esses métodos são usados principalmente para estudar a cinética das reações dos eletrodos.
Coulometria.
Na coulometria, a um potencial controlado, a eletrólise completa de uma solução é realizada misturando-a intensamente em um eletrolisador com um eletrodo de trabalho relativamente grande (mercúrio inferior ou malha de platina). Quantidade total de eletricidade ( P, C) necessária para a eletrólise está relacionada à quantidade da substância formadora ( A, d) Lei de Faraday:
Onde M- eles dizem massa (g/mol), F- Número de Faraday. A titulação coulométrica envolve o uso de uma corrente constante para gerar eletroliticamente um reagente que reage com a substância que está sendo determinada. O progresso da titulação é controlado potenciometricamente ou amperometricamente. Os métodos coulométricos são convenientes porque são de natureza absoluta (ou seja, permitem calcular a quantidade do analito sem recorrer a curvas de calibração) e são insensíveis a mudanças nas condições de eletrólise e nos parâmetros do eletrolisador (área superficial do eletrodo ou intensidade de agitação). Na coulogravimetria, a quantidade de substância que sofreu eletrólise é determinada pesando o eletrodo antes e depois da eletrólise.
Existem outros métodos eletroanalíticos. Na polarografia de corrente alternada, uma tensão senoidal de baixa amplitude é aplicada a um potencial linearmente variável em uma ampla faixa de frequência e a amplitude e a mudança de fase da corrente alternada resultante ou a impedância são determinadas. A partir desses dados, são obtidas informações sobre a natureza das substâncias em solução e sobre o mecanismo e a cinética das reações dos eletrodos. Os métodos de camada fina usam células eletroquímicas com uma camada eletrolítica de 10–100 µm de espessura. Nessas células, a eletrólise ocorre mais rapidamente do que nos eletrolisadores convencionais. Para estudar os processos dos eletrodos, são utilizados métodos espectroquímicos com registro espectrofotométrico. Para analisar as substâncias formadas na superfície do eletrodo, mede-se a absorção de luz nas regiões visível, UV e IR. Mudanças nas propriedades da superfície do eletrodo e do meio são monitoradas usando métodos de reflexão elétrica e elipsometria, que se baseiam na medição da reflexão da radiação da superfície do eletrodo. Estes incluem métodos de reflexão especular e espalhamento Raman de luz (espectroscopia Raman), espectroscopia de segundo harmônico (espectroscopia de Fourier).
Outros fenómenos e métodos electroquímicos.
Com o movimento relativo do eletrólito e das partículas ou superfícies carregadas, ocorrem efeitos eletrocinéticos. Um exemplo importante desse tipo é a eletroforese, na qual ocorre a separação de partículas carregadas (por exemplo, moléculas de proteínas ou partículas coloidais) que se movem em um campo elétrico. Os métodos eletroforéticos são amplamente utilizados para separar proteínas ou ácidos desoxirribonucléicos (DNA) em géis. Os fenômenos elétricos desempenham um grande papel no funcionamento dos organismos vivos: são responsáveis pela geração e propagação de impulsos nervosos, pela ocorrência de potenciais transmembrana, etc. Vários métodos eletroquímicos são usados para estudar sistemas biológicos e seus componentes. Também é de interesse estudar o efeito da luz nos processos eletroquímicos. Assim, o tema da pesquisa fotoeletroquímica é a geração de energia elétrica e o início de reações químicas sob a influência da luz, o que é muito importante para aumentar a eficiência da conversão da energia solar em energia elétrica. Eletrodos semicondutores feitos de dióxido de titânio, sulfeto de cádmio, arseneto de gálio e silício são comumente usados aqui. Outro fenômeno interessante é a eletroquimioluminescência, ou seja, geração de luz em uma célula eletroquímica. É observado quando produtos de alta energia são formados nos eletrodos. Freqüentemente, o processo é realizado de maneira cíclica para obter formas oxidadas e reduzidas de um determinado composto. A interação entre eles leva à formação de moléculas excitadas, que passam ao estado fundamental com a emissão de luz.
Eletroquímica aplicada.
A eletroquímica tem muitas aplicações práticas. Com a ajuda de células galvânicas primárias (elementos descartáveis) conectadas a baterias, a energia química é convertida em energia elétrica. Fontes de corrente secundária - baterias - armazenam energia elétrica. As células de combustível são fontes primárias de energia que geram eletricidade através de um fornecimento contínuo de reagentes (como hidrogênio e oxigênio). Estes princípios estão subjacentes às fontes de energia portáteis e às baterias utilizadas em estações espaciais, veículos eléctricos e dispositivos electrónicos.
A produção em larga escala de muitas substâncias é baseada na síntese eletroquímica. A eletrólise da salmoura no processo cloro-álcali produz cloro e álcalis, que são então utilizados para produzir compostos orgânicos e polímeros, bem como na indústria de celulose e papel. Os produtos da eletrólise são compostos como clorato de sódio, persulfato, permanganato de sódio; Metais industrialmente importantes são obtidos por eletroextração: alumínio, magnésio, lítio, sódio e titânio. É melhor usar sais fundidos como eletrólitos, pois neste caso, ao contrário das soluções aquosas, a redução dos metais não é complicada pela liberação de hidrogênio. O flúor é produzido por eletrólise em sal fundido. Os processos eletroquímicos servem de base para a síntese de alguns compostos orgânicos; por exemplo, a adiponitrila (um intermediário na síntese do náilon) é obtida pela hidrodimerização da acrilonitrila.
A galvanoplastia de prata, ouro, cromo, latão, bronze e outros metais e ligas é amplamente praticada em diversos objetos para proteger produtos siderúrgicos da corrosão, para fins decorativos, para fabricação de conectores elétricos e placas de circuito impresso na indústria eletrônica. Os métodos eletroquímicos são utilizados para processamento dimensional de alta precisão de peças feitas de metais e ligas, especialmente aquelas que não podem ser processadas por métodos mecânicos convencionais, bem como para a fabricação de peças com perfis complexos. Quando a superfície de metais como alumínio e titânio é anodizada, formam-se películas protetoras de óxido. Esses filmes são criados na superfície de peças feitas de alumínio, tântalo e nióbio na fabricação de capacitores eletrolíticos e, às vezes, para fins decorativos.
Métodos eletroquímicos são frequentemente utilizados para embasar estudos de processos de corrosão e a seleção de materiais que retardam esses processos. A corrosão das estruturas metálicas pode ser evitada através da protecção catódica, para a qual uma fonte externa é ligada à estrutura a ser protegida e o ânodo e a estrutura são mantidos num potencial tal que a sua oxidação é excluída. As possibilidades de aplicação prática de outros processos eletroquímicos estão sendo exploradas. Assim, a eletrólise pode ser usada para purificar a água. Uma direção muito promissora é a conversão da energia solar por métodos fotoquímicos. Estão sendo desenvolvidos monitores eletroquímicos cujo princípio de funcionamento é baseado na eletroquimioluminescência. Mencionemos também o estudo das mudanças reversíveis na cor da superfície do eletrodo como resultado das reações do eletrodo.
Literatura:
Agladze R.I. Eletroquímica aplicada. M.-L., 1975
Izmailov N.A. Eletroquímica de soluções. M., 1976
Métodos de medição em eletroquímica, vol. 1–2. M., 1977
Korita I. Íons, eletrodos, membranas. M., 1983
Bagotsky V.S. Noções básicas de eletroquímica. M., 1988