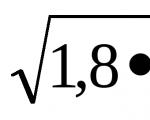İyon değişim reaksiyonları tamamlanmak üzere. İyonik reaksiyon denklemleri
Sorun 1. HCN çözeltisindeki hidrojen iyonlarının konsantrasyonunu hesaplayın (C m = 10 -3 M), eğer = 4,2∙10 -3 .
Çözüm: Hidrosiyanik asidin ayrışması HCN ↔ H + + CN denklemine göre ilerler - ; iyonların ve çözeltideki konsantrasyonları birbirine eşittir (çünkü H+: CN - = 1:1, burada
- stokiyometrik katsayılar) yani = = C m, mol/l; O zaman = = 4,2∙10 -3 ∙ 10 -3 = 4,210 -7 mol/l.
Çözüm : Amonyum hidroksit aşağıdaki şekilde ayrışır:
NH 4 OH ↔ NH 4 + + OH -, ayrışma sabiti şu şekildedir:
K d =;
amonyum ve hidroksit iyonlarının konsantrasyonları aynıdır ( (NH4+): (OH -) = 1:1), bunları şu şekilde gösteririz: X:
= =x mol/l , o zaman K d'nin ifadesi şu formu alacaktır:
1,810 -5 = X 2 / 0,01-X. Hesaba katıldığında X<< С м, решаем уравнение
1,810 -5 =x 2 / 0,01, bağıl X:
X=
 =4,2∙10 -4 mol/l; = 4,2∙10 -4 mol/l.
=4,2∙10 -4 mol/l; = 4,2∙10 -4 mol/l.
Hidrojen ve hidroksit iyonlarının konsantrasyonları suyun K iyonik ürünü ile ilişkilidir. w= =10 -14, hidrojen iyonlarının konsantrasyonunu = K olarak ifade edelim w/ ve değerini hesaplayın:
110 -14 /4.210 -4 = 2.310 -11 mol/l.
Sorun 3. HCl çözeltisinin pH'ını belirleyin ( =1), eğer C m =2∙10 -3 M
Çözüm: Hidroklorik asidin ayrışması denkleme göre ilerler
HCl H + + Cl - , hidrojen iyonlarının konsantrasyonu = C m =1∙2∙10 -3 = =2∙10 -3 mol/l. Hidrojen göstergesi pH = - log = - log2∙10 -3 = 2,7.
Sorun 4. pH=11 ve Kd=1,8∙10 -5 ise amonyum hidroksitin molar konsantrasyonunu belirleyin.
Çözüm: Hidrojen iyonlarının konsantrasyonu =10 - pH =10 -11 mol/l. Suyun iyonik ürününden konsantrasyonu belirleriz = K w / = 10 -14 /10 -11 =10 -3 mol/l. Amonyum hidroksit zayıf bir bazdır ve ayrışma reaksiyonu denklemi ile karakterize edilir.
NH4OH ↔ NH4++ OH - . Ayrışma sabiti için ifade
Kd =. 
Ostwald yasasından şu sonuç çıkıyor: = = ∙C m, a İLE D = 2 C m Denklemleri birleştirerek C m = 2 / K d = 10 -6 / 1,8∙10 -5 = 0,056 mol/l elde ederiz
Çözünürlük ürünü
Maddeler, doğalarına bağlı olarak, suda miligramın kesirlerinden litre başına yüzlerce grama kadar değişen farklı çözünürlüklere sahiptir. Zor çözünen elektrolitler çok düşük konsantrasyonlarda doymuş çözeltiler oluşturur, dolayısıyla bunların ayrışma derecesinin birliğe ulaştığını varsayabiliriz. Bu nedenle, az çözünen bir elektrolitin doymuş bir çözeltisi, çözünmüş maddenin bir çökeltisi ile dengede olan çözeltinin kendisinden oluşan bir sistemdir. Sabit dış koşullar altında çökeltinin çözünme hızı, kristalizasyon işleminin hızına eşittir: K N A M ↔ N K+ M + M A- N (1)
çökelti çözümü
Bu heterojen denge sürecini tanımlamak için çözünürlük ürünü PR = olarak adlandırılan bir denge sabiti kullanılır. N M, burada ve doymuş bir çözeltideki iyonların konsantrasyonlarıdır (mol/l). Örneğin:
AgCl= Ag + +Cl- , PR = ; Burada n=m=1.
PbI2 = Pb2+ +2I - , PR = 2; Burada N=1, M=2.
PR çözünmüş maddenin doğasına ve sıcaklığa bağlıdır. PR tablo halindeki bir değerdir. PR'yi bilmek , bir maddenin doymuş çözeltisinin konsantrasyonunu hesaplayabilir ve ayrıca 100 ml su başına çözünürlüğünü g cinsinden tahmin edebilirsiniz (değer S, referans literatürde verilmiştir) ve maddenin çökelme olasılığını belirleyin.
Denklem (1) için, zor çözünen bir maddenin doymuş çözeltisinin konsantrasyonu (Cm, mol/l) ile PR değeri arasındaki ilişki aşağıdaki denklemle belirlenir: 
 ,
,
Nerede N Ve M – stokiyometrik katsayılar denklemde. 1.
Görev 5. Doymuş çözelti (Cm)Mg(OH)2'nin konsantrasyonu 1,1'dir 10-4 mol/l. PR ifadesini yazınız ve değerini hesaplayın.
Çözüm: Doymuş bir Mg(OH)2 çözeltisinde, çökelti ile Mg(OH)2 ↔Mg2+ + 2OH - çözeltisi arasında denge kurulur; bunun için PR ifadesi PR biçimindedir. = 2 . İyonların konsantrasyonunu bilerek sayısal değerini bulabilirsiniz. Tam ayrışma göz önüne alındığında
Mg(OH) 2, konsantrasyonu doymuş çözelti C m = = 1,110 -4 mol/l, a = 2 = 2,210 -4 mol/l. Bu nedenle PR= 2 =1,1. 10 -4 (2,2 10 -4) 2 = 5,3. 10-12.
Görev 6. 0,011 g tuzun 0,5 l suda çözülmesi durumunda doymuş çözeltinin konsantrasyonunu ve gümüş kromatın PR'sini hesaplayın.
Çözüm:
Doymuş bir Ag2CrO4 çözeltisinin molar konsantrasyonunu belirlemek için CM = formülünü kullanırız
 ,
Nerede M- çözünen maddenin kütlesi (g), M - molar kütle (g/mol), V- çözeltinin hacmi (l). M (Ag 2
CRO 4
)
=332 g/mol. santimetre =9,48. 10 -5 mol/l. Gümüş (I) kromatın çözünmesine tuzun tam ( = 1) ayrışması eşlik eder: Ag2CrO4 ↔ 2Ag + +CrO42-, PR = 2, burada = Cm = 9,48. 10 -5 mol/l, a = 2 =1,89610 -4.
,
Nerede M- çözünen maddenin kütlesi (g), M - molar kütle (g/mol), V- çözeltinin hacmi (l). M (Ag 2
CRO 4
)
=332 g/mol. santimetre =9,48. 10 -5 mol/l. Gümüş (I) kromatın çözünmesine tuzun tam ( = 1) ayrışması eşlik eder: Ag2CrO4 ↔ 2Ag + +CrO42-, PR = 2, burada = Cm = 9,48. 10 -5 mol/l, a = 2 =1,89610 -4.
Böylece PR = (1,89610 -4) 2 (9,4810 -5) = 3,410 -12.
Sorun 7. PR CaCO3 = 3.810 -9 ise, CaCO3 C1 = 10-2 M ve C2 = 10-6 M konsantrasyonlarına sahip CaCO3 tuzu çözeltileri hazırlamak mümkün müdür?
Çözüm: PR değerini bilerek konsantrasyonu hesaplayabilirsiniz
doymuş tuz çözeltisi ve önerilenle karşılaştırılması
konsantrasyonları, çözelti hazırlamanın olasılığı veya imkansızlığı hakkında bir sonuca varır. Kalsiyum karbonatın çözünmesi CaCO 3 ↔Ca 2+ +CO 3 2- şemasına göre ilerler. Bu denklemde N = M = 1 o zaman
 =
=
 ≈ 6,2 10 -5 mol/l,
≈ 6,2 10 -5 mol/l,
C 1 > C m – çökelti oluşacağından çözelti hazırlanamıyor;
C2< С м – раствор приготовить можно.
İyon değişim reaksiyonları
Elektrolit çözeltileri iyon değişim reaksiyonları ile karakterize edilir. Bu tür reaksiyonların neredeyse tamamen gerçekleşmesinin ön koşulu, aşağıdaki nedenlerden dolayı belirli iyonların çözeltiden uzaklaştırılmasıdır:
1) tortu oluşumu
FeSO 4 + 2 NaOH Fe(OH) 2 + Na 2 SO 4 - moleküler denklem (MU)
Fe 2+ +SO 4 2- +2Na + +2OH - Fe(OH) 2 +2Na + +SO 4 2- iyon-moleküler denklem (IMU).
Fe 2+ +2OH - Fe(OH) 2 (PR Fe (OH) 2 = 4,810 -16) – çökeltinin oluşumu için kısa bir iyon-moleküler denklem;
2) gaz salınımı
Na 2 CO 3 + 2H 2 SO 4 H 2 CO 3 + 2NaHSO 4 (MU)
2Na + +CO3 2- + 2H + + 2HSO 4 - H 2 C0 3 + 2Na + + 2HSO 4 - (IMU)
2H + + CO 3 2- H 2 C0 3 H 2 O + C0 2 - iyon - moleküler seviye
uçucu bir bileşiğin oluşumu.
3) zayıf elektrolitlerin oluşumu
a) basit maddeler:
2KCN + H 2 SO 4 2HCN + K 2 SO 4 (MU)
2K + + 2CN - + 2H + +SO 4 2- 2HCN + 2K + +SO 4 2- (IMU)
CN - +H + HCN (K d HCN = 7,8 · 10 -10) – zayıf elektrolit HCN'nin iyon-moleküler oluşum seviyesi.
b) karmaşık bileşikler:
ZnCl 2 + 4NH 3 Cl 2 (MU)
Zn 2+ + 2Cl - +4NH3 2+ + 2Cl - -(IMU)
Zn 2+ +4NH3 2+ - karmaşık bir katyonun oluşumu için kısa bir iyonik moleküler denklem.
Başlangıç malzemeleri ve reaksiyon ürünleri arasında zayıf elektrolitlerin veya az çözünen bileşiklerin olduğu işlemler vardır. Bu durumda denge, en düşük ayrışma sabitine sahip maddelerin oluşumuna veya daha az çözünür bir maddenin oluşumuna doğru kayar:
A) NH4OH + HCl NH4Cl + H2O (MU)
NH4OH + H + + Cl - NH4 + + Cl - + H2O
NH 4 OH + H + NH 4 + + H 2 O (IMU)
K d ( NH 4 OH) =1,8 10 -5 > K d ( H 2 O) =1,810 -16.
Denge su moleküllerinin oluşumuna doğru kaydırılır.
B) AgCl + NaI AgI + NaCl (MU)
AgCl + Na + +I - AgI+ Na + +Cl -
AgCl + I - AgI + Cl - (IMU)
VESAİRE AgCl =1.7810 -10 > VESAİRE AgI =8.310 -17.
Denge, bir AgI çökeltisinin oluşumuna doğru kaydırılır.
C) Denklemlerde hem az çözünen bir bileşiğin hem de zayıf bir elektrolitin bulunduğu işlemler olabilir.
MnS + 2HCl MnCl 2 + H 2 S (MU)
MnS + 2H + +2Cl - Mn 2+ + 2Cl - + H 2 S
MnS + 2 H + Mn 2+ + H 2 S (IMU)
PR MnS =2.510 -10 ; =  =1,58,10 -5 mol/l
=1,58,10 -5 mol/l
K d H 2 S = K 1 K 2 = 610 -22; =  =5.4.10 -8 mol/l
=5.4.10 -8 mol/l
S 2-iyonlarının H 2 S moleküllerine bağlanması, MnS'ye göre daha eksiksiz bir şekilde gerçekleşir, bu nedenle reaksiyon ileri yönde, H 2 S oluşumuna doğru ilerler.
Tuzların hidrolizi
Hidroliz, tuz iyonlarının hidrasyon kabuklarıyla polarizasyon etkileşiminin sonucudur. Hidroliz, su molekülleri ile tuz iyonları arasındaki çözeltideki değişim reaksiyonudur. Hidroliz sonucunda, zayıf bir elektrolit (zayıf asit veya zayıf baz) oluşumu nedeniyle, H2O⇄H + + OH - iyonik dengesi, H + veya OH'nin bağlanmasına bağlı olarak değişir - ve pH ortamı değişir. . Zayıf asit veya zayıf baz iyonları içeren tuzlar hidrolize uğrar. Güçlü bir asit ve güçlü bir bazın iyonlarından oluşan tuzlar hidrolize uğramaz (NaCl, Na2S04). Hidroliz ürünleri zayıf elektrolitler, zayıf ayrışan, az çözünen ve uçucu maddeler olabilir. Hidroliz aşamalı bir reaksiyondur; çoklu yüklü iyon durumunda adım sayısı yüküne eşittir. Hidroliz katyon Güçlü asit anyonları ve zayıf baz katyonlarının oluşturduğu tuzlar etkilenir. Örneğin zayıf bazlar arasında hidroksitler bulunur P- Ve D-metaller (K d 10 -4) ve ayrıca amonyum hidroksit.
Çinko klorür, zayıf Zn(OH)2 bazı ve güçlü asit HC1'den oluşan bir tuzdur. Çinko katyonunun yükü 2+ olduğundan hidroliz iki aşamada gerçekleşir:
Zn 2+ + HOH ↔ ZnOH + + H + I aşaması
ZnOH + +HOH↔ Zn(OH) 2 +H + II aşaması
Bu etkileşimin bir sonucu olarak, fazla miktarda H + iyonu ortaya çıkar ([H + ] [OH - ]), çözelti asitleştirilir (pH<7).
Hidroliz anyon. Bu tip hidroliz, zayıf bir asidin anyonları (Kd 10 -3) ve güçlü bir bazın katyonları (Kd >10 -3) tarafından oluşturulan tuzlar için tipiktir. Zayıf karbonik asitH2C03 (KdI) tarafından oluşturulan bir tuz olan potasyum karbonatın hidrolizini ele alalım. = 4,5. 10 -7) ve güçlü baz KOH, karbokso anyonu (2-) yüküne sahiptir. Hidroliz iki aşamada gerçekleşir:
CO 3 2- +H 2 O↔HCO 3 - +OH - Aşama I
HCO 3 - +H 2 O↔H 2 CO 3 +OH - II aşaması
Bu durumda OH - iyonları açığa çıkar ([H + ] [OH - ]) - çözelti alkalin hale gelir (pH > 7).
Geri dönüşü olmayan hidroliz. Zayıf bir baz ve zayıf bir asitin oluşturduğu tuzlar katyon ve anyonda hidrolize olur. Hidrolizin sonucu değere bağlı olacaktır. Bazlara ve asitlere. Zayıf elementlerin oluşturduğu bir tuz olan amonyum florürün hidrolizini ele alalım.
baz NH4OH (Kd = 1.8.10-5) ve zayıf asit HF (Kd = 6.8.10-4):
NH4F + HOH NH4OH + HF
Bu durumda K d ( NH 4OH) K d ( HF), bu nedenle hidroliz (esas olarak) katyon boyunca ilerleyecek ve ortamın reaksiyonu hafif asidik olacaktır.
Elektrolit çözeltileri arasındaki değişim reaksiyonları
Çökelti oluşumuna yol açan reaksiyonlar. Bir test tüpüne 3-4 ml bakır(I) sülfat çözeltisi, ikincisine aynı miktarda kalsiyum klorür çözeltisi ve üçüncüsüne de alüminyum sülfat dökün. Birinci test tüpüne bir miktar sodyum hidroksit çözeltisi, ikincisine sodyum ortofosfat çözeltisi ve üçüncüsüne baryum nitrat çözeltisi ekleyin. Tüm test tüplerinde çökeltiler oluşur.
Egzersiz yapmak. Reaksiyon denklemlerini moleküler, iyonik ve kısaltılmış iyonik biçimde yazın. Yağışın neden oluştuğunu açıklayın. Çökelti oluşmasına neden olmak için test tüplerine başka hangi maddelerin dökülebileceği çözeltileri? Bu reaksiyonların denklemlerini moleküler, iyonik ve kısaltılmış iyonik formda yazın.
Gaz salınımını içeren reaksiyonlar. Bir test tüpüne 3-4 ml sodyum sülfit çözeltisi, ikincisine de aynı hacimde sodyum karbonat çözeltisi dökün. Her birine aynı miktarda sülfürik asit ekleyin. Birinci test tüpü keskin kokulu bir gaz salar, ikinci test tüpü ise kokusuz bir gaz salar.
Egzersiz yapmak. Moleküler, iyonik ve kısaltılmış iyonik formda meydana gelen reaksiyonların denklemlerini yazın. Benzer sonuçlar elde etmek için bu çözeltilere başka hangi asitlerin uygulanabileceğini düşünün. Bu reaksiyonların denklemlerini moleküler, iyonik ve kısaltılmış iyonik formda yazın.
Hafif ayrışan bir maddenin oluşmasıyla ortaya çıkan reaksiyonlar. Bir test tüpüne 3-4 ml sodyum hidroksit çözeltisi dökün ve iki veya üç damla fenolftalein ekleyin. Çözüm koyu kırmızı bir renk alır. Daha sonra rengi değişene kadar hidroklorik veya sülfürik asit ekleyin.
Başka bir test tüpüne yaklaşık 10 ml bakır(II) sülfat dökün ve bir miktar sodyum hidroksit çözeltisi ekleyin. Mavi bir bakır(II) hidroksit çökeltisi oluşur. Çökelti eriyene kadar sülfürik asidi test tüpüne dökün.
Egzersiz yapmak. Moleküler, iyonik ve kısaltılmış iyonik formda meydana gelen reaksiyonların denklemlerini yazın. İlk test tüpünde renk değişikliğinin neden meydana geldiğini ve ikinci test tüpünde çökeltinin neden çözündüğünü açıklayın. Çözünür ve çözünmeyen bazların ortak özellikleri nelerdir?
Klorür iyonuna kalitatif reaksiyon. Bir test tüpüne 1-2 ml seyreltik hidroklorik asit, ikincisine aynı miktarda sodyum klorür çözeltisi ve üçüncüsüne de kalsiyum klorür çözeltisi dökün. Tüm test tüplerine birkaç damla gümüş(I) nitrat çözeltisi AgNO3 ekleyin. Çökeltinin konsantre nitrik asitte çözülüp çözülmediğini kontrol edin.
Egzersiz yapmak. Karşılık gelen kimyasal reaksiyonların denklemlerini moleküler, iyonik ve kısaltılmış iyonik formda yazın. Aşağıdakileri nasıl ayırt edebileceğinizi düşünün: a) hidroklorik asidi diğer asitlerden; b) diğer tuzlardan elde edilen klorürler; c) hidroklorik asitten klorür çözeltileri. Neden gümüş(I) nitrat çözeltisi yerine kurşun(II) nitrat çözeltisi de kullanabilirsiniz?
Derste iyon değişim reaksiyonlarının tamamlanma koşulları incelenecektir. İyon değiştirme reaksiyonlarının tamamlanmaya devam etmesi için hangi koşulların gözlemlenmesi gerektiğini daha iyi anlamak için bu reaksiyonların ne olduğunu ve özlerini gözden geçireceğiz. Bu kavramları pekiştirmek için örnekler verilmiştir.
Konu: Kimyasal bağ. Elektrolitik ayrışma
Ders: Akış Koşullarıtamamlanmaya kadar iyon değişim reaksiyonları
Sodyum hidroksiti potasyum klorürle reaksiyona sokmaya çalışırsanız reaksiyon oluşmayacaktır. Bir reaksiyonda iyonlar değiştirilir ancak ürün oluşmaz. Bunun nedenlerine bakalım. Karşılıklı çekim sonucu oluşan maddeler ayrışabilir.
1. Bir çökeltinin oluşmasına yol açan iyon değişim reaksiyonları.
Daha önce çökelti oluşumuyla sonuçlanan reaksiyon denklemleri dikkate alınıyordu.
Bu reaksiyonların tümü iyon değişim reaksiyonlarına aitti. İyon değiştirme reaksiyonunun tamamlanmaya doğru ilerlemesi için gerekli koşullardan birinin çökelti oluşması olduğu sonucuna varılabilir.
BaCl2 + Na2C03 → BaCO3 ↓ + 2NaCl.
Ba 2+ +2Cl - + 2Na + + CO 3 2- →BaCO 3 ↓ + 2Na + +2Cl - tam iyonik denklem
Ba 2+ + CO 3 2- → BaCO 3 ↓ kısaltılmış iyonik denklem.
Çökeltinin oluşmasına yol açan başka bir reaksiyon denklemi yazalım.
CuS04 + 2NaOH → Cu(OH)2 ↓ + Na2S04
Cu 2+ + SO 4 2- +2Na + + 2OH - → Cu(OH) 2 ↓ + 2Na + + SO 4 2- tam iyonik denklem
Cu 2+ + 2OH - → Cu(OH) 2 ↓ kısaltılmış iyonik denklem.
Çözüm: Sonuç bir çökelti ise iyon değişim reaksiyonları tamamlanmaya devam eder.
Pirinç. 1. Nötralizasyon reaksiyonu ()
Sodyum hidroksitin hidroklorik asitle nötrleştirilmesi reaksiyonunu düşünün.
NaOH + HCl → NaCl+ H 2 O
Na + + OH - + H + + Cl - →Na + + Cl - + H2O tam iyonik denklem
OH - + H + → H 2 O indirgenmiş iyonik denklem
Bu reaksiyon tamamlanmaya devam eder, çünkü sonuç hafif ayrışan bir madde olan sudur.
Çözüm: Sonuç hafif ayrışan bir madde ise iyon değişim reaksiyonları tamamlanmaya devam eder.
Kalsiyum karbonatın hidroklorik asitle iyi reaksiyona girdiğini biliyorsunuz.
CaCO3 +2HCl → CaCl2 + H2O + CO2
CaCO3 +2H + + 2Cl - → Ca2+ +2Cl - + H2O + CO2 tam iyonik denklem
2H + + CaCO3 → Ca2+ + H2O + CO2 kısaltılmış iyonik denklem.
Bu reaksiyon sonucunda zayıf karbonik asidin ayrışması sırasında oluşan karbondioksit üretilir. Kalsiyum karbonatın çözünmeyen bir madde olduğunu ve iyonlara parçalanmadığını lütfen unutmayın. İyonik denklemin tamamında iyon olarak yalnızca hidrojen klorür ve kalsiyum klorür yazıyoruz. Geriye kalan formüller bu maddelere maruz kalmadığından değişmeden kalır.
Çözüm:İyon değiştirme reaksiyonları gazla sonuçlanırsa tamamlanmaya devam eder.
Bu derste iyon değişim reaksiyonlarının tamamlanma koşullarını incelediniz. Sonuç çökelti, hafif ayrışan bir madde veya gaz ise iyon değişim reaksiyonları tamamlanmaya devam eder.
1. Rudzitis G.E. İnorganik ve organik kimya. 9. sınıf: genel eğitim kurumları için ders kitabı: temel düzey / G. E. Rudzitis, F.G. Feldman. M.: Aydınlanma. 2009 119 s.: hasta.
2. Popel P.P. Kimya: 8. sınıf: genel eğitim kurumları için ders kitabı / P.P. Popel, L.S. Krivlya. -K.: IC “Akademi”, 2008.-240 s.: hasta.
3. Gabrielyan O.Ş. Kimya. 9. sınıf. Ders kitabı. Yayıncı: Bustard: 2001. 224'ler.
1. No. 3,4,5 (s.22) Rudzitis G.E. İnorganik ve organik kimya. 9. sınıf: genel eğitim kurumları için ders kitabı: temel düzey / G. E. Rudzitis, F.G. Feldman. M.: Aydınlanma. 2009 119 s.: hasta.
2. Sodaya sirke kattığınızda hamur yaparken nelere dikkat ediyorsunuz? Reaksiyon denklemini yazın.
3. Su ısıtıcısında neden kireç oluşuyor? Nasıl kaldırılır? Reaksiyon denklemlerini yazın.
Hedefler:
- Öğrenciler iyon değişim reaksiyonları ve bunların meydana geldiği koşullar hakkında bilgi sahibi olmalıdır.
- maddelerin ayrışma denklemlerini yazma becerilerini geliştirmeye devam etmek;
- çözünürlük tablosuyla çalışın;
- elektrolitleri ve elektrolit olmayanları tanırken, karşılaştırma yaparken, gözlem yaparken mantıksal düşünmeyi geliştirmek; pratik beceri ve yetenekler geliştirmek, sonuç çıkarmak;
- Moleküler, tam iyonik ve indirgenmiş iyonik formlarda reaksiyon denklemlerini yazar.
Yöntemler ve metodolojik teknikler: sözel-görsel, buluşsal, grup ön laboratuvar çalışması.
Teçhizat:
- öğrenci masalarında: H 2 SO 4, BaCl 2, Na 2 CO 3, fenolftalein, NaOH, 4 şırınga, tablet, çözünürlük tablosu, doldurulacak tablo.
- öğretmene: H2S04, BaCl2, Na2C03, fenolftalein, NaOH, 3 test tüpü, 2 kapta: soda ve tuz, su, asetik asit.
Dersler sırasında
1. Organizasyon anı.
2. Hedef belirleme.
Öğretmen. Beyler, mutfağınızda etiketsiz 2 özdeş kavanozda tuz ve soda bulunduğunu hayal edin. Bu iki maddeyi tatmadan nasıl tanıyabilirsiniz?
Öğretmen. Bunu öğrenmek için iyon değişim reaksiyonlarını tanımamız, bunların oluşma koşullarını belirlememiz ve tam, kısaltılmış iyonik denklemler yazmayı öğrenmemiz gerekir. İyon değişim reaksiyonlarının mekanizmasını daha iyi anlamak için hangi maddelere elektrolit denildiğini hatırlayalım.
Öğrenci. Elektrolitler eriyiklerde ve çözeltilerde elektrik akımını ileten maddelerdir.
Öğretmen. Çözeltilerdeki ve eriyiklerdeki elektrolitler neden elektrik akımını iletir?
Öğrenci. Elektrolitler, çözeltilerde iyonlar oluştuğu ve eridiği için elektriği iletir.
Öğretmen. Elektrolitik ayrışma nedir?
Öğrenci. Elektrolitin iyonlara parçalanması işlemine elektrolitik ayrışma denir.
Öğretmen. Çeşitli maddeler için ayrışma denklemlerini yazalım. (3 öğrenci tahtadaki kartlar üzerinde çalışır):
- 1 numaralı kart. Maddeler için özet ayrışma denklemleri yazın: H 2 SO 4, HCl.
- 2 numaralı harita. Maddeler için genel ayrışma denklemlerini yazın: Na 2 CO 3, BaCl 2.
- Kart No. 3. Maddeler için toplam ayrışma denklemlerini yazın: NaOH, Ba(OH) 2
Öğretmen. Sınıf ödevi: Bu madde listesinden elektrolitleri ve elektrolit olmayanları seçin.
KCl, CuO, CuS04, Cu(OH)2, BaS04, K2S04. (bir sayfadan).
Elektrolitler için özet ayrışma denklemlerini yazın. (tahtada).
Öğretmen. Tahtadaki notları kontrol edelim.
Öğretmen. Beyler, çözünmeyen BaSO 4 maddesinin hangi iyonlardan oluştuğunu söyleyin?
Öğrenci. Baryum sülfat, baryum iyonları ve sülfat iyonlarından oluşur.
Öğretmen. Çözünürlükleri Ba 2+ iyonu ve SO 4 2- ? içeren maddeleri çözünürlük tablosunu kullanarak adlandırın.
Öğrenci. Örneğin baryum klorür ve sülfürik asit.
Öğretmen. H 2 SO 4 ile BaCl 2 arasındaki reaksiyonun denklemini yazalım (tahtadaki öğrenci).
BaCl2 + H2SO4 = BaSO4 + 2HCl
Öğretmen. Elektrolit çözeltilerde meydana gelen reaksiyonlara iyon değişim reaksiyonları denir. İyon değişim reaksiyonlarının hangi koşullar altında gerçekleştiğini öğrenmek için laboratuvar çalışması yapalım:
Amaç: Bu tür reaksiyonların koşullarına aşina olmak. (not defterine yazın)
1 numaralı deneyimi yaşayın. BaSO 4'ün elde edilmesi (deneyim yerine, “Cyril ve Methodius sanal okulu” 9. sınıf 6 numaralı dersten bir dersin bir parçasını kullanabilirsiniz)
Öğretmen tahtada da aynısını yapar.
Öğretmen şu yorumu yapar: BaCl 2 çözeltisine H 2 SO 4 çözeltisi ekleyin, ne gözlemliyoruz?
Öğrenci : Beyaz bir çökelti düştü.
Öğretmen: İyonik denklemin tamamını yazalım, bunun için alınan maddelerin çözeltilerinde hangi iyonların bulunduğunu ve hangi maddelerin oluştuğunu yazıyoruz.
2H 1+ + SO 4 2- + Ba 2+ +2Cl 1- - > BaSO 4v + 2H 1+ +2Cl 1-
Bu tam iyonik denklemdir.
Denklemin sağ ve sol taraflarını aynı iyonlarla azaltırsak kısaltılmış iyonik denklemi elde ederiz.
SO 4 2- + Ba 2+ -> BaSO 4v
Tartışma:
Sınıf için sorular:
- Reaksiyondan önce çözeltide hangi iyonlar vardı?
- Reaksiyondan sonra çözeltide hangi iyonlar kaldı?
- Bu tepkilerin özü nedir?
Sınıfla konuşma: Reaksiyonun esasının Ba 2+ ve SO 4 2- iyonlarının bağlanması olduğunu tartışıyoruz.
Bu denklem bu reaksiyonun özünü göstermektedir.
2 numaralı deneyimi yaşayın. Karbondioksit elde etmek.
Öğretmen yorumu: Na 2 CO 3 çözeltisine H 2 SO 4 çözeltisi ekleyin (1 öğrenci reaksiyonu tahtaya yazar)
Na 2 C03 + H 2 SO 4 = Na 2 SO 4 + H 2 O + C02
Ne görüyoruz?
Öğrenci: Gaz kabarcıklarının salınması.
Öğretmen iyonik denklemin tamamını ve kısaltılmış iyonik denklemi yazar.
2Na 1+ +CO3 2- +2H 1+ +SO 4 2- - >2Na 1+ + SO 4 2- + H 2 O+ CO 2
CO 3 2- +2H 1+ -> H 2 O+ CO 2
3 numaralı deneyimi yaşayın. H 2 O oluşumu (düşük ayrışan madde).
Öğretmen yorumu: NaOH çözeltisine 1-2 damla ftalein fenol ekleyin, çözelti kıpkırmızı olur, H 2 SO 4 ekleyin. (1 öğrenci reaksiyonu tahtaya yazar)
2 NaOH + H2S04 = Na2S04 + 2 H20
Ne görüyoruz?
Öğrenci. Çözelti renksiz hale geldi.
Öğretmen. İyonik denklemin tamamını ve kısaltılmış iyonik denklemini tahtaya yazalım (1 öğrenci).
2Na 1+ +2OH 1- +2H 1+ + SO 4 2- ->2Na 1+ + SO 4 2- + 2H 2 O
2OH 1- +2H 1+ ->2H 2 O
| Reaksiyon koşulları Elektrolit çözeltileri arasında (öğrenci tarafından doldurulacaktır). |
İyon değiştirme reaksiyonlarına örnekler. |
| 1. | Na2C03 +CaCl2 =CaCO3 +2NaCl 2Na + + CO3 2- +Ca 2+ + 2Cl - = CaCO3 +2Na + + 2Cl - Ca 2+ + CO 3 2- = CaCO 3 |
| 2. | K2C03 +2HCl =2KCl+H20+C02 2K + + CO3 2- +2H + +2Cl - =2K + +2Cl - +H2O+CO2 CO 3 2- +2H + = CO 2 ^+H 2 O |
| 3. | NaOH+HNO3 = NaNO3 +H20 Na + +OH - +H + +NO3 =Na + +NO3 - + H2O H + + OH - =H20 |
Öğretmen: Çocuklar, iyon değişim reaksiyonlarını gerçekleştirdik. Sonuca varalım: İyon değişim reaksiyonları hangi koşullar altında tamamlanmaya başlar? (verilen tabloları doldurun)
Öğrenci: Sonuç olarak bir çökelti oluşursa, bir gaz açığa çıkarsa ve su gibi zayıf ayrışan bir madde oluşursa, iyon değişim reaksiyonları tamamlanmaya devam eder.
Öğretmen: Sorunumuza dönelim. Tuz (NaCl) ve sodayı (Na 2 CO 3) tanımak için bir yöntem önerin.
Öğrenci : Bu maddelere asit eklemeniz gerekiyor. Hangi kapta gaz çıkışı gözlemlenecekse soda olacaktır.
Malzemenin sabitlenmesi:
Kuruldaki görevi: 1 Bu listeden sona giden reaksiyonları seçin (bir öğrenci)
NaOH+ NaCl -> NaCl+ H 2 O
AgNO 3 + NaCl ->NaNO 3 + AgCl
CuCl 2 +2NaOH ->Cu(OH) 2 +2NaCl
KNO 3 +LiCl ->KCl+LiNO 3
Verilen:
İyonik denklemi tamamlayın.
Fe3+ +3Cl - +3Na + +3OH - = Fe(OH)3 +3Na + +3Cl -
Moleküler ve kısaltılmış iyonik denklemleri buna göre yazın.
Öğretmen. Dersimizi özetleyelim: Derste hangi tepkilerle tanıştık?
Öğrenci.İyon değişim reaksiyonlarını öğrendik.
Öğretmen. Bu reaksiyonların tamamlanmaya devam etmesi hangi koşullar altında mümkündür?
Öğrenci. İyon değiştirme reaksiyonları, bir çökelti oluştuğunda, bir gaz açığa çıktığında ve hafif ayrışan bir madde oluştuğunda tamamlanmaya devam eder.
Öğretmen. Ödev: §37 alıştırması. 4, 5.
Edebiyat.
- Gabrielyan O.S. Kimya. 8. sınıf: Bustard, 1999.
- “Cyril ve Methodius Sanal Okulu” Kimya dersleri 8-9. sınıflar, 2004.
Önerilen materyal, 9. sınıf için pratik çalışmanın metodolojik gelişmelerini sunmaktadır: “Azot ve Fosfor” konulu deneysel problemlerin çözülmesi, “Mineral gübrelerin belirlenmesi” ve “Elektrolit çözeltileri arasındaki değişim reaksiyonları” konulu laboratuvar deneyleri.
Elektrolit çözeltileri arasındaki değişim reaksiyonları
Metodolojik geliştirme üç bölümden oluşur: teori, çalıştay, kontrol. Teorik kısım, bir çökelti oluşumu, hafif ayrışan bir madde ve gaz salınımı ile meydana gelen kimyasal reaksiyonların moleküler, tam ve kısaltılmış iyonik denklemlerinin bazı örneklerini sağlar. Pratik kısım, öğrencilere laboratuvar deneylerinin nasıl yapılacağına ilişkin görevler ve öneriler içerir. Kontrol, doğru cevabın seçildiği test görevlerinden oluşur.
Teori
1. Çökelti oluşumuna yol açan reaksiyonlar.
a) Bakır(II) sülfat sodyum hidroksit ile reaksiyona girdiğinde mavi bir bakır(II) hidroksit çökeltisi oluşur.
CuS04 + 2NaOH = Cu(OH)2 + Na2S04.
Cu 2+ + + 2Na + + 2OH – = Cu(OH) 2 + 2Na + + ,
Cu 2+ + 2OH – = Cu(OH)2.
b) Baryum klorür sodyum sülfatla reaksiyona girdiğinde beyaz sütlü bir baryum sülfat çökeltisi çöker.
Bir kimyasal reaksiyonun moleküler denklemi:
BaCl2 + Na2S04 = 2NaCl + BaS04.
Tam ve kısaltılmış iyonik reaksiyon denklemleri:
Ba 2+ + 2Cl – + 2Na + + = 2Na + + 2Cl – + BaS04 ,
Ba 2+ + = BaS04 .
2.
Sodyum karbonat veya bikarbonat (kabartma tozu) hidroklorik veya diğer çözünür asitlerle etkileşime girdiğinde kaynama veya yoğun gaz kabarcıkları salınımı gözlemlenir. Bu, karbondioksit CO2 açığa çıkararak kireç suyunun (kalsiyum hidroksit) berrak çözeltisinde bulanıklığa neden olur. Kireçli su bulanıklaşıyor çünkü... çözünmeyen kalsiyum karbonat oluşur.
a) Na2C03 + 2HCl = 2NaCl + H20 + C02;
b) NaHC03 + HC1 = NaCl + C02 + H20;
Ca(OH)2 + C02 = CaC03 + H20.
a) 2Na + + + 2H + + 2Cl – = 2Na + + 2Cl – + CO 2 + H 2 O,
2H+ = C02 + H20;
b) Na + + + H + + Cl – = Na + + Cl – + CO2 + H2O,
H + = C02 + H20.
3. Hafif ayrışan bir maddenin oluşmasıyla ortaya çıkan reaksiyonlar.
Sodyum veya potasyum hidroksit, fenolftalein göstergesi varlığında hidroklorik asit veya diğer çözünür asitlerle reaksiyona girdiğinde, alkali çözelti renksiz hale gelir ve nötrleştirme reaksiyonunun bir sonucu olarak, düşük ayrışan bir H20 maddesi oluşur.
Kimyasal reaksiyonların moleküler denklemleri:
a) NaOH + HC1 = NaCl + H20;
c) 3KOH + H3P04 = K3P04 + 3H20.
Tam ve kısaltılmış iyonik reaksiyon denklemleri:
a) Na + + OH – + H + + Cl – = Na + + Cl – + H 2 O,
OH – + H + = H20;
b) 2Na + + 2OH – + 2H + + = 2Na + + + 2H 2 O,
2OH – + 2H + = 2H20;
c) 3K + + 3OH – +3H + + = 3K + + + 3H 2 O,
3OH – + 3H + = 3H20.
Atölye
1. Elektrolit çözeltileri arasında çökelti oluşumuna yol açan değişim reaksiyonları.
a) Bakır(II) sülfat ve sodyum hidroksit çözeltileri arasında reaksiyon gerçekleştirin. Kimyasal reaksiyonların moleküler, tam ve kısaltılmış iyonik denklemlerini yazın, kimyasal reaksiyon belirtilerine dikkat edin.
b) Baryum klorür ve sodyum sülfat çözeltileri arasında bir reaksiyon gerçekleştirin. Kimyasal reaksiyonların moleküler, tam ve kısaltılmış iyonik denklemlerini yazın, kimyasal reaksiyon belirtilerine dikkat edin.
2. Gaz salınımını içeren reaksiyonlar.
Sodyum karbonat veya sodyum bikarbonat (kabartma tozu) çözeltileri ile hidroklorik veya diğer çözünür asitler arasındaki reaksiyonları gerçekleştirin. Açığa çıkan gazı (bir gaz çıkış tüpü kullanarak), başka bir test tüpüne dökülen temiz kireçli sudan, bulanıklaşana kadar geçirin. Kimyasal reaksiyonların moleküler, tam ve kısaltılmış iyonik denklemlerini yazın, bu reaksiyonların işaretlerini not edin.
3. Hafif ayrışan bir maddenin oluşmasıyla ortaya çıkan reaksiyonlar.
Fenolftaleini alkali çözeltiye yerleştirdikten sonra bir alkali (NaOH veya KOH) ile bir asit (HCl, HNO3 veya H2S04) arasında nötrleştirme reaksiyonları gerçekleştirin. Gözlemleri not edin ve kimyasal reaksiyonlar için moleküler, tam ve kısaltılmış iyonik denklemleri yazın.
İşaretler Bu reaksiyonlara eşlik eden aşağıdaki listeden seçilebilir:
1) gaz kabarcıklarının salınması; 2) sedimantasyon; 3) kokunun ortaya çıkışı; 4) tortunun çözünmesi; 5) ısı salınımı; 6) çözeltinin renginde değişiklik.
Kontrol (test)
1. Mavi çökeltiyi oluşturan reaksiyonun iyonik denklemi şöyledir:
a) Cu2+ + 2OH – = Cu(OH)2;
c) Fe3+ + 3OH – = Fe(OH)3;
d) Al 3+ + 3OH – = Al(OH)3.
2. Karbondioksitin açığa çıktığı reaksiyonun iyonik denklemi şöyledir:
a) CaC03 + C02 + H20 = Ca2+ +;
b) 2H + + S02-3 = H20 + S02;
c) C02-3 + 2H + = C02 + H20;
d) 2H + + 2OH – = 2H20.
3. Düşük ayrışan bir maddenin oluştuğu reaksiyonun iyonik denklemi şöyledir:
a) Ag + + Cl – = AgCl;
b) OH – + H + = H20;
c) Zn + 2H + = Zn 2+ + H2;
d) Fe3+ + 3OH – = Fe(OH)3.
4. Beyaz çökeltiyi oluşturan reaksiyonun iyonik denklemi şöyledir:
a) Cu2+ + 2OH – = Cu(OH)2;
b) CuO + 2H + = Cu2+ + H20;
c) Fe3+ + 3OH – = Fe(OH)3;
d) Ba2+ + SO2-4 = BaS04.
5. 3OH – + 3H + = 3H 2 O reaksiyonu için kısaltılmış iyonik denkleme karşılık gelen moleküler denklem şöyledir:
a) NaOH + HC1 = NaCl + H20;
b) 2NaOH + H2S04 = Na2S04 + 2H20;
c) 3KOH + H3P04 = K3P04 + 3H20;
d) Ba(OH)2 + 2HCl = BaCl2 + H20.
6. Kısaltılmış iyonik reaksiyon denklemine karşılık gelen moleküler denklem
H + + = H 2 O + CO 2 , –
a) MgC03 + 2HCl = MgCl2 + C02 + H20;
b) Na2C03 + 2HCl = 2NaCl + C02 + H20;
c) NaHC03 + HC1 = NaCl + C02 + H20;
d) Ca(OH)2 + C02 = CaC03 + H20.
| Yanıtlar. 1 -A; 2 -V; 3 -B; 4 -G; 5 -V; 6 -V. |
“Azot ve Fosfor” konulu deneysel problemlerin çözümü
Öğrenciler "Azot ve Fosfor" konulu yeni materyaller üzerinde çalışırken, amonyak üretimi, nitratların, fosfatların ve amonyum tuzlarının belirlenmesi ile ilgili bir dizi deney gerçekleştirir ve belirli beceri ve yetenekler kazanırlar. Bu metodolojik gelişme altı görevi içermektedir. Pratik çalışmayı tamamlamak için üç görev yeterlidir: biri maddeyi elde etme, ikisi maddeleri tanıma. Pratik çalışmalar yaparken öğrencilere rapor hazırlamalarını kolaylaştıracak bir biçimde görevler sunulabilir (bkz. Görev 1, 2). (Cevaplar öğretmen adına verilmiştir.)
1. Egzersiz
Amonyak elde edin ve varlığını deneysel olarak kanıtlayın.
a) Amonyak üretimi.
Eşit hacimli katı amonyum klorür ve kalsiyum hidroksit tozu karışımını, gaz çıkış tüpü olan bir test tüpünde ısıtın. Bu durumda, bir delik bulunan başka bir kuru test tüpünde toplanması gereken amonyak açığa çıkacaktır............. ( Neden?).
Amonyak üretimi için reaksiyon denklemini yazın.
…………………………………………………..
b) Amonyak tayini.
Kokusuyla tanınabilir………… (maddenin adı) turnusol veya fenolftaleinin rengindeki değişikliklerin yanı sıra. Amonyak suda çözündüğünde ...... oluşur. (bazın adı) yani turnusol testi...... (renk belirtin) ve renksiz fenolftalein ………… olur. (renk belirtin).
Noktalar yerine kelimeleri anlamlarına göre ekleyin. Reaksiyon denklemini yazın.
…………………………………………………..


* Amonyağın sulu bir çözeltisi olan amonyak, amonyak gibi kokar. – Not ed.
Görev 2
Bakır nitratı, aşağıdaki maddeleri içeren iki farklı yolla hazırlayın: konsantre nitrik asit, bakır talaşları, bakır(II) sülfat, sodyum hidroksit. Kimyasal reaksiyonların denklemlerini moleküler biçimde yazın ve değişiklikleri not edin. Yöntem 1'de bir redoks reaksiyonu için elektron dengesi denklemlerini yazın, oksitleyici maddeyi ve indirgeyici maddeyi belirleyin. Yöntem 2'de kısaltılmış iyonik reaksiyon denklemlerini yazın.
1. s p o s o b. Bakır + nitrik asit. Test tüpünün içeriğini hafifçe ısıtın. Renksiz çözüm olur… .. (renk belirtin), Çünkü oluşturulmuş….. (maddenin adı); hoş olmayan bir kokuya sahip olan …….. gaz açığa çıkar, bu……. (maddenin adı).
2.s p o s o b. Bakır(II) sülfat sodyum hidroksit ile reaksiyona girdiğinde ..... renginde bir çökelti elde edilir, bu ...... (maddenin adı). Çökelti tamamen eriyene kadar nitrik asit ekleyin....... (tortunun adı). Berrak mavi bir çözelti oluşur...... (tuzun adı).


Görev 3
Amonyum sülfatın NH 4+ ve SO 2-4 iyonları içerdiğini deneysel olarak kanıtlayın. Gözlemleri not edin ve reaksiyonlar için moleküler ve kısaltılmış iyonik denklemleri yazın.


Görev 4
1, No. 2, No. 3 test tüplerinde sodyum ortofosfat, sodyum klorür, sodyum nitrat çözeltilerinin varlığı deneysel olarak nasıl belirlenir? Gözlemleri not edin ve reaksiyonlar için moleküler ve kısaltılmış iyonik denklemleri yazın.

Görev 5
Aşağıdaki maddelere sahip olmak: nitrik asit, bakır talaşı veya tel, evrensel gösterge kağıdı veya metil turuncu, nitrik asidin bileşimini deneysel olarak kanıtlamaktadır. Nitrik asidin ayrışması için denklemi yazın; Bakırın konsantre nitrik asitle reaksiyonunun moleküler denklemi ve elektron dengesi denklemleri, oksitleyici maddeyi ve indirgeyici maddeyi tanımlar.

Görev 6
Aşağıdaki maddeleri içeren farklı şekillerde bir bakır nitrat çözeltisi hazırlayın: nitrik asit, bakır oksit, bazik bakır karbonat veya hidroksibakır(II) karbonat. Kimyasal reaksiyonlar için moleküler, tam ve kısaltılmış iyonik denklemleri yazın. Kimyasal reaksiyon belirtilerine dikkat edin.


Karşılaştırma testleri
1. Sarı bir çökeltinin oluştuğu reaksiyon denklemini verin.

2. Beyaz peynirli çökeltinin oluştuğu reaksiyonun iyonik denklemi şöyledir:

3. Nitratlarda nitrat iyonunun varlığını kanıtlamak için şunları yapmanız gerekir:
a) hidroklorik asit ve çinko;
b) sülfürik asit ve sodyum klorür;
c) sülfürik asit ve bakır.
4. Klorür iyonu için reaktif:
a) bakır ve sülfürik asit;
b) gümüş nitrat;
c) baryum klorür.
5. Reaksiyon denkleminde diyagramı
HNO 3 + Cu -> Cu(NO 3) 2 + NO 2 + H 2 O,
Oksitleyici maddeden önce katsayıyı koymanız gerekir:
a) 2; b) 4; 6'da.
6. Bazik ve asit tuzları çiftlere karşılık gelir:
a) Cu(OH)2, Mg(HC03)2;
b) Cu(N03)2, HNO3;
c) 2C03, Ca(HCO3)2.
|
Yanıtlar. 1 -A; 2 -B; 3 -V; 4 -B; 5 -B; 6 -V. |
Mineral gübrelerin belirlenmesi
Bu pratik çalışmanın metodolojik gelişimi üç bölümden oluşur: teori, atölye çalışması, kontrol. Teorik kısım, mineral gübrelerde bulunan katyon ve anyonların kalitatif tayini hakkında genel bilgi sağlar. Atölye, karakteristik özelliklerinin bir açıklamasıyla birlikte yedi mineral gübrenin örneklerini sunuyor ve ayrıca niteliksel reaksiyonlar için denklemler veriyor. Metinde noktalar ve soru işaretleri yerine anlam bakımından uygun cevapları eklemeniz gerekir. Öğretmenin takdirine bağlı olarak pratik çalışmayı tamamlamak için dört gübre almak yeterlidir. Öğrencilerin bilgilerini test etmek, bu pratik çalışmada verilen gübre formüllerini belirlemeye yönelik test görevlerinden oluşur.
Teori
1. Klorür iyonunun reaktifi gümüş nitrattır. Reaksiyon beyaz peynirli bir çökeltinin oluşmasıyla ilerler:
Ag + + Cl – = AgCl.
2. Amonyum iyonu alkali kullanılarak tespit edilebilir. Bir amonyum tuzu çözeltisi bir alkali çözelti ile ısıtıldığında keskin karakteristik bir kokuya sahip olan amonyak açığa çıkar:
NH + 4 + OH – = NH3 + H20.
Amonyum iyonunu belirlemek için suyla nemlendirilmiş kırmızı turnusol kağıdı, evrensel bir gösterge veya fenolftalein kağıt şeridi de kullanabilirsiniz. Kağıt parçası test tüpünden çıkan buharların üzerinde tutulmalıdır. Kırmızı turnusol maviye, evrensel gösterge mora ve fenolftalein kırmızıya döner.
3. Nitrat iyonlarını belirlemek için tuz çözeltisine bakır talaşı veya parçaları eklenir, ardından konsantre sülfürik asit eklenir ve ısıtılır. Bir süre sonra hoş olmayan bir kokuya sahip kahverengi bir gaz açığa çıkmaya başlar. Kahverengi NO2 gazının salınması iyonların varlığını gösterir.
Örneğin:
NaNO3 + H2SO4 NaHSO4 + HNO3,
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O.
4. Fosfat iyonunun reaktifi gümüş nitrattır. Bir fosfat çözeltisine eklendiğinde sarı bir gümüş fosfat çökeltisi çöker:
3Ag + + PO 3- 4 = Ag 3 PO 4.
5. Sülfat iyonunun reaktifi baryum klorürdür. Asetik asitte çözünmeyen beyaz sütlü baryum sülfat çökeltisi çöker:
Ba2+ + SO2-4 = BaS04.
Atölye
1. Sylvinite (NaCl KCl), pembe kristaller, suda iyi çözünürlük. Alev sarıya döner. Aleve mavi camdan bakıldığında mor bir renk fark edilir. İLE …….. (reaktifin adı) beyaz bir çökelti verir...... (tuzun adı).
KCI + ? -> KNO3 + AgCl.
2. Amonyum nitrat NH 4 NO 3 veya…….. (gübrenin adı) Beyaz kristaller, suda oldukça çözünür. Sülfürik asit ve bakırla birlikte kahverengi gaz açığa çıkıyor... (maddenin adı). Çözüm ile……. (reaktifin adı) Isıtıldığında amonyak kokusu hissedilir, buharı kırmızı turnusola dönüşür. renk.
NH 4 NO 3 + H 2 SO 4 NH 4 HSO 4 + HNO 3,
HNO 3 + Cu -> Cu(NO 3) 2 + ? +? .
NH4 NO3 + ? -> NH3 + H2O + NaNO3.
3. Potasyum nitrat (KNO 3), veya…… (gübrenin adı), H 2 SO 4 ve ……… ile (maddenin adı) kahverengi gaz üretir. Alev mora döner.
KNO 3 + H 2 SO 4 KHSO 4 + HNO 3,
4HNO3+ ? -> Cu(NO 3) 2 + ? + 2H20.
4. Amonyum klorür NH4Cl çözeltisi ile……. (reaktifin adı) Isıtıldığında amonyak oluşturur, buharları kırmızı turnusol mavisine döner. İLE …… (reaktif anyonun adı) gümüş beyaz peynirli bir çökelti verir...... (tortunun adı).
NH4CI+? = NH4NO3 + AgCl,
NH4CI+? = NH3 + H20 + NaCl.
5. Isıtıldığında, alkali bir çözelti ile amonyum sülfat (NH4)2S04 amonyak oluşturur, buharı kırmızı turnusol mavisine döner. İLE …….. (reaktifin adı) beyaz sütlü bir çökelti verir....... (tortunun adı).
(NH4)2S04 + 2NaOH = 2NH3 + 2H2O + ? ,
(NH4)2S04+? -> NH 4Cl + ? .
6. Sodyum nitrat NaNO 3 veya…… (gübrenin adı) Beyaz kristaller, suda iyi çözünürlük, H2SO4 ve Cu ile kahverengi bir gaz üretir. Alev sarıya döner.
NaNO 3 + H 2 SO 4 NaHSO 4 + ? ,
Cu -> Cu(NO 3) 2 + ? + 2H20.
7. Kalsiyum dihidrojen fosfat Ca(H2PO4)2 veya…… (gübrenin adı), gri ince taneli toz veya granüller, suda az çözünür, ..... (reaktifin adı)….. (renk belirtin) çökelti ……… verir (maddenin adı) AgH2PO4.
Ca(H2PO4)2 + ? -> 2AgH2PO4 + Ca(NO3)2.

Kontrol (test)
1. Suda oldukça çözünür olan pembe kristaller alevi sarıya boyar; AgNO 3 ile etkileşime girdiğinde beyaz bir çökelti oluşur - bu:
a) Ca(H2P04)2; b) NaCl KCl;
c) KNO 3; d) NH4Cl.
2. Kristaller suda oldukça çözünür; H2SO4 ve bakır ile reaksiyona girdiğinde kahverengi bir gaz açığa çıkar; alkali bir çözelti ile ısıtıldığında, buharları kırmızı turnusol mavisine dönüşen amonyak üretir - bu:
a) NaN03; b) (NH4)2S04;
c) NH4NO3; d) BİLİNÇ 3.
3. Suda oldukça çözünür olan hafif kristaller; H2S04 ve Cu ile etkileşime girdiğinde kahverengi gaz açığa çıkar; alev mora döner - bu:
a) KNO 3; b) NH4H2P04;
c) Ca(H2PO4)2CaS04; d) NH4NO3.
4. Kristaller suda oldukça çözünür; gümüş nitrat ile beyaz bir çökelti verir, alkali ile ısıtıldığında buharları kırmızı turnusol mavisine dönüşen amonyak verir - bu:
a) (NH4)2S04; b) NH4H2P04;
c) NaCl KCl; d) NH4Cl.
5. Suda oldukça çözünür olan hafif kristaller; BaCl 2 ile beyaz sütlü bir çökelti verir, alkali ile buharları kırmızı turnusol mavisine dönüşen amonyak verir - bu:
c) NH4Cl; d) NH4H2PO4.
6. Suda oldukça çözünür olan hafif kristaller; H2SO4 ve Cu ile etkileşime girdiğinde kahverengi bir gaz üretir, alev sarıya döner - bu:
a) NH4NO3; b) (NH4)2S04;
c) KNO 3; d) NaNO3.
7. Gri ince taneli toz veya granüller, suda çözünürlüğü zayıftır, gümüş nitrat çözeltisi ile sarı bir çökelti verir - bu:
a) (NH4)2S04; b) NaCl KCl;
c) Ca(H2P04)2; d) BİLİNÇ 3.
| Yanıtlar. 1 -B; 2 -V; 3 -A; 4 -G; 5 -B; 6 -G; 7 -V. |