आवर्त सारणी के समूह IVA की सामान्य विशेषताएँ। समूह IVA के तत्व समूह IIIA, IVA और VA के तत्वों की सामान्य विशेषताएँ
आईवीए समूह में सबसे महत्वपूर्ण तत्व शामिल हैं, जिनके बिना न तो हम होते और न ही वह पृथ्वी जिस पर हम रहते हैं। यह कार्बन सभी जैविक जीवन का आधार है, और सिलिकॉन खनिज साम्राज्य का "सम्राट" है।
यदि कार्बन और सिलिकॉन विशिष्ट गैर-धातु हैं, और टिन और सीसा धातु हैं, तो जर्मेनियम एक मध्यवर्ती स्थान रखता है। कुछ पाठ्यपुस्तकें इसे अधातु के रूप में वर्गीकृत करती हैं, जबकि अन्य इसे धातु के रूप में वर्गीकृत करती हैं। इसका रंग चांदी-सफ़ेद है और धातु जैसा दिखता है, लेकिन इसमें हीरे जैसी क्रिस्टल जाली होती है और यह सिलिकॉन जैसा अर्धचालक होता है।
कार्बन से लेड तक (घटते गैर-धात्विक गुणों के साथ):
डब्ल्यू ऋणात्मक ऑक्सीकरण अवस्था की स्थिरता कम हो जाती है (-4)
डब्ल्यू उच्चतम सकारात्मक ऑक्सीकरण अवस्था की स्थिरता कम हो जाती है (+4)
डब्ल्यू निम्न धनात्मक ऑक्सीकरण अवस्था की स्थिरता बढ़ जाती है (+2)
कार्बन सभी जीवों का मुख्य घटक है। प्रकृति में, कार्बन (हीरा, ग्रेफाइट) और यौगिकों (कार्बन डाइऑक्साइड, विभिन्न कार्बोनेट, मीथेन और प्राकृतिक गैस और तेल में अन्य हाइड्रोकार्बन) द्वारा निर्मित दोनों सरल पदार्थ होते हैं। कठोर कोयले में कार्बन का द्रव्यमान अंश 97% तक पहुँच जाता है।
जमीनी अवस्था में एक कार्बन परमाणु एक विनिमय तंत्र द्वारा दो सहसंयोजक बंधन बना सकता है, लेकिन सामान्य परिस्थितियों में ऐसे यौगिक नहीं बनते हैं। जब एक कार्बन परमाणु उत्तेजित अवस्था में प्रवेश करता है, तो यह सभी चार वैलेंस इलेक्ट्रॉनों का उपयोग करता है।
कार्बन बहुत सारे एलोट्रोपिक संशोधन बनाता है (चित्र 16.2 देखें)। ये हीरा, ग्रेफाइट, कार्बाइन और विभिन्न फुलरीन हैं।
अकार्बनिक पदार्थों में कार्बन की ऑक्सीकरण अवस्था +II और +IV होती है। कार्बन की इन ऑक्सीकरण अवस्थाओं के साथ, दो ऑक्साइड होते हैं।
कार्बन मोनोऑक्साइड (II) एक रंगहीन, गंधहीन, जहरीली गैस है। इसका तुच्छ नाम कार्बन मोनोऑक्साइड है। कार्बन युक्त ईंधन के अधूरे दहन के दौरान बनता है। इसके अणु की इलेक्ट्रॉनिक संरचना के लिए, पृष्ठ 121 देखें। रासायनिक गुणों के अनुसार, CO एक गैर-नमक बनाने वाला ऑक्साइड है; गर्म होने पर, यह कम करने वाले गुण प्रदर्शित करता है (बहुत सक्रिय धातुओं के कई ऑक्साइड को धातु में बदल देता है)।
कार्बन मोनोऑक्साइड (IV) एक रंगहीन, गंधहीन गैस है। इसका तुच्छ नाम कार्बन डाइऑक्साइड है। अम्लीय ऑक्साइड. यह पानी में थोड़ा घुलनशील है (शारीरिक रूप से), इसके साथ आंशिक रूप से प्रतिक्रिया करता है, जिससे कार्बोनिक एसिड H2CO3 बनता है (इस पदार्थ के अणु केवल बहुत पतले जलीय घोल में मौजूद होते हैं)।
कार्बोनिक एसिड एक बहुत कमजोर, डिबासिक एसिड है जो लवणों (कार्बोनेट और बाइकार्बोनेट) की दो श्रृंखला बनाता है। अधिकांश कार्बोनेट पानी में अघुलनशील होते हैं। हाइड्रोकार्बोनेट में से केवल क्षार धातु और अमोनियम हाइड्रोकार्बोनेट ही व्यक्तिगत पदार्थ के रूप में मौजूद हैं। कार्बोनेट आयन और बाइकार्बोनेट आयन दोनों आधार कण हैं, इसलिए जलीय घोल में कार्बोनेट और बाइकार्बोनेट दोनों आयन में हाइड्रोलिसिस से गुजरते हैं।
कार्बोनेट में, सबसे महत्वपूर्ण हैं सोडियम कार्बोनेट Na2CO3 (सोडा, सोडा ऐश, वाशिंग सोडा), सोडियम बाइकार्बोनेट NaHCO3 (बेकिंग सोडा, बेकिंग सोडा), पोटेशियम कार्बोनेट K2CO3 (पोटाश) और कैल्शियम कार्बोनेट CaCO3 (चाक, संगमरमर, चूना पत्थर)।
गैस मिश्रण में कार्बन डाइऑक्साइड की उपस्थिति के लिए गुणात्मक प्रतिक्रिया: चूने के पानी (कैल्शियम हाइड्रॉक्साइड का एक संतृप्त समाधान) के माध्यम से परीक्षण गैस को पारित करने पर कैल्शियम कार्बोनेट अवक्षेप का निर्माण और गैस को आगे पारित करने पर अवक्षेप का विघटन। होने वाली प्रतिक्रियाएं:
Ca2 + 2OH +CO2 = CaCO3 + H2O;
CaCO3 + CO2 + H2O = Ca2 +2HCO3.
औषध विज्ञान और चिकित्सा में, विभिन्न कार्बन यौगिकों का व्यापक रूप से उपयोग किया जाता है - कार्बोनिक एसिड और कार्बोक्जिलिक एसिड के व्युत्पन्न, विभिन्न हेटरोसायकल, पॉलिमर और अन्य यौगिक। इस प्रकार, कार्बोलीन (सक्रिय कार्बन) का उपयोग शरीर से विभिन्न विषाक्त पदार्थों को अवशोषित करने और निकालने के लिए किया जाता है; ग्रेफाइट (मलहम के रूप में) - त्वचा रोगों के उपचार के लिए; रेडियोधर्मी कार्बन आइसोटोप - वैज्ञानिक अनुसंधान (रेडियोकार्बन डेटिंग) के लिए।
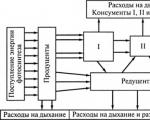
कार्बन सभी कार्बनिक पदार्थों का आधार है। किसी भी जीवित जीव में बड़े पैमाने पर कार्बन होता है। कार्बन जीवन का आधार है। जीवित जीवों के लिए कार्बन का स्रोत आमतौर पर वायुमंडल या पानी से CO2 होता है। प्रकाश संश्लेषण के माध्यम से, यह जैविक खाद्य श्रृंखलाओं में प्रवेश करता है जिसमें जीवित चीजें एक-दूसरे या एक-दूसरे के अवशेषों को खाती हैं और इस तरह अपने शरीर के निर्माण के लिए कार्बन प्राप्त करती हैं। कार्बन का जैविक चक्र या तो ऑक्सीकरण और वायुमंडल में लौटने से, या कोयले या तेल के रूप में दफन होने से समाप्त होता है।
कार्बोनेट आयन CO 3 2 की विश्लेषणात्मक प्रतिक्रियाएँ
कार्बोनेट अस्थिर, बहुत कमजोर कार्बोनिक एसिड एच 2 सीओ 3 के लवण हैं, जो जलीय घोल में मुक्त अवस्था में अस्थिर होते हैं और सीओ 2 की रिहाई के साथ विघटित होते हैं: एच 2 सीओ 3 - सीओ 2 + एच 2 ओ
अमोनियम, सोडियम, रूबिडियम और सीज़ियम कार्बोनेट पानी में घुलनशील हैं। लिथियम कार्बोनेट पानी में थोड़ा घुलनशील है। अन्य धातुओं के कार्बोनेट पानी में थोड़े घुलनशील होते हैं। हाइड्रोकार्बोनेट पानी में घुल जाते हैं। जलीय घोल में कार्बोनेट आयन रंगहीन होते हैं और हाइड्रोलिसिस से गुजरते हैं। क्षार धातु बाइकार्बोनेट के जलीय घोल में फिनोलफथेलिन घोल की एक बूंद डालने पर वे रंगीन नहीं होते हैं, जिससे कार्बोनेट के घोल को बाइकार्बोनेट (फार्माकोपियल परीक्षण) के घोल से अलग करना संभव हो जाता है।
1. बेरियम क्लोराइड के साथ प्रतिक्रिया।
Ba 2+ + CO3 2 - -> BaCO 3 (सफेद महीन-क्रिस्टलीय)
इसी तरह के कार्बोनेट अवक्षेप कैल्शियम (CaCO 3) और स्ट्रोंटियम (SrCO 3) धनायनों द्वारा निर्मित होते हैं। अवक्षेप खनिज अम्ल और एसिटिक अम्ल में घुल जाता है। H2SO4 के घोल में BaSO4 का एक सफेद अवक्षेप बनता है।
HC1 का घोल धीरे-धीरे अवक्षेप में बूंद-बूंद करके डाला जाता है जब तक कि अवक्षेप पूरी तरह से घुल न जाए: BaCO3 + 2 HC1 -> BaCl 2 + CO 2 + H 2 O
2. मैग्नीशियम सल्फेट (फार्माकोपियल) के साथ प्रतिक्रिया।
एमजी 2+ + सीओजेड 2 - ->एमजीसीओ 3 (सफेद)
हाइड्रोकार्बोनेट - HCO 3 आयन - केवल उबलने पर मैग्नीशियम सल्फेट के साथ एक अवक्षेप MgCO 3 बनाता है: Mg 2+ + 2 HCO3- -> MgCO 3 + CO 2 + H 2 O
MgCO3 अवक्षेप अम्ल में घुल जाता है।
3. खनिज एसिड (फार्माकोपियल) के साथ प्रतिक्रिया।
सीओ 3 2- + 2 एच 3 ओ = एच 2 सीओ 3 + 2 एच 2 ओ
एचसीओ 3 - + एच 3 ओ + = एच 2 सीओ 3 + 2 एच 2 ओ
एच 2 सीओ 3 - सीओ 2 + एच 2 ओ
जारी गैसीय CO 2 का पता गैसों, गैस बुलबुले (CO 2) का पता लगाने के लिए एक उपकरण में बैरिटोन या चूने के पानी की मैलापन और रिसीवर टेस्ट ट्यूब में समाधान की मैलापन से लगाया जाता है।
4. यूरेनिल हेक्सासायनोफेरेट (II) के साथ प्रतिक्रिया।
2CO 3 2 - + (UO 2) 2 (भूरा) -> 2 UO 2 CO 3 (रंगहीन) + 4 -
यूरेनिल हेक्सासायनोफेरेट (II) का एक भूरा घोल यूरेनिल एसीटेट (CH 3 COO) 2 UO 2 के घोल को पोटेशियम हेक्सासायनोफेरेट (II) के घोल के साथ मिलाकर तैयार किया जाता है:
2(सीएच 3 एसओओ) 2 जीओ 2 + के 4 -> (यूओ 2) 2 + 4 सीएच 3 एसओओके
परिणामी घोल में Na 2 CO 3 या K 2 CO 3 का एक घोल बूंद-बूंद करके मिलाया जाता है, जब तक कि भूरा रंग गायब न हो जाए।
5. कैल्शियम धनायनों और अमोनिया के साथ अभिक्रिया द्वारा कार्बोनेट आयनों और बाइकार्बोनेट आयनों की अलग-अलग खोज।
यदि घोल में कार्बोनेट-आयन और बाइकार्बोनेट-आयन एक साथ मौजूद हों, तो उनमें से प्रत्येक को अलग से खोला जा सकता है।
ऐसा करने के लिए, पहले विश्लेषण किए गए समाधान में CaCl 2 समाधान की अधिकता जोड़ें। इस मामले में, CO3 2 CaCO 3 के रूप में अवक्षेपित होता है:
CO3 2 - + Ca 2+ = CaCO 3
बाइकार्बोनेट आयन घोल में रहते हैं, क्योंकि पानी में Ca(HCO 3) 2 घोल होता है। अवक्षेप को घोल से अलग किया जाता है और बाद में अमोनिया घोल मिलाया जाता है। HCO 2 - अमोनिया और कैल्शियम धनायन वाले आयन फिर से CaCO 3 का अवक्षेप देते हैं: HCO 3 - + Ca 2+ + NH 3 -> CaCO3 + NH 4 +
6. कार्बोनेट आयन की अन्य अभिक्रियाएँ।
कार्बोनेट आयन, जब आयरन (III) क्लोराइड FeCl 3 के साथ प्रतिक्रिया करते हैं, तो सिल्वर नाइट्रेट के साथ एक भूरा अवक्षेप Fe(OH)CO 3 बनाते हैं - सिल्वर कार्बोनेट Ag 2 CO3 का एक सफेद अवक्षेप, HbTO3 में घुलनशील और पानी में उबालने पर विघटित हो जाता है। गहरा अवक्षेप Ag 2 O ISO 2: Ag 2 CO 3 -> Ag 2 O + CO 2
एसीटेट आयन सीएच 3 सीओओ की विश्लेषणात्मक प्रतिक्रियाएं
एसीटेट - आयन सीएच 3 सीओओ- - कमजोर मोनोबैसिक एसिटिक एसिड सीएच 3 सीओओएच का आयन: जलीय घोल में रंगहीन, हाइड्रोलिसिस से गुजरता है, इसमें रेडॉक्स गुण नहीं होते हैं; यह काफी प्रभावी लिगैंड है और कई धातुओं के धनायनों के साथ स्थिर एसीटेट कॉम्प्लेक्स बनाता है। अम्लीय वातावरण में अल्कोहल के साथ प्रतिक्रिया करने पर यह एस्टर उत्पन्न करता है।
अमोनियम, क्षार और अधिकांश अन्य धातुओं के एसीटेट पानी में अत्यधिक घुलनशील होते हैं। सिल्वर CH 3 COOAg और मरकरी (I) के एसीटेट अन्य धातुओं के एसीटेट की तुलना में पानी में कम घुलनशील होते हैं।
1. आयरन (III) क्लोराइड (फार्माकोपियल) के साथ प्रतिक्रिया।
pH = 5-8 पर, Fe(III) धनायनों के साथ एसीटेट आयन घुलनशील गहरा लाल (मजबूत चाय का रंग) एसीटेट या आयरन (III) ऑक्सीएसीटेट बनाता है।
जलीय घोल में यह आंशिक रूप से जल-अपघटित होता है; खनिज एसिड के साथ घोल का अम्लीकरण हाइड्रोलिसिस को दबा देता है और घोल का लाल रंग गायब हो जाता है।
3 CH3COOH + Fe --> (CH 3 COO) 3 Fe + 3 H +
उबालते समय, मूल लौह (III) एसीटेट का एक लाल-भूरा अवक्षेप घोल से निकलता है:
(सीएच 3 सीओओ) 3 फे + 2 एच 2 ओ<- Fe(OH) 2 CH 3 COO + 2 СН 3 СООН
लौह (III) और एसीटेट आयनों की सांद्रता के अनुपात के आधार पर, तलछट की संरचना बदल सकती है और उदाहरण के लिए, सूत्रों के अनुरूप हो सकती है: Fe OH (CH 3 COO) 2, Fe 3 (OH) 2 O 3 (CH 3 COO), Fe 3 O (OH)(CH 3 COO) 6 या Fe 3 (OH) 2 (CH 3 COO) 7.
प्रतिक्रिया आयनों CO 3 2 -, SO 3 "-, PO 4 3 -, 4 द्वारा बाधित होती है, जो लोहे (III) के साथ अवक्षेपण बनाती है, साथ ही SCN- आयन (Fe 3+ धनायनों के साथ लाल संकुल देते हैं) , आयोडाइड - आयन जी, आयोडीन 1 2 में ऑक्सीकृत हो जाता है, जिससे घोल का रंग पीला हो जाता है।
2. सल्फ्यूरिक अम्ल के साथ अभिक्रिया।
अत्यधिक अम्लीय वातावरण में एसीटेट आयन कमजोर एसिटिक एसिड में बदल जाता है, जिसके वाष्प में सिरके की विशिष्ट गंध होती है:
सीएच 3 सीओओ- + एच +<- СН 3 СООН
प्रतिक्रिया आयनों NO 2 \ S 2 -, SO 3 2 -, S 2 O 3 2 - द्वारा बाधित होती है, जो एक केंद्रित H 2 SO4 वातावरण में एक विशिष्ट गंध के साथ गैसीय उत्पाद भी छोड़ते हैं।
3. एसिटिक एथिल ईथर (फार्माकोपियल) के निर्माण की प्रतिक्रिया।
प्रतिक्रिया सल्फ्यूरिक एसिड वातावरण में की जाती है। इथेनॉल के साथ:
सीएच 3 सीओओ- + एच + - सीएच 3 सीओओएच सीएच 3 सीओओएच + सी 2 एच 5 ओएच = सीएच 3 सीओओसी 2 एच 4 + एच 2 ओ
जारी एथिल एसीटेट का पता उसकी विशिष्ट सुखद गंध से लगाया जाता है। सिल्वर लवण इस प्रतिक्रिया को उत्प्रेरित करते हैं, इसलिए इस प्रतिक्रिया को करते समय थोड़ी मात्रा में AgNO 3 जोड़ने की सिफारिश की जाती है।
इसी प्रकार, एमाइल अल्कोहल सी 5 एचसीओएच के साथ प्रतिक्रिया करने पर, एमाइल एसीटेट सीएच 3 एसओओसी 5 नी (-नाशपाती-) भी बनता है, जिसमें एक सुखद गंध होती है। एथिल एसीटेट की विशिष्ट गंध महसूस होती है, जो मिश्रण को धीरे से गर्म करने पर तेज हो जाती है। .
टार्ट्रेट की विश्लेषणात्मक प्रतिक्रियाएँ - POC आयन - CH(OH) - CH(OH) - CONST। टार्ट्रेट आयन कमजोर डिबासिक टार्टरिक एसिड का आयन है:
हो-सीएच-कूह
हो-सीएच-कूह
टार्ट्रेट आयन पानी में अत्यधिक घुलनशील है। जलीय घोल में, टार्ट्रेट आयन रंगहीन होते हैं, हाइड्रोलिसिस से गुजरते हैं, और जटिल गठन के लिए प्रवण होते हैं, जिससे कई धातुओं के धनायनों के साथ स्थिर टार्ट्रेट कॉम्प्लेक्स मिलते हैं। टार्टरिक एसिड लवणों की दो श्रृंखला बनाता है - मध्यम टार्ट्रेट जिसमें दोगुना चार्ज टार्ट्रेट होता है - COCH(OH)CH(OH)COO - आयन, और एसिड टार्ट्रेट - हाइड्रोटाट्रेट जिसमें एकल चार्ज हाइड्रोजन टार्ट्रेट होता है - HOOOCH(OH)CH(OH) सीओओ - आयन. पोटेशियम हाइड्रोजन टार्ट्रेट (-टार्टर-) KNS 4 H 4 O 6 पानी में व्यावहारिक रूप से अघुलनशील है, जिसका उपयोग पोटेशियम धनायनों को खोलने के लिए किया जाता है। औसत कैल्शियम नमक भी पानी में थोड़ा घुलनशील होता है। औसत पोटेशियम नमक K 2 C 4 H 4 O 6 पानी में अत्यधिक घुलनशील है।
I. पोटेशियम क्लोराइड (फार्माकोपियल) के साथ प्रतिक्रिया।
सी 4 एच 4 ओ 6 2 - + के + + एन + -> केएनएस 4 एच 4 ओ 6 1 (सफेद)
2. अम्लीय वातावरण (फार्माकोपियल) में रेसोरिसिनॉल के साथ प्रतिक्रिया।
टार्ट्रेट्स, जब सांद्र सल्फ्यूरिक एसिड में रेसोरिसिनॉल मेटा - सी 6 एच 4 (ओएच) 2 के साथ गर्म किया जाता है, तो चेरी-लाल प्रतिक्रिया उत्पाद बनाते हैं।
14) चांदी के अमोनिया कॉम्प्लेक्स के साथ प्रतिक्रियाएं। धात्विक चांदी का एक काला अवक्षेप बाहर गिरता है।
15) आयरन (II) सल्फेट और हाइड्रोजन पेरोक्साइड के साथ प्रतिक्रिया।
टार्ट्रेट युक्त घोल में FeSO 4 और H 2 O 2 का पतला जलीय घोल मिलाना। झुर्रियों वाले रंग के साथ एक अस्थिर लौह परिसर के निर्माण की ओर ले जाता है। NaOH क्षार समाधान के साथ बाद के उपचार से परिसर का रंग नीला हो जाता है।
ऑक्सालेट आयन सी 2 ओ 4 2 की विश्लेषणात्मक प्रतिक्रियाएं
ऑक्सालेट आयन सी 2 ओ 4 2- मध्यम शक्ति के डिबासिक ऑक्सालिक एसिड एच 2 सी 2 ओ 4 का आयन है, जो पानी में अपेक्षाकृत अच्छी तरह से घुलनशील है। जलीय घोल में ऑक्सालेट आयन रंगहीन, आंशिक रूप से हाइड्रोलाइज्ड, एक मजबूत कम करने वाला एजेंट, एक प्रभावी लिगैंड है - यह कई धातुओं के धनायनों के साथ स्थिर ऑक्सालेट कॉम्प्लेक्स बनाता है। क्षार धातुओं, मैग्नीशियम और अमोनियम के ऑक्सालेट पानी में घुलनशील होते हैं, जबकि अन्य धातुएँ पानी में थोड़ा घुलनशील होते हैं।
1बेरियम क्लोराइड के साथ प्रतिक्रिया बीए 2+ + सी 2 ओ 4 2- = बीएसी 2 ओ 4 (सफेद) अवक्षेप खनिज एसिड और एसिटिक एसिड में (उबलने पर) घुल जाता है। 2. कैल्शियम क्लोराइड (फार्माकोपियल) के साथ प्रतिक्रिया: Ca 2+ + C 2 O 4 2 - = CaC 2 O 4 (सफेद)
अवक्षेप खनिज अम्लों में घुलनशील है, लेकिन एसिटिक अम्ल में अघुलनशील है।
3. सिल्वर नाइट्रेट के साथ अभिक्रिया।
2 Ag + + C 2 O 4 2 - -> Ag2C2O 4 .|.(जमा हुआ) घुलनशीलता परीक्षण। तलछट को 3 भागों में बांटा गया है:
ए)। अवक्षेप वाली पहली परखनली में, अवक्षेप के घुलने तक हिलाते हुए बूंद-बूंद करके HNO 3 का घोल डालें;
बी)। अवक्षेप के साथ दूसरी परखनली में हिलाते हुए बूंद-बूंद करके सांद्र अमोनिया घोल डालें जब तक कि अवक्षेप घुल न जाए; वी). तलछट के साथ तीसरी परखनली में HC1 घोल की 4-5 बूँदें डालें; परखनली में सिल्वर क्लोराइड का एक सफेद अवक्षेप रहता है:
एजी 2 सी 2 ओ 4 + 2 एचसी1 -> 2 एसी1 (सफेद) + एच 2 सी 2 ओ 4
4.पोटेशियम परमैंगनेट के साथ प्रतिक्रिया। अम्लीय वातावरण में KMnO4 के साथ ऑक्सालेट आयन CO2 की रिहाई के साथ ऑक्सीकृत हो जाते हैं; मैंगनीज (VII) से मैंगनीज (II) में कमी के कारण KMpO 4 घोल का रंग फीका पड़ जाता है:
5 सी 2 ओ 4 2 - + 2 एमएनओ 4 " + 16 एच + -> 10 सीओ 2 + 2 एमएन 2+ + 8 एच 2 ओ
KMnO4 का घोल पतला करें। बाद वाला बदरंग हो जाता है; गैस के बुलबुले - CO 2 - का निकलना देखा जाता है।
38 वीए समूह तत्व
आवर्त सारणी के वीए समूह की सामान्य विशेषताएँ।वीए समूह के तत्वों के बाह्य ऊर्जा स्तर के इलेक्ट्रॉनिक विन्यास के रूप में।
आर्सेनिक और एंटीमोनी में अलग-अलग एलोट्रोपिक संशोधन होते हैं: आणविक और धातु क्रिस्टल जाली दोनों के साथ। हालाँकि, धनायनित रूपों (As 3+, Sb 3+) की स्थिरता की तुलना के आधार पर, आर्सेनिक को एक गैर-धातु के रूप में वर्गीकृत किया गया है, और सुरमा को एक धातु के रूप में वर्गीकृत किया गया है।
वीए समूह के तत्वों के लिए ऑक्सीकरण अवस्था स्थिर है
नाइट्रोजन से बिस्मथ तक (गैर-धातु गुणों में कमी के साथ):
डब्ल्यू ऋणात्मक ऑक्सीकरण अवस्था (-3) की स्थिरता कम हो जाती है (एम. हाइड्रोजन यौगिकों के गुण)
डब्ल्यू उच्चतम सकारात्मक ऑक्सीकरण अवस्था की स्थिरता कम हो जाती है (+5)
डब्ल्यू निम्न धनात्मक ऑक्सीकरण अवस्था की स्थिरता बढ़ जाती है (+3)
जानना
- आवर्त सारणी में कार्बन और सिलिकॉन की स्थिति, प्रकृति में घटना और व्यावहारिक अनुप्रयोग;
- कार्बन और सिलिकॉन की परमाणु संरचना, संयोजकता, ऑक्सीकरण अवस्थाएँ;
- सरल पदार्थों के उत्पादन के तरीके और गुण - ग्रेफाइट, हीरा और सिलिकॉन; कार्बन के नए एलोट्रोपिक रूप;
- कार्बन और सिलिकॉन यौगिकों के मुख्य प्रकार;
- जर्मेनियम उपसमूह के तत्वों की विशेषताएं;
करने में सक्षम हों
- सरल पदार्थों कार्बन और सिलिकॉन के उत्पादन के लिए प्रतिक्रिया समीकरण और इन पदार्थों के रासायनिक गुणों को दर्शाने वाली प्रतिक्रियाएं तैयार करना;
- कार्बन समूह में तत्वों के गुणों की तुलना कर सकेंगे;
- कार्बन और सिलिकॉन के व्यावहारिक रूप से महत्वपूर्ण यौगिकों का वर्णन कर सकेंगे;
- प्रतिक्रिया समीकरणों का उपयोग करके गणना करना जिसमें कार्बन और सिलिकॉन शामिल हैं;
अपना
कार्बन, सिलिकॉन और उनके यौगिकों से जुड़ी प्रतिक्रियाओं के पाठ्यक्रम की भविष्यवाणी करने में कौशल।
परमाणुओं की संरचना. प्रकृति में व्यापकता
आवर्त सारणी के समूह IVA में सम परमाणु क्रमांक वाले पाँच तत्व शामिल हैं: कार्बन C, सिलिकॉन Si, जर्मेनियम Ge, टिन Sn और लेड Pb (तालिका 21.1)। प्रकृति में, समूह के सभी तत्व स्थिर समस्थानिकों के मिश्रण होते हैं। कार्बन के दो आइसोगोन हैं - *|C (98.9%) और *§C (1.1%)। इसके अलावा, प्रकृति में रेडियोधर्मी आइसोटोप के निशान हैं "|С с टी टी= 5730 वर्ष. यह पृथ्वी के वायुमंडल में नाइट्रोजन नाभिक के साथ ब्रह्मांडीय विकिरण से न्यूट्रॉन की टक्कर के दौरान लगातार बनता है:
तालिका 21.1
समूह IVA के तत्वों की विशेषताएँ
* बायोजेनिक तत्व.
कार्बन का मुख्य आइसोटोप रसायन विज्ञान और भौतिकी में विशेष महत्व रखता है, क्योंकि यह परमाणु द्रव्यमान इकाई पर आधारित है, अर्थात् { /2 एक परमाणु के द्रव्यमान का भाग 'ICO हाँ)।
प्रकृति में सिलिकॉन के तीन समस्थानिक होते हैं; उनमें से, सबसे आम ^)Si (92.23%) है। जर्मेनियम में पाँच समस्थानिक (j^Ge - 36.5%) होते हैं। टिन - 10 समस्थानिक। रासायनिक तत्वों में यह एक रिकार्ड है। सबसे आम 12 5 जीएसएन (32.59%) है। लेड के चार समस्थानिक होते हैं: 2 §^Pb (1.4%), 2 §|Pb (24.1%), 2 82?b (22.1%) और 2 82?b (52.4%)। सीसे के अंतिम तीन समस्थानिक यूरेनियम और थोरियम के प्राकृतिक रेडियोधर्मी समस्थानिकों के क्षय के अंतिम उत्पाद हैं, और इसलिए पृथ्वी के अस्तित्व के दौरान पृथ्वी की पपड़ी में उनकी सामग्री बढ़ गई है।
पृथ्वी की पपड़ी में प्रचुरता की दृष्टि से कार्बन शीर्ष दस रासायनिक तत्वों में से एक है। यह ग्रेफाइट, कई प्रकार के कोयले, तेल, प्राकृतिक दहनशील गैस, चूना पत्थर संरचनाओं (CaCO e), डोलोमाइट (CaC0 3 -MgC0 3) और अन्य कार्बोनेट के रूप में पाया जाता है। प्राकृतिक हीरा, हालांकि यह उपलब्ध कार्बन का एक नगण्य हिस्सा है, एक सुंदर और सबसे कठोर खनिज के रूप में बेहद मूल्यवान है। लेकिन, निश्चित रूप से, कार्बन का उच्चतम मूल्य इस तथ्य में निहित है कि यह जैव-कार्बनिक पदार्थों का संरचनात्मक आधार है जो सभी जीवित जीवों के शरीर का निर्माण करते हैं। जीवन के अस्तित्व के लिए आवश्यक कई रासायनिक तत्वों में कार्बन को पहला माना जाता है।
सिलिकॉन पृथ्वी की पपड़ी में दूसरा सबसे प्रचुर तत्व है। रेत, मिट्टी और कई चट्टानें जिन्हें आप देखते हैं वे सिलिकॉन खनिजों से बनी हैं। सिलिकॉन ऑक्साइड की क्रिस्टलीय किस्मों को छोड़कर, इसके सभी यौगिक प्राकृतिक हैं सिलिकेट, अर्थात। विभिन्न सिलिकिक एसिड के लवण। ये अम्ल स्वयं व्यक्तिगत पदार्थ के रूप में प्राप्त नहीं किये गये हैं। ऑर्थोसिलिकेट्स में SiOj आयन होते हैं, मेटासिलिकेट्स में पॉलिमर श्रृंखलाएं (Si0 3") होती हैं। अधिकांश सिलिकेट्स सिलिकॉन और ऑक्सीजन परमाणुओं के ढांचे पर बने होते हैं, जिनके बीच किसी भी धातु और कुछ गैर-धातुओं (फ्लोरीन) के परमाणु स्थित हो सकते हैं। खैर -ज्ञात सिलिकॉन खनिजों में क्वार्ट्ज Si0 2, फेल्डस्पार (ऑर्थोक्लेज़ KAlSi 3 0 8), अभ्रक (मस्कोवाइट KAl 3 H 2 Si 3 0 12) शामिल हैं। कुल मिलाकर, 400 से अधिक सिलिकॉन खनिज ज्ञात हैं। आधे से अधिक आभूषण और सजावटी पत्थर सिलिकॉन यौगिक हैं। ऑक्सीजन-सिलिकॉन ढांचा पानी में कम घुलनशीलता वाले सिलिकॉन खनिजों का कारण बनता है। हजारों वर्षों से केवल गर्म भूमिगत झरनों से ही सिलिकॉन यौगिकों की वृद्धि और परतें जमा हो सकती हैं। इस प्रकार की चट्टानों में जैस्पर शामिल है।
कार्बन, सिलिकॉन, टिन और सीसा की खोज के समय के बारे में बात करने की आवश्यकता नहीं है, क्योंकि ये प्राचीन काल से ही सरल पदार्थों या यौगिकों के रूप में जाने जाते रहे हैं। जर्मेनियम की खोज के. विंकलर (जर्मनी) ने 1886 में दुर्लभ खनिज आर्गीरोडाइट में की थी। यह जल्द ही स्पष्ट हो गया कि ऐसे गुणों वाले तत्व के अस्तित्व की भविष्यवाणी डी.आई. मेंडेलीव ने की थी। नये तत्व के नाम पर विवाद उत्पन्न हो गया। विंकलर को लिखे एक पत्र में मेंडेलीव ने नाम का पुरजोर समर्थन किया जर्मेनियम.
समूह IVA तत्वों के सबसे बाहरी भाग पर चार वैलेंस इलेक्ट्रॉन होते हैं एस-और पी-उपस्तर:

परमाणुओं के इलेक्ट्रॉनिक सूत्र:

जमीनी अवस्था में, ये तत्व द्विसंयोजक होते हैं, और उत्तेजित अवस्था में ये चतुष्संयोजक बन जाते हैं:

कार्बन और सिलिकॉन द्विसंयोजक अवस्था में बहुत कम रासायनिक यौगिक बनाते हैं; लगभग सभी स्थिर यौगिकों में वे चतुष्संयोजक होते हैं। समूह में आगे बढ़ने पर, जर्मेनियम, टिन और सीसा के लिए द्विसंयोजक अवस्था की स्थिरता बढ़ जाती है और चतुष्कोणीय अवस्था की स्थिरता कम हो जाती है। इसलिए, सीसा (1यू) यौगिक मजबूत ऑक्सीकरण एजेंटों के रूप में व्यवहार करते हैं। यह पैटर्न वीए समूह में भी स्पष्ट है। कार्बन और समूह के अन्य तत्वों के बीच एक महत्वपूर्ण अंतर संकरण की तीन अलग-अलग अवस्थाओं में रासायनिक बंधन बनाने की क्षमता है - एसपी, एसपी 2और sp3.सिलिकॉन में व्यावहारिक रूप से केवल एक संकर अवस्था बची है sp3.कार्बन और सिलिकॉन यौगिकों के गुणों की तुलना करने पर यह स्पष्ट रूप से स्पष्ट होता है। उदाहरण के लिए, कार्बन मोनोऑक्साइड C0 2 एक गैस (कार्बन डाइऑक्साइड) है, और सिलिकॉन ऑक्साइड Si0 2 एक दुर्दम्य पदार्थ (क्वार्ट्ज) है। पहला पदार्थ गैसीय है क्योंकि कब? एसपी-कार्बन संकरण, सभी सहसंयोजक बंधन C0 2 अणु में बंद हो जाते हैं:
अणुओं के बीच आकर्षण कमजोर होता है, और यह पदार्थ की स्थिति को निर्धारित करता है। सिलिकॉन ऑक्साइड में, सिलिकॉन के चार हाइब्रिड 5पी 3 ऑर्बिटल्स को दो ऑक्सीजन परमाणुओं पर बंद नहीं किया जा सकता है। एक सिलिकॉन परमाणु चार ऑक्सीजन परमाणुओं के साथ बंधता है, जिनमें से प्रत्येक दूसरे सिलिकॉन परमाणु के साथ बंधता है। परिणाम एक फ्रेम संरचना है जिसमें सभी परमाणुओं के बीच बंधन की समान ताकत होती है (आरेख देखें, खंड 1, पृष्ठ 40)।
समान संकरण वाले कार्बन और सिलिकॉन के यौगिक, उदाहरण के लिए मीथेन सीएच 4 और सिलेन सीएच 4, संरचना और भौतिक गुणों में समान हैं। दोनों पदार्थ गैस हैं।
वीए समूह के तत्वों की तुलना में आईवीए तत्वों की इलेक्ट्रोनगेटिविटी कम हो जाती है, और यह विशेष रूप से दूसरे और तीसरे आवर्त के तत्वों में ध्यान देने योग्य है। IVA समूह में तत्वों की धात्विकता VA समूह की तुलना में अधिक स्पष्ट है। कार्बन, ग्रेफाइट के रूप में, एक सुचालक है। सिलिकॉन और जर्मेनियम अर्धचालक हैं, जबकि टिन और सीसा वास्तविक धातु हैं।
16.1. IIIA, IVA और VA समूहों के तत्वों की सामान्य विशेषताएँ
बी |
सी |
एन |
अल अल्युमीनियम |
सी |
पी |
गा |
जीई जर्मेनियम |
जैसा |
में |
एस.एन. |
एस.बी |
टी एल |
पंजाब |
द्वि |
तत्वों की प्राकृतिक प्रणाली के इन तीन समूहों की संरचना चित्र 16.1 में दिखाई गई है। परमाणुओं की कक्षीय त्रिज्या के मान (एंगस्ट्रॉम में) भी यहां दिए गए हैं। यह इन समूहों में है कि धातु बनाने वाले तत्वों (कक्षीय त्रिज्या 1.1 एंगस्ट्रॉम से अधिक) और अधातु बनाने वाले तत्वों (कक्षीय त्रिज्या 1.1 एंगस्ट्रॉम से कम) के बीच की सीमा सबसे स्पष्ट रूप से दिखाई देती है। चित्र में इस सीमा को दोहरी रेखा द्वारा दर्शाया गया है। हमें यह नहीं भूलना चाहिए कि यह सीमा अभी भी मनमानी है: एल्यूमीनियम, गैलियम, टिन, सीसा और सुरमा निश्चित रूप से उभयचर धातुएं हैं, लेकिन बोरान, जर्मेनियम और आर्सेनिक भी उभयचरता के कुछ लक्षण दिखाते हैं।
इन तीन समूहों के तत्वों के परमाणुओं में से, निम्नलिखित सबसे अधिक बार पृथ्वी की पपड़ी में पाए जाते हैं: Si (w = 25.8%), Al (w = 7.57%), P (w = 0.090%), C (w = 0.087%) और एन (डब्ल्यू = 0.030%)। ये वे हैं जिनसे आप इस अध्याय में मिलेंगे।
समूह IIIA तत्वों के परमाणुओं के सामान्य संयोजकता इलेक्ट्रॉनिक सूत्र - एन एस 2 एन.पी. 1, आईवीए समूह - एन एस 2 एन.पी. 2, वीए समूह - एन एस 2 एन.पी. 3. उच्चतम ऑक्सीकरण अवस्थाएँ समूह संख्या के बराबर होती हैं। इंटरमीडिएट वाले 2 कम हैं.
इन तत्वों के परमाणुओं से बनने वाले सभी सरल पदार्थ (नाइट्रोजन को छोड़कर) ठोस होते हैं। कई तत्वों की विशेषता एलोट्रॉपी (बी, सी, एसएन, पी, एएस) है। केवल तीन स्थिर आणविक पदार्थ हैं: नाइट्रोजन एन2, सफेद फास्फोरस पी4 और पीला आर्सेनिक एएस4।
इन तीन समूहों के अधात्विक तत्व सहसंयोजक बंधों के साथ आणविक हाइड्रोजन यौगिक बनाते हैं। इसके अलावा, कार्बन में इतने सारे हैं कि हाइड्रोकार्बन और उनके डेरिवेटिव का अध्ययन एक अलग विज्ञान - कार्बनिक रसायन विज्ञान द्वारा किया जाता है। इन तत्वों में हाइड्रोजन यौगिकों की दूसरी सबसे बड़ी संख्या बोरान है। बोरोहाइड्राइड्स (बोरेन) संरचना में बहुत अधिक और जटिल हैं, इसलिए बोरोहाइड्राइड्स का रसायन भी रसायन विज्ञान की एक अलग शाखा बन गया है। सिलिकॉन केवल 8 हाइड्रोजन यौगिक (सिलेन), नाइट्रोजन और फॉस्फोरस - दो-दो, बाकी - एक-एक हाइड्रोजन यौगिक बनाता है। सरलतम हाइड्रोजन यौगिकों के आणविक सूत्र और उनके नाम:
उच्च ऑक्साइड की संरचना समूह संख्या के बराबर उच्चतम ऑक्सीकरण अवस्था से मेल खाती है। प्रत्येक समूह में उच्च ऑक्साइड का प्रकार धीरे-धीरे बढ़ते परमाणु क्रमांक के साथ अम्लीय से उभयधर्मी या क्षारीय में बदलता है।
हाइड्रॉक्साइड्स का एसिड-बेस चरित्र बहुत विविध है। तो, HNO 3 एक प्रबल अम्ल है, और TlOH एक क्षार है।
1. समूह IIIA, IVA और VA के तत्वों के परमाणुओं के संक्षिप्त इलेक्ट्रॉनिक सूत्र और ऊर्जा आरेख बनाएं। बाहरी और संयोजकता इलेक्ट्रॉनों को इंगित करें।
नाइट्रोजन परमाणु में तीन अयुग्मित इलेक्ट्रॉन होते हैं, इसलिए विनिमय तंत्र द्वारा यह तीन सहसंयोजक बंधन बना सकता है। यह दाता-स्वीकर्ता तंत्र द्वारा एक और सहसंयोजक बंधन बना सकता है, जिसमें नाइट्रोजन परमाणु +1 का सकारात्मक औपचारिक चार्ज प्राप्त करता है इ. इस प्रकार, अधिकतम नाइट्रोजन पेंटावैलेंट है, लेकिन इसकी अधिकतम सहसंयोजकता चार है। (यह अक्सर सामने आने वाले कथन को स्पष्ट करता है कि नाइट्रोजन पेंटावैलेंट नहीं हो सकती)
पृथ्वी का लगभग सारा नाइट्रोजन हमारे ग्रह के वायुमंडल में पाया जाता है। नाइट्रोजन का एक काफी छोटा हिस्सा नाइट्रेट के रूप में स्थलमंडल में मौजूद है। नाइट्रोजन सभी जीवों और उनके अपघटन उत्पादों में निहित कार्बनिक यौगिकों का हिस्सा है।
नाइट्रोजन ही बनता है सरलमोलेकुलर पदार्थअणु में एक द्विपरमाणुक त्रिबंध के साथ एन 2 (चित्र 16.2)। इस बंधन की ऊर्जा 945 kJ/mol है, जो अन्य बंधन ऊर्जाओं के मूल्यों से अधिक है (तालिका 21 देखें)। यह सामान्य तापमान पर नाइट्रोजन की जड़ता की व्याख्या करता है। अपनी भौतिक विशेषताओं के अनुसार, नाइट्रोजन एक रंगहीन, गंधहीन गैस है, जो हमें जन्म से ही परिचित है (पृथ्वी के वायुमंडल का तीन-चौथाई भाग नाइट्रोजन से बना है)। नाइट्रोजन पानी में थोड़ा घुलनशील है।

नाइट्रोजन दो रूप बनाती है हाइड्रोजन यौगिक: अमोनिया NH 3 और हाइड्राज़ीन N 2 H 6:

अमोनिया एक रंगहीन गैस है जिसमें तीखी, दम घुटने वाली गंध होती है। सांद्रित अमोनिया वाष्प को लापरवाही से अंदर लेने से ऐंठन और घुटन हो सकती है। अमोनिया पानी में बहुत घुलनशील है, जिसे प्रत्येक अमोनिया अणु द्वारा पानी के अणुओं के साथ चार हाइड्रोजन बांड के गठन द्वारा समझाया गया है।

अमोनिया अणु एक आधार कण है (परिशिष्ट 14 देखें)। प्रोटॉन ग्रहण करने पर यह अमोनियम आयन में बदल जाता है। प्रतिक्रिया जलीय घोल और गैस चरण दोनों में हो सकती है:
एनएच 3 + एच 2 ओ एनएच 4 + ओएच (समाधान में);
एनएच 3 + एच 3 ओ बी = एनएच 4 + एच 2 ओ (समाधान में);
एनएच 3जी + एचसीएल जी = एनएच 4 सीएल करोड़ (गैस चरण में)।
अमोनिया के जलीय घोल इतने क्षारीय होते हैं कि अघुलनशील हाइड्रॉक्साइड को अवक्षेपित कर सकें, लेकिन इतने क्षारीय नहीं होते कि एम्फोटेरिक हाइड्रॉक्साइड उनमें घुलकर हाइड्रॉक्सो कॉम्प्लेक्स बना सकें। इसलिए, एम्फोटेरिक हाइड्रॉक्साइड की तैयारी के लिए अमोनिया समाधान का उपयोग करना सुविधाजनक है पी-तत्व: अल(ओएच) 3, बीई(ओएच) 2, पीबी(ओएच) 2, आदि, उदाहरण के लिए:
पीबी 2 + 2एनएच 3 + 2एच 2 ओ = पीबी(ओएच) 2 + 2एनएच 4।
हवा में प्रज्वलित होने पर, अमोनिया जलकर नाइट्रोजन और पानी बनाता है; उत्प्रेरक (पीटी) की उपस्थिति में ऑक्सीजन के साथ बातचीत करते समय, यह नाइट्रोजन मोनोऑक्साइड में विपरीत रूप से ऑक्सीकृत हो जाता है:
4NH 3 + 3O 2 = 2N 2 + 6H 2 O (उत्प्रेरक के बिना),
4NH 3 + 5O 2 4NO + 6H 2 O (उत्प्रेरक के साथ)।
गर्म होने पर, अमोनिया बहुत सक्रिय धातुओं के ऑक्साइड को कम कर सकता है, उदाहरण के लिए, तांबा:
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O
अमोनियम लवण अपने गुणों में (थर्मल स्थिरता को छोड़कर) क्षार धातु लवण के समान होते हैं। उत्तरार्द्ध की तरह, उनमें से लगभग सभी पानी में घुलनशील हैं, लेकिन, चूंकि अमोनियम आयन एक कमजोर एसिड है, इसलिए वे धनायन पर हाइड्रोलाइज्ड हो जाते हैं। गर्म करने पर अमोनियम लवण विघटित हो जाते हैं:
एनएच 4 सीएल = एनएच 3 + एचसीएल;
(एनएच 4) 2 एसओ 4 = एनएच 4 एचएसओ 4 + एनएच 3;
(एनएच 4) 2 सीओ 3 = 2एनएच 3 + सीओ 2 + एच 2 ओ;
एनएच 4 एचएस = एनएच 3 + एच 2 एस;
NH 4 NO 3 = N 2 O + 2H 2 O;
NH 4 NO 2 = N 2 + 2H 2 O;
(एनएच 4) 2 एचपीओ 4 = एनएच 3 + (एनएच 4)एच 2 पीओ 4;
(एनएच 4)एच 2 पीओ 4 = एनएच 4 पीओ 3 + एच 2 ओ।
विभिन्न ऑक्सीकरण अवस्थाओं में नाइट्रोजन पाँच बनती है आक्साइड: एन 2 ओ, एनओ, एन 2 ओ 3, एन 2 ओ 2 और एन 2 ओ 5।
उनमें से सबसे स्थिर नाइट्रोजन डाइऑक्साइड है। यह एक अप्रिय गंध वाली भूरे रंग की जहरीली गैस है। पानी के साथ प्रतिक्रिया करता है:
2NO 2 + H 2 O = HNO 2 + HNO 3.
क्षार समाधान के साथ, प्रतिक्रिया नाइट्रेट और नाइट्राइट के गठन के साथ होती है।
N 2 O और NO गैर-नमक बनाने वाले ऑक्साइड हैं।
एन 2 ओ 3 और एन 2 ओ 5 अम्लीय ऑक्साइड हैं। पानी के साथ प्रतिक्रिया करके, वे क्रमशः नाइट्रस और नाइट्रिक एसिड के घोल बनाते हैं।
ऑक्सीकरण अवस्था +III में नाइट्रोजन ऑक्सोएसिड नाइट्रस एसिड HNO2 है। यह एक कमजोर अम्ल है जिसके अणु केवल जलीय घोल में मौजूद होते हैं। इसके लवण नाइट्राइट हैं। नाइट्रस एसिड और नाइट्राइट में नाइट्रोजन आसानी से +V ऑक्सीकरण अवस्था में ऑक्सीकृत हो जाता है।
नाइट्रस एसिड के विपरीत, नाइट्रिक एसिड HNO 3 एक मजबूत एसिड है। इसके अणु की संरचना को दो प्रकार से व्यक्त किया जा सकता है:
नाइट्रिक एसिड सभी तरह से पानी के साथ मिश्रित होता है, तनु घोल में इसके साथ पूरी तरह से प्रतिक्रिया करता है:
HNO3 + H2O = H3O + NO3
नाइट्रिक एसिड और उसके घोल मजबूत ऑक्सीकरण एजेंट हैं। जब नाइट्रिक एसिड पतला होता है, तो इसकी ऑक्सीडेटिव गतिविधि कम हो जाती है। किसी भी सांद्रता के नाइट्रिक एसिड के समाधान में, ऑक्सीकरण करने वाले परमाणु मुख्य रूप से नाइट्रोजन परमाणु होते हैं, हाइड्रोजन नहीं। इसलिए, नाइट्रिक एसिड के साथ विभिन्न पदार्थों के ऑक्सीकरण के दौरान, हाइड्रोजन केवल उप-उत्पाद के रूप में निकलता है। एसिड की सांद्रता और अन्य अभिकर्मक की कम करने वाली गतिविधि के आधार पर, प्रतिक्रिया उत्पाद NO 2, NO, N 2 O, N 2 और यहां तक कि NH 4 भी हो सकते हैं। अक्सर गैसों का मिश्रण बनता है, लेकिन सांद्र नाइट्रिक एसिड के मामले में केवल नाइट्रोजन डाइऑक्साइड निकलता है:
Cu + 4HNO 3 = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
3FeS + 30HNO3 = Fe2(SO4)3 + Fe(NO3)3 + 27NO2 + 15H2O
तनु नाइट्रिक एसिड के मामले में, नाइट्रोजन मोनोऑक्साइड सबसे अधिक बार जारी होता है:
Fe + 4HNO 3 = Fe(NO 3) 3 + NO + 2H 2 O
3H 2 S + 2HNO 3 = 2NO + 4H 2 O + 3S
बहुत पतले नाइट्रिक एसिड की एक मजबूत कम करने वाले एजेंट (Mg, Al, Zn) के साथ प्रतिक्रिया करने पर, अमोनियम आयन बनते हैं:
4Mg + 10HNO3 = 4Mg(NO3)2 + NH4NO3 + 3H2O
वे धातुएँ जो सांद्र सल्फ्यूरिक एसिड द्वारा निष्क्रिय हो जाती हैं, वे धातुएँ सांद्र नाइट्रिक एसिड द्वारा भी निष्क्रिय हो जाती हैं।
नाइट्रिक एसिड के लवण - नाइट्रेट - ऊष्मीय रूप से अस्थिर यौगिक हैं। गर्म करने पर वे विघटित हो जाते हैं:
2KNO 3 = 2KNO 2 + O 2 ;
2Zn(NO 3) 2 = 2ZnO + 4NO 2 + O 2;
2AgNO3 = 2Ag + 2NO2 + O2.
1. पैराग्राफ के पाठ में दी गई प्रतिक्रियाओं के लिए वर्णनात्मक समीकरण लिखें।
2. ए) अमोनिया, बी) नाइट्रिक एसिड, सी) जिंक नाइट्रेट के रासायनिक गुणों को दर्शाने वाले प्रतिक्रिया समीकरण बनाएं।
अमोनिया और नाइट्रिक एसिड के रासायनिक गुण।
16.3. फास्फोरस
नाइट्रोजन परमाणु के विपरीत, एटमफास्फोरस एक विनिमय तंत्र द्वारा पांच सहसंयोजक बंधन बना सकता है। इसके लिए पारंपरिक व्याख्या 3 में से किसी एक की उत्तेजना की संभावना पर आधारित है एस-इलेक्ट्रॉन और इसका 3 में संक्रमण डी-उपस्तर.
फास्फोरस तत्व काफी मात्रा में बनता है एलोट्रोपिक संशोधन. इनमें से तीन संशोधन सबसे अधिक स्थिर हैं: सफेद फास्फोरस, लाल फास्फोरस और काला फास्फोरस। सफेद फास्फोरस एक मोमी, जहरीला पदार्थ है जो हवा में स्वतःस्फूर्त रूप से जलने का खतरा रखता है, जिसमें P4 अणु होते हैं। लाल फास्फोरस एक जटिल संरचना वाला गहरे लाल रंग का एक गैर-आणविक, कम सक्रिय पदार्थ है। आमतौर पर, लाल फास्फोरस में हमेशा सफेद रंग का मिश्रण होता है, इसलिए सफेद और लाल फास्फोरस दोनों हमेशा पानी की एक परत के नीचे जमा होते हैं। काला फास्फोरस भी एक जटिल ढाँचा संरचना वाला एक गैर-आणविक पदार्थ है।
श्वेत फास्फोरस के अणु चतुष्फलकीय होते हैं, इनमें फास्फोरस परमाणु त्रिसंयोजी होता है। सफेद फास्फोरस अणु का बॉल-एंड-स्टिक मॉडल और संरचनात्मक सूत्र:
![]()
लाल फास्फोरस की संरचना को संरचनात्मक सूत्र द्वारा व्यक्त किया जा सकता है:

फॉस्फोरस को कैल्शियम फॉस्फेट से रेत और कोक के साथ गर्म करके प्राप्त किया जाता है:
Ca 3 (PO 4) 2 + 3SiO 2 + 5C = 3CaSiO 3 + 2P + 5CO।
फॉस्फोरस की सबसे अधिक विशेषता ऑक्सीकरण अवस्था +V वाले यौगिकों से होती है। अतिरिक्त क्लोरीन के साथ प्रतिक्रिया करने पर फॉस्फोरस पेंटाक्लोराइड बनाता है। फॉस्फोरस के किसी भी एलोट्रोपिक संशोधन के दहन के दौरान अतिरिक्त ऑक्सीजन बनती है ऑक्साइडफॉस्फोरस(वी):
4P + 5O2 = 2P2O5.
फॉस्फोरस (वी) ऑक्साइड के दो संशोधन हैं: गैर-आणविक (सरलतम सूत्र पी 2 ओ 5 के साथ) और आणविक (आणविक सूत्र पी 4 ओ 10 के साथ)। फॉस्फोरस ऑक्साइड आमतौर पर इन पदार्थों का मिश्रण होता है।

यह अत्यंत हीड्रोस्कोपिक अम्लीय ऑक्साइड, पानी के साथ प्रतिक्रिया करके, क्रमिक रूप से मेटाफॉस्फोरिक, डाइफॉस्फोरिक और ऑर्थोफॉस्फोरिक एसिड बनाता है:
पी 2 ओ 5 + एच 2 ओ = 2एचपीओ 3, 2एचपीओ 3 + एच 2 ओ = एच 4 पी 2 ओ 7, एच 4 पी 2 ओ 7 + एच 2 ओ = 2एच 3 पीओ 4।
ऑर्थोफॉस्फोरिक अम्ल(आमतौर पर इसे केवल फॉस्फोरिक कहा जाता है) एक ट्राइबेसिक कमजोर एसिड है (परिशिष्ट 13 देखें)। यह एक रंगहीन क्रिस्टलीय पदार्थ है, जो पानी में बहुत घुलनशील है। मजबूत आधारों के साथ प्रतिक्रिया करते समय, अभिकर्मकों के अनुपात के आधार पर, यह तीन पंक्तियाँ बनाता है लवण(ऑर्थोफॉस्फेट, हाइड्रोऑर्थोफॉस्फेट और डाइहाइड्रोजन ऑर्थोफॉस्फेट - आमतौर पर उनके नाम से उपसर्ग "ऑर्थो" हटा दिया जाता है):
एच 3 पीओ 4 + ओएच = एच 2 पीओ 4 + एच 2 ओ,
एच 3 पीओ 4 + 2ओएच = एचपीओ 4 2 + 2एच 2 ओ,
एच 3 पीओ 4 + 3ओएच = पीओ 4 3 + 3एच 2 ओ।
अधिकांश मध्यम फॉस्फेट (लिथियम के अलावा अन्य क्षारीय तत्वों के लवण को छोड़कर) पानी में अघुलनशील होते हैं। घुलनशील एसिड फॉस्फेट काफी अधिक होते हैं।
फॉस्फोरिक एसिड प्राकृतिक कैल्शियम फॉस्फेट से अतिरिक्त सल्फ्यूरिक एसिड के साथ उपचार करके प्राप्त किया जाता है। कैल्शियम फॉस्फेट और सल्फ्यूरिक एसिड के एक अलग अनुपात के साथ, डाइहाइड्रोजन फॉस्फेट और कैल्शियम सल्फेट का मिश्रण बनता है, जिसका उपयोग कृषि में खनिज उर्वरक के रूप में किया जाता है जिसे "सरल सुपरफॉस्फेट" कहा जाता है:
Ca 3 (PO 4) 2 + 3H 2 SO 4 = 2H 3 PO 4 + 3CaSO 4 ;
Ca 3 (PO 4) 2 + 2H 2 SO 4 = Ca (H 2 PO 4) 2 + 2CaSO 4।
प्रतिक्रिया से अधिक मूल्यवान "डबल सुपरफॉस्फेट" प्राप्त होता है
सीए 3 (पीओ 4) 2 + 4एच 3 पीओ 4 = 3सीए(एच 2 पीओ 4) 3.
इस खनिज उर्वरक का मुख्य पदार्थ कैल्शियम डाइहाइड्रोजन फॉस्फेट है।
1. उन प्रतिक्रियाओं के लिए आणविक समीकरण बनाएं जिनके लिए आयनिक समीकरण पैराग्राफ के पाठ में दिए गए हैं।
2. अनुच्छेद के पाठ में दी गई प्रतिक्रियाओं के समीकरण वर्णनात्मक ढंग से लिखें।
3. ए) फॉस्फोरस, बी) फॉस्फोरस ऑक्साइड (वी), सी) ऑर्थोफोस्फोरिक एसिड, डी) सोडियम डाइहाइड्रोजन फॉस्फेट के रासायनिक गुणों को दर्शाने वाले प्रतिक्रिया समीकरण बनाएं।
फॉस्फोरिक एसिड के रासायनिक गुण।
16.4. कार्बन
कार्बन सभी जीवों का मुख्य घटक है। प्रकृति में, कार्बन (हीरा, ग्रेफाइट) और यौगिकों (कार्बन डाइऑक्साइड, विभिन्न कार्बोनेट, मीथेन और प्राकृतिक गैस और तेल में अन्य हाइड्रोकार्बन) द्वारा निर्मित दोनों सरल पदार्थ होते हैं। कठोर कोयले में कार्बन का द्रव्यमान अंश 97% तक पहुँच जाता है।
एटमजमीनी अवस्था में कार्बन एक विनिमय तंत्र द्वारा दो सहसंयोजक बंधन बना सकता है, लेकिन सामान्य परिस्थितियों में ऐसे यौगिक नहीं बनते हैं। जब एक कार्बन परमाणु उत्तेजित अवस्था में प्रवेश करता है, तो यह सभी चार वैलेंस इलेक्ट्रॉनों का उपयोग करता है।
कार्बन काफी मात्रा में बनता है एलोट्रोपिक संशोधन(चित्र 16.2 देखें)। ये हीरा, ग्रेफाइट, कार्बाइन और विभिन्न फुलरीन हैं।

हीरा एक अत्यंत कठोर, रंगहीन, पारदर्शी क्रिस्टलीय पदार्थ है। हीरे के क्रिस्टल कार्बन परमाणुओं से बने होते हैं एसपी 3-संकरित अवस्था, एक स्थानिक ढाँचा बनाती है।
ग्रेफाइट भूरे-काले रंग का एक नरम क्रिस्टलीय पदार्थ है। ग्रेफाइट क्रिस्टल में सपाट परतें होती हैं जिनमें कार्बन परमाणु स्थित होते हैं एसपी 2-संकर अवस्था और हेक्सागोनल कोशिकाओं के साथ नेटवर्क बनाते हैं।
कार्बाइन रेशेदार संरचना वाला एक रंगहीन पदार्थ है, जिसमें रैखिक अणु होते हैं जिनमें कार्बन परमाणु स्थित होते हैं एसपी-संकर अवस्था (=C=C=C=C= या –C C–C C–)।
फुलरीन सी 60, सी 80, आदि अणुओं के साथ कार्बन के आणविक एलोट्रोपिक संशोधन हैं। इन पदार्थों के अणु खोखले जाल गोले हैं।
कार्बन के सभी संशोधन ऑक्सीकरण वाले की तुलना में अधिक हद तक कम करने वाले गुणों को प्रदर्शित करते हैं, उदाहरण के लिए, कोक (कोयला प्रसंस्करण का एक उत्पाद; इसमें 98% तक कार्बन होता है) का उपयोग ऑक्साइड अयस्कों से लोहा और उनके ऑक्साइड से कई अन्य धातुओं को कम करने के लिए किया जाता है। :
Fe 2 O 3 + 3C = 2Fe + 3CO (उच्च तापमान पर)।
अधिकांश कार्बन यौगिकों का अध्ययन कार्बनिक रसायन विज्ञान में किया जाता है, जिसके बारे में आप 10वीं और 11वीं कक्षा में सीखेंगे।
अकार्बनिक पदार्थों में कार्बन की ऑक्सीकरण अवस्था +II और +IV होती है। कार्बन की इन ऑक्सीकरण अवस्थाओं के साथ, दो हैं ऑक्साइड.
कार्बन मोनोऑक्साइड (II) एक रंगहीन, गंधहीन, जहरीली गैस है। इसका तुच्छ नाम कार्बन मोनोऑक्साइड है। कार्बन युक्त ईंधन के अधूरे दहन के दौरान बनता है। इसके अणु की इलेक्ट्रॉनिक संरचना के लिए, पृष्ठ 121 देखें। रासायनिक गुणों के अनुसार, CO एक गैर-नमक बनाने वाला ऑक्साइड है; गर्म होने पर, यह कम करने वाले गुण प्रदर्शित करता है (बहुत सक्रिय धातुओं के कई ऑक्साइड को धातु में बदल देता है)।
कार्बन मोनोऑक्साइड (IV) एक रंगहीन, गंधहीन गैस है। इसका तुच्छ नाम कार्बन डाइऑक्साइड है। अम्लीय ऑक्साइड. यह पानी में (भौतिक रूप से) थोड़ा घुलनशील है, आंशिक रूप से इसके साथ प्रतिक्रिया करता है, जिससे कोयला बनता है अम्लएच 2 सीओ 3 (इस पदार्थ के अणु केवल बहुत पतले जलीय घोल में मौजूद होते हैं)।
कार्बोनिक एसिड एक बहुत कमजोर एसिड है (परिशिष्ट 13 देखें), डिबासिक, दो पंक्तियाँ बनाता है लवण(कार्बोनेट और बाइकार्बोनेट)। अधिकांश कार्बोनेट पानी में अघुलनशील होते हैं। हाइड्रोकार्बोनेट में से केवल क्षार धातु और अमोनियम हाइड्रोकार्बोनेट ही व्यक्तिगत पदार्थ के रूप में मौजूद हैं। कार्बोनेट आयन और बाइकार्बोनेट आयन दोनों आधार कण हैं, इसलिए जलीय घोल में कार्बोनेट और बाइकार्बोनेट दोनों आयन में हाइड्रोलिसिस से गुजरते हैं।
कार्बोनेट में, सबसे महत्वपूर्ण हैं सोडियम कार्बोनेट Na 2 CO 3 (सोडा, सोडा ऐश, वाशिंग सोडा), सोडियम बाइकार्बोनेट NaHCO 3 (बेकिंग सोडा, बेकिंग सोडा), पोटेशियम कार्बोनेट K 2 CO 3 (पोटाश) और कैल्शियम कार्बोनेट CaCO 3 (चाक, संगमरमर, चूना पत्थर)।
गुणात्मक प्रतिक्रियागैस मिश्रण में कार्बन डाइऑक्साइड की उपस्थिति के लिए: चूने के पानी (कैल्शियम हाइड्रॉक्साइड का एक संतृप्त समाधान) के माध्यम से परीक्षण गैस को पारित करने पर कैल्शियम कार्बोनेट अवक्षेप का निर्माण और गैस को आगे पारित करने पर अवक्षेप का विघटन। होने वाली प्रतिक्रियाएं: सिलिकॉन तत्व एक बनाता है साधारण पदार्थइसी नाम से. यह हीरे की संरचना वाला एक गैर-आणविक पदार्थ है, जिसकी कठोरता में सिलिकॉन थोड़ा सा हीन है। पिछली आधी सदी में, सिलिकॉन हमारी सभ्यता के लिए एक अत्यंत आवश्यक सामग्री बन गया है, क्योंकि इसके एकल क्रिस्टल का उपयोग लगभग सभी इलेक्ट्रॉनिक उपकरणों में किया जाता है।
सिलिकॉन एक काफी निष्क्रिय पदार्थ है. कमरे के तापमान पर यह फ्लोरीन और हाइड्रोजन फ्लोराइड को छोड़कर व्यावहारिक रूप से किसी भी चीज़ के साथ प्रतिक्रिया नहीं करता है:
सी + 2एफ 2 = सीआईएफ 4;
Si + 4HF = SiF 4 + 2H 2.
बारीक पिसे हुए पाउडर के रूप में गर्म करने पर यह ऑक्सीजन में जलता है, जिससे डाइऑक्साइड (SiO2) बनता है। जब क्षार के साथ संलयन होता है या जब क्षार के सांद्र विलयन के साथ उबाला जाता है, तो यह सिलिकेट बनाता है:
Si + 4NaOH = Na 4 SiO 4 + 2H 2;
Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2H 2.
सिलिकॉन मोनोऑक्साइड SiO - गैर-नमक बनाने वाला ऑक्साइड; आसानी से डाइऑक्साइड में ऑक्सीकृत हो जाता है।
सिलिकॉन डाइऑक्साइड SiO2 एक ढांचागत संरचना वाला एक गैर-आणविक पदार्थ है। पानी के साथ प्रतिक्रिया नहीं करता. एसिड ऑक्साइड - जब क्षार के साथ संलयन होता है, तो यह सिलिकेट बनाता है, उदाहरण के लिए:
SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O. एल्युमीनियम पृथ्वी के स्थलमंडल में सिलिकॉन के बाद अगला सबसे प्रचुर तत्व है। अकेले और सिलिकॉन के साथ मिलकर, यह कई खनिज बनाता है: फेल्डस्पार, अभ्रक, कोरन्डम अल 2 ओ 3 और इसकी कीमती किस्में (रंगहीन ल्यूकोसैफायर, क्रोमियम युक्त रूबी, टाइटेनियम युक्त नीलम)।
साधारण पदार्थ एल्युमीनियम एक चांदी-सफ़ेद चमकदार हल्की धातु है। शुद्ध एल्यूमीनियम बहुत नरम होता है, इसे पतली पन्नी में लपेटा जा सकता है और इसमें से तार निकाला जा सकता है। एल्युमीनियम में अच्छी विद्युत चालकता होती है। यह वायुमंडलीय प्रभावों के प्रति प्रतिरोधी है। एल्युमीनियम मिश्रधातुएँ काफी कठोर होती हैं, लेकिन इन्हें अच्छी तरह से संसाधित किया जा सकता है। एल्युमिनियम जहरीला नहीं है. यह सब विभिन्न प्रकार के उद्योगों में एल्यूमीनियम के उपयोग की अनुमति देता है: विमानन, विद्युत, खाद्य उद्योग और निर्माण में। रोजमर्रा की जिंदगी में भी एल्युमीनियम का व्यापक रूप से उपयोग किया जाता है। एल्युमीनियम का उत्पादन इसके यौगिकों के पिघलने के इलेक्ट्रोलिसिस द्वारा किया जाता है।
एल्यूमीनियम की रासायनिक जड़ता इसकी सतह पर एक घने ऑक्साइड फिल्म की उपस्थिति के कारण होती है, जो अभिकर्मक के साथ धातु के संपर्क को रोकती है। जब इस फिल्म को रासायनिक या यंत्रवत् हटा दिया जाता है, तो एल्युमीनियम अत्यधिक सक्रिय हो जाता है। इस प्रकार, ऑक्साइड फिल्म के बिना, एल्यूमीनियम स्वचालित रूप से प्रज्वलित होता है और बिना अतिरिक्त ताप के हवा में जल जाता है।
गर्म करने पर एल्युमीनियम के अपचायक गुण विशेष रूप से स्पष्ट होते हैं। इन परिस्थितियों में, यह ऑक्साइड से कई धातुओं को कम करता है: न केवल लोहा, टाइटेनियम, ज़िरकोनियम, बल्कि कैल्शियम और बेरियम भी।
एल्यूमिनियम ऑक्साइड अल 2 ओ 3 (तुच्छ नाम - एल्यूमिना, कोरंडम) एक गैर-आणविक पदार्थ है, जिसमें बंधन को आयनिक और सहसंयोजक दोनों के रूप में खराब रूप से वर्णित किया गया है। इन मामलों में हमेशा की तरह, यह एक एम्फोटेरिक ऑक्साइड है। यह एल्यूमीनियम हाइड्रॉक्साइड के कैल्सीनेशन द्वारा प्राप्त किया जाता है, जिसमें उभयचर गुण भी होते हैं।
हाइड्रेटेड एल्युमीनियम आयन एक धनायनित अम्ल है, इसलिए घुलनशील एल्युमीनियम लवण काफी अधिक हाइड्रोलाइज्ड होते हैं।
एल्यूमीनियम लवणों में से, सबसे अधिक उपयोग किया जाने वाला पोटेशियम एलम KAl(SO 4) 2·12H 2 O - पोटेशियम एल्यूमीनियम सल्फेट डोडेकाहाइड्रेट है। यह एक गैर-हीड्रोस्कोपिक, पूरी तरह से क्रिस्टलीकरण करने वाला पदार्थ है। इसका घोल दो अलग-अलग सल्फेटों के घोल के मिश्रण के रूप में व्यवहार करता है: पोटेशियम सल्फेट और एल्यूमीनियम सल्फेट। फिटकरी की संरचना को सूत्र द्वारा व्यक्त किया जा सकता है: (एसओ 4) 2।
1. पैराग्राफ के पाठ में दी गई प्रतिक्रियाओं के लिए वर्णनात्मक समीकरण लिखें।
2. ए) एल्युमीनियम, बी) एल्युमीनियम हाइड्रॉक्साइड, आई) पोटेशियम एलम के रासायनिक गुणों को दर्शाने वाले प्रतिक्रिया समीकरण बनाएं।
एल्यूमीनियम लवण के रासायनिक गुण
सार के मुख्य शब्द: कार्बन, सिलिकॉन, आईवीए समूह के तत्व, तत्वों के गुण, हीरा, ग्रेफाइट, कार्बाइन, फुलरीन।
समूह IV के तत्व हैं कार्बन, सिलिकॉन, जर्मेनियम, टिन और सीसा. आइए कार्बन और सिलिकॉन के गुणों पर करीब से नज़र डालें। तालिका इन तत्वों की सबसे महत्वपूर्ण विशेषताओं को दर्शाती है।
इनके लगभग सभी यौगिकों में कार्बन और सिलिकॉन होते हैं चतुष्कोणीय , उनके परमाणु उत्तेजित अवस्था में हैं। जब परमाणु उत्तेजित होता है तो कार्बन परमाणु की संयोजकता परत का विन्यास बदल जाता है:
सिलिकॉन परमाणु की संयोजकता परत का विन्यास इसी प्रकार बदलता है: 
कार्बन और सिलिकॉन परमाणुओं के बाहरी ऊर्जा स्तर में 4 अयुग्मित इलेक्ट्रॉन होते हैं। सिलिकॉन परमाणु की त्रिज्या बड़ी होती है, इसकी संयोजकता परत पर रिक्त स्थान होते हैं। 3 डी-ऑर्बिटल्स, यह सिलिकॉन परमाणुओं को बनाने वाले बांड की प्रकृति में अंतर का कारण बनता है।
कार्बन की ऑक्सीकरण अवस्थाएँ -4 से +4 तक होती हैं।
कार्बन की एक विशिष्ट विशेषता इसकी श्रृंखला बनाने की क्षमता है: कार्बन परमाणु एक दूसरे से जुड़ते हैं और स्थिर यौगिक बनाते हैं। समान सिलिकॉन यौगिक अस्थिर होते हैं। कार्बन की शृंखला बनाने की क्षमता एक बड़ी संख्या के अस्तित्व को निर्धारित करती है कार्बनिक यौगिक .
को अकार्बनिक यौगिक कार्बन में इसके ऑक्साइड, कार्बोनिक एसिड, कार्बोनेट और बाइकार्बोनेट, कार्बाइड शामिल हैं। शेष कार्बन यौगिक कार्बनिक हैं।
कार्बन तत्व की विशेषता है अपररूपता, इसके एलोट्रोपिक संशोधन हैं हीरा, ग्रेफाइट, कार्बाइन, फुलरीन. कार्बन के अन्य एलोट्रोपिक संशोधन अब ज्ञात हैं।
कोयलाऔर कालिखके रूप में देखा जा सकता है बेढबग्रेफाइट की किस्में.
सिलिकॉन एक सरल पदार्थ बनाता है - क्रिस्टलीय सिलिकॉन. अनाकार सिलिकॉन है - एक सफेद पाउडर (अशुद्धियों के बिना)।
हीरा, ग्रेफाइट और क्रिस्टलीय सिलिकॉन के गुण तालिका में दिए गए हैं। 
ग्रेफाइट और हीरे के भौतिक गुणों में स्पष्ट अंतर का कारण अलग-अलग है क्रिस्टल जाली की संरचना . हीरे के क्रिस्टल में, प्रत्येक कार्बन परमाणु (क्रिस्टल की सतह पर मौजूद परमाणुओं को छोड़कर) बनता है चारपड़ोसी कार्बन परमाणुओं के साथ समान मजबूत बंधन। ये बंधन टेट्राहेड्रोन के शीर्षों की ओर निर्देशित होते हैं (जैसा कि सीएच 4 अणु में होता है)। इस प्रकार, हीरे के क्रिस्टल में, प्रत्येक कार्बन परमाणु टेट्राहेड्रोन के शीर्ष पर स्थित चार समान परमाणुओं से घिरा होता है। हीरे के क्रिस्टल में सी-सी बांड की समरूपता और ताकत इसकी असाधारण ताकत और इलेक्ट्रॉनिक चालकता की कमी को निर्धारित करती है।
में ग्रेफाइट क्रिस्टल प्रत्येक कार्बन परमाणु 120° के कोण पर एक ही तल में पड़ोसी कार्बन परमाणुओं के साथ तीन मजबूत, समतुल्य बंधन बनाता है। इस तल में चपटी छः सदस्यीय वलयों से बनी एक परत बनती है।
इसके अलावा, प्रत्येक कार्बन परमाणु में होता है एक अयुग्मित इलेक्ट्रॉन. ये इलेक्ट्रॉन एक सामान्य इलेक्ट्रॉन प्रणाली बनाते हैं। परतों के बीच संबंध अपेक्षाकृत कमजोर अंतर-आणविक बलों के कारण होता है। परतें एक-दूसरे के सापेक्ष इस प्रकार स्थित होती हैं कि एक परत का कार्बन परमाणु दूसरी परत के षट्भुज के केंद्र के ऊपर स्थित होता है। परत के अंदर सी-सी बंधन की लंबाई 0.142 एनएम है, परतों के बीच की दूरी 0.335 एनएम है। परिणामस्वरूप, परतों के बीच के बंधन परत के भीतर परमाणुओं के बीच के बंधन की तुलना में बहुत कमजोर होते हैं। ये तय करता है ग्रेफाइट के गुण: यह मुलायम होता है, आसानी से टूट जाता है, इसका रंग धूसर और धात्विक चमक वाला होता है, यह विद्युत प्रवाहकीय होता है और हीरे की तुलना में अधिक रासायनिक रूप से प्रतिक्रियाशील होता है। हीरे और ग्रेफाइट के क्रिस्टल जाली के मॉडल चित्र में दिखाए गए हैं।

क्या ग्रेफाइट को हीरे में बदलना संभव है? इस प्रक्रिया को कठोर परिस्थितियों में - लगभग 5000 एमपीए के दबाव पर और 1500 डिग्री सेल्सियस से 3000 डिग्री सेल्सियस के तापमान पर उत्प्रेरक (नी) की उपस्थिति में कई घंटों तक किया जा सकता है। उत्पादों का बड़ा हिस्सा छोटे क्रिस्टल (1 से कई मिमी तक) और हीरे की धूल हैं।
कार्बिन- कार्बन का एलोट्रोपिक संशोधन, जिसमें कार्बन परमाणु निम्न प्रकार की रैखिक श्रृंखलाएँ बनाते हैं:
–С≡С–С≡С–С≡С–(α-कार्बाइन, पॉलीनी) या =सी=सी=सी=सी=सी=सी=(बीटा-कार्बाइन, पॉलीन)
मजबूत अंतर-आणविक अंतःक्रियाओं के कारण इन श्रृंखलाओं के बीच की दूरी ग्रेफाइट परतों के बीच की दूरी से कम है।
कार्बाइन एक काला पाउडर है और अर्धचालक है। रासायनिक दृष्टि से यह ग्रेफाइट से अधिक सक्रिय है।
फुलरीन- अणुओं C60, C70 या C84 द्वारा निर्मित कार्बन का एलोट्रोपिक संशोधन। C60 अणु की गोलाकार सतह पर, कार्बन परमाणु 20 नियमित षट्कोण और 12 नियमित पंचकोण के शीर्ष पर स्थित होते हैं। सभी फुलरीन कार्बन परमाणुओं की बंद संरचनाएँ हैं। फुलरीन क्रिस्टल आणविक संरचना वाले पदार्थ हैं।
सिलिकॉन.सिलिकॉन का केवल एक स्थिर एलोट्रोपिक संशोधन है, जिसकी क्रिस्टल जाली हीरे के समान है। सिलिकॉन कठोर, दुर्दम्य है ( टी° pl = 1412 °C), धात्विक चमक के साथ गहरे भूरे रंग का एक बहुत ही नाजुक पदार्थ, मानक परिस्थितियों में यह एक अर्धचालक है।
| तत्व | सी | सी | जीई | एस.एन. | पंजाब |
|---|---|---|---|---|---|
| क्रम संख्या | 6 | 14 | 32 | 50 | 82 |
| परमाणु द्रव्यमान (सापेक्ष) | 12,011 | 28,0855 | 72,59 | 118,69 | 207,2 |
| घनत्व (एन.एस.), जी/सेमी 3 | 2,25 | 2,33 | 5,323 | 7,31 | 11,34 |
| टी पीएल, डिग्री सेल्सियस | 3550 | 1412 | 273 | 231 | 327,5 |
| टी किप, डिग्री सेल्सियस | 4827 | 2355 | 2830 | 2600 | 1749 |
| आयनीकरण ऊर्जा, केजे/मोल | 1085,7 | 786,5 | 762,1 | 708,6 | 715,2 |
| इलेक्ट्रॉनिक सूत्र | 2एस 2 2पी 2 | 3एस 2 3पी 2 | 3डी 10 4एस 2 4पी 2 | 4डी 10 5एस 2 5पी 2 | 4एफ 14 5डी 10 6एस 2 6पी 2 |
| इलेक्ट्रोनगेटिविटी (पॉलिंग के अनुसार) | 2,55 | 1,9 | 2,01 | 1,96 | 2,33 |
उत्कृष्ट गैसों के इलेक्ट्रॉनिक सूत्र:
- वह - 1s 2 ;
- ने - 1s 2 2s 2 2p 6 ;
- एआर - 1s 2 2s 2 2p 6 3s 2 3p 6 ;
- क्र - 3डी 10 4एस 2 4पी 6 ;
- एक्सई - 4डी 10 5एस 2 5पी 6 ;
चावल। कार्बन परमाणु की संरचना.
डी. आई. मेंडेलीव की रासायनिक तत्वों की आवर्त सारणी के समूह 14 (पुराने वर्गीकरण के अनुसार समूह IVa) में 5 तत्व शामिल हैं: कार्बन, सिलिकॉन, जर्मेनियम, टिन, सीसा (ऊपर तालिका देखें)। कार्बन और सिलिकॉन अधातु हैं, जर्मेनियम धात्विक गुण प्रदर्शित करने वाला पदार्थ है, टिन और सीसा विशिष्ट धातुएँ हैं।
पृथ्वी की पपड़ी में सबसे आम समूह 14(IVa) तत्व सिलिकॉन है (ऑक्सीजन के बाद पृथ्वी पर दूसरा सबसे प्रचुर तत्व) (द्रव्यमान के अनुसार 27.6%), इसके बाद: कार्बन (0.1%), सीसा (0.0014%), टिन ( 0.00022%), जर्मेनियम (0.00018%)।
कार्बन के विपरीत, सिलिकॉन प्रकृति में मुक्त रूप में नहीं पाया जाता है; यह केवल बंधे हुए रूप में पाया जा सकता है:
- SiO2 - सिलिका, क्वार्ट्ज (कई चट्टानों, रेत, मिट्टी का हिस्सा) और इसकी किस्मों (एगेट, एमेथिस्ट, रॉक क्रिस्टल, जैस्पर, आदि) के रूप में पाया जाता है;
- सिलिकॉन से भरपूर सिलिकेट्स: टैल्क, एस्बेस्टस;
- एलुमिनोसिलिकेट्स: फेल्डस्पार, अभ्रक, काओलिन।
जर्मेनियम, टिन और सीसा भी प्रकृति में मुक्त रूप में नहीं पाए जाते हैं, लेकिन कुछ खनिजों का हिस्सा हैं:
- जर्मेनियम: (Cu 3 (Fe, Ge)S 4) - जर्मेनियम खनिज;
- टिन: एसएनओ 2 - कैसिटेराइट;
- लीड: पीबीएस - गैलेना; पीबीएसओ 4 - एंगलसाइट; पीबीसीओ 3 - सेरुसाइट।
बाहरी ऊर्जा स्तर पर अउत्तेजित अवस्था में 14(आईवीए) समूह के सभी तत्वों में दो अयुग्मित पी-इलेक्ट्रॉन (वैलेंसी 2, उदाहरण के लिए, सीओ) होते हैं। उत्तेजित अवस्था में संक्रमण करते समय (प्रक्रिया के लिए ऊर्जा की आवश्यकता होती है), बाहरी स्तर का एक युग्मित एस-इलेक्ट्रॉन एक मुक्त पी-ऑर्बिटल पर "कूदता है", इस प्रकार 4 "अकेले" इलेक्ट्रॉन बनते हैं (एक एस-उपस्तर पर और तीन उपस्तर पर) पी-सबलेवल) , जो तत्वों की वैलेंस क्षमताओं का विस्तार करता है (वैलेंस 4 है: उदाहरण के लिए, सीओ 2)।

चावल। कार्बन परमाणु का उत्तेजित अवस्था में संक्रमण.
उपरोक्त कारण से, समूह 14(IVa) के तत्व ऑक्सीकरण अवस्था प्रदर्शित कर सकते हैं: +4; +2; 0; -4.
चूंकि कार्बन से लेड तक की श्रृंखला में एस-उपस्तर से पी-उपस्तर तक एक इलेक्ट्रॉन की "छलांग" के लिए अधिक से अधिक ऊर्जा की आवश्यकता होती है (सीसा परमाणु को उत्तेजित करने की तुलना में कार्बन परमाणु को उत्तेजित करने के लिए बहुत कम ऊर्जा की आवश्यकता होती है), कार्बन "अधिक स्वेच्छा से" उन यौगिकों में प्रवेश करता है जिनमें संयोजकता चार है; और लीड - दो.
ऑक्सीकरण अवस्थाओं के बारे में भी यही कहा जा सकता है: कार्बन से लेड तक की श्रृंखला में, ऑक्सीकरण अवस्था +4 और -4 की अभिव्यक्ति कम हो जाती है, और ऑक्सीकरण अवस्था +2 बढ़ जाती है।
चूंकि कार्बन और सिलिकॉन गैर-धातु हैं, इसलिए वे यौगिक के आधार पर सकारात्मक या नकारात्मक ऑक्सीकरण अवस्था प्रदर्शित कर सकते हैं (अधिक विद्युतीय तत्वों वाले यौगिकों में, सी और सी इलेक्ट्रॉन छोड़ देते हैं, और कम विद्युतीय तत्वों वाले यौगिकों में लाभ प्राप्त करते हैं):
सी +2 ओ, सी +4 ओ 2, सी +4 सीएल 4 सी -4 एच 4, एमजी 2 सी -4
Ge, Sn, Pb, यौगिकों में धातु के रूप में, हमेशा अपने इलेक्ट्रॉन छोड़ते हैं:
जीई +4 सीएल 4, एसएन +4 बीआर 4, पीबी +2 सीएल 2
कार्बन समूह के तत्व निम्नलिखित यौगिक बनाते हैं:
- अस्थिर अस्थिर हाइड्रोजन यौगिक(सामान्य सूत्र ईएच 4), जिसमें से केवल मीथेन सीएच 4 एक स्थिर यौगिक है।
- गैर-नमक बनाने वाले ऑक्साइड- कम ऑक्साइड CO और SiO;
- एसिड ऑक्साइड- उच्च ऑक्साइड CO 2 और SiO 2 - वे हाइड्रॉक्साइड के अनुरूप हैं, जो कमजोर एसिड हैं: H 2 CO 3 (कार्बोनिक एसिड), H 2 SiO 3 (सिलिकिक एसिड);
- उभयधर्मी ऑक्साइड- GeO, SnO, PbO और GeO 2, SnO 2, PbO 2 - बाद वाला जर्मेनियम Ge(OH) 4, स्ट्रोंटियम Sn(OH) 4, लेड Pb(OH) 4 के हाइड्रॉक्साइड्स (IV) के अनुरूप है;