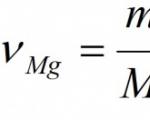화학 방정식을 사용한 계산. 화학 반응식을 이용한 계산 화학 반응식을 이용한 6가지 계산 작업
화학량론- 반응 물질 간의 정량적 관계.
시약이 엄격하게 정의된 양으로 화학적 상호작용을 일으키고 반응 물질의 결과로 그 양을 계산할 수 있는 경우 이러한 반응을 호출합니다. 화학양론적.
화학량론의 법칙:
화합물의 공식이 호출되기 전 화학 방정식의 계수 화학양론적.
화학 반응식을 사용한 모든 계산은 화학양론적 계수의 사용을 기반으로 하며 물질의 양(몰 수)을 찾는 것과 관련됩니다.
반응식에서 물질의 양(몰수) = 해당 분자 앞의 계수입니다.
해당 없음=6.02×10 23몰 -1.
η - 제품의 실제 질량 비율 m p이론적으로 가능한 중 t는 단위의 분수 또는 백분율로 표시됩니다.
반응 생성물의 수율이 조건에 표시되지 않은 경우 계산 시 100%(정량적 수율)로 간주됩니다.
화학 반응 방정식을 사용한 계산 방식:
- 화학 반응의 방정식을 쓰세요.
- 물질의 화학식 위에는 알려진 양과 알려지지 않은 양을 측정 단위와 함께 기재합니다.
- 알려진 물질과 알려지지 않은 물질의 화학식 아래에 반응식에서 찾은 이러한 양의 해당 값을 기록하십시오.
- 비율을 구성하고 해결합니다.
예.마그네슘 24g이 완전 연소될 때 생성되는 산화마그네슘의 질량과 양을 계산하십시오.
|
주어진: 중(마그네슘) = 24g 찾다: ν (MgO) 중 (MgO) |
해결책: 1. 화학 반응에 대한 방정식을 만들어 보겠습니다. 2Mg + O 2 = 2MgO. 2. 물질 공식에서 화학량론적 계수에 해당하는 물질의 양(몰 수)을 나타냅니다. 2Mg + O2 = 2MgO 2몰 2몰 3. 마그네슘의 몰 질량을 결정합니다. 마그네슘의 상대 원자 질량 아르곤(Mg) = 24. 왜냐하면 몰 질량 값은 상대 원자 또는 분자 질량과 같습니다. 엠(Mg)= 24g/몰. 4. 조건에 지정된 물질의 질량을 사용하여 물질의 양을 계산합니다.
5. 산화마그네슘의 화학식 이상 MgO, 그 질량을 알 수 없는 경우, 우리는 엑스두더지, 마그네슘 공식 위 마그네슘우리는 몰 질량을 씁니다: 1몰 엑스두더지 2Mg + O2 = 2MgO 2몰 2몰
비율 해결 규칙에 따르면:
산화마그네슘의 양 ν(MgO)= 1 몰 7. 산화마그네슘의 몰 질량을 계산합니다. 엠(Mg)=24g/몰, 남(O)=16g/몰. M(MgO)= 24 + 16 = 40g/mol. 산화마그네슘의 질량을 계산합니다. m(MgO) = ν(MgO) × M(MgO) = 1mol × 40g/mol = 40g. 답변: ν(MgO) = 1몰; m(MgO) = 40g. |
무엇을 공부하든 당신은
당신은 스스로 공부합니다.
페트로니우스
수업 목표:
- 학생들에게 화학 방정식을 사용하여 문제를 해결하는 기본 방법을 소개합니다.
- 출발 물질의 양, 질량, 부피로부터 반응 생성물의 양, 질량, 부피를 구하고,
- 문제의 텍스트를 다루는 기술, 교육 문제 해결 방법을 합리적으로 선택하는 능력, 화학 반응 방정식을 구성하는 능력을 계속 개발합니다.
- 분석, 비교, 주요 사항 강조, 실행 계획 작성 및 결론 도출 능력을 개발합니다.
- 타인에 대한 관용, 의사결정의 독립성, 업무 결과를 객관적으로 평가하는 능력을 기릅니다.
작업 형태: 정면, 개인, 쌍, 그룹.
수업 유형: ICT 활용과 결합
I 조직적인 순간.
안녕하세요 여러분. 오늘은 화학반응식을 이용하여 문제를 푸는 방법을 배워보겠습니다. 슬라이드 1(프레젠테이션 참조)
수업 목표 슬라이드 2.
II.지식, 기술 및 능력을 업데이트합니다.
화학은 매우 흥미롭고 동시에 복잡한 과학입니다. 화학을 알고 이해하려면 물질을 동화할 뿐만 아니라 습득한 지식을 응용할 수 있어야 합니다. 화학 반응의 발생을 나타내는 표시가 무엇인지 배웠고 화학 반응에 대한 방정식을 작성하는 방법을 배웠습니다. 이 주제를 잘 이해하시고 제 질문에 어려움 없이 답변해 주실 수 있기를 바랍니다.
다음 중 화학적 변형의 징후가 아닌 현상은 무엇입니까?
a) 퇴적물의 출현; c) 부피 변화;
b) 가스 방출; d) 냄새의 출현. 슬라이드 3
숫자로 표시해주세요:
a) 복합 반응 방정식
b) 치환 반응 방정식
c) 분해 반응 방정식 슬라이드 4
문제를 해결하는 방법을 배우려면 행동 알고리즘을 만드는 것이 필요합니다. 행동의 순서를 결정하십시오.
화학 방정식을 이용한 계산 알고리즘(각 학생의 책상에 있음)
5. 답을 적어보세요.
알고리즘을 사용하여 문제 해결을 시작해 보겠습니다.
반응에 참여하는 다른 물질의 알려진 질량으로부터 물질의 질량 계산
분해 결과로 방출되는 산소의 질량을 계산합니다.
9g 무게의 물 부분.
물과 산소의 몰질량을 구해 봅시다:
M(H2O) = 18g/mol
M(O2) = 32g/mol 슬라이드 6
화학 반응 방정식을 작성해 보겠습니다.
2H 2 O = 2H 2 + O 2
반응 방정식의 공식 위에 우리가 찾은 것을 적습니다.
물질의 양과 물질의 공식에 따른 가치 -
화학양론적 비율 표시
화학 방정식
0.5몰×몰
2H 2 O = 2H 2 + O 2
2몰 1몰
질량을 구하려는 물질의 양을 계산해 봅시다.
이를 위해 비율을 만듭니다.
0.5mol = 홉몰
2몰 1몰
여기서 x = 0.25mol 슬라이드 7
따라서 n(O 2) = 0.25 mol
계산해야 하는 물질의 질량을 구합니다.
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0.25 mol 32 g/mol = 8 g
답을 적어보자
답: m(O 2) = 8g 슬라이드 8
반응에 참여하는 다른 물질의 알려진 질량으로부터 물질의 부피 계산
무게 9g의 물 일부가 분해되어 방출되는 산소의 양(no.)을 계산하십시오.

V(0 2)=?l(ns)
M(H2O) = 18g/mol
Vm=22.4l/mol 슬라이드 9
반응식을 적어보자. 계수를 정리해보자
2H 2 O = 2H 2 + O 2
반응식의 공식 위에는 물질 양의 발견된 값을 쓰고, 물질의 공식 아래에는 화학 방정식에 의해 표시되는 화학량론적 비율을 씁니다.
0.5 몰 - x 몰
2H 2 O = 2H 2 + O 2 슬라이드10
2몰 - 1몰
질량을 구하려는 물질의 양을 계산해 봅시다. 이렇게 하려면 비율을 만들어 보겠습니다.
![]()
여기서 x = 0.25mol
계산해야 하는 물질의 부피를 구해 봅시다
V(0 2)=n(0 2) Vm
V(O 2) = 0.25 mol 22.4 l/mol = 5.6 l (no.)
답: 5.6리터 슬라이드 11
III. 연구 자료의 통합.
독립적인 솔루션을 위한 작업:
1. Fe 2 O 3 와 SnO 2 산화물을 석탄으로 환원시키면 Fe와 Sn 20g이 얻어졌다. 각 산화물은 몇 그램씩 채취되었습니까?
2. 어떤 경우에는 더 많은 물이 형성됩니까?
a) 산화구리(I)(Cu 2 O) 10g을 수소로 환원하는 경우 또는
b) 산화구리(II)(CuO) 10g을 수소로 환원할 때? 슬라이드 12
문제 1의 해결 방법을 확인해 보겠습니다.

M(Fe2O3)=160g/mol
M(Fe)=56g/mol, ![]()
m(Fe2O3)=, m(Fe2O3)= 0.18*160=28.6g
답: 28.6g
슬라이드 13
문제 2의 해결 방법을 확인해 보겠습니다.

M(CuO) = 80g/mol
4. ![]()
x 몰 = 0.07 몰,
n(H2O)=0.07mol
m(H 2 O) = 0.07mol*18g/mol = 1.26g
슬라이드 14
CuO + H 2 = Cu + H 2 O
n(CuO) = m/ M(CuO)
n(CuO) = 10g/ 80g/mol = 0.125 mol
0.125mol 홉
CuO + H 2 = Cu + H 2 O
1몰 1몰
![]()
x mol = 0.125 mol, n(H 2 O) = 0.125 mol
m(H2O) = n * M(H2O);
m(H 2 O) = 0.125mol*18g/mol=2.25g
답변: 2.25g 슬라이드 15
숙제: 교과서 자료를 공부하세요 p. 45-47, 문제를 해결해 보세요
산화칼슘의 질량은 얼마이고 이산화탄소의 부피(n.s.)는 얼마입니까?
무게 250g의 탄산칼슘을 분해하면 얻을 수 있나요?
CaCO 3 = CaO + CO 슬라이드 16.
문학
1. 가브리엘리안 O.S. 일반 교육 기관의 8~11학년을 위한 화학 과정 프로그램입니다. M. 버스타드 2006
2. 가브리엘리안 O.S. 화학. 8 학년. 일반 교육 기관용 교과서. 버스타드. 2005년 M.
3. 고르분초바 S.V. 학교 과정의 주요 섹션에 대한 테스트입니다. 8~9학년 VAKO, 모스크바, 2006.
4. Gorkovenko M.Yu 화학 수업 개발. O.S. Gabrielyan, L.S. Guzey, V.V. Sorokin, R.P. Surovtseva 및 G.E. Rudzitis, F.G. Feldman의 교과서. 8학년 VAKO, 모스크바, 2004년.
5. 가브리엘리안 O.S. 화학. 8학년: 시험과 시험. – M.: 버스타드, 2003.
6. Radetsky A.M., Gorshkova V.P. 8-9학년을 위한 화학 교육 자료: 교사를 위한 매뉴얼. – M.: 교육, 2000
애플리케이션.
화학 방정식을 사용한 계산
행동 알고리즘.
화학 계산 문제를 해결하려면 다음 알고리즘을 사용할 수 있습니다. 5단계를 수행하세요.
1. 화학 반응의 방정식을 쓰십시오.
2. 물질 공식 위에는 알려진 양과 알려지지 않은 양을 해당 측정 단위와 함께 기재합니다(순수한 물질, 불순물이 없는 물질에만 해당). 문제의 조건에 따라 불순물을 함유한 물질이 반응에 들어가면 먼저 순수 물질의 함량을 결정해야 합니다.
3. 알려진 물질과 알려지지 않은 물질의 공식 아래에 반응식에서 찾은 이러한 양의 해당 값을 적습니다.
4. 비율을 구성하고 풀어보세요.
5. 답을 적어보세요.
일부 물리화학적 양과 그 단위 사이의 관계
질량(m) : g; 킬로그램; mg
물질의 양(n): 몰; kmol; 밀리몰
몰 질량(M): g/mol; kg/kmol; mg/mmol
부피(V): l; m 3 /kmol; 밀리리터
몰 부피(Vm): l/mol; m 3 /kmol; ml/mmol
입자 수(N): 6 1023(Avagadro 수 – N A); 6 1026 ; 6 1020
이 수업은 "화학 반응 방정식"이라는 주제에 대한 연구를 계속하는 데 전념합니다. 이 수업에서는 반응에 참여하는 물질의 양 비율과 관련된 화학 반응 방정식을 사용하여 가장 간단한 계산을 논의합니다.
주제: 초기 화학 아이디어
강의: 화학 반응 방정식
1. 반응에 참여하는 물질의 양의 비율
반응식의 계수는 각 물질의 분자 수뿐만 아니라 반응에 참여하는 물질의 양에 대한 비율도 나타냅니다. 따라서 반응식: 2H2 + O2 = 2H2O에 따르면 특정 양의 물(예: 2 mol)을 형성하려면 동일한 몰 수의 단순 물질 수소(2 mol)와 절반이 필요하다고 주장할 수 있습니다. 단순 물질 산소의 몰수(1몰)가 필요합니다. 그러한 계산의 예를 들어 보겠습니다.
2. 과제 1
과제 1. 물 4몰이 분해되어 생성된 산소 물질의 양을 구해 보겠습니다.
문제 해결을 위한 알고리즘:
1. 반응식을 적어보세요
2. 반응식과 문제의 조건에 따라 물질의 양을 결정하여 비율을 구성합니다(미지의 물질의 양을 x 몰로 지정).
3. (비율로부터) 방정식을 만드세요.
4. 방정식을 풀고 x를 찾으세요.
쌀. 1. 문제 1에 대한 간략한 조건의 성립 및 해결방법
3. 과제 2과제 2. 구리 3몰을 완전히 태우려면 얼마만큼의 산소가 필요합니까?화학 반응 방정식을 사용하여 문제를 해결하는 알고리즘을 사용해 봅시다.

쌀. 2. 문제 2에 대한 간략한 조건의 공식화 및 해결 방법.
알고리즘을 주의 깊게 연구하고 노트에 적어서 제안된 문제를 직접 해결하세요.
나. 알고리즘을 사용하여 다음 문제를 직접 해결해 보세요.
1. 알루미늄과 0.27mol의 물질과 충분한 양의 산소가 상호작용하여 형성된 산화알루미늄 물질의 양을 계산합니다. (4Al+3O 2 =2Al2O3).
2. 나트륨과 충분한 양의 산소가 있는 2.3몰 양의 물질의 상호작용으로 인해 형성된 산화나트륨 물질의 양을 계산합니다.(4Na+O2=2Na2O).
알고리즘 1번
반응에 관련된 물질의 알려진 양으로부터 물질의 양을 계산합니다.
예. 6 mol의 물질량으로 물이 분해되어 방출되는 산소의 양을 계산하십시오.



II. 알고리즘을 사용하여 다음 문제를 직접 해결해 보세요.
1. 4mol(S + O)의 물질량으로 황산화물(IV)을 얻는 데 필요한 황의 질량을 계산합니다. 2
=SO2).
2. 물질량 0.6 mol(2Li+Cl2 = 2LiCl)의 염화리튬을 얻는 데 필요한 리튬의 질량을 계산하십시오.
알고리즘 2번
반응에 관련된 다른 물질의 알려진 양으로부터 물질의 질량을 계산합니다.
예: 물질 양이 8mol인 산화알루미늄을 얻는 데 필요한 알루미늄의 질량을 계산하십시오.



III. 알고리즘을 사용하여 다음 문제를 직접 해결해 보세요.
1. 12.8g의 황(2Na+S=Na2S)이 나트륨과 반응할 때 황화나트륨의 양을 계산하십시오.
2. 64g 무게의 산화구리(II)가 수소(CuO + H2 = Cu + H2 O)와 반응하면 생성되는 구리 물질의 양을 계산하십시오.
알고리즘을 주의 깊게 연구하고 노트에 적어보세요.
알고리즘 3번
반응에 관련된 다른 물질의 알려진 질량으로부터 물질의 양을 계산합니다.
예. 무게 19.2g의 구리가 산소와 반응할 때 산화구리(I)의 양을 계산하십시오.



알고리즘을 주의 깊게 연구하고 노트에 적어보세요.
IV. 알고리즘을 사용하여 다음 문제를 직접 해결해 보세요.
1. 무게가 112g인 철과 반응하는 데 필요한 산소의 질량을 계산합니다.
(3Fe + 4O2 =Fe3 O4).
알고리즘 4번
반응에 참여하는 다른 물질의 알려진 질량으로부터 물질의 질량 계산
예. 무게가 0.31g인 인을 연소하는 데 필요한 산소의 질량을 계산하십시오.



독립적인 솔루션을 위한 과제
1. 알루미늄과 충분한 양의 산소(4Al + 3O2 = 2Al2O3)가 있는 0.27mol 양의 물질과 상호 작용하여 형성된 산화알루미늄 물질의 양을 계산합니다.
2. 나트륨과 충분한 양의 산소(4Na + O2 = 2Na2 O)가 있는 2.3mol 양의 물질과 상호작용하여 형성된 산화나트륨 물질의 양을 계산합니다.
3. 물질량 4 mol(S+O2 =SO2)의 황산화물(IV)을 얻는 데 필요한 황의 질량을 계산하십시오.
4. 물질량 0.6 mol(2Li+Cl2 = 2LiCl)의 염화리튬을 얻는 데 필요한 리튬의 질량을 계산하십시오.
5. 12.8g의 황(2Na+S=Na2S)이 나트륨과 반응할 때 황화나트륨의 양을 계산하십시오.
6. 무게 64g의 산화구리(II)가 수소(CuO + H2 = Cu + H2 O)와 반응하면 생성되는 구리 물질의 양을 계산하십시오.
수업 과정
시뮬레이터 1번 - 화학 반응식 분석
시뮬레이터 6번 - 화학양론적 계산
수업 요약 “화학 방정식을 사용한 계산”
1. 숙제 확인하기
숙제로 반응 방정식에 계수를 배치하라는 요청을 받았습니다.휴식시간 동안 진행된 작업을 보실 수 있습니다. 분명 실수가 있을 것입니다.모든 일이 잘 진행되었나요? 궁금한 점이 있으신가요?가정에서의 경험에 대해 이야기하게 하십시오.
2. 주제 발표 및 지식 업데이트
오늘 수업의 주제는 화학 방정식을 이용한 계산입니다. 먼저 오늘날 우리에게 유용할 수 있는 모든 것을 기억합시다. 우리는 이미 이전 실험실 작업, 숙제, 그리고 이진 화합물 주제의 초기 부분에서 화학 반응식을 접했습니다. 화학 반응 방정식의 정의를 기억해 봅시다.
(이것은 화학식과 계수를 사용하는 화학반응의 일반적인 표기법입니다.)
놀라운.
화합물을 생산할 때 필요한 반응 생성물 질량을 얻기 위해 얼마나 많은 출발 물질을 섭취해야 하는지 알아야 합니다. 이렇게 하려면 진행 중인 화학 반응에 대한 방정식을 만들고 계산할 때질량은 몰 질량을 고려합니다. 물질, 그리고 계산할 때가스의 양 가치를 고려하다몰 부피가스
정상적인 조건에서 가스의 몰 부피 값을 기억하는 사람은 누구입니까? (22.4리터/몰)
그리고 이러한 정상적인 조건은 무엇입니까? (압력 101.3kPa, 온도 0 o 다)
즉, 이러한 조건에서 모든 가스 1몰은 22.4리터의 부피를 차지합니다.
실제로 문제를 해결하려면 몇 가지 수량을 기억해야 합니다.
몰 질량 - M (g/mol)
물질의 양 – n (mol)
볼륨 - V (l)
이 방법이 더 좋습니다. 몰 질량은 물질의 상대 원자 질량 또는 상대 분자 질량과 수치적으로 동일하다는 것을 기억합니다. 이렇게하려면 각 "셀"의 하단에 상대 원자 질량이 표시되는 주기율표를 사용해야합니다. 반올림 규칙을 잊지 않고 이 질량의 전체 값을 계산에 사용합니다.
화학은 매우 명확하고 논리적이며 일관된 과학이므로 교과서에 나와 있는 알고리즘을 사용하여 문제를 해결하는 것이 편리할 것입니다. 이는 이러한 유형의 문제를 해결하는 데 사용되는 보편적인 일련의 작업입니다.
교과서를 펴고 우리 모두 알고리즘에 대해 알아봅시다.
(여기서 우리는 모두 함께 교과서를 펴고 한 사람, 아마도 나 자신이 알고리즘을 읽고 나머지는 지금 무엇을 해야 하는지 이해하기 위해 따릅니다)
광범위하게 들리지만 너무 혼란스럽지 않기를 바랍니다. 예를 들어 알아 보겠습니다.
작업 1. 수소를 생산하기 위해 알루미늄은 황산(2Al + 3H)에 용해됩니다. 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 (우리 알고리즘의 첫 번째 포인트). 반응을 위해 우리는 10.8g의 알루미늄을 사용했습니다. 소비된 황산의 질량을 계산하십시오.
주어진: m(Al) = 10.8g | 해결책: m=10.8g·m - ? 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 M=27g/mol M=98g/mol 여기서 우리는 실제로 2개의 알루미늄 원자와 3개의 산 분자가 반응에 참여하는 것이 아니라 알루미늄 원자의 일부와 산 분자의 일부가 반응에 참여한다고 언급할 수 있습니다. 화학에서 이 부분을 줄여서 "몰"이라고 합니다. n=2몰 n=3몰 m = M ∙ n m=54g m=294g 비율에 따른 계산: |
||||
m(H2SO4) - ? |
|||||
10.8g | |||||
54g | 294g | ||||
10.8g ∙ 294g | |||||
54g | |||||
엑스 = 58.8g 답: m (H 2 SO 4 ) = 58.8 g |
|||||
이것이 문제에 대한 모든 해결책입니다. 질문이 있으신가요? 해결책에 대해 한 번 더 이야기해 보겠습니다.
방정식을 만들었습니다
물질 위에 우리가 알고 있는 것과 찾고 싶은 것에 서명했습니다.
공식에 따라 우리는 몰 질량, 물질의 양 및화학양론적물질의 질량 ( "주기율표에 따른 질량"을 표시하는 것이 더 좋습니다)
비율로 만들어서
비율을 해결했습니다
답변을 녹음했습니다
유사한 문제를 기체 물질로 해결해 보겠습니다(여기서는 물질의 몰 질량을 사용하지 않지만 무엇을 사용합니까?...몰 부피).
문제 2. 25그램 아연은 염산에 용해되고 화학 반응 중에 가스가 방출됩니다-수소. 방출된 수소의 양을 계산합니다.
주어진: m(Zn) = 10.8g | 해결책: m=25gV - ? Zn + 2HCl → ZnCl 2 + H 2 M=65g/mol Vm=22.4l/mol n=1몰 n=1몰 m=65g V=22.4l 비율에 따른 계산: |
||||
m(HCl) - ? |
|||||
25g | |||||
65g | 22.4리터 | ||||
25g ∙ 22.4l | |||||
65g | |||||
X = 8.61리터 답: V(H 2 ) = 8.61 l |
|||||
자료를 어떻게 마스터했는지 확인해 봅시다. 동일한 알고리즘을 사용하여 문제를 해결합니다.
당신이 성공할 것이라는 것은 사실이 아닙니다:
와 반응할 때 석탄 산화물 Fe2O3(첫 번째 옵션) 및 SnO2(두 번째 옵션)를 사용하여 각각 20g의 Fe 및 Sn을 받았습니다. 각 산화물은 몇 그램씩 채취되었습니까?
지금은 반응 생성물이 아닌 출발 물질의 질량을 계산하고 있다는 점에 유의하세요.)
(모두가 노트북에 문제를 풀고 선택적으로 해결책을 보여달라고 요청하면 방정식을 모두 칠판에 쓰고 모두가 스스로 해결하려고 노력할 것입니다)
Fe2O3 + 3C = 2Fe + 3CO·m(Fe2O3)= 160*20/2*56= 28.5g
SnO2+C=Sn+CO2m(SnO2)= 20*151/119= 25.38g
숙제: 교과서 자료를 공부하세요 p. 146-150, 문제를 해결해 보세요
산화칼슘의 질량은 얼마이고 이산화탄소의 부피(n.s.)는 얼마입니까?
무게 250g의 탄산칼슘을 분해하면 얻을 수 있나요?학교 아이들에게 주어야 합니다준비된 방정식이 작업을 완료하려면
방법론적 수업 개발(2시간)
화학 방정식을 사용한 계산
카푸기나 폴리나 이바노브나,
화학 교사 GBOU 중등 학교 277
상트페테르부르크의 키로프스키 지구
수업 목표: 8학년 학생들에게 화학 방정식을 사용하여 계산하도록 가르칩니다. 출발 물질의 양, 부피 및 질량에서 반응 생성물의 양, 질량 및 부피를 찾습니다.
수업 중:
새로운 주제를 공부하기 전에 이미 알고 있는 양과 공식을 기억해야 합니다. 화학 반응의 유형을 기억하십시오. 그리고 당신은 화학 반응식을 만들고 균등화하는 방법을 이미 알고 있습니다. 다음을 수행하여 지식을 테스트해 보겠습니다. 평가 시험.(테스트 내용은 제 개인 홈페이지의 파일 및 사진 폴더에서 확인하실 수 있습니다)
선생님의 설명:
1. 화학 방정식을 사용하여 계산하는 방법을 배우기 전에 물질의 양, 물질의 질량 및 부피를 찾기 위해 이미 알고 있는 공식을 다시 한 번 기억해야 합니다. 한 단계에서 작업을 수행한 후 자신을 테스트할 수 있습니다. . 이를 위해 우리의 지식을 기억 속에 회복하는 데 도움이 될 다음 프레젠테이션을 살펴보겠습니다. 프레젠테이션 번호 1.
이미 알고 있는 공식을 노트에 적어보세요.
n- 물질의 양 (mol)
m- 물질의 질량 (g)
M - 몰 질량 (g/mol)
V - 가스량(l)
V m - 몰 부피 = 22.4 l/mol
n = m/M; m = n.M
n = V/Vm; V = n.Vm
2. 이제 우리는 화학 반응식은 그 과정의 질적인(물질의 변형) 측면뿐만 아니라 양적인 측면도 보여준다는 것을 이해해야 합니다. 이를 위해 다음을 살펴보겠습니다. 프리젠테이션#2(발표 내용은 내 개인 웹사이트의 파일 및 사진 폴더에서 볼 수 있습니다)
노트에 다음을 적으세요:
반응식의 계수는 입자의 수를 나타내고, 입자의 수에 따라 몰수도 결정됩니다!
2시간₂ + 오₂ = 2시간₂ 에 대한
입자수 2분자 1분자 2분자
수량 ↓ ↓ ↓
물질,N2몰 1몰 2몰
2 철(오)3 = 철2 영형3 + 3 시간2 영형
↓ ↓ ↓
N= 2몰 1몰 3몰
3. 우리가 검토해야 할 다음 단계는 반응식을 이용하여 비율을 생성하고 이를 해결하는 능력입니다. 이를 위해 다음을 살펴보겠습니다. 프레젠테이션 3.(발표 내용은 내 개인 웹사이트의 파일 및 사진 폴더에서 볼 수 있습니다)
노트에 다음을 적으세요:
조건으로 알 수 있음: 2 mol X mol(분자)
4P+5O₂ = 2P₂ 영형₅
방정식으로 알 수 있음: 4 mol 5 mol 2 mol (분모)
비율을 구성하고 해결해 봅시다.
2몰 X 몰
_______ = _______
4몰 2몰
X 몰 = 2몰 2몰= 1몰
4몰
엑스 =N(피₂ 영형₅ )= 1몰
4. 화학 반응 방정식을 사용하여 문제를 해결해 보겠습니다. 화학 계산 문제를 해결하려면 다음 알고리즘을 사용해야 합니다. 다섯 단계를 거쳐야 합니다. 발표 4. (발표 내용은 개인 홈페이지의 파일 및 사진 폴더에서 보실 수 있습니다.) 교과서 101페이지
노트북에서:
학생들에게는 노트북에 붙여 넣을 수 있는 기성 솔루션 알고리즘이 제공됩니다.
화학 반응 방정식을 사용하여 계산 문제를 해결하는 알고리즘:
1. 화학 반응에 대한 방정식을 만듭니다. (즉, 계수를 설정해야 합니다!)
2. 방정식의 해당 공식 위에는 문제의 조건에 따라 알려졌거나 계산할 수 있는 측정 단위가 있는 물질에 대한 정량적 데이터와 측정 단위가 있는 원하는 값 X를 기록합니다.
3. 이 공식 아래에 방정식 자체에 의해 지정된 해당 양적 수량을 측정 단위와 함께 기록하십시오.
4. 비율을 구성하고 풀어보세요.
5. 답변을 공식화하십시오.
5. 문제를 해결해 봅시다.
가열 시 0.5몰의 산화알루미늄과 황산의 상호작용으로 생성되는 물의 질량을 계산하십시오.
문제를 읽어보세요.
문제 설명을 적어보세요. (주어진, 찾아보세요.)
노트북에서: (학생들은 선생님의 설명에 따라 풀이를 적는다. 프레젠테이션 5 ) (발표 내용은 내 개인 웹사이트의 파일 및 사진 폴더에서 볼 수 있습니다)
주어진:
n(Al2O₃)=0.5mol
_________________
찾다:
해결책:
N=0.5몰 X 몰
알₂ 영형₃ +3 시간₂ 그래서₄ = 알₂ (그래서₄ ) ₃ +3 시간₂ 영형
N= 1몰 3몰
M = 102g/몰 18g/몰
분자량 계산:
Мr(Al2O₃)= 2.27+3.16= 54+48=102
MR(H2O)= 2.1+16=18
비율을 구성하고 해결합니다.
0.5몰 = X두더지
1몰 3몰
X 몰 =N(시간₂ 영형) = 0.5몰 3몰= 1.5몰
1몰
물의 질량을 구해보자.
중(시간₂ 영형) = N(시간₂ 영형) . 중(시간₂ 영형)
중(시간₂ 영형) = 1.5몰.18g/몰 = 27g
답변:중(시간₂ 영형)=27g
6. 문제를 스스로 해결하십시오.
평가를 위해 두 명의 학생이 위원회에 호출됩니다.
1. 2Al + 3Cl 2 = 2AlCl 3 방정식에 따라 염화알루미늄 634g을 얻는 데 필요한 염소의 부피(no.)를 결정합니다. 답: 159.6리터
2. 다음 방정식에 따라 128g의 산소와 반응하는 데 필요한 물질의 양과 리튬의 질량을 계산합니다. 4Li + O 2 = 2Li 2 O 답: 16mol, 112g
7. 숙제.
일.
아연 13g이 산소와 상호작용하여 생성되는 산화아연의 질량을 구하십시오.