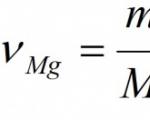Skaičiavimai naudojant chemines lygtis. Skaičiavimai naudojant chemines lygtis. Atlikite 6 skaičiavimus naudojant cheminių reakcijų lygtis
Stechiometrija- kiekybiniai santykiai tarp reaguojančių medžiagų.
Jei reagentai į cheminę sąveiką patenka griežtai apibrėžtais kiekiais ir reakcijos rezultate susidaro medžiagos, kurių kiekį galima apskaičiuoti, tai tokios reakcijos vadinamos stechiometrinis.
Stechiometrijos dėsniai:
Cheminių lygčių koeficientai prieš cheminių junginių formules vadinami stechiometrinis.
Visi skaičiavimai naudojant chemines lygtis yra pagrįsti stechiometrinių koeficientų naudojimu ir yra susiję su medžiagos kiekių (molių skaičiaus) nustatymu.
Medžiagos kiekis reakcijos lygtyje (molių skaičius) = koeficientas prieš atitinkamą molekulę.
N A=6,02×10 23 mol -1.
η - faktinės gaminio masės santykis m p iki teoriškai įmanomo m t, išreikšta vieneto dalimis arba procentais.
Jei būsenoje reakcijos produktų išeiga nenurodyta, tada skaičiavimuose ji laikoma lygi 100% (kiekybinė išeiga).
Skaičiavimo schema naudojant cheminių reakcijų lygtis:
- Parašykite cheminės reakcijos lygtį.
- Virš cheminių medžiagų formulių parašykite žinomus ir nežinomus dydžius su matavimo vienetais.
- Pagal cheminių medžiagų formules su žinomomis ir nežinomomis užrašykite atitinkamas šių dydžių reikšmes, gautas iš reakcijos lygties.
- Sudarykite ir išspręskite proporciją.
Pavyzdys. Apskaičiuokite magnio oksido masę ir kiekį, susidariusį visiškai sudeginus 24 g magnio.
|
Duota: m(Mg) = 24 g Rasti: ν (MgO) m (MgO) |
Sprendimas: 1. Sukurkime cheminės reakcijos lygtį: 2Mg + O 2 = 2MgO. 2. Pagal medžiagų formules nurodome medžiagos kiekį (molių skaičių), atitinkantį stechiometrinius koeficientus: 2Mg + O2 = 2MgO 2 moliai 2 moliai 3. Nustatykite magnio molinę masę: Santykinė magnio atominė masė Ar (Mg) = 24. Nes molinės masės reikšmė lygi santykinei atominei arba molekulinei masei, tada M (Mg)= 24 g/mol. 4. Naudodami sąlygoje nurodytą medžiagos masę, apskaičiuojame medžiagos kiekį:
5. Virš magnio oksido cheminės formulės MgO, kurio masė nežinoma, nustatome xapgamas, viršijant magnio formulę Mg rašome jo molinę masę: 1 molis xapgamas 2Mg + O2 = 2MgO 2 moliai 2 moliai
Pagal proporcijų sprendimo taisykles:
Magnio oksido kiekis ν (MgO)= 1 mol. 7. Apskaičiuokite magnio oksido molinę masę: M (Mg)= 24 g/mol, M(O)=16 g/mol. M (MgO)= 24 + 16 = 40 g/mol. Apskaičiuojame magnio oksido masę: m (MgO) = ν (MgO) × M (MgO) = 1 mol × 40 g/mol = 40 g. Atsakymas: ν (MgO) = 1 mol; m (MgO) = 40 g. |
Kad ir ką studijuoji, tu
mokaisi sau.
Petronius
Pamokos tikslai:
- supažindinti studentus su pagrindiniais problemų sprendimo būdais naudojant chemines lygtis:
- rasti reakcijos produktų kiekį, masę ir tūrį pagal pradinių medžiagų kiekį, masę ar tūrį,
- toliau ugdyti įgūdžius dirbant su uždavinio tekstu, gebėjimą argumentuotai pasirinkti ugdymo problemos sprendimo būdą, gebėjimą sudaryti cheminių reakcijų lygtis.
- ugdyti gebėjimą analizuoti, lyginti, pabrėžti pagrindinį dalyką, sudaryti veiksmų planą ir daryti išvadas.
- ugdyti toleranciją kitiems, savarankiškumą priimant sprendimus ir gebėjimą objektyviai vertinti savo darbo rezultatus.
Darbo formos: frontalinis, individualus, porinis, grupinis.
Pamokos tipas: derinamas su IKT naudojimu
I Organizacinis momentas.
Sveiki bičiuliai. Šiandien mes išmoksime išspręsti problemas naudojant cheminių reakcijų lygtis. 1 skaidrė (žr. pristatymą).
Pamokos tikslai 2 skaidrė.
II.Žinių, įgūdžių ir gebėjimų atnaujinimas.
Chemija yra labai įdomus ir kartu sudėtingas mokslas. Norint išmanyti ir suprasti chemiją, reikia ne tik įsisavinti medžiagą, bet ir mokėti pritaikyti įgytas žinias. Sužinojote, kokie ženklai rodo cheminių reakcijų atsiradimą, išmokote rašyti cheminių reakcijų lygtis. Tikiuosi, kad gerai suprantate šias temas ir be vargo galėsite atsakyti į mano klausimus.
Kuris reiškinys nėra cheminių virsmų požymis:
a) nuosėdų atsiradimas; c) tūrio pokytis;
b) dujų išleidimas; d) kvapo atsiradimas. 3 skaidrė
Nurodykite skaičiais:
a) junginių reakcijų lygtys
b) pakeitimo reakcijų lygtys
c) skilimo reakcijų lygtys 4 skaidrė
Norint išmokti spręsti problemas, reikia susikurti veiksmų algoritmą, t.y. nustatyti veiksmų seką.
Skaičiavimų, naudojant chemines lygtis, algoritmas (ant kiekvieno mokinio stalo)
5. Užsirašykite atsakymą.
Pradėkime spręsti problemas naudodami algoritmą
Medžiagos masės apskaičiavimas pagal žinomą kitos reakcijoje dalyvaujančios medžiagos masę
Apskaičiuokite skilimo metu išsiskyrusio deguonies masę
vandens porcijos, sveriančios 9 g.
Raskime vandens ir deguonies molinę masę:
M(H2O) = 18 g/mol
M(O2) = 32 g/mol 6 skaidrė
Parašykime cheminės reakcijos lygtį:
2H 2 O = 2H 2 + O 2
Virš formulės reakcijos lygtyje rašome tai, ką radome
medžiagos kiekio vertė, o pagal medžiagų formules -
rodomi stechiometriniai santykiai
cheminė lygtis
0,5 mol x mol
2H 2 O = 2H 2 + O 2
2 mol 1 mol
Apskaičiuokime medžiagos kiekį, kurio masę norime rasti.
Norėdami tai padaryti, sukuriame proporciją
0,5 mol = hopmolis
2 mol 1 mol
kur x = 0,25 mol 7 skaidrė
Todėl n(O 2) = 0,25 mol
Raskite medžiagos masę, kurią reikia apskaičiuoti
m(O2)= n(O2)*M(O2)
m(O 2) = 0,25 mol 32 g/mol = 8 g
Užsirašykime atsakymą
Atsakymas: m(O 2) = 8 g 8 skaidrė
Medžiagos tūrio apskaičiavimas pagal žinomą kitos reakcijoje dalyvaujančios medžiagos masę
Apskaičiuokite deguonies tūrį (nr.), išsiskyrusio suskaidžius 9 g sveriančią vandens dalį.

V(0 2)=?l(n.s.)
M(H2O) = 18 g/mol
Vm=22,4l/mol 9 skaidrė
Užrašykime reakcijos lygtį. Sudėkime koeficientus
2H 2 O = 2H 2 + O 2
Virš formulės reakcijos lygtyje rašome rastą medžiagos kiekio reikšmę, o po medžiagų formulėmis - stechiometrinius santykius, rodomus chemine lygtimi.
0,5 mol - x mol
2H 2 O = 2H 2 + O 2 10 skaidrė
2 mol - 1 mol
Apskaičiuokime medžiagos kiekį, kurio masę norime rasti. Norėdami tai padaryti, sukurkime proporciją
![]()
kur x = 0,25 mol
Raskime medžiagos tūrį, kurią reikia apskaičiuoti
V(0 2)=n(0 2) Vm
V(O 2) = 0,25 mol 22,4 l/mol = 5,6 l (ne)
Atsakymas: 5,6 l 11 skaidrė
III Studijos medžiagos konsolidavimas.
Užduotys savarankiškam sprendimui:
1. Oksidus Fe 2 O 3 ir SnO 2 redukuojant anglimi, gauta 20 g Fe ir Sn. Kiek gramų kiekvieno oksido buvo paimta?
2. Tokiu atveju susidaro daugiau vandens:
a) redukuojant 10 g vario (I) oksido (Cu 2 O) vandeniliu arba
b) redukuojant 10 g vario(II) oksido (CuO) vandeniliu? 12 skaidrė
Patikrinkime 1 problemos sprendimą

M(Fe2O3)=160g/mol
M(Fe) = 56 g/mol, ![]()
m(Fe2O3)=, m(Fe2O3)=0,18*160=28,6g
Atsakymas: 28,6g
13 skaidrė
Patikrinkime 2 problemos sprendimą

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mol,
n(H2O)=0,07 mol
m(H2O) = 0,07 mol * 18 g/mol = 1,26 g
14 skaidrė
CuO + H 2 = Cu + H 2 O
n(CuO) = m/M(CuO)
n(CuO) = 10 g / 80 g / mol = 0,125 mol
0,125 molio apynių
CuO + H 2 = Cu + H 2 O
1 mol 1 mol
![]()
x mol = 0,125 mol, n(H2O) = 0,125 mol
m (H2O) = n*M (H2O);
m(H2O) = 0,125 mol * 18 g / mol = 2,25 g
Atsakymas: 2,25g 15 skaidrė
Namų darbas: išstudijuokite vadovėlio medžiagą p. 45-47, išspręskite problemą
Kokia yra kalcio oksido masė ir koks anglies dioksido tūris (n.s.)
galima gauti skaidant kalcio karbonatą, sveriantį 250 g?
CaCO 3 = CaO + CO 16 skaidrė.
Literatūra
1. Gabrielyan O.S. Chemijos kurso programa 8-11 klasėms bendrojo ugdymo įstaigose. M. Bustardas 2006 m
2. Gabrielyan O.S. Chemija. 8 klasė. Vadovėlis bendrojo ugdymo įstaigoms. Bustardas. M. 2005 m
3. Gorbuntsova S.V. Pagrindinių mokyklinio kurso dalių testai. 8 - 9 klasės.VAKO, Maskva, 2006 m.
4. Gorkovenko M.Yu. Chemijos pamokos raida. Į O.S.Gabrijano, L.S.Guzėjaus, V.V.Sorokino, R.P.Surovcevos ir G.E.Rudzičio, F.G.Feldmano vadovėlius. 8 klasė.VAKO, Maskva, 2004 m.
5. Gabrielyan O.S. Chemija. 8 klasė: Testai ir testai. – M.: Bustard, 2003 m.
6. Radetskis A.M., Gorškova V.P. Didaktinė medžiaga apie chemiją 8-9 klasėms: Vadovas mokytojams. – M.: Išsilavinimas, 2000 m
Taikymas.
Skaičiavimai naudojant chemines lygtis
Veiksmų algoritmas.
Norėdami išspręsti chemijos skaičiavimo problemą, galite naudoti šį algoritmą - atlikite penkis veiksmus:
1. Parašykite cheminės reakcijos lygtį.
2. Virš medžiagų formulių surašykite žinomus ir nežinomus dydžius su atitinkamais matavimo vienetais (tik grynoms medžiagoms, be priemaišų). Jei, atsižvelgiant į problemos sąlygas, į reakciją patenka medžiagos, kuriose yra priemaišų, pirmiausia turite nustatyti grynos medžiagos kiekį.
3. Medžiagų su žinomomis ir nežinomomis formulėmis užrašykite atitinkamas šių dydžių reikšmes, gautas iš reakcijos lygties.
4. Sudarykite ir išspręskite proporciją.
5. Užsirašykite atsakymą.
Kai kurių fizikinių ir cheminių dydžių ir jų vienetų ryšys
Masė (m): g; kilogramas; mg
Medžiagų kiekis (n): molis; kmol; mmol
Molinė masė (M): g/mol; kg/kmol; mg/mmol
Tūris (V): l; m 3 /kmol; ml
Molinis tūris (Vm) : l/mol; m 3 /kmol; ml/mmol
Dalelių skaičius (N): 6 1023 (Avagadro skaičius – N A); 6 1026; 6 1020
Pamoka skirta tęsti temos „Cheminės reakcijos lygtis“ studijas. Pamokoje aptariami paprasčiausi skaičiavimai naudojant cheminės reakcijos lygtį, susiję su reakcijoje dalyvaujančių medžiagų kiekių santykiu.
Tema: Pradinės cheminės idėjos
Pamoka: Cheminės reakcijos lygtis
1. Reakcijoje dalyvaujančių medžiagų kiekių santykis
Reakcijos lygtyje esantys koeficientai parodo ne tik kiekvienos medžiagos molekulių skaičių, bet ir reakcijoje dalyvaujančių medžiagų kiekių santykį. Taigi pagal reakcijos lygtį: 2H2 + O2 = 2H2O – galima teigti, kad tam tikram kiekiui vandens (pavyzdžiui, 2 mol) susidaryti tiek pat paprastos medžiagos molių vandenilio (2 mol) ir pusė. kiek reikia molių paprastosios medžiagos deguonies (1 mol) ). Pateiksime tokių skaičiavimų pavyzdžių.
2. 1 užduotis
UŽDUOTIS 1. Nustatykime deguonies medžiagos kiekį, susidariusį suirus 4 moliams vandens.
Problemos sprendimo ALGORITMAS:
1. Užrašykite reakcijos lygtį
2. Sudarykite proporciją nustatydami medžiagų kiekius pagal reakcijos lygtį ir pagal uždavinio sąlygas (nežinomą medžiagos kiekį pažymėkite x moliais).
3. Sudarykite lygtį (iš proporcijos).
4. Išspręskite lygtį, raskite x.
Ryžiai. 1. Trumpos sąlygos formulavimas ir 1 uždavinio sprendimas
3. 2 užduotis2 UŽDUOTIS. Kokio deguonies kiekio reikia norint visiškai sudeginti 3 molius vario?Naudokime uždavinių sprendimo algoritmą, naudodami cheminės reakcijos lygtį.

Ryžiai. 2. Trumpos sąlygos formulavimas ir 2 uždavinio sprendimas.
Atidžiai išstudijuokite algoritmus ir užsirašykite juos į sąsiuvinį, patys spręskite siūlomas problemas
aš. Naudodami algoritmą patys išspręskite šias problemas:
1. Apskaičiuokite aliuminio oksido medžiagos kiekį, susidarantį dėl aliuminio sąveikos su 0,27 mol medžiagos kiekiu su pakankamu deguonies kiekiu. (4Al +3O 2 =2Al2O3).
2. Apskaičiuokite natrio oksido medžiagos kiekį, susidarantį dėl natrio sąveikos su 2,3 mol medžiagos kiekiu su pakankamu deguonies kiekiu.(4Na+O2 =2Na2O).
Algoritmas Nr.1
Medžiagos kiekio apskaičiavimas pagal žinomą reakcijoje dalyvaujančios medžiagos kiekį.
Pavyzdys. Apskaičiuokite deguonies kiekį, išsiskiriantį skaidant vandenį, kai medžiagos kiekis yra 6 mol.



II. Naudodami algoritmą patys išspręskite šias problemas:
1. Apskaičiuokite sieros masę, reikalingą sieros oksidui (IV) gauti su 4 mol medžiagos kiekiu (S + O 2
=SO2).
2. Apskaičiuokite ličio masę, reikalingą ličio chloridui gauti su 0,6 mol medžiagos kiekiu (2Li+Cl2 = 2LiCl).
Algoritmas Nr.2
Medžiagos masės apskaičiavimas pagal žinomą kitos reakcijoje dalyvaujančios medžiagos kiekį.
Pavyzdys: Apskaičiuokite aliuminio masę, reikalingą aliuminio oksidui gauti, kai medžiagos kiekis yra 8 mol.



III. Naudodami algoritmą patys išspręskite šias problemas:
1. Apskaičiuokite natrio sulfido kiekį, jei siera, sverianti 12,8 g (2Na+S=Na2S), reaguoja su natriu.
2. Apskaičiuokite vario medžiagos kiekį, susidarantį, jei vario (II) oksidas, sveriantis 64 g, reaguoja su vandeniliu (CuO + H2 = Cu + H2 O).
Atidžiai išstudijuokite algoritmą ir užsirašykite jį į užrašų knygelę.
Algoritmas Nr.3
Medžiagos kiekio apskaičiavimas pagal žinomą kitos reakcijoje dalyvaujančios medžiagos masę.
Pavyzdys. Apskaičiuokite vario (I) oksido kiekį, jei varis, sveriantis 19,2 g, reaguoja su deguonimi.



Atidžiai išstudijuokite algoritmą ir užsirašykite jį į užrašų knygelę.
IV. Naudodami algoritmą patys išspręskite šias problemas:
1. Apskaičiuokite deguonies masę, reikalingą reaguoti su 112 g sveriančia geležimi
(3Fe + 4O2 =Fe3 O4).
Algoritmas Nr.4
Medžiagos masės apskaičiavimas pagal žinomą kitos reakcijoje dalyvaujančios medžiagos masę
Pavyzdys. Apskaičiuokite deguonies masę, reikalingą fosforo, sveriančio 0,31 g, degimui.



NEPRIKLAUSOMO SPRENDIMO UŽDUOTYS
1. Apskaičiuokite aliuminio oksido medžiagos kiekį, susidarantį dėl aliuminio sąveikos su 0,27 mol medžiagos kiekiu su pakankamu deguonies kiekiu (4Al + 3O2 = 2Al2 O3).
2. Apskaičiuokite natrio oksido medžiagos kiekį, susidarantį natriui sąveikaujant su 2,3 mol medžiagos kiekiu su pakankamu deguonies kiekiu (4Na + O2 = 2Na2 O).
3. Apskaičiuokite sieros masę, reikalingą sieros oksidui (IV) gauti su 4 mol medžiagos kiekiu (S+O2 =SO2).
4. Apskaičiuokite ličio masę, reikalingą ličio chloridui gauti su 0,6 mol medžiagos kiekiu (2Li+Cl2 = 2LiCl).
5. Apskaičiuokite natrio sulfido kiekį, jei siera, sverianti 12,8 g (2Na+S=Na2S), reaguoja su natriu.
6. Apskaičiuokite vario medžiagos kiekį, susidarantį, jei vario (II) oksidas, sveriantis 64 g, reaguoja su vandeniliu (CuO + H2 = Cu + H2 O).
PRATIMAS
Simuliatorius Nr. 1 – cheminės reakcijos lygties analizė
Simuliatorius Nr. 6 – Stechiometriniai skaičiavimai
Pamokos santrauka „Skaičiavimai naudojant chemines lygtis“
1. Namų darbų tikrinimas
Kaip namų darbus jūsų buvo paprašyta reakcijų lygtyse sudėti koeficientus.Pertraukos metu galite pamatyti atliktus darbus. Klaidų tikrai bus.Ar viskas pavyko, ar kas nors turi klausimų?Leiskite jiems kalbėti apie savo namų patirtį.
2. Temos paskelbimas ir žinių papildymas
Šios pamokos tema – skaičiavimai naudojant chemines lygtis. Pirmiausia prisiminkime viską, kas mums šiandien gali būti naudinga. Su cheminėmis lygtimis jau buvome susidūrę ir ankstesniuose laboratoriniuose darbuose, ir namų darbuose, ir dar anksčiau dvejetainių junginių temoje. Prisiminkime cheminės reakcijos lygties apibrėžimą.
(tai yra įprastas cheminės reakcijos žymėjimas naudojant chemines formules ir koeficientus.)
Nuostabu.
Gaminant bet kokius junginius reikia žinoti, kiek pradinės medžiagos reikia paimti, kad gautumėte reikiamą reakcijos produkto masę. Norėdami tai padaryti, sukurkite vykstančios cheminės reakcijos lygtį ir skaičiuodami masėse atsižvelgiama į molines mases medžiagų, ir skaičiuojant dujų tūrių atsižvelgti į vertęmolinis tūris dujų
Kas prisimena dujų molinio tūrio vertę normaliomis sąlygomis? (22,4 l/mol)
O kokios tos normalios sąlygos? (slėgis 101,3 kPa ir temperatūra 0 o C)
Tai reiškia, kad tokiomis sąlygomis 1 molis BET KURIŲ dujų užima 22,4 litro tūrį.
Tiesą sakant, norėdami išspręsti problemas, turime atsiminti keletą dydžių:
Molinė masė – M (g/mol)
Medžiagos kiekis – n (mol)
Tūris – V (l)
Geriau taip: atsiminkite, kad molinė masė yra skaitine prasme lygi santykinei medžiagos atominei masei arba santykinei molekulinei masei. Norėdami tai padaryti, turite naudoti periodinę lentelę, kurioje santykinė atominė masė nurodoma kiekvienos „ląstelės“ apačioje. Nepamiršdami apvalinimo taisyklių, skaičiavimuose naudojame visą šios masės reikšmę.
Chemija yra labai aiškus, logiškas ir nuoseklus mokslas, todėl uždaviniams spręsti bus patogu naudoti ALGORITMĄ, kuris pateiktas vadovėlyje. Tai universali veiksmų seka, naudojama bet kuriai tokio tipo problemai išspręsti.
Atsiverskite vadovėlį ir susipažinkime su algoritmu.
(čia mes visi kartu atsiverčiame vadovėlius, vienas žmogus, galbūt aš, perskaito algoritmą, likusieji seka, kad suprastų, ką dabar turi daryti)
Tai skamba plačiai, bet tikiuosi, kad tai nėra pernelyg painu. Pabandykime tai išsiaiškinti su pavyzdžiu.
1 užduotis. Norint pagaminti vandenilį, aliuminis ištirpinamas sieros rūgštyje: 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 (Pirmasis mūsų algoritmo punktas). Reakcijai paėmėme 10,8 g aliuminio. Apskaičiuokite sunaudotos sieros rūgšties masę.
Duota: m(Al) = 10,8 g | Sprendimas: m = 10,8 g m - ? 2Al + 3H 2SO 4 → Al 2 (SO 4 ) 3 + 3H 2 M = 27 g/mol M = 98 g/mol Čia galima paminėti, kad iš tikrųjų į reakciją patenka ne 2 aliuminio atomai ir 3 rūgšties molekulės, o dalis aliuminio atomų ir dalis rūgšties molekulių. Ši chemijos dalis vadinama trumpu žodžiu „molis“. n = 2 mol n = 3 mol m = M ∙ n m = 54 g m = 294 g Skaičiavimas pagal proporcijas: |
||||
m (H2SO4) - ? |
|||||
10,8 g | |||||
54 g | 294 g | ||||
10,8 g ∙ 294 g | |||||
54 g | |||||
X = 58,8 g Atsakymas: m (H 2 SO 4 ) = 58,8 g |
|||||
Tai yra visas problemos sprendimas. Turite klausimų? Pakalbėkime apie sprendimą dar kartą:
Sudarė lygtį
Virš medžiagų pasirašėme tai, ką ŽINOME ir NORIME RASTI
Pagal formules surašėme molinę masę, medžiagos kiekį irstechiometrinis medžiagos masė ( geriau nurodyti „masę pagal periodinę lentelę“).
Sudarė proporciją
Išsprendė proporciją
Įrašė atsakymą
Išspręskime panašią problemą, bet su dujinėmis medžiagomis (čia naudosime ne medžiagos molinę masę, o ką?...molinis tūris)
2 uždavinys. 25 gramai cinkas ištirpsta druskos rūgštyje, cheminės reakcijos metu išsiskiria dujos – vandenilis. Apskaičiuokite išleisto vandenilio tūrį.
Duota: m(Zn) = 10,8 g | Sprendimas: m = 25 g V - ? Zn + 2HCl → ZnCl 2 + H2 M = 65 g/mol V m = 22,4 l/mol n = 1 mol n = 1 mol m=65 g V=22,4 l Skaičiavimas pagal proporcijas: |
||||
m(HCl)-? |
|||||
25 g | |||||
65 g | 22,4 l | ||||
25 g ∙ 22,4 l | |||||
65 g | |||||
X = 8,61 l Atsakymas: V(H 2 ) = 8,61 l |
|||||
Pažiūrėkime, kaip įvaldėte medžiagą. Naudodami tą patį algoritmą išspręskite problemą:
TAI NĖRA FAKTAS, KAD JUMS PASIEKS:
Kai reaguoja su naudojant anglies oksidus Fe2O3 (pirmasis variantas) ir SnO2 (antras variantas) gavo po 20 g Fe ir Sn. Kiek gramų kiekvieno oksido buvo paimta?
Atkreipkite dėmesį, kad dabar mes skaičiuojame pradinių medžiagų masę, o ne reakcijos produktus)
(kiekvienas tegu išsprendžia sąsiuvinyje ir pasirinktinai paprašo parodyti sprendimą, lygtį visi kartu surašysime ant lentos, o kiekvienas bandys išspręsti pats)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119=25,38 g
Namų darbas: išstudijuokite vadovėlio medžiagą p. 146-150, išspręskite problemą
Kokia yra kalcio oksido masė ir koks anglies dioksido tūris (n.s.)
galima gauti skaidant kalcio karbonatą, sveriantį 250 g?TURI BŪTI DUOTI MOKSLINIAMSPARUOŠTA LYGTISKAD ATLIKT ŠIĄ UŽDUOTĮ
Metodinės pamokos rengimas (2 val.)
Skaičiavimai naudojant chemines lygtis
Chapugina Polina Ivanovna,
chemijos mokytoja GBOU vidurinė mokykla 277
Sankt Peterburgo Kirovskio rajonas
Pamokos tikslai: Išmokykite aštuntokus skaičiuoti naudojant chemines lygtis: iš pradinių medžiagų kiekio, tūrio ir masės raskite reakcijos produktų kiekį, masę ir tūrį.
Užsiėmimų metu:
Prieš pradėdami studijuoti naują temą, turime prisiminti kiekius ir formules, kurias jau žinote. Prisiminkite cheminių reakcijų tipus. Ir jūs jau žinote, kaip sukurti chemines lygtis ir jas išlyginti. Išbandykime savo žinias atlikdami šiuos veiksmus: vertinimo testas.(testo turinį galima peržiūrėti mano asmeninėje svetainėje failų ir nuotraukų aplanke)
Mokytojo paaiškinimas:
1. Prieš mokantis atlikti skaičiavimus naudojant chemines lygtis, reikia dar kartą prisiminti mums jau žinomas formules medžiagos kiekiui, masei ir tūriui nustatyti, vienu žingsniu galėsite išbandyti save po atlikto darbo . Norėdami tai padaryti, pereikime prie šio pristatymo, kuris padės atkurti mūsų žinias atmintyje. Pristatymas Nr.1.
Užsirašykite jau žinomas formules į sąsiuvinį:
n – medžiagos kiekis (mol)
m – medžiagos masė (g)
M – molinė masė (g/mol)
V – dujų tūris (l)
V m - molinis tūris = 22,4 l/mol
n = m/M; m = n.M
n = V/Vm; V = n.V m
2. Dabar turime suprasti, kad cheminė lygtis parodo ne tik kokybinę (medžiagų transformacijos) proceso pusę, bet ir kiekybinę jo pusę. Norėdami tai padaryti, pereikime prie toliau pateiktų dalykų Pristatymai Nr. 2(pristatymą galima peržiūrėti mano asmeninėje svetainėje failų ir nuotraukų aplanke)
Į užrašų knygelę parašykite:
Koeficientas reakcijos lygtyje rodo dalelių skaičių, o dalelių skaičius savo ruožtu lemia molių skaičių!
2H₂ + O₂ = 2H₂ APIE
Dalelių skaičius 2 molekulės 1 molekulės 2 molekulės
Kiekis ↓ ↓ ↓
medžiagos,n2 moliai 1 moliai 2 moliai
2 Fe(OI)3 = Fe2 O3 + 3 H2 O
↓ ↓ ↓
n= 2 mol 1 mol 3 mol
3. Kitas etapas, kurį turime išnagrinėti, yra galimybė sukurti proporciją naudojant reakcijos lygtį, taip pat ją išspręsti. Norėdami tai padaryti, pereikime prie toliau pateiktų dalykų Pristatymai 3.(pristatymą galima peržiūrėti mano asmeninėje svetainėje failų ir nuotraukų aplanke)
Į užrašų knygelę parašykite:
Žinoma pagal sąlygą: 2 mol X mol (skaitiklis)
4P+5O₂ = 2P₂ O₅
Žinoma pagal lygtį: 4 mol 5 mol 2 mol (vardiklis)
Sudarykime ir išspręskime proporciją:
2 mol X mol
_______ = _______
4 mol 2 mol
X molas = 2 mol. 2 mol= 1 mol
4 mol
X =n(P₂ O₅ )= 1 mol
4. Pereikime prie uždavinių sprendimo naudojant cheminių reakcijų lygtis. Norėdami išspręsti chemijos skaičiavimo problemą, turite naudoti šį algoritmą - atlikite penkis veiksmus. Pristatymas 4. (pristatymą galima peržiūrėti mano asmeninėje svetainėje failų ir nuotraukų aplanke) Vadovėlis 101 p.
Užrašų knygelėje:
Mokiniams pateikiamas paruoštas sprendimo algoritmas, kurį galima įklijuoti į savo sąsiuvinius.
Skaičiavimo uždavinių, naudojant cheminių reakcijų lygtis, sprendimo algoritmas:
1. Sukurkite cheminės reakcijos lygtį (t. y. būtinai nustatykite koeficientus!)
2. Virš atitinkamų formulių lygtyje surašykite kiekybinius duomenis apie medžiagas su matavimo vienetais, kurie yra žinomi arba gali būti apskaičiuojami pagal uždavinio sąlygas, o norimą reikšmę X taip pat su matavimo vienetais.
3. Pagal šias formules užrašykite atitinkamus kiekybinius dydžius, nurodytus pačios lygties, taip pat su matavimo vienetais.
4. Sudarykite ir išspręskite proporciją.
5. Formalizuokite atsakymą.
5. Išspręskime problemą.
Apskaičiuokite vandens masę, kuri susidaro dėl 0,5 mol aliuminio oksido sąveikos su sieros rūgštimi kaitinant.
Perskaitykite problemą.
Užsirašykite problemos teiginį. (Duota, rasti.)
Užrašų knygelėje: (mokiniai rašo sprendimą pagal mokytojo paaiškinimus pagal Pristatymai 5 ) (pristatymą galima peržiūrėti mano asmeninėje svetainėje failų ir nuotraukų aplanke)
Duota:
n(Al2O3) = 0,5 mol
_________________
Rasti:
Sprendimas:
n=0,5 mol X mol
Al₂ O₃ +3 H₂ TAIP₄ = Al₂ (TAIP₄ ) ₃ +3 H₂ O
n= 1 mol 3 mol
M = 102 g/mol 18 g/mol
Molekulinės masės apskaičiavimas:
Мr(Al₂O3) = 2,27 + 3,16 = 54 + 48 = 102
Мr(H₂O)= 2,1+16=18
Sudarykite ir išspręskite proporciją.
0,5 mol = X molas
1 molis 3 molis
X molas =n(H₂ O) = 0,5 mol. 3 mol= 1,5 mol
1 molis
Raskime vandens masę.
m(H₂ O) = n(H₂ O) . M(H₂ O)
m(H₂ O) = 1.5 mol.18 g/mol = 27 g
Atsakymas:m(H₂ O)=27 g
6. Spręskite problemas patys.
Du studentai kviečiami prie komisijos įvertinti.
1. Nustatykite chloro tūrį (nr.), reikalingą 634 g aliuminio chlorido gauti pagal lygtį: 2Al + 3Cl 2 = 2AlCl 3. Atsakymas: 159,6 l
2. Apskaičiuokite medžiagos kiekį ir ličio masę, reikalingą reakcijai su deguonimi, sveriančiu 128 g, pagal lygtį: 4Li + O 2 = 2Li 2 O Atsakymas: 16 mol, 112 g
7. Namų darbai.
Užduotis.
Raskite cinko oksido masę, kuri susidaro sąveikaujant 13 g cinko su deguonimi.