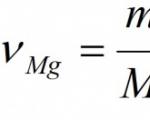Beregninger ved hjelp av kjemiske ligninger. Beregninger ved hjelp av kjemiske ligninger Arbeid 6 beregninger ved hjelp av ligninger av kjemiske reaksjoner
Støkiometri- kvantitative sammenhenger mellom reagerende stoffer.
Hvis reagenser inngår i en kjemisk interaksjon i strengt definerte mengder, og som et resultat av reaksjonen dannes stoffer, hvorav mengden kan beregnes, kalles slike reaksjoner støkiometrisk.
Lover for støkiometri:
Koeffisientene i kjemiske ligninger før formlene til kjemiske forbindelser kalles støkiometrisk.
Alle beregninger ved bruk av kjemiske ligninger er basert på bruk av støkiometriske koeffisienter og er forbundet med å finne mengder av et stoff (antall mol).
Stoffmengden i reaksjonsligningen (antall mol) = koeffisienten foran det tilsvarende molekylet.
N A=6,02x1023 mol -1.
η - forholdet mellom den faktiske massen til produktet m p til en teoretisk mulig m t, uttrykt i brøkdeler av en enhet eller i prosent.
Hvis utbyttet av reaksjonsprodukter ikke er angitt i tilstanden, blir det i beregningene tatt lik 100% (kvantitativt utbytte).
Beregningsskjema ved hjelp av kjemiske reaksjonsligninger:
- Skriv en ligning for en kjemisk reaksjon.
- Over de kjemiske formlene til stoffer skriv kjente og ukjente mengder med måleenheter.
- Under de kjemiske formlene for stoffer med kjente og ukjente, skriv ned de tilsvarende verdiene av disse mengdene funnet fra reaksjonsligningen.
- Komponer og løs en proporsjon.
Eksempel. Beregn massen og mengden magnesiumoksid som dannes under fullstendig forbrenning av 24 g magnesium.
|
Gitt: m(Mg) = 24 g Finne: ν (MgO) m (MgO) |
Løsning: 1. La oss lage en ligning for en kjemisk reaksjon: 2Mg + O2 = 2MgO. 2. Under stoffformlene angir vi mengden stoff (antall mol) som tilsvarer de støkiometriske koeffisientene: 2Mg + O2 = 2MgO 2 mol 2 mol 3. Bestem den molare massen av magnesium: Relativ atommasse av magnesium Ar (Mg) = 24. Fordi den molare masseverdien er lik den relative atom- eller molekylmassen, da M (Mg)= 24 g/mol. 4. Ved å bruke massen av stoffet spesifisert i betingelsen, beregner vi mengden av stoffet:
5. Over den kjemiske formelen for magnesiumoksid MgO, hvis masse er ukjent, setter vi xmuldvarp, over magnesiumformelen Mg vi skriver dens molare masse: 1 føflekk xmuldvarp 2Mg + O2 = 2MgO 2 mol 2 mol
I henhold til reglene for å løse proporsjoner:
Mengde magnesiumoksid ν (MgO)= 1 mol. 7. Regn ut den molare massen av magnesiumoksid: M (Mg)=24 g/mol, M(O)=16 g/mol. M(MgO)= 24 + 16 = 40 g/mol. Vi beregner massen av magnesiumoksid: m (MgO) = ν (MgO) × M (MgO) = 1 mol × 40 g/mol = 40 g. Svar: v (MgO) = 1 mol; m (MgO) = 40 g. |
Uansett hva du studerer, du
du studerer for deg selv.
Petronius
Leksjonens mål:
- introdusere elevene til de grunnleggende måtene å løse problemer ved å bruke kjemiske ligninger:
- finne mengden, massen og volumet av reaksjonsprodukter fra mengden, massen eller volumet av utgangsstoffer,
- fortsette å utvikle ferdigheter i å arbeide med teksten til et problem, evnen til å begrunne velge en metode for å løse et pedagogisk problem, og evnen til å sette sammen ligninger av kjemiske reaksjoner.
- utvikle evnen til å analysere, sammenligne, fremheve det viktigste, lage en handlingsplan og trekke konklusjoner.
- dyrke toleranse overfor andre, uavhengighet i beslutningstaking og evnen til objektivt å vurdere resultatene av ens arbeid.
Arbeidsformer: frontalt, individuelt, par, gruppe.
Leksjonstype: kombinert med bruk av IKT
I Organisatorisk øyeblikk.
Hei folkens. I dag skal vi lære å løse problemer ved å bruke ligninger av kjemiske reaksjoner. Lysbilde 1 (se presentasjon).
Leksjonens mål Lysbilde 2.
II.Oppdatering av kunnskap, ferdigheter og evner.
Kjemi er en veldig interessant og samtidig kompleks vitenskap. For å kunne og forstå kjemi må du ikke bare assimilere stoffet, men også kunne anvende den ervervede kunnskapen. Du lærte hvilke tegn som indikerer forekomsten av kjemiske reaksjoner, lærte hvordan du skriver ligninger for kjemiske reaksjoner. Jeg håper du har en god forståelse av disse emnene og kan svare på spørsmålene mine uten problemer.
Hvilket fenomen er ikke et tegn på kjemiske transformasjoner:
a) utseendet til sediment; c) endring i volum;
b) gassfrigjøring; d) utseendet til en lukt. Lysbilde 3
Vennligst angi med tall:
a) ligninger av sammensatte reaksjoner
b) likninger av substitusjonsreaksjoner
c) ligninger av nedbrytningsreaksjoner Lysbilde 4
For å lære å løse problemer, er det nødvendig å lage en handlingsalgoritme, dvs. bestemme rekkefølgen av handlinger.
Algoritme for beregninger ved hjelp av kjemiske ligninger (på hver elevs skrivebord)
5. Skriv ned svaret.
La oss begynne å løse problemer ved hjelp av en algoritme
Beregne massen til et stoff fra den kjente massen til et annet stoff som deltar i reaksjonen
Beregn massen av oksygen som frigjøres som følge av nedbrytning
porsjoner vann som veier 9 g.
La oss finne den molare massen av vann og oksygen:
M(H20) = 18 g/mol
M(02) = 32 g/mol Lysbilde 6
La oss skrive ligningen for den kjemiske reaksjonen:
2H20 = 2H2 + O2
Over formelen i reaksjonsligningen skriver vi det vi fant
verdien av mengden av et stoff, og under formlene for stoffer -
støkiometriske forhold vises
kjemisk ligning
0,5 mol x mol
2H20 = 2H2 + O2
2mol 1mol
La oss beregne mengden stoff hvis masse vi ønsker å finne.
For å gjøre dette lager vi en proporsjon
0,5 mol = hopmol
2mol 1mol
hvor x = 0,25 mol Lysbilde 7
Derfor er n(O 2) = 0,25 mol
Finn massen til stoffet som skal beregnes
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0,25 mol 32 g/mol = 8 g
La oss skrive ned svaret
Svar: m(O 2) = 8 g Lysbilde 8
Beregne volumet av et stoff fra den kjente massen til et annet stoff som deltar i reaksjonen
Beregn volumet av oksygen (antall) som frigjøres som følge av dekomponering av en del vann som veier 9 g.

V(0 2)=?l(n.s.)
M(H20) = 18 g/mol
Vm=22,4l/mol Lysbilde 9
La oss skrive ned reaksjonsligningen. La oss ordne koeffisientene
2H20 = 2H2 + O2
Over formelen i reaksjonsligningen skriver vi funnverdien av mengden av stoffet, og under formlene til stoffene - de støkiometriske forholdene vist av den kjemiske ligningen
0,5 mol - x mol
2H20 = 2H2 + O2 Lysbilde 10
2mol - 1mol
La oss beregne mengden stoff hvis masse vi ønsker å finne. For å gjøre dette, la oss lage en proporsjon
![]()
hvor x = 0,25 mol
La oss finne volumet av stoffet som må beregnes
V(0 2)=n(0 2) Vm
V(O 2) = 0,25 mol 22,4 l/mol = 5,6 l (antall)
Svar: 5,6 l Lysbilde 11
III. Konsolidering av studert materiale.
Oppgaver for selvstendig løsning:
1. Ved reduksjon av oksidene Fe 2 O 3 og SnO 2 med kull ble det oppnådd 20 g Fe og Sn. Hvor mange gram av hvert oksid ble tatt?
2. I så fall dannes det mer vann:
a) når du reduserer 10 g kobber(I)oksid (Cu 2 O) med hydrogen eller
b) når man reduserer 10 g kobber(II)oksid (CuO) med hydrogen? Lysbilde 12
La oss sjekke løsningen på problem 1

M(Fe2O3)=160g/mol
M(Fe)=56g/mol, ![]()
m(Fe2O3)=, m(Fe2O3)=0,18*160=28,6g
Svar: 28,6g
Lysbilde 13
La oss sjekke løsningen på problem 2

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mol,
n(H20)=0,07 mol
m(H20) = 0,07 mol*18 g/mol = 1,26 g
Lysbilde 14
CuO + H 2 = Cu + H 2 O
n(CuO) = m/ M(CuO)
n(CuO) = 10g/80g/mol = 0,125 mol
0,125 mol humle
CuO + H 2 = Cu + H 2 O
1 mol 1 mol
![]()
x mol = 0,125 mol, n(H20) = 0,125 mol
m (H20) = n*M (H20);
m(H20) = 0,125mol*18g/mol=2,25g
Svar: 2,25g Lysbilde 15
Lekser: studer lærebokmaterialet s. 45-47, løs problemet
Hva er massen av kalsiumoksid og hva er volumet av karbondioksid (n.s.)
kan oppnås ved å dekomponere kalsiumkarbonat som veier 250 g?
CaCO 3 = CaO + CO Lysbilde 16.
Litteratur
1. Gabrielyan O.S. Kjemikursprogram for klassetrinn 8-11 i allmennutdanningsinstitusjoner. M. Bustard 2006
2. Gabrielyan O.S. Kjemi. 8. klasse. Lærebok for allmenne utdanningsinstitusjoner. Bustard. M. 2005
3. Gorbuntsova S.V. Prøver på hoveddelene i skoleløpet. 8. - 9. klasse. VAKO, Moskva, 2006.
4. Gorkovenko M.Yu Leksjonsutvikling i kjemi. Til lærebøkene til O.S. Gabrielyan, L.S. Guzey, V.V. Sorokin, R.P. Surovtseva og G.E. Rudzitis, F.G. Feldman. 8. klasse. VAKO, Moskva, 2004.
5. Gabrielyan O.S. Kjemi. Karakter 8: Prøver og prøver. – M.: Bustard, 2003.
6. Radetsky A.M., Gorshkova V.P. Didaktisk stoff om kjemi for 8-9 klassetrinn: En manual for lærere. – M.: Utdanning, 2000
Applikasjon.
Beregninger ved hjelp av kjemiske ligninger
Algoritme for handlinger.
For å løse et regneproblem i kjemi kan du bruke følgende algoritme - ta fem trinn:
1. Skriv en ligning for en kjemisk reaksjon.
2. Over formlene for stoffer, skriv kjente og ukjente mengder med tilsvarende måleenheter (kun for rene stoffer, uten urenheter). Hvis stoffer som inneholder urenheter, i henhold til forholdene for problemet, inngår i en reaksjon, må du først bestemme innholdet av det rene stoffet.
3. Under formlene for stoffer med kjente og ukjente, skriv ned de tilsvarende verdiene av disse mengdene funnet fra reaksjonsligningen.
4. Komponer og løs en proporsjon.
5. Skriv ned svaret.
Forholdet mellom noen fysiske og kjemiske mengder og deres enheter
Masse (m): g; kg; mg
Mengde stoffer (n): føflekk; kmol; mmol
Molar masse (M): g/mol; kg/kmol; mg/mmol
Volum (V): l; m3/kmol; ml
Molar volum (Vm): l/mol; m3/kmol; ml/mmol
Antall partikler (N): 6 1023 (Avagadro-tall – N A); 6 1026; 6 1020
Leksjonen er viet til å fortsette studiet av emnet "ligning av en kjemisk reaksjon." Leksjonen diskuterer de enkleste beregningene ved å bruke ligningen for en kjemisk reaksjon, relatert til forholdet mellom mengdene av stoffer som deltar i reaksjonen.
Emne: Innledende kjemiske ideer
Leksjon: Kjemisk reaksjonsligning
1. Forholdet mellom mengdene av stoffer som deltar i reaksjonen
Koeffisientene i reaksjonsligningen viser ikke bare antall molekyler til hvert stoff, men også forholdet mellom mengdene av stoffer som deltar i reaksjonen. Således, i henhold til reaksjonsligningen: 2H2 + O2 = 2H2O - kan det hevdes at for å danne en viss mengde vann (for eksempel 2 mol), det samme antall mol av det enkle stoffet hydrogen (2 mol) og halvparten så mange mol av det enkle stoffet oksygen (1 mol) er nødvendig ). La oss gi eksempler på slike beregninger.
2. Oppgave 1
OPPGAVE 1. La oss bestemme mengden oksygenstoff som dannes som følge av nedbrytning av 4 mol vann.
ALGORITME for å løse problemet:
1. Skriv ned reaksjonsligningen
2. Gjør opp en andel ved å bestemme mengdene av stoffer i henhold til reaksjonsligningen og i henhold til betingelsene for problemet (betegn den ukjente mengden stoff som x mol).
3. Lag en likning (fra proporsjon).
4. Løs ligningen, finn x.
Ris. 1. Formulering av en kort tilstand og løsning på problem 1
3. Oppgave 2OPPGAVE 2. Hvor mye oksygen kreves for å brenne 3 mol kobber fullstendig?La oss bruke en algoritme for å løse problemer ved å bruke ligningen for en kjemisk reaksjon.

Ris. 2. Formulering av en kort tilstand og løsning på problem 2.
Studer nøye algoritmene og skriv dem ned i en notatbok, løs de foreslåtte problemene selv
Jeg. Bruk algoritmen til å løse følgende problemer selv:
1. Beregn mengden aluminiumoksidstoff som dannes som et resultat av interaksjonen av aluminium med en mengde på 0,27 mol stoff med tilstrekkelig mengde oksygen (4Al +3O 2 = 2Al203).
2. Beregn mengden natriumoksidstoff som dannes som et resultat av interaksjonen av natrium med en 2,3 mol mengde stoff med tilstrekkelig mengde oksygen(4Na+02=2Na20).
Algoritme nr. 1
Beregne mengden av et stoff fra en kjent mengde av stoffet som er involvert i en reaksjon.
Eksempel. Beregn mengden oksygen som frigjøres som følge av nedbrytning av vann med en mengde stoff på 6 mol.



II. Bruk algoritmen til å løse følgende problemer selv:
1. Beregn massen av svovel som kreves for å oppnå svoveloksid (IV) med en mengde stoff på 4 mol (S + O 2
=SO2).
2. Beregn massen av litium som kreves for å oppnå litiumklorid med en substansmengde på 0,6 mol (2Li+Cl2 = 2LiCl).
Algoritme nr. 2
Beregning av massen til et stoff fra en kjent mengde av et annet stoff som er involvert i en reaksjon.
Eksempel: Beregn massen av aluminium som kreves for å oppnå aluminiumoksid med en mengde stoff på 8 mol.



III. Bruk algoritmen til å løse følgende problemer selv:
1. Beregn mengden natriumsulfid hvis svovel som veier 12,8 g (2Na+S=Na2S) reagerer med natrium.
2. Beregn mengden kobberstoff som dannes hvis kobber(II)oksid som veier 64 g reagerer med hydrogen (CuO + H2 = Cu + H2 O).
Studer algoritmen nøye og skriv den ned i notatboken.
Algoritme nr. 3
Beregne mengden av et stoff fra den kjente massen til et annet stoff som deltar i en reaksjon.
Eksempel. Beregn mengden kobber(I)oksid hvis kobber som veier 19,2 g reagerer med oksygen.



Studer algoritmen nøye og skriv den ned i notatboken.
IV. Bruk algoritmen til å løse følgende problemer selv:
1. Beregn massen av oksygen som kreves for å reagere med jern som veier 112 g
(3Fe + 4O2 =Fe304).
Algoritme nr. 4
Beregning av massen til et stoff fra den kjente massen til et annet stoff som deltar i reaksjonen
Eksempel. Beregn massen av oksygen som kreves for forbrenning av fosfor, som veier 0,31 g.



OPPGAVER FOR UAVHENGIG LØSNING
1. Beregn mengden aluminiumoksidstoff som dannes som følge av interaksjonen mellom aluminium og en 0,27 mol mengde stoff med tilstrekkelig mengde oksygen (4Al + 3O2 = 2Al2 O3).
2. Beregn mengden natriumoksidstoff som dannes som et resultat av interaksjonen av natrium med en 2,3 mol mengde stoff med tilstrekkelig mengde oksygen (4Na + O2 = 2Na2 O).
3. Beregn massen av svovel som kreves for å oppnå svoveloksid (IV) med en stoffmengde på 4 mol (S+O2 =SO2).
4. Beregn massen av litium som kreves for å oppnå litiumklorid med en substansmengde på 0,6 mol (2Li+Cl2 = 2LiCl).
5. Beregn mengden natriumsulfid hvis svovel som veier 12,8 g (2Na+S=Na2S) reagerer med natrium.
6. Beregn mengden kobberstoff som dannes hvis kobber(II)oksid som veier 64 g reagerer med hydrogen (CuO + H2 = Cu + H2 O).
ØVELSER
Simulator nr. 1 - Analyse av den kjemiske reaksjonsligningen
Simulator nr. 6 - Støkiometriske beregninger
Leksjonssammendrag "Beregninger ved hjelp av kjemiske ligninger"
1. Sjekke lekser
Som lekser ble du bedt om å plassere koeffisienter i reaksjonsligninger.Du kan se arbeidet som er gjort i pausen. Det vil garantert være feil.Har alt ordnet seg, er det noen som har spørsmål?La dem snakke om hjemmeopplevelsen.
2. Kunngjøring av tema og oppdatering av kunnskap
Temaet for dagens leksjon er beregninger ved hjelp av kjemiske ligninger. Først, la oss huske alt som kan være nyttig for oss i dag. Vi har allerede møtt kjemiske ligninger i tidligere laboratoriearbeid, i lekser og enda tidligere i temaet binære forbindelser. La oss huske definisjonen av ligningen for en kjemisk reaksjon.
(dette er en konvensjonell notasjon av en kjemisk reaksjon ved bruk av kjemiske formler og koeffisienter.)
Fantastisk.
Når du produserer forbindelser, må du vite hvor mye utgangsmateriale du skal ta for å oppnå den nødvendige massen av reaksjonsproduktet. For å gjøre dette, lag en ligning for den pågående kjemiske reaksjonen, og når du beregner masser tar hensyn til molare masser stoffer, og ved beregning volumer av gasser ta hensyn til verdienmolar volum gasser
Hvem husker verdien av det molare volumet av gasser under normale forhold? (22,4 l/mol)
Og hva er disse normale forholdene? (trykk 101,3 kPa og temperatur 0 o C)
Det vil si at under disse forholdene opptar 1 mol ENHVER gass et volum på 22,4 liter.
Faktisk, for å løse problemer, må vi huske flere mengder:
Molar masse – M (g/mol)
Mengde stoff – n (mol)
Volum – V (l)
Det er bedre på denne måten: du husker at molar masse er numerisk lik den relative atommassen eller relative molekylmassen til et stoff. For å gjøre dette må du bruke det periodiske systemet, der den relative atommassen er angitt nederst i hver "celle". For ikke å glemme avrundingsreglene, bruker vi hele verdien av denne massen i beregninger.
Kjemi er en veldig klar, logisk og konsekvent vitenskap, derfor vil det være praktisk å bruke ALGORITMEN, som er gitt i læreboken, for å løse problemer. Dette er en universell sekvens av handlinger som brukes til å løse ethvert problem av denne typen.
Vennligst åpne læreboken og la oss alle bli kjent med algoritmen.
(her åpner vi alle lærebøkene våre sammen, en person, kanskje jeg, leser algoritmen, resten følger for å forstå hva de må gjøre nå)
Det høres omfattende ut, men jeg håper det ikke er for forvirrende. La oss prøve å finne ut av det med et eksempel.
Oppgave 1. For å produsere hydrogen løses aluminium i svovelsyre: 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 (Det første punktet i algoritmen vår). For reaksjonen tok vi 10,8 g aluminium. Beregn massen av forbrukt svovelsyre.
Gitt: m(Al) = 10,8 g | Løsning: m=10,8 g m - ? 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 M=27g/mol M=98g/mol Her kan vi nevne at faktisk ikke 2 aluminiumatomer og 3 syremolekyler går inn i reaksjonen, men en del aluminiumatomer og en del syremolekyler. Denne delen i kjemi kalles det korte ordet "føflekk". n=2 mol n=3 mol m = M ∙ n m=54 g m=294 g Beregning etter proporsjon: |
||||
m (H 2 SO 4 ) - ? |
|||||
10,8 g | |||||
54 g | 294 g | ||||
10,8 g ∙ 294 g | |||||
54 g | |||||
X = 58,8 g Svar: m (H 2 SO 4 ) = 58,8 g |
|||||
Det er hele løsningen på problemet. Har du spørsmål? La oss snakke om løsningen en gang til:
Laget en ligning
Over stoffene signerte vi det vi VET og det vi VIL FINNE
Under formlene skrev vi ned molmassen, stoffmengden ogstøkiometrisk massen av stoffet ( det er bedre å indikere "masse i henhold til det periodiske systemet")
Laget opp en andel
Løste andelen
Registrerte svaret
La oss løse et lignende problem, men med gassformige stoffer (her skal vi ikke bruke molarmassen til stoffet, men hva?...molarvolum)
Oppgave 2. 25 gram sink er oppløst i saltsyre, under den kjemiske reaksjonen frigjøres en gass - hydrogen. Beregn volumet av frigjort hydrogen.
Gitt: m(Zn) = 10,8 g | Løsning: m=25 g V - ? Zn + 2HCl → ZnCl2 + H2 M=65 g/mol V m=22,4 l/mol n=1 mol n=1 mol m=65 g V=22,4 l Beregning etter proporsjon: |
||||
m(HCl) - ? |
|||||
25 g | |||||
65 g | 22,4 l | ||||
25 g ∙ 22,4 l | |||||
65 g | |||||
X = 8,61 l Svar: V(H 2 ) = 8,61 l |
|||||
La oss sjekke hvordan du mestrer materialet. Bruk samme algoritme, løs problemet:
DET ER IKKE ET FAKTUM AT DU VIL LYKKES:
Når man reagerer med ved bruk av kulloksider Fe2O3 (første alternativ) og SnO2 (andre alternativ) fikk hver 20 g Fe og Sn. Hvor mange gram av hvert oksid ble tatt?
Vær oppmerksom på at vi nå beregner massen til utgangsstoffene, ikke reaksjonsproduktene)
(la alle løse det i en notatbok og be dem selektivt vise løsningen, vi vil skrive likningen sammen på tavlen, og alle vil prøve å løse den selv)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 g
Lekser: studer lærebokmaterialet s. 146-150, løs problemet
Hva er massen av kalsiumoksid og hva er volumet av karbondioksid (n.s.)
kan oppnås ved å dekomponere kalsiumkarbonat som veier 250 g?BØR GIVES SKOLEBARNKLAR LIGNINGFOR Å FØRE DENNE OPPGAVEN
Metodisk leksjonsutvikling (2 timer)
Beregninger ved hjelp av kjemiske ligninger
Khapugina Polina Ivanovna,
kjemilærer GBOU ungdomsskole 277
Kirovsky-distriktet i St. Petersburg
Leksjonens mål: Lær åttendeklassingene å gjøre beregninger ved hjelp av kjemiske ligninger: finn mengden, massen og volumet av reaksjonsproduktene fra mengden, volumet og massen til utgangsstoffene.
I løpet av timene:
Før vi går videre til å studere et nytt emne, må vi huske mengdene og formlene du allerede kjenner. Husk hvilke typer kjemiske reaksjoner. Og du vet allerede hvordan du lager kjemiske ligninger og utligner dem. La oss teste kunnskapen din ved å gjøre følgende: vurderingstest.(innholdet i testen kan sees på min personlige nettside i mappen filer og bilder)
Lærerens forklaring:
1. Før du lærer å lage beregninger ved hjelp av kjemiske ligninger, må du igjen huske formlene vi allerede kjenner for å finne mengden av et stoff, masse og volum av stoffer, i ett trinn kan du teste deg selv etter arbeidet du har gjort . For å gjøre dette, la oss gå til følgende presentasjon, som vil bidra til å gjenopprette kunnskapen vår i minnet. Presentasjon nr. 1.
Skriv ned formlene du allerede kjenner i notatboken din:
n- mengde stoff (mol)
m- masse av stoff (g)
M - molar masse (g/mol)
V - gassvolum (l)
V m - molvolum = 22,4 l/mol
n = m/M; m = n.M
n = V/Vm; V = n.V m
2. Nå må vi forstå at en kjemisk ligning viser ikke bare den kvalitative (transformasjonen av stoffer) siden av prosessen, men også den kvantitative siden av den. For å gjøre dette, la oss gå til følgende Presentasjoner #2(presentasjonen kan sees på min personlige nettside i mappen filer og bilder)
Skriv i notatboken din:
Koeffisienten i reaksjonsligningen angir antall partikler, og antall partikler bestemmer igjen antall mol!
2H₂ + O₂ = 2H₂ OM
Antall partikler 2 molekyler 1 molekyler 2 molekyler
Mengde ↓ ↓ ↓
stoffer,n2 mol 1 mol 2 mol
2 Fe(ÅH)3 = Fe2 O3 + 3 H2 O
↓ ↓ ↓
n= 2mol 1mol 3mol
3. Det neste trinnet som vi må undersøke er evnen til å lage en proporsjon ved hjelp av reaksjonsligningen, samt løse den. For å gjøre dette, la oss gå til følgende Presentasjoner 3.(presentasjonen kan sees på min personlige nettside i mappen filer og bilder)
Skriv i notatboken din:
Kjent av tilstanden: 2 mol X mol (teller)
4P+5O₂ = 2P₂ O₅
Kjent av ligningen: 4 mol 5 mol 2 mol (nevner)
La oss komponere og løse andelen:
2 mol X mol
_______ = _______
4 mol 2 mol
X mol = 2 mol. 2 mol= 1 mol
4 mol
X =n(S₂ O₅ )= 1 mol
4. La oss gå videre til å løse problemer ved å bruke ligninger av kjemiske reaksjoner. For å løse et regneproblem i kjemi, må du bruke følgende algoritme - ta fem trinn. Presentasjon 4. (presentasjonen kan sees på min personlige nettside i mappen filer og bilder) Lærebok s. 101
I notatboken din:
Elevene får en ferdig løsningsalgoritme som de limer inn i notatbøkene sine.
Algoritme for å løse beregningsproblemer ved å bruke kjemiske reaksjonsligninger:
1. Lag en ligning for en kjemisk reaksjon (dvs. pass på å angi koeffisientene!)
2. Over de tilsvarende formlene i ligningen, skriv ned kvantitative data om stoffer med måleenheter som er kjent eller kan beregnes ut fra forholdene til problemet, og ønsket verdi X også med måleenheter.
3. Under disse formlene skriver du ned de tilsvarende kvantitative mengdene spesifisert av selve ligningen, også med måleenheter.
4. Komponer og løs en proporsjon.
5. Formaliser svaret.
5. La oss løse problemet.
Beregn massen av vann som dannes som et resultat av samspillet mellom 0,5 mol aluminiumoksid og svovelsyre ved oppvarming.
Les problemet.
Skriv ned problemstillingen. (Gi, finn.)
I notatboken din: (elevene skriver ned løsningen i henhold til lærerens forklaringer iht Presentasjoner 5 ) (presentasjonen kan sees på min personlige nettside i mappen filer og bilder)
Gitt:
n(Al203) = 0,5 mol
_________________
Finne:
Løsning:
n= 0,5 mol X mol
Al₂ O₃ +3 H₂ SÅ₄ = Al₂ (SÅ₄ ) ₃ +3 H₂ O
n= 1 mol 3 mol
M = 102 g/mol 18 g/mol
Beregning av molekylvekt:
Мr(Al₂O₃)= 2,27+3,16= 54+48=102
Мr(H2O)= 2,1+16=18
Komponer og løs en proporsjon.
0,5 mol = X føflekk
1 mol 3 mol
X mol =n(H₂ O) = 0,5 mol. 3 mol= 1,5 mol
1 føflekk
La oss finne massen av vann.
m(H₂ O) = n(H₂ O) . M(H₂ O)
m(H₂ O) = 1,5 mol.18 g/mol = 27 g
Svar:m(H₂ O) = 27 g
6. Løs problemer selv.
To elever kalles inn til styret for vurdering.
1. Bestem volumet av klor (nr.) som kreves for å oppnå 634 g aluminiumklorid i henhold til ligningen: 2Al + 3Cl 2 = 2AlCl 3. Svar: 159,6 l
2. Beregn mengde stoff og masse litium som kreves for reaksjonen med oksygen som veier 128 g i henhold til ligningen: 4Li + O 2 = 2Li 2 O Svar: 16 mol, 112 g
7. Lekser.
Oppgave.
Finn massen av sinkoksyd, som dannes når 13 g sink reagerer med oksygen.