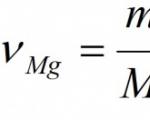Perhitungan menggunakan persamaan kimia. Perhitungan menggunakan persamaan kimia Pekerjaan 6 Perhitungan menggunakan persamaan reaksi kimia
Stoikiometri- hubungan kuantitatif antar zat yang bereaksi.
Jika reagen-reagen melakukan interaksi kimia dalam jumlah yang ditentukan secara ketat, dan sebagai hasil dari reaksi tersebut terbentuk zat-zat yang jumlahnya dapat dihitung, maka reaksi tersebut disebut stoikiometri.
Hukum stoikiometri:
Koefisien dalam persamaan kimia sebelum rumus senyawa kimia disebut stoikiometri.
Semua perhitungan menggunakan persamaan kimia didasarkan pada penggunaan koefisien stoikiometri dan berhubungan dengan pencarian jumlah suatu zat (jumlah mol).
Jumlah zat dalam persamaan reaksi (jumlah mol) = koefisien di depan molekul yang bersangkutan.
tidak ada=6,02×10 23 mol -1.
η - rasio massa sebenarnya produk m hal secara teoritis mungkin M t, dinyatakan dalam pecahan satuan atau persentase.
Jika rendemen produk reaksi tidak ditentukan pada kondisi tersebut, maka dalam perhitungannya diambil sama dengan 100% (hasil kuantitatif).
Skema perhitungan menggunakan persamaan reaksi kimia:
- Tuliskan persamaan reaksi kimia.
- Di atas rumus kimia suatu zat tuliskan besaran yang diketahui dan tidak diketahui beserta satuannya.
- Di bawah rumus kimia zat yang diketahui dan tidak diketahui, tuliskan nilai yang sesuai dari besaran yang diperoleh dari persamaan reaksi.
- Menyusun dan menyelesaikan suatu proporsi.
Contoh. Hitung massa dan jumlah magnesium oksida yang terbentuk selama pembakaran sempurna 24 g magnesium.
|
Diberikan: M(Mg) = 24 gram Menemukan: ν (MgO) M (MgO) |
Larutan: 1. Mari kita buat persamaan reaksi kimia: 2Mg + O 2 = 2MgO. 2. Di bawah rumus zat, kami menunjukkan jumlah zat (jumlah mol) yang sesuai dengan koefisien stoikiometri: 2Mg + O2 = 2MgO 2 mol 2 mol 3. Tentukan massa molar magnesium: Massa atom relatif magnesium Ar (Mg) = 24. Karena maka nilai massa molar sama dengan massa atom atau molekul relatif M (Mg)= 24 gram/mol. 4. Dengan menggunakan massa zat yang ditentukan dalam kondisi, kita menghitung jumlah zat:
5. Di atas rumus kimia magnesium oksida MgO, yang massanya tidak diketahui, kami tetapkan Xtikus tanah, di atas rumus magnesium mg kami menulis massa molarnya: 1 tahi lalat Xtikus tanah 2Mg + O2 = 2MgO 2 mol 2 mol
Menurut aturan untuk menyelesaikan proporsi:
Jumlah magnesium oksida (MgO)= 1 mol. 7. Hitung massa molar magnesium oksida: M (Mg)=24 gram/mol, M(O)=16 gram/mol. M(MgO)= 24 + 16 = 40 gram/mol. Kami menghitung massa magnesium oksida: m (MgO) = ν (MgO) × M (MgO) = 1 mol × 40 g/mol = 40 g. Menjawab: ν (MgO) = 1 mol; m (MgO) = 40 gram. |
Apa pun yang Anda pelajari, Anda
kamu belajar sendiri.
Petronius
Tujuan pelajaran:
- mengenalkan siswa pada cara dasar menyelesaikan masalah menggunakan persamaan kimia:
- menemukan kuantitas, massa dan volume produk reaksi dari kuantitas, massa atau volume zat awal,
- terus mengembangkan keterampilan dalam mengerjakan teks masalah, kemampuan memilih metode penyelesaian masalah pendidikan secara wajar, dan kemampuan menyusun persamaan reaksi kimia.
- mengembangkan kemampuan menganalisis, membandingkan, menonjolkan hal yang pokok, menyusun rencana tindakan, dan menarik kesimpulan.
- menumbuhkan toleransi terhadap orang lain, kemandirian dalam pengambilan keputusan, dan kemampuan mengevaluasi hasil pekerjaan secara objektif.
Bentuk pekerjaan: frontal, individu, berpasangan, kelompok.
Jenis pelajaran: dipadukan dengan pemanfaatan TIK
I Momen organisasi.
Hallo teman-teman. Hari ini, kita akan belajar bagaimana menyelesaikan masalah menggunakan persamaan reaksi kimia. Slide 1 (lihat presentasi).
Tujuan pelajaran Geser 2.
II.Memperbarui pengetahuan, keterampilan dan kemampuan.
Kimia adalah ilmu yang sangat menarik sekaligus kompleks. Untuk mengetahui dan memahami kimia, Anda tidak hanya harus mengasimilasi materi, tetapi juga mampu menerapkan ilmu yang diperoleh. Anda mempelajari tanda-tanda apa yang menunjukkan terjadinya reaksi kimia, mempelajari cara menulis persamaan reaksi kimia. Saya harap Anda memiliki pemahaman yang baik tentang topik ini dan dapat menjawab pertanyaan saya tanpa kesulitan.
Fenomena manakah yang bukan merupakan tanda transformasi kimia:
a) munculnya sedimen; c) perubahan volume;
b) pelepasan gas; d) munculnya bau. Geser 3
Silakan sebutkan dalam angka:
a) persamaan reaksi senyawa
b) persamaan reaksi substitusi
c) persamaan reaksi dekomposisi Geser 4
Untuk mempelajari cara memecahkan masalah, perlu dibuat algoritma tindakan, yaitu. menentukan urutan tindakan.
Algoritma perhitungan menggunakan persamaan kimia (di meja masing-masing siswa)
5. Tuliskan jawabannya.
Mari kita mulai memecahkan masalah menggunakan algoritma
Menghitung massa suatu zat dari massa zat lain yang diketahui ikut serta dalam reaksi
Hitung massa oksigen yang dilepaskan sebagai akibat dekomposisi
porsi air seberat 9 g.
Mari kita cari massa molar air dan oksigen:
M(H 2 O) = 18 g/mol
M(O2) = 32 g/mol Geser 6
Mari kita tulis persamaan reaksi kimianya:
2H 2 O = 2H 2 + O 2
Di atas rumus persamaan reaksi kami menulis apa yang kami temukan
nilai jumlah suatu zat, dan berdasarkan rumus zat -
rasio stoikiometri ditampilkan
persamaan kimia
0,5 mol x mol
2H 2 O = 2H 2 + O 2
2mol 1mol
Mari kita hitung jumlah zat yang massanya ingin kita cari.
Untuk melakukan ini, kita membuat proporsi
0,5mol = hopmol
2mol 1mol
dimana x = 0,25 mol Geser 7
Oleh karena itu, n(O 2) = 0,25 mol
Temukan massa zat yang perlu dihitung
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0,25 mol 32 g/mol = 8 g
Mari kita tuliskan jawabannya
Jawaban: m(O 2) = 8 gram Geser 8
Menghitung volume suatu zat dari massa zat lain yang diketahui ikut serta dalam reaksi
Hitung volume oksigen (no.) yang dilepaskan sebagai hasil penguraian sebagian air seberat 9 g.

V(0 2)=?l(n.s.)
M(H 2 O) = 18 g/mol
Vm=22,4l/mol Geser 9
Mari kita tuliskan persamaan reaksinya. Mari kita atur koefisiennya
2H 2 O = 2H 2 + O 2
Di atas rumus persamaan reaksi kita tuliskan nilai jumlah zat yang ditemukan, dan di bawah rumus zat - rasio stoikiometri yang ditampilkan oleh persamaan kimia
0,5 mol - x mol
2H 2 O = 2H 2 + O 2 Geser10
2mol - 1mol
Mari kita hitung jumlah zat yang massanya ingin kita cari. Untuk melakukan ini, mari buat proporsi
![]()
dimana x = 0,25 mol
Mari kita cari volume zat yang perlu dihitung
V(0 2)=n(0 2) Vm
V(O 2) = 0,25 mol 22,4 l/mol = 5,6 l (no.)
Jawaban: 5,6 liter Geser 11
III.Pemantapan materi yang dipelajari.
Tugas untuk solusi mandiri:
1. Ketika oksida Fe 2 O 3 dan SnO 2 direduksi dengan batubara, diperoleh 20 g Fe dan Sn. Berapa gram setiap oksida yang diambil?
2. Dalam hal ini air yang terbentuk lebih banyak:
a) ketika mereduksi 10 g tembaga (I) oksida (Cu 2 O) dengan hidrogen atau
b) ketika mereduksi 10 g tembaga(II) oksida (CuO) dengan hidrogen? Geser 12
Mari kita periksa solusi masalah 1

M(Fe 2 O 3)=160g/mol
M(Fe)=56g/mol, ![]()
m(Fe 2 O 3)=, m(Fe 2 O 3)= 0,18*160=28,6g
Jawaban: 28.6g
Geser 13
Mari kita periksa solusi masalah 2

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mol,
n(H 2 O)=0,07 mol
m(H 2 O) = 0,07 mol*18 g/mol = 1,26 g
Geser 14
CuO + H 2 = Cu + H 2 O
n(CuO) = m/ M(CuO)
n(CuO) = 10g/ 80g/mol = 0,125 mol
0,125 mol hop
CuO + H 2 = Cu + H 2 O
1mol 1mol
![]()
x mol = 0,125 mol, n(H 2 O) = 0,125 mol
m (H 2 O) = n * M (H 2 O);
m(H 2 O) = 0,125mol*18g/mol=2,25g
Jawaban: 2,25g Geser 15
Pekerjaan rumah: mempelajari materi buku teks hal. 45-47, selesaikan masalahnya
Berapa massa kalsium oksida dan berapa volume karbon dioksida (n.s.)
dapatkah diperoleh dengan menguraikan kalsium karbonat seberat 250 g?
CaCO 3 = CaO + CO Geser 16.
literatur
1. Gabrielyan O.S. Program kursus kimia untuk kelas 8-11 di lembaga pendidikan umum. M.Bustard 2006
2. Gabrielyan O.S. Kimia. kelas 8. Buku teks untuk lembaga pendidikan umum. Bustard. M.2005
3. Gorbuntsova S.V. Tes pada bagian utama kursus sekolah. kelas 8 - 9. VAKO, Moskow, 2006.
4. Gorkovenko M.Yu.Perkembangan pelajaran kimia. Ke buku teks O.S. Gabrielyan, L.S. Guzey, V.V. Sorokin, R.P. Surovtseva dan G.E. Rudzitis, F.G. Feldman. kelas 8. VAKO, Moskow, 2004.
5. Gabrielyan O.S. Kimia. Kelas 8: Tes dan tes. – M.: Bustard, 2003.
6. Radetsky A.M., Gorshkova V.P. Materi didaktik kimia untuk kelas 8-9: Panduan untuk guru. – M.: Pendidikan, 2000
Aplikasi.
Perhitungan menggunakan persamaan kimia
Algoritma tindakan.
Untuk menyelesaikan masalah perhitungan dalam kimia, Anda dapat menggunakan algoritma berikut - lakukan lima langkah:
1. Tuliskan persamaan reaksi kimia.
2. Di atas rumus zat, tuliskan besaran yang diketahui dan tidak diketahui beserta satuan besarannya (hanya untuk zat murni, tanpa pengotor). Jika menurut kondisi soal, zat yang mengandung pengotor bereaksi, maka terlebih dahulu perlu ditentukan kandungan zat murninya.
3. Di bawah rumus zat yang diketahui dan tidak diketahui, tuliskan nilai yang sesuai dari besaran yang diperoleh dari persamaan reaksi.
4. Menyusun dan menyelesaikan suatu proporsi.
5. Tuliskan jawabannya.
Hubungan antara beberapa besaran fisika dan kimia serta satuannya
Massa (m): g; kg; mg
Jumlah zat (n): mol; kmol; mmol
Massa molar (M): g/mol; kg/kmol; mg/mmol
Volume (V) : aku; m 3 /kmol; ml
Volume molar (Vm): l/mol; m 3 /kmol; ml/mmol
Jumlah partikel (N): 6 1023 (bilangan Avagadro – N A); 6 1026 ; 6 1020
Pelajaran ini dikhususkan untuk melanjutkan pembelajaran topik “Persamaan reaksi kimia”. Pembelajaran membahas tentang perhitungan paling sederhana dengan menggunakan persamaan reaksi kimia, yang berkaitan dengan perbandingan jumlah zat yang ikut serta dalam reaksi.
Topik: Ide kimia awal
Pelajaran: Persamaan Reaksi Kimia
1. Perbandingan jumlah zat yang ikut serta dalam reaksi
Koefisien dalam persamaan reaksi tidak hanya menunjukkan jumlah molekul setiap zat, tetapi juga perbandingan jumlah zat yang ikut serta dalam reaksi. Jadi, menurut persamaan reaksi: 2H2 + O2 = 2H2O - dapat dikatakan bahwa untuk membentuk sejumlah air tertentu (misalnya, 2 mol), jumlah mol zat sederhana hidrogen (2 mol) dan setengahnya sama. berapa mol zat sederhana oksigen (1 mol) yang dibutuhkan). Mari kita beri contoh perhitungan tersebut.
2. Tugas 1
TUGAS 1. Tentukan jumlah zat oksigen yang terbentuk dari penguraian 4 mol air.
ALGORITMA untuk menyelesaikan masalah:
1. Tuliskan persamaan reaksinya
2. Buatlah perbandingan dengan menentukan jumlah zat menurut persamaan reaksi dan kondisi soal (sebutkan jumlah zat yang tidak diketahui sebagai x mol).
3. Buatlah persamaan (dari proporsi).
4. Selesaikan persamaannya, cari x.
Beras. 1. Rumusan kondisi singkat dan pemecahan masalah 1
3. Tugas 2TUGAS 2. Berapa jumlah oksigen yang diperlukan untuk membakar 3 mol tembaga seluruhnya?Mari kita gunakan algoritma untuk memecahkan masalah menggunakan persamaan reaksi kimia.

Beras. 2. Rumusan kondisi singkat dan pemecahan masalah 2.
Pelajari algoritme dengan cermat dan tuliskan di buku catatan, selesaikan sendiri masalah yang diajukan
SAYA. Dengan menggunakan algoritme, selesaikan sendiri masalah berikut:
1. Hitung jumlah zat aluminium oksida yang terbentuk dari interaksi aluminium dengan sejumlah 0,27 mol zat dengan jumlah oksigen yang cukup (4Al+3O 2 =2Al2 O3 ).
2. Hitung jumlah zat natrium oksida yang terbentuk sebagai hasil interaksi natrium dengan zat sebanyak 2,3 mol dengan jumlah oksigen yang cukup(4Na+O2 =2Na2O).
Algoritma No.1
Menghitung jumlah suatu zat dari sejumlah zat yang diketahui terlibat dalam suatu reaksi.
Contoh. Hitung jumlah oksigen yang dilepaskan akibat penguraian air dengan jumlah zat 6 mol.



II. Dengan menggunakan algoritme, selesaikan sendiri masalah berikut:
1. Hitung massa belerang yang diperlukan untuk memperoleh belerang oksida (IV) dengan jumlah zat 4 mol (S + O 2
=SO2).
2. Hitung massa litium yang diperlukan untuk memperoleh litium klorida dengan jumlah zat 0,6 mol (2Li+Cl2 = 2LiCl).
Algoritma No.2
Menghitung massa suatu zat dari sejumlah zat lain yang diketahui terlibat dalam suatu reaksi.
Contoh: Hitung massa aluminium yang diperlukan untuk memperoleh aluminium oksida dengan jumlah zat 8 mol.



AKU AKU AKU. Dengan menggunakan algoritme, selesaikan sendiri masalah berikut:
1. Hitung jumlah natrium sulfida jika belerang seberat 12,8 g (2Na+S=Na2S) bereaksi dengan natrium.
2. Hitung jumlah zat tembaga yang terbentuk jika tembaga (II) oksida seberat 64 g bereaksi dengan hidrogen (CuO + H2 = Cu + H2 O).
Pelajari algoritmanya dengan cermat dan tuliskan di buku catatan Anda.
Algoritma No.3
Menghitung jumlah suatu zat dari massa zat lain yang diketahui ikut serta dalam suatu reaksi.
Contoh. Hitung jumlah tembaga (I) oksida jika tembaga seberat 19,2 g bereaksi dengan oksigen.



Pelajari algoritmanya dengan cermat dan tuliskan di buku catatan Anda.
IV. Dengan menggunakan algoritme, selesaikan sendiri masalah berikut:
1. Hitung massa oksigen yang diperlukan untuk bereaksi dengan besi seberat 112 g
(3Fe + 4O2 =Fe3 O4).
Algoritma No.4
Menghitung massa suatu zat dari massa zat lain yang diketahui ikut serta dalam reaksi
Contoh. Hitung massa oksigen yang diperlukan untuk pembakaran fosfor, seberat 0,31 g.



TUGAS UNTUK SOLUSI INDEPENDEN
1. Hitung jumlah zat aluminium oksida yang terbentuk dari interaksi aluminium dengan zat sebanyak 0,27 mol dengan jumlah oksigen yang cukup (4Al + 3O2 = 2Al2 O3).
2. Hitung jumlah zat natrium oksida yang terbentuk sebagai hasil interaksi natrium dengan zat sebanyak 2,3 mol dengan jumlah oksigen yang cukup (4Na + O2 = 2Na2 O).
3. Hitung massa belerang yang diperlukan untuk memperoleh belerang oksida (IV) dengan jumlah zat 4 mol (S+O2 =SO2).
4. Hitung massa litium yang diperlukan untuk memperoleh litium klorida dengan jumlah zat 0,6 mol (2Li+Cl2 = 2LiCl).
5. Hitung jumlah natrium sulfida jika belerang seberat 12,8 g (2Na+S=Na2S) bereaksi dengan natrium.
6. Hitung jumlah zat tembaga yang terbentuk jika tembaga (II) oksida seberat 64 g bereaksi dengan hidrogen (CuO + H2 = Cu + H2 O).
LATIHAN
Simulator No. 1 - Analisis persamaan reaksi kimia
Simulator No. 6 - Perhitungan stoikiometri
Ringkasan pelajaran “Perhitungan menggunakan persamaan kimia”
1. Memeriksa pekerjaan rumah
Sebagai pekerjaan rumah, Anda diminta untuk menempatkan koefisien dalam persamaan reaksi.Anda dapat melihat pekerjaan yang dilakukan selama istirahat. Pasti akan ada kesalahan.Apakah semuanya berhasil, apakah ada yang punya pertanyaan?Biarkan mereka berbicara tentang pengalaman rumah mereka.
2. Pengumuman topik dan pemutakhiran ilmu
Topik pelajaran hari ini adalah perhitungan menggunakan persamaan kimia. Pertama, mari kita ingat segala sesuatu yang mungkin berguna bagi kita saat ini. Kita telah menemukan persamaan kimia dalam pekerjaan laboratorium sebelumnya, dalam pekerjaan rumah, dan bahkan sebelumnya dalam topik senyawa biner. Mari kita ingat kembali definisi persamaan reaksi kimia.
(ini adalah notasi konvensional dari reaksi kimia menggunakan rumus dan koefisien kimia.)
Luar biasa.
Saat memproduksi senyawa apa pun, Anda perlu mengetahui berapa banyak bahan awal yang harus diambil untuk mendapatkan massa produk reaksi yang diperlukan. Untuk melakukan ini, buat persamaan reaksi kimia yang sedang berlangsung, dan saat menghitung massa memperhitungkan massa molar zat, dan saat menghitung volume gas memperhitungkan nilainyavolume molar gas
Siapa yang ingat nilai volume molar gas pada kondisi normal? (22,4 l/mol)
Dan apa sajakah kondisi normal tersebut? (tekanan 101,3 kPa dan suhu 0 o C)
Artinya, dalam kondisi ini, 1 mol gas APAPUN menempati volume 22,4 liter.
Sebenarnya untuk menyelesaikan soal, kita perlu mengingat beberapa besaran:
Massa molar – M (g/mol)
Jumlah zat – n (mol)
Volume – V (aku)
Lebih baik begini: Anda ingat bahwa massa molar secara numerik sama dengan massa atom relatif atau massa molekul relatif suatu zat. Untuk melakukan ini, Anda perlu menggunakan tabel periodik, di mana massa atom relatif ditunjukkan di bagian bawah setiap “sel”. Tanpa melupakan aturan pembulatan, kami menggunakan seluruh nilai massa ini dalam perhitungan.
Kimia merupakan ilmu yang sangat jelas, logis dan konsisten, oleh karena itu akan lebih mudah jika menggunakan ALGORITMA yang diberikan dalam buku teks untuk menyelesaikan masalah. Ini adalah rangkaian tindakan universal yang digunakan untuk menyelesaikan masalah apa pun jenis ini.
Silakan buka buku teksnya dan mari kita semua mengenal algoritmanya.
(di sini kita semua membuka buku teks kita bersama-sama, satu orang, mungkin saya, membaca algoritmanya, sisanya mengikuti untuk memahami apa yang harus mereka lakukan sekarang)
Kedengarannya luas, tapi saya harap ini tidak terlalu membingungkan. Mari kita coba mencari tahu dengan sebuah contoh.
Tugas 1. Untuk menghasilkan hidrogen, aluminium dilarutkan dalam asam sulfat: 2Al + 3H 2 JADI 4 → Al 2 (JADI 4 ) 3 + 3H 2 (Poin pertama dari algoritma kami). Untuk reaksinya kami mengambil 10,8 g aluminium. Hitung massa asam sulfat yang dikonsumsi.
Diberikan: m(Al) = 10,8 gram | Larutan: m=10,8 gram m - ? 2Al + 3H 2 JADI 4 → Al 2 (JADI 4 ) 3 + 3H 2 M=27g/mol M=98g/mol Di sini kita dapat menyebutkan bahwa sebenarnya, bukan 2 atom aluminium dan 3 molekul asam yang masuk ke dalam reaksi, tetapi sebagian atom aluminium dan sebagian molekul asam. Bagian ini dalam ilmu kimia disebut dengan kata pendek “mol”. n=2 mol n=3 mol m = M ∙ n m=54 gram m=294 gram Perhitungan berdasarkan proporsi: |
||||
m (H 2 JADI 4 ) - ? |
|||||
10,8 gram | |||||
54 gram | 294 gram | ||||
10,8 gram ∙ 294 gram | |||||
54 gram | |||||
X = 58,8 gram Jawaban: m (H 2 JADI 4 ) = 58,8 gram |
|||||
Itu semua solusi untuk masalah ini. Ada pertanyaan? Mari kita bahas solusinya sekali lagi:
Membuat persamaan
Di atas substansi kita tandatangani apa yang kita KETAHUI dan apa yang INGIN kita TEMUKAN
Berdasarkan rumus kami menuliskan massa molar, jumlah zat danstoikiometri massa zat ( lebih baik menunjukkan "massa menurut tabel periodik")
Membuat proporsi
Memecahkan proporsinya
Merekam jawabannya
Mari kita selesaikan soal serupa, tetapi dengan zat gas (di sini kita tidak akan menggunakan massa molar zat tersebut, tapi apa?...volume molar)
Soal 2. 25 gram seng dilarutkan dalam asam klorida, selama reaksi kimia gas dilepaskan - hidrogen. Hitung volume hidrogen yang dilepaskan.
Diberikan: m(Zn) = 10,8 gram | Larutan: m=25 gram V - ? Zn + 2HCl → ZnCl 2 + H 2 M=65 g/mol V m=22,4 l/mol n=1 mol n=1 mol m=65 gram V=22,4 liter Perhitungan berdasarkan proporsi: |
||||
m(HCl) - ? |
|||||
25 gram | |||||
65 gram | 22,4 liter | ||||
25 gram ∙ 22,4 liter | |||||
65 gram | |||||
X = 8,61 liter Jawaban: V(H 2 ) = 8,61 liter |
|||||
Mari kita periksa bagaimana Anda menguasai materi. Dengan menggunakan algoritma yang sama, selesaikan masalahnya:
BUKAN FAKTA BAHWA ANDA AKAN SUKSES:
Saat bereaksi dengan menggunakan batubara oksida Fe2O3 (pilihan pertama) dan SnO2 (pilihan kedua) masing-masing mendapat 20 g Fe dan Sn. Berapa gram setiap oksida yang diambil?
Harap dicatat bahwa kami sekarang menghitung massa zat awal, bukan produk reaksi)
(biarkan semua orang menyelesaikannya di buku catatan dan secara selektif minta mereka menunjukkan solusinya, kita akan menuliskan persamaannya bersama-sama di papan tulis, dan semua orang akan mencoba menyelesaikannya sendiri)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 gram
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 gram
Pekerjaan rumah: mempelajari materi buku teks hal. 146-150, selesaikan masalahnya
Berapa massa kalsium oksida dan berapa volume karbon dioksida (n.s.)
dapatkah diperoleh dengan menguraikan kalsium karbonat seberat 250 g?HARUS DIBERIKAN KEPADA ANAK SEKOLAHPERSAMAAN SIAPUNTUK MENYELESAIKAN TUGAS INI
Pengembangan pelajaran metodologis (2 jam)
Perhitungan menggunakan persamaan kimia
Khapugina Polina Ivanovna,
guru kimia sekolah menengah GBOU 277
Distrik Kirovsky di St
Tujuan pelajaran: Ajari siswa kelas VIII membuat perhitungan menggunakan persamaan kimia: temukan jumlah, massa dan volume produk reaksi dari jumlah, volume dan massa zat awal.
Selama kelas:
Sebelum melanjutkan mempelajari topik baru, kita perlu mengingat besaran dan rumus yang sudah kita ketahui. Ingat jenis reaksi kimia. Dan Anda sudah mengetahui cara membuat persamaan kimia dan menyamakannya. Mari uji pengetahuan Anda dengan melakukan hal berikut: tes penilaian.(isi tesnya bisa dilihat di website pribadi saya di folder file dan foto)
Penjelasan guru:
1. Sebelum mempelajari cara menghitung menggunakan persamaan kimia, perlu diingat kembali rumus-rumus yang telah kita ketahui untuk mencari jumlah suatu zat, massa dan volume suatu zat, dalam satu langkah Anda dapat menguji diri sendiri setelah usaha yang telah Anda lakukan. . Untuk melakukan hal ini, mari kita beralih ke presentasi berikut, yang akan membantu mengembalikan pengetahuan kita dalam memori. Presentasi No.1.
Tuliskan rumus-rumus yang sudah anda ketahui di buku catatan anda:
n- jumlah zat (mol)
m- massa zat (g)
M - massa molar (g/mol)
V - volume gas (l)
V m - volume molar = 22,4 l/mol
n = m/M ; m = n.M
n = V/Vm; V = n.V m
2. Sekarang, kita harus memahami bahwa persamaan kimia tidak hanya menunjukkan sisi kualitatif (transformasi zat) dari suatu proses, tetapi juga sisi kuantitatifnya. Untuk melakukan ini, mari kita beralih ke yang berikut ini Presentasi#2(presentasi dapat dilihat di website pribadi saya di folder file dan foto)
Tulis di buku catatanmu:
Koefisien dalam persamaan reaksi menunjukkan jumlah partikel, dan jumlah partikel menentukan jumlah mol!
2 jam₂ + HAI₂ = 2 jam₂ TENTANG
Jumlah partikel 2 molekul 1 molekul 2 molekul
Kuantitas ↓ ↓ ↓
zat,N2 mol 1 mol 2 mol
2 Fe(OH)3 = Fe2 HAI3 + 3 H2 HAI
↓ ↓ ↓
N= 2mol 1mol 3mol
3. Tahap selanjutnya yang harus kita kuasai adalah kemampuan membuat perbandingan menggunakan persamaan reaksi, serta menyelesaikannya. Untuk melakukan ini, mari kita beralih ke yang berikut ini Presentasi 3.(presentasi dapat dilihat di website pribadi saya di folder file dan foto)
Tulis di buku catatanmu:
Dikenal dengan syarat: 2 mol X mol (pembilang)
4P+5O₂ = 2P₂ HAI₅
Dikenal dengan persamaan: 4 mol 5 mol 2 mol (penyebut)
Mari kita buat dan selesaikan proporsinya:
2 mol X mol
_______ = _______
4 mol 2 mol
X mol = 2 mol. 2 mol= 1 mol
4 mol
X =N(P₂ HAI₅ )= 1 mol
4. Mari kita beralih ke penyelesaian masalah menggunakan persamaan reaksi kimia. Untuk menyelesaikan masalah perhitungan dalam kimia, Anda perlu menggunakan algoritma berikut - lakukan lima langkah. Presentasi 4. (presentasi dapat dilihat di website pribadi saya di folder file dan foto) Buku Ajar hal.101
Di buku catatanmu:
Siswa diberikan algoritma solusi siap pakai untuk ditempelkan ke buku catatan mereka.
Algoritma penyelesaian masalah perhitungan menggunakan persamaan reaksi kimia:
1. Buatlah persamaan reaksi kimia (yaitu, pastikan untuk menetapkan koefisiennya!)
2. Di atas rumus-rumus persamaan yang sesuai, tuliskan data kuantitatif zat dengan satuan ukur yang diketahui atau dapat dihitung berdasarkan kondisi soal, dan nilai X yang diinginkan juga dengan satuan ukur.
3. Berdasarkan rumus ini, tuliskan besaran kuantitatif yang sesuai yang ditentukan oleh persamaan itu sendiri, juga dengan satuan pengukuran.
4. Menyusun dan menyelesaikan suatu proporsi.
5. Formalisasikan jawabannya.
5. Mari kita selesaikan masalahnya.
Hitung massa air yang terbentuk akibat interaksi 0,5 mol aluminium oksida dengan asam sulfat bila dipanaskan.
Baca masalahnya.
Tuliskan pernyataan masalahnya. (Diberikan, temukan.)
Di buku catatanmu: (siswa menuliskan penyelesaiannya sesuai penjelasan guru sesuai Presentasi 5 ) (presentasi dapat dilihat di website pribadi saya di folder file dan foto)
Diberikan:
n(Al₂O₃)=0,5 mol
_________________
Menemukan:
Larutan:
N=0,5 mol X mol
Al₂ HAI₃ +3 H₂ JADI₄ = Al₂ (JADI₄ ) ₃ +3 H₂ HAI
N= 1 mol 3 mol
M = 102 g/mol 18 g/mol
Perhitungan berat molekul:
Mr(Al₂O₃)= 2,27+3,16= 54+48=102
Mr(H₂O)= 2,1+16=18
Menyusun dan menyelesaikan suatu proporsi.
0,5 mol = X tahi lalat
1 mol 3 mol
X mol =N(H₂ HAI) = 0,5 mol. 3 mol= 1,5 mol
1 tahi lalat
Mari kita cari massa air.
M(H₂ HAI) = N(H₂ HAI) . M(H₂ HAI)
M(H₂ HAI) = 1,5 mol.18 g/mol = 27 g
Menjawab:M(H₂ HAI)=27 gram
6. Selesaikan masalahnya sendiri.
Dua siswa dipanggil ke dewan untuk penilaian.
1. Tentukan volume klorin (no.) yang diperlukan untuk memperoleh 634 g aluminium klorida menurut persamaan: 2Al + 3Cl 2 = 2AlCl 3. Jawaban: 159,6 liter
2. Hitung jumlah zat dan massa litium yang diperlukan untuk reaksi dengan oksigen seberat 128 g menurut persamaan: 4Li + O 2 = 2Li 2 O Jawaban: 16 mol, 112 gram
7. Pekerjaan rumah.
Tugas.
Temukan massa seng oksida, yang terbentuk ketika 13 g seng bereaksi dengan oksigen.