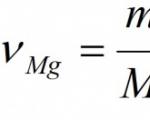Beräkningar med kemiska ekvationer. Beräkningar med kemiska ekvationer Arbete 6 beräkningar med kemiska reaktionsekvationer
Stökiometri- kvantitativa samband mellan reagerande ämnen.
Om reagenser ingår i en kemisk interaktion i strikt definierade mängder och som ett resultat av reaktionen bildas ämnen, vars mängd kan beräknas, kallas sådana reaktioner stökiometrisk.
Stökiometrins lagar:
Koefficienterna i kemiska ekvationer före formlerna för kemiska föreningar kallas stökiometrisk.
Alla beräkningar med kemiska ekvationer är baserade på användningen av stökiometriska koefficienter och är förknippade med att hitta mängder av ett ämne (antal mol).
Mängden ämne i reaktionsekvationen (antal mol) = koefficienten framför motsvarande molekyl.
N A=6,02x1023 mol -1.
η - förhållandet mellan produktens faktiska massa m sid till ett teoretiskt möjligt m t, uttryckt i bråkdelar av en enhet eller i procent.
Om utbytet av reaktionsprodukter inte anges i tillståndet, tas det i beräkningarna lika med 100% (kvantitativt utbyte).
Beräkningsschema med kemiska reaktionsekvationer:
- Skriv en ekvation för en kemisk reaktion.
- Ovanför de kemiska formlerna för ämnen skriv kända och okända storheter med måttenheter.
- Under de kemiska formlerna för ämnen med kända och okända, skriv ner motsvarande värden för dessa kvantiteter från reaktionsekvationen.
- Komponera och lös en proportion.
Exempel. Beräkna massan och mängden magnesiumoxid som bildas vid fullständig förbränning av 24 g magnesium.
|
Given: m(Mg) = 24 g Hitta: ν (MgO) m (MgO) |
Lösning: 1. Låt oss skapa en ekvation för en kemisk reaktion: 2Mg + O2 = 2MgO. 2. Under ämnesformlerna anger vi mängden ämne (antal mol) som motsvarar de stökiometriska koefficienterna: 2Mg + O2 = 2MgO 2 mol 2 mol 3. Bestäm den molära massan av magnesium: Relativ atommassa av magnesium Ar (Mg) = 24. Därför att molmassavärdet är alltså lika med den relativa atom- eller molekylmassan M (Mg)= 24 g/mol. 4. Med hjälp av massan av ämnet som anges i villkoret, beräknar vi mängden av ämnet:
5. Över den kemiska formeln för magnesiumoxid MgO, vars massa är okänd, sätter vi xmol, ovanför magnesiumformeln Mg vi skriver dess molära massa: 1 mol xmol 2Mg + O2 = 2MgO 2 mol 2 mol
Enligt reglerna för att lösa proportioner:
Mängden magnesiumoxid ν (MgO)= 1 mol. 7. Beräkna molmassan av magnesiumoxid: M (Mg)=24 g/mol, M(O)=16 g/mol. M(MgO)= 24 + 16 = 40 g/mol. Vi beräknar massan av magnesiumoxid: m (MgO) = ν (MgO) × M (MgO) = 1 mol × 40 g/mol = 40 g. Svar: v (MgO) = 1 mol; m (MgO) = 40 g. |
Vad du än studerar, du
du studerar själv.
Petronius
Lektionens mål:
- introducera eleverna för de grundläggande sätten att lösa problem med kemiska ekvationer:
- hitta mängden, massan och volymen av reaktionsprodukter från mängden, massan eller volymen av utgångsämnen,
- fortsätta utveckla färdigheter i att arbeta med texten till ett problem, förmågan att resonerat välja metod för att lösa ett pedagogiskt problem och förmågan att sammanställa ekvationer av kemiska reaktioner.
- utveckla förmågan att analysera, jämföra, lyfta fram det viktigaste, upprätta en handlingsplan och dra slutsatser.
- odla tolerans mot andra, självständighet i beslutsfattande och förmåga att objektivt utvärdera resultatet av sitt arbete.
Arbetsformer: frontal, individuell, par, grupp.
Lektionstyp: kombinerat med användning av IKT
I Organisatoriskt ögonblick.
Hej grabbar. Idag kommer vi att lära oss hur man löser problem med hjälp av ekvationer av kemiska reaktioner. Bild 1 (se presentation).
Lektionens mål Bild 2.
II.Uppdatering av kunskaper, färdigheter och förmågor.
Kemi är en mycket intressant och samtidigt komplex vetenskap. För att kunna och förstå kemi måste du inte bara tillgodogöra dig materialet, utan också kunna tillämpa den inhämtade kunskapen. Du lärde dig vilka tecken som tyder på förekomsten av kemiska reaktioner, lärde dig hur man skriver ekvationer för kemiska reaktioner. Jag hoppas att du har en god förståelse för dessa ämnen och kan svara på mina frågor utan svårighet.
Vilket fenomen är inte ett tecken på kemiska omvandlingar:
a) utseendet på sediment; c) förändring i volym;
b) gasutsläpp; d) uppkomsten av en lukt. Bild 3
Vänligen ange med siffror:
a) ekvationer av sammansatta reaktioner
b) ekvationer av substitutionsreaktioner
c) ekvationer för sönderdelningsreaktioner Bild 4
För att lära sig att lösa problem är det nödvändigt att skapa en handlingsalgoritm, d.v.s. bestämma sekvensen av åtgärder.
Algoritm för beräkningar med kemiska ekvationer (på varje elevs skrivbord)
5. Skriv ner svaret.
Låt oss börja lösa problem med hjälp av en algoritm
Beräkna massan av ett ämne från den kända massan av ett annat ämne som deltar i reaktionen
Beräkna mängden syre som frigörs till följd av nedbrytning
portioner vatten som väger 9 g.
Låt oss hitta molmassan av vatten och syre:
M(H2O) = 18 g/mol
M(02) = 32 g/mol Bild 6
Låt oss skriva ekvationen för den kemiska reaktionen:
2H2O = 2H2 + O2
Ovanför formeln i reaktionsekvationen skriver vi vad vi hittade
värdet av mängden av ett ämne, och under formlerna för ämnen -
stökiometriska förhållanden visas
kemisk ekvation
0,5 mol x mol
2H2O = 2H2 + O2
2mol 1mol
Låt oss beräkna mängden ämne vars massa vi vill hitta.
För att göra detta skapar vi en proportion
0,5 mol = hopmol
2mol 1mol
där x = 0,25 mol Bild 7
Därför är n(O2) = 0,25 mol
Hitta massan av ämnet som behöver beräknas
m(O2)= n(O2)*M(O2)
m(02) = 0,25 mol 32 g/mol = 8 g
Låt oss skriva ner svaret
Svar: m(O 2) = 8 g Bild 8
Beräkna volymen av ett ämne från den kända massan av ett annat ämne som deltar i reaktionen
Beräkna volymen syre (antal) som frigörs till följd av nedbrytningen av en del vatten som väger 9 g.

V(0 2)=?l(n.s.)
M(H2O) = 18 g/mol
Vm=22,4l/mol Bild 9
Låt oss skriva ner reaktionsekvationen. Låt oss ordna koefficienterna
2H2O = 2H2 + O2
Ovanför formeln i reaktionsekvationen skriver vi det funna värdet för mängden av ämnet, och under formlerna för ämnena - de stökiometriska förhållanden som visas av den kemiska ekvationen
0,5 mol - x mol
2H2O = 2H2 + O2 Bild 10
2mol - 1mol
Låt oss beräkna mängden ämne vars massa vi vill hitta. För att göra detta, låt oss skapa en proportion
![]()
där x = 0,25 mol
Låt oss hitta volymen av ämnet som behöver beräknas
V(02)=n(02) Vm
V(O2) = 0,25 mol 22,4 l/mol = 5,6 l (antal)
Svar: 5,6 l Bild 11
III. Konsolidering av det studerade materialet.
Uppgifter för oberoende lösning:
1. Vid reducering av oxiderna Fe 2 O 3 och SnO 2 med kol erhölls 20 g Fe och Sn. Hur många gram av varje oxid togs?
2.I så fall bildas mer vatten:
a) när man reducerar 10 g koppar(I)oxid (Cu 2 O) med väte eller
b) när man reducerar 10 g koppar(II)oxid (CuO) med väte? Bild 12
Låt oss kolla lösningen på problem 1

M(Fe2O3)=160 g/mol
M(Fe)=56g/mol, ![]()
m(Fe2O3)=, m(Fe2O3)=0,18*160=28,6g
Svar: 28,6g
Bild 13
Låt oss kolla lösningen på problem 2

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mol,
n(H2O)=0,07 mol
m(H2O) = 0,07mol*18g/mol=1,26g
Bild 14
CuO + H2 = Cu + H2O
n(CuO) = m/ M(CuO)
n(CuO) = 10 g/80 g/mol = 0,125 mol
0,125 mol humle
CuO + H2 = Cu + H2O
1 mol 1 mol
![]()
x mol = 0,125 mol, n(H2O) = 0,125 mol
m (H2O) = n*M (H2O);
m(H2O) = 0,125mol*18g/mol=2,25g
Svar: 2,25g Bild 15
Läxor: studera läroboksmaterialet sid. 45-47, lös problemet
Vad är massan av kalciumoxid och vad är volymen koldioxid (n.s.)
kan erhållas genom att sönderdela kalciumkarbonat som väger 250 g?
CaCO3 = CaO + CO Bild 16.
Litteratur
1. Gabrielyan O.S. Kemikursprogram för årskurs 8-11 vid allmänna läroanstalter. M. Bustard 2006
2. Gabrielyan O.S. Kemi. 8: e klass. Lärobok för allmänna läroanstalter. Bustard. M. 2005
3. Gorbuntsova S.V. Prov på skolkursens huvuddelar. 8:e - 9:e klasserna. VAKO, Moskva, 2006.
4. Gorkovenko M.Yu Lektionsutveckling i kemi. Till läroböckerna av O.S. Gabrielyan, L.S. Guzey, V.V. Sorokin, R.P. Surovtseva och G.E. Rudzitis, F.G. Feldman. 8:e klass. VAKO, Moskva, 2004.
5. Gabrielyan O.S. Kemi. Betyg 8: Prov och prov. – M.: Bustard, 2003.
6. Radetsky A.M., Gorshkova V.P. Didaktiskt material om kemi för årskurs 8-9: En manual för lärare. – M.: Utbildning, 2000
Ansökan.
Beräkningar med kemiska ekvationer
Algoritm för åtgärder.
För att lösa ett beräkningsproblem i kemi kan du använda följande algoritm - ta fem steg:
1. Skriv en ekvation för en kemisk reaktion.
2. Ovanför formlerna för ämnen, skriv kända och okända storheter med motsvarande måttenheter (endast för rena ämnen, utan föroreningar). Om, enligt villkoren för problemet, ämnen som innehåller föroreningar inträder i en reaktion, måste du först bestämma innehållet i det rena ämnet.
3. Under formlerna för ämnen med kända och okända, skriv ner motsvarande värden för dessa kvantiteter från reaktionsekvationen.
4. Komponera och lös en proportion.
5. Skriv ner svaret.
Sambandet mellan vissa fysikaliska och kemiska storheter och deras enheter
Massa (m): g; kg; mg
Mängd ämnen (n): mullvad; kmol; mmol
Molmassa (M): g/mol; kg/kmol; mg/mmol
Volym (V): 1; m3/kmol; ml
Molar volym (Vm): l/mol; m3/kmol; ml/mmol
Antal partiklar (N): 6 1023 (Avagadro-tal – N A); 6 1026; 6 1020
Lektionen ägnas åt att fortsätta studiet av ämnet "Ekvation för en kemisk reaktion." Lektionen diskuterar de enklaste beräkningarna med hjälp av ekvationen för en kemisk reaktion, relaterad till förhållandet mellan mängderna av ämnen som deltar i reaktionen.
Ämne: Inledande kemiska idéer
Lektion: Kemisk reaktionsekvation
1. Förhållandet mellan mängderna av ämnen som deltar i reaktionen
Koefficienterna i reaktionsekvationen visar inte bara antalet molekyler av varje ämne, utan också förhållandet mellan mängderna av ämnen som deltar i reaktionen. Således, enligt reaktionsekvationen: 2H2 + O2 = 2H2O - det kan hävdas att för att bilda en viss mängd vatten (till exempel 2 mol), samma antal mol av det enkla ämnet väte (2 mol) och hälften så många mol av det enkla ämnet syre (1 mol) behövs ). Låt oss ge exempel på sådana beräkningar.
2. Uppgift 1
UPPGIFT 1. Låt oss bestämma mängden syreämne som bildas till följd av nedbrytningen av 4 mol vatten.
ALGORITM för att lösa problemet:
1. Skriv ner reaktionsekvationen
2. Gör en proportion genom att bestämma mängderna av ämnen enligt reaktionsekvationen och enligt villkoren för problemet (beteckna den okända ämnesmängden som x mol).
3. Gör en ekvation (från proportion).
4. Lös ekvationen, hitta x.
Ris. 1. Formulering av ett kortfattat tillstånd och lösning på problem 1
3. Uppgift 2UPPGIFT 2. Hur mycket syre krävs för att helt förbränna 3 mol koppar?Låt oss använda en algoritm för att lösa problem med hjälp av ekvationen för en kemisk reaktion.

Ris. 2. Formulering av ett kortfattat tillstånd och lösning på problem 2.
Studera noggrant algoritmerna och skriv ner dem i en anteckningsbok, lös de föreslagna problemen själv
jag. Använd algoritmen för att lösa följande problem själv:
1. Beräkna mängden aluminiumoxidämne som bildas som ett resultat av växelverkan mellan aluminium och en mängd av 0,27 mol ämne med en tillräcklig mängd syre (4Al +3O 2 = 2Al203).
2. Beräkna mängden natriumoxidämne som bildas som ett resultat av växelverkan mellan natrium och en 2,3 mol mängd ämne med tillräcklig mängd syre(4Na+02=2Na2O).
Algoritm nr 1
Beräkna mängden av ett ämne från en känd mängd av ämnet som är involverat i en reaktion.
Exempel. Beräkna mängden syre som frigörs till följd av nedbrytningen av vatten med en ämnesmängd på 6 mol.



II. Använd algoritmen för att lösa följande problem själv:
1. Beräkna massan svavel som krävs för att erhålla svaveloxid (IV) med en ämnesmängd på 4 mol (S + O 2
=SO2).
2. Beräkna massan litium som krävs för att erhålla litiumklorid med en substansmängd på 0,6 mol (2Li+Cl2 = 2LiCl).
Algoritm nr 2
Beräkna massan av ett ämne från en känd mängd av ett annat ämne som är involverat i en reaktion.
Exempel: Beräkna vikten av aluminium som krävs för att erhålla aluminiumoxid med en ämnesmängd på 8 mol.



III. Använd algoritmen för att lösa följande problem själv:
1. Beräkna mängden natriumsulfid om svavel som väger 12,8 g (2Na+S=Na2S) reagerar med natrium.
2. Beräkna mängden kopparämne som bildas om koppar(II)oxid som väger 64 g reagerar med väte (CuO + H2 = Cu + H2 O).
Studera algoritmen noggrant och skriv ner den i din anteckningsbok.
Algoritm nr 3
Beräkna mängden av ett ämne från den kända massan av ett annat ämne som är involverat i en reaktion.
Exempel. Beräkna mängden koppar(I)oxid om koppar som väger 19,2 g reagerar med syre.



Studera algoritmen noggrant och skriv ner den i din anteckningsbok.
IV. Använd algoritmen för att lösa följande problem själv:
1. Beräkna mängden syre som krävs för att reagera med järn som väger 112 g
(3Fe + 4O2 =Fe304).
Algoritm nr 4
Beräkna massan av ett ämne från den kända massan av ett annat ämne som deltar i reaktionen
Exempel. Beräkna mängden syre som krävs för förbränning av fosfor, som väger 0,31 g.



UPPGIFTER FÖR OBEROENDE LÖSNING
1. Beräkna mängden aluminiumoxidämne som bildas som ett resultat av växelverkan mellan aluminium och en 0,27 mol mängd ämne med tillräcklig mängd syre (4Al + 3O2 = 2Al2 O3).
2. Beräkna mängden natriumoxidämne som bildas som ett resultat av växelverkan mellan natrium och en 2,3 mol mängd ämne med tillräcklig mängd syre (4Na + O2 = 2Na2 O).
3. Beräkna massan svavel som krävs för att erhålla svaveloxid (IV) med en ämnesmängd på 4 mol (S+O2 =SO2).
4. Beräkna massan litium som krävs för att erhålla litiumklorid med en ämnesmängd på 0,6 mol (2Li+Cl2 = 2LiCl).
5. Beräkna mängden natriumsulfid om svavel som väger 12,8 g (2Na+S=Na2S) reagerar med natrium.
6. Beräkna mängden kopparämne som bildas om koppar(II)oxid som väger 64 g reagerar med väte (CuO + H2 = Cu + H2 O).
ÖVNINGAR
Simulator nr 1 - Analys av den kemiska reaktionsekvationen
Simulator nr 6 - Stökiometriska beräkningar
Lektionssammanfattning "Beräkningar med kemiska ekvationer"
1. Kontrollera läxor
Som läxa blev du ombedd att placera koefficienter i reaktionsekvationer.Du kan se arbetet som utförs under pausen. Det kommer säkert att bli misstag.Har allt löst sig, är det någon som har några frågor?Låt dem berätta om sin hemupplevelse.
2. Tillkännagivande av ämne och uppdatering av kunskap
Ämnet för dagens lektion är beräkningar med kemiska ekvationer. Låt oss först komma ihåg allt som kan vara användbart för oss idag. Vi har redan stött på kemiska ekvationer i tidigare laborationer, i läxor och ännu tidigare i ämnet binära föreningar. Låt oss komma ihåg definitionen av ekvationen för en kemisk reaktion.
(detta är en konventionell notation av en kemisk reaktion med kemiska formler och koefficienter.)
Fantastisk.
När du tillverkar några föreningar måste du veta hur mycket utgångsmaterial som ska tas för att erhålla den erforderliga massan av reaktionsprodukten. För att göra detta, skapa en ekvation för den pågående kemiska reaktionen och vid beräkning massor tar hänsyn till molära massor ämnen, och vid beräkning volymer av gaser ta hänsyn till värdetmolar volym gaser
Vem kommer ihåg värdet på den molära volymen av gaser under normala förhållanden? (22,4 l/mol)
Och vilka är dessa normala förhållanden? (tryck 101,3 kPa och temperatur 0 o C)
Det vill säga, under dessa förhållanden upptar 1 mol ALLA gas en volym på 22,4 liter.
För att lösa problem måste vi faktiskt komma ihåg flera kvantiteter:
Molmassa – M (g/mol)
Mängd ämne – n (mol)
Volym – V (l)
Det är bättre så här: du kommer ihåg att molmassan numeriskt är lika med den relativa atommassan eller relativa molekylmassan för ett ämne. För att göra detta måste du använda det periodiska systemet, där den relativa atommassan anges längst ner på varje "cell". För att inte glömma avrundningsreglerna använder vi hela värdet av denna massa i beräkningar.
Kemi är en mycket tydlig, logisk och konsekvent vetenskap, därför kommer det att vara bekvämt att använda ALGORITMEN, som ges i läroboken, för att lösa problem. Detta är en universell sekvens av åtgärder som används för att lösa alla problem av denna typ.
Öppna läroboken och låt oss alla bekanta oss med algoritmen.
(här öppnar vi alla våra läroböcker tillsammans, en person, kanske jag, läser algoritmen, resten följer för att förstå vad de måste göra nu)
Det låter omfattande, men jag hoppas att det inte är för förvirrande. Låt oss försöka lista ut det med ett exempel.
Uppgift 1. För att producera väte löses aluminium i svavelsyra: 2Al + 3H 2SO4 → Al2(SO4)3 + 3H2 (Den första punkten i vår algoritm). För reaktionen tog vi 10,8 g aluminium. Beräkna massan svavelsyra som förbrukas.
Given: m(Al) = 10,8 g | Lösning: m=10,8 g m - ? 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 M=27g/mol M=98g/mol Här kan vi nämna att faktiskt inte 2 aluminiumatomer och 3 syramolekyler går in i reaktionen, utan en del aluminiumatomer och en del syramolekyler. Denna del i kemi kallas det korta ordet "mullvad". n=2 mol n=3 mol m = M ∙ n m=54 g m=294 g Beräkning efter proportion: |
||||
m (H2SO4) -? |
|||||
10,8 g | |||||
54 g | 294 g | ||||
10,8 g ∙ 294 g | |||||
54 g | |||||
X = 58,8 g Svar: m (H 2 SO 4 ) = 58,8 g |
|||||
Det är hela lösningen på problemet. Har frågor? Låt oss prata om lösningen en gång till:
Gjorde en ekvation
Ovanför ämnena skrev vi på vad vi VET och vad vi VILL FINNA
Under formlerna skrev vi ner molmassan, mängden ämne ochstökiometrisk massan av ämnet ( det är bättre att ange "massa enligt det periodiska systemet")
Utgjorde en proportion
Löste proportionen
Spelade in svaret
Låt oss lösa ett liknande problem, men med gasformiga ämnen (här kommer vi inte att använda ämnets molära massa, men vad?...molar volym)
Uppgift 2. 25 gram zink löses i saltsyra, under den kemiska reaktionen frigörs en gas - väte. Beräkna volymen väte som frigörs.
Given: m(Zn) = 10,8 g | Lösning: m=25 g V-? Zn + 2HCl → ZnCl2 + H2 M=65 g/mol V m=22,4 l/mol n=1 mol n=1 mol m=65 g V=22,4 l Beräkning efter proportion: |
||||
m(HCl)-? |
|||||
25 g | |||||
65 g | 22,4 l | ||||
25 g ∙ 22,4 l | |||||
65 g | |||||
X = 8,61 1 Svar: V(H 2 ) = 8,61 l |
|||||
Låt oss kolla hur du har bemästrat materialet. Använd samma algoritm för att lösa problemet:
DET ÄR INTE ETT FAKTUM ATT DU KOMMER ATT LYCKAS:
När man reagerar med med användning av koloxider Fe2O3 (första alternativet) och SnO2 (andra alternativet) fick vardera 20 g Fe och Sn. Hur många gram av varje oxid togs?
Observera att vi nu beräknar massan av utgångsämnena, inte reaktionsprodukterna)
(låt alla lösa det i en anteckningsbok och be dem selektivt visa lösningen, vi kommer att skriva ekvationen tillsammans på tavlan, och alla kommer att försöka lösa det själva)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 g
Läxor: studera läroboksmaterialet sid. 146-150, lös problemet
Vad är massan av kalciumoxid och vad är volymen koldioxid (n.s.)
kan erhållas genom att sönderdela kalciumkarbonat som väger 250 g?BÖR GE TILL SKOLBARNFÄRDIG EKVATIONFÖR ATT SLUTFÖRA DENNA UPPGIFT
Metodologisk lektionsutveckling (2 timmar)
Beräkningar med kemiska ekvationer
Khapugina Polina Ivanovna,
kemilärare GBOU gymnasieskola 277
Kirovsky-distriktet i St Petersburg
Lektionens mål: Lär åttondeklassare att göra beräkningar med hjälp av kemiska ekvationer: ta reda på mängden, massan och volymen av reaktionsprodukter från mängden, volymen och massan av utgångsämnena.
Under lektionerna:
Innan vi går vidare till att studera ett nytt ämne måste vi komma ihåg de kvantiteter och formler du redan känner till. Kom ihåg vilka typer av kemiska reaktioner. Och du vet redan hur man skapar kemiska ekvationer och utjämnar dem. Låt oss testa dina kunskaper genom att göra följande: bedömningsprov.(innehållet i testet kan ses på min personliga webbplats i mappen filer och bilder)
Lärarens förklaring:
1. Innan du lär dig att göra beräkningar med kemiska ekvationer måste du återigen komma ihåg formlerna vi redan känner till för att hitta mängden av ett ämne, massa och volym av ämnen, i ett steg kan du testa dig själv efter det arbete du har gjort . För att göra detta, låt oss vända oss till följande presentation, som hjälper till att återställa vår kunskap i minnet. Presentation nr 1.
Skriv ner formlerna du redan känner till i din anteckningsbok:
n- mängd ämne (mol)
m- massa av ämne (g)
M - molmassa (g/mol)
V - gasvolym (l)
V m - molvolym = 22,4 l/mol
n = m/M; m = n.M
n = V/Vm; V = n.V m
2. Nu måste vi förstå att en kemisk ekvation visar inte bara den kvalitativa (omvandlingen av ämnen) sidan av processen, utan också den kvantitativa sidan av den. För att göra detta, låt oss gå till följande Presentationer #2(presentationen kan ses på min personliga hemsida i mappen filer och bilder)
Skriv i din anteckningsbok:
Koefficienten i reaktionsekvationen anger antalet partiklar, och antalet partiklar i sin tur bestämmer antalet mol!
2H₂ + O₂ = 2H₂ HANDLA OM
Antal partiklar 2 molekyler 1 molekyler 2 molekyler
Kvantitet ↓ ↓ ↓
ämnen,n2 mol 1 mol 2 mol
2 Fe(ÅH)3 = Fe2 O3 + 3 H2 O
↓ ↓ ↓
n= 2mol 1mol 3mol
3. Nästa steg som vi måste undersöka är förmågan att skapa en proportion med hjälp av reaktionsekvationen, samt lösa den. För att göra detta, låt oss gå till följande Presentationer 3.(presentationen kan ses på min personliga hemsida i mappen filer och bilder)
Skriv i din anteckningsbok:
Känd under tillståndet: 2 mol X mol (täljare)
4P+5O₂ = 2P₂ O₅
Känd genom ekvationen: 4 mol 5 mol 2 mol (nämnare)
Låt oss komponera och lösa proportionen:
2 mol X mol
_______ = _______
4 mol 2 mol
X mol = 2 mol. 2 mol= 1 mol
4 mol
X =n(P₂ O₅ )= 1 mol
4. Låt oss gå vidare till att lösa problem med hjälp av ekvationer för kemiska reaktioner. För att lösa ett beräkningsproblem i kemi måste du använda följande algoritm - ta fem steg. Presentation 4. (presentationen kan ses på min personliga hemsida i mappen filer och bilder) Lärobok s. 101
I din anteckningsbok:
Eleverna får en färdig lösningsalgoritm att klistra in i sina anteckningsböcker.
Algoritm för att lösa beräkningsproblem med kemiska reaktionsekvationer:
1. Skapa en ekvation för en kemisk reaktion (dvs. var noga med att ställa in koefficienterna!)
2. Ovanför motsvarande formler i ekvationen, skriv ner kvantitativa data om ämnen med måttenheter som är kända eller kan beräknas utifrån problemets förutsättningar, och önskat värde X även med måttenheter.
3. Under dessa formler, skriv ner motsvarande kvantitativa storheter som anges av ekvationen själv, även med måttenheter.
4. Komponera och lös en proportion.
5. Formalisera svaret.
5. Låt oss lösa problemet.
Beräkna massan av vatten som bildas som ett resultat av interaktionen av 0,5 mol aluminiumoxid med svavelsyra vid upphettning.
Läs problemet.
Skriv ner problemformuleringen. (Ges, hitta.)
I din anteckningsbok: (eleverna skriver ner lösningen enligt lärarens förklaringar enligt Presentationer 5 ) (presentationen kan ses på min personliga hemsida i mappen filer och bilder)
Given:
n(Al2O3)=0,5 mol
_________________
Hitta:
Lösning:
n= 0,5 mol X mol
Al₂ O₃ +3 H₂ SÅ₄ = Al₂ (SÅ₄ ) ₃ +3 H₂ O
n= 1 mol 3 mol
M = 102 g/mol 18 g/mol
Beräkning av molekylvikt:
Мr(Al2O3)= 2,27+3,16= 54+48=102
Мr(H2O)=2,1+16=18
Komponera och lös en proportion.
0,5 mol = X mol
1 mol 3 mol
X mol =n(H₂ O) = 0,5 mol. 3 mol= 1,5 mol
1 mol
Låt oss hitta massan av vatten.
m(H₂ O) = n(H₂ O) . M(H₂ O)
m(H₂ O) = 1,5 mol.18 g/mol = 27 g
Svar:m(H₂ O)=27 g
6. Lös problem själv.
Två elever kallas till nämnden för bedömning.
1. Bestäm volymen klor (antal) som krävs för att få 634 g aluminiumklorid enligt ekvationen: 2Al + 3Cl 2 = 2AlCl 3. Svar: 159,6 l
2. Beräkna mängden ämne och massa litium som krävs för reaktionen med syre som väger 128 g enligt ekvationen: 4Li + O 2 = 2Li 2 O Svar: 16 mol, 112 g
7. Läxor.
Uppgift.
Hitta massan av zinkoxid, som bildas genom växelverkan mellan 13 g zink och syre.