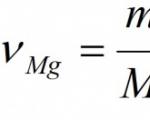Kimyasal denklemleri kullanarak hesaplamalar. Kimyasal denklemleri kullanan hesaplamalar Kimyasal reaksiyon denklemlerini kullanan 6 hesaplama
Stokiyometri- reaksiyona giren maddeler arasındaki niceliksel ilişkiler.
Reaktifler kesin olarak tanımlanmış miktarlarda kimyasal bir etkileşime girerse ve miktarı hesaplanabilen reaksiyon maddeleri oluşursa, bu tür reaksiyonlara denir. stokiyometrik.
Stokiyometri yasaları:
Kimyasal bileşiklerin formüllerinden önceki kimyasal denklemlerdeki katsayılara denir. stokiyometrik.
Kimyasal denklemleri kullanan tüm hesaplamalar stokiyometrik katsayıların kullanımına dayanır ve bir maddenin miktarlarının (mol sayısı) bulunmasıyla ilişkilidir.
Reaksiyon denklemindeki madde miktarı (mol sayısı) = karşılık gelen molekülün önündeki katsayı.
Yok=6,02×10 23 mol -1.
η - ürünün gerçek kütlesinin oranı m p teorik olarak mümkün olana kadar M t, bir birimin kesirleri veya yüzde olarak ifade edilir.
Reaksiyon ürünlerinin verimi koşulda belirtilmemişse, hesaplamalarda %100'e (kantitatif verim) eşit alınır.
Kimyasal reaksiyon denklemlerini kullanan hesaplama şeması:
- Kimyasal reaksiyon için bir denklem yazın.
- Maddelerin kimyasal formüllerinin üzerine bilinen ve bilinmeyen miktarları ölçü birimleriyle yazın.
- Bilinen ve bilinmeyen maddelerin kimyasal formülleri altında, reaksiyon denkleminden bulunan bu miktarların karşılık gelen değerlerini yazın.
- Bir orantı oluşturun ve çözün.
Örnek. 24 g magnezyumun tamamen yanması sırasında oluşan magnezyum oksidin kütlesini ve miktarını hesaplayın.
|
Verilen: M(Mg) = 24g Bulmak: ν (MgO) M (MgO) |
Çözüm: 1. Kimyasal reaksiyon için bir denklem oluşturalım: 2Mg + O2 = 2MgO. 2. Madde formülleri altında stokiyometrik katsayılara karşılık gelen madde miktarını (mol sayısı) belirtiriz: 2Mg + O2 = 2MgO 2 mol 2 mol 3. Magnezyumun molar kütlesini belirleyin: Magnezyumun bağıl atom kütlesi Ar (Mg) = 24. Çünkü molar kütle değeri bağıl atomik veya moleküler kütleye eşittir, o zaman M (Mg)= 24 g/mol. 4. Koşulda belirtilen maddenin kütlesini kullanarak maddenin miktarını hesaplıyoruz:
5. Magnezyum oksidin kimyasal formülünün üstünde MgO kütlesi bilinmeyenleri belirledik Xköstebek, magnezyum formülünün üstünde Mg molar kütlesini yazıyoruz: 1 mol Xköstebek 2Mg + O2 = 2MgO 2 mol 2 mol
Oranları çözme kurallarına göre:
Magnezyum oksit miktarı v (MgO)= 1 mol. 7. Magnezyum oksidin molar kütlesini hesaplayın: M (Mg)=24 g/mol, M(O)=16 g/mol. M(MgO)= 24 + 16 = 40 g/mol. Magnezyum oksidin kütlesini hesaplıyoruz: m (MgO) = ν (MgO) × M (MgO) = 1 mol × 40 g/mol = 40 g. Cevap: ν (MgO) = 1 mol; m (MgO) = 40 gr. |
Ne okursanız okuyun
kendin için çalışıyorsun.
Petronius
Dersin Hedefleri:
- öğrencilere kimyasal denklemleri kullanarak problem çözmenin temel yollarını tanıtmak:
- Başlangıç maddelerinin miktarı, kütlesi veya hacminden reaksiyon ürünlerinin miktarını, kütlesini ve hacmini bulmak,
- Bir problemin metniyle çalışma becerilerini, bir eğitim problemini çözmek için mantıklı bir yöntem seçme yeteneğini, kimyasal reaksiyon denklemleri oluşturma yeteneğini geliştirmeye devam edin.
- Ana şeyi analiz etme, karşılaştırma, vurgulama, bir eylem planı hazırlama ve sonuç çıkarma yeteneğini geliştirmek.
- Başkalarına karşı hoşgörüyü, karar vermede bağımsızlığı ve kişinin işinin sonuçlarını objektif olarak değerlendirme yeteneğini geliştirin.
Çalışma biçimleri: ön, bireysel, çift, grup.
Ders türü: BİT kullanımıyla birleştirilmiş
Ben Organizasyon anı.
Merhaba beyler. Bugün kimyasal reaksiyon denklemlerini kullanarak problemleri nasıl çözeceğimizi öğreneceğiz. Slayt 1 (sunuma bakın).
Ders hedefleri Slayt 2.
II.Bilgi, beceri ve yeteneklerin güncellenmesi.
Kimya çok ilginç ve aynı zamanda karmaşık bir bilimdir. Kimyayı bilmek ve anlamak için sadece materyali özümsemekle kalmamalı, aynı zamanda edinilen bilgiyi de uygulayabilmelisiniz. Hangi işaretlerin kimyasal reaksiyonların oluşumunu gösterdiğini öğrendiniz, kimyasal reaksiyonlar için denklemlerin nasıl yazılacağını öğrendiniz. Umarım bu konuları iyi anlamışsınızdır ve sorularıma zorlanmadan cevap verebilirsiniz.
Hangi olay kimyasal dönüşümlerin işareti değildir:
a) tortunun görünümü; c) hacimdeki değişiklik;
b) gaz salınımı; d) bir kokunun ortaya çıkması. Slayt 3
Lütfen rakamlarla belirtin:
a) bileşik reaksiyonların denklemleri
b) ikame reaksiyonlarının denklemleri
c) ayrışma reaksiyonlarının denklemleri Slayt 4
Sorunların nasıl çözüleceğini öğrenmek için bir eylem algoritması oluşturmak gerekir; eylemlerin sırasını belirleyin.
Kimyasal denklemleri kullanan hesaplamalar için algoritma (her öğrencinin masasında)
5. Cevabı yazın.
Bir algoritma kullanarak problemleri çözmeye başlayalım
Bir maddenin kütlesinin, reaksiyona katılan başka bir maddenin bilinen kütlesinden hesaplanması
Ayrışma sonucu açığa çıkan oksijenin kütlesini hesaplayın
9 g ağırlığında su porsiyonları.
Su ve oksijenin molar kütlesini bulalım:
M(H20) = 18 g/mol
M(O2) = 32 g/mol Slayt 6
Kimyasal reaksiyonun denklemini yazalım:
2H2Ö = 2H2 + Ö2
Reaksiyon denklemindeki formülün üstüne bulduğumuzu yazıyoruz
bir maddenin miktarının değeri ve madde formülleri altında -
görüntülenen stokiyometrik oranlar
kimyasal denklem
0.5mol x mol
2H2Ö = 2H2 + Ö2
2mol 1mol
Kütlesini bulmak istediğimiz maddenin miktarını hesaplayalım.
Bunu yapmak için bir orantı oluşturuyoruz
0.5mol = hopmol
2mol 1mol
burada x = 0,25 mol Slayt 7
Bu nedenle n(O 2) = 0,25 mol
Hesaplanması gereken maddenin kütlesini bulun
m(O 2)= n(O 2)*M(O 2)
m(O2) = 0,25 mol 32 g/mol = 8 g
Cevabını yazalım
Cevap: m(O 2) = 8 g Slayt 8
Bir maddenin hacminin, reaksiyona katılan başka bir maddenin bilinen kütlesinden hesaplanması
9 g ağırlığındaki suyun bir kısmının ayrışması sonucu açığa çıkan oksijenin hacmini (no.) hesaplayın.

V(0 2)=?l(n.s.)
M(H20) = 18 g/mol
Vm=22,4l/mol Slayt 9
Reaksiyon denklemini yazalım. Katsayıları sıralayalım
2H2Ö = 2H2 + Ö2
Reaksiyon denklemindeki formülün üstüne, madde miktarının bulunan değerini ve madde formüllerinin altına - kimyasal denklemin gösterdiği stokiyometrik oranları yazıyoruz.
0,5 mol - x mol
2H2Ö = 2H2 + Ö2 Slayt10
2mol - 1mol
Kütlesini bulmak istediğimiz maddenin miktarını hesaplayalım. Bunu yapmak için bir orantı oluşturalım
![]()
burada x = 0,25 mol
Hesaplanması gereken maddenin hacmini bulalım
V(0 2)=n(0 2) Vm
V(O2) = 0,25 mol 22,4 l/mol = 5,6 l (no.)
Cevap: 5,6 l Slayt 11
III.Çalışılan materyalin konsolidasyonu.
Bağımsız çözüm için görevler:
1. Fe203 ve Sn02 oksitleri kömürle indirgendiğinde 20 g Fe ve Sn elde edildi. Her oksitten kaç gram alındı?
2. Bu durumda daha fazla su oluşur:
a) 10 g bakır (I) oksidi (Cu20) hidrojenle indirgerken veya
b) 10 g bakır(II) oksidi (CuO) hidrojenle indirgerken? Slayt 12
Sorun 1'in çözümünü kontrol edelim

M(Fe203)=160g/mol
M(Fe)=56g/mol, ![]()
m(Fe 2 O 3)=, m(Fe 2 O 3)= 0,18*160=28,6g
Cevap: 28.6g
Slayt 13
2. sorunun çözümünü kontrol edelim

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mol,
n(H20)=0,07 mol
m(H20) = 0,07 mol*18 g/mol = 1,26 g
Slayt 14
CuO + H2 = Cu + H2O
n(CuO) = m/ M(CuO)
n(CuO) = 10g/ 80g/mol = 0,125 mol
0.125mol şerbetçiotu
CuO + H2 = Cu + H2O
1mol 1mol
![]()
x mol = 0,125 mol, n(H2O) = 0,125 mol
m (H20) = n * M (H20);
m(H20) = 0,125mol*18g/mol=2,25g
Cevap: 2.25g Slayt 15
Ödev: ders kitabı materyalini inceleyin s. 45-47, sorunu çöz
Kalsiyum oksidin kütlesi nedir ve karbondioksitin hacmi nedir (n.s.)
250 gr ağırlığındaki kalsiyum karbonatın ayrıştırılmasıyla elde edilebilir mi?
CaCO3 = CaO + CO Slayt 16.
Edebiyat
1. Gabrielyan O.Ş. Genel eğitim kurumlarında 8-11. sınıflar için kimya ders programı. M. Bustard 2006
2. Gabrielyan O.Ş. Kimya. 8. sınıf. Genel eğitim kurumları için ders kitabı. Bustard. M.2005
3. Gorbuntsova S.V. Okul kursunun ana bölümlerine ilişkin testler. 8. - 9. sınıflar VAKO, Moskova, 2006.
4. Gorkovenko M.Yu.Kimyada ders gelişmeleri. O.S. Gabrielyan, L.S. Guzey, V.V. Sorokin, R.P. Surovtseva ve G.E. Rudzitis, F.G. Feldman'ın ders kitaplarına. 8. sınıf VAKO, Moskova, 2004.
5. Gabrielyan O.Ş. Kimya. 8. Sınıf: Testler ve testler. – M.: Bustard, 2003.
6. Radetsky A.M., Gorshkova V.P. 8-9. Sınıflar için kimya üzerine didaktik materyal: Öğretmenler için bir el kitabı. – M.: Eğitim, 2000
Başvuru.
Kimyasal denklemleri kullanarak hesaplamalar
Eylem algoritması.
Kimyadaki bir hesaplama problemini çözmek için aşağıdaki algoritmayı kullanabilirsiniz - beş adım atın:
1. Kimyasal reaksiyon için bir denklem yazın.
2. Madde formüllerinin üzerine, bilinen ve bilinmeyen miktarları karşılık gelen ölçü birimleriyle birlikte yazın (yalnızca saf maddeler için, safsızlıklar olmadan). Sorunun koşullarına göre safsızlık içeren maddeler reaksiyona girerse, önce saf maddenin içeriğini belirlemeniz gerekir.
3. Bilinen ve bilinmeyen maddelerin formülleri altında, reaksiyon denkleminden bulunan bu miktarların karşılık gelen değerlerini yazın.
4. Bir orantı oluşturun ve çözün.
5. Cevabı yazın.
Bazı fiziksel ve kimyasal büyüklükler ile birimleri arasındaki ilişki
Kütle (m): g; kilogram; mg
Maddelerin miktarı (n): mol; kmol; mmol
Molar kütle (M): g/mol; kg/kmol; mg/mmol
Hacim (V): 1; m3 /kmol; ml
Molar hacim (Vm): l/mol; m3 /kmol; ml/mmol
Parçacık sayısı (N): 6 1023 (Avagadro sayısı – N A); 6 1026; 6 1020
Ders “Kimyasal reaksiyonun denklemi” konusunun incelenmesine devam etmeye ayrılmıştır. Ders, reaksiyona katılan madde miktarlarının oranıyla ilgili bir kimyasal reaksiyon denklemini kullanarak en basit hesaplamaları tartışmaktadır.
Konu: İlk kimyasal fikirler
Ders: Kimyasal Reaksiyon Denklemi
1. Reaksiyona katılan madde miktarlarının oranı
Reaksiyon denklemindeki katsayılar yalnızca her maddenin molekül sayısını değil aynı zamanda reaksiyona katılan madde miktarlarının oranını da gösterir. Dolayısıyla, reaksiyon denklemine göre: 2H2 + O2 = 2H2O - belirli bir miktarda su (örneğin, 2 mol) oluşturmak için aynı sayıda basit hidrojen maddesinin (2 mol) molünün ve yarısının olduğu iddia edilebilir. kadar basit bir madde olan oksijene (1 mol) ihtiyaç vardır. Bu tür hesaplamalara örnekler verelim.
2. Görev 1
GÖREV 1. 4 mol suyun ayrışması sonucu oluşan oksijenli madde miktarını belirleyelim.
Sorunun çözümü için ALGORİTMA:
1. Reaksiyon denklemini yazın
2. Reaksiyon denklemine ve problemin koşullarına göre madde miktarlarını belirleyerek bir orantı oluşturun (bilinmeyen madde miktarını x mol olarak belirtin).
3. Bir denklem yapın (orantıdan).
4. Denklemi çözün ve x'i bulun.
Pirinç. 1. Kısa bir koşulun formüle edilmesi ve problem 1'in çözümü
3. Görev 2GÖREV 2. 3 mol bakırın tamamen yanması için ne kadar oksijen gereklidir?Kimyasal reaksiyon denklemini kullanarak problemleri çözmek için bir algoritma kullanalım.

Pirinç. 2. Kısa bir koşulun formüle edilmesi ve problem 2'nin çözümü.
Algoritmaları dikkatlice inceleyin ve bunları bir not defterine yazın, önerilen sorunları kendiniz çözün
BEN. Algoritmayı kullanarak aşağıdaki sorunları kendiniz çözün:
1. Alüminyumun 0,27 mol miktardaki madde ile yeterli miktarda oksijenle etkileşimi sonucu oluşan alüminyum oksit maddesi miktarını hesaplayın. (4Al +3O 2 =2Al2O3).
2. Sodyumun 2,3 mol miktarındaki madde ile yeterli miktarda oksijenin etkileşimi sonucu oluşan sodyum oksit maddesi miktarını hesaplayınız.(4Na+O2 =2Na20).
Algoritma No.1
Bir reaksiyona katılan maddenin bilinen bir miktarından bir maddenin miktarının hesaplanması.
Örnek. Suyun 6 mol madde miktarı ile ayrışması sonucu açığa çıkan oksijen miktarını hesaplayınız.



II. Algoritmayı kullanarak aşağıdaki sorunları kendiniz çözün:
1. 4 mol (S + O) madde miktarı ile kükürt oksit (IV) elde etmek için gereken kükürt kütlesini hesaplayın 2
=SO2).
2. 0,6 mol madde miktarıyla (2Li+Cl2 = 2LiCl) lityum klorür elde etmek için gereken lityum kütlesini hesaplayın.
Algoritma No.2
Bir maddenin kütlesinin, reaksiyona katılan başka bir maddenin bilinen miktarından hesaplanması.
Örnek: 8 mol madde miktarı ile alüminyum oksit elde etmek için gereken alüminyum kütlesini hesaplayın.



III. Algoritmayı kullanarak aşağıdaki sorunları kendiniz çözün:
1. 12,8 g (2Na+S=Na2S) ağırlığındaki kükürtün sodyum ile reaksiyona girmesi durumunda sodyum sülfit miktarını hesaplayın.
2. 64 g ağırlığındaki bakır (II) oksidin hidrojenle reaksiyona girmesi durumunda oluşan bakır maddesi miktarını hesaplayın (CuO + H2 = Cu + H2 O).
Algoritmayı dikkatlice inceleyin ve not defterinize yazın.
Algoritma No.3
Bir reaksiyona katılan başka bir maddenin bilinen kütlesinden bir maddenin miktarının hesaplanması.
Örnek. 19,2 g ağırlığındaki bakır oksijenle reaksiyona girerse bakır (I) oksit miktarını hesaplayın.



Algoritmayı dikkatlice inceleyin ve not defterinize yazın.
IV. Algoritmayı kullanarak aşağıdaki sorunları kendiniz çözün:
1. 112 g ağırlığındaki demir ile reaksiyona girmek için gereken oksijen kütlesini hesaplayın
(3Fe + 4O2 =Fe3O4).
Algoritma No.4
Bir maddenin kütlesinin, reaksiyona katılan başka bir maddenin bilinen kütlesinden hesaplanması
Örnek. Fosforun yanması için gerekli olan 0,31 g ağırlığındaki oksijen kütlesini hesaplayın.



BAĞIMSIZ ÇÖZÜM İÇİN GÖREVLER
1. Alüminyumun 0,27 mol miktarındaki madde ile yeterli miktarda oksijenin (4Al + 3O2 = 2Al2 O3) etkileşimi sonucu oluşan alüminyum oksit maddesi miktarını hesaplayınız.
2. Sodyumun 2,3 mol miktarındaki madde ile yeterli miktarda oksijenin (4Na + O2 = 2Na2 O) etkileşimi sonucu oluşan sodyum oksit maddesi miktarını hesaplayınız.
3. 4 mol madde miktarıyla (S+O2 =SO2) kükürt oksit (IV) elde etmek için gereken kükürt kütlesini hesaplayın.
4. 0,6 mol madde miktarıyla (2Li+Cl2 = 2LiCl) lityum klorür elde etmek için gereken lityum kütlesini hesaplayın.
5. 12,8 g (2Na+S=Na2S) ağırlığındaki kükürt sodyum ile reaksiyona girerse sodyum sülfit miktarını hesaplayın.
6. 64 g ağırlığındaki bakır (II) oksidin hidrojenle reaksiyona girmesi durumunda oluşan bakır maddesi miktarını hesaplayın (CuO + H2 = Cu + H2 O).
EGZERSİZLER
Simülatör No. 1 - Kimyasal reaksiyon denkleminin analizi
Simülatör No. 6 - Stokiyometrik hesaplamalar
Ders özeti “Kimyasal denklemleri kullanarak hesaplamalar”
1. Ödevleri kontrol etmek
Ev ödevi olarak reaksiyon denklemlerine katsayıları yerleştirmeniz istendi.Mola sırasında yapılan çalışmaları görebilirsiniz. Mutlaka hatalar olacaktır.Her şey yolunda gitti mi, sorusu olan var mı?Ev deneyimleri hakkında konuşmalarına izin verin.
2. Konunun duyurulması ve bilgilerin güncellenmesi
Bugünkü dersin konusu kimyasal denklemler kullanılarak yapılan hesaplamalardır. Öncelikle bugün bize faydalı olabilecek her şeyi hatırlayalım. Kimyasal denklemlerle daha önceki laboratuvar çalışmalarımızda, ev ödevlerimizde ve hatta daha önce ikili bileşikler konusunda karşılaşmıştık. Kimyasal reaksiyon denkleminin tanımını hatırlayalım.
(Bu, kimyasal formüller ve katsayılar kullanılarak kimyasal reaksiyonun geleneksel gösterimidir.)
İnanılmaz.
Herhangi bir bileşik üretirken, reaksiyon ürününün gerekli kütlesini elde etmek için ne kadar başlangıç malzemesi almanız gerektiğini bilmeniz gerekir. Bunu yapmak için devam eden kimyasal reaksiyon için bir denklem oluşturun ve hesaplarken kütleler molar kütleleri hesaba katar maddeler ve hesaplanırken gaz hacimleri değerini dikkate almolar hacim gazlar
Normal koşullar altında gazların molar hacminin değerini kim hatırlıyor? (22,4 l/mol)
Peki nedir bu normal koşullar? (basınç 101,3 kPa ve sıcaklık 0 veya C)
Yani bu koşullar altında HERHANGİ bir gazın 1 mol'ü 22,4 litre hacim kaplar.
Aslında sorunları çözmek için birkaç niceliği hatırlamamız gerekiyor:
Molar kütle – M (g/mol)
Madde miktarı – n (mol)
Hacim – V (l)
Bu şekilde daha iyi: Molar kütlenin sayısal olarak bir maddenin bağıl atom kütlesine veya bağıl moleküler kütlesine eşit olduğunu hatırlarsınız. Bunu yapmak için, göreceli atom kütlesinin her "hücrenin" altında gösterildiği periyodik tabloyu kullanmanız gerekir. Yuvarlama kurallarını unutmadan hesaplamalarda bu kütlenin tam değerini kullanırız.
Kimya çok açık, mantıklı ve tutarlı bir bilimdir, bu nedenle problemlerin çözümünde ders kitabında verilen ALGORİTMA'nın kullanılması uygun olacaktır. Bu, bu türden herhangi bir sorunu çözmek için kullanılan evrensel bir eylem dizisidir.
Lütfen ders kitabını açın ve hep birlikte algoritmayı tanıyalım.
(burada hep birlikte ders kitaplarımızı açıyoruz, bir kişi, belki ben, algoritmayı okuyor, geri kalanlar şimdi ne yapmaları gerektiğini anlamak için takip ediyor)
Çok kapsamlı gibi görünüyor ama umarım çok kafa karıştırıcı değildir. Bir örnekle anlamaya çalışalım.
Görev 1. Hidrojen üretmek için alüminyum sülfürik asitte çözülür: 2Al + 3H 2 SO 4 → Al 2 (S04) 3 + 3H 2 (Algoritmamızın ilk noktası). Reaksiyon için 10,8 g alüminyum aldık. Tüketilen sülfürik asit kütlesini hesaplayın.
Verilen: m(Al) = 10,8 g | Çözüm: m=10,8 g m - ? 2Al + 3H 2 SO 4 → Al 2 (S04) 3 + 3H 2 M=27g/mol M=98g/mol Burada aslında reaksiyona 2 alüminyum atomu ve 3 asit molekülünün değil, bir kısım alüminyum atomu ve bir kısım asit molekülünün girdiğini söyleyebiliriz. Kimyada bu kısma kısa kelime “mol” denir. n=2 mol n=3 mol m = M ∙ n m=54 gr m=294 gr Orantıya göre hesaplama: |
||||
m (H2S04) -? |
|||||
10,8 gr | |||||
54 gr | 294 gr | ||||
10,8 gr ∙ 294 gr | |||||
54 gr | |||||
X = 58,8 gr Cevap: m (H 2 SO 4 ) = 58,8 g |
|||||
Sorunun tüm çözümü bu. Sorularım var? Çözümden bir kez daha bahsedelim:
Bir denklem kurdum
BİLDİKLERİMİZ VE BULMAK İSTEDİKLERİMİZİ imzaladığımız maddelerin üstünde
Formüllerin altına molar kütleyi, madde miktarını vestokiyometrik maddenin kütlesi ( “periyodik tabloya göre kütleyi” belirtmek daha iyidir)
Bir orantı oluşturduk
Orantıyı çözdüm
Cevabı kaydetti
Benzer bir problemi gaz halindeki maddelerle çözelim (burada maddenin molar kütlesini kullanmayacağız ama ne?...molar hacmi)
Sorun 2. 25 gram çinko hidroklorik asit içinde çözülür, kimyasal reaksiyon sırasında bir gaz açığa çıkar - hidrojen. Açığa çıkan hidrojenin hacmini hesaplayın.
Verilen: m(Zn) = 10,8 g | Çözüm: m=25 gr V - ? Zn + 2HCl → ZnCl2 + H2 M=65 g/mol V m=22,4 l/mol n=1 mol n=1 mol m=65 gr V=22,4 l Orantıya göre hesaplama: |
||||
m(HCl) -? |
|||||
25 gr | |||||
65 gr | 22,4 litre | ||||
25 gr ∙ 22,4 l | |||||
65 gr | |||||
X = 8,61 litre Cevap: V(H 2 ) = 8,61 l |
|||||
Malzemeye nasıl hakim olduğunuzu kontrol edelim. Aynı algoritmayı kullanarak sorunu çözün:
BAŞARILI OLACAĞINIZ BİR GERÇEK DEĞİL:
İle tepki verirken kömür oksitleri Fe2O3 (birinci seçenek) ve SnO2 (ikinci seçenek) kullanılarak her biri 20 g Fe ve Sn aldı. Her oksitten kaç gram alındı?
Lütfen artık reaksiyon ürünlerinin değil başlangıç maddelerinin kütlesini hesapladığımızı unutmayın.)
(Herkes bunu bir defterde çözsün ve seçici olarak çözümü göstermelerini isteyin, denklemi hep birlikte tahtaya yazacağız ve herkes kendi çözmeye çalışacaktır)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 g
Ödev: ders kitabı materyalini inceleyin s. 146-150, sorunu çöz
Kalsiyum oksidin kütlesi nedir ve karbondioksitin hacmi nedir (n.s.)
250 gr ağırlığındaki kalsiyum karbonatın ayrıştırılmasıyla elde edilebilir mi?OKUL ÇOCUKLARINA VERİLECEKHAZIR DENKLEMBU GÖREVİ TAMAMLAMAK İÇİN
Metodolojik ders geliştirme (2 saat)
Kimyasal denklemleri kullanarak hesaplamalar
Khapugina Polina Ivanovna,
kimya öğretmeni GBOU ortaokul 277
St.Petersburg'un Kirovsky bölgesi
Dersin Hedefleri: Sekizinci sınıf öğrencilerine kimyasal denklemleri kullanarak hesaplamalar yapmayı öğretin: Başlangıç maddelerinin miktarı, hacmi ve kütlesinden reaksiyon ürünlerinin miktarını, kütlesini ve hacmini bulun.
Dersler sırasında:
Yeni bir konuya geçmeden önce bildiğiniz miktarları ve formülleri hatırlamamız gerekiyor. Kimyasal reaksiyon türlerini hatırlayın. Ve zaten kimyasal denklemlerin nasıl oluşturulacağını ve bunları nasıl eşitleyeceğinizi biliyorsunuz. Aşağıdakileri yaparak bilginizi test edelim: değerlendirme testi.(testin içeriği kişisel web sitemde dosyalar ve fotoğraflar klasöründe görülebilir)
Öğretmenin açıklaması:
1. Kimyasal denklemleri kullanarak hesaplama yapmayı öğrenmeden önce, bir maddenin miktarını, kütlesini ve hacmini bulmak için zaten bildiğimiz formülleri bir kez daha hatırlamanız gerekir; yaptığınız işin ardından tek adımda kendinizi test edebilirsiniz. . Bunu yapmak için bilgimizi hafızamıza geri yüklememize yardımcı olacak aşağıdaki sunuma geçelim. Sunum No.1.
Bildiğiniz formülleri defterinize yazın:
n- madde miktarı (mol)
m- maddenin kütlesi (g)
M - molar kütle (g/mol)
V - gaz hacmi (l)
V m - molar hacim = 22,4 l/mol
n = m/M; m = n.M
n = V/Vm; V = n.Vm
2. Şimdi, kimyasal bir denklemin sürecin yalnızca niteliksel (maddelerin dönüşümü) yönünü değil, aynı zamanda niceliksel yönünü de gösterdiğini anlamalıyız. Bunu yapmak için aşağıdakilere dönelim Sunumlar#2(sunum kişisel web sitemde dosyalar ve fotoğraflar klasöründe görüntülenebilir)
Defterine yaz:
Reaksiyon denklemindeki katsayı parçacık sayısını gösterir ve parçacık sayısı da mol sayısını belirler!
2 saat₂ + O₂ = 2H₂ HAKKINDA
Parçacık sayısı 2 molekül 1 molekül 2 molekül
Adet ↓ ↓ ↓
maddeler,N2 mol 1 mol 2 mol
2 Fe(AH)3 = Fe2 Ö3 + 3 H2 Ö
↓ ↓ ↓
N= 2mol 1mol 3mol
3. İncelememiz gereken bir sonraki aşama, reaksiyon denklemini kullanarak orantı oluşturma ve çözme yeteneğidir. Bunu yapmak için aşağıdakilere dönelim Sunumlar 3.(sunum kişisel web sitemde dosyalar ve fotoğraflar klasöründe görüntülenebilir)
Defterine yaz:
Şu koşulla bilinir: 2 mol X mol (pay)
4P+5O₂ = 2P₂ Ö₅
Denklemle bilinir: 4 mol 5 mol 2 mol (payda)
Oranı oluşturup çözelim:
2 mol X mol
_______ = _______
4 mol 2 mol
X mol = 2 mol. 2 mol= 1 mol
4 mol
X =N(P₂ Ö₅ )= 1 mol
4. Kimyasal reaksiyon denklemlerini kullanarak problemleri çözmeye devam edelim. Kimyadaki bir hesaplama problemini çözmek için aşağıdaki algoritmayı kullanmanız gerekir - beş adım atın. Sunum 4. (sunum kişisel web sitemde dosyalar ve fotoğraflar klasöründe görülebilir) Ders Kitabı s.101
Not defterinizde:
Öğrencilere not defterlerine yapıştırmaları için hazır bir çözüm algoritması verilir.
Kimyasal reaksiyon denklemlerini kullanarak hesaplama problemlerini çözmek için algoritma:
1. Kimyasal reaksiyon için bir denklem oluşturun (yani katsayıları ayarladığınızdan emin olun!)
2. Denklemdeki ilgili formüllerin üzerine, problemin koşullarına göre bilinen veya hesaplanabilen ölçü birimlerine sahip maddelere ilişkin niceliksel verileri ve ayrıca ölçü birimleriyle istenen X değerini yazın.
3. Bu formüllerin altına, denklemin kendisi tarafından belirtilen karşılık gelen niceliksel büyüklükleri ölçü birimleriyle birlikte yazın.
4. Bir orantı oluşturun ve çözün.
5. Cevabı resmileştirin.
5. Sorunu çözelim.
0,5 mol alüminyum oksidin ısıtıldığında sülfürik asitle etkileşimi sonucu oluşan suyun kütlesini hesaplayın.
Sorunu okuyun.
Sorun ifadesini yazın. (Verildi, bulun.)
Not defterinizde: (Öğrenciler öğretmenin açıklamalarına göre çözümü yazarlar.) Sunumlar 5 ) (sunum kişisel web sitemde dosyalar ve fotoğraflar klasöründe görüntülenebilir)
Verilen:
n(Al₂O₃)=0,5 mol
_________________
Bulmak:
Çözüm:
N=0,5 mol X mol
Al₂ Ö₃ +3 H₂ BU YÜZDEN₄ = Al₂ (BU YÜZDEN₄ ) ₃ +3 H₂ Ö
N= 1 mol 3 mol
M = 102 g/mol 18 g/mol
Molekül ağırlığının hesaplanması:
Мr(Al₂O₃)= 2,27+3,16= 54+48=102
Мr(H₂O)= 2,1+16=18
Bir orantı oluşturun ve çözün.
0,5 mol = X köstebeği
1 mol 3 mol
X mol =N(H₂ Ö) = 0,5 mol. 3 mol= 1,5 mol
1 mol
Suyun kütlesini bulalım.
M(H₂ Ö) = N(H₂ Ö) . M(H₂ Ö)
M(H₂ Ö) = 1,5 mol.18 g/mol = 27 g
Cevap:M(H₂ Ö)=27 gr
6. Sorunları kendiniz çözün.
Değerlendirme için iki öğrenci kurula çağrılır.
1. 2Al + 3Cl2 = 2AlCl3 denklemine göre 634 g alüminyum klorür elde etmek için gereken klor hacmini (no.) belirleyin. Cevap: 159,6 l
2. Aşağıdaki denkleme göre 128 g oksijenle reaksiyon için gereken madde miktarını ve lityum kütlesini hesaplayın: 4Li + O 2 = 2Li 2 O Cevap: 16 mol, 112 gr
7. Ödev.
Görev.
13 g çinkonun oksijenle etkileşimi sonucu oluşan çinko oksidin kütlesini bulun.