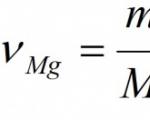Berechnungen mit chemischen Gleichungen. Berechnungen unter Verwendung chemischer Gleichungen Arbeiten Sie 6 Berechnungen unter Verwendung von Gleichungen chemischer Reaktionen durch
Stöchiometrie- quantitative Beziehungen zwischen reagierenden Substanzen.
Wenn Reagenzien in genau definierten Mengen eine chemische Wechselwirkung eingehen und infolge der Reaktion Stoffe entstehen, deren Menge berechnet werden kann, spricht man von solchen Reaktionen stöchiometrisch.
Gesetze der Stöchiometrie:
Die Koeffizienten in chemischen Gleichungen werden vor den Formeln chemischer Verbindungen genannt stöchiometrisch.
Alle Berechnungen mithilfe chemischer Gleichungen basieren auf der Verwendung stöchiometrischer Koeffizienten und sind mit der Ermittlung von Mengen eines Stoffes (Anzahl der Mol) verbunden.
Die Stoffmenge in der Reaktionsgleichung (Anzahl der Mol) = der Koeffizient vor dem entsprechenden Molekül.
N / A=6,02×10 23 mol -1.
η - Verhältnis der tatsächlichen Masse des Produkts m p zu einem theoretisch möglichen M t, ausgedrückt in Bruchteilen einer Einheit oder als Prozentsatz.
Wenn die Ausbeute an Reaktionsprodukten in der Bedingung nicht angegeben ist, wird sie in den Berechnungen mit 100 % (quantitative Ausbeute) angenommen.
Berechnungsschema anhand chemischer Reaktionsgleichungen:
- Schreiben Sie eine Gleichung für eine chemische Reaktion.
- Über den chemischen Formeln von Stoffen schreiben Sie bekannte und unbekannte Größen mit Maßeinheiten.
- Notieren Sie unter den chemischen Formeln von Stoffen mit bekannten und unbekannten Stoffen die entsprechenden Werte dieser aus der Reaktionsgleichung ermittelten Größen.
- Verfassen und lösen Sie eine Proportion.
Beispiel. Berechnen Sie die Masse und Menge des Magnesiumoxids, das bei der vollständigen Verbrennung von 24 g Magnesium entsteht.
|
Gegeben: M(Mg) = 24 g Finden: ν (MgO) M (MgO) |
Lösung: 1. Erstellen wir eine Gleichung für eine chemische Reaktion: 2Mg + O 2 = 2MgO. 2. Unter den Stoffformeln geben wir die Stoffmenge (Molzahl) an, die den stöchiometrischen Koeffizienten entspricht: 2Mg + O2 = 2MgO 2 Mol 2 Mol 3. Bestimmen Sie die Molmasse von Magnesium: Relative Atommasse von Magnesium Ar (Mg) = 24. Weil Der Molmassenwert ist dann gleich der relativen Atom- oder Molekülmasse M (Mg)= 24 g/mol. 4. Anhand der in der Bedingung angegebenen Masse des Stoffes berechnen wir die Menge des Stoffes:
5. Oben die chemische Formel von Magnesiumoxid MgO, dessen Masse unbekannt ist, setzen wir XMol, über der Magnesiumformel Mg Wir schreiben seine Molmasse: 1 Mol XMol 2Mg + O2 = 2MgO 2 Mol 2 Mol
Nach den Regeln zum Lösen von Proportionen:
Menge an Magnesiumoxid ν (MgO)= 1 Mol. 7. Berechnen Sie die Molmasse von Magnesiumoxid: M (Mg)=24 g/mol, M(O)=16 g/mol. M(MgO)= 24 + 16 = 40 g/mol. Wir berechnen die Masse von Magnesiumoxid: m (MgO) = ν (MgO) × M (MgO) = 1 mol × 40 g/mol = 40 g. Antwort: ν (MgO) = 1 mol; m (MgO) = 40 g. |
Was auch immer Sie studieren, Sie
Du lernst für dich.
Petronius
Lernziele:
- Führen Sie die Schüler in die grundlegenden Methoden zur Lösung von Problemen mithilfe chemischer Gleichungen ein:
- Menge, Masse und Volumen der Reaktionsprodukte aus der Menge, Masse oder dem Volumen der Ausgangsstoffe ermitteln,
- entwickeln Sie weiterhin Fähigkeiten im Umgang mit dem Text eines Problems, die Fähigkeit, eine Methode zur Lösung eines Bildungsproblems mit Bedacht auszuwählen und die Fähigkeit, Gleichungen chemischer Reaktionen aufzustellen.
- Entwickeln Sie die Fähigkeit, zu analysieren, zu vergleichen, das Wesentliche hervorzuheben, einen Aktionsplan zu erstellen und Schlussfolgerungen zu ziehen.
- kultivieren Sie Toleranz gegenüber anderen, Unabhängigkeit bei der Entscheidungsfindung und die Fähigkeit, die Ergebnisse Ihrer Arbeit objektiv zu bewerten.
Arbeitsformen: Frontal, Einzel, Paar, Gruppe.
Unterrichtsart: kombiniert mit dem Einsatz von IKT
Ich organisatorischer Moment.
Hallo Leute. Heute lernen wir, wie man Probleme mithilfe von Gleichungen chemischer Reaktionen löst. Folie 1 (siehe Präsentation).
Unterrichtsziele Folie 2.
II. Aktualisierung von Kenntnissen, Fähigkeiten und Fertigkeiten.
Chemie ist eine sehr interessante und zugleich komplexe Wissenschaft. Um Chemie zu kennen und zu verstehen, muss man sich nicht nur den Stoff aneignen, sondern auch das erworbene Wissen anwenden können. Sie haben gelernt, welche Anzeichen auf das Auftreten chemischer Reaktionen hinweisen, und haben gelernt, wie man Gleichungen für chemische Reaktionen aufstellt. Ich hoffe, Sie haben ein gutes Verständnis für diese Themen und können meine Fragen problemlos beantworten.
Welches Phänomen ist kein Zeichen chemischer Umwandlungen:
a) das Auftreten von Sedimenten; c) Volumenänderung;
b) Gasfreisetzung; d) das Auftreten eines Geruchs. Folie 3
Bitte in Zahlen angeben:
a) Gleichungen zusammengesetzter Reaktionen
b) Gleichungen von Substitutionsreaktionen
c) Gleichungen der Zersetzungsreaktionen Folie 4
Um zu lernen, wie man Probleme löst, ist es notwendig, einen Aktionsalgorithmus zu erstellen, d.h. Bestimmen Sie die Reihenfolge der Aktionen.
Algorithmus für Berechnungen anhand chemischer Gleichungen (auf dem Schreibtisch jedes Schülers)
5. Schreiben Sie die Antwort auf.
Beginnen wir mit der Lösung von Problemen mithilfe eines Algorithmus
Berechnen der Masse eines Stoffes aus der bekannten Masse eines anderen an der Reaktion beteiligten Stoffes
Berechnen Sie die Menge an Sauerstoff, die bei der Zersetzung freigesetzt wird
Portionen Wasser mit einem Gewicht von 9 g.
Lassen Sie uns die Molmasse von Wasser und Sauerstoff ermitteln:
M(H 2 O) = 18 g/mol
M(O 2) = 32 g/mol Folie 6
Schreiben wir die Gleichung der chemischen Reaktion:
2H 2 O = 2H 2 + O 2
Über der Formel in der Reaktionsgleichung schreiben wir, was wir herausgefunden haben
der Wert der Menge eines Stoffes und unter den Stoffformeln -
stöchiometrische Verhältnisse angezeigt
chemische Gleichung
0,5 mol x mol
2H 2 O = 2H 2 + O 2
2mol 1mol
Berechnen wir die Stoffmenge, deren Masse wir ermitteln möchten.
Dazu erstellen wir eine Proportion
0,5mol = Hopmol
2mol 1mol
wobei x = 0,25 mol Folie 7
Daher ist n(O 2) = 0,25 mol
Finden Sie die Masse des Stoffes, die berechnet werden muss
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0,25 mol 32 g/mol = 8 g
Schreiben wir die Antwort auf
Antwort: m(O 2) = 8 g Folie 8
Berechnen des Volumens eines Stoffes aus der bekannten Masse eines anderen an der Reaktion beteiligten Stoffes
Berechnen Sie das Sauerstoffvolumen (Nr.), das bei der Zersetzung einer 9 g schweren Portion Wasser freigesetzt wird.

V(0 2)=?l(n.s.)
M(H 2 O) = 18 g/mol
Vm=22,4l/mol Folie 9
Schreiben wir die Reaktionsgleichung auf. Ordnen wir die Koeffizienten an
2H 2 O = 2H 2 + O 2
Oberhalb der Formel in der Reaktionsgleichung schreiben wir den gefundenen Wert der Stoffmenge und unter den Formeln der Stoffe die durch die chemische Gleichung angezeigten stöchiometrischen Verhältnisse
0,5 mol - x mol
2H 2 O = 2H 2 + O 2 Folie 10
2mol - 1mol
Berechnen wir die Stoffmenge, deren Masse wir ermitteln wollen. Erstellen wir dazu eine Proportion
![]()
wobei x = 0,25 mol
Lassen Sie uns das Volumen der Substanz ermitteln, das berechnet werden muss
V(0 2)=n(0 2) Vm
V(O 2) = 0,25 mol 22,4 l/mol = 5,6 l (Anz.)
Antwort: 5,6 l Folie 11
III. Konsolidierung des untersuchten Materials.
Aufgaben zur eigenständigen Lösung:
1. Bei der Reduktion der Oxide Fe 2 O 3 und SnO 2 mit Kohle wurden 20 g Fe und Sn erhalten. Wie viele Gramm jedes Oxids wurden eingenommen?
2.In diesem Fall wird mehr Wasser gebildet:
a) bei der Reduktion von 10 g Kupfer(I)oxid (Cu 2 O) mit Wasserstoff oder
b) bei der Reduktion von 10 g Kupfer(II)-oxid (CuO) mit Wasserstoff? Folie 12
Sehen wir uns die Lösung für Problem 1 an

M(Fe 2 O 3)=160g/mol
M(Fe)=56g/mol, ![]()
m(Fe 2 O 3)=, m(Fe 2 O 3)= 0,18*160=28,6g
Antwort: 28,6 g
Folie 13
Sehen wir uns die Lösung für Problem 2 an

M(CuO) = 80 g/mol
4. ![]()
x mol = 0,07 mol,
n(H 2 O)=0,07 mol
m(H 2 O) = 0,07 mol*18 g/mol = 1,26 g
Folie 14
CuO + H 2 = Cu + H 2 O
n(CuO) = m/ M(CuO)
n(CuO) = 10g/ 80g/mol = 0,125 mol
0,125 mol Hopfen
CuO + H 2 = Cu + H 2 O
1mol 1mol
![]()
x mol = 0,125 mol, n(H 2 O) = 0,125 mol
m (H 2 O) = n * M (H 2 O);
m(H 2 O) = 0,125 mol*18 g/mol = 2,25 g
Antwort: 2,25 g Folie 15
Hausaufgabe: Studieren Sie das Lehrbuchmaterial S. 45-47, lösen Sie das Problem
Wie groß ist die Masse von Calciumoxid und wie groß ist das Volumen von Kohlendioxid (n.s.)
kann durch Zersetzung von Calciumcarbonat mit einem Gewicht von 250 g gewonnen werden?
CaCO 3 = CaO + CO Folie 16.
Literatur
1. Gabrielyan O.S. Chemiekursprogramm für die Klassen 8-11 in allgemeinbildenden Einrichtungen. M. Bustard 2006
2. Gabrielyan O.S. Chemie. 8. Klasse. Lehrbuch für allgemeinbildende Einrichtungen. Trappe. M. 2005
3. Gorbuntsova S.V. Tests zu den Hauptabschnitten des Schulkurses. 8. - 9. Klasse. VAKO, Moskau, 2006.
4. Gorkovenko M. Yu. Unterrichtsentwicklungen in der Chemie. Zu den Lehrbüchern von O.S. Gabrielyan, L.S. Guzey, V.V. Sorokin, R.P. Surovtseva und G.E. Rudzitis, F.G. Feldman. 8. Klasse. VAKO, Moskau, 2004.
5. Gabrielyan O.S. Chemie. Note 8: Tests und Prüfungen. – M.: Bustard, 2003.
6. Radetsky A.M., Gorshkova V.P. Didaktisches Material zur Chemie für die Klassen 8-9: Ein Handbuch für Lehrer. – M.: Bildung, 2000
Anwendung.
Berechnungen mit chemischen Gleichungen
Aktionsalgorithmus.
Um ein Rechenproblem in der Chemie zu lösen, können Sie den folgenden Algorithmus verwenden – führen Sie fünf Schritte aus:
1. Schreiben Sie eine Gleichung für eine chemische Reaktion.
2. Schreiben Sie über die Stoffformeln bekannte und unbekannte Größen mit den entsprechenden Maßeinheiten (nur für reine Stoffe, ohne Verunreinigungen). Wenn je nach Problemstellung Stoffe mit Verunreinigungen eine Reaktion eingehen, muss zunächst der Gehalt an Reinstoff bestimmt werden.
3. Notieren Sie unter den Formeln von Stoffen mit bekannten und unbekannten Größen die entsprechenden Werte dieser aus der Reaktionsgleichung ermittelten Größen.
4. Bilden und lösen Sie eine Proportion.
5. Schreiben Sie die Antwort auf.
Die Beziehung zwischen einigen physikalischen und chemischen Größen und ihren Einheiten
Masse (m): g; kg; mg
Stoffmenge (n): Mol; kmol; mmol
Molmasse (M): g/mol; kg/kmol; mg/mmol
Volumen (V): l; m 3 /kmol; ml
Molvolumen (Vm): l/mol; m 3 /kmol; ml/mmol
Anzahl der Teilchen (N): 6 1023 (Avagadro-Zahl – N A); 6 1026 ; 6 1020
Die Lektion ist der Fortsetzung des Studiums des Themas „Gleichung einer chemischen Reaktion“ gewidmet. In der Lektion werden die einfachsten Berechnungen anhand der Gleichung einer chemischen Reaktion besprochen, die sich auf das Verhältnis der an der Reaktion beteiligten Stoffmengen bezieht.
Thema: Erste chemische Ideen
Lektion: Chemische Reaktionsgleichung
1. Das Verhältnis der an der Reaktion beteiligten Stoffmengen
Die Koeffizienten in der Reaktionsgleichung geben nicht nur die Anzahl der Moleküle jedes Stoffes an, sondern auch das Verhältnis der an der Reaktion beteiligten Stoffmengen. Somit kann gemäß der Reaktionsgleichung: 2H2 + O2 = 2H2O argumentiert werden, dass zur Bildung einer bestimmten Menge Wasser (z. B. 2 Mol) die gleiche Anzahl Mol der einfachen Substanz Wasserstoff (2 Mol) und die Hälfte erforderlich sind so viele Mole des einfachen Stoffes Sauerstoff (1 Mol) benötigt werden). Lassen Sie uns Beispiele für solche Berechnungen geben.
2. Aufgabe 1
AUFGABE 1. Bestimmen wir die Menge an Sauerstoff, die bei der Zersetzung von 4 Mol Wasser entsteht.
ALGORITHMUS zur Lösung des Problems:
1. Schreiben Sie die Reaktionsgleichung auf
2. Bilden Sie einen Anteil, indem Sie die Stoffmengen gemäß der Reaktionsgleichung und entsprechend den Bedingungen der Aufgabe bestimmen (bezeichnen Sie die unbekannte Stoffmenge als x Mol).
3. Stellen Sie eine Gleichung auf (aus Proportionen).
4. Lösen Sie die Gleichung und finden Sie x.
Reis. 1. Formulierung einer kurzen Bedingung und Lösung zu Problem 1
3. Aufgabe 2AUFGABE 2. Welche Sauerstoffmenge ist erforderlich, um 3 Mol Kupfer vollständig zu verbrennen?Lassen Sie uns einen Algorithmus zur Lösung von Problemen mithilfe der Gleichung einer chemischen Reaktion verwenden.

Reis. 2. Formulierung einer kurzen Bedingung und Lösung zu Problem 2.
Studieren Sie die Algorithmen sorgfältig und schreiben Sie sie in ein Notizbuch. Lösen Sie die vorgeschlagenen Probleme selbst
ICH. Lösen Sie mithilfe des Algorithmus die folgenden Probleme selbst:
1. Berechnen Sie die Menge an Aluminiumoxid, die durch die Wechselwirkung von Aluminium mit einer Menge von 0,27 Mol der Substanz mit einer ausreichenden Menge Sauerstoff entsteht (4Al +3O 2 =2Al2 O3 ).
2. Berechnen Sie die Menge an Natriumoxid, die durch die Wechselwirkung von Natrium mit einer 2,3 Mol-Menge der Substanz mit einer ausreichenden Menge Sauerstoff entsteht(4Na+O2 =2Na2 O).
Algorithmus Nr. 1
Berechnen der Menge eines Stoffes aus einer bekannten Menge des an einer Reaktion beteiligten Stoffes.
Beispiel. Berechnen Sie die Menge an Sauerstoff, die bei der Zersetzung von Wasser bei einer Stoffmenge von 6 Mol freigesetzt wird.



II. Lösen Sie mithilfe des Algorithmus die folgenden Probleme selbst:
1. Berechnen Sie die Schwefelmasse, die erforderlich ist, um Schwefeloxid (IV) mit einer Stoffmenge von 4 Mol (S + O) zu erhalten 2
=SO2).
2. Berechnen Sie die Masse an Lithium, die erforderlich ist, um Lithiumchlorid mit einer Stoffmenge von 0,6 Mol (2Li+Cl2 = 2LiCl) zu erhalten.
Algorithmus Nr. 2
Berechnen der Masse eines Stoffes aus einer bekannten Menge eines anderen an einer Reaktion beteiligten Stoffes.
Beispiel: Berechnen Sie die Masse an Aluminium, die erforderlich ist, um Aluminiumoxid mit einer Stoffmenge von 8 Mol zu erhalten.



III. Lösen Sie mithilfe des Algorithmus die folgenden Probleme selbst:
1. Berechnen Sie die Menge an Natriumsulfid, wenn Schwefel mit einem Gewicht von 12,8 g (2Na+S=Na2S) mit Natrium reagiert.
2. Berechnen Sie die Menge an Kupfersubstanz, die entsteht, wenn 64 g schweres Kupfer(II)-oxid mit Wasserstoff reagiert (CuO + H2 = Cu + H2 O).
Studieren Sie den Algorithmus sorgfältig und notieren Sie ihn in Ihrem Notizbuch.
Algorithmus Nr. 3
Berechnen der Menge eines Stoffes aus der bekannten Masse eines anderen an einer Reaktion beteiligten Stoffes.
Beispiel. Berechnen Sie die Menge an Kupfer(I)-oxid, wenn Kupfer mit einem Gewicht von 19,2 g mit Sauerstoff reagiert.



Studieren Sie den Algorithmus sorgfältig und notieren Sie ihn in Ihrem Notizbuch.
IV. Lösen Sie mithilfe des Algorithmus die folgenden Probleme selbst:
1. Berechnen Sie die Sauerstoffmasse, die erforderlich ist, um mit Eisen mit einem Gewicht von 112 g zu reagieren
(3Fe + 4O2 =Fe3 O4).
Algorithmus Nr. 4
Berechnen der Masse eines Stoffes aus der bekannten Masse eines anderen an der Reaktion beteiligten Stoffes
Beispiel. Berechnen Sie die für die Verbrennung von Phosphor erforderliche Sauerstoffmasse mit einem Gewicht von 0,31 g.



AUFGABEN ZUR UNABHÄNGIGEN LÖSUNG
1. Berechnen Sie die Menge an Aluminiumoxid-Substanz, die durch die Wechselwirkung von Aluminium mit einer 0,27 Mol-Substanzmenge mit einer ausreichenden Menge Sauerstoff (4Al + 3O2 = 2Al2 O3) entsteht.
2. Berechnen Sie die Menge an Natriumoxid-Substanz, die durch die Wechselwirkung von Natrium mit einer 2,3 Mol-Substanzmenge mit einer ausreichenden Menge Sauerstoff (4Na + O2 = 2Na2 O) entsteht.
3. Berechnen Sie die Schwefelmasse, die erforderlich ist, um Schwefeloxid (IV) mit einer Stoffmenge von 4 mol (S+O2 =SO2) zu erhalten.
4. Berechnen Sie die Masse an Lithium, die benötigt wird, um Lithiumchlorid mit einer Stoffmenge von 0,6 Mol (2Li+Cl2 = 2LiCl) zu erhalten.
5. Berechnen Sie die Menge an Natriumsulfid, wenn Schwefel mit einem Gewicht von 12,8 g (2Na+S=Na2S) mit Natrium reagiert.
6. Berechnen Sie die Menge an Kupfersubstanz, die entsteht, wenn 64 g schweres Kupfer(II)-oxid mit Wasserstoff reagiert (CuO + H2 = Cu + H2 O).
ÜBUNGEN
Simulator Nr. 1 – Analyse der chemischen Reaktionsgleichung
Simulator Nr. 6 – Stöchiometrische Berechnungen
Zusammenfassung der Lektion „Berechnungen mit chemischen Gleichungen“
1. Hausaufgaben überprüfen
Als Hausaufgabe wurden Sie gebeten, Koeffizienten in Reaktionsgleichungen einzusetzen.In der Pause können Sie die geleistete Arbeit sehen. Es wird sicherlich Fehler geben.Hat alles geklappt, hat jemand Fragen?Lassen Sie sie über ihre Erfahrungen zu Hause sprechen.
2. Bekanntgabe des Themas und Aktualisierung des Wissens
Das Thema der heutigen Lektion sind Berechnungen mit chemischen Gleichungen. Erinnern wir uns zunächst an alles, was uns heute nützlich sein kann. Chemische Gleichungen sind uns bereits in früheren Laborarbeiten, in Hausaufgaben und noch früher beim Thema binäre Verbindungen begegnet. Erinnern wir uns an die Definition der Gleichung einer chemischen Reaktion.
(Dies ist eine herkömmliche Notation einer chemischen Reaktion unter Verwendung chemischer Formeln und Koeffizienten.)
Toll.
Bei der Herstellung von Verbindungen müssen Sie wissen, wie viel Ausgangsmaterial Sie benötigen, um die erforderliche Masse des Reaktionsprodukts zu erhalten. Erstellen Sie dazu eine Gleichung für die ablaufende chemische Reaktion und berechnen Sie Massen berücksichtigen Molmassen Stoffe und beim Rechnen Volumina von Gasen Berücksichtigen Sie den WertMolvolumen Gase
Wer erinnert sich an den Wert des Molvolumens von Gasen unter normalen Bedingungen? (22,4 l/mol)
Und was sind diese Normalbedingungen? (Druck 101,3 kPa und Temperatur 0 o C)
Das heißt, unter diesen Bedingungen nimmt 1 Mol JEGLICHES Gases ein Volumen von 22,4 Litern ein.
Um Probleme zu lösen, müssen wir uns tatsächlich mehrere Größen merken:
Molmasse – M (g/mol)
Stoffmenge – n (mol)
Volumen – V (l)
So ist es besser: Denken Sie daran, dass die Molmasse numerisch gleich der relativen Atommasse oder relativen Molekülmasse einer Substanz ist. Dazu müssen Sie das Periodensystem verwenden, in dem die relative Atommasse am unteren Rand jeder „Zelle“ angegeben ist. Ohne die Rundungsregeln zu vergessen, verwenden wir für die Berechnungen den Gesamtwert dieser Masse.
Chemie ist eine sehr klare, logische und konsistente Wissenschaft, daher ist es praktisch, den im Lehrbuch angegebenen ALGORITHMUS zur Lösung von Problemen zu verwenden. Dies ist eine universelle Abfolge von Aktionen, die zur Lösung jedes Problems dieser Art verwendet wird.
Bitte öffnen Sie das Lehrbuch und machen wir uns alle mit dem Algorithmus vertraut.
(Hier schlagen wir alle gemeinsam unsere Lehrbücher auf, eine Person, vielleicht ich, liest den Algorithmus, der Rest folgt ihm, um zu verstehen, was er jetzt tun muss)
Es klingt umfangreich, aber ich hoffe, es ist nicht zu verwirrend. Versuchen wir es anhand eines Beispiels herauszufinden.
Aufgabe 1. Zur Herstellung von Wasserstoff wird Aluminium in Schwefelsäure gelöst: 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 (Der erste Punkt unseres Algorithmus). Für die Reaktion haben wir 10,8 g Aluminium genommen. Berechnen Sie die Masse der verbrauchten Schwefelsäure.
Gegeben: m(Al) = 10,8 g | Lösung: m=10,8 g m - ? 2Al + 3H 2 SO 4 → Al 2 (SO 4 ) 3 + 3H 2 M=27g/mol M=98g/mol Hier können wir erwähnen, dass tatsächlich nicht 2 Aluminiumatome und 3 Säuremoleküle an der Reaktion beteiligt sind, sondern ein Teil der Aluminiumatome und ein Teil der Säuremoleküle. Dieser Teil wird in der Chemie als Kurzwort „Maulwurf“ bezeichnet. n=2 mol n=3 mol m = M ∙ n m=54 g m=294 g Berechnung nach Anteilen: |
||||
m (H 2 SO 4 ) - ? |
|||||
10,8 g | |||||
54 g | 294 g | ||||
10,8 g ∙ 294 g | |||||
54 g | |||||
X = 58,8 g Antwort: m (H 2 SO 4 ) = 58,8 g |
|||||
Das ist die Lösung des Problems. Habe Fragen? Lassen Sie uns noch einmal über die Lösung sprechen:
Habe eine Gleichung aufgestellt
Über den Stoffen haben wir unterschrieben, was wir WISSEN und FINDEN WOLLEN
Unter den Formeln haben wir die Molmasse, die Stoffmenge und notiertstöchiometrisch Masse des Stoffes ( besser ist die Angabe „Masse laut Periodensystem“)
Habe einen Anteil gebildet
Das Verhältnis wurde gelöst
Habe die Antwort aufgezeichnet
Lassen Sie uns ein ähnliches Problem lösen, aber mit gasförmigen Substanzen (hier verwenden wir nicht die Molmasse der Substanz, sondern was? ... Molvolumen)
Aufgabe 2. 25 Gramm Zink wird in Salzsäure gelöst, bei der chemischen Reaktion wird ein Gas freigesetzt – Wasserstoff. Berechnen Sie die Menge des freigesetzten Wasserstoffs.
Gegeben: m(Zn) = 10,8 g | Lösung: m=25 g V - ? Zn + 2HCl → ZnCl 2 + H 2 M = 65 g/mol V m = 22,4 l/mol n=1 mol n=1 mol m=65 g V=22,4 l Berechnung nach Anteilen: |
||||
m(HCl) - ? |
|||||
25 g | |||||
65 g | 22,4 l | ||||
25 g ∙ 22,4 l | |||||
65 g | |||||
X = 8,61 l Antwort: V(H 2 ) = 8,61 l |
|||||
Lassen Sie uns überprüfen, wie Sie das Material beherrschen. Lösen Sie das Problem mit demselben Algorithmus:
Es ist keine Tatsache, dass Sie erfolgreich sein werden:
Bei der Reaktion mit Unter Verwendung der Kohlenoxide Fe2O3 (erste Option) und SnO2 (zweite Option) wurden jeweils 20 g Fe und Sn erhalten. Wie viele Gramm jedes Oxids wurden eingenommen?
Bitte beachten Sie, dass wir jetzt die Masse der Ausgangsstoffe berechnen, nicht die der Reaktionsprodukte)
(Lassen Sie alle es in einem Notizbuch lösen und bitten Sie sie gezielt, die Lösung zu zeigen. Wir schreiben die Gleichung gemeinsam an die Tafel und jeder wird versuchen, sie selbst zu lösen.)
Fe2O3 + 3C = 2Fe + 3CO m(Fe2O3)= 160*20/2*56= 28,5 g
SnO2+C=Sn+CO2 m(SnO2)= 20*151/119= 25,38 g
Hausaufgabe: Studieren Sie das Lehrbuchmaterial S. 146-150, lösen Sie das Problem
Wie groß ist die Masse von Calciumoxid und wie groß ist das Volumen von Kohlendioxid (n.s.)
kann durch Zersetzung von Calciumcarbonat mit einem Gewicht von 250 g gewonnen werden?SOLLTE SCHULKINDERN GEGEBEN WERDENFertige GleichungUM DIESE AUFGABE ABZUSCHLIESSEN
Methodische Unterrichtsentwicklung (2 Stunden)
Berechnungen mit chemischen Gleichungen
Khapugina Polina Iwanowna,
Chemielehrer GBOU Sekundarschule 277
Bezirk Kirovsky von St. Petersburg
Lernziele: Bringen Sie Achtklässlern bei, Berechnungen anhand chemischer Gleichungen durchzuführen: Ermitteln Sie Menge, Masse und Volumen der Reaktionsprodukte aus Menge, Volumen und Masse der Ausgangsstoffe.
Während des Unterrichts:
Bevor wir mit dem Studium eines neuen Themas fortfahren, müssen wir uns an die Mengen und Formeln erinnern, die wir bereits kennen. Denken Sie an die Arten chemischer Reaktionen. Und Sie wissen bereits, wie man chemische Gleichungen erstellt und ausgleicht. Lassen Sie uns Ihr Wissen testen, indem wir Folgendes tun: Einstufungstest.(Der Inhalt des Tests kann auf meiner persönlichen Website im Ordner „Dateien und Fotos“ eingesehen werden.)
Erklärung des Lehrers:
1. Bevor Sie lernen, mit chemischen Gleichungen zu rechnen, müssen Sie sich noch einmal die uns bekannten Formeln zum Ermitteln der Menge, Masse und des Volumens eines Stoffes merken; in einem Schritt können Sie sich nach getaner Arbeit selbst testen . Wenden wir uns dazu der folgenden Präsentation zu, die dabei helfen wird, unser Wissen im Gedächtnis wiederherzustellen. Präsentation Nr. 1.
Notieren Sie die Formeln, die Sie bereits kennen, in Ihrem Notizbuch:
n- Stoffmenge (Mol)
m- Stoffmasse (g)
M – Molmasse (g/mol)
V - Gasvolumen (l)
V m - Molvolumen = 22,4 l/mol
n = m/M ; m = n.M
n = V/Vm; V = n.V m
2. Nun müssen wir verstehen, dass eine chemische Gleichung nicht nur die qualitative (Umwandlung von Stoffen) Seite des Prozesses, sondern auch die quantitative Seite davon zeigt. Um dies zu tun, wenden wir uns dem Folgenden zu Präsentationen#2(Die Präsentation kann auf meiner persönlichen Website im Ordner „Dateien und Fotos“ eingesehen werden)
Schreibe in dein Heft:
Der Koeffizient in der Reaktionsgleichung gibt die Anzahl der Teilchen an, und die Anzahl der Teilchen bestimmt wiederum die Anzahl der Mol!
2H₂ + O₂ = 2H₂ UM
Anzahl der Teilchen 2 Moleküle 1 Moleküle 2 Moleküle
Menge ↓ ↓ ↓
Substanzen,N2 Mol 1 Mol 2 Mol
2 Fe(OH)3 = Fe2 Ö3 + 3 H2 Ö
↓ ↓ ↓
N= 2mol 1mol 3mol
3. Der nächste Schritt, den wir untersuchen müssen, ist die Fähigkeit, mithilfe der Reaktionsgleichung eine Proportion zu erstellen und diese zu lösen. Um dies zu tun, wenden wir uns dem Folgenden zu Präsentationen 3.(Die Präsentation kann auf meiner persönlichen Website im Ordner „Dateien und Fotos“ eingesehen werden)
Schreibe in dein Heft:
Bekannt unter der Bedingung: 2 mol X mol (Zähler)
4P+5O₂ = 2P₂ Ö₅
Bekannt durch die Gleichung: 4 mol 5 mol 2 mol (Nenner)
Lassen Sie uns das Verhältnis zusammenstellen und lösen:
2 mol X mol
_______ = _______
4 mol 2 mol
X Mol = 2 Mol. 2 Mol= 1 mol
4 Mol
X =N(P₂ Ö₅ )= 1 mol
4. Fahren wir mit der Lösung von Problemen mithilfe von Gleichungen chemischer Reaktionen fort. Um ein Rechenproblem in der Chemie zu lösen, müssen Sie den folgenden Algorithmus verwenden – führen Sie fünf Schritte aus. Präsentation 4. (Die Präsentation kann auf meiner persönlichen Website im Ordner „Dateien und Fotos“ eingesehen werden) Lehrbuch S. 101
In Ihrem Notebook:
Die Schüler erhalten einen vorgefertigten Lösungsalgorithmus, den sie in ihr Notizbuch einfügen können.
Algorithmus zur Lösung von Rechenproblemen mithilfe chemischer Reaktionsgleichungen:
1. Erstellen Sie eine Gleichung für eine chemische Reaktion (stellen Sie also unbedingt die Koeffizienten ein!)
2. Tragen Sie über den entsprechenden Formeln in der Gleichung quantitative Daten zu Stoffen mit Maßeinheiten ein, die bekannt sind oder anhand der Bedingungen des Problems berechnet werden können, und den gewünschten Wert X ebenfalls mit Maßeinheiten.
3. Notieren Sie unter diesen Formeln die entsprechenden quantitativen Größen, die durch die Gleichung selbst angegeben werden, ebenfalls mit Maßeinheiten.
4. Bilden und lösen Sie eine Proportion.
5. Formulieren Sie die Antwort.
5. Lassen Sie uns das Problem lösen.
Berechnen Sie die Wassermasse, die durch die Wechselwirkung von 0,5 Mol Aluminiumoxid mit Schwefelsäure beim Erhitzen entsteht.
Lesen Sie das Problem.
Schreiben Sie die Problemstellung auf. (Gegeben, finden.)
In Ihrem Notebook: (Die Schüler schreiben die Lösung entsprechend den Erläuterungen des Lehrers auf Vorträge 5 ) (Die Präsentation kann auf meiner persönlichen Website im Ordner „Dateien und Fotos“ eingesehen werden)
Gegeben:
n(Al₂O₃)=0,5 mol
_________________
Finden:
Lösung:
N=0,5 mol X mol
Al₂ Ö₃ +3 H₂ ALSO₄ = Al₂ (ALSO₄ ) ₃ +3 H₂ Ö
N= 1 mol 3 mol
M = 102 g/mol 18 g/mol
Berechnung des Molekulargewichts:
Мr(Al₂O₃)= 2,27+3,16= 54+48=102
Мr(H₂O)= 2,1+16=18
Verfassen und lösen Sie eine Proportion.
0,5 Mol = X Maulwurf
1 Mol 3 Mol
X Mol =N(H₂ Ö) = 0,5 Mol. 3 Mol= 1,5 Mol
1 Mol
Finden wir die Wassermasse.
M(H₂ Ö) = N(H₂ Ö) . M(H₂ Ö)
M(H₂ Ö) = 1,5 mol.18 g/mol = 27 g
Antwort:M(H₂ Ö)=27 g
6. Lösen Sie Probleme selbst.
Zwei Studierende werden zur Beurteilung in den Vorstand gerufen.
1. Bestimmen Sie das Chlorvolumen (Anzahl), das zur Herstellung von 634 g Aluminiumchlorid erforderlich ist, gemäß der Gleichung: 2Al + 3Cl 2 = 2AlCl 3. Antwort: 159,6 l
2. Berechnen Sie die für die Reaktion mit 128 g schwerem Sauerstoff benötigte Stoffmenge und Masse an Lithium nach der Gleichung: 4Li + O 2 = 2Li 2 O Antwort: 16 Mol, 112 g
7. Hausaufgaben.
Aufgabe.
Finden Sie die Masse an Zinkoxid, die durch die Wechselwirkung von 13 g Zink mit Sauerstoff entsteht.